Molothrus ater
| Molothrus ater | ||
|---|---|---|
 Macho adulto. | ||
| Estado de conservación | ||
 Preocupación menor (UICN 3.1)[1] | ||
| Taxonomía | ||
| Reino: | Animalia | |
| Filo: | Chordata | |
| Clase: | Aves | |
| Orden: | Passeriformes | |
| Familia: | Icteridae | |
| Género: | Molothrus | |
| Especie: |
M. ater (Boddaert, 1783)[2][3] | |
| Distribución | ||
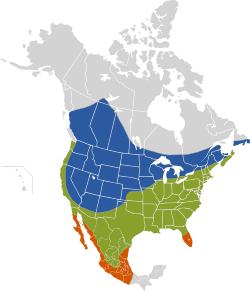 zona de cría estival.) Presente todo el año Zona de invernada. | ||
| Subespecies | ||
El tordo cabecicafé (Molothrus ater),[7] también conocido como tordo cabecipardo,[8] tordo negro,[9][10] tordo negro común,[9] tordo cabeza marrón,[9] tordo cabeza café,[3][7][11] tordo cuco,[12] vaquero cabecicafé,[7] vaquero de cabeza castaña[7] o boyero negro,[13] es una especie de ave paseriforme de la familia Icteridae propia de América del Norte. Es un pájaro de hábitos parcialmente migratorios que habita en las regiones norteamericanas de clima templado y subtropical.[13] Es sedentario en las regiones australes de su área de distribución, mientras que las aves del norte, en cambio, migran al sur de los Estados Unidos y a México en invierno y regresan a su hábitat de verano en marzo o abril.[14] Se trata de una especie abundante y ampliamente distribuida, de comportamiento gregario,[10] que se alimenta fundamentalmente de semillas y artrópodos.[15]
Exhibe un marcado dimorfismo sexual,[9] y es conocido por ser el parásito de puesta más común de América del norte, depositando sus huevos en nidos de más de 220 especies de aves, reduciendo el éxito reproductivo y amenazando la supervivencia de algunas de ellas.[10] A pesar de compartir esta particular estrategia reproductiva con muchas especies de cucos, no está emparentado con ellos, sino que se trata de un caso de convergencia evolutiva.
Antes del asentamiento europeo, el tordo cabecicafé seguía las manadas de bisontes (Bison bison) a través de las Grandes Llanuras,[6] y quizá también al antílope americano (Antilocapra americana) y al uapití (Cervus canadensis).[16] El parasitismo de puesta complementaba este estilo de vida nómade.[17] Su número creció con la creación de nuevos hábitats abiertos por parte de los colonizadores. Invadió los estados a orillas de los Grandes Lagos y el noreste de Estados Unidos durante el siglo XIX.[2] También se diseminó hacia el oeste, llegando a California.[2] En la actualidad, es posible verlos alimentándose en comederos para aves en áreas suburbanas.
Taxonomía y subespecies[editar]

El tordo cabecicafé es una especie del género Molothrus y pertenece a la familia de los ictéridos, la cual comprende a aves paseriformes oriundas de América del norte y del sur.[3][15] Molothrus significa "vagabundo" en griego y ater quiere decir "negro" en latín, aludiendo a su estilo de vida nómade y al color predominante del plumaje del macho.[18][19] Existen tres subespecies reconocidas, que se diferencian principalmente por su tamaño y por la oscuridad del plumaje de las hembras, aunque no son distinguibles en el trabajo de campo:[20] M. a. artemisiae (Gran Cuenca),[21] M. a. ater (Medio Oeste y este de los Estados Unidos)[4][6] y M. a. obscurus (desiertos del sudoeste y costa del Pacífico).[21] Los machos jóvenes de M. a. artemisiae presentan una mayor tendencia a agruparse en bandadas únicamente de juveniles, mientras que los de M. a. ater son más proclives a unirse a bandadas de individuos de distintas edades.[22]
En la actualidad, dos subespecies de tordo cabecicafé se reproducen en California. M. a. artemisiae probablemente siempre haya sido un residente raro en verano en las porciones del estado incluidas dentro de la Gran Cuenca y un visitante invernal también raro en el resto de California (Grinnell, 1915; Mailliard, 1927). Aunque su abundancia ha aumentado, su área de distribución se mantuvo constante. Por otro lado, de acuerdo con Laymon (1987), el estatus de M. a. obscurus había cambiado notablemente durante los previos 120 años y esta subespecie sería aparentemente la responsable de la sustancial disminución del éxito reproductivo de ciertos paseriformes del Valle Central y el sur de California.[23] La cruza entre M. a. artemisiae y M. a. obscurus ha estado ocurriendo desde que ambas subespecies se pusieron en contacto en la década de 1930 en la Sierra Nevada; el tamaño de M. a. artemisiae se redujo en el área en donde convive con la otra subespecie, la cual naturalmente presenta una talla menor.[4][21]
Hibridación entre subespecies[editar]
Fleischer y Rothstein (1988) afirmaron que dos subspecies morfológicamente distintas ocupaban las respectivas laderas de la Sierra Nevada: M. a artemisiae sobre la ladera oriental y M. a. obscurus sobre la occidental. Las poblaciones de obscurus llegaron a California desde el bajo río Colorado alrededor del 1900 e invadieron el oeste de la Sierra Nevada durante la década de 1930. Poblaciones de obscurus apartadas entre sí por distancias de hasta 700 km producían un silbido relativamente constante en vuelo, mientras que los artemisiae del este presentaban numerosos dialectos.[21]
Las medidas medias de siete mediciones morfológicas para 2.287 individuos mostraban patrones similares en cuanto a tamaño corporal para machos adultos, machos de un año de edad y hembras dentro de segmentos latitudinales de 60 km a lo largo del este de la Sierra Nevada: en el punto de estudio más austral en Bishop se registraron tallas grandes, las cuales se reducían gradualmente hacia el norte hasta Mammoth Lakes y luego comenzaban a aumentar nuevamente en dirección norte hasta Lee Vining, el sitio de estudio más septentrional.[21]
Mientras que la información recolectada no indica un origen adaptativo para estas variaciones, una explicación más conservadora sugiere un flujo de genes de obscurus en las poblaciones de artemisiae en el área de Mammoth Lakes. No es sorpresa que la cresta de la Sierra Nevada en Mammoth Lakes sea considerablemente menos elevada que en cualquier otro punto 80 km al norte y 180 km al sur.[21]
Otros dos descubrimientos respaldaron esta suposición. En primer lugar, los ejemplares de mayor longitud alar (recogidos en Bishop y en Lee Vining) presentaban alas significativamente más cortas que las de los tordos cabecicafé recolectados en la misma región entre 1912 y 1922. En segundo lugar, el largo de las alas de machos adultos y hembras en Mammoth Lakes entre 1978 y 1981 era significativamente mayor que el de los individuos del período 1982 – 1985.[21]
Esta presunta hibridación debe haber sido rápida puesto que pasaron menos de cincuenta años entre el contacto entre ambas subespecies por primera vez y el comienzo del estudio de Fleischer y Rothstein. La transferencia de genes se produjo entre dos subespecies con distintos silbidos en vuelo y entre varios dialectos de silbidos dentro de artemisiae. Por lo tanto, las diferencias vocales entre estos dialectos no parecen ser un importante elemento disuasorio del entrecruzamiento.[21]
Descripción[editar]

El tordo cabecicafé es un ictérido pequeño.[2][10] El macho mide 19 - 22 cm, con un peso de entre 42 y 50 g.[10] La longitud de la hembra oscila entre los 16 y 20 cm y pesa 38 - 45 g.[10] Generalmente, su reducido tamaño es suficiente para diferenciarlo de otras especies en bandadas mixtas, incluso cuando su coloración no es distinguible.[19] El pico es cónico,[2][15] más corto y de base más ancha que en otros ictéridos,[10] negro en el macho y en la hembra oscuro en la mitad superior y pálido en la mandíbula inferior.[20] Los ojos son oscuros y las patas, negras.[20] Las alas son largas y en punta.[2][15] Su cola es más corta —una característica distintiva en vuelo— y su cabeza, más robusta que en la mayoría de los miembros de su familia.[10]
El plumaje del macho adulto es predominantemente negro iridiscente, con la cabeza, el cuello y el pecho marrones,[9][13] lo que lo diferencia de especies similares tales como el tordo ojo rojo (Molothrus aeneus) y el tordo renegrido (Molothrus bonariensis).[10] Visto en la luz, su iridiscencia es menor que la de los zanates (Quiscalus spp.) y la del tordo ojo amarillo (Euphagus cyanocephalus).[10] La hembra, de color marrón o gris, presenta una tonalidad más oscura sobre las alas y cola[20] y más clara sobre la cabeza y el vientre, con finas vetas en el abdomen y pecho, mucho más sutiles que las de la hembra de tordo sargento (Agelaius phoeniceus).[10] Su garganta blanquecina contrasta con su cara más oscura.[20] Incluso ella presenta indicios de iridiscencia verdosa, aunque su coloración más apagada le brinda un buen camuflaje mientras busca nidos en los que depositar sus huevos.[18][24] Los juveniles son más veteados y claros que las hembras adultas,[20][25] y las puntas de sus plumas son más pálidas, lo que le da a su dorso una apariencia escamosa.[20][26]
Los cambios en el plumaje del tordo cabecicafé son bastante simples. El plumón natal fue caracterizado por el ornitólogo Jonathan Dwight (1900) como oliva grisáceo. Describió el plumaje juvenil, común a ambos sexos, de la siguiente manera: “Arriba, incluyendo los costados de la cabeza y el cuello, las alas y la cola, oliva amarronado oscuro, las plumas con un borde beige claro, blancuzco sobre las primarias. Abajo, blanco apagado, beige sobre la garganta, pecho y flancos con muchas vetas oliva amarronado. El mentón es blanco o amarillento.” En agosto o a comienzos de septiembre se produce una muda postnupcial completa, dando lugar al primer plumaje de invierno que es indistinguible del de los adultos. Mientras mudan sus plumas, los machos jóvenes se vuelven llamativos debido a que las lustrosas plumas negras de su nuevo plumaje emergen esparcidas entre las viejas plumas marrones, dándoles una curiosa apariencia moteada. En el macho, la cabeza, el cuello y la nuca son de una especie de marrón violáceo, pero el resto del plumaje, incluyendo las alas y la cola, es de un negro lustroso con reflejos verdes y púrpuras. La hembra adquiere su coloración “gris ratón”. Los adultos atraviesan una muda total en septiembre pero no sufren una muda prenupcial,[19] a diferencia de lo que sucede con el tordo arrocero (Dolichonyx oryzivorus).[27]
Distribución[editar]

El tordo cabecicafé es una especie neártica originaria de las Grandes Llanuras. Su área de distribución ha estado en constante crecimiento durante los siglos XIX y XX y actualmente cubre la mayor parte del territorio estadounidense y mexicano y grandes extensiones en el sur y oeste de Canadá. Su número aumentó con la deforestación de los bosques, la introducción de nuevos animales de pasturas por parte de los colonizadores europeos, la urbanización y la conversión de los hábitats boscosos en terrenos agrícolas.[2][16] Para fines de la década del 2000 o principios de la de 2010, su área de distribución —incluyendo tanto las zonas de reproducción como las de migración invernal— se extendía sobre aproximadamente 11.200.000 km²,[28] lo que equivale a un 46% de la superficie norteamericana. A pesar de la idea comúnmente aceptada de que en un principio habitaba sólo en las Grandes Llanuras, la existencia de tres subespecies distintas podría sugerir que su área de distribución original era más amplia.[20]
Expansión de su área de distribución[editar]
Graham (1988) y Rothstein (1994) identificaron al tordo cabecicafé como la especie que había experimentado la mayor expansión en su distribución entre todas las aves norteamericanas.[29] En el siglo XIX, se propagó por el este de América del norte.[30] Durante el siglo XX, se diseminó hacia el oeste, haciendo que su área de distribucìón cubriera entonces los 48 estados americanos contiguos y todo el sur de Canadá.[24] La conquista de los estados occidentales se debe en gran parte a la rápida colonización del M. ater obscurus.[4][23][31] Se ha afirmado que el hecho de que las áreas de reproducción y alimentación estén separadas entre sí contribuyó de manera importante a esta expansión.[4][31] Debido a que los tordos cabecicafé pueden volar hasta 7 km entre unas y otras, el surgimiento de nuevos hábitats en los que alimentarse (corrales de caballos, zonas residenciales con comederos para aves, etc.) dentro de lo que antes era bosque cerrado supuso consecuentemente el uso de nuevas áreas para reproducirse.[4][31]
Colonización del este[editar]
Antes del 1800, el tordo cabecicafé habitaba fundamentalmente en las praderas al oeste del río Misisipi. No se le encontraba en las vastas extensiones de bosque ininterrumpido que cubrían gran parte del este de América del norte debido a que sus hábitos alimenticios y su comportamiento social lo restringían a hábitats abiertos. A medida que los pobladores talaban los bosques orientales y despejaban el terreno para su uso en actividades agropecuarias, se originaron nuevos hábitats abiertos, los cuales favorecieron una expansión hacia el este por parte del tordo cabecicafé. Aparentemente, hacia fines del siglo XIX, la especie se había esparcido por el este de América del norte, pero no era abundante y vivía principalmente en áreas cultivadas. No era común en hábitats boscosos y, en ese entonces, el impacto de su parasitismo de puesta sobre el éxito reproductivo de los paseriformes del bosque era probablemente mínimo.[30]
En 1958, Arthur Cleveland Bent determinó que los valles de los ríos Potomac y Ohio eran los límites septentrionales del área de distribución invernal regular del tordo cabecicafé oriental, la cual se extendía hasta Florida y la costa del Golfo de México.[19]
Colonización del oeste[editar]

No se sabe a ciencia cierta si M. a. obscurus habitaba a orillas del río Colorado antes de 1870, cuando fue documentado reproduciéndose allí por primera vez (Laymon, 1987). Sin embargo, existe un único registro al oeste de ese río anterior a 1870: en la ladera este de las montañas Cuyamaca (condado de San Diego, extremo sudoeste de California) en 1862. Según los registros, su área de distribución se expandió rápidamente hacia el oeste y el norte entre 1900 y 1930. Para 1925 era común en el área de Los Ángeles y para 1930 se había esparcido al área de la bahía de San Francisco y el valle de Sacramento central. Para 1941 se había diseminado por el condado de Humboldt (noroeste del estado) y para 1960, alcanzado el condado de Del Norte (extremo noroeste), el límite con Oregón y los prados de mayor altitud de la Sierra Nevada.[23] Rothstein y otros (1980) documentaron la reciente expansión en el área de distribución del tordo cabecicafé en la Sierra Nevada, advirtiendo que el ave no era avistada allí antes de 1930, pero parecía estar ampliamente distribuida para entonces sobre la mayoría o la totalidad de las monatañas.[32]
En términos relativos, podría decirse que los tordos cabecicafé son recién llegados en Washington. Si bien pudieron haber estado presentes allí en pequeños números desde antes, generalmente se considera que arribaron a la cuenca de Columbia a finales del siglo XIX. Para 1955 eran vistos con regularidad en el oeste de Washington, y para 1958 ya se reproducían en esa zona del estado.[33]
Se desconoce la fecha exacta de la llegada del tordo cabecicafé a Columbia Británica. El primer registro, procedente del área de Revelstoke, fue de mayo de 1890. Los reportes más tempranos de esta ave fueron del sur de la provincia e incluso para 1930 la mayoría de los registros correspondían a las zonas meridionales del interior (es decir, el sur y el sudeste de Columbia Británica). Para 1950, el tordo cabecicafé había sido documentado en las ecoprovincias interior central (centro-sur de Columbia Británica) e interior subboreal (centro-norte), pero aún era una especie rara a lo largo de la costa. Eso cambió a finales de la década de 1950 y principios de la de 1960, y para 1970 el tordo cabecicafé podía ser encontrado en hábitats adecuados en toda la longitud de la costa, incluyendo gran parte de la isla de Vancouver. Al mismo tiempo, era registrado en más sitios y probablemente su abundancia aumentaba en el interior de la provincia al sur del paralelo 56° norte. Para 1990, podía hallársele en toda Columbia Británica, incluyendo las zonas más septentrionales de las montañas boreales del norte (norte y noroeste de la provincia) y de las llanuras de taiga (noreste).[29]
Distribución actual y cambios recientes[editar]

En la actualidad, su área de reproducción se extiende desde el sudeste de Alaska, norte de Columbia Británica, sur de los Territorios del Noroeste, norte de Alberta y centro-norte de Saskatchewan, hacia el este hasta el sur de Manitoba, de Ontario, de Quebec y de Terranova,[34] Nuevo Brunswick, Nueva Escocia y la Isla del Príncipe Eduardo (Canadá),[35] cubriendo todos los Estados Unidos continentales, hasta Florida central y la costa del Golfo, continuando hacia el sur de México —Oaxaca y Veracruz—[29] y, en el noroeste de dicho país, hasta el norte de Baja California.[4][15][36] Según Peter E. Lowther (1993), anida también en el sudeste del territorio canadiense de Yukón.[6][35] Su parasitismo ha sido detectado incluso en nidos de gorriones de Ipswich (Passerculus sandwichensis princeps) sobre la remota isla Sable, al sudeste de Nueva Escocia (Stobo y McLaren, 1975).[37]
De acuerdo con Richard M. DeGraaf y otros (1991), pasa el invierno desde el norte de California, Arizona central, los estados a orillas de los Grandes Lagos y Nueva Inglaterra, hacia el sur hasta México meridional,[9] la costa del Golfo y el extremo de la península de Florida.[4][15][38] Otras fuentes incluyen también en su área de distribución invernal el sudoeste de Columbia Británica, oeste de los estados sobre el océano Pacífico, sur de Utah, porciones meridionales de Ontario, Nuevo Brunswick y Nueva Escocia.[29] Según Peterson y Chalif (1989), habita en todo el territorio mexicano, excepto en Chiapas, Tabasco, Campeche, Quintana Roo y Yucatán.[9] Si bien reside durante el año entero en el sur de los Estados Unidos, puede hallársele en regiones septentrionales y montañosas sólo durante la temporada reproductiva.[2]
Según información de la Seattle Audubon Society para la década del 2000, es posible encontrarlo durante los meses invernales en los feedlots del este de Washington. Asimismo, en el oeste de dicho estado, grandes cantidades de tordos cabecicafé son vistas durante todo el año en los alrededores de Kent (condado de King).[33]
De acuerdo con un estudio de Root y Weckstein (1994) basado en información recolectada durante buena parte del siglo XX, su área de distribución invernal se había extendido hacia la región noreste (Maine y Nueva Escocia), reduciéndose en otros lugares a lo largo de los confines septentrionales de la misma (Pensilvania, Míchigan, Wisconsin, Iowa, Montana y Washington). Las razones que explican esta disminución son indudablemente complejas, pero uno de los factores más relevantes pudo haber sido el control poblacional a través de la captura con trampas durante la temporada reproductiva en Míchigan, por parte del Servicio de Pesca y Vida Silvestre de los Estados Unidos y el Departamento de Recursos Naturales de ese estado a fin de preservar al chipe de Kirtland (Dendroica kirtlandii), amenazado por el parasitismo. Para 1980, se habían eliminado ya 40 mil ejemplares de la especie parasítica.[39]
Población[editar]

Según datos publicados en 1993, la tasa de supervivencia anual de los adultos es de un 48,5% para los machos y 40,4% para las hembras.[4][6] La fecundidad de una hembra promedio en su vida entera es de 80 huevos,[4][6] unos 40 por año a lo largo de dos años.[40] Los estudios probaron que sólo un 3% de los huevos de tordo cabecicafé producirá polluelos que lleguen a la adultez, lo cual se compensa con la gran cantidad de huevos depositados, dando una descendencia promedio de 2,4 ejemplares adultos por hembra.[25][40]
De acuerdo con el ornitólogo Arthur Cleveland Bent (1958), la prevalente impresión de que los machos superan ampliamente a las hembras en número probablemente sea más aparente que real debido a que los primeros son más llamativos y menos reservados. El ornitólogo Herbert Friedmann (1929) concluyó de sus observaciones que habría unos tres machos por cada dos hembras.[19] Rothstein y otros (1986) y Yokel (1989) mencionaron que los machos representaban un porcentaje sensiblemente mayor al de las hembras sobre la población total de la especie, lo cual probablemente significaría que numerosos machos presentes en las áreas de búsqueda de nidos no tengan pareja y en realidad estén procurando una compañera.[16]
Las estimaciones de su población total en América del norte variaban entre los 20 y los 40 millones de individuos para 1972. En ese mismo año, se calculó que el número de tordos cabecicafé en Dakota del Norte sería de un millón de ejemplares.[4][41] La población estimada para 1957 en Illinois era de aproximadamente 1,1 millones.[4] Otras estimaciones manejan una cifra de alrededor de 56 millones de individuos maduros para 2010, distribuidos en un área de 11.200.000 km².[18][28] Debido a su abundancia, se le considera una especie bajo preocupación menor.[10][28]
Densidad poblacional[editar]
El norte de las Grandes Llanuras es el área con mayor abundancia de tordos cabecicafé en Estados Unidos y Canadá.[16][35] De acuerdo con Robinson y otros (1993), entre los 48 estados contiguos los tordos cabecicafé son más abundantes en Dakota del Norte, Dakota del Sur, Nebraska, Kansas y Iowa; muy abundantes en Oklahoma y Misuri; moderadamente abundantes en Washington, Oregón, Idaho, Montana, Arizona, Texas, Luisiana, Arkansas, Misisipi, Tennessee, Kentucky, Maryland, Ohio, Indiana, Illinois, Míchigan, Wisconsin y Minnesota; y más escasos en California, Nevada, Utah, Wyoming, Colorado, Nuevo México, Alabama, Florida, Georgia, Carolina del Norte, Carolina del Sur, Virginia, Virginia Occidental, Pensilvania, Delaware, Nueva Jersey, Nueva York, Connecticut, Rhode Island, Massachusetts, Vermont, Nuevo Hampshire y Maine.[16]
De acuerdo con Laymon (1987), las mayores concentraciones de tordos cabecicafé en California en invierno se dan en el Valle de Sacramento, el Valle Imperial, el oeste del condado de Riverside y el sudoeste del de San Bernardino.[23] Quizá debido a la proximidad entre las áreas de alimentación y las de búsqueda de nidos, tienden a ser más abundantes en hábitats heterogéneos fragmentados en los que se combinen superficies cubiertas de césped con campos arbustivos en desuso y/o bosques.[16]
Fluctuaciones poblacionales[editar]

Algunas investigaciones sostienen que las poblaciones de tordos cabecicafé han crecido a lo largo del siglo XX en la mayor parte de Estados Unidos. En el noreste, sin embargo, han sufrido una disminución estadísticamente significativa.[16][42] La información de Breeding Bird Survey (BBS) de entre 1965 y 1979 indicaba que el número de tordos cabecicafé se había incrementado en el sudeste estadounidense, incluyendo Carolina del Norte, Carolina del Sur y el sur de Georgia.[4][43] Margaret Clark Brittingham y el ecologista aviar y biólogo de vida silvestre Stanley A. Temple (1983) concluyeron que la cantidad de ejemplares había estado creciendo constantemente entre 1900 y 1980 en los once estados meridionales al sur del paralelo 37° norte desde Texas hasta el océano Atlántico, a donde la mayoría de ejemplares del este migra para pasar los meses invernales. Este aumento en su abundancia probablemente se deba a una mayor disponibilidad de alimento y de hábitats en los que pasar el invierno. Los granos residuales que quedan esparcidos sobre los campos de arroz (Oryza sativa) en los estados sureños constituyen una importante fuente de alimento para varias especies de ictéridos, incluyendo el tordo cabecicafé, en esa época del año,[30] lo cual podría repercutir en una mayor tasa de supervivencia al invierno.[16][24] Un incremento en su éxito reproductivo derivado de la exposición a nuevas y vulnerables especies hospedadoras posiblemente también esté relacionado con esta tendencia.[16][24]
Conforme a un estudio publicado en 1993, las poblaciones de esta especie estaban reduciéndose en Arizona, aumentando ligeramente en Idaho e incrementándose marcadamente en Montana.[4][44] En Oregón, crecieron en los bosques de sabinas (Juniperus) entre 1899 y 1983, pero disminuyeron considerablemente en el estado en general.[4][6][45] En la Sierra Nevada, aumentaron entre 1966 y 1985.[4][46] Los datos de Breeding Bird Survey para el Medio Oeste sugieren un decrecimiento para el período 1966 - 1981 y un incremento entre 1982 y 1991.[4][47] Según Peter E. Lowther, aumentos demográficos significativos (información de BBS 1966 - 1987) se dieron en Georgia, Carolina del Norte, Iowa, Dakota del Norte, Utah y Colorado, mientras que se registraron disminuciones significativas en Minnesota, Míchigan, Wisconsin, Nueva York, Rhode Island, Ohio, Ontario (Canadá), Virginia Occidental, Tennessee, Nuevo Brunswick (Canadá), Oklahoma y Texas.[4][6] Si bien su población disminuyó considerablemente en Washington entre 1966 y 2002, aún son comunes y se encuentran ampliamente distribuidos en el estado.[33]
Una interpretación alternativa de la información de BBS por parte de James R. Herkert señalaría una tendencia generalmente negativa para los Estados Unidos, pero un marcado crecimiento en Illinois durante el período 1966 - 1991.[4][48] Según la National Geographic (2006), su número había estado en descenso recientemente.[20] Butcher y Niven (2007) argumentan que la especie ha sufrido una disminución pequeña o estadísticamente insignificante en su población en América del norte en su conjunto durante las últimas cuatro décadas.[28]
Las observaciones de tordos cabecicafé en el interior de la Columbia Británica se mantuvieron relativamente estables desde la década de 1930 hasta la de 1950, mientras que los avistamientos sobre la costa —en donde proporcionalmente hay más observadores— fueron escasos entre los años 1930 y 1940, pero comenzaron a incrementarse en los ‘50 a medida que las aves empezaban a colonizar estas áreas. Importantes aumentos en el número de avistamientos y en la cantidad de ejemplares por avistamiento se produjeron en la década de 1960. En los ‘80, esta tendencia positiva se mantuvo en el interior, pero se revirtió en la costa.[29]
Un análisis de la información de las Breeding Bird Surveys en la Columbia Británica para el período 1968 – 1993 muestra que el número de tordos cabecicafé sobre la costa había disminuido un 4% anual en promedio; en un análisis de los datos del interior de la provincia para el mismo período, no se detectaron cambios netos en la cantidad de individuos. A lo largo de Canadá, los datos de las BBS indican una disminución poblacional; desde 1960 a 1996, su número cayó en promedio un 2% cada año. En la totalidad de su área de distribución, la información sugiere que su cantidad se redujo un 0,8% anual promedio en el mismo período (Sauer y otros, 1997).[29]
Hábitat[editar]
Se le encuentra en hábitats abiertos y semiabiertos, incluyendo áreas de esas características en las cercanías de terrenos agrícolas,[2][9] márgenes de bosques,[9][15] bosques de coníferas y caducifolios poco densos,[2] matorrales,[2] vegetación ribereña,[9] praderas y prados,[15] cultivos de frutales[15] y áreas residenciales.[2][15] Generalmente, evita los bosques tupidos y sin claros,[2][10] pero prospera en aquellos más fragmentados.[30] En Kansas, un censo llevado a cabo entre 1974 y 1988 reveló que había 6 tordos cabecicafé por km² en las praderas de pastos altos, pero tan sólo 1 por km² en los humedales adyacentes.[4]
Los tordos cabecicafé son capaces de explotar los ambientes modificados por el hombre particularmente bien debido a la gran variedad de alimentos que consumen y su adaptabilidad a nuevos hábitats.[24] Para alimentarse, necesitan áreas con vegetación baja.[35] Prefieren las zonas en las que haya ganado en donde pueden conseguir tanto insectos como granos, pero también aprovechan desperdicios que encuentren en cámpings, áreas de pícnic, etcétera. Debido a que no cuidan de sus polluelos, las áreas de alimentación pueden estar alejadas de las de reproducción, lo que le permite a las hembras de esta especie explotar distintos hábitats sobre grandes distancias.[24] Sin embargo, las zonas en las se alimentan y depositan sus huevos también pueden superponerse, particularmente en el este de su área de distribución.[49][50]
Los sitios en los que posarse constituyen un elemento importante dentro de los hábitats de los tordos cabecicafé, puesto que los machos cantan y se exhiben desde allí y las hembras los utilizan para buscar huéspedes para sus huevos. Estos sitios incluyen árboles, arbustos y otras estructuras que excedan la altura promedio de la vegetación circundante. En Alberta, Biermann y otros (1987) observaron individuos posados en árboles de hasta 4 metros de altura; no así en áreas sin árboles dominadas por el arbusto Artemisia tridentata.[35]
En la región de los Grandes Lagos[editar]
En Wisconsin, de 1375 avistamientos entre 1995 y 2000 en los que se registró el tipo de hábitat en el que fue observado, el 25% se dio en zonas de meseta con arbustos de madera dura (particularmente setos) o arbustos mixtos, 23% en áreas urbanas, 19,5% en zonas de meseta con bosques de madera dura (en especial robles) o bosques mixtos, y 14% en áreas abiertas de meseta.[49] En Míchigan, un tercio de las observaciones entre 1983 y 1988 se produjeron en hábitats residenciales, al costado de caminos y rutas y en setos.[49][51] En un estudio llevado a cabo en Illinois, Robinson y otros (1999) descubrieron que había menos hembras de tordo cabecicafé en los pastizales (alrededor de 1,25) por cada 100 huéspedes de especies receptivas para con sus huevos que en los bosques (3,75), sabanas (12,5) y matorrales (5).[35]
En las Grandes Llanuras[editar]
La abundancia de tordos cabecicafé puede verse influida por las características de la vegetación, tal como lo han comprobado numerosos estudios realizados en distintos estados del norte de las Grandes Llanuras. En Nebraska, el número de ejemplares estaba positivamente relacionado con la altura de la vegetación (King y Savidge, 1995). En Minnesota, Montana, Dakota del Norte y Dakota del Sur, la densidad de su población era menor en áreas cubiertas con césped y legumbres (Johnson y Schwartz, 1993 a). En praderas de pasto mixto quemadas en el noroeste de Dakota del Norte, eran más abundantes en presencia de plantas herbáceas, vegetación viva y asociaciones del arbusto Symphoricarpos occidentalis y especies de césped tales como Elytrigia repens y Bromus inermis (Madden, 1996).[35]
En los campos de pasturas de Dakota del Norte surcentral y noroccidental existía una mayor cantidad de ejemplares en las formaciones vegetales dominadas por una mezcla de pasto azul de Kentucky (Poa pratensis) y especies nativas de césped. Su abundancia estaba negativamente asociada a la densidad de los arbustos y a un lecho de la planta licófita Selaginella densa, y era baja en las áreas dominadas únicamente por especies nativas de césped. Asimismo, el principal elemento determinante de su abundancia era una escasa obstrucción visual, ligada a la altura y la densidad de la vegetación (Schneider, 1998).[35]
En Colorado, Montana, Nebraska, Dakota del Norte, Dakota del Sur y Wyoming, altas densidades de tordos cabecicafé se encontraban en zonas moderadamente utilizadas como pasturas en las que hubiera pasto azul de Kentucky y la planta herbácea Artemisia ludoviciana (Kantrud y Kologiski, 1982). En el centro de Dakota del Norte, había una mayor cantidad de ellos en áreas cubiertas en un 30 – 80% de Symphoricarpos occidentalis y Elaeagnus commutata que en áreas cubiertas por arbustos en menos de un 10% (Arnold y Higgins, 1986). En Iowa su número a los costados de rutas y caminos era inversamente proporcional a la altura de la vegetación y a la densidad vertical de la misma (Camp y Best, 1993). En hábitats ribereños, la densidad de su población estaba negativamente relacionada con la densidad de los árboles y positivamente vinculada a los árboles pequeños y a la estratificación vertical de la vegetación de menos de 3 metros (Stauffer y Best, 1980). Young y Hutto (1999) se encontraron con que en Montana y Idaho eran más comunes en aéreas abiertas, como pastizales y terrenos agrícolas, y en áreas ribereñas que en los bosques.[35]
La distancia a los terrenos agrícolas, como prados, tiene una fuerte influencia sobre la presencia de los tordos cabecicafé (Goguen y Mathews, 1999). En Nuevo México, su abundancia y tasas de parasitismo en nidos de víreo plomizo (Vireo plumbeus) se reducían con la distancia de los prados activamente utilizados como pasturas para los animales, desde un 81% de 58 nidos en esos prados a 33% de 24 nidos ubicados a entre 8 y 12 km de ellos (Goguen y Mathews, 2000). En un área agrícola de Misuri, la densidad de tordos cabecicafé alimentándose era mayor en feedlots, seguido por césped corto (2 a 20 cm) usado como pasturas, césped largo (5 a 30 cm) empleado para el mismo fin y hábitats no utilizados como pasturas, siendo estos últimos césped cortado, campos de heno con pasto de entre 2 y 10 cm y campos de heno sin cortar con pasto de más de 30 cm (Morris, 1996; Morris y Thompson, 1998). Las tasas de parasitismo eran más altas en un prado que había sido poco utilizado como pastura (58% de 93 nidos) que en un área silvestre que no había sido empleada para tal fin (22% de 139 nidos) en Manitoba (Knapton, 1978). El número de tordos cabecicafé en el prado se redujo después de que dejara de ser empleado como pastura.[35]
Topografía de sus hábitats[editar]
La topografía era un importante elemento en la determinación de su abundancia en el oeste de Montana —más aún que la cantidad de aves hospedadoras y el tipo de vegetación—, puesto que se les hallaba más frecuentemente sobre un relieve llano que en uno escarpado, en parte debido a que los cañones estaban más alejados de los terrenos agrícolas y la densidad de huéspedes es menor allí que en áreas llanas (Tewksbury y otros, 1999). Young y Hutto (1999) informaron que los tordos cabecicafé en Montana y Idaho eran menos proclives a encontrarse en pastizales de gran altitud; no fueron hallados por encima de los 2.318 m sobre el nivel del mar. En otros lugares, sin embargo, han sido avistados en altitudes aún mayores, como en Colorado —a 2.895 m (Hanka, 1985)— y en California, en donde el 41% de los 114 sitios en los que fueron vistos por Rothstein y otros (1980) se encontraban por encima de los 2.400 m sobre el nivel del mar.[35]
Dentro de la Columbia Británica, el tordo cabecicafé es avistado generalmente en altitudes bajas tanto sobre la costa como en el interior. Sobre la costa, la mayor parte de los registros son de las tierras bajas de la depresión de Georgia, aunque han sido observados acompañando al uapití de Roosevelt (Cervus canadensis roosevelti) a altitudes de 1.370 m (Green Mountain, cerca de Nanaimo). A fines del verano, los jóvenes se alimentan en las crestas alpinas. En el interior de la provincia, el tordo cabecicafé ha sido encontrado a altitudes de entre 460 y 2440 m (al sur del lago Tatlayoko) y los juveniles independientes son frecuentemente vistos en praderas alpinas. Se cree que la conquista de estas altitudes elevadas en la Columbia Británica es relativamente reciente, al igual que la expansión latitudinal documentada por Rothstein y otros (1980) en la Sierra Nevada y la registrada por Hanka (1985) en Colorado. En ambos casos, el fenómeno se atribuyó a la alteración del hábitat causada por el intensivo consumo de la vegetación del terreno por parte del ganado.[29]
En la Columbia Británica, el tordo cabecicafé ha sido documentado parasitando nidos a altitudes de entre casi el nivel del mar y los 335 m en la costa y entre los 280 y los 1600 m en el interior (Fonnesbeck, 1998). En todas las ecoprovincias es más abundante en altitudes bajas.[29]
Comportamiento[editar]

El tordo cabecicafé rara vez salta sobre el suelo, prefiriendo caminar o correr.[15][19] Bate sus alas constantemente cuando vuela;[10] de acuerdo con la descripción de Arthur Cleveland Bent, su vuelo pareciera ser más bien inestable, similar al del tordo sargento (Agelaius phoeniceus).[19] Los machos suelen posarse erguidos sobre las copas de los árboles al tiempo que reproducen silbidos y se congregan sobre el césped para pavonearse y exhibirse ante las hembras, mientras que éstas a menudo merodean por los márgenes de los bosques en busca de nidos.[10][34] Se trata de aves ruidosas capaces de vocalizar diferentes sonidos.[10] Mientras cantan, los machos frecuentemente inflan las plumas de su dorso y pecho, levantan sus alas, despliegan las plumas de su cola y se inclinan hacia adelante; a veces hacen esto en grupo.[10] Cuando no están exhibiéndose o alimentándose en el campo, se posan en ramas altas y prominentes.[10] Es posible encontrarlos en jardines hogareños, más aún si se ha esparcido semillas para aves sobre el suelo.[10] Es una especie altamente gregaria en todas las estaciones.[19]
Debido a que los tordos cabecicafé no cuidan de sus polluelos, sus dos principales actividades durante la temporada reproductiva —la alimentación y la búsqueda de nidos— pueden llevarse a cabo en sitios distintos.[16] Consecuentemente, pueden ocupar hábitats que satisfagan sólo una de esas necesidades y volar regularmente hasta 7 km entre las áreas de alimentación y las de búsqueda de nidos (Rothstein y otros, 1984).[16][52] En el sur de Illinois y el centro de Misuri, los tordos cabecicafé que buscaba nidos en los bosques se trasladaban entre 0,1 y 4,0 km para alimentarse en pasturas con ganado, feedlots de cerdos, caballos y vacas, costados de caminos con el césped corto, jardines, campos recientemente arados y sembrados, campings, costados de caminos con grava, comederos de aves y caminos de ripio.[16] Según Stephen I. Rothstein y otros (1980), los tordos cabecicafé a veces no se mueven de sus áreas de reproducción, si las mismas les ofrecen la oportunidad de alimentarse y dormir allí mismo.[35]
En el este de la Sierra Nevada, el tordo cabecicafé se reproduce y se alimenta en sitios casi totalmente distintos. Las cinco hembras y cuatro de los ocho machos equipados con radiotransmisores estudiados por Stephen I. Rothstein, Jared Verner y Ernest Stevens a principios de la década de 1980 pasaban las primeras horas de la mañana en bosques abundantes en huéspedes y luego se trasladaban entre 2,1 y 6,7 km hasta los lugares de alimentación como corrales de caballos y zonas residenciales con comederos para aves. Los cuatro machos que no volaron esas grandes distancias para alimentarse, que tenían sólo un año de edad y posiblemente estaban socialmente subordinados, también mostraban una gran movilidad pero no ocupaban las mismas áreas reproductivas cada mañana. Las áreas matutinas de reproducción de las aves que se desplazaban, consideradas individualmente, tenían una extensión promedio de 68 hectáreas y la suma de sus áreas de reproducción y las áreas en las que se alimentaban por la tarde ocupaban un promedio de 442 hectáreas. Estas cifras se encuentran entre las más altas documentadas entre los paseriformes e igualan las de algunas aves de presa. Los patrones de traslación de los tordos cabecicafé implican un cambio radical entre un comportamiento bastante antisocial durante la mañana y otro extremadamente sociable por la tarde. A diferencia de ictéridos no parasíticos que se alejan desde un sitio reproductivo central (su nido) para alimentarse, estas aves hacen lo contrario, apartándose de los sitios centrales de alimentación para reproducirse en otros lugares.[52]
Migración[editar]

El tordo cabecicafé es un ave migratoria de corta distancia dentro de América del norte.[4] Puede haber diferencias entre las distancias recorridas por los adultos y los juveniles.[53] En el noreste, la mayoría de los individuos se desplaza unos 800 a 850 km entre las áreas de reproducción y las regiones en las que pasan el invierno.[4][6] Según la National Geographic, mayormente vuelan hacia el norte entre mediados de marzo y mediados de abril y hacia el sur entre fines de julio y octubre.[20] De acuerdo con Batts (1958), Bent (1965), Knapton (1979) y Johnsgard (1980), arriban al norte de los Estados Unidos desde inicios de abril a comienzos de mayo y parten entre agosto y noviembre.[35] Llegan a Connecticut en marzo y, aunque algunos pocos pasan allí el invierno, la gran mayoría migra a fines de septiembre.[25] En la Columbia Británica, el mayor número de tordos cabecicafé en invierno se encuentra en la ecoprovincia de la depresión de Georgia (este de la isla de Vancouver y extremo sudoeste de la Columbia Británica continental), y en verano, en las ecoprovincias interior meridional (centro del sur de la provincia) y montañas meridionales del interior (sudeste).[29]
Viajan durante el día, con frecuencia como parte de grandes bandadas compuestas por diversas especies: tordos sargento (Agelaius phoeniceus), zanates norteños (Quiscalus quiscula), estorninos pintos (Sturnus vulgaris) y, más raramente, tordos canadienses (Euphagus carolinus), tordos ojo amarillo (Euphagus cyanocephalus) y zorzales pechirrojos (Turdus migratorius).[4][6] Típicamente, los machos llegan antes que las hembras a las zonas en las que se reproducen.[33] Según una información publicada en 1958, la migración primaveral en Maryland y el Distrito de Columbia ocurre entre el 5 de febrero y el 25 de abril, con un pico de actividad entre el 10 de marzo y el 10 de abril.[4][54] En otoño, sobre las laderas occidentales de la Sierra Nevada, los juveniles comienzan a formar bandadas a medida que adquieren independencia. Según datos publicados aquel mismo año, los primeros juveniles independientes aparecieron el 14 de julio. En la misma área, todos los adultos partieron entre el 17 de julio y el 21 de julio. En Maryland y el Distrito de Columbia, la migración de otoño se extiende desde el 15 de agosto hasta el 10 de diciembre, con su apogeo entre el 25 de septiembre y el 1 de noviembre.[4][54]
Según Arthur Cleveland Bent (1958), los tordos cabecicafé orientales no viajan mucho en su migración de primavera, dejando los estados sureños durante marzo para alcanzar las partes septentrionales de su área de reproducción en las primeras dos semanas de abril y a veces antes del final de marzo. Herbert Friedmann (1929) escribió que comúnmente migraban en compañía de tordos sargento (Agelaius phoeniceus), tordos canadienses (Euphagus carolinus) y zanates norteños (Quiscalus quiscula), mientras que se relacionaban con menor frecuencia con praderos orientales (Sturnella magna) y zorzales pechirrojos (Turdus migratorius) en el este y tordos ojo amarillo (Euphagus cyanocephalus) y tordos cabeciamarillos (Xanthocephalus xanthocephalus) en el oeste. Los juveniles llegan a las áreas de reproducción después que los adultos. Bent afirmó que la migración otoñal comienza en septiembre, pero tiene lugar principalmente en octubre, con algunos individuos quedando aún en su área de distribución estival bien entrado noviembre.[19]
Gregarismo[editar]

Aunque los machos con pareja y las hembras se dispersan en sus territorios reproductivos, suelen encontrarse en las cercanías bandadas de individuos sin pareja o promiscuos con los cuales las aves reproductivas se relacionan hasta cierto punto. Herbert Friedmann (1929) nunca los documentó peleando, pero la Sra. Nice (1937) los vio reñir en cinco oportunidades “en ocasión de discrepancias entre los machos durante eventos de cortejo comunal.”[19]
Tan pronto como finaliza la puesta de huevos, los tordos cabecicafé comienzan a agruparse en grandes bandadas para alimentarse en los campos y prados. Los jóvenes se suman a estos grupos cuando se independizan de sus padres adoptivos. Elon H. Eaton (1914) estimó que la bandada promedio en otoño sería de entre 50 y 200 aves.[19]
En algunos lugares —particularmente en el oeste—[22] los juveniles pueden no interactuar en ningún momento con los adultos durante su primer año de vida, mientras que en otros sitios se unen a bandadas de otros tordos cabecicafé mientras aquellos aún se encuentran en los días finales de la temporada reproductiva y permanecen a su lado durante un año entero.[53] En áreas recientemente colonizadas, existe una mayor fluidez social entre los individuos de esta especie, es decir, más ejemplares se suman o se separan de las bandadas, mientras que en poblaciones más antiguas se aprecia una mayor estabilidad social.[22] Se han registrado bandadas exclusivamente de juveniles, únicamente de hembras y mixtas.[53]
Fuera de la época de reproducción, duermen en compañía de varias especies de ictéridos en grupos de más de 100 mil aves.[10] Los tordos sargento (Agelaius phoeniceus), zanates norteños (Quiscalus quiscula), tordos cabecicafé y estorninos pintos (Sturnus vulgaris) pasan la noche en grandes concentraciones a finales del verano y en otoño.[55] En Kentucky, estas asociaciones mixtas pueden superar los 5 millones de individuos, de los cuales un 2 a un 5% son generalmente tordos cabecicafé.[4][10] En Oklahoma, las bandadas de descanso tienen su auge en noviembre, con 250 a 900 mil aves.[4][6]
En ocasiones, los tordos cabecicafé pasan la noche acompañados de golondrinas.[19] Milton B. Trautman (1940) documentó que algunos tordos cabecicafé que pasaban el invierno en Ohio a veces se asociaban con gorriones comunes (Passer domesticus).[19] Durante el invierno, es posible verlos junto a tordos tricolores (Agelaius tricolor) en el delta de Sacramento-San Joaquín y la zona central de la costa de California.[56] Edward Howe Forbush (1927), por otra parte, manifestó que “en Nueva Inglaterra los tordos cabeciafé generalmente duermen entre ellos; con frecuencia eligen coníferas de tronco grueso u otras arboledas en las que pasan la noche en grandes números. Otro lugar de descanso predilecto es entre el pasto y los juncos en amplios prados.”[19]
John E. Galley le envió a Arthur Cleveland Bent sus anotaciones con respecto su estudio sobre una gran bandada invernal de descanso de tordos cabecicafé y estorninos en Midland (Texas). En el momento de mayor abundancia, estimó que el sitio en el que estas aves descansaban agruparía “entre 10.500 y 11.000 individuos, de los cuales 2.000 o 2.500 eran tordos cabecicafé.” Dormían en olmos chinos (Ulmus parvifolia) alrededor del palacio de justicia de la ciudad. “Los estorninos se congregaban en las ramas más altas, los tordos cabecicafé debajo de ellos.”[19]
Vocalizaciones[editar]
Las vocalizaciones son el componente básico del sistema de comunicación de los tordos cabecicafé.[53] Al igual que en otros paseriformes, cumplen un rol importante durante la época de reproducción.[57] Son utilizadas entre los machos en lo que podría denominarse "duelos vocales" que sirven para establecer jerarquías de dominancia dentro de un grupo.[53] Asimismo, cantar persistentemente les es necesario para conseguir una compañera con la que aparearse.[53] Si bien también cantan en los meses de invierno, los machos hacen mayor uso de estas vocalizaciones, fundamentales para atraer a las hembras, como parte del cortejo y durante la temporada reproductiva.[57] Aretas A. Saunders describió:
Algunos de los sonidos del tordo cabecicafé son claramente estacionales, emitidos en su mayoría, sino exclusivamente, por el macho y por lo tanto deberían ser considerados canciones, aunque no sean muy agradables al oído. La más común de ellas consiste en una nota prolongada, aguda y chillona, seguida de otras dos o tres notas más cortas y graves y generalmente sibilantes. Podría ser transcripta como wheeeee tsitsitsi. (…) La primera nota puede estar por completo dentro de un mismo tono o elevarse ligeramente. Una alternativa no inusual consiste en una primera nota procedida por una variación descendente que es explosiva y sibilante al principio; suena wheeeee tseeya y recuerda bastante a un estornudo.
Durante el cortejo, cuando el macho está inclinándose y desplegando sus alas y cola, produce otro tipo de canción, algo similar a la descripta para el zanate bajo circunstancias semejantes, pero por lo general sube abruptamente desde un tono acústico grave a uno agudo: dos o tres notas bajas y luego unas pocas altas y chillonas. Las notas graves no son ásperas, sino gorgoteantes. Suena como glub-glub-kee-he-heek. (…)El período en el que estas canciones son reproducidas se extiende entre el arribo de las aves y principios de julio, cuando termina la puesta de huevos y las aves se congregan en bandadas para alimentarse en los campos durante el resto del verano. Las notas de sus llamados incluyen un corto chuck, un preeah poco definido y un traqueteo fuerte y áspero.[19]
El botánico y ornitólogo Eugene Pintard Bicknell (1884) afirmó:
Parece no haber regularidad en su canto en el otoño; pero he escuchado algunas canciones imperfectas o incompletas en distintas oportunidades en el mes siguiente a mediados de septiembre. A veces, en otoño, cuando los tordos cabecicafé se congregan en pequeñas bandadas, se vuelven parladores y la emisión combinada de sus notas graves produce el sonido de un gorjeo suave.[19]
Alimentación[editar]

Su dieta está compuesta de semillas, frutos, bayas, insectos y otros invertebrados.[13] Prefieren las semillas de hierbas a los granos de cultivo.[10] Durante el verano, las semillas representan alrededor de la mitad de su dieta, mientras que la otra mitad consiste en insectos y otros invertebrados. Las semillas y los granos residuales componen más del 90% de su alimentación invernal.[33]
Se alimentan sobre el suelo,[15] en grupos mixtos de ictéridos y estorninos.[10] Mientras caminan sobre la tierra alimentándose, levantan la cola por encima de su dorso.[20][58] Frecuentemente siguen a caballos, vacas y bisontes para atrapar los insectos que estos levantan al caminar; de allí, los nombres de "vaquero cabecicafé" y "vaquero de cabeza castaña".[19] Buscan alimento entre las cabezas y las patas del ganado, sin espantarse.[19] En ocasiones también se posan sobre el lomo de estos mamíferos y extraen las garrapatas e insectos que encuentren sobre ellos. Algunos autores de antaño afirmaron que buscaban gusanos intestinales entre los excrementos de dichos animales; sin embargo, según Arthur Cleveland Bent, esto no fue respaldado por los análisis estomacales.[19] Las hembras necesitan grandes cantidades de calcio para depositar sus numerosos huevos, el cual consiguen ingiriendo las conchas de caracoles y a veces las cáscaras de los huevos del ave hospedadora cuyo nido parasitan, particularmente durante la temporada reproductiva.[10][33]
Beal (1900) escribió sobre los contenidos estomacales de 544 tordos cabecicafé, obtenidos de 20 diferentes estados durante todos los meses del año y examinados por la Biological Survey:
Los alimentos hallados en estos estómagos fueron clasificados de la siguiente manera: materia animal (22,3%) y materia vegetal (77,7%). (...) Los alimentos de origen animal consisten casi completamente en insectos y arañas, siendo unos pocos caracoles la excepción. Los insectos comprenden avispas y hormigas (Hymenoptera), hemípteros, algunas moscas (Diptera), escarabajos (Coleoptera), saltamontes (Orthoptera) y orugas (Lepidoptera). (…) Los saltamontes parecen ser el alimento animal favorito de los tordos cabecicafé y componen la mitad de su dieta insectívora o un 11% del total. (…)Los alimentos de origen vegetal del tordo cabecicafé exceden a los de origen animal tanto en calidad como en variedad. Cuando examina el suelo en cascos de estancia y caminos evidentemente busca semillas esparcidas más que insectos, aunque probablemente tomen estos últimos cuando los encuentran.(…) [Consume también] semillas duras de pastos y hierbas, con pocos indicios de consumo de pulpa de fruta u otro tipo de materia vegetal suave.[19]
Se encontraron granos de maíz en 56 estómagos, de trigo en 20, de avenas en 102 (…), mientras que se hallaron semillas de ambrosías en 176 estómagos, de Echinochloa[59] en 265 y de Panicum en 133. Los granos constituían un 16,5% —alrededor de un sexto— de su dieta anual y probablemente la mitad de estos sean granos residuales.[19] Beal afirmó:
Resumiendo los resultados de la investigación, los siguientes puntos pueden considerarse bastante sólidos: 1) Un 20% del alimento del tordo cabecicafé consiste en insectos, los cuales son perjudiciales, o bien, molestos. 2) Un 16% es grano, cuyo consumo podría considerarse una pérdida, aunque es casi seguro que la mitad de éste sea grano residual. 3) Más del 50% consiste en semillas de hierbas perjudiciales, cuya eliminación es beneficiosa para el productor. 4) Prácticamente no comen fruta.[19]
B. H. Warren (1890) aseveró que los tordos cabecicafé consumen moras, cerezas silvestres, Vitis aestivalis y otras bayas. E. R. Kalmbach (1914) lo incluyó entre las aves que comen Hypera postica, un escarabajo curculiónido que afecta los cultivos de alfalfa; según él, desde el 1 de mayo hasta mediados de julio, el curculionoideo constituye más de la mitad de su ingesta. El zoólogo Arthur Holmes Howell (1907) afirmó que se alimentaba del Anthonomus grandis, otro curculiónido nocivo para la agricultura, que daña los cultivos de algodón. Hervey Brackbill le escribió lo siguiente a Arthur Cleveland Bent: “Una tarde me topé con una hembra de tordo cabecicafé comiendo semillas de diente de león directamente de la estructura que las sostenía. Debió haber encontrado dificultoso alimentarse de ese tallo recto, por que lo después de que hubiera presenciado unos pocos bocados suyos, lo sujetó sobre el suelo con una de sus patas y terminó de comer de esa manera.”[19]
Reproducción[editar]

El rasgo más característico de esta ave con respecto a su reproducción es el hecho de que practica el parasitismo de puesta. La hembra deposita sus huevos en los nidos de otras aves —típicamente, paseriformes pequeños—,[2] en particular en aquellos en forma de taza.[24] Los machos alcanzan la madurez sexual al año, pero rara vez se aparean hasta los dos años.[4][6] Las hembras se reproducen ya al año de edad.[4][6] Al igual que en otros paseriformes, las vocalizaciones cumplen un rol importante durante la época de reproducción. Si bien también cantan en los meses de invierno, los machos hacen mayor uso de estas vocalizaciones, fundamentales para atraer a las hembras, como parte del cortejo y durante la temporada reproductiva.[57]
La temporada reproductiva inicia en abril, culmina en mayo, comienza a declinar en junio y continúa de manera esporádica en julio.[2] Según Ortega (1998), generalmente se extiende desde comienzos de mayo a fines de julio, un período que se superpone con la época de reproducción de numerosas aves norteamericanas de los pastizales (Stewart, 1975).[35] En Dakota del Norte, de acuerdo con Stewart (1975), se prolonga hasta mediados de agosto, pero tiene su auge entre inicios de mayo y mediados de julio.[35] En Connecticut, es posible ver adultos cortejando en marzo e inicios de abril y las hembras comienzan a depositar sus huevos a mediados de mayo.[25] Según información de 1958, los tordos cabecicafé ponen sus huevos en Maryland y el Distrito de Columbia desde fines de abril a fines de julio (siendo las fechas extremas el 24 de abril y el 28 de julio), particularmente desde comienzos de mayo hasta comienzos de julio.[4][54] Según un estudio publicado en 1993, en Misuri se han encontrado huevos de esta especie en nidos ajenos desde mediados de abril hasta mediados de julio.[4][6]
Numerosos estudios han constatado una cierta tendencia a regresar una y otra vez a las mismas zonas de reproducción tanto por parte de los machos como de las hembras. En Manitoba (Canadá), el 64% de 337 machos marcados y el 46% de 173 hembras marcadas exhibían un comportamiento de fidelidad hacia los sitios en los que se reproducían (Woolfenden y otros, 2001). Shake y Mattsson (1975) se encontraron con que el 40% de 119 machos y el 9% de 81 hembras marcados en Míchigan centro septentrional regresaron a un radio de 4,8 km desde el punto en el que habían sido identificados el año anterior. En un estudio llevado a cabo en Illinois, Raim (2000) descubrió que el 47% de 79 sitios de reproducción utilizados por hembras con marcas de colores en junio de un año volvía a ser usado por las mismas aves al año siguiente.[35]
Factores de mortalidad[editar]
En el noreste de Arkansas, se descubrieron egagrópilas de búho campestre (Asio flammeus) que contenían restos de tordos cabecicafé.[4][60] Los predadores de los polluelos incluyen la culebra corredora constrictor (Coluber constictor), la víbora ratonera (Elaphe obsoleta) y el arrendajo azul (Cyanocitta cristata). Estas aves a veces atacan conjuntamente a los búhos cornudos (Bubo virginianus), un potencial predador tanto para los adultos como para los jóvenes. Los ectoparásitos, los helmintos y las bacterias infecciosas son otros factores de mortalidad.[4][6]
De acuerdo con Arthur Cleveland Bent (1958), mientras descansan son presas del visón americano (Neovison vison), las comadrejas (Mustela spp.) y los búhos, y durante el día son atacados por halcones (Falco spp.) y otros falconiformes. Harold S. Peters (1936) lista un piojo, dos moscas, una garrapata y otras dos especies de ácaros como ectoparásitos del tordo cabecicafé oriental.[19]
Los químicos utilizados para controlar los insectos pueden matar a los tordos cabecicafé. En Nuevo México, el toxafeno aplicado a una superficie de 71.600 hectáreas de pradera de pasto corto causó una disminución en el número de estas aves (McEwen y otros, 1972). El diazinón rociado sobre el césped y sobre una cancha de béisbol en Connecticut mató a docenas de tordos cabecicafé (Anderson y Glowa, 1985).[35]
Impacto económico[editar]

De acuerdo con Arthur Cleveland Bent, sus hábitos alimenticios son decididamente más beneficiosos que perjudiciales, provocando muy poco daño a los cultivos y eliminando muchos insectos nocivos. Se alimentan, por ejemplo, de Anthonomus grandis e Hypera postica, dos especies de curculiónidos que afectan el algodón y la alfalfa respectivamente. La principal causa de su impopularidad yace en el daño que produce a través de su comportamiento parasítico, el cual indudablemente interfiere con la crianza de una gran cantidad de pequeñas aves insectívoras.[19] Beal (1900) escribió al respecto:
Cuando un único polluelo de tordo cabecicafé reemplaza una nidada de cuatro aves, se produce, obviamente, una pérdida clara; pero, como ya se ha dicho, debe atribuírsele una gran importancia económica debido a sus hábitos alimenticios, y hay que recordar que en la mayoría de los casos las aves eliminadas son mucho más pequeñas que el intruso y por lo tanto el efecto de su alimentación es menor, y que a menudo se depositan dos o tres huevos de tordo cabecicafé en un mismo nido.[19]
De 215 especies neotropicales migratorias, Rodenhouse y otros (1992) listan al tordo cabecicafé entre las menos de diez que causan un daño significativo a los cultivos sobre amplias áreas geográficas.[61]
Impacto ecológico[editar]

El problema del parasitismo del tordo cabecicafé, especialmente en los hábitats ribereños, ha sido documentado.[23] Debido a que puede tener un impacto significativo sobre el éxito reproductivo de otras aves, muchas han aprendido a reconocer este peligro y actúan agresivamente hacia el tordo cabecicafé cuando este se acerca a sus territorios.[15] La fragmentación de los bosques en América del norte expandió su hábitat y redujo —y en muchos lugares, eliminó— los hábitats de vegetación densa en los que esta especie no penetraba.[15] Como consecuencia, un cierto número de aves del bosque sufre una amenaza progresiva de parasitismo de puesta.[15][30] A diferencia de las moradoras de las Grandes Llanuras, estas nuevas víctimas no evolucionaron conjuntamente con el tordo cabecicafé y, por esta razón, no cuentan con las defensas naturales necesarias para hacer frente a su parasitismo y se vuelven extremadamente vulnerables en presencia de estos parásitos de puesta.[18][30] Se le ha responsabilizado por la disminución en las poblaciones de varios paseriformes.[2] Por otro lado, Martin (1992) sostuvo que en la mayoría de los lugares los efectos de la depredación en los nidos sobre la dinámica poblacional de los huéspedes del tordo cabecicafé superan ampliamente las repercusiones del parasitismo de puesta.[16]
Factores determinantes de su impacto ecológico[editar]

Aunque algunas especies pueden volver a anidar y, por lo tanto, su éxito reproductivo no se ve tan afectado por el parasitismo de puesta, otras aves cuyas temporadas de reproducción son más abreviadas no son capaces de hacerlo y corren mayor riesgo a causa del tordo cabecicafé. Sin embargo, parte de este impacto ambiental es controversial y un estudio sobre la magnitud de los daños del tordo cabecicafé en las poblaciones de aves norteamericanas argumentó que los conservacionistas y el público en general tienden a magnificar las implicaciones de esta peculiar estrategia reproductiva como causa importante del decrecimiento de las poblaciones de aves.[2]
En general, las poblaciones de huéspedes deben producir 2,0 – 2,5 jóvenes al año por pareja para mantener una tasa de crecimiento poblacional positiva, asumiendo que la supervivencia anual sea de un 40 – 60% para los adultos y 20 – 35% para los jóvenes. Los niveles de parasitismo de puesta que pueden ser tolerados manteniendo un crecimiento poblacional positivo varían entre las distintas aves hospedadoras. Las especies con altos niveles de depredación en sus nidos, una baja proporción de abandono de los nidos parasitados, períodos de incubación prolongados y temporadas reproductivas breves en relación con el período de incubación sólo pueden soportar una frecuencia parasítica menor. Contrariamente, las especies con escasa depredación en sus nidos, un alto porcentaje de abandono de los nidos vulnerados —por ejemplo: el verdín de las praderas (Dendroica discolor); Nolan, 1978—, períodos de incubación reducidos y épocas de cría más largas podrían ser más resistentes a la amenaza del parasitismo.[16]
Especies y subespecies amenazadas y no amenazadas[editar]

El parasitismo de puesta del tordo cabecicafé representa efectivamente una amenaza para diversos paseriformes neotropicales migratorios con áreas de distribución restringidas.[16] Robinson y otros (1989) incluyen entre las aves amenazadas por el parasitismo al chipe de Kirtland (Dendroica kirtlandii; Walkinshaw, 1983), una subespecie de víreo de Bell (Vireo bellii pusillus; Franzreb, 1989), otra de mosquerito saucero (Empidonax traillii extimus; Unitt, 1987; Brown, 1988), al víreo gorra negra (Vireo atricapilla; Grzybowski y otros, 1986) y al chipe mejillas doradas (Dendroica chrysoparia).[16] Cabe destacar que para el mosquerito saucero, así como para la mayoría de las especies en peligro afectadas por el parasitismo del tordo cabecicafé, existe una interacción compleja entre los efectos directos resultantes de la pérdida de su hábitat y los efectos indirectos derivados del parasitismo de puesta.[4][31]
Las pequeñas poblaciones de estas aves son frecuentemente parasitadas, lo que condujo a la implementación de programas de captura de tordos cabecicafé en áreas específicas de reproducción en donde otras especies están amenazadas.[15] Los huéspedes con áreas de distribución más amplias son menos vulnerables debido a que las poblaciones severamente parasitadas pueden ser restauradas con inmigrantes procedentes de otras regiones en donde el parasitismo sea menor.[16]
En una investigación llevada a cabo en el Sierra National Forest (California) entre 1980 y 1981 (Verner y Ritter, 1983), la abundancia relativa de víreos gorjeadores (Vireo gilvus) estaba negativamente relacionada con la de tordos cabecicafé, lo cual respalda los resultados de estudios anteriores que habían encontrado altas tasas de parasitismo de puesta en los nidos de esta especie en la Sierra Nevada. Sin embargo, debido a que los tordos cabecicafé son raros o se encuentran ausentes en muchos de los principales tipos de hábitats y en áreas alejadas de fuentes de alimento vinculadas a las actividades humanas, Verner y Ritter pusieron en duda la posibilidad de que alguna otra especie en la Sierra Nevada se viera amenazada por el parasitismo. Aun así, los autores destacaron la necesidad de un monitoreo periódico debido a la creciente presencia humana en las montañas.[32]
Gaines (1974), en un estudio de la avifauna ribereña del Valle de Sacramento (California), sugirió que los tordos cabecicafé habían constituido un factor relevante en las significativas disminuciones poblacionales de varias especies de paseriformes en ese lugar durante los cuarenta años anteriores. El víreo de Bell (Vireo bellii) ha desaparecido aparentemente de California central y el parasitismo del tordo cabecicafé es considerado una de las principales causas de esto (Games, 1974; Goldwasser y otros, 1980).[32]
Efecto sobre el chipe de Kirtland (Dendroica kirtlandii)[editar]

Mayfield (1960) identificó una tasa de parasitismo del 55% en los nidos del chipe de Kirtland (Dendroica kirtlandii).[62] En 1971, el mismo autor pronosticó la extinción de la especie para 1980 si el tordo cabecicafé no era controlado.[63][64] Gracias a un programa extensivo iniciado en 1972, la población de esta ave se mantuvo estable durante unos veinte años aunque sin recuperarse, hasta que se registraron ligeros aumentos poblacionales en 1991 y 1992.[64] Conforme a dos estudios de 1993, es probable que dicho programa haya sido la clave para la estabilización de las poblaciones del chipe de Kirtland.[16][64]
En 1972, el Servicio de Pesca y Vida Silvestre de los Estados Unidos, en cooperación con el Servicio Forestal, el Departamento de Recursos Naturales de Míchigan y la Michigan Audubon Society, comenzó a controlar el número de tordos cabecicafé con trampas ubicadas en las áreas de nidificación del chipe de Kirtland en primavera y a comienzos del verano. Las trampas, que contenían mijo, agua y varios tordos cabecicafé vivos, eran revisadas a diario y los tordos cabecicafé capturados eran eliminados. El éxito reproductivo del chipe mejoró dramáticamente desde el inicio del programa y la tasa de parasitismo se redujo de un 69% en 1966 - 1971 a menos del 5%. La cantidad de polluelos de chipe por nido que lograban independizarse aumentó de menos de uno a casi tres.[17][65]
Efecto sobre el víreo de Bell (Vireo bellii)[editar]

El víreo de Bell (Vireo bellii) construye nidos en forma de taza abierta, los cuales son muy susceptibles al parasitismo del tordo cabecicafé (Goldwasser y otros, 1980). La reacción del víreo puede ser tanto el abandono del nido como la aceptación de los huevos extraños (Barlow, 1962). Naturalmente, los nidos no parasitados son más exitosos. Laymon (1987) calculó las curvas de crecimiento poblacional de acuerdo con cuatro tasas parasíticas diferentes utilizando información de ocho estudios entre 1929 y 1980: 13%, la tasa más baja conocida; 30%, el promedio de las tres tasas más bajas; 48%, el promedio de los ocho estudios, y 69%, el promedio de las dos tasas más altas. Con una tasa de parasitismo de un 13%, una población de víreos de Bell de 10 hembras alcanzaría las 100 hembras en 6 años. Una población con una tasa de parasitismo del 30% necesitaría 37 años para llegar a las 100 hembras, mientras que tasas del 48% y 69% llevarían a la extinción en 18 y 8 años respectivamente. Así, las tasas superiores al 48% conducirían a la extinción en un reducido lapso de tiempo, mientras que las mayores al 30% repercutirían en una población inestable que podría extinguirse a causa de acontecimientos eventuales.[23]
La subespecie pusillus de víreo de Bell, otrora abundante en el Valle Central de California y otros sistemas fluviales de baja altitud en ese estado norteamericano y en el mexicano de Baja California, desapareció de la mayor parte de su área de distribución reproductiva debido al limitado éxito de su reproducción a causa del parasitismo del tordo cabecicafé y a la pérdida de su hábitat.[66] Además de en su distribución, el Vireo bellii pusillus también ha sufrido una tremenda disminución en su número de ejemplares desde la década de 1920 debido a la alteración de la vegetación ribereña y al parasitismo de puesta.[67] Los programas de control de estos parásitos de puesta en áreas ribereñas resultaron beneficiosos para su reproducción.[66]
Aves amenazadas y no amenazadas en Columbia Británica[editar]

En la Columbia Británica, las especies que pueden estar amenazadas por el parasitismo del tordo cabecicafé incluyen el mosquerito saucero (Empidonax traillii) y el víreo gorjeador (Vireo gilvus). El víreo, otrora común en el sur del valle de Okanagan, prácticamente desapareció del valle; su disminución parece haberse debido a una combinación de la fragmentación de su hábitat y el parasitismo, factores que están amenazando la supervivencia de otros paseriformes en la región (Smith y otros, 1998).[29]
Para algunos otros paseriformes, sin embargo, particularmente las víctimas más frecuentes del parasitismo del tordo cabecicafé, que son especies comunes y ampliamente distribuidas, existe poca evidencia de algún efecto nocivo en sus poblaciones. Por ejemplo, en una población de gorriones melódicos (Melospiza melodia) en Mandarte Island —una isla diminuta en el estrecho de Georgia, al sudeste de la isla de Vancouver—, las hembras cuyos nidos fueron parasitados al menos una vez durante la temporada reproductiva lograron criar tantos polluelos hasta que estos lograran la independencia como las hembras que no habían sufrido parasitismo alguno en sus nidos (Smith, 1981). La colonización de Mandarte Island por parte de una o dos hembras de tordo cabecicafé tuvo un impacto pequeño en el número de gorriones melódicos debido a la incompleta superposición de las temporadas de puesta de huevos de ambas especies, las multiplicidad de las nidadas del gorrión, su habilidad para criar a sus propios polluelos junto a los del tordo cabecicafé y su éxito reproductivo basado en la densidad de su población (Smith y Arcese, 1994).[29][68]
Métodos de control poblacional[editar]

A pesar de estar legalmente protegido por el Migratory Bird Treaty Act,[4][69] los métodos de control directo incluyen el envenenamiento, los disparos con armas de fuego y la captura con trampas.[35] Sin embargo, las implicancias éticas de la erradicación de grandes números de tordos cabecicafé, una especie nativa, deben ser consideradas.[16] Entre los métodos de control indirecto se encuentran la preservación de amplias superficies de bosque,[70] la reforestación[23] y la eliminación de sus zonas de alimentación.[70]
Conocer en dónde se encuentran las áreas de alimentación locales es esencial para diseñar y predecir la efectividad de los esfuerzos por controlar su número (Rothstein y otros, 1987). La telemetría provee la mejor información sobre el uso de áreas de alimentación y de reproducción (Rothstein y otros, 1980 y 1984; F. Thompson, información no publicada), pero es cara —alrededor de 140 dólares por transmisor— y trabajosa. F. Thompson estimó que rastrear a 35 o 40 hembras con trasmisores con un equipo de tres personas durante un período de dos meses costaría entre 25.000 y 35.000 dólares anuales por sitio estudiado. Si la telemetría resulta demasiado costosa, los tordos cabecicafé pueden ser censados visitando potenciales sitios de alimentación, especialmente al mediodía y a la tarde. Si sus áreas de alimentación son reducidas, es más probable que la captura con trampas sea efectiva (Rothstein y otros, 1987). Existen ciertos indicios de que las hembras podrían descansar en conjunto incluso durante la temporada reproductiva en algunos lugares (F. Thompson, información no publicada), lo que se traduciría en mayores oportunidades para el control local.[16]
Una vez que se identificó la presencia de tordos cabecicafé en un área, deben llevarse a cabo estudios para determinar la tasa parasítica en las especies más vulnerables. El porcentaje de parasitismo puede ser estimado a partir de una muestra de nidos (Pease y Grzybowski) o la frecuencia relativa con la que los huéspedes son vistos alimentando a sus propios polluelos en comparación a los polluelos de tordo cabecicafé. Si el nivel de parasitismo es alto —mayor al 25% de los nidos—, es probable que la especie no rechace los huevos intrusos (Rothstein, 1975) y podría estar amenazada por las perturbaciones de esta ave.[16]
Control poblacional directo[editar]

Según Laymon (1987), los disparos posiblemente sean más efectivos que las trampas en hábitats ribereños angostos. Durante la temporada reproductiva, tanto los machos como las hembras pueden ser atraídos al área de alcance de un arma utilizando grabaciones de una hembra (Rothstein, comunicación personal). El dispararles a las hembras de manera selectiva dejando a los machos desbalancearía su población. La atracción de los tordos cabecicafé por medio de llamados grabados saca provecho de un comportamiento natural vinculado a su reproducción, razón por la cual es improbable que existan ejemplares inmunes a este método, un problema que sí puede surgir con las trampas.[23]
La otra técnica de control directo frecuentemente utilizada consiste en su captura con trampas en invierno en feedlots y tambos, o bien durante la temporada reproductiva en las proximidades de los nidos de las especies amenazadas. Las jaulas de grandes dimensiones con tordos cabecicafé vivos en su interior haciendo las veces de señuelos han demostrado ser efectivas para atrapar estas aves (Crase y otros, 1972). Los tordos cabecicafé son particularmente vulnerables a este sistema debido a su tendencia a concentrarse en bandadas numerosas durante el invierno. Laymon (1987) sugiere que la captura con trampas fuera de la época de reproducción debe considerarse más seriamente en las áreas con poblaciones comprobadamente sedentarias debido a que en muchos casos se desconoce si los tordos cabecicafé que pasan el invierno en cierto lugar son los mismos que se reproducen allí; recomienda además el marcado de las aves para estudiar sus movimientos.[23]
En Arkansas, la 4-aminopiridina fue utilizada para matar a las aves que dañaban los cultivos, mezclando una parte de ese químico en nueve partes de alimento, lo que resultó en la muerte de 5.400 tordos cabecicafé y estorninos pintos (Sturnus vulgaris; Dolbeer, 1988). Sin embargo, la efectividad de la 4-aminopiridina fue a corto plazo, debido a que el número de aves se recuperó dentro de los 8 días.[35]
Trampas[editar]

El empleo de trampas ha sido puesto en práctica exitosamente para proteger varias especies neotropicales migratorias con poblaciones pequeñas y áreas de distribución locales.[16] Los tordos cabecicafé han sido activamente capturados por agencias de recursos naturales en un esfuerzo por reducir su impacto sobre las poblaciones de víreo gorra negra (Vireo atricapilla) en Texas y chipe de Kirtland (Dendroica kirtlandii) en Míchigan.[25] Sin embargo, es poco probable que la captura con trampas sea efectiva sobre áreas amplias tales como bosques nacionales.[16]
Las dimensiones de las jaulas suelen variar entre los 2 x 2,5 x 1,5 m y los 5 x 5 x 2 m. Las de este último tamaño son utilizadas más a menudo para deshacerse de grandes cantidades de ictéridos en áreas con una importante concentración durante los meses de invierno. Pueden estar constituidas por distintos paneles que se ensamblen y desarmen fácilmente si existe la necesidad de trasladar las trampas. Los tordos cabecicafé son atraídos por señuelos —otros ejemplares de su especie vivos en el interior de las jaulas— y comida e ingresan a través de una entrada en forma de embudo o rendija. Las entradas en forma de rendija han sido, hasta cierto punto, más exitosas que los embudos en lo que se refiere a evitar el escape de las aves capturadas (D. Steed, comunicación personal). Las jaulas más grandes resultan más eficientes que las de menor tamaño (Hesteberg y otros, 1985). Es necesario tener en cuenta el ancho de la aberturas de la tela de gallinero utilizada en la fabricación de las trampas: una pequeña variación en su tamaño podría permitirle a las hembras, particularmente las de la subespecie más pequeña (M. a. obscurus), escapar.[16]
Cebo y señuelos[editar]

El alimento debe ser ubicado directamente debajo de la entrada de la jaula pero no en montones grandes que puedan resultar extraños al tordo cabecicafé. Las trampas deben contar con objetos sobre los que puedan posarse y agua, preferentemente en puntos desde los cuales la abertura de entrada a la jaula no sea directamente visible. El suelo debe estar libre de césped y hierbas en todo momento. Algunas trampas con el suelo raído en pastizales y terrenos agrícolas a menudo atraen y capturan tordos cabecicafé en ausencia de señuelos o incluso no habiendo un cebo adentro. Una variedad de granos y otras semillas —incluyendo trigo, mijo, maíz molido y girasol— pueden funcionar como cebo.[16]
Los señuelos deben ser una combinación de machos y hembras. La inclusión de al menos dos hembras señuelo entre los machos aumenta sustancialmente la captura de otras hembras. Las proporciones desbalanceadas en favor de las hembras entre las aves señuelo fueron las más eficientes para atrapar ejemplares de ese sexo. La captura de hembras optimizada por medio de las hembras señuelo compensa con creces los escapes ocasionales de hembras atrapadas que puedan parasitar nidos de especies sensibles. Al cortar las alas de las hembras señuelo, pueden minimizarse los escapes. Sin embargo, las aves con las alas cortadas no deben parecer heridas, puesto que esto podría afectar la captura de otros ejemplares.[16]
Otra consideración a tener en cuenta es el lapso de tiempo que las aves señuelo permanecen en la jaula. Las que son mantenidas durante más de dos semanas pueden alterar su comportamiento de tal manera que afectarían negativamente la captura de otros tordos cabecicafé. Esto sucede cuando los ejemplares en la trampa se muestran ansiosos por unirse a otros que se acerquen. Por esta razón, los señuelos deben ser marcados, removidos periódicamente y reemplazados con aves recientemente atrapadas.[16]
Ubicación y efectividad[editar]

El campo de acción de las trampas individuales en las áreas de reproducción no supera con frecuencia los 0,8 km a la redonda (Grzybowski, información no publicada). En Fort Hood (Texas), durante 1991, se colocaron 52 trampas para proteger una población de víreo gorra negra (Vireo atricapilla) distribuida en 152 territorios esparcidos (Hayden y Tazik, información no publicada). En las montañas Wichita (Oklahoma), nueve trampas fueron usadas para proteger aproximadamente 75 territorios del víreo (Grzybowski, información no publicada). A no ser que la población amenazada sea pequeña —y, por lo tanto, ya en serios problemas—, el uso de trampas debería ser extendido y en consecuencia costoso.[16]
La ubicación de las jaulas puede jugar un rol de importancia en la captura de tordos cabecicafé. Las trampas deben ser colocadas en espacios parcialmente abiertos, cerca de potenciales puntos de observación altos, pero no directamente debajo de ellos. Collins y otros (1989) indicaron que las trampas ubicadas en hábitats ribereños densos eran menos efectivas que las dejadas en áreas abiertas adyacentes a dichos hábitats. Como regla general, las jaulas deben colocarse de manera tal que un tordo cabecicafé descansando en el fondo de la misma no pueda divisar una rama u otro objeto en el que posarse a través de la abertura de entrada de la trampa.[16]
Los movimientos diarios del tordo cabecicafé podrían constituir una de las consideraciones más relevantes. Una buena estrategia de emplazamiento de las trampas consiste en ubicarlas entre los sitios de alimentación y las áreas que requieren protección del parasitismo. Muchos tordos cabecicafé en terrenos dominados por colinas optan por atravesarlas por medio de lechos secos de arroyos, bajos y pasos de montaña al trasladarse de las áreas matutinas de reproducción a las vespertinas de alimentación. Las jaulas ubicadas en la entrada de estas áreas o en los pasos pueden ser más efectivas en algunos lugares. En las montañas Wichita, por ejemplo, las trampas dejadas en medio de las áreas de cría del víreo gorra negra redujeron el parasitismo de un 70% a un 30%, duplicando o triplicando su éxito reproductivo. Sin embargo, cuando las trampas eran puestas en el perímetro de las áreas de nidificación del víreo, el parasitismo se reducía a menos del 20% y la fecundidad aumentaba entre seis y ocho veces (Grzybowski, 1990 a).[16]
Otra estrategia consiste en colocar las jaulas en las proximidades de las áreas de alimentación, especialmente en donde se concentran las reses. La tasa de captura de hembras al día por trampa al comienzo de su implementación era arrolladoramente superior cerca del ganado o de bisontes americanos (Bison bison) que lejos de esos animales (Grzybowski, 1990 a). Sin embargo, si el ganado se encuentra disperso, la efectividad de este método se ve comprometida (Rothstein y otros, 1987; Tazik y Cornelius, información no publicada).[16]
Una variable para este último enfoque incluye la rotación del ganado. En la Kerr Wildlife Management Area (Texas), las reses eran ubicadas en pasturas inmediatamente adyacentes a las áreas de cría del víreo gorra negra a comienzos de la temporada de nidificación. La tasa de captura de hembras de tordo cabecicafé aumentó dramáticamente en las trampas más cercanas al ganado, el nivel de parasitismo fue el más bajo registrado y el éxito reproductivo, el más alto documentado (Grzybowski, 1990 b).[16]
A menudo, la tasa de captura es elevada al principio de estos programas de control poblacional y desciende sustancialmente tras un período de captura inicial de entre dos y cuatro semanas. La mayor parte de los tordos cabecicafé son removidos en ese lapso inicial, aunque las jaulas dispuestas en las proximidades de los sitios de alimentación continúan atrapando tordos cabecicafé durante la mayor parte de la temporada.[16]
Disparos[editar]
Los disparos han sido implementados junto a las trampas en Fort Hood (Hayden y Tazik, información no publicada), pero los efectos específicos de los mismos no estaban aislados de los de la captura con jaulas. Alrededor de 247 hembras fueron aniquiladas de esta manera, algunas de las cuales probablemente habrían sido atrapadas de no haber recibido un disparo. No obstante, esta técnica puede ser utilizada para deshacerse de un número significativo de tordos cabecicafé y probablemente resulte útil y más efectiva en algunas áreas con grupos pequeños o esparcidos de ejemplares de especies amenazadas. Sin embargo, los tordos cabecicafé son sensibles a la actividad cerca de las trampas, incluyendo una prolongada presencia humana. Por esa razón, el empleo de armas como método de control poblacional no debería ser efectuado en los sitios en los que se han ubicado trampas.[16]
Control poblacional en sitios de descanso comunal invernal[editar]
Debido a que los tordos cabecicafé descansan en grandes grupos fuera de la temporada de reproducción, son potencialmente vulnerables a los esfuerzos a gran escala por controlar su número (Johnson y otros, 1980). Aparentemente, los programas previos de erradicación han surtido poco efecto sobre la población nacional de tordos cabecicafé, posiblemente a causa de que las aves que se concentran en los mismos puntos de descanso comunal proceden en realidad de muchas regiones distintas. En consecuencia, la efectividad del control poblacional en esos sitios de descanso es difusa, no protegiendo ninguna población amenazada en particular. Sin embargo, el control poblacional en los puntos de descanso comunal en invierno puede ser la manera más práctica de reducir su número en hábitats fragmentados en los que la captura con trampas a nivel local sea demasiado costosa.[16]
Control poblacional indirecto[editar]

Entre las soluciones alternativas, se destacan diferentes técnicas destinadas a una gestión del hábitat que dificulte el acceso a los nidos de los huéspedes,[16][23] restrinja la disponibilidad de alimento,[23] disminuya la cantidad de hábitats adecuados[16] y consecuentemente reduzca las poblaciones de tordos cabecicafé y las repercusiones de su peculiar estrategia reproductiva sobre las especies vulnerables.[16][23] La añadidura de huevos artificiales o infértiles también ha demostrado ser efectiva para disuadir el parasitismo.[35]
Gestión del hábitat[editar]
Robinson y otros (1995) sugieren, como estrategia regional a fin proteger las poblaciones de paseriformes migratorios en el Medio Oeste, preservar y restaurar los vastos segmentos de bosques que constituyan más probablemente fuentes de individuos que ayuden a estabilizar sus números en áreas seriamente afectadas por el parasitismo; asimismo, aconsejan minimizar sus hábitats de alimentación dentro de grandes extensiones ininterrumpidas.[70] Laymon (1987) recomendó evitar el pastoreo cerca de las áreas ribereñas, la eliminación de los feedlots, establos y tambos de las zonas críticas y la reforestación.[23]
Las poblaciones de tordos cabecicafé y las de muchos depredadores de nidos son mayores en áreas fragmentadas en donde se combinan hábitats de alimentación (agrícolas y suburbanos) y de reproducción (bosques y pastizales).[70] En áreas fragmentadas por los terrenos agrícolas, los niveles de depredación en los nidos y parasitismo de puesta son más tan elevados que el éxito reproductivo de muchas poblaciones locales de paseriformes del bosque resulta insuficiente para contrarrestar la mortalidad en individuos adultos.[70] A medida que los hábitats se ven crecientemente fragmentados, esta disfunción reproductiva puede causar decrecimientos regionales en las poblaciones de especies migratorias.[70] Robinson y otros (1993) sugirieron que una gestión del hábitat que reduzca tanto las poblaciones de tordos cabecicafé como las de los depredadores de nidos podría constituir la mejor solución a largo plazo para preservar las poblaciones de las especies migratorias neotropicales; la gestión del hábitat resulta efectiva a una escala mucho mayor que la captura con trampas.[16]
Reforestación de corredores ribereños[editar]
En teoría, las aves que anidan en los angostos corredores ribereños son más susceptibles al parasitismo de puesta que aquellas que nidifican en hábitats más amplios.[23] Esto se debe a que la vegetación de los mismos suele ser lineal, dejando poca superficie inaccesible para los tordos cabecicafé, contrario a lo que sucede con espesuras en forma de círculo o cuadrado.[4][71] Por esta razón, es posible que la tasa de parasitismo pueda reducirse al aumentar la anchura de dichos corredores a través de la reforestación.[23]
Laymon (1987) sugiere que la reforestación es el método más promisorio a largo plazo para controlar el parasitismo de puesta del tordo cabecicafé. Constituye una solución permanente al problema y no requiere mano de obra o financiamiento continuos. Asimismo, los programas de tales características benefician a todas las especies de aves en las comunidades ribereñas, no sólo a la que se pretenda proteger de manera particular del parasitismo de puesta.[23]
Preservación de hábitats y consideraciones asociadas[editar]
Debido a que los tordos cabecicafé se encuentran frecuentemente en terrenos agrícolas, asentamientos humanos y márgenes de hábitats, la mejor estrategia de gestión es preservar amplias áreas ininterrumpidas de un mismo hábitat. Desafortunadamente, las variaciones en el edge effect (“efecto de borde”) entre distintos lugares y la tendencia del tordo cabecicafé a trasladarse largas distancias en su búsqueda de nidos dificultan la tarea de determinar la superficie mínima de hábitat continuo necesaria para limitar el impacto de su parasitismo. Como regla general, sin embargo, los segmentos grandes son preferibles a los reducidos, las franjas ribereñas anchas son mejores que las estrechas y las formas compactas son menos propicias para el parasitismo que las complejas con mucho margen en comparación al área cubierta.[16]
También deben tenerse en cuenta las características de los alrededores del área gestionada. Los que ofrecen escasas oportunidades de alimentación bien podrían no tener problemas con el parasitismo incluso a lo largo de márgenes o pequeños claros. En cambio, si contienen abundantes hábitats alimenticios, las poblaciones de tordos cabecicafé pueden saturar los hábitats reproductivos sin importar su proximidad a los márgenes.[16]
Preservación de los bosques[editar]

Las estimaciones de la superficie mínima de bosque continuo que se requiere para mantener las poblaciones de las especies migratorias neotropicales varían según la región. Robbins y otros (1989) recomendaron la preservación de al menos 3 mil hectáreas contiguas a fin de proteger las poblaciones locales de paseriformes del bosque en los estados del Atlántico medio. La información sobre áreas moderadamente fragmentadas en el Medio Oeste sugiere que una superficie cubierta de entre 20 mil y 50 mil hectáreas podría ser necesaria ya que la abundancia de tordos cabecicafé en esa región es muy alta y las tasas de parasitismo continúan siendo elevadas incluso a dos kilómetros de los sitios de alimentación. El Biological Advisory Team (1990) del Plan de Conservación de Hábitat de Balcones Canyonlands (Texas) determinó la necesidad de establecer tramos de entre 2 mil y 5 mil hectáreas para minimizar los efectos del parasitismo y la depredación en los nidos del chipe mejillas doradas (Dendroica chrysoparia).[16]
Robinson y otros (1993) recomendaron que la compra de tierras se enfocara en la consolidación de la propiedad de los segmentos de hábitat más grandes dentro de una región y en la restauración de bosques para eliminar las áreas alimenticias de los tordos cabecicafé. También respaldan la compra de tierras y la restauración de los corredores ribereños para asegurar la existencia de hábitats lo suficientemente anchos para preservar las poblaciones del víreo de Bell (Vireo bellii) y el mosquerito saucero (Empidonax traillii). La consolidación de la propiedad de grandes segmentos es particularmente proclive a ser efectiva en hábitats moderadamente fragmentados, en donde las superficies cubiertas de mayor tamaño representarían fuentes potenciales de inmigrantes que recolonizarían los fragmentos más pequeños.[16]
Deben evitarse los proyectos de planificación suburbana y agrícola que impliquen el aislamiento de pequeñas porciones de bosque y favorezcan un incremento en el número de tordos cabecicafé. El planeamiento debe realizarse de manera tal que preserve los espacios boscosos con formas compactas en lugar de aquellos largos y angostos.[16]
Dentro de los segmentos más amplios de un hábitat, debe evitarse cualquier práctica que aumente las oportunidades alimentarias del tordo cabecicafé como cortar el césped a los costados de los caminos y en campings, colocar comederos para aves, construir corrales y utilizar el terreno como pasturas para los animales. Si esto no es viable o práctico, los potenciales sitios de alimentación deberían estar tan concentrados como fuera posible y sería aconsejable la implementación de programas de captura con trampas. Incluso si las tasas de parasitismo del tordo cabecicafé son bajas en estos segmentos grandes, la disminución del éxito reproductivo cerca de las áreas de alimentación podría reducir sustancialmente la disponibilidad de ejemplares de las especies migratorias neotropicales que recolonicen otros más pequeños.[16]
En lugares severamente fragmentados en donde la compra de tierras y la restauración del hábitat no son viables y/o prácticas, la captura en puntos estratégicos podría ser la única manera de preservar las poblaciones restantes de especies sensibles. Dicha captura, sin embargo, probablemente resulte costosa debido a la disponibilidad de tantos sitios de alimentación. En estos hábitats, cuando es implementada en las áreas de reproducción, la captura con trampas podría ser más efectiva que en las de alimentación.[16]
Implicaciones de la tala de árboles[editar]

En áreas boscosas aprovechadas en la industria maderera, los métodos de tala deben variar dependiendo de las características del hábitat. En extensas superficies arboladas, como la meseta de Ozark en Misuri, Thompson y otros (1992) descubrieron que los tordos cabecicafé preferían márgenes talados, pero en términos generales no eran más abundantes en presencia o ausencia de ellos. En estos lugares, la técnica de tala utilizada probablemente tenga un impacto menor en los niveles de parasitismo de puesta debido a que, de todas maneras, sus poblaciones están limitadas por la disponibilidad de los hábitats de alimentación. De manera similar, en bosques severamente fragmentados con abundantes hábitats de alimentación, los tordos cabecicafé podrían saturar el hábitat reproductivo sin importar el método de tala implementado.[16]
Sin embargo, probablemente éste no sea el caso en bosques moderadamente fragmentados, en donde la apertura de claros en el dosel arbóreo ofrece al tordo cabecicafé nuevas oportunidades de acercarse a los nidos hospedadores. La tala de superficies de entre 0,1 y 1 hectáreas tiene el potencial de incrementar la frecuencia parasítica debido a que aumenta el margen del hábitat. La información recopilada en un bosque fragmentado en el sur de Illinois (Robinson, información no publicada) mostraba tasas más altas de parasitismo en algunas especies, aunque no en todas, en porciones en las que se habían ido talando pequeños grupos de árboles durante los últimos cinco años.[16]
La franja de árboles que en ocasiones se tala a lo largo de los caminos debe ser tan angosta como sea posible y debe cubrirse con nueva vegetación para evitar el surgimiento de un hábitat propicio para la alimentación del tordo cabecicafé.[16]
Preservación de las praderas de pasto alto[editar]
De acuerdo con Robinson y otros (1993), deben preservarse y restaurarse amplias superficies contiguas de praderas de pasto alto. La compra de tierras tendría que enfocarse en minimizar la fragmentación y los hábitats alimentarios del tordo cabecicafé. Al igual que con los bosques, es importante evitar los proyectos de planificación suburbana y agrícola que impliquen el aislamiento de pequeñas porciones de pradera. De no ser esto posible, el planeamiento debe procurar la preservación de formas compactas. A no ser que constituyan un punto crítico de hábitat reproductivo para las especies vulnerables, es aconsejable que los árboles secos en pie y los corredores dentro de las praderas o adyacentes a ellas sean eliminados.[16]
Manejo de las actividades agrícola-ganaderas[editar]
Un uso menor o nulo de las praderas alpinas para la alimentación del ganado mejora el éxito reproductivo de las especies ribereñas sensibles, tales como el mosquerito saucero (Empidonax traillii).[23][72] La ausencia del ganado permitiría un mayor crecimiento en el césped, el cual alcanzaría una altura superior a la adecuada para los hábitos alimenticios del tordo cabecicafé.[23] A su vez, esto daría lugar a hábitats ribereños más densos en los que los nidos serían más difíciles de encontrar.[23] La reubicación de los feedlots, establos y tambos lejos de los bosques ribereños reduciría los hábitats de alimentación del parásito cercanos a las áreas de nidificación de las especies amenazadas.[23]
Robinson y otros (1993) sugieren que los feedlots sean diseñados de manera tal que el volumen de grano residual disminuya. La rotación del ganado reduce la superficie cubierta por césped corto, lo cual a su vez podría tener un efecto importante en el tamaño de las poblaciones locales de tordos cabecicafé. Debido a que una mayor disponibilidad de grano residual en invierno podría estar aumentando la tasa de supervivencia del parásito (Brittingham y Temple, 1983), métodos de cosecha más eficientes podrían reducir la cantidad de ejemplares. Sin embargo, una disponibilidad menor de esta fuente de alimento, también podría repercutir sobre las poblaciones de gansos y otras presas de caza, lo cual podría originar un conflicto.[16]
Añadidura de huevos artificiales o infértiles[editar]
Otra técnica destinada a reducir el parasitismo del tordo cabecicafé implica colocar huevos artificiales o infértiles dentro de los nidos (Ortega y otros, 1994). La añadidura de estos huevos en nidos de tordo sargento (Agelaius phoeniceus) disuadió el parasitismo en esos nidos. Por otro lado, la remoción de huevos depositados de manera natural puede ser inefectiva debido a que otras hembras creerían que los nidos no han sido parasitados y pondrían sus huevos en ellos.[35]
Notas y referencias[editar]
- ↑ BirdLife International (2012). «Molothrus ater». Lista Roja de especies amenazadas de la UICN 2015.2 (en inglés). ISSN 2307-8235. Consultado el 19 de julio de 2015.
- ↑ a b c d e f g h i j k l m n ñ o p «issg Database: Ecology of Molothrus ater» (en inglés). Archivado desde el original el 4 de marzo de 2016. Consultado el 12 de enero de 2011.
- ↑ a b c d «ITIS Standard Report Page: Molothrus ater» (en inglés). Consultado el 13 de enero de 2011.
- ↑ a b c d e f g h i j k l m n ñ o p q r s t u v w x y z aa ab ac ad ae af ag ah ai Sullivan, Janet (1995). «Index of Species Information: Molothrus ater» (en inglés). Departamento de Agricultura de los Estados Unidos, Servicio Forestal, Rocky Mountain Research Station, Fire Sciences Laboratory. Consultado el 14 de enero de 2011.
- ↑ American Ornithologists' Union (1983). Checklist of North American birds (en inglés) (Sexta edición). Lawrence (Kansas): Allen Press.
- ↑ a b c d e f g h i j k l m n ñ Lowther, Peter E. (1993). «Brown-headed Cowbird (Molothrus ater)». The Birds of North America (en inglés) (Ithaca (Nueva York): Cornell Lab of Ornithology) (47). Consultado el 22 de marzo de 2011.
- ↑ a b c d «Molothrus ater - Avibase». Consultado el 13 de enero de 2011.
- ↑ De Juana, E; Del Hoyo, J; Fernández-Cruz, M; Ferrer, X; Sáez-Royuela, R; Sargatal, J (2012). «Nombres en castellano de las aves del mundo recomendados por la Sociedad Española de Ornitología (Decimosexta parte: Orden Passeriformes, Familias Thraupidae a Icteridae)». Ardeola. Handbook of the Birds of the World (Madrid: SEO/BirdLife) 59 (1): 157-166. ISSN 0570-7358. Consultado el 4 de mayo de 2019.
- ↑ a b c d e f g h i j «Instituto Nacional de Ecología de México - Tordo negro (Molothrus ater)». Consultado el 10 de enero de 2011.
- ↑ a b c d e f g h i j k l m n ñ o p q r s t u v w «Brown-headed Cowbird». All About Birds (en inglés). Ithaca (Nueva York): Cornell Lab of Ornithology. 2009. Consultado el 11 de enero de 2011.
- ↑ «CONABIO - Tordo Cabeza Café». Archivado desde el original el 21 de julio de 2015. Consultado el 13 de enero de 2011.
- ↑ «Compañeros de viaje: Tordo cuco (Molothrus ater)». 18 de mayo de 2010. Consultado el 13 de enero de 2011.
- ↑ a b c d Bologna, Gianfranco (1981). Guías de la naturaleza: Aves. Barcelona: Grijalbo. ISBN 84-253-3362-8.
- ↑ Henninger, W. F. (1906). «A preliminary list of the birds of Seneca County, Ohio». Wilson Bulletin (en inglés) 18 (2): 47-60. Archivado desde el original el 6 de junio de 2011. Consultado el 13 de mayo de 2011.
- ↑ a b c d e f g h i j k l m n ñ o Roof, Jennifer (1999). «Animal Diversity Web: Molothrus ater, brown-headed cowbird» (en inglés). Consultado el 11 de enero de 2011.
- ↑ a b c d e f g h i j k l m n ñ o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an añ ao ap aq ar as at au av aw Robinson, Scott K.; Grzybowski, Joseph A.; Rothstein, Stephen I.; Brittingham, Margaret C.; Petit, Lisa J.; Thompson, Frank R. (1993). «Management implications of cowbird parasitism on neotropical migrant songbirds». Gen. Tech. Rep. RM-229. (en inglés) (Fort Collins (Colorado): Departamento de Agricultura de los Estados Unidos, Servicio Forestal, Rocky Mountain Forest and Range Experiment Station): 93-102. Consultado el 25 de marzo de 2011.
- ↑ a b «Michigan Department of Natural Resources and Environment - Brown-headed Cowbird (Molothrus ater)» (en inglés). Consultado el 15 de enero de 2011.
- ↑ a b c d Hilton Jr., Bill. «Hilton Pond - Brown-headed Cowbird (Molothrus ater): The "Black Vagabond"» (en inglés). Consultado el 15 de enero de 2011.
- ↑ a b c d e f g h i j k l m n ñ o p q r s t u v w x y z Bent, Arthur Cleveland (1958). «Brown-headed Cowbird, Molothrus ater [Eastern Brown-headed Cowbird]». Life Histories of North American Blackbirds, Orioles, Tanagers, and Allies (Life Histories of North American Birds) (en inglés). Instituto Smithsoniano, United States National Museum Bulletin 211. pp. 421-450. Consultado el 20 de febrero de 2011.
- ↑ a b c d e f g h i j k «Brown-Headed Cowbird (Molothrus ater)». National Geographic Complete Birds of North America (en inglés). National Geographic Society. 2006. Consultado el 19 de febrero de 2011.
- ↑ a b c d e f g h Fleischer, Robert C.; Rothstein, Stephen I. (Noviembre de 1988). «Known secondary contact and rapid gene flow among subspecies and dialects in the brown-headed cowbird». Evolution (en inglés) (Society for the Study of Evolution) 42 (6): 1146-1158. Consultado el 16 de marzo de 2011.
- ↑ a b c White, David J. «Social Influences on reproductive success in brown-headed cowbirds (Molothrus ater)» (en inglés). Filadelfia (Pensilvania): Universidad de Pensilvania. Consultado el 8 de febrero de 2011.
- ↑ a b c d e f g h i j k l m n ñ o p q r s Laymon, Stephen A. (1987). «Brown-headed cowbirds in California: historical perspectives and management opportunities in riparian habitats». Western Birds (en inglés) (Universidad de California, sede Berkeley) 18: 63-70. Consultado el 19 de marzo de 2011.
- ↑ a b c d e f g Petit, Lisa. «Brown-headed Cowbirds: From Buffalo Birds to Modern Scourge» (en inglés). Smithsonian Migratory Bird Center. Archivado desde el original el 12 de junio de 2010. Consultado el 6 de febrero de 2011.
- ↑ a b c d e «Wildlife in Connecticut – Brown-headed Cowbird (Molothrus ater)» (en inglés). Connecticut Department of Environmental Protection, Wlidlife Division. Archivado desde el original el 1 de septiembre de 2010. Consultado el 8 de febrero de 2011.
- ↑ «Birds in forested landscapes – Brood parasites: Brown-headed Cowbird» (en inglés). Ithaca (Nueva York): Cornell Lab of Ornithology. Archivado desde el original el 6 de septiembre de 2011. Consultado el 10 de febrero de 2011.
- ↑ «Bobolink» (en inglés). Ithaca (Nueva York): Cornell Lab of Ornithology. Consultado el 29 de diciembre de 2010.
- ↑ a b c d «Species factsheet: Brown-headed Cowbird (Molothrus ater)» (en inglés). BirdLife International. 2011. Archivado desde el original el 24 de mayo de 2015. Consultado el 15 de enero de 2011.
- ↑ a b c d e f g h i j k Autor y título no especificados (en inglés). Universidad de Columbia Británica. pp. 454-470. Archivado desde el original el 17 de diciembre de 2007. Consultado el 19 de febrero de 2011.
- ↑ a b c d e f Brittingham, Margaret Clark; Temple, Stanley A. (enero de 1983). «Have cowbirds caused forest songbirds to decline?». BioScience (en inglés) (American Institute of Biological Sciences) 33 (1): 31-35. Consultado el 6 de febrero de 2011.
- ↑ a b c d Rothstein, Stephen I. (1994). «The cowbird's invasion of the Far West: history, causes and consequences experienced by host species». Studies in Avian Biology (en inglés) (15): 301-315.
- ↑ a b c Verner, Jared; Ritter, Lyman V. (abril de 1983). «Current status of the brown-headed cowbird in the Sierra National Forest». The Auk (en inglés) (American Ornithologists' Union) 100 (2): 355-368.
- ↑ a b c d e f «Brown-headed Cowbird - BirdWeb» (en inglés). Seattle Audubon Society. Consultado el 7 de febrero de 2011.
- ↑ a b «eNature - Brown-headed Cowbird» (en inglés). Archivado desde el original el 2 de septiembre de 2010. Consultado el 13 de enero de 2011.
- ↑ a b c d e f g h i j k l m n ñ o p q r s t «Brown-headed Cowbirds in Grasslands: Their Habitats, Hosts, and Response to Management» (en inglés). Departamento de Interior de los Estados Unidos, Servicio Geológico, Northern Prairie Wildlife Research Center. 3 de agosto de 2006, fecha de última modificación cuando la página fue consultada. Archivado desde el original el 22 de junio de 2010. Consultado el 10 de febrero de 2011.
- ↑ Sibley, Charles G.; Monroe, Burt L., Jr. (1990). Distribution and taxonomy of the birds of the world (en inglés). New Haven (Connecticut): Yale University Press.
- ↑ «Birds of Nova Scotia – Brown-headed Cowbird» (en inglés). Nova Scotia Museum. 20 de febrero de 1998 (fecha de la última actualización cuando la página fue consultada). Archivado desde el original el 11 de junio de 2011. Consultado el 15 de marzo de 2011.
- ↑ DeGraaf, Richard M.; Scott, Virgil E.; Hamre, R. H.; y otros (1991). «Forest and rangeland birds of the United States: Natural history and habitat use». Agricultural Handbook (en inglés) (Washington, DC: Departamento de Agricultura de los Estados Unidos, Servicio Forestal) 688.
- ↑ Root, Terry L.; Weckstein, Jason D. (1994). «Changes in distribution patterns of select wintering North American birds form 1901 to 1989». Studies in Avian Biology (en inglés) (15): 191-201. Consultado el 19 de abril de 2011.
- ↑ a b Ehrlich, Paul R.; Dobkin, David S.; Wheye, Darryl (1998). Cowbirds (en inglés). Palo Alto (California): Universidad Stanford. Consultado el 9 de febrero de 2011.
- ↑ Stewart, Robert E.; Kantrud, Harold A. (octubre de 1972). «Population estimates of breeding birds in North Dakota». The Auk (en inglés) (American Ornithologists' Union) 89 (4): 766-788.
- ↑ Smith, Charles R.; Pence, Diane M.; O'Connor, Raymond J. (1993). «Status of neotropical migratory birds in the Northeast: a preliminary assessment». Gen. Tech. Rep. RM-229 (en inglés) (Fort Collins (Colorado): Departamento de Agricultura de los Estados Unidos, Servicio Forestal): 172-188. Archivado desde el original el 4 de mayo de 2017.
- ↑ Robbins, Chandler S.; Bystrak, Danny; Geissler, Paul H. (1986). «The breeding bird survey: its first fifteen years, 1965-1979». Resource Publication 157 (en inglés) (Washington, DC: Departamento del Interior de los Estados Unidos, Servicio de Pesca y Vida Silvestre): 196.
- ↑ Carter, Michael F.; Barker, Keith (1993). «An interactive database for setting conservation priorities for western neotropical migrants». Gen. Tech. Rep. RM-229 (en inglés) (Fort Collins (Colorado): Departamento de Agricultura de los Estados Unidos, Servicio Forestal, Rocky Mountain Forest and Range Experiment Station): 120-144.
- ↑ Sharp, Brian (1985). «Avifaunal changes in central Oregon since 1899». Western Birds (en inglés) 16: 63-70.
- ↑ Raphael, Martin G.; Morrison, Michael L.; Yoder-William, Michael P. (agosto de 1987). «Breeding bird populations during twenty-five years of postfire succession in the Sierra Nevada». The Condor (en inglés) (Cooper Ornithological Society) 89 (3): 614-626.
- ↑ Thompson, Frank R.; Lewid, Stephen J.; Green, Janet; Ewert, David (1993). «Status of neotropical migrant landbirds in the Midwest: identifying species of management concern». Gen. Tech. Rep. RM-229. (en inglés) (Fort Collins (Colorado): Departamento de Agricultura de los Estados Unidos, Servicio Forestal, Rocky Mountain Forest and Range Experiment Station): 145-158.
- ↑ Herkert, James R. (agosto de 1994). «The effects of habitat fragmentation on midwestern grassland bird communities». Ecological Applications (en inglés) (Ecological Society of America) 4 (3): 461-471. Consultado el 18 de marzo de 2011.
- ↑ a b c «Brown-headed Cowbird – Bird Conservation, Western Great Lakes Basin» (en inglés). Consultado el 10 de febrero de 2011.
- ↑ Dufty, A. M., Jr. (1982). «Movements and activities of radio-tracked Brown-headed Cowbirds». The Auk (en inglés) (Berkeley (California): Universidad de California) 99: 319-327.
- ↑ Brewer, R.; McPeek, G. A.; Adams, R. J., Jr. (1991). The atlas of breeding birds of Michigan (en inglés). East Lansing (Míchigan): Universidad Estatal de Míchigan.
- ↑ a b Rothstein, Stephen I.; Verner, Jared; Stevens, Ernest (febrero de 1984). «Radio-tracking confirms a unique diurnal pattern of spatial occurrence in the parasitic brown-headed cowbird». Ecology (en inglés) (Ecological Society of America) 65 (1): 77-88. Consultado el 18 de febrero de 2011.
- ↑ a b c d e f White, David J. (2001). «Facultative development of courtship and communication in juvenile male cowbirds (Molothrus ater)» (en inglés). Oxford Journals. Consultado el 17 de enero de 2011.
- ↑ a b c Stewart, Robert E.; Robbins, Chandler S. (1958). «Birds of Maryland and the District of Columbia». North American Fauna (en inglés) (Washington, DC: Departamento del Interior de los Estados Unidos, Servicio de Pesca y Vida Silvestre) (62): 401. (requiere registro).
- ↑ Micacchion, Mick; Townsend, T. W. (1983). «Botanical characteristics of autumnal blackbird roosts in central Ohio». OHIO J. SCI. (en inglés) (Ohio Academy of Sciences) 83 (3): 131-135. Consultado el 24 de marzo de 2011.
- ↑ «Tricolored Blackbird Portal» (en inglés). Universidad de California en Davis. Consultado el 21 de enero de 2011.
- ↑ a b c «Cultures, genes, and neurons in the development of song and singing in brown-headed cowbirds (Molothrus ater)» (en inglés). 31 de octubre de 2002. Consultado el 13 de enero de 2011. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ «Brown-Headed Cowbird – birdinginformation.com» (en inglés). Archivado desde el original el 14 de diciembre de 2012. Consultado el 8 de febrero de 2011.
- ↑ Nota: La fuente de información original (en inglés) habla de barngrass —también conocido como barnyard grass—, denominación que puede aplicarse tanto al género Echinochloa en su conjunto como exclusivamente a la especie Echinochloa crus-galli. Ante la ausencia de nombres científicos esclarecedores en el artículo original que disipen esa ambigüedad, se optó por interpretar aquella denominación como sinónima del género.
- ↑ Smith, Ronald A.; Hanebrink, Earl L. (1982). «Analysis of regurgitated short-eared owl (Asio flammeus) pellets from the Roth Prairie, Arkansas County, Arkansas». Arkansas Academy of Science Proceedings (en inglés) (Arkansas Academy of Science) 36: 106-108.
- ↑ Rodenhouse, Nicholas L.; Best, Louis B.; O'Connor, Raymond J.; Bollinger, Eric K. (1992). «Effects of temperate agriculture on neotropical migrant landbirds». Gen. Tech. Rep. RM-229 (en inglés) (Fort Collins (Colorado): Departamento de Agricultura de Estados Unidos, Servicio Forestal, Rocky Mountain Forest and Range Experiment Station): 280-295. Consultado el 4 de abril de 2011.
- ↑ Friedmann, Herbert; Kiff, Lloyd F.; Rothstein, Stephen I. (1977). «A further contribution to knowledge of the host relations of the parasitic cowbirds». Smithsonian Contributions to Zoology (en inglés) (Washington D.C.: Smithsonian Institution Press) 235: 5-10. Consultado el 26 de junio de 2011.
- ↑ Mayfield, Harold F. (1975). «The numbers of Kirtland's warblers». Jack-Pine Warbler (en inglés) 53 (2): 39-47.
- ↑ a b c Mayfield, Harold F. (junio de 1993). «Kirtland's warblers benefit from large forest tracts». Wilson Bulletin (en inglés) 105 (2): 351-353. Archivado desde el original el 14 de junio de 2011. Consultado el 24 de marzo de 2011.
- ↑ «Michigan Department of Natural Resources and Environment - Kirtland's Warbler (Dendroica kirtlandii)» (en inglés). Consultado el 24 de marzo de 2011.
- ↑ a b Franzreb, Kathleen E. (marzo de 1989). Ecology and conservation of the endangered least Bell's vireo (en inglés). Washington, DC: Servicio de Pesca y Vida Silvestre de los Estados Unidos. Archivado desde el original el 4 de marzo de 2016. Consultado el 18 de marzo de 2011.
- ↑ Olson, Thomas E.; Gray, M. Violet (1989). «Characteristics of least Bell's vireo nest sites along the Santa Ynez River». USDA Forest Service Gen. Tech. Rep. PSW-110 (en inglés) (Berkeley (California): Departamento de Agricultura de los Estados Unidos, Servicio Forestal, Pacific Southwest Forest and Range Experiment Station): 278-284. Consultado el 24 de marzo de 2011.
- ↑ Smith, James N. M.; Arcese, Peter (Noviembre de 1994). «Brown-headed cowbirds and an island population of song sparrows: a 16-year study». The Condor (en inglés) (Cooper Ornithological Society) 96: 916-934. Consultado el 15 de marzo de 2011.
- ↑ Departamento del Interior de los Estados Unidos, Servicio de Pesca y Vida Silvestre (1990). Title 50, Code of federal regulations, Part 10: General provisions. FWS/LE Reg. 10 (en inglés). Washington, DC.
- ↑ a b c d e f Robinson, Scott K.; Thompson III, Frank R.; Donovan, Therese M.; Whitehead, Donald R.; Faaborg, John (31 de marzo de 1995). «Regional forest fragmentation and the nesting success of migratory birds». Science (en inglés) (Asociación Estadounidense para el Avance de la Ciencia) 267: 1987-1990. Archivado desde el original el 5 de marzo de 2016. Consultado el 3 de abril de 2011.
- ↑ Faaborg, John; Brittingham, Margaret; Donovan, Therese; Blake, John (1993). Habitat fragmentation in the temperate zone: a perspective for managers (en inglés).
- ↑ Sanders, Susan D.; Flett, Mary Anne (1989). «Montane riparian habitat and willow flycatchers: threats to a sensitive environment and species». Gen. Tech. Rep. PSW-110 (en inglés) (Berkeley (California): Departamento de Agricultura de los Estados Unidos, Servicio Forestal, Pacific Southwest Forest and Range Experiment Station): 262-266.
Véase también[editar]
- Reproducción del tordo cabecicafé (Molothrus ater)
- Parasitismo de puesta del tordo cabecicafé (Molothrus ater)
Enlaces externos[editar]
 Wikimedia Commons alberga una categoría multimedia sobre Molothrus ater.
Wikimedia Commons alberga una categoría multimedia sobre Molothrus ater. Wikispecies tiene un artículo sobre Molothrus ater.
Wikispecies tiene un artículo sobre Molothrus ater.
