Síndrome del intestino irritable
| Síndrome del intestino irritable | ||
|---|---|---|
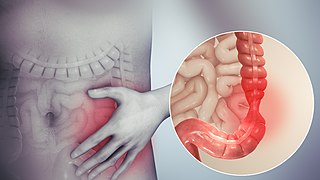 Está ilustración representa la manifestación física de lo que sucede en el intestino durante un brote de los síntomas del SII. | ||
| Especialidad | Gastroenterología | |
| Síntomas | Diarrea, estreñimiento, dolor abdominal | |
| Diagnóstico | Basado en síntomas, exclusión de otras enfermedades | |
| Tratamiento | Sintomático (cambios en la dieta, medicación, oligosacáridos de la leche humana, probióticos, asesoramiento) | |
| Pronóstico | Esperanza de vida normal | |
| Sinónimos | ||
| ||
El síndrome del intestino irritable (SII), antiguamente llamado colon espástico, colon nervioso o colon irritable,[1][2][3] es un grupo de síntomas digestivos, que incluyen dolor o molestias abdominales, acompañados de una modificación en la frecuencia o en la consistencia de las deposiciones, sin ninguna señal visible de daño o enfermedad en el tracto digestivo.[1] Estos síntomas ocurren durante mucho tiempo, a menudo años, y puede haber períodos de agudización o mejoría.[4] Es un trastorno digestivo funcional.[5][6][7][8][9] Se ha clasificado en cuatro tipos principales dependiendo de si el síntoma más común es la diarrea (SII-D), el estreñimiento (SII-E), o si ambos son frecuentes (SII-M), o ninguno de los dos ocurre muy a menudo (SII-NC).[1][10] Las terminologías que se han acuñado en el pasado para referirse a este síndrome y que aluden al colon están obsoletas y actualmente desaconsejadas, puesto que el trastorno no se limita a este tramo del tubo digestivo.[1][2][3]
Es una afectación muy frecuente, especialmente en personas jóvenes, constituyendo en la práctica clínica habitual uno de los principales motivos de consulta tanto en la atención primaria de salud como al especialista de gastroenterología.[9][11]
Actualmente se sabe que el SII no es un trastorno psiquiátrico ni psicológico.[7] Sin embargo, durante años solo se ha considerado como enfermo aquel paciente en el que se podía demostrar una causa orgánica de sus molestias, mientras que en el resto se aceptaba que presentaban "trastorno de somatización" o "hipocondría", y estas erróneas creencias continúan estando generalizadas en la actualidad. Los trastornos funcionales producen un gran deterioro de la calidad de vida e incomprensión, incluso superiores a los relacionados con dolencias orgánicas.[9] Se ha demostrado que tanto el estrés como los problemas psicológicos o psiquiátricos provocan malos hábitos alimenticios y esta mala nutrición causa diversos trastornos de salud, incluyendo problemas gastrointestinales, y empeora la salud mental, en una especie de círculo vicioso.[12]
Antes de instaurar un tratamiento, el paciente debe ser evaluado para excluir otros diagnósticos con síntomas similares a los del SII.[13] No obstante, a los médicos se les recomienda que minimicen el uso de pruebas médicas:[14] habitualmente diagnostican un SII empleando los criterios de Roma, que permiten dar el diagnóstico simplemente basándose en los síntomas digestivos sin la realización de ninguna prueba ni exploración complementaria,[10][9][13][15] por lo que suponen un abaratamiento de los costes, pero no tienen suficiente precisión.[13] Asimismo, cuando se realizan pruebas complementarias, los criterios propuestos para su elección dependen de los recursos disponibles.[7] Normalmente, los médicos interrogan minuciosamente al paciente para descartar síntomas de alarma que indiquen un posible cáncer digestivo, pero se olvidan de buscar los síntomas o signos no digestivos que son claves fundamentales para poder sospechar enfermedades orgánicas que pueden afectar a múltiples órganos, entre las cuales una de las más frecuentes es la enfermedad celíaca.[16] En más del 20 % de los casos transcurren diez años antes de que el médico sospeche su presencia y realice todas las pruebas necesarias para su diagnóstico.[16]
La complejidad y diversidad de la presentación del SII hacen que el tratamiento sea variado[13] y depende de los síntomas y de su gravedad.[10] Entre las medidas dietéticas, se aconseja una dieta sin gluten,[10][17] que es eficaz aproximadamente en la mitad de los pacientes,[18] y baja en FODMAP (hidratos de carbono fermentables).[10][17] La dieta sin gluten es una dieta segura y equilibrada, que no provoca ningún efecto secundario negativo.[19] Por el contrario, el seguimiento de una dieta baja en FODMAP, si bien ayuda a controlar los síntomas digestivos a corto plazo,[20][21][22][23] a largo plazo puede acarrear efectos negativos,[21][23][24][25] alterando desfavorablemente la flora intestinal[21][23][24][25] y la correcta ingesta de nutrientes.[21] Aunque los FODMAP pueden provocar ciertas molestias digestivas, como hinchazón abdominal, en realidad no solo no causan inflamación intestinal, sino que la evitan y ejercen propiedades anticancerígenas.[18][26][27] Para manejar el estreñimiento, se recomienda aumentar el consumo de fibra, que puede incluir la toma de suplementos de psyllium.[10] Fármacos como la loperamida y la colestiramina pueden ser útiles en el SII con predominio de diarrea, y laxantes tipo polietilenglicol y la linaclotida en el SII con predominio de estreñimiento.[10] Para el dolor, que suele ser difícil de controlar, se pueden emplear espasmolíticos del músculo liso.[10]
Muchas personas pasan años diagnosticadas por error como SII o no son nunca correctamente diagnosticadas ni tratadas, cuando en realidad padecen enfermedad celíaca o sensibilidad al gluten no celíaca (pruebas negativas de enfermedad celíaca, pero mejoría al eliminar el gluten).[18][28][29] Es difícil relacionar con el consumo de gluten la aparición de los diversos y variados síntomas digestivos y no digestivos, principalmente debido a que normalmente se consume gluten inadvertidamente en cualquiera de las comidas diarias aparentemente libres de gluten, bien como aditivo o bien por contaminaciones cruzadas,[29][30] y las reacciones pueden ser retardadas, horas, días o incluso semanas.[31] Especialmente en el caso de los síntomas de SII debidos a la sensibilidad al gluten no celíaca, los pacientes permanecen en una "tierra de nadie", sin ser reconocidos ni por los especialistas en trastornos funcionales ni por los especialistas en enfermedad celíaca.[29]
Clasificación
[editar]
Se han propuesto algunas escalas visuales descriptivas para la identificación del tipo de heces. La más ampliamente utilizada es la escala de Bristol, que incluye una clasificación dividida en siete patrones, con ilustraciones.[32]
Atendiendo a los síntomas, según los criterios de Roma IV, el síndrome del intestino irritable se clasifica en cuatro tipos: SII-E (con predominio de estreñimiento, heces tipo 1 o 2), SII-D (con predominio de diarrea, heces tipo 6 o 7), SII-M (con hábito intestinal mixto diarrea/estreñimiento) y SII-NC (sin clasificar, que no encaja en ninguno de los anteriores).[10] Los pacientes pasan de un subgrupo a otro con frecuencia.[7][6] Asimismo, se puede clasificar según predomine la disfunción intestinal, el dolor o la hinchazón.[7]
Otra clasificación posible es atendiendo a los factores precipitantes: post-infeccioso, inducido por alimentos o vinculado al estrés.[7]
Historia
[editar]
Históricamente, el síndrome del intestino irritable (SII) se reconoció hace más de 150 años, con la descripción en 1849 de Cumming: ”Los intestinos presentan una vez estreñimiento, otra diarrea, en la misma persona. No puedo explicar cómo la enfermedad tiene estos dos síntomas diferentes”.[13]
En el pasado se han empleado diversos términos para referirse a los síntomas del síndrome del intestino irritable, tales como colitis mucosa, colitis espástica, colon espástico, colon nervioso o colon irritable.[1][2][33] El término síndrome del colon irritable se atribuye a Walter C. Álvarez, quien completó su formación médica en la Universidad de Stanford en 1910.[34] Posteriormente, fue sustituido por síndrome del intestino irritable, puesto que los problemas no se limitan al colon.[34]
La comprensión del SII ha experimentado una rápida evolución con el progreso científico.[13] A lo largo del tiempo, se han propuesto diversos criterios para intentar evitar pruebas superfluas y poder establecer un diagnóstico positivo basado en los síntomas. Al tratarse de un trastorno funcional, se ha asumido que el paciente con SII no presenta ninguna alteración bioquímica o estructural que pueda justificar la naturaleza de los síntomas. Sin embargo, estos síntomas son compartidos por numerosas dolencias orgánicas, lo que explica la dificultad para establecer un consenso.[9]
En 1978, Manning formuló los primeros criterios basados en los síntomas.[9]
En 1992 se publicaron los criterios de Roma I, en 1999 los criterios de Roma II y en 2006 los criterios de Roma III, elaborados por comités de expertos que se reúnen periódicamente en Italia. Se ha fomentado la aplicación de estos criterios basados en los síntomas para el diagnóstico del SII y son utilizados por la mayoría de los clínicos desde hace años. Sin embargo, se desarrollaron en parte para la selección de pacientes para su inclusión en estudios de investigación (ensayos clínicos).[8][9][11] Según una revisión sistemática reciente (Dang et al., 2012), pocos estudios han validado los criterios de Roma I y Roma II, y ningún estudio ha validado los criterios de Roma III.[8]
En 2009, en una declaración de consenso de expertos en el tema, el Colegio Americano de Gastroenterología (ACG) estableció que ningún criterio basado en los síntomas tiene precisión ideal para diagnosticar el SII.[13]
Actualmente, todavía no se han desarrollado y validado criterios diagnósticos basados en los tipos de sintomatología que presentan los pacientes, puesto que la localización de causas orgánicas subyacentes podría perderse sin la realización de endoscopias.[8] Asimismo, hay pruebas de que ya no es apropiado ver el SII como un trastorno puramente funcional, sin ninguna causa orgánica asociada.[13][35]
Epidemiología
[editar]El síndrome del intestino irritable (SII) representa por sí solo, entre el 10 y el 15 % del motivo de todas las consultas en Atención Primaria y entre el 25 y el 30 % de los pacientes derivados a las consultas del gastroenterólogo.[9]
Afecta de manera desigual a un amplio porcentaje de la población. Las estimaciones sobre su incidencia son complicadas por diversos motivos, entre ellos los criterios empleados para el diagnóstico y la pequeña proporción de los pacientes afectados que busca ayuda médica.[9][8]
La frecuencia es entre un 10 a un 15 % de la población general de Europa Occidental y Norteamérica y entre un 5 y un 10 % de Asia. Se han llegado a alcanzar en algunas series cifras del 25 % de afectados en la población general. Las tasas más bajas reportadas han sido en países como Israel, Irán, India y China, con estimaciones que han llegado a ser tan bajas como el 1 % en este último.[8][36] En España, la prevalencia encontrada es del 7,8 % de la población general.[9]
Un aspecto llamativo es que la relación mujer/hombre registrada en el mundo occidental (2:1) no se ha constatado en los países asiáticos.[9]
El SII es más frecuente en edades más jóvenes, si bien se ha descrito un segundo pico de incidencia en edades más avanzadas.[9]
Es importante reseñar que todas estas cifras son el resultado de estudios en los que el diagnóstico se ha basado en los síntomas. Algunos autores han sugerido que cualquier estrategia basada en la búsqueda intencionada de un trastorno orgánico subyacente (“diagnóstico por exclusión”), reduciría con toda probabilidad estos valores, al conseguir identificar enfermedades con una base orgánica cuyos síntomas simulan a los del SII.[9]
Etiología
[editar]Tradicionalmente, el síndrome del intestino irritable (SII) ha sido catalogado como una enfermedad por hipersensibilidad visceral (que conduce a la aparición de malestar y/o dolor abdominal) y se acompaña de alteraciones motoras gastrointestinales (que conducen a la diarrea o estreñimiento). Los trastornos motores gastrointestinales identificados, incluyendo cambios en el tránsito intestinal, no explican por sí solos la combinación o alternancia de síntomas en el SII.[13]
El SII no es un trastorno psiquiátrico ni psicológico.[7] Algunos autores han sugerido que la hipersensibilidad visceral y las alteraciones motoras gastrointestinales son secundarias a trastornos psicológicos, sin darles una importancia primordial. Sin embargo, no todos los pacientes con SII tienen una superposición de trastornos psicológicos significativa y el sesgo de referencia se puede explicar en parte por las asociaciones psicológicas.[13] No se ha demostrado la existencia de factores psicológicos que provoquen el SII o que influyan en su instalación, si bien los factores psicológicos pueden contribuir al deterioro de la calidad de vida e incidir en la percepción de la severidad de los síntomas, por lo que es común que los pacientes con SII presenten afecciones psicológicas (ansiedad, depresión, miedos vinculados a los síntomas, etc.).[7]
Existen abundantes pruebas de que ya no resulta apropiado etiquetar al SII como un trastorno puramente funcional, sin ninguna causa orgánica asociada.[35] Cada vez hay más evidencias de que puede ser identificada alguna enfermedad orgánica del tracto gastrointestinal como causante de la aparición de la hipersensibilidad visceral y los trastornos de la motilidad gastrointestinal, en una parte de los pacientes que cumplen los criterios de Roma para el diagnóstico del SII.[13] Las evidencias incluyen la presencia de micro-inflamación intestinal,[35][13] alteración de la serotonina, trastornos del control central, sobrecrecimiento bacteriano intestinal, sensibilidad a ciertos alimentos, malabsorción de hidratos de carbono, reactividad post-infecciosa,[13] alteraciones en la micro flora intestinal,[35][13] aumento de la permeabilidad intestinal y citosinas proinflamatorias en la circulación sistémica, etc.[35] Se ha descrito asimismo, una posible asociación entre el SII y la diverticulosis del colon en las personas de edad avanzada. Aún está por definir el papel de las infecciones e infestaciones intestinales crónicas, como las que ocurren más comúnmente en climas tropicales, para generar una sintomatología similar al SII, al iniciar una inflamación crónica.[35]
Por otra parte, también parece probable que presente una participación genética el SII.[13] Diversos estudios sugieren la existencia de una prevalencia familiar aumentada. Los resultados de estos estudios sugieren que la contribución de la genética es razonablemente elevada, con evidencias a favor de una interacción entre factores hereditarios y ambientales en la patogénesis del SII. Una preocupación que añade incertidumbre en estos estudios, es la presencia de cualquier otra enfermedad de base genética que, al presentar síntomas gastrointestinales parecidos, pueda estar contribuyendo falsamente a la “agregabilidad familiar” observada en el SII. Tal es el caso de la enfermedad de Crohn, la enfermedad celíaca o la intolerancia a la lactosa o fructosa, que deben ser razonablemente excluidas.[9]
Genes que han sido implicados en el desarrollo del SII incluyen el HTR2A, HTR3E, la citosina IL10 o la IL6. Los genes IL-6, CDH1 y TLR9 pueden predisponer para el desarrollo del SII post-infeccioso. No obstante, la susceptibilidad genética sólo es un factor que contribuye al desarrollo del síndrome, pero es necesaria la participación de otros factores ambientales.[9]
La comprensión de la patogénesis del SII es importante, puesto que los nuevos fármacos actuales están empezando a centrarse en los mecanismos fisiopatológicos conocidos del SII.[13]
Cuadro clínico
[editar]El SII se trata, por lo general, de una afección crónica que acompaña al paciente a lo largo de toda su vida, unas veces con síntomas leves que no los motivan a acudir al médico y otras representan un importante trastorno en su vida diaria.[37][38]
Los síntomas principales son la presencia de dolor o malestar abdominal que se alivia con la defecación, acompañado de hinchazón abdominal fluctuante, junto con la combinación de alteraciones en el patrón de evacuación.[9]
Los pacientes suelen describir el dolor como de tipo cólico con “retortijones” y de forma característica se alivia, o al menos mejora, con la deposición y/o la expulsión de gases. Aunque se localiza más frecuentemente en la parte inferior del abdomen, también se puede presentar con localización difusa abdominal.[9]
Otros síntomas que lo constituyen son las alteraciones en el ritmo intestinal o con cambios en la forma y consistencia de las heces (diarrea, estreñimiento o combinación de ambos).[9]
Los pacientes en los que predomina la diarrea suelen presentar heces blandas, semilíquidas o acuosas, con una frecuencia de tres a seis deposiciones diarias, emitidas con carácter de urgencia. Con frecuencia, se manifiesta la necesidad de defecar al despertarse, después de cada ingesta de alimentos o ante situaciones de estrés, momentos en los que la actividad motora del colon es más intensa. No obstante, es excepcional que el enfermo se despierte por la noche con necesidad de evacuar.[9]
Los pacientes en los que predomina el estreñimiento suelen quejarse de un excesivo esfuerzo defecatorio, con frecuencia acompañado de una sensación “frustrante” o de evacuación incompleta. Síntomas tales como sensación de hinchazón, flatulencia o distensión abdominal, son más frecuentes en este subgrupo.[9]
Otros pacientes presentan un ritmo fluctuante en las características de sus deposiciones, en el que se alternan períodos de estreñimiento y diarrea. El moco en las heces es un componente frecuente, con independencia del patrón defecatorio que predomine.[9]
Estos tres patrones de comportamiento (diarreico, con estreñimiento o alternante) pueden no ser estables en el tiempo y tanto los pacientes con un patrón predominante de diarrea, como aquellos en los que predomina el estreñimiento, pueden abocar o cambiar durante su evolución a un ritmo alternante.[9]
Comorbilidad con otras enfermedades
[editar]El SII suele presentarse en forma concomitante a otras enfermedades con manifestaciones dolorosas tales como la fibromialgia, el síndrome de fatiga crónica, trastornos de la articulación temporomandibular, dolor pélvico crónico y dispepsia no ulcerosa. Estos pacientes tienden a tener un SII más severo.[7][13][35][9]
La coexistencia de manifestaciones extra-intestinales tales como dolores de cabeza, neblina mental, fibromialgia, fatiga crónica, ansiedad, depresión, etc., resulta de gran utilidad para realizar un correcto diagnóstico diferencial. Actualmente, la presencia de estos síntomas no digestivos es crecientemente reconocida como las señas de identidad de la existencia de una sensibilidad al gluten no celíaca subyacente.[39][40] Véase el apartado: Diagnóstico diferencial
Un análisis del genoma completo (en inglés, GWAS (Genome-wide association study) o WGAS (Whole genome association study) de 53.000 personas que padecían intestino irritable confirmaba la relación genética entre esta enfermedad y los trastornos del estado de animo y la ansiedad.[41]
Algunos de los loci confirmados para síndrome del intestinoirritable implican genes como NCAM1,CADM2, PHF2/FAM120A y DOCK9, que influyen en los trastornos de ánimo y ansiedad o que se expresan en el sistema nervioso.[41]
Los síntomas que no son compatibles con un síndrome del intestino irritable indican la posible presencia de una patología orgánica. Entre ellos se incluyen los siguientes:[6]
- Inicio de los síntomas en edad media de la vida o en personas mayores.
- Presencia de síntomas agudos, puesto que el síndrome del intestino irritable se define por la cronicidad.
- Síntomas progresivos.
- Síntomas nocturnos.
- Anorexia (falta de apetito) marcada.
- Fiebre.
- Sangrado rectal.
- Diarrea indolora.
- Esteatorrea.
- Intolerancia a la lactosa y/o fructosa.
- Intolerancia al gluten.
- Pérdida de peso llamativa, en corto período de tiempo.
Diagnóstico
[editar]Una historia médica completa, un examen físico y estudios de laboratorio específicos, pueden ayudar a establecer un diagnóstico de síndrome del intestino irritable en la mayoría de los pacientes.[6]
Actualmente, existe un debate abierto entre dos estrategias para llegar al diagnóstico positivo de SII: diagnóstico basado en síntomas compatibles y diagnóstico por exclusión de cualquier patología orgánica, que requiere la realización de pruebas complementarias.[9]
La Organización Mundial de Gastroenterología propone unos criterios según los recursos disponibles para el diagnóstico. De esta forma, cuando los recursos son bajos, se puede diagnosticar un SII simplemente tras la realización de un examen físico, la exclusión de síntomas de alarma de cáncer digestivo, un hemograma con velocidad de sedimentación, examen de materias fecales y la consideración de factores psicológicos. Por el contrario, cuando los recursos son altos, para el diagnóstico del SII se realiza un descarte minucioso de posibles causas orgánicas de los síntomas a través de la realización de una batería completa de pruebas, que incluyen, además de las anteriores, marcadores de inflamación en sangre y heces, pruebas de malabsorción de ácidos biliares, pruebas de función tiroidea, anticuerpos específicos de enfermedad celíaca y biopsias duodenales, colonoscopia con biopsias, y pruebas de intolerancia a la lactosa y de sobrecrecimiento bacteriano intestinal.[7]
En cualquier caso, es importante recoger una completa historia clínica del paciente, incluyendo:[9]
- Edad. La probabilidad de padecer una dolencia orgánica aumenta a partir de los 50 años, lo que puede justificar la necesidad de llevar a cabo exploraciones específicas para asegurar la ausencia de una patología potencialmente grave (ej.: cáncer de colon). Esta consideración es particularmente cierta cuando los síntomas son de reciente aparición.[9]
- Sexo. En las mujeres es más probable que la causa de los síntomas obedezca a un SII.[9]
- Antecedentes familiares de cáncer de colon, enfermedad inflamatoria intestinal (EII) o enfermedad celíaca. Cualquiera de estos antecedentes es considerado como un dato de "alarma".[9]
- Presencia de síntomas característicos del SII.[9] (Véase Cuadro clínico)
- Presencia de los denominados “síntomas y/o signos de alarma” que hacen sospechar una causa orgánica que incluyen principalmente:
- - Pérdida de peso importante, no explicable por otra causa (superior a 4,5 kg).[9]
- - Fiebre persistente (superior a los 37,5 °C).[9]
- - Comienzo de los síntomas a partir de los 50 años.[9]
- - Presencia de sangre en las heces.[9]
- - Anemia ferropénica.[6]
- - Diarrea con un volumen de heces superior a 300 cm³ por día.[9]
- - Diarrea de predominio nocturno.[9]
- - En caso de la diarrea: toma reciente de antibióticos, viajes recientes a una zona endémica de causas infecciosas de diarrea y los antecedentes familiares de celiaquía o EII.[9]
- - En caso de estreñimiento: antecedentes personales o familiares de cáncer colorrectal.[9]
- - Cualquier cambio en la naturaleza de los síntomas, especialmente si existen antecedentes familiares de cáncer de colon o de enfermedad inflamatoria intestinal, puesto que una patología orgánica puede aparecer en cualquier paciente con un SII previo.[9]
- - Síntomas extradigestivos relacionados con la enfermedad celíaca o la sensibilidad al gluten no celíaca. Normalmente, los médicos se olvidan de buscar los síntomas o signos no digestivos que son claves fundamentales para poder sospechar una enfermedad celíaca.[16] (Véase Diagnóstico diferencial)
- Exploración física, en busca de datos para establecer la sospecha de una dolencia orgánica, como pueden ser presencia de lesiones cutáneas, signos de artritis, bocio, linfadenopatías, palpación de una masa abdominal o disfunción del suelo pélvico mediante tacto rectal. Otros signos típicos del SII como la palpación de zona de hipersensibilidad en la fosa ilíaca izquierda son, sin embargo, muy inespecíficos.[9]
Criterios diagnósticos basados en síntomas
[editar]Basándose únicamente en la información recopilada mediante la historia clínica y el examen físico, sin necesidad de recurrir a otras pruebas y exámenes complementarios,[9] según los criterios de Roma (actualmente Roma IV), se puede realizar un diagnóstico de SII si se cumplen los siguientes criterios:[10][15]
- Instalación de los síntomas como mínimo 6 meses antes del diagnóstico.
- Dolor o molestia abdominal recurrente (que constituye el síntoma principal) al menos un día por semana, durante los últimos 3 meses, que debe estar asociado con dos o más de las siguientes características:
- Relacionado con la defecación.
- Cambio en la frecuencia de las deposiciones.
- Cambio en la forma (apariencia y/o consistencia) de las deposiciones.
Los criterios basados en síntomas fueron desarrollados por gastroenterólogos de hospitales secundarios y terciarios. Su utilización sin realización de exploraciones complementarias, supone un abaratamiento de los costes y permite establecer una homogeneidad en la selección de pacientes para su inclusión en ensayos clínicos, clasificándolos en función del patrón clínico dominante, pero su utilidad en la práctica clínica y su exactitud a la hora de excluir una dolencia orgánica continúa siendo especulativa.[9] En 2009, en una declaración de consenso de expertos en el tema, el Colegio Americano de Gastroenterología (ACG) estableció que ningún criterio basado en los síntomas tiene precisión ideal para diagnosticar el SII.[13]
Asimismo, en los últimos años han aparecido numerosos estudios que alertan sobre la existencia de dolencias orgánicas en pacientes previamente diagnosticados de un SII. Tal es el caso de entidades que pueden manifestarse con criterios de «aparente funcionalidad», como la colitis microscópica, el sobrecrecimiento bacteriano, la malabsorción de sales biliares, la enteropatía sensible al gluten y la insuficiencia exocrina del páncreas.[9]
Criterios diagnósticos por exclusión de patología orgánica
[editar]Para mantener un diagnóstico de SII, se debe descartar un conjunto de enfermedades que pueden ser tratadas de manera específica. Estas incluyen fundamentalmente las infecciones entéricas (infecciones que se desarrollan en el tracto intestinal), los trastornos hormonales, la enfermedad celíaca y el cáncer colorrectal. Las pruebas más empleadas son:[9]
Analítica elemental
[editar]- Hemograma completo con velocidad de sedimentación globular (VSG) para descartar la presencia de anemia, inflamación o infección.[6][9]
- Bioquímica completa,[9] que incluye la medición de los niveles sanguíneos de hierro, ferritina, calcio, proteínas totales, albúmina y colesterol, pruebas de función hepática y niveles de vitamina D.
- Niveles séricos de PCR (proteína C reactiva), para descartar la presencia de un proceso inflamatorio subyacente.[9][6]
- Anticuerpos de enfermedad celíaca.[6] Actualmente, la práctica habitual es descartar la enfermedad celíaca si estos anticuerpos son negativos, sin realizar las biopsias duodenales. Esta estrategia supone dejar sin diagnosticar una gran parte de los casos, puesto que estos anticuerpos son habitualmente negativos en los celíacos que presentan inflamación intestinal sin atrofia de las vellosidades.[16]
- Panel metabólico completo para evaluar trastornos metabólicos (por ejemplo, determinación de los niveles de TSH y hormonas tiroideas para evaluar un hiper o hipotiroidismo) y para descartar deshidratación y/o alteración de electrolitos, en pacientes con diarrea.[6]
Gastroscopia
[editar]La gastroscopia con toma de biopsias duodenales múltiple está indicada en pacientes con dispepsia persistente, si la pérdida de peso o los síntomas sugieren malabsorción, o si la enfermedad celíaca es una preocupación.[6] Actualmente, la mayor parte de las personas con enfermedad celíaca no presenta las características consideradas «clásicas» (diarrea y malabsorción).[42] Los síntomas digestivos pueden ser indistinguibles de los del SII, incluyendo el estreñimiento.[7][11] Muchos pacientes celíacos reciben un diagnóstico inicial de SII hasta el hallazgo de su enfermedad.[9]
Las recomendaciones de la American College of Gastroenterology Task Force para el SII establecen la indicación de realizar las biopsias de duodeno en los pacientes con anticuerpos de enfermedad celíaca positivos (anticuerpos antiendomisio o anti-transglutaminasa). Sin embargo, esta afirmación se basa en estudios en los que el diagnóstico de la enfermedad celíaca se fundamentó en el hallazgo de una atrofia severa de las vellosidades intestinales (Marsh 3c). Actualmente, sin embargo, es creciente el reconocimiento de formas de enfermedad celíaca con lesiones leves en la mucosa duodenal, sin atrofia de las vellosidades intestinales, en las que la serología es habitualmente negativa (títulos bajos de anticuerpos en sangre).[9]
Pruebas genéticas
[editar]Las pruebas genéticas (determinación de los genotipos DQ2–DQ8 del sistema HLA) pueden ayudar a realizar un correcto diagnóstico diferencial en pacientes de SII con anticuerpos de enfermedad celíaca negativos y hallazgos en las biopsias duodenales no concluyentes. Nuevamente, la historia clínica puede proporcionar información de gran valor en este punto, como puede ser cualquier antecedente familiar de enteropatía sensible al gluten (ESG), la coexistencia de otros trastornos autoinmunes (como diabetes tipo 1, Síndrome de Sjögren, hipotiroidismo, psoriasis, etc.) o antecedentes de retraso del crecimiento, infertilidad, osteoporosis o ferropenia de origen no aclarado.[9]
Colonoscopia
[editar]La American College of Gastroenterology IBS Task Force establece la recomendación de tomar biopsias del colon a diferentes niveles a los pacientes con SII mayores de 50 años y a pacientes de cualquier edad en quienes se indica una colonoscopia por sospecha de SII-D. El hallazgo de diferentes lesiones (divertículos, pólipos, angiodisplasias, hemorroides) permite establecer un diagnóstico que en algunos casos puede tener relevancia a largo plazo. Realizar biopsias escalonadas desde el recto hasta el colon ascendente, permite detectar casos de colitis microscópica (CM), una entidad englobada actualmente en el concepto de la enfermedad inflamatoria intestinal y potencialmente curable con un tratamiento específico. El íleon terminal debería ser incluido para valorar la presencia de una nueva entidad emergente: la ileítis colágena.[9]
Estudios de imagen
[editar]- Estudio con bario del tracto gastrointestinal superior, para la detección de tumores, inflamación, obstrucción y la enfermedad de Crohn.[6]
- Enema de bario con doble contraste, de utilidad para la detección de neoplasia colorrectal e inflamación.[6]
- Tomografía computorizada del abdomen, para la detección de tumores, obstrucción y enfermedad pancreática.[6]
Test respiratorios de malabsorción de carbohidratos
[editar]Con independencia de los trastornos motores, es probable que algunos pacientes con síntomas compatibles con el síndrome del intestino irritable presenten en realidad una dolencia orgánica que provoque un aumento de la producción de gas causada por:[9]
- Sobrecrecimiento de bacterias en el intestino delgado (SBID).
- Maldigestión de azúcares.
- Combinación de ambos.
La American College of Gastroenterology Task Force declara que no existen suficientes evidencias para recomendar de forma rutinaria la realización del test del aliento para la detección de sobrecrecimiento bacteriano en pacientes con SII.[9]
Algunos gastroenterólogos realizan pruebas del hidrógeno expirado,[6] ya que la maldigestión de lactosa y de fructosa son relativamente frecuentes entre los pacientes diagnosticados de SII (66 % y 33 %, respectivamente). Los pacientes que restringen estos carbohidratos en su dieta mejoran su sintomatología tras un año de seguimiento, incluso aquellos pacientes en los que el test del aliento resulta negativo o, alternativamente, son tratados con antibióticos o probióticos. Este hecho, junto con la pobre especificidad de las pruebas respiratorias, lleva a plantearse si realmente la realización de los test de aliento es una estrategia coste-efectiva o si resulta más racional y práctica la recomendación de reducir la ingesta de aquellos carbohidratos que el enfermo identifica como agentes que empeoran su sintomatología, o la administración de un régimen empírico de antibióticos.[9]
Pruebas en heces
[editar]Estudios microbiológicos a tener en cuenta en los exámenes de heces son los siguientes:[6]
- Huevos y parásitos, y obtención de muestras para el antígeno de Giardia lamblia.
- Patógenos entéricos.
- Leucocitos.
- Toxina del Clostridium difficile.
- Blastocystis hominis, el cual ha sido implicado en la patogénesis de algunos casos de SII, si bien el significado clínico de esta observación es incierto.[9]
La probabilidad de detectar entre los pacientes con síntomas de SII una infección gastrointestinal mediante un cultivo de las heces es muy baja (menor del 2 %). Por esta razón, la American College of Gastroenterology Task Force no recomienda el uso rutinario de los estudios de heces en ausencia de una historia de viajes a zonas endémicas de parasitosis o de síntomas de alarma (diarrea intensa e incontrolable, hematoquecia o pérdida de peso).[9]
La determinación de la lactoferrina, calprotectina y elastasa leucocitaria, orienta hacia el carácter inflamatorio de una diarrea. Una determinación negativa de calprotectina fecal no excluye con seguridad la presencia de una enfermedad inflamatoria intestinal, puesto que hasta un 11 % de estos pacientes puede dar un falso negativo.[9]
Biomarcadores y alergias alimentarias
[editar]Un biomarcador es un indicador de un estado fisiológico o patológico que puede ser medido y evaluado de manera objetiva. Principalmente, su utilidad radica en identificar el tratamiento más apropiado para un paciente concreto, en función del mecanismo fisiopatológico implicado en el origen de sus síntomas (alteración de la motilidad, hipersensibilidad visceral, respuesta anormal al estrés o inflamación).[9]
Por diversas cuestiones, esencialmente relacionadas con el coste económico, el carácter invasivo de algunas técnicas y la amplia variación los resultados, es difícil definir actualmente un biomarcador que reúna todas las condiciones exigibles para su generalización en la práctica clínica. Asimismo, muchas de las alteraciones fisiopatológicas descritas para el SII no se cumplen en una proporción muy importante de pacientes.[9]
El panel serológico Prometeus combina una batería de test, entre los cuales figuran los anticuerpos anti-transglutaminasa de la enfermedad celíaca, los anticitoplasma de los neutrófilos (p-ANCA) y los anti Saccharomyces, presentes en la enfermedad inflamatoria intestinal, y otros dirigidos contra el TNF-α, la interleucina-1b o la flagelina bacteriana, los cuales sugieren un estado de infección previa o de inflamación activa.[9]
Otros biomarcadores propuestos incluyen los que evalúan alergias alimentarias, que pueden provocar algunos síntomas similares a los del SII, si bien los pacientes con una verdadera alergia alimentaria suelen presentar urticaria.[9]
Solo un 3,6 % de los pacientes con SII presentan datos objetivos de alergia alimentaria. Un estudio demostró que en el SII podían detectarse títulos de IgG significativamente más elevados contra el trigo, la carne de ternera, el cerdo y el cordero, en comparación con los controles, hallazgos que no fueron reproducidos en otro estudio, salvo para el caso del trigo.[9]
En un estudio, la presencia de una prueba cutánea positiva para ciertos alimentos (skin prick test) incrementó las posibilidades de respuesta al cromoglicato disódico, pero estos resultados no se han reproducido y no hay claras evidencias de que el skin prick test aporte un valor añadido en la evaluación de un paciente con SII.[9]
Por último, algunos estudios sugieren que el estudio de algunos polimorfismos de enzimas que intervienen en el metabolismo de fármacos o de los genes transportadores de serotonina, podrían ser útiles para predecir la respuesta al tratamiento con antagonistas de los receptores HT (como el alosetrón) o los agonistas HT (como el tegaserod).[9]
Diagnóstico diferencial
[editar]El diagnóstico diferencial del síndrome del intestino irritable incluye, principalmente:
- Síndromes de malabsorción/maldigestión, como la enfermedad celíaca, la sensibilidad al gluten no celíaca, intolerancias alimentarias (intolerancia a la lactosa, fructosa o sorbitol), malabsorción de sales biliares, insuficiencia pancreática exocrina y sobrecrecimiento bacteriano intestinal.[9]
- Muchos pacientes, encuadrados y tratados durante años como síndrome del intestino irritable (SII), pueden tener en realidad enfermedad celíaca o sensibilidad al gluten no celíaca.[28][43] Normalmente, los médicos interrogan minuciosamente al paciente para descartar síntomas de alarma que indiquen un posible cáncer digestivo, pero se olvidan de buscar los síntomas o signos no digestivos que son claves fundamentales para poder sospechar una enfermedad celíaca.[16] Esta es una de las enfermedades sistémicas (que puede afectar a múltiples órganos) más frecuentes.[16] Los síntomas gastrointestinales del SII son clínicamente indistinguibles de los que pueden aparecer en la enfermedad celíaca o la sensibilidad al gluten no celíaca,[28] pero la presencia de cualquiera de las siguientes manifestaciones no intestinales sugiere la existencia de una posible relación con los trastornos relacionados con el gluten: dolor de cabeza o migraña, neblina mental, fatiga crónica,[40] fibromialgia,[44][45][46] dolor de articulaciones o muscular, entumecimiento de piernas o brazos,[40][44][47] hormigueos en las extremidades,[40][47] retraso del crecimiento, osteoporosis, aftas orales,[16] dermatitis (eccema o rash cutáneo),[40][47] trastornos atópicos,[40] alergia a uno o más inhalantes, alimentos o metales[40][44] (tales como ácaros del polvo, gramíneas, parietaria, pelo de perros o gatos, mariscos o níquel[44]), depresión,[40][44][47] ansiedad,[44] anemia,[40][47] ferropenia, deficiencia de ácido fólico, asma, rinitis, trastornos de la alimentación,[44] infertilidad,[16] trastornos neurológicos (tales como la esquizofrenia,[47][48] el autismo,[44][47][48] la neuropatía periférica,[47][48] la ataxia,[48] el trastorno por déficit de atención con hiperactividad [TDAH],[40] —véase Trastornos neurológicos relacionados con el gluten—) o enfermedades autoinmunes.[40] Una mejoría con la dieta libre de gluten de los síntomas relacionados con alteraciones inmunológicas, incluyendo enfermedades autoinmunes, una vez excluidas razonablemente la enfermedad celíaca y la alergia al trigo, es otra manera de realizar un diagnóstico diferencial entre el SII y la sensibilidad al gluten no celíaca.[40] No obstante, algunos autores concluyen que la presencia de enfermedades autoinmunes en pacientes con diagnóstico o sospecha de sensibilidad al gluten no celíaca, sugiere la existencia de una enfermedad celíaca no reconocida ni diagnosticada.[49] Las enfermedades autoinmunes típicamente asociadas a la enfermedad celíaca incluyen la diabetes mellitus tipo 1, las tiroiditis (hipo- e hipertiroidismo),[50][51] la ataxia por gluten, la psoriasis, el vitiligo, la hepatitis autoinmune, la dermatitis herpetiforme, la colangitis esclerosante primaria y otras.[50]
- Enfermedad inflamatoria intestinal, como la colitis ulcerosa, la enfermedad de Crohn y la colitis microscópica (linfocítica o colágena).[9]
- Enfermedades metabólicas, como la diabetes mellitus, el hipertiroidismo o el hipotiroidismo.[9]
- Efectos secundarios causados por medicaciones, como fármacos que producen diarrea (por ejemplo: laxantes que contienen magnesio, antiácidos, colchicina) o fármacos que inducen estreñimiento (por ejemplo: opiáceos para el control del dolor, sales de aluminio).[9]
- Infecciones gastrointestinales, como la giardiasis, la amebiasis y la infección por Yersinia enterocolítica.[9]
- Neuropatía o miopatía intestinal.[9]
- Malignidad: cáncer de páncreas y cáncer colorrectal.[9]
- Tumores neuroendocrinos, como VIPoma, gastrinoma, cáncer medular tiroideo o tumor carcinoide.[9]
Tratamiento
[editar]Medidas generales
[editar]El primer paso y más importante, es asegurarse de que los síntomas no obedecen en realidad a una dolencia orgánica, que se pueda confundir con un trastorno funcional, para evitar consultas, exámenes o terapias psicológicas innecesarias y el consumo desorbitado de fármacos, que pueden presentar efectos secundarios adversos.[9]
El objetivo del tratamiento es aliviar los síntomas.[52] No existe un único tratamiento común a todos los pacientes.[7] Una vez descartada una dolencia orgánica, el tratamiento varía según diversos factores: el tipo de síntoma predominante, la frecuencia e intensidad de los síntomas, la preocupación que provocan, la repercusión sobre la calidad de vida y la posible existencia de trastornos psicológicos asociados.[9]
En algunos pacientes son beneficiosas medidas sencillas, tales como consejos dietéticos o cambios en el estilo de vida.[7] Otros pacientes necesitan tratamiento farmacológico, para aliviar la intensidad de los síntomas durante los períodos de agudización. Finalmente, unos pocos pacientes requieren un tratamiento psiquiátrico.[9]
Para el control del dolor, se pueden emplear los antiespasmódicos, analgésicos generales del tipo del paracetamol, los antidepresivos tricíclicos y los inhibidores de la recaptación de la serotonina, y probióticos.[7]
Para el manejo del estreñimiento, puede ser útil una dieta rica en fibras y un formador de volumen (ejemplo, el plantago ovata) combinado con una ingesta suficiente de líquidos, si bien en algunos pacientes puede haber un agravamiento de la hinchazón y la distensión abdominal. Otras recomendaciones pueden ser los laxantes osmóticos, como la lactulosa.[6][7]
Para el control de la diarrea, son útiles la loperamida y el alosetrón, este último indicado sólo en mujeres con síntomas severos que no responden a otros tratamientos antidiarreicos.[7]
La hinchazón y la distensión abdominal pueden aliviarse mediante dietas que producen menos gas, probióticos o tratamiento antibiótico con rifaximina. No existen evidencias a favor del uso en el tratamiento del SII de productos que contienen carbón activado, «antiflatulentos», tipo simeticona y otras sustancias similares.[7]
Relación médico-paciente
[editar]Es importante la existencia de una relación positiva entre el médico y el paciente, aceptando las molestias y los síntomas como reales.[9][6][7]
Dieta
[editar]

Durante mucho tiempo, la ingestión de alimentos ha sido vinculada con los síntomas intestinales. Actualmente, hay un creciente interés en el uso de la dieta para el tratamiento de pacientes con SII por medio de dietas restrictivas especializadas, tales como las que se dirigen a varios grupos de alimentos, suprimir el gluten o reducir la ingesta de FODMAP (acrónimo que deriva del inglés Fermentable Oligosaccharides, Disaccharides, Monosaccharide And Polyols: Oligosacáridos, Disacáridos, Monosacáridos y Polioles Fermentables).[10][17][55]
Puede resultar útil realizar un diario de síntomas, para identificar el tipo de alimentos que puedan estar influyendo negativamente. Las intervenciones en la dieta pueden resultar clave, cuando el origen de los síntomas guarda relación con la presencia de una intolerancia a la lactosa o la fructosa, o con la sensibilidad al gluten no celíaca.[9][6] No obstante, en el caso del gluten, con frecuencia el paciente no es capaz de relacionarlo con sus trastornos, debido a que existen diversos factores de confusión y fuentes de gluten insospechadas. Habitualmente, estamos comiendo gluten inadvertidamente en cualquiera de las comidas diarias aparentemente libres de gluten, como aditivo, como contaminaciones cruzadas o incluso como adulteración,[29][30] y las reacciones pueden ser retardadas horas, días o incluso semanas.[31][56] A esto se suma que el gluten ejerce un efecto opioide sobre el tubo digestivo, que puede adormecer sus reacciones naturales,[57][58] y puede ocurrir que se noten las intolerancias a otros alimentos (la más típica a la lactosa), pero pasen inadvertidas las reacciones al ingerir el gluten. Otras fuentes no sospechadas de gluten son medicamentos recetados y de venta libre, suplementos vitamínicos y minerales, productos a base de plantas medicinales y suplementos dietéticos.[59] Asimismo, ciertos productos de uso habitual pueden ser la causa de ingestiones inadvertidas de gluten, pues pueden llegar a la boca directamente, o indirectamente por los restos que quedan en las manos al manipularlos.[59] Entre ellos se incluyen productos farmacéuticos (gargarismos, colutorios, vendas adhesivas, esparadrapos y tiras adhesivas sanitarias), todo tipo de productos cosméticos y de cuidado personal (barras de labios, bálsamos y brillos labiales, pasta de dientes, enjuagues bucales, productos para el cuidado de la piel y el cabello, etc.), piensos y alimentos para animales de granja y mascotas, champús para perros, pasta de modelar para niños (como Play-Doh), entre otros.[59][60][61][62]
Ciertos alimentos favorecen la producción de gas, tales como legumbres,[6] cebollas, apio, zanahorias, pasas, plátanos, albaricoques, ciruelas, coles de Bruselas, galletas y panecillos.[9]
Los suplementos de fibra soluble (como ispaghula o psillium) pueden ser beneficiosos en algunos pacientes con predominio de estreñimiento (SII-E), comenzando con dosis bajas, que se pueden ir incrementando a lo largo de varias semanas, hasta un máximo de 20-30 g de fibra al día. Un uso excesivo de la fibra puede empeorar algunos de los síntomas del SII, como la flatulencia.[9]
Evitar la cafeína puede limitar la ansiedad y la exacerbación de los síntomas.[6]
Dieta sin gluten
[editar]
Evidencias actuales apoyan el empleo de la dieta sin gluten en personas con el síndrome del intestino irritable,[10][17] que es eficaz aproximadamente en la mitad de los casos.[18] Esto indica la existencia de una sensibilidad al gluten no celíaca subyacente en estas personas.[18]
Es una dieta segura, que no provoca ningún efecto secundario negativo, y normalmente es equilibrada.[19] Consiste en eliminar de forma estricta de la alimentación todos los productos que contengan o se cocinen con trigo, centeno, cebada y avena, o cualquiera de sus variedades e híbridos (espelta, escanda, kamut, triticale...), y productos derivados, evitando contaminaciones inadvertidas y todo tipo de transgresiones dietéticas.[65][66][67] El gluten no es indispensable para el ser humano. Se trata de una mezcla de proteínas de bajo valor nutricional y biológico, deficiente en aminoácidos esenciales, por lo que desde el punto de vista de la nutrición su exclusión de la alimentación no representa ningún problema.[68]
Controversias sobre la dieta baja en FODMAP
[editar]Aunque los FODMAP pueden provocar ciertas molestias digestivas, como hinchazón abdominal, en realidad no solo no causan inflamación intestinal, sino que la evitan.[18] Asimismo, producen alteraciones beneficiosas en la flora intestinal y generan ácidos grasos de cadena corta,[18] los cuales son particularmente importantes para mantener la buena salud del colon y tienen propiedades anticancerígenas y antiinflamatorias.[26][27]
Varios estudios concluyen que restringir estos FODMAP de la dieta ayuda a controlar los síntomas digestivos a corto plazo en personas con el síndrome del intestino irritable y otros desórdenes gastrointestinales funcionales.[20][69][21][22][23] No obstante, esta dieta puede alterar negativamente la flora intestinal[21][23][24][25] y la correcta ingesta de nutrientes,[21] por lo que su seguimiento a largo plazo puede acarrear efectos negativos.[24][25] Son precisos más estudios para evaluar el verdadero impacto de estas dietas sobre la salud.[21][23]
Estilo de vida
[editar]Algunos hábitos saludables pueden ser beneficiosos, como el ejercicio físico regular o, en los casos de estreñimiento, dedicar un tiempo por las mañanas para realizar la evacuación después del desayuno (momento en el que el reflejo gastroentérico es más intenso).[9]
Terapias dirigidas a la microbiota e inflamación
[editar]Las nuevas hipótesis de que las alteraciones en la microbiota intestinal y/o inflamaciones leves pueden provocar los síntomas del SII en determinados grupos de pacientes, han conducido al desarrollo de nuevas estrategias de tratamiento, incluyendo antibióticos, prebióticos, probióticos, simbióticos y fármacos con propiedades antiinflamatorias.[9]
Probióticos
[editar]Los probióticos son organismos vivos que ingeridos en cantidades apropiadas, ejercen un efecto beneficioso sobre la salud. Los que se emplean más comúnmente son bacterias productoras de ácido láctico y levaduras no patógenas.[9]
Los probióticos se han propuesto para el tratamiento de la enfermedad inflamatoria intestinal, trastornos alérgicos, enfermedades infecciosas y neoplásicas. El reconocimiento de que el SII puede ser provocados por una gastroenteritis infecciosa, la observación de importantes alteraciones en la microbiota intestinal de pacientes con SII y evidencias crecientes a favor de una disfunción inmune, han propiciado el uso de probióticos también para el tratamiento del SII.[9][7]
Además de sus efectos antivíricos y antibacterianos (en el caso del SII post-infeccioso), sus beneficios potenciales se deben a su capacidad para disminuir la producción de gas, promover cambios en la conjugación de las sales biliares y sus propiedades estimulantes de la motilidad, de la secreción de moco e incluso antiinflamatorias.[9]
El Lactobacilus GG, L. plantarum, L. acidophilus, L. casei, así como el cóctel VSL-3 y Bifidobacterium animalis, proporcionan alivio de algunos síntomas aislados del SII como la hinchazón, la flatulencia y el estreñimiento. Sin embargo, pocos productos han demostrado ser capaces de proporcionar un alivio sintomático global, especialmente del dolor abdominal. Entre ellos, destacan los ensayos realizados con Bifidobacterium infantis.[9][7]
Prebióticos y simbióticos
[editar]Un prebiótico es un alimento no digerible que al ser fermentado, estimula de forma selectiva el crecimiento y la actividad de un número limitado de especies bacterianas del colon (principalmente lactobacilos y bifidobacterias), que ejercen un efecto beneficioso sobre la salud. Los oligosacáridos contenidos en la leche materna representan el prototipo de sustancias con propiedades prebióticas, lo cual explica en gran medida los enormes beneficios de la lactancia materna.[9]
Algunos prebióticos, como los oligosacáridos y los fructanos del tipo inulina, abundan en frutas y vegetales comestibles tales como cebolla, achicoria, ajo, puerros, alcachofas, plátanos y trigo. Los suplementos de fibra, la lactulosa y las soluciones de polietilenglicol poseen propiedades prebióticas.[9]
Los simbióticos son una combinación de un probiótico y un prebiótico. Aumentan la sobrevida y la actividad de los prebióticos in vivo, a la vez que estimulan la producción por parte del organismo de bifidobacterias y lactobacilus. Datos preliminares sugieren su potencial y prometedor efecto beneficioso en el SII.[9]
Adsorbentes intestinales
[editar]El polihidrato de polimetilsiloxano es bueno para el manejo de la diarrea del SII, sobre todo cuando los pacientes no responden a otros tratamientos; no solo mejora la consistencia de las evacuaciones, sino también otros síntomas como el dolor abdominal, la distensión subjetiva y el estado general.[70]Es un compuesto organosiliconado que conforma un hidrogel poroso amorfo, insoluble en agua, cuyos poros tienen un diámetro de 2 a 100 nm, que crea un área que recubre la superficie con capacidad adsorbente de moléculas de peso molecular elevado[71]. El perfil adsorbente que posee le confiere una característica particular, y es que permite el paso de moléculas de bajo peso molecular, como son los medicamentos. En otras palabras, no impide la absorción de otros agentes terapéuticos. Este dispositivo médico es uno de los pocos que tiene evidencia clínica en los trastornos de la interacción intestino-cerebro, ya que ha sido estudiado en la diarrea crónica de pacientes con SII-D[72].
Antibióticos
[editar]La posibilidad de la existencia de un sobrecrecimiento bacteriano intestinal (SIB) como causante de los síntomas del SII, ha llevado a ensayar el empleo de antibióticos poco absorbibles para su tratamiento. Algunos estudios han demostrado que la rifaximina mejora los síntomas globales y la hinchazón en los pacientes con SII con predominio de diarrea (SII-D).[9][7]
Es probable que el beneficio de los antibióticos no absorbibles resida además en su efecto sobre la reducción de las bacterias colónicas con capacidad para fermentar carbohidratos. La prevalencia de intolerancia a carbohidratos (lactosa, fructosa) es elevada, tanto en población general, como en sujetos con SII.[9]
Un inconveniente de la terapia con antibióticos es la duración limitada de sus efectos, que obliga en muchos casos a realizar ciclos de tratamiento repetidos, cuya seguridad a largo plazo no ha sido bien estudiada.[9]
Antiinflamatorios
[editar]En la actualidad, existen diferentes teorías que apuntan a la existencia de una inflamación de bajo grado, como causante de los síntomas del SII, si bien las evidencias sobre el beneficio del tratamiento con agentes antiinflamatorios son escasas.[9]
Se han estudiado algunos fármacos antiinflamatorios para el tratamiento del SII. La mesalazina produce un descenso significativo de las células inmunes de la mucosa intestinal y mejora el bienestar global, si bien no modifica de forma significativa el dolor, la hinchazón o el hábito intestinal. El ketotifeno ha demostrado un beneficio en la reducción de los síntomas y de la hipersensibilidad visceral. Unos pocos estudios obtuvieron resultados favorables con el empleo del cromoglicato disódico, especialmente en pacientes que relacionan sus síntomas con la ingesta de ciertos tipos de alimentos.[9]
Tratamiento farmacológico
[editar]Antidiarreicos
[editar]Los pacientes con un SII-D (diarrea predominante) pueden beneficiarse del empleo de antidiarreicos tales como loperamida[7] o el difenoxilato, especialmente durante los períodos de intensificación de los síntomas. Loperamida a dosis comprendidas entre 2-8 mg/24 horas consigue mejorar la consistencia y frecuencia de las deposiciones, aunque no resulta eficaz para el control del dolor y los síntomas globales de la enfermedad.[9]
Antiespasmódicos
[editar]El músculo liso interviene en la patogénesis de los síntomas del SII. Los fármacos con propiedades relajantes del músculo liso pueden aliviar el dolor espasmódico de tipo cólico, que caracteriza a la enfermedad. No obstante, pueden provocar la aparición de efectos secundarios adversos, debido a sus propiedades anticolinérgicas, tales como sequedad de boca, visión borrosa, vértigos, retención urinaria, confusión mental (especialmente en ancianos) y estreñimiento.[9]
Ejemplos de antiespasmódicos empleados para el tratamiento del SII son la mebeverina y el octilonio bromuro.[9]
Serotoninérgicos
[editar]La serotonina (5-HT) es un neurotransmisor que se sintetiza y almacena en el intestino (95 % del contenido corporal total de 5-HT) y tiene importantes funciones reguladoras de las funciones secretora, absortiva, motora y sensorial intestinal. Observaciones recientes han identificado una actividad serotoninérgica anómala en el SII, con un incremento en el SII-D y un descenso en el SII-E. Los antagonistas de los receptores 5-HT3, provocan un enlentecimiento del tránsito y de la secreción intestinal, y disminuyen el tono y tránsito cólicos. En contraste, los agonistas de los receptores HT4 aceleran el vaciamiento gástrico, incrementan el tránsito del intestino delgado y del colon y posiblemente disminuyen la sensibilidad visceral.[9]
El alosetrón es el único antagonista de los receptores HT3 aprobado por la US Food and Drug Administration (FDA) para el tratamiento del síndrome del intestino irritable con predominio de diarrea (SII-D).[7] Proporciona alivio del dolor y/o disconfort abdominal, descenso en la sensación de urgencia defecatoria, reducción en la frecuencia de los movimientos intestinales e incremento en la consistencia de las heces. Fue retirado del mercado en noviembre del 2000, debido a la aparición de importantes efectos adversos, incluyendo casos de colitis isquémica y otras complicaciones asociadas al estreñimiento, pero la FDA volvió a aprobar su empleo en junio de 2002 para formas graves de SII-D que no responden a otros tratamientos, en respuesta a la multitud de cartas y llamadas telefónicas de muchas mujeres con un SII-D invalidante que se sentían decepcionadas por la retirada del mercado de este fármaco. El tratamiento debe ser interrumpido si al cabo de cuatro semanas no se obtiene una respuesta satisfactoria.[9]
Lubiprostona
[editar]La lubiprostona está indicada en el tratamiento del SII con predominio de estreñimiento (SII-E), en mujeres,[7] de edad igual o superior a los 18 años. Reduce la intensidad del estreñimiento, el dolor abdominal, el esfuerzo defecatorio y la hinchazón, mejorando la calidad de vida de los pacientes. Los efectos secundarios adversos más frecuentes son aparición de náuseas, cefalea y diarrea. Está contraindicado en casos de obstrucción mecánica del intestino, en pacientes con diarrea preexistente y durante el embarazo.[9]
Psicofármacos
[editar]El desarrollo de técnicas de imagen avanzadas del cerebro y el mejor conocimiento del papel de los neurotransmisores en la regulación de la motilidad y de la percepción visceral, ha permitido descubrir que determinados agentes que actúan sobre el sistema nervioso central, pueden provocar disfunciones de la actividad motora y sensorial del intestino. El uso de psicofármacos comporta numerosos beneficios, gracias a sus propiedades reguladoras, tanto a nivel central, como periférico.[9]
Se han ensayado cuatro tipos diferentes de psicofármacos para el tratamiento del SII: antidepresivos tricíclicos, inhibidores de la recaptación selectiva de la serotonina, inhibidores de la recaptación de serotonina-noradrenalina y antipsicóticos atípicos.[9]
Los antidepresivos tricíclicos (ATC) modulan la percepción del dolor a nivel central y disminuyen la hipersensibilidad rectal inducida por el estrés. Sus efectos secundarios más frecuentes son el estreñimiento, las taquicardias, retención urinaria, xerostomía (sequedad de boca), insomnio, agitación y pesadillas nocturnas.[9]
Los inhibidores de la recaptación selectiva de la serotonina (IRSS) pueden ser de utilidad en los trastornos funcionales digestivos, debido a que mejoran la sensación de bienestar global, controlan la ansiedad, potencian el efecto analgésico de otros agentes (como los antidepresivos tricíclicos) y permiten el tratamiento de otras comorbilidades psiquiátricas. Entre los posibles efectos secundarios figura la diarrea. Los más empleados son la paroxetina y la fluoxetina.[9]
La duloxetina es un inhibidor de la recaptación de la serotonina-noradrenalina (IRSN). Ha sido estudiada en pacientes con SII. Resulta efectiva para el control del dolor y mejora la consistencia de las deposiciones. La venlafaxina es un IRSN que mejora la acomodación postprandial y disminuye la sensibilidad rectal a la distensión. Su principal efecto secundario es la náusea. Otro IRSN es el milnaciprán, que podría ser empleado en pacientes con SII asociado a fibromialgia.[9]
Los antipsicóticos atípicos pueden ser de utilidad en el tratamiento de trastornos funcionales, por sus propiedades analgésicas y ansiolíticas (control del dolor y de la ansiedad) y sus efectos sedantes. Se emplean solos o en combinación con otros antidepresivos, a dosis más bajas que las empleadas para el tratamiento del trastorno bipolar y la esquizofrenia. La quetiapina logra mejorar los síntomas de intestino irritable y de dolor abdominal funcional en pacientes que no han respondido al tratamiento con otros antidepresivos.[9]
Terapias psicosociales
[editar]Puede resultar útil identificar factores ambientales que puedan ejercer una influencia negativa sobre los síntomas o una mala adaptación a la enfermedad, así como la presencia de cualquier comorbilidad psiquiátrica (ansiedad, depresión, neuroticismo), antecedentes de una historia de maltratos o abusos en la infancia o en la juventud y la falta de apoyo del entorno social o familiar. En determinados pacientes con síntomas graves, pueden resultar de utilidad las terapias cognitivo-conductuales o psicodinámicas, técnicas de relajación, meditación e incluso la hipnosis,[7] especialmente cuando logran identificarse los acontecimientos estresantes y/o niveles elevados de ansiedad o neurosis. Todas ellas están orientadas a atenuar los efectos de una respuesta exagerada al estrés, modificar la mala adaptación psicológica (catastrofismo, sentimientos de culpa o vergüenza, ansiedad) y modificar los comportamientos negativos ante los síntomas, como la agorafobia.[9]
Fármacos en desarrollo
[editar]Durante los últimos años, la investigación se ha centrado en el desarrollo de moléculas capaces de controlar algunos de los mecanismos implicados en los síntomas del SII, gracias a los nuevos avances en el conocimiento de su patogenia. El SII no es una enfermedad propiamente dicha, sino un síndrome definido por un conjunto de síntomas que responden a muy diversos trastornos fisiopatológicos, lo cual explica que el éxito obtenido con los fármacos sea siempre parcial y no responda de forma totalmente satisfactoria a las expectativas depositadas en ellos, por parte de las agencias reguladoras del medicamento, las industrias farmacéuticas, los médicos y los pacientes.[9]
Entre las terapias emergentes para el tratamiento del SII-E se encuentran algunos moduladores de los receptores de la serotonina (como la prucaloprida, la mosaprida y el pumosetrag), agonistas de los receptores C de la guanilato-ciclasa (como la linaclotida y la plecanatida), moduladores de los ácidos biliares (como el ácido ursodesoxicólico) y antagonistas dopaminérgicos (como la itoprida). Actualmente, los que se encuentran en una fase de desarrollo más avanzada son la prucaloprida (mejora la frecuencia de las deposiciones y otros síntomas relacionados con el estreñimiento) y la linaclotida (mejora en la frecuencia y consistencia de las deposiciones y del esfuerzo defecatorio; alivio del dolor e hinchazón abdominal).[9]
Pronóstico
[editar]Aproximadamente la mitad de los pacientes con SII permanecen estables y no modifican el patrón de los síntomas predominantes (diarrea, estreñimiento o alternante). El otro 50 % puede cambiar de un patrón a otro.[9]
No existe una mayor tasa de mortalidad en los pacientes de SII, en comparación con la observada en la población general. Sin embargo, la calidad de vida puede deteriorarse gravemente, llegando a niveles iguales o peores que los observados en otras enfermedades de curso crónico (como el reflujo gastroesofágico, la diabetes, la insuficiencia renal crónica, la depresión o la artritis reumatoide), debido a las importantes repercusiones físicas, emocionales, sociales y económicas que ocasionan las molestias del paciente. Algunos informes sugieren un aumento en el riesgo de suicidio, así como en la necesidad de diversas cirugías insuficientemente justificadas, en los pacientes con SII.[9]
Véase también
[editar]Referencias
[editar]- ↑ a b c d e Institutos Nacionales de la Salud de los Estados Unidos (febrero de 2015). «Definition & Facts for Irritable Bowel Syndrome». Consultado el 16 de julio de 2017. «In the past, doctors called IBS colitis, mucous colitis, spastic colon, nervous colon, and spastic bowel. Experts changed the name (IBS: Irritable Bowel Syndrome). En el pasado, los médicos llamaron al SII colitis, colitis mucosa, colon espástico, colon nervioso e intestino espástico. Los expertos cambiaron el nombre (SII: Síndrome del Intestino Irritable).».
- ↑ a b c Spiller R, Aziz Q, Creed F, Emmanuel A, Houghton L, Hungin P, Jones R, Kumar D, Rubin G, Trudgill N, Whorwell P; Clinical Services Committee of The British Society of Gastroenterology (diciembre de 2007). «Guidelines on the irritable bowel syndrome: mechanisms and practical management». Gut (Revisión. Guía clínica.) 56 (12): 1770-98. PMC 2095723. PMID 17488783. doi:10.1136/gut.2007.119446. «Antecedent terms used to describe the clinical entity now known as IBS include “spastic colon” and “irritable colon”.»
- ↑ a b García Novo, M. D.; García Burriel, J. I.; Pereda Pérez, A. (1 de enero de 2002). «Trastornos intestinales funcionales (equivalentes del colon irritable)». Anales de Pediatría 57 (3): 253-263. doi:10.1016/S1695-4033(02)77914-9. Consultado el 28 de septiembre de 2017. «SÍNDROME DEL INTESTINO IRRITABLE ... Se han utilizado numerosas denominaciones: colitis mucosa, colon irritable, colon inestable, colon espástico, colitis espástica, diarrea nerviosa, neurosis colónica, diarrea benigna crónica. Debe evitarse la terminología que alude al colon, como única localización, ya que otros tramos del tubo digestivo pueden estar afectados. De igual forma, el término “colitis” no es adecuado por no estar presente la inflamación en esta entidad.»
- ↑ Institutos Nacionales de la Salud de los Estados Unidos (febrero de 2015). «Symptoms & Causes of Irritable Bowel Syndrome». Consultado el 16 de julio de 2017.
- ↑ Ikechi, Ronald; Fischer, Bradford D.; DeSipio, Joshua; Phadtare, Sangita (junio de 2017). «Irritable Bowel Syndrome: Clinical Manifestations, Dietary Influences, and Management» [Síndrome del intestino irritable: manifestaciones clínicas, influencias dietarias y manejo]. Healthcare (Basel) (en inglés) (Multidisciplinary Digital Publishing Institute (MDPI)) 5 (2): 21. PMID 28445436. doi:10.3390/healthcare5020021. Consultado el 9 de julio de 2017.
- ↑ a b c d e f g h i j k l m n ñ o p q r s t Lehrer, Jenifer K.; Lichtenstein, Gary R.; et al (abril de 2017). «Irritable Bowel Syndrome» [Síndrome del intestino irritable]. Medscape. Consultado el 9 de julio de 2017.
- ↑ a b c d e f g h i j k l m n ñ o p q r s t u v w x Quigley, Eamonn M.M.; Fried, Michael; Gwee, Kok-Ann; Khalif, Igor; Hungin, Pali; Lindberg, Greger; et al (septiembre de 2015). «Síndrome de Intestino Irritable: una Perspectiva Mundial». WGO Global Guidelines (World Gastroenterology Organization). Consultado el 9 de julio de 2017.
- ↑ a b c d e f Hungin, A. P.; Molloy-Bland, M.; Claes, R.; Heidelbaugh, J.; Cayley, W. E. Jr.; Muris, J.; Seifert, B.; et al. (noviembre de 2014). «Systematic review: the perceptions, diagnosis and management of irritable bowel syndrome in primary care--a Rome Foundation working team report». Aliment Pharmacol Ther 40 (10): 1133-45. PMID 25230281. doi:10.1111/apt.12957.
- ↑ a b c d e f g h i j k l m n ñ o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an añ ao ap aq ar as at au av aw ax ay az ba bb bc bd be bf bg bh bi bj bk bl bm bn bñ bo bp bq br bs bt bu bv bw bx by bz ca cb cc cd ce cf cg ch ci cj ck cl cm cn cñ co cp cq cr cs ct cu cv cw cx cy cz da db dc dd Mearin, Fermín; Montoro, Miguel A. (2012). «Síndrome de intestino irritable». En Mearin, Fermín; Montoro, Miguel A., eds. Gastroenterología y hematología. Problemas comunes en la práctica clínica (2 edición). España: Jarpyo Editores, S.A. pp. 523-568. ISBN 9788492982319
|isbn=incorrecto (ayuda). Archivado desde el original el 26 de junio de 2017. Consultado el 9 de julio de 2017. - ↑ a b c d e f g h i j k l Sebastián Domingo J. J. (23 de mayo de 2017). «The new Rome criteria (IV) of functional digestive disorders in clinical practice». Med Clin (Barc) 148 (10): 464-468. PMID 28153434. doi:10.1016/j.medcli.2016.12.020.
- ↑ a b c Furman, David L.; Cash, Brooks D. (marzo de 2011). «The role of diagnostic testing in irritable bowel syndrome.». Gastroenterol Clin North Am 40 (1): 105-19. PMID 21333903. doi:10.1016/j.gtc.2010.12.001.
- ↑ Logan AC, Jacka FN (24 de julio de 2014). «Nutritional psychiatry research: an emerging discipline and its intersection with global urbanization, environmental challenges and the evolutionary mismatch». J Physiol Anthropol (Revisión) 33: 22. PMC 4131231. PMID 25060574. doi:10.1186/1880-6805-33-22.
- ↑ a b c d e f g h i j k l m n ñ o p q Saha, L. (junio de 2014). «Irritable bowel syndrome: pathogenesis, diagnosis, treatment, and evidence-based medicine». World J Gastroenterol 20 (22): 6759-73. PMID 24944467. doi:10.3748/wjg.v20.i22.6759.
- ↑ Irvine AJ, Chey WD, Ford AC (enero de 2017). «Screening for Celiac Disease in Irritable Bowel Syndrome: An Updated Systematic Review and Meta-analysis». Am J Gastroenterol (Revisión Sistemática y Metaanálisis) 112 (1): 65-76. PMID 27753436. doi:10.1038/ajg.2016.466. «Although IBS is not a diagnosis of exclusion, with physicians advised to minimize the use of investigations, the gastrointestinal (GI) tract has a limited repertoire of symptoms, meaning that abdominal pain and a change in bowel habit is not specific to the disorder [IBS]. Aunque el SII no es un diagnóstico de exclusión, con los médicos avisados de que minimicen el uso de las investigaciones, el tracto gastrointestinal tiene un repertorio limitado de síntomas, lo que significa que el dolor abdominal y un cambio en el hábito intestinal no son específicos del trastorno [SII].»
- ↑ a b Schmulson M. J., Drossman D. A. (30 de abril de 2017). «What Is New in Rome IV». J Neurogastroenterol Motil (Revisión) 23 (2): 151-163. PMC 5383110. PMID 28274109. doi:10.5056/jnm16214.
- ↑ a b c d e f g h Mearin F., Montoro M. (4 de agosto de 2014). «Irritable bowel syndrome, celiac disease and gluten» [Síndrome del intestino irritable, enfermedad celíaca y gluten: «Una cosa es predicar y otra dar trigo»]. Med Clin (Barc) (Revisión) 143 (4): 124-9. PMID 24029448. doi:10.1016/j.medcli.2013.06.006. «A menudo, el médico que se enfrenta a un SII hace un interrogatorio minucioso orientado a descartar síntomas que puedan alertar sobre malignidad, pero olvida llevar a cabo una búsqueda intencionada de síntomas o signos extraintestinales, que proporcionan claves importantes para sospechar EC (EC: enfermedad celíaca). No en vano la EC es uno de los paradigmas con expresión multisistémica más frecuentemente encontrados en medicina.»
- ↑ a b c d Chey W. D., Kurlander J., Eswaran S. (3 de marzo de 2015). «Irritable bowel syndrome: a clinical review». JAMA (Revisión) 313 (3): 949-58. PMID 25734736. doi:10.1001/jama.2015.0954. «At present, there is emerging evidence that supports diets for IBS patients that are gluten free and low in fermentable oligosaccharides, disaccharides, monosaccharides, and polyols (FODMAP).»
- ↑ a b c d e f g Makharia A, Catassi C, Makharia GK (10 de diciembre de 2015). «The Overlap between Irritable Bowel Syndrome and Non-Celiac Gluten Sensitivity: A Clinical Dilemma». Nutrients (Revisión) 7 (12): 10417-26. PMC 4690093. PMID 26690475. doi:10.3390/nu7125541.
- ↑ a b Elli L., Villalta D., Roncoroni L., Barisani D., Ferrero S., Pellegrini N., Bardella M. T., Valiante F., Tomba C., Carroccio A., Bellini M., Soncini M., Cannizzaro R., Leandro G. (febrero de 2017). «Nomenclature and diagnosis of gluten-related disorders: A position statement by the Italian Association of Hospital Gastroenterologists and Endoscopists (AIGO)». Dig Liver Dis (Revisión) 49 (2): 138-146. PMID 27887897. doi:10.1016/j.dld.2016.10.016. «GFD does not present side effects and is usually balanced and safe (strong recommendation, high level of evidence). GFD: gluten-free diet La dieta sin gluten no presenta efectos secundarios y suele ser equilibrada y segura (fuerte recomendación, alto nivel de evidencia).»
- ↑ a b «FODMAPs». King's College, London. Diabetes & Nutritional Sciences, Research Projects. Archivado desde el original el 6 de mayo de 2013. Consultado el 18 de marzo de 2012.
- ↑ a b c d e f g h Staudacher H. M., Irving P. M., Lomer M. C., Whelan K. (abril de 2014). «Mechanisms and efficacy of dietary FODMAP restriction in IBS». Nat Rev Gastroenterol Hepatol (Revisión) 11 (4): 256-66. PMID 24445613. doi:10.1038/nrgastro.2013.259. «An emerging body of research now demonstrates the efficacy of fermentable carbohydrate restriction in IBS; however, limitations still exist with this approach owing to a limited number of randomized trials, in part due to the fundamental difficulty of placebo control in dietary trials. Evidence also indicates that the diet can influence the gut microbiota and nutrient intake. Fermentable carbohydrate restriction in people with IBS is promising, but the effects on gastrointestinal health require further investigation.»
- ↑ a b Marsh A., Eslick E. M., Eslick G. D. (2015). «Does a diet low in FODMAPs reduce symptoms associated with functional gastrointestinal disorders? A comprehensive systematic review and meta-analysis». Eur J Nutr. PMID 25982757. doi:10.1007/s00394-015-0922-1.
- ↑ a b c d e f Rao S. S., Yu S., Fedewa A. (2015). «Systematic review: dietary fibre and FODMAP-restricted diet in the management of constipation and irritable bowel syndrome». Aliment. Pharmacol. Ther. 41 (12): 1256-70. PMID 25903636. doi:10.1111/apt.13167.
- ↑ a b c d Tuck, C. J.; Muir, J. G.; Barrett, J. S.; Gibson, P. R. (2014). «Fermentable oligosaccharides, disaccharides, monosaccharides and polyols: role in irritable bowel syndrome». Expert Rev Gastroenterol Hepatol 8 (7): 819-834. PMID 24830318. doi:10.1586/17474124.2014.917956.
- ↑ a b c d Heiman M. L., Greenway F. L. (5 de marzo de 2016). «A healthy gastrointestinal microbiome is dependent on dietary diversity». Mol Metab (Revisión) 5 (5): 317-20. PMC 4837298. PMID 27110483. doi:10.1016/j.molmet.2016.02.005.
- ↑ a b Greer J. B., O'Keefe S. J. (26 de enero de 2011). «Microbial induction of immunity, inflammation, and cancer». Front Physiol (Revisión) 1: 168. PMC 3059938. PMID 21423403. doi:10.3389/fphys.2010.00168.
- ↑ a b Andoh A., Tsujikawa T., Fujiyama Y. (2003). «Role of dietary fiber and short-chain fatty acids in the colon». Curr Pharm Des (Revisión) 9 (4): 347-58. PMID 12570825.
- ↑ a b c El-Salhy M, Hatlebakk JG, Gilja OH, Hausken T (7 de septiembre de 2015). «The relation between celiac disease, nonceliac gluten sensitivity and irritable bowel syndrome». Nutr J (Revisión) 14: 92. PMC 4561431. PMID 26345589. doi:10.1186/s12937-015-0080-6.
- ↑ a b c d Verdu EF, Armstrong D, Murray JA (junio de 2009). «Between celiac disease and irritable bowel syndrome: the "no man's land" of gluten sensitivity». Am J Gastroenterol (Revisión) 104 (6): 1587-94. PMC 3480312. PMID 19455131. doi:10.1038/ajg.2009.188. «Gluten-sensitive individuals, who have IBS symptoms and IgG antibodies to gluten, are orphans, living in no man’s land, acknowledged neither by functional disease specialists nor by celiac disease specialists. Los individuos sensibles al gluten, que tienen síntomas del SII y anticuerpos IgG contra el gluten, son huérfanos, que viven en la tierra de nadie, no reconocidos ni por los especialistas en enfermedades funcionales ni por los especialistas en enfermedades celíacas.».
- ↑ a b Lionetti E., Gatti S., Pulvirenti A., Catassi C. (junio de 2015). «Celiac disease from a global perspective» [Enfermedad celíaca desde una perspectiva global]. Best Pract Res Clin Gastroenterol. (Revisión) (en inglés) 29 (3): 365-79. PMID 26060103. doi:10.1016/j.bpg.2015.05.004.
- ↑ a b Schuppan D, Pickert G, Ashfaq-Khan M, Zevallos V (junio de 2015). «Non-celiac wheat sensitivity: differential diagnosis, triggers and implications». Best Pract Res Clin Gastroenterol (Revisión) 29 (3): 469-76. PMID 26060111. doi:10.1016/j.bpg.2015.04.002.
- ↑ Parés, D; Comas, M; Dorcaratto, D; Araujo, MI; Vial, M; Bohle, B; Pera, M; et al. (mayo de 2009). «Adaptation and validation of the Bristol scale stool form translated into the Spanish language among health professionals and patients». Rev Esp Enferm Dig 101 (5): 312-6. PMID 19527076.
- ↑ Horwitz BJ, Fisher RS (14 de junio de 2001). «The Irritable Bowel Syndrome». N Engl J Med (Revisión) 344 (24): 1846-50. PMID 11407347. doi:10.1056/NEJM200106143442407.
- ↑ a b Camilleri M. (noviembre de 2012). «Irritable bowel syndrome: how useful is the term and the 'diagnosis'?». Therap Adv Gastroenterol 5 (6): 381-6. PMC 3491678. PMID 23152731. doi:10.1177/1756283X12442223.
- ↑ a b c d e f g Quigley, E. M.; Abdel-Hamid, H.; Barbara, G.; Bhatia, S. J.; Boeckxstaens, G.; De Giorgio, R.; Delvaux, M.; et al. (mayo a junio de 2012). «A global perspective on irritable bowel syndrome: a consensus statement of the World Gastroenterology Organisation Summit Task Force on irritable bowel syndrome». J Clin Gastroenterol 46 (5): 356-66. PMID 22499071. doi:10.1097/MCG.0b013e318247157c. «There is also evidence that it is no longer appropriate to view IBS as a purely functional disorder without any organic correlate. Such evidence includes the reported association between IBS and diverticulosis in the elderly,48,49 the documentation of changes in the number and distribution of the various cells that participate in the inflammatory response, as well as altered expression of cytokines, chemokines, defensins, and molecular components of the epithelial barrier, in the gut, among patients with IBS.50–63 These findings have been linked to alterations in the microbiota,64–71 increased intestinal permeability, 51,72,73 and the detection of proinflammatory cytokines in the systemic circulation.55,74–76 Relationships between these findings and clinical phenotype are, as yet, poorly developed and their value in the diagnosis of IBS has not been defined. On a clinical level, the development of IBS-type symptoms among patients with inflammatory bowel disease77 and celiac disease,78 illustrates the ability of intestinal inflammation, regardless of cause, to generate complaints that, in another context, would have been regarded as purely “functional” in origin. Whether chronic infections and infestations such as those that commonly occur in more tropical climes can generate a similar symptomatology by initiating chronic inflammatory responses (as extensive animal studies would predict79) remains to be defined. Future studies should aim to identify biomarkers representative for different etiologic subclasses of IBS, which will contribute to improved and targeted treatment.80».
- ↑ Sperber, A. D.; Drossman, D. A.; Quigley, E. M. (noviembre de 2012). «The global perspective on irritable bowel syndrome: a Rome Foundation-World Gastroenterology Organisation symposium». Am J Gastroenterol 107 (11): 1602-9. PMID 23160283. doi:10.1038/ajg.2012.106.
- ↑ Nellesen, D.; Yee, K.; Chawla, A.; et al. (2013). «A systematic review of the economic and humanistic burden of illness in irritable bowel syndrome and chronic constipation». J Manag Care Pharm 19: 755-64.
- ↑ Fortea, J.; Prior, M. (2013). «Irritable bowel syndrome with constipation: a European-focused systematic literature review of disease burden». J Med Econ 16: 329-41.
- ↑ Schuppan D., Pickert G., Ashfaq-Khan M., Zevallos V. (junio de 2015). «Non-celiac wheat sensitivity: differential diagnosis, triggers and implications». Best Pract Res Clin Gastroenterol 29 (3): 469–76. PMID 26060111. doi:10.1016/j.bpg.2015.04.002. «For the experienced clinician extraintestinal symptoms which are frequent serve as the best indicator of the disease, and accordingly, are increasingly recognized as hallmarks of NCWS [4,5]. When it comes to mainly intestinal symptoms, there may be a significant overlap with the spectrum of irritable bowel syndrome (IBS) [6], wheat allergy which is frequently missed with conventional blood IgE and skin testing [7-9] and (less likely) intolerance to FODMAPs (fermentable oligo-, di-, monosaccharides and polyols [10].»
- ↑ a b c d e f g h i j k l m n Fasano A., Sapone A., Zevallos V., Schuppan D. (mayo de 2015). «Nonceliac gluten sensitivity». Gastroenterology (Revisión) 148 (6): 1195-204. PMID 25583468. doi:10.1053/j.gastro.2014.12.049. «IBS-like symptoms, such as abdominal pain, gas, distension, and irregular bowel movements, frequently are reported and therefore make it difficult to distinguish NCGS from IBS induced by other causes. The differential diagnosis is facilitated for patients who also experience extraintestinal symptoms, including headache or frank migraine, foggy mind, chronic fatigue, joint and muscle pain, tingling of the extremities, leg or arm numbness, eczema, anemia, depression, or for patients who report a reduction in immune-mediated (including autoimmune) symptoms on a GFD. (...) Therefore, it is possible to consider some subjects with NCGS to be typical IBS patients and vice versa: a subgroup of IBS patients may have NCGS. This last scenario was highlighted in subjects affected by the diarrheapredominant variant of IBS —particularly those with HLA-DQ2 and/or DQ8 genotypes (associated with celiac disease).»
- ↑ a b Genome-wide analysis of 53,400 people with irritable bowel syndrome highlights shared genetic pathways with mood and anxiety disorders. doi:10.1038/s41588-021-00950-8.
- ↑ Newnham E. D. (marzo de 2017). «Coeliac disease in the 21st century: paradigm shifts in the modern age». J Gastroenterol Hepatol (Revisión). 32 Suppl 1: 82-85. PMID 28244672. doi:10.1111/jgh.13704.
- ↑ Levy J., Bernstein L., Silber N. (diciembre de 2014). «Celiac disease: an immune dysregulation syndrome». Curr Probl Pediatr Adolesc Health Care 44 (11): 324-7. PMID 25499458. doi:10.1016/j.cppeds.2014.10.002.
- ↑ a b c d e f g h i Volta U., Caio G., De Giorgio R., Henriksen C., Skodje G., Lundin K. E. (junio de 2015). «Non-celiac gluten sensitivity: a work-in-progress entity in the spectrum of wheat-related disorders». Best Pract Res Clin Gastroenterol (Revisión) 29 (3): 477-91. PMID 26060112. doi:10.1016/j.bpg.2015.04.006.
- ↑ Rossi A., Di Lollo A. C., Guzzo M. P., Giacomelli C., Atzeni F., Bazzichi L., Di Franco M. (2015). «Fibromyalgia and nutrition: what news?». Clin Exp Rheumatol 33 (1 Suppl 88): S117-25. PMID 25786053.
- ↑ San Mauro Martín I., Garicano Vilar E., Collado Yurrutia L., Ciudad Cabañas M. J. (diciembre de 2014). «Is gluten the great etiopathogenic agent of disease in the XXI century?». Nutr Hosp 30 (6): 1203-10. PMID 25433099. doi:10.3305/nh.2014.30.6.7866.
- ↑ a b c d e f g h Catassi C., Bai J., Bonaz B., Bouma G., Calabrò A., Carroccio A., Castillejo G., Ciacci C., Cristofori F., Dolinsek J., Francavilla R., Elli L., Green P., Holtmeier W., Koehler P., Koletzko S., Meinhold C., Sanders D., Schumann M., Schuppan D., Ullrich R., Vécsei A., Volta U., Zevallos V., Sapone A., Fasano A. (2013). «Non-celiac gluten sensitivity: the new frontier of gluten related disorders». Nutrients (Revisión) 5 (10): 3839-3853. ISSN 2072-6643. PMID 24077239. doi:10.3390/nu5103839.
- ↑ a b c d Lebwohl B., Ludvigsson J. F., Green P. H. (octubre de 2015). «Celiac disease and non-celiac gluten sensitivity». BMJ (Revisión) 5: 351:h4347. PMC 4596973. PMID 26438584. doi:10.1136/bmj.h4347.
- ↑ Molina-Infante J., Santolaria S., Montoro M., Esteve M., Fernández-Bañares F. (2014). «Non-celiac gluten sensitivity: a critical review of current evidence». Gastroenterol Hepatol 37 (6): 362–71. PMID 24667093. doi:10.1016/j.gastrohep.2014.01.005.
- ↑ a b Lundin K. E., Wijmenga C. (septiembre de 2015). «Coeliac disease and autoimmune disease-genetic overlap and screening». Nat Rev Gastroenterol Hepatol 12 (9): 507–15. PMID 26303674. doi:10.1038/nrgastro.2015.136.
- ↑ Ciccocioppo R., Kruzliak P., Cangemi G. C., Pohanka M., Betti E., Lauret E., Rodrigo L. (22 de octubre de 2015). «The Spectrum of Differences between Childhood and Adulthood Celiac Disease». Nutrients 7 (10): 8733–51. PMID 26506381. doi:10.3390/nu7105426.
- ↑ «Irritable bowel síndrome». U.S. National Library of Medicine A.D.A.M. Medical Encyclopedia. 18 de julio de 2013.
- ↑ a b Nash DT, Slutzky AR (octubre de 2014). «Gluten sensitivity: new epidemic or new myth?». Proc (Bayl Univ Med Cent) 27 (4): 377-8. PMC 4255872. PMID 25484517.
- ↑ a b Herald Sun, ed. (18 de noviembre de 2014). «An increasing number of Australians are choosing a gluten-free diet». Consultado el 4 de abril de 2018.
- ↑ Gibson, P. R.; Varney, J.; Malakar, S.; Muir, J. G. (10 de febrero de 2015). «Food Components and Irritable Bowel Syndrome». Gastroenterology. pii: S0016-5085 (15): 00196-1. PMID 25680668. doi:10.1053/j.gastro.2015.02.005.
- ↑ Comino, I.; Real, A.; Moreno, M. L.; Cebolla, A.; Sousa, C. (2013). «Detección de la fracción inmunotóxica del gluten: aplicaciones en seguridad alimentaria y en la monitorización de pacientes celíacos». Enfermedad celíaca y sensibilidad al gluten no celíaca: 433-445. doi:10.3926/oms.24.
- ↑ Guandalini S., Polanco I. (abril de 2015). «Nonceliac gluten sensitivity or wheat intolerance syndrome?». J Pediatr (Revisión) 166 (4): 805-11. PMID 25662287. doi:10.1016/j.jpeds.2014.12.039.
- ↑ Pruimboom L., de Punder K. (24 de noviembre de 2015). «The opioid effects of gluten exorphins: asymptomatic celiac disease». J Health Popul Nutr (Revisión) 33: 24. PMC 5025969. PMID 26825414. doi:10.1186/s41043-015-0032-y.
- ↑ a b c National Institutes of Health (Estados Unidos) (junio de 2016). «Treatment for Celiac Disease». Consultado el 9 de junio de 2017.
- ↑ Day L., Augustin M. A., Batey I. L., Wrigley C. W. (2006). «Wheat-gluten uses and industry needs». Trends in Food Science & Technology (Revisión) 17 (2): 82- 90. doi:10.1016/j.tifs.2005.10.003.
- ↑ Mangione R. A, Patel P. N. (septiembre-octubre de 2008). «Caring for patients with celiac disease: the role of the pharmacist». J Am Pharm Assoc (Revisión) 48 (5): e125-35; quiz e136-9. PMID 18826893. doi:10.1331/JAPhA.2008.08014.
- ↑ Flamez B., Clark A. A., Sheperis C. J. (2014). «Celiac Disease. Psychological Developmental and Family Counseling Issues». The Family Journal 22 (2): 226-30. doi:10.1177/1066480713515407.
- ↑ Academy of Nutrition and Dietetics (22 de abril de 2014). «Avoiding Gluten Cross-Contamination». Archivado desde el original el 17 de marzo de 2017. Consultado el 17 de marzo de 2017. «For people with celiac disease, even just a microscopic amount of gluten can cause a reaction and damage to the intestines, such as a single bread crumb on a plate or speck of wheat flour on manufacturing equipment.»
- ↑ Bern E. M., O'Brien R. F. (agosto de 2013). «Is it an eating disorder, gastrointestinal disorder, or both?». Curr Opin Pediatr (Revisión) 25 (4): 463-70. PMID 23838835. doi:10.1097/MOP.0b013e328362d1ad.
- ↑ Ministerio de Sanidad y Consumo de España, ed. (2008). «Diagnóstico precoz de la enfermedad celíaca». Archivado desde el original el 5 de octubre de 2018. Consultado el 25 de agosto de 2013.
- ↑ Rodrigo, L.; Garrote, J. A.; Vivas, S.; et al. (2008). «Enfermedad Celíaca». Med Clin (Barc) 131: 264-70.
- ↑ Rodrigo, L. (2010). «Enfermedad celiaca». IT Sistema Nacional Salud 34 (2): 52.
- ↑ Lamacchia, C.; Camarca, A.; Picascia, S.; Di Luccia, A.; Gianfrani, C. (29 de enero de 2014). «Cereal-based gluten-free food: how to reconcile nutritional and technological properties of wheat proteins with safety for celiac disease patients». Nutrients 6 (2): 575-90. PMC 3942718. PMID 24481131. doi:10.3390/nu6020575.
- ↑ Peter R. Gibson y Susan J. Shepherd (2010). «Evidence-based dietary management of functional gastrointestinal symptoms: The FODMAP approach». Journal of Gastroenterology and Hepatology 25 (2): 252-258. PMID 20136989. doi:10.1111/j.1440-1746.2009.06149.x.
- ↑ Schmulson, Max J.; Saps, Miguel (1 de junio de 2023). «Editorial: eosinófilos en dispepsia funcional, mucoprotectores, motilidad del intestino delgado en el SII y estudios manométricos en pediatría». NeuroGastroLATAM Reviews 6 (3). ISSN 2462-7011. doi:10.24875/ngl.m23000025. Consultado el 19 de agosto de 2024.
- ↑ Howell, Carol Angela; Kemppinen, Anu; Allgar, Victoria; Dodd, Matthew; Knowles, Charles H; McLaughlin, John; Pandya, Preeti; Whorwell, Peter et al. (27 de junio de 2022). «Double-blinded randomised placebo controlled trial of enterosgel (polymethylsiloxane polyhydrate) for the treatment of IBS with diarrhoea (IBS-D)». Gut 71 (12): 2430-2438. ISSN 0017-5749. doi:10.1136/gutjnl-2022-327293. Consultado el 19 de agosto de 2024.
- ↑ Teramoto-Matsubara, Óscar; Miranda-Guzmán, Yumari A.; Schmulson, Max J. (31 de mayo de 2023). «Dispositivos médicos que parecen medicamentos en trastornos de la interacción intestino-cerebro». NeuroGastroLATAM Reviews 6 (3). ISSN 2462-7011. doi:10.24875/ngl.23000001. Consultado el 19 de agosto de 2024.
Bibliografía
[editar]- Thompson W. G., Longstreth G. L., Drossman D. A. et al. (2000). Desórdenes funcionales de Intestinos.
- Drossman D. A., Corazziari E., Talley N.J., et al (eds.). Roma II: Los Desórdenes Gastrointestinales Funcionales. Diagnóstico, fisiopatología y tratamiento. Un Consenso Multinacional.
