Alcalino
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo nomenclatura IUPAC | 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo nomenclatura CAS | IA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementos | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Los metales alcalinos o simplemente alcalinos (del árabe, alqali) son estos seis elementos químicos: litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio (Cs) y francio (Fr). Estos elementos, junto con el hidrógeno (que es un gas), constituyen el grupo 1 que se encuentra en el bloque-s de la tabla periódica.
Todos los metales alcalinos tienen su electrón más externo en un orbital-s, esta configuración electrónica compartida da como resultado que tengan propiedades características muy similares. De hecho, los metales alcalinos proporcionan el mejor ejemplo de patrones de grupos parecidos en sus propiedades de la tabla periódica, con elementos que exhiben un comportamiento característico homólogo. Esta familia de elementos es también conocida con la familia del litio al ser este su primer elemento.
Los metales alcalinos son metales brillantes, blandos, altamente reactivos a temperatura y presión estándar y pierden fácilmente su electrón más externo para formar cationes con carga +1. Todos se pueden cortar fácilmente con un cuchillo debido a su suavidad, exponiendo una superficie brillante que se empaña rápidamente en el aire debido a la oxidación por la humedad atmosférica y el oxígeno (y en el caso del litio, nitrógeno). Debido a su alta reactividad, deben almacenarse bajo aceite para evitar la reacción con el aire y se encuentran naturalmente solo en sales y nunca como elementos libres. El cesio, el quinto metal alcalino, es el más reactivo de todos los metales. Todos los metales alcalinos reaccionan con el agua, y los metales alcalinos más pesados reaccionan más vigorosamente que los más ligeros.
Todos los metales alcalinos descubiertos se encuentran en la naturaleza como sus compuestos: en orden de abundancia, el sodio es el más abundante, seguido de potasio, litio, rubidio, cesio y finalmente francio, que es muy raro debido a su radioactividad extremadamente alta; El francio se produce solo en pequeñas huellas en la naturaleza como un paso intermedio en algunas ramas laterales oscuras de las cadenas naturales de descomposición. Se han realizado experimentos para intentar la síntesis de ununenio (Uue), que probablemente sea el próximo miembro del grupo; ninguno tuvo éxito. Sin embargo, el ununenio puede no ser un metal alcalino debido a los efectos relativistas, que se predice que tienen una gran influencia en las propiedades químicas de los elementos superpesados ; incluso si resulta ser un metal alcalino, se prevé que tenga algunas diferencias en las propiedades físicas y químicas de sus homólogos más ligeros.
La mayoría de los metales alcalinos tienen muchas aplicaciones diferentes. Una de las aplicaciones más conocidas de los elementos puros es el uso de rubidio y cesio en los relojes atómicos, de los cuales los relojes atómicos de cesio forman la base del segundo . Una aplicación común de los compuestos de sodio es la lámpara de vapor de sodio, que emite luz de manera muy eficiente. La sal de mesa, o cloruro de sodio, se ha utilizado desde la antigüedad. El litio se usa como medicamento psiquiátrico y como ánodo en las baterías de litio . El sodio y el potasio también son elementos esenciales, que tienen funciones biológicas importantes como electrolitos, y aunque los otros metales alcalinos no son esenciales, también tienen varios efectos en el cuerpo, tanto beneficiosos como perjudiciales.
Historia[editar]

Los compuestos de sodio se conocen desde la antigüedad; sal (cloruro de sodio) ha sido un producto importante en las actividades humanas, por ejemplo la palabra salario, en referencia a Salarium, el dinero pagado a los soldados romanos para la compra de sal.[1] Si bien la potasa se ha usado desde la antigüedad, no se entendió que la mayor parte de su historia fuera una sustancia fundamentalmente diferente de las sales minerales de sodio. Georg Ernst Stahl obtuvo evidencia experimental que lo llevó a sugerir la diferencia fundamental de las sales de sodio y potasio en 1702,[2] y Henri-Louis Duhamel du Monceau pudo demostrar esta diferencia en 1736.[3] La composición química exacta de los compuestos de potasio y sodio, y el estado como elemento químico de potasio y sodio, no se conocía en ese momento, por lo que Antoine Lavoisier no incluyó ninguno de los álcalis en su lista de elementos químicos en 1789.[4][5]
El potasio puro fue aislado por primera vez en 1807 en Inglaterra por Humphry Davy, quien lo derivó de la potasa cáustica (KOH, hidróxido de potasio) mediante el uso de electrólisis de la sal fundida con la pila voltaica recién inventada. Los intentos previos de electrólisis de la sal acuosa no tuvieron éxito debido a la extrema reactividad del potasio. El potasio fue el primer metal que se aisló por electrólisis.[6] Más tarde ese mismo año, Davy informó que la extracción de sodio de la sustancia similar a la sosa cáustica (NaOH, lejía) por una técnica similar, demostrando que los elementos y, por lo tanto, las sales, son diferentes.[7][8][9][10]

La petalita (Li Al Si4 O10) fue descubierta en 1800 por el químico brasileño José Bonifácio de Andrada en una mina en la isla de Utö, Suecia.[11][12][13] Sin embargo, no fue hasta 1817 que Johan August Arfwedson, que trabajaba en el laboratorio del químico Jöns Jacob Berzelius, detectó la presencia de un nuevo elemento mientras analizaba el mineral de petalita.[14][15] Él notó que este nuevo elemento formaba compuestos similares a los del sodio y el potasio, aunque su carbonato e hidróxido eran menos solubles en agua y más alcalinos que los otros metales alcalinos.[16] Berzelius le dio al material desconocido el nombre de "litio/litina", de la palabra griega λιθoς (transliterada como lithos, que significa "piedra"), para reflejar su descubrimiento en un mineral sólido, a diferencia del potasio, que se había descubierto en las cenizas de las plantas. y sodio, que era conocido en parte por su alta abundancia en sangre animal. Llamó al metal dentro del material "litio".[17][12][15] El litio, el sodio y el potasio fueron parte del descubrimiento de la periodicidad, ya que se encuentran entre una serie de tríadas de elementos en el mismo grupo que Johann Wolfgang Döbereiner señaló en 1850 que tenían propiedades similares.[18]

El rubidio y el cesio fueron los primeros elementos que se descubrieron utilizando el espectroscopio, inventado en 1859 por Robert Bunsen y Gustav Kirchhoff.[19] Al año siguiente, descubrieron cesio en el agua mineral de Bad Dürkheim, Alemania. Su descubrimiento del rubidio se produjo al año siguiente en Heidelberg, Alemania, y lo encontró en el mineral lepidolita.[20] Los nombres de rubidio y cesio provienen de las líneas más prominentes en sus espectros de emisión: una línea roja brillante para rubidio (de la palabra latina rubidus, que significa rojo oscuro o rojo brillante), y una línea azul celeste para cesio (derivado del Palabra latina caesius, que significa azul celeste).[21][22]
Alrededor de 1865, John Newlands produjo una serie de documentos donde enumeró los elementos en orden de aumento del peso atómico y propiedades físicas y químicas similares que se repetían a intervalos de ocho; comparó esa periodicidad con las octavas de la música, donde las notas separadas por una octava tienen funciones musicales similares.[23][24] Su versión reunió todos los metales alcalinos conocidos (litio a cesio), así como cobre, plata y talio (que muestran el estado de oxidación +1 característico de los metales alcalinos), en un grupo. Su tabla colocaba hidrógeno con los halógenos.[25]
Después de 1869, Dmitri Mendeleev propuso su tabla periódica colocando el litio en la parte superior de un grupo con sodio, potasio, rubidio, cesio y talio.[26] Dos años después, Mendeleev revisó su tabla, colocando hidrógeno en el grupo 1 sobre el litio, y también moviendo el talio al grupo de boro. En esta versión de 1871, el cobre, la plata y el oro se colocaron dos veces, una vez como parte del grupo IB, y una vez como parte de un "grupo VIII" que abarca los grupos actuales 8 a 11.[27][nota 1] Después de la introducción de la tabla de 18 columnas, los elementos del grupo IB se movieron a su posición actual en el bloque d, mientras que los metales alcalinos se dejaron en el grupo IA . Más tarde, el nombre del grupo fue cambiado al grupo 1 en 1988. El nombre trivial "metales alcalinos" proviene del hecho de que los hidróxidos de los elementos del grupo 1 son todos álcalis fuertes cuando se disuelven en agua.[28]

Hubo al menos cuatro descubrimientos erróneos e incompletos[29][30][31][32] antes de que Marguerite Perey, del Instituto Curie en París, Francia descubriera el francio en 1939 al purificar una muestra de actinio-227, que se había informado a tener una energía de descomposición de 220 keV. Sin embargo, Perey notó partículas de descomposición con un nivel de energía por debajo de 80 keV. Perey pensó que esta actividad de descomposición podría haber sido causada por un producto de descomposición no identificado previamente, uno que se separó durante la purificación, pero surgió nuevamente del actinio puro -227. Varias pruebas eliminaron la posibilidad de que el elemento desconocido sea torio, radio, plomo, bismuto o talio. El nuevo producto exhibió propiedades químicas de un metal alcalino (como coprecipitar con sales de cesio), lo que llevó a Perey a creer que era el elemento 87, causado por la desintegración alfa del actinio-227. Luego, Perey intentó determinar la proporción de desintegración beta a desintegración alfa en actinio-227. Su primera prueba puso la ramificación alfa en 0.6%, una cifra que luego revisó al 1%.[33]
El siguiente elemento debajo del francio (eka- francium) en la tabla periódica sería ununenio (Uue), elemento 119.[34] : 1729–1730 La síntesis de ununenio se intentó por primera vez en 1985 bombardeando un objetivo de einsteinium -254 con iones de calcio -48 en el acelerador superHILAC en Berkeley, California. No se identificaron átomos, lo que condujo a un rendimiento limitante de 300 nb.[35][36]
Es muy poco probable[37] que esta reacción pueda crear átomos de ununenio en el futuro cercano, dada la tarea extremadamente difícil de producir cantidades suficientes de einsteinium-254, que es favorecida para la producción de elementos ultrapesados debido a su gran tamaño. masa, vida media relativamente larga de 270 días y disponibilidad en cantidades significativas de varios microgramos,[38] para hacer un objetivo lo suficientemente grande como para aumentar la sensibilidad del experimento al nivel requerido; El einsteinium no se ha encontrado en la naturaleza y solo se ha producido en laboratorios, y en cantidades más pequeñas que las necesarias para la síntesis efectiva de elementos superpesados. Sin embargo, dado que el ununenio es solo el primer elemento del período 8 en la tabla periódica extendida, bien puede descubrirse en el futuro cercano a través de otras reacciones, y de hecho un intento de sintetizarlo está actualmente en curso en Japón.[39] Actualmente, ninguno de los elementos del período 8 se ha descubierto todavía, y también es posible, debido a la inestabilidad por goteo, que solo los elementos del período 8 inferior, hasta el elemento 128, sean físicamente posibles.[40][41] No se han realizado intentos de síntesis para metales alcalinos más pesados: debido a su número atómico extremadamente alto, requerirían métodos y tecnología nuevos y más potentes para fabricarlos.[42] : 1737–1739
Ocurrencia[editar]
En el Sistema solar[editar]

La regla de Oddo-Harkins sostiene que los elementos con números atómicos pares son más comunes que aquellos con números atómicos impares, con la excepción del hidrógeno. Esta regla argumenta que los elementos con números atómicos impares tienen un protón no apareado y es más probable que capturen otro, aumentando así su número atómico. En elementos con números atómicos pares, los protones están emparejados, con cada miembro del par compensando el giro del otro, mejorando la estabilidad.[44][45][46] Todos los metales alcalinos tienen números atómicos impares y no son tan comunes como los elementos con números atómicos pares adyacentes (los gases nobles y los metales alcalinotérreos) en el Sistema Solar. Los metales alcalinos más pesados también son menos abundantes que los más ligeros, ya que los metales alcalinos a partir del rubidio en adelante solo pueden sintetizarse en supernovas y no en nucleosíntesis estelar. El litio también es mucho menos abundante que el sodio y el potasio, ya que se sintetiza poco en la nucleosíntesis del Big Bang y en las estrellas: el Big Bang solo puede producir trazas de litio, berilio y boro debido a la ausencia de un núcleo estable con 5 u 8 nucleones, y la nucleosíntesis estelar solo podrían pasar este cuello de botella por el proceso triple alfa, fusionando tres núcleos de helio para formar carbono y saltando sobre esos tres elementos.[47]
En la Tierra[editar]
La Tierra se formó a partir de la misma nube de materia que formó el Sol, pero los planetas adquirieron diferentes composiciones durante la formación y evolución del sistema solar. A su vez, la historia natural de la Tierra provocó que partes de este planeta tuvieran diferentes concentraciones de los elementos. La masa de la Tierra es aproximadamente 5.98 ×1024 kg. Se compone principalmente de hierro (32.1%), oxígeno (30.1%), silicio (15.1%), magnesio (13.9%), azufre (2.9%), níquel (1.8%), calcio (1.5%) y aluminio (1,4%); El 1,2% restante consiste en pequeñas cantidades de otros elementos. Debido a la diferenciación planetaria, se cree que la región central está compuesta principalmente de hierro (88.8%), con pequeñas cantidades de níquel (5.8%), azufre (4.5%) y menos de 1% de oligoelementos.[48]
Los metales alcalinos, debido a su alta reactividad, no aparecen de forma natural en estado puro. Son litófilos y, por lo tanto, permanecen cerca de la superficie de la Tierra porque se combinan fácilmente con el oxígeno y, por lo tanto, se asocian fuertemente con el sílice, formando minerales de densidad relativamente baja que no se hunden en el núcleo de la Tierra. El potasio, el rubidio y el cesio también son elementos incompatibles debido a sus grandes radios iónicos.[49]
El sodio y el potasio son muy abundantes en la tierra, ambos se encuentran entre los diez elementos más comunes en la corteza terrestre;[50][51] el sodio constituye aproximadamente el 2,6% del peso de la corteza terrestre, convirtiéndolo en el sexto elemento más abundante y el metal alcalino más abundante. El potasio constituye aproximadamente el 1.5% de la corteza terrestre y es el séptimo elemento más abundante. El sodio se encuentra en muchos minerales diferentes, de los cuales el más común es la sal ordinaria (cloruro de sodio), que se produce en grandes cantidades disueltas en el agua de mar. Otros depósitos sólidos incluyen halita, anfíbol, criolita, nitratina y zeolita. Muchos de estos depósitos sólidos se producen como resultado de la evaporación de los antiguos mares, que todavía se producen ahora en lugares como el Gran Lago Salado de Utah y el mar Muerto. A pesar de su abundancia casi igual en la corteza terrestre, el sodio es mucho más común que el potasio en el océano, tanto porque el mayor tamaño del potasio hace que sus sales sean menos solubles, como porque el potasio está ligado por silicatos en el suelo y las lixiviaciones de potasio se absorben mucho más fácilmente por vida vegetal que el sodio.

A pesar de su similitud química, el litio generalmente no se produce junto con el sodio o el potasio debido a su menor tamaño. Debido a su reactividad relativamente baja, se puede encontrar en agua de mar en grandes cantidades; su concentración estimada en el agua de mar es de aproximadamente 0,14 a 0,25 partes por millón (ppm)[52][53] o 25 micromolar.[54] Su relación diagonal con el magnesio a menudo le permite reemplazar el magnesio en minerales de ferromagnesio, donde su concentración en la corteza es de aproximadamente 18 ppm, comparable a la del galio y el niobio. Comercialmente, el mineral de litio más importante es la espodumena, que se encuentra en grandes depósitos en todo el mundo.
El rubidio es aproximadamente tan abundante como el zinc y más abundante que el cobre. Se produce naturalmente en los minerales de leucita, polucita, carnalita, zinnwaldite, y lepidolita,[55] aunque ninguno de estos contienen solamente rubidio y no hay otros metales alcalinos. El cesio es más abundante que algunos elementos comúnmente conocidos, como el antimonio, el cadmio, el estaño y el tungsteno, pero es mucho menos abundante que el rubidio.[56]
El francio-223, el único isótopo natural del francio,[57][58] es el producto de la desintegración alfa del actinio-227 y se puede encontrar en pequeñas cantidades en los minerales de uranio.[59] En una muestra dada de uranio, se estima que hay solo un átomo de francio por cada 1018 átomos de uranio.[60][61] Se ha calculado que hay como máximo 30 g de francio en la corteza terrestre en cualquier momento, debido a su vida media extremadamente corta de 22 minutos.[62][63]
Propiedades[editar]
Físicas y químicas[editar]
Las propiedades físicas y químicas de los metales alcalinos se pueden explicar fácilmente por tener una configuración de electrones de valencia ns1, lo que da como resultado un enlace metálico débil. Por lo tanto, todos los metales alcalinos son blandos y tienen bajas densidades,[64] puntos de fusión[64] y ebullición,[64] así como también temperaturas de sublimación, vaporización y disociación. Todos cristalizan en la estructura de cristal cúbico centrada en el cuerpo, y tienen colores de llama distintivos porque su electrón externo se excita muy fácilmente. La configuración ns1 también da como resultado que los metales alcalinos tengan radios atómicos e iónicos muy grandes, así como una conductividad térmica y eléctrica muy alta. Su química está dominada por la pérdida de su electrón de valencia solitario en el orbital-s más externo para formar el estado de oxidación +1, debido a la facilidad de ionización de este electrón y la muy alta energía de segunda ionización. La mayor parte de la química se ha observado solo para los primeros cinco miembros del grupo. La química del francio no está bien establecida debido a su radioactividad extrema;[64] por tanto, la presentación de sus propiedades aquí es limitada. Lo poco que se sabe sobre el francio muestra que tiene un comportamiento muy cercano al cesio, como se esperaba.
| Nombre | Litio | Sodio | Potasio | Rubidio | Cesio | Francio |
|---|---|---|---|---|---|---|
| Número atómico | 3 | 11 | 19 | 37 | 55 | 87 |
| Peso atómico (u)[nota 2][67][68] | 6.94(1)[nota 3] | 22.98976928(2) | 39.0983(1) | 85.4678(3) | 132.9054519(2) | [223][nota 4] |
| Configuración electrónica | [He] 2s1 | [Ne] 3s1 | [Ar] 4s1 | [Kr] 5s1 | [Xe] 6s1 | [Rn] 7s1 |
| Punto de fusión (°C) | 180.54 | 97.72 | 63.38 | 39.31 | 28.44 | ? |
| Punto de ebullición (°C) | 1342 | 883 | 759 | 688 | 671 | ? |
| Densidad (g·cm−3) | 0.534 | 0.968 | 0.89 | 1.532 | 1.93 | ? |
| Entalpía de fusión (kJ·mol−1) | 3.00 | 2.60 | 2.321 | 2.19 | 2.09 | ? |
| Entalpía de vaporización (kJ·mol−1) | 136 | 97.42 | 79.1 | 69 | 66.1 | ? |
| Entalpía de formación de un gas monoatómico (kJ·mol−1) | 162 | 108 | 89.6 | 82.0 | 78.2 | ? |
| Conductividad eléctrica a 25 °C (nΩ·cm) | 94.7 | 48.8 | 73.9 | 131 | 208 | ? |
| Radio atómico (pm) | 152 | 186 | 227 | 248 | 265 | ? |
| Radio iónico de un ion M+ hexacoordinado (pm) | 76 | 102 | 138 | 152 | 167 | ? |
| Primera energía de inonización (kJ·mol−1) | 520.2 | 495.8 | 418.8 | 403.0 | 375.7 | 392.8 |
| Afinidad electrónica (kJ·mol−1) | 59.62 | 52.87 | 48.38 | 46.89 | 45.51 | ? |
| Entalpía de disociación del M2 (kJ·mol−1) | 106.5 | 73.6 | 57.3 | 45.6 | 44.77 | ? |
| Escala de Pauling | 0.98 | 0.93 | 0.82 | 0.82 | 0.79 | ? |
| Potencial normal de electrodo (E°(M+→M0); V) | −3.04 | −2.71 | −2.93 | −2.98 | -3.03 | ? |
| Color de llama
Longitud de onda de emisión / absorción principal (nm) |
Carmesí 670.8 |
Amarillo 589.2 |
Violeta 766.5 |
Rojo-violáceo 780.0 |
Azul
455.5 |
? |
Los metales alcalinos son más similares entre sí que los elementos de cualquier otro grupo entre sí.[69] De hecho, la similitud es tan grande que es bastante difícil separar el potasio, el rubidio y el cesio, debido a sus radios iónicos similares; El litio y el sodio son más distintos. Por ejemplo, al moverse hacia abajo de la tabla, todos los metales alcalinos conocidos muestran un aumento del radio atómico, disminución de la electronegatividad,[70] aumento de la reactividad,[69] y disminución de los puntos de fusión y ebullición,[70] así como los calores de fusión y vaporización. En general, sus densidades aumentan cuando más hacia abajo sea el grupo, con la excepción de que el potasio es menos denso que el sodio.[70] Una de las pocas propiedades de los metales alcalinos que no muestra una tendencia muy suave es su potencial de reducción: el valor del litio es anómalo, siendo más negativo que los demás..Esto se debe a que el ion Li + tiene una energía de hidratación muy alta en la fase gaseosa: aunque el ion de litio altera significativamente la estructura del agua, causando un cambio mayor en la entropía, esta energía de hidratación alta es suficiente para hacer que los potenciales de reducción lo indiquen como siendo el metal alcalino más electropositivo, a pesar de la dificultad de ionizarlo en la fase gaseosa.
Los metales alcalinos estables son todos de color plateado, excepto el cesio, que tiene un tinte dorado pálido:[71] es uno de los tres metales que están claramente coloreados (los otros dos son cobre y oro). Además, los metales alcalinotérreos pesados calcio, estroncio y bario, así como los lantánidos divalentes europio e iterbio son de color amarillo pálido, aunque el color es mucho menos prominente que el del cesio. Su brillo se empaña rápidamente en el aire debido a la oxidación.[72] Todos presentan un sistema cristalino cúbico, y tienen colores de llama distintivos porque su electrón externo se excita muy fácilmente. De hecho, estos colores de prueba de llama son la forma más común de identificarlos, ya que todas sus sales con iones comunes son solubles.
Todos los metales alcalinos son altamente reactivos y nunca se encuentran en formas elementales en la naturaleza.[73] Debido a esto, generalmente se almacenan en aceite mineral o queroseno (aceite de parafina).[74] Reaccionan agresivamente con los halógenos para formar los haluros de metales alcalinos, que son compuestos cristalinos iónicos blancos que son todos solubles en agua excepto el fluoruro de litio (Li F).[75] Los metales alcalinos también reaccionan con el agua para formar hidróxidos fuertemente alcalinos y, por lo tanto, deben manipularse con mucho cuidado. Los metales alcalinos más pesados reaccionan más vigorosamente que los más ligeros; por ejemplo, cuando cae al agua, el cesio produce una explosión mayor que el potasio si se usa la misma cantidad de moles de cada metal.[75][76][77] Los metales alcalinos tienen las primeras energías de ionización más bajas en sus respectivos períodos de la tabla periódica[78] debido a su baja carga nuclear efectiva[75] y la capacidad de lograr una configuración de gas noble al perder solo un electrón.[75] Los metales alcalinos no solo reaccionan con el agua, sino también con los donantes de protones como los alcoholes y fenoles, el amoníaco gaseoso y los alquinos, lo último demuestra el grado fenomenal de su reactividad. Su gran poder como agentes reductores los hace muy útiles para liberar otros metales de sus óxidos o haluros.
La segunda energía de ionización de todos los metales alcalinos es muy alta[79][80] ya que está en una capa completa que también está más cerca del núcleo;[79] tanto, casi siempre pierden un solo electrón, formando cationes. Los alcalinos son una excepción, son compuestos inestables que contienen metales alcalinos en un estado de oxidación -1, lo cual es muy inusual ya que antes del descubrimiento de los alcalinos, no se esperaba que los metales alcalinos pudieran formar aniones y se pensaba que eran capaz de aparecer en sales solo como cationes. Los aniones alcalinos tienen subcapas-s llenas, lo que les da suficiente estabilidad para existir. Se sabe que todos los metales alcalinos estables, excepto el litio, pueden formar alcalinos,[81][82][83] y los alcalinos tienen mucho interés teórico debido a su inusual estequiometría y bajos potenciales de ionización. Los alcalidos son químicamente similares a los electruros, que son sales con electrones atrapados que actúan como aniones.[84] Un ejemplo particularmente llamativo de un alcalino es el "hidruro de sodio inverso", H+Na- (ambos iones complejados), a diferencia del hidruro de sodio habitual, Na+H-[85] es inestable de forma aislada, debido a su alta energía resultante del desplazamiento de dos electrones de hidrógeno a sodio, aunque se predice que varios derivados son metaestables o estables.[85][86]
En solución acuosa, los iones de metales alcalinos forman iones aqua de la fórmula [M (H2O)n]+, donde n es el número de solvatación. Sus números de coordinación y formas concuerdan bien con los que se esperan de sus radios iónicos. En solución acuosa, se dice que las moléculas de agua unidas directamente al ion metálico pertenecen a la primera esfera de coordinación, también conocida como la primera capa de solvatación, o primaria. El enlace entre una molécula de agua y el ion metálico es un enlace covalente dativo, con el átomo de oxígeno que dona ambos electrones al enlace. Cada molécula de agua coordinada puede estar unida por enlaces de hidrógeno a otras moléculas de agua. Se dice que estos últimos residen en la segunda esfera de coordinación. Sin embargo, para los cationes de metales alcalinos, la segunda esfera de coordinación no está bien definida ya que la carga +1 en el catión no es lo suficientemente alta como para polarizar las moléculas de agua en la capa de solvatación primaria lo suficiente como para que formen fuertes enlaces de hidrógeno con aquellos en la segunda esfera de coordinación, produciendo una entidad más estable.[87] Se ha determinado experimentalmente que el número de solvatación para Li + es 4, formando el tetraédrico [Li (H2O)4]+ ; mientras que se han encontrado números de solvatación de 3 a 6 para iones de litio, los números de solvatación menores que 4 pueden ser el resultado de la formación de pares de iones de contacto y los números de solvatación más altos pueden interpretarse en términos de moléculas de agua que se aproximan a [Li (H2O)4]+ a través de una cara del tetraedro, aunque las simulaciones dinámicas moleculares pueden indicar la existencia de un ion hexaaqua octaédrico . También hay probablemente seis moléculas de agua en la esfera de solvatación primaria del ion sodio, que forman el ion octaédrico [Na (H2O)6]+.[88][89] : 126–127 Si bien anteriormente se pensaba que los metales alcalinos más pesados también formaban iones hexaaqua octaédricos, desde entonces se descubrió que el potasio y el rubidio probablemente forman los iones [K (H2O)8]+ y [Rb (H2O)8]+, que tienen la estructura antiprismática cuadrada, y que el cesio forma el ion de 12 coordenadas [Cs (H2O)12]+ .[90]
Litio[editar]
La química del litio muestra varias diferencias con respecto al resto del grupo, ya que el pequeño catión Li + polariza los aniones y le da a sus compuestos un carácter más covalente.[91] El litio y el magnesio tienen una relación diagonal debido a sus radios atómicos similares,[91] por lo que muestran algunas similitudes. Por ejemplo, el litio forma un nitruro estable, una propiedad común entre todos los metales alcalinotérreos (grupo del magnesio) pero única entre los metales alcalinos.[92] Además, entre sus respectivos grupos, solo el litio y el magnesio forman compuestos organometálicos con un carácter covalente significativo[93]
El fluoruro de litio es el único haluro de metal alcalino que es poco soluble en agua,[94] y el hidróxido de litio es el único hidróxido de metal alcalino que no es delicuescente.[94] Por el contrario, el perclorato de litio y otras sales de litio con aniones grandes que no pueden polarizarse son mucho más estables que los compuestos análogos de los otros metales alcalinos, probablemente porque Li + tiene una alta energía de solvatación. Este efecto también significa que la mayoría de las sales de litio simples se encuentran comúnmente en forma hidratada, porque las formas anhidras son extremadamente higroscópicas, esto permite que sales como el cloruro de litio y el bromuro de litio se utilicen en deshumidificadores y acondicionadores de aire.
Francio[editar]
Se predice que el francio muestre algunas diferencias debido a su alto peso atómico, lo que hace que sus electrones viajen a fracciones considerables de la velocidad de la luz y, por lo tanto, hacen que los efectos relativistas sean más prominentes. En contraste con la tendencia a la disminución de las electronegatividades y las energías de ionización de los metales alcalinos, se predice que la electronegatividad del francio y la energía de ionización serán más altas que las del cesio debido a la estabilización relativista de los electrones 7s; Además, se espera que su radio atómico sea anormalmente bajo. Por lo tanto, contrario a lo esperado, el cesio es el más reactivo de los metales alcalinos, no el francio.[95][96] : 1729 [97] Todas las propiedades físicas conocidas del francio también se desvían de las tendencias claras que van del litio al cesio, como la primera energía de ionización, la afinidad electrónica y la polarización del anión, aunque debido a la escasez de datos conocidos sobre el francio, muchas fuentes dan valores extrapolados, ignorando que Los efectos relativistas hacen que la tendencia del litio al cesio se vuelva inaplicable en el francio.[97] Algunas de las pocas propiedades del francio que se han predicho teniendo en cuenta la relatividad son la afinidad electrónica (47.2 kJ / mol)[98] y la entalpía de disociación de la molécula Fr 2 (42.1 kJ / mol).[99] La molécula CsFr está polarizada como Cs+Fr-, lo que muestra que la subcapa 7s de francio se ve mucho más afectada por los efectos relativistas que la subcapa 6s de cesio.[97] Además, se espera que el superóxido de francio (FrO2) tenga un carácter covalente significativo, a diferencia de los otros superóxidos de metales alcalinos, debido a las contribuciones de enlace de los electrones 6p del francio.[97]
Nucleares[editar]
| Z | Metal alcalino | Estable | Decadencia | inestable: cursiva | ||
|---|---|---|---|---|---|---|
| 3 | litio | 2 | - | 7Li | 6Li | |
| 11 | sodio | 1 | - | 23Na | ||
| 19 | potasio | 2 | 1 | 39K | 41K | 40K |
| 37 | rubidio | 1 | 1 | 85Rb | 87Rb | |
| 55 | cesio | 1 | - | 133Cs | ||
| 87 | francio | - | - | No hay isótopos primordiales
(223Fr es un nucleido radiogénico) | ||
| Radioactivo: 40K, t1/2 1.25 × 109 años; 87Rb, t1/2 4.9 × 1010 años; 223Fr, t1/2 22.0 min. | ||||||
Todos los metales alcalinos tienen números atómicos impares; por lo tanto, sus isótopos deben ser impares-impares (tanto el número de protones como el de neutrones son impares) o impares-pares (el número de protones es impar, pero el número de neutrones es par). Los núcleos impares tienen números de masa pares, mientras que los núcleos impares tienen números de masa impares. Los nucleidos primordiales impares e impares son raros porque la mayoría de los núcleos impares e impares son muy inestables con respecto a la desintegración beta, porque los productos de desintegración son pares e incluso, y por lo tanto están más fuertemente unidos, debido a los efectos de emparejamiento nuclear.[100]
Debido a la gran rareza de los núcleos impares e impares, casi todos los isótopos primordiales de los metales alcalinos son pares e impares (con la excepción del isótopo estable a la luz litio-6 y el radioisótopo potásico-40 de larga vida). Para un número de masa impar dado, solo puede haber un único nucleido beta estable, ya que no hay una diferencia en la energía de unión entre pares-impares e impares, incluso comparable a la de pares-pares e impares-impares, dejando otros nucleidos del mismo número de masa (isobaras) libre de desintegración beta hacia el nucleido de menor masa. Un efecto de la inestabilidad de un número impar de cualquiera de los tipos de nucleones es que los elementos con números impares, como los metales alcalinos, tienden a tener menos isótopos estables que los elementos con números pares. De los 26 elementos monoisotópicos que tienen un solo isótopo estable, todos menos uno tienen un número atómico impar y todos menos uno también tienen un número par de neutrones. El berilio es la única excepción a ambas reglas, debido a su bajo número atómico.[101]
Todos los metales alcalinos, excepto el litio y el cesio, tienen al menos un radioisótopo natural: sodio-22 y sodio-24 son trazas de radioisótopos producidos cosmogénicamente,[102] potasio-40 y rubidio-87 tienen vidas medias muy largas y, por lo tanto, ocurren de forma natural, y todos los isótopos de francio son radiactivos. También se pensó que el cesio era radiactivo a principios del siglo XX,[103][104] aunque no tiene radioisótopos naturales.[105] (El francio aún no había sido descubierto en ese momento). El radioisótopo natural de larga duración del potasio, el potasio-40, constituye aproximadamente el 0.012% del potasio natural,[106] y por lo tanto el potasio natural es débilmente radiactivo. Esta radiactividad natural se convirtió en una base para una afirmación errónea del descubrimiento del elemento 87 (el próximo metal alcalino después del cesio) en 1925.[29][107] El rubidio natural es similarmente ligeramente radiactivo, con un 27.83% siendo el radioisótopo de larga duración rubidio-87.
El Cesio-137, con una vida media de 30.17 años, es uno de los dos principales productos de fisión de vida media, junto con el estroncio-90, que son responsables de la mayor parte de la radiactividad del combustible nuclear gastado después de varios años de enfriamiento, hasta varios cientos de años después de su uso. Constituye la mayor parte de la radiactividad que aún queda del accidente de Chernobyl. El cesio-137 sufre una desintegración beta de alta energía y finalmente se convierte en bario-137 estable. Es un fuerte emisor de radiación gamma. El cesio-137 tiene una tasa muy baja de captura de neutrones y no se puede eliminar de esta manera, pero se debe permitir que se descomponga.[108] El cesio-137 se ha utilizado como marcador en estudios hidrológicos, análogo al uso de tritio.[109] Se liberaron pequeñas cantidades de cesio-134 y cesio-137 al medio ambiente durante casi todas las pruebas de armas nucleares y algunos accidentes nucleares, especialmente el accidente de Goiânia y el desastre de Chernobyl. A partir de 2005, el cesio-137 es la principal fuente de radiación en la zona de alienación alrededor de la central nuclear de Chernobyl.[110] Sus propiedades químicas como uno de los metales alcalinos lo convierten en uno de los productos de fisión más problemáticos de corta a media vida porque se mueve y se propaga fácilmente en la naturaleza debido a la alta solubilidad en agua de sus sales, y es absorbido por el cuerpo, que lo confunde con sus congéneres esenciales de sodio y potasio.[111] : 114
Tendencias periódicas[editar]
Los metales alcalinos son más similares entre sí que los elementos de cualquier otro grupo.[112] Por ejemplo, al moverse hacia abajo de la tabla, todos los metales alcalinos conocidos muestran un aumento del radio atómico,[113] disminución de la electronegatividad,[113] aumento de la reactividad,[112] y disminución de los puntos de fusión y ebullición,[113] así como los calores de fusión y vaporización. En general, sus densidades aumentan cuando bajan de la mesa, con la excepción de que el potasio es menos denso que el sodio.[113]
Radios atómicos e iónicos[editar]

Los radios atómicos de los metales alcalinos aumentan bajando el grupo.[114] Debido al efecto de protección, cuando un átomo tiene más de una capa de electrones, cada electrón siente repulsión eléctrica de los otros electrones, así como atracción eléctrica del núcleo.[115] En los metales alcalinos, el electrón más externo solo siente una carga neta de +1, ya que parte de la carga nuclear (que es igual al número atómico) es cancelada por los electrones internos; El número de electrones internos de un metal alcalino es siempre uno menos que la carga nuclear. Por lo tanto, el único factor que afecta el radio atómico de los metales alcalinos es el número de capas de electrones. Como este número aumenta en el grupo, el radio atómico también debe aumentar en el grupo.[114]
Los radios iónicos de los metales alcalinos son mucho más pequeños que sus radios atómicos. Esto se debe a que el electrón más externo de los metales alcalinos está en una capa de electrones diferente a la de los electrones internos y, por lo tanto, cuando se elimina, el átomo resultante tiene una capa de electrones menos y es más pequeño. Además, la carga nuclear efectiva ha aumentado y, por lo tanto, los electrones son atraídos con mayor fuerza hacia el núcleo y el radio iónico disminuye.[116]
Primera energía de Ionización[editar]
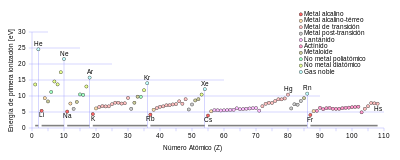
La primera energía de ionización de un elemento o molécula es la energía requerida para mover el electrón más suelto de un mol de átomos gaseosos del elemento o moléculas para formar un mol de iones gaseosos con carga eléctrica +1. Los factores que afectan la primera energía de ionización son la carga nuclear, la cantidad de blindaje de los electrones internos y la distancia desde el electrón más débilmente sostenido desde el núcleo, que siempre es un electrón externo en los elementos del grupo principal. Los primeros dos factores cambian la carga nuclear efectiva que siente el electrón más suelto. Dado que el electrón más externo de los metales alcalinos siempre siente la misma carga nuclear efectiva (+1), el único factor que afecta la primera energía de ionización es la distancia desde el electrón más externo al núcleo. Como esta distancia aumenta en el grupo, el electrón más externo siente menos atracción del núcleo y, por lo tanto, la primera energía de ionización disminuye.[117] (Esta tendencia se rompe en el francio debido a la estabilización relativista y la contracción del orbital 7s, lo que acerca el electrón de valencia del francio más cerca del núcleo de lo que se esperaría de los cálculos no relativistas. Esto hace que el electrón más externo del francio sienta más atracción del núcleo, aumentando su primera energía de ionización ligeramente más allá de la del cesio).[118] : 1729
La segunda energía de ionización de los metales alcalinos es mucho más alta que la primera, ya que el segundo electrón más suelto es parte de una capa de electrones completamente llena y, por lo tanto, es difícil de eliminar.[119]
Reactividad[editar]
Las reactividades de los metales alcalinos aumentan bajando el grupo. Este es el resultado de una combinación de dos factores: las primeras energías de ionización y las energías de atomización de los metales alcalinos. Debido a que la primera energía de ionización de los metales alcalinos disminuye en el grupo, es más fácil que el electrón más externo se elimine del átomo y participe en las reacciones químicas, aumentando así la reactividad en el grupo. La energía de atomización mide la fuerza del enlace metálico de un elemento, que cae en el grupo a medida que los átomos aumentan en radio y, por lo tanto, el enlace metálico debe aumentar en longitud, haciendo que los electrones deslocalizados se alejen más de la atracción de los núcleos de los núcleos más pesados de los metales alcalinos. Agregar las energías de atomización y primera ionización da una cantidad estrechamente relacionada (pero no igual a) la energía de activación de la reacción de un metal alcalino con otra sustancia. Esta cantidad disminuye bajando por el grupo, y también lo hace la energía de activación; por lo tanto, las reacciones químicas pueden ocurrir más rápido y la reactividad aumenta en el grupo.[120]
Electronegatividad[editar]

La electronegatividad es una propiedad química que describe la tendencia de un átomo o un grupo funcional de atraer electrones (o densidad de electrones) hacia sí mismo.[121] Si el enlace entre el sodio y el cloro en el cloruro de sodio fuera covalente, el par de electrones compartidos se sentiría atraído por el cloro porque la carga nuclear efectiva en los electrones externos es +7 en cloro pero solo es +1 en sodio. El par de electrones se atrae tan cerca del átomo de cloro que prácticamente se transfieren al átomo de cloro (un enlace iónico). Sin embargo, si el átomo de sodio fue reemplazado por un átomo de litio, los electrones no serán atraídos tan cerca del átomo de cloro como antes porque el átomo de litio es más pequeño, haciendo que el par de electrones se atraiga más fuertemente a la carga nuclear efectiva más cercana del litio. Por lo tanto, los átomos de metal alcalino más grandes (más abajo en el grupo) serán menos electronegativos ya que el par de enlace es menos atraído hacia ellos. Se espera que el francio sea una excepción.[122]
Debido a la mayor electronegatividad del litio, algunos de sus compuestos tienen un carácter más covalente. Por ejemplo, el yoduro de litio (Li I) se disolverá en solventes orgánicos, una propiedad de la mayoría de los compuestos covalentes.[123] El fluoruro de litio (Li F) es el único haluro alcalino que no es soluble en agua,[124] y el hidróxido de litio (Li OH) es el único hidróxido de metal alcalino que no es delicuescente.[124]
Puntos de fusión y ebullición[editar]
El punto de fusión de una sustancia es el punto donde cambia de estado sólido a líquido, mientras que el punto de ebullición de una sustancia (en estado líquido) es el punto donde la presión de vapor del líquido es igual a la presión ambiental que rodea al líquido[125][126] y todo el líquido cambia de estado a gas. Cuando un metal se calienta hasta su punto de fusión, los enlaces metálicos que mantienen los átomos en su lugar se debilitan para que los átomos puedan moverse, y los enlaces metálicos finalmente se rompen por completo en el punto de ebullición del metal.[127][128] Por lo tanto, la caída de los puntos de fusión y ebullición de los metales alcalinos indica que la resistencia de los enlaces metálicos de los metales alcalinos disminuye en el grupo.[127] Esto se debe a que los átomos de metal se mantienen unidos por la atracción electromagnética de los iones positivos a los electrones deslocalizados.[127][128] A medida que los átomos aumentan de tamaño bajando por el grupo (debido a que aumenta su radio atómico), los núcleos de los iones se alejan más de los electrones deslocalizados y, por lo tanto, el enlace metálico se debilita para que el metal se derrita y hierva más fácilmente, bajando así los puntos de fusión y ebullición.[127] (El aumento de la carga nuclear no es un factor relevante debido al efecto de blindaje).[127]
Densidad[editar]
Todos los metales alcalinos tienen la misma estructura cristalina (cúbica centrada en el cuerpo) y, por lo tanto, los únicos factores relevantes son el número de átomos que pueden caber en un determinado volumen y la masa de uno de los átomos, ya que la densidad se define como masa por unidad de volumen. El primer factor depende del volumen del átomo y, por lo tanto, del radio atómico, que aumenta al descender el grupo; así, el volumen de un átomo de metal alcalino aumenta al descender el grupo. La masa de un átomo de metal alcalino también aumenta al descender el grupo. Por lo tanto, la tendencia de las densidades de los metales alcalinos depende de sus pesos atómicos y radios atómicos; si se conocen las cifras de estos dos factores, se pueden calcular las relaciones entre las densidades de los metales alcalinos. La tendencia resultante es que las densidades de los metales alcalinos aumentan en la tabla, con la excepción del potasio. Debido a que tienen el peso atómico más bajo y el radio atómico más grande de todos los elementos en sus períodos, los metales alcalinos son los metales menos densos en la tabla periódica.[129] El litio, el sodio y el potasio son los únicos tres metales en la tabla periódica que son menos densos que el agua:[130] de hecho, el litio es el sólido menos denso conocido a temperatura ambiente.
Compuestos[editar]
Los metales alcalinos forman una serie completa de compuestos con todos los aniones generalmente encontrados, que ilustran bien las tendencias del grupo. Se puede describir que estos compuestos involucran a los metales alcalinos que pierden electrones a las especies aceptoras y forman iones monopositivos. Esta descripción es más precisa para haluros alcalinos y se vuelve cada vez menos precisa a medida que aumenta la carga catiónica y aniónica, y a medida que el anión se hace más grande y más polarizable. Por ejemplo, la unión iónica da paso a la unión metálica a lo largo de las series NaCl, Na2O, Na2S, Na3P, Na3As, Na3Sb, Na3Bi
Hidróxidos[editar]

Todos los metales alcalinos reaccionan vigorosa o explosivamente con agua fría, produciendo una solución acuosa de un hidróxido de metal alcalino fuertemente básico y liberando gas hidrógeno.[131] Esta reacción se vuelve más vigorosa al descender por el grupo, el litio reacciona constantemente con efervescencia, pero el sodio y el potasio pueden encenderse y el rubidio y el cesio se hunden en el agua y generan gas hidrógeno con tanta rapidez que se forman ondas de choque en el agua que pueden romper los envases de vidrio.[132] Cuando un metal alcalino se cae al agua, produce una explosión, de las cuales hay dos etapas separadas. El metal reacciona primero con el agua, rompiendo los enlaces de hidrógeno en el agua y produciendo hidrógeno gaseoso; esto ocurre más rápido para los metales alcalinos más pesados más reactivos. En segundo lugar, el calor generado por la primera parte de la reacción a menudo enciende el gas hidrógeno, haciendo que se queme explosivamente en el aire circundante. Esta explosión secundaria de gas de hidrógeno produce la llama visible sobre el tazón de agua, lago u otro cuerpo de agua, no la reacción inicial del metal con agua (que tiende a ocurrir principalmente bajo el agua).[133] Los hidróxidos de metales alcalinos son los hidróxidos más básicos conocidos.
Investigaciones recientes han sugerido que el comportamiento explosivo de los metales alcalinos en el agua es impulsado por una explosión de Coulomb y no solo por la generación rápida de hidrógeno.[134] Todos los metales alcalinos se funden como parte de la reacción con agua. Las moléculas de agua ionizan la superficie metálica desnuda del metal líquido, dejando una superficie metálica cargada positivamente y iones de agua cargados negativamente. La atracción entre el metal cargado y los iones de agua aumentará rápidamente el área superficial, causando un aumento exponencial de la ionización. Cuando las fuerzas repulsivas dentro de la superficie del metal líquido exceden las fuerzas de la tensión superficial, explota vigorosamente.[134]
Los hidróxidos mismos son los hidróxidos más básicos conocidos, reaccionan con ácidos para dar sales y con alcoholes para dar alcóxidos oligoméricos. Reaccionan fácilmente con dióxido de carbono para formar carbonatos o bicarbonatos, o con sulfuro de hidrógeno para formar sulfuros o bisulfuros, y pueden usarse para separar los tioles del petróleo. Reaccionan con óxidos anfóteros: por ejemplo, los óxidos de aluminio, zinc, estaño y plomo reaccionan con los hidróxidos de metales alcalinos para dar aluminatos, zincatos, estannatos y plomería. El dióxido de silicio es ácido y, por lo tanto, los hidróxidos de metales alcalinos también pueden atacar al vidrio de silicato.
Compuestos intermetalicos[editar]

Los metales alcalinos forman muchos compuestos intermetálicos entre sí y los elementos de los grupos 2 a 13 en la tabla periódica de estequiometrías variables, tales como las amalgamas de sodio con mercurio, incluyendo Na5Hg8 y Na3Hg.[135] Algunos de estos tienen características iónicas: tomar las aleaciones con oro, el metal más electronegativo, por ejemplo, NaAu y KAu son metálicos, pero RbAu y CsAu son semiconductores. El NaK es una aleación de sodio y potasio que es muy útil porque es líquido a temperatura ambiente, aunque se deben tomar precauciones debido a su extrema reactividad hacia el agua y el aire. La mezcla eutéctica se derrite a −12,6 °C.[136] Una aleación de 41% de cesio, 47% de sodio y 12% de potasio tiene el punto de fusión más bajo conocido de cualquier metal o aleación, −78 °C.[137]
Compuestos con los elementos del grupo 13[editar]
Los compuestos intermetálicos de los metales alcalinos con los elementos más pesados del grupo 13 (aluminio, galio, indio y talio), como NaTl, son conductores pobres o semiconductores, a diferencia de las aleaciones normales con los elementos anteriores, lo que implica que el metal alcalino involucrado tiene perdió un electrón a los aniones Zintl involucrados.[138] Sin embargo, mientras que los elementos del grupo 14 y más allá tienden a formar grupos aniónicos discretos, los elementos del grupo 13 tienden a formar iones poliméricos con los cationes de metales alcalinos ubicados entre la red iónica gigante. Por ejemplo, NaTl consiste en un anión polimérico (—Tl - -)n con una estructura cúbica de diamante covalente con iones Na + ubicados entre la red aniónica. Los metales alcalinos más grandes no pueden encajar de manera similar en una red aniónica y tienden a forzar a los elementos más pesados del grupo 13 a formar grupos aniónicos.[139]
El boro es un caso especial, ya que es el único no metal en el grupo 13. Los boruros de metales alcalinos tienden a ser ricos en boro, lo que implica una unión apreciable de boro-boro que involucra estructuras deltaédricas, y son térmicamente inestables debido a que los metales alcalinos tienen una presión de vapor muy alta a temperaturas elevadas. Esto hace que la síntesis directa sea problemática porque los metales alcalinos no reaccionan con el boro por debajo de 700 °C, y por lo tanto esto debe lograrse en contenedores sellados con el metal alcalino en exceso. Además, excepcionalmente en este grupo, la reactividad con boro disminuye en el grupo: el litio reacciona completamente a 700 °C, pero sodio a 900 °C y potasio no hasta 1200 °C, y la reacción es instantánea para el litio, pero lleva horas para el potasio. Los boruros de rubidio y cesio ni siquiera se han caracterizado. Se conocen varias fases, como LiB10, NaB6, NaB15 y KB6.[140][141] Bajo alta presión, la unión boro-boro en los boruros de litio cambia de seguir las reglas de Wade a formar aniones Zintl como el resto del grupo 13.[142]
Compuestos con los elementos del grupo 14[editar]

El litio y el sodio reaccionan con el carbono para formar acetiluros, Li2C2 y Na2C2, que también se pueden obtener por reacción del metal con acetileno. El potasio, el rubidio y el cesio reaccionan con el grafito; sus átomos se intercalan entre las capas de grafito hexagonal, formando compuestos de intercalación de grafito de fórmulas MC60 (gris oscuro, casi negro), MC48 (gris oscuro, casi negro), MC36 (azul), MC24 (azul acero) y MC8 (bronce) (M = K, Rb o Cs). Estos compuestos son más de 200 veces más conductores de electricidad que el grafito puro, lo que sugiere que el electrón de valencia del metal alcalino se transfiere a las capas de grafito (p. Ej. M+
C−
8).[143] Al calentar KC8, la eliminación de los átomos de potasio da como resultado la conversión en secuencia a KC24, KC36, KC48 y finalmente KC60 . KC8 es un agente reductor muy fuerte y es pirofórico y explota en contacto con el agua.[144][145] Mientras que los metales alcalinos más grandes (K, Rb y Cs) inicialmente forman MC8, los más pequeños inicialmente forman MC6, y de hecho requieren la reacción de los metales con grafito a altas temperaturas alrededor de 500 °C para formar.[146] Aparte de esto, los metales alcalinos son agentes reductores tan fuertes que incluso pueden reducir el buckminsterfullereno para producir fulleridos sólidos MnC60; el sodio, el potasio, el rubidio y el cesio pueden formar fulleridos donde n = 2, 3, 4 o 6, y el rubidio y el cesio adicionalmente pueden alcanzar n = 1.
Cuando los metales alcalinos reaccionan con los elementos más pesados en el grupo de carbono (silicio, germanio, estaño y plomo), se forman sustancias iónicas con estructuras en forma de jaula, como los siliciuros M4Si4 (M = K, Rb o Cs), que contiene M+ y iones tetraédricos Si4−
4.[147] La química de las germanidas de metales alcalinos, involucrando el ion germanida Ge4− y otros iones de racimo (Zintl) como Ge2−
4, Ge4−
9, Ge2−
9, y [(Ge9)2]6−, es en gran medida análogo al de los siliciuros correspondientes. Los estannuros de metales alcalinos son en su mayoría iónicos, a veces con el ion estannuro (Sn4−),[148] y a veces con iones Zintl más complejos como Sn4−
9, que aparece en el nonastanuro de tetrapotasio (K4Sn9 ).[149] El ion monatómico de la plomada (Pb4−) es desconocido, y de hecho se predice que su formación será energéticamente desfavorable; los plásmidos de metales alcalinos tienen iones Zintl complejos, como Pb4−
9. Estos germanuros, estannuros y plásmidos de metales alcalinos pueden producirse reduciendo germanio, estaño y plomo con sodio metálico en amoníaco líquido.
Nitruros y pnictidos[editar]

El litio, el más ligero de los metales alcalinos, es el único metal alcalino que reacciona con el nitrógeno en condiciones estándar, y su nitruro es el único nitruro de metal alcalino estable. El nitrógeno es un gas no reactivo porque romper el triple enlace fuerte en la molécula de dinitrógeno (N2) requiere mucha energía. La formación de un nitruro de metal alcalino consumiría la energía de ionización del metal alcalino (formando iones M+), la energía requerida para romper el triple enlace en N2 y la formación de iones N3−, y toda la energía liberada de la formación de un nitruro de metal alcalino proviene de la energía reticular del nitruro de metal alcalino. La energía de la red se maximiza con iones pequeños y altamente cargados; los metales alcalinos no forman iones altamente cargados, solo forman iones con una carga de +1, por lo que solo el litio, el metal alcalino más pequeño, puede liberar suficiente energía reticular para hacer que la reacción con nitrógeno sea exotérmica, formando nitruro de litio. Las reacciones de los otros metales alcalinos con nitrógeno no liberarían suficiente energía reticular y, por lo tanto, serían endotérmicas, por lo que no forman nitruros en condiciones estándar.[151] El nitruro de sodio (Na3N) y el nitruro de potasio (K3N), aunque existen, son extremadamente inestables, propensos a descomponerse nuevamente en sus elementos constituyentes, y no se pueden producir haciendo reaccionar los elementos entre sí en condiciones estándar.[152][153] El impedimento estérico prohíbe la existencia de rubidio o nitruro de cesio. Sin embargo, el sodio y el potasio forman sales de azida incoloras que involucran al anion N−
3 lineal; que debido al gran tamaño de los cationes de metales alcalinos, son térmicamente lo suficientemente estables como para poder fundirse antes de descomponerse.
Todos los metales alcalinos reaccionan fácilmente con fósforo y arsénico para formar fosfuros y arseniuros con la fórmula M3Pn (donde M representa un metal alcalino y Pn representa un picnógeno: fósforo, arsénico, antimonio o bismuto). Esto se debe al mayor tamaño de los iones P3- y As3-, por lo que se necesita liberar menos energía reticular para que se formen las sales.[154] Estos no son los únicos fosfuros y arseniuros de los metales alcalinos; por ejemplo, el potasio tiene nueve fosfuros conocidos diferentes, con fórmulas K3P, K4P3, K5P4, KP, K4P6, K3P7, K3P11, KP10.3 y KP15.[155] Mientras que la mayoría de los metales forman arseniuros, solo los metales alcalinos y alcalinotérreos forman principalmente arseniuros iónicos. La estructura del Na3As es compleja con distancias inusualmente cortas de Na-Na de 328-330 pm, que son más cortas que en el metal de sodio, y esto indica que incluso con estos metales electropositivos, la unión no puede ser directamente iónica. Se conocen otros arseniuros de metales alcalinos que no se ajustan a la fórmula M3As, como LiAs, que tiene un brillo metálico y conductividad eléctrica que indica la presencia de algún enlace metálico. Los antimonuros son inestables y reactivos ya que el ion Sb3 es un agente reductor fuerte; La reacción de los mismos con ácidos forma la estibina gaseosa tóxica e inestable (SbH3).[156] De hecho, tienen algunas propiedades metálicas, y los antimoniuros de metales alcalinos de la estequiometría MSb involucran átomos de antimonio unidos en una estructura en espiral de Zintl.[157] Los bismutidos ni siquiera son totalmente iónicos; son compuestos intermetálicos que contienen enlaces parcialmente metálicos y parcialmente iónicos.[158]
Óxidos[editar]
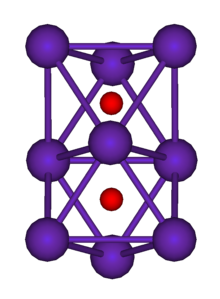
Todos los metales alcalinos reaccionan vigorosamente con oxígeno en condiciones estándar. Forman varios tipos de óxidos, tales como óxidos simples (que contienen el ion O2−), peróxidos (que contienen el ion O2−
2, donde hay un enlace simple entre los dos átomos de oxígeno), superóxidos (que contienen el ion O−
2), y muchos otros. El litio se quema en el aire para formar óxido de litio, pero el sodio reacciona con el oxígeno para formar una mezcla de óxido de sodio y peróxido de sodio. El potasio forma una mezcla de peróxido de potasio y superóxido de potasio, mientras que el rubidio y el cesio forman superóxidos exclusivamente. Su reactividad aumenta al descender el grupo: mientras que el litio, el sodio y el potasio simplemente se queman en el aire, el rubidio y el cesio son pirofóricos (se incendian espontáneamente en el aire).[159]
Los metales alcalinos más pequeños tienden a polarizar los aniones más grandes (peróxido y superóxido) debido a su pequeño tamaño. Esto atrae los electrones en los aniones más complejos hacia uno de sus átomos de oxígeno constituyentes, formando un ion óxido y un átomo de oxígeno. Esto hace que el litio forme un óxido exclusivamente en reacción con oxígeno a temperatura ambiente. Este efecto se vuelve drásticamente más débil para el sodio y el potasio más grandes, lo que les permite formar los peróxidos menos estables. El rubidio y el cesio, en la parte inferior del grupo, son tan grandes que incluso se pueden formar los superóxidos menos estables. Debido a que el superóxido libera la mayor cantidad de energía cuando se forma, el superóxido se forma preferentemente para los metales alcalinos más grandes donde los aniones más complejos no están polarizados. (Los óxidos y peróxidos para estos metales alcalinos existen, pero no se forman por reacción directa del metal con oxígeno en condiciones estándar).[160] Además, el pequeño tamaño de los iones Li+ y O2− contribuye a que formen una estructura reticular iónica estable. Sin embargo, bajo condiciones controladas, se sabe que todos los metales alcalinos, con la excepción del francio, forman sus óxidos, peróxidos y superóxidos. Los peróxidos y superóxidos de metales alcalinos son agentes oxidantes poderosos. El peróxido de sodio y el superóxido de potasio reaccionan con el dióxido de carbono para formar un carbonato de metal alcalino y el gas oxígeno, lo que les permite ser utilizados en purificadores de aire para submarinos; La presencia de vapor de agua, naturalmente presente en el aliento, hace que la eliminación de dióxido de carbono por el superóxido de potasio sea aún más eficiente.[161][162] Todos los metales alcalinos estables, excepto el litio, pueden formar ozónidos rojos (MO3) a través de la reacción a baja temperatura del hidróxido anhidro en polvo con ozono: los ozónidos se pueden extraer con amoníaco líquido.
El rubidio y el cesio pueden formar una gran variedad de suboxidos con los metales en estados de oxidación formales por debajo de +1. El rubidio puede formar Rb6O y Rb9O2 (color cobre) tras la oxidación en el aire, mientras que las formas de cesio una variedad inmensa de óxidos, tales como el ozónido OSC3[163][164] y varios colores brillantes subóxidos,[165] como Cs7O (bronce), Cs4O (rojo-violeta), Cs11O3 (violeta), Cs3O (verde oscuro),[166] CsO, Cs3O2,[167] también como Cs7O2.[168][169] El último de estos puede calentarse al vacío para generar Cs2O.[170]
Haluros, hidruros[editar]
Los metales alcalinos se encuentran entre los elementos más electropositivos en la tabla periódica y, por lo tanto, tienden a unirse iónicamente a los elementos más electronegativos en la tabla periódica, los halógenos (flúor, cloro, bromo, yodo y astatina), formando sales conocidas como haluros de metales alcalinos. La reacción es muy enérgica y a veces puede provocar explosiones. Se conocen los veinte haluros de metales alcalinos estables; Se desconocen los inestables, a excepción del astato de sodio, debido a la gran inestabilidad y rareza del astato y el francio. El más conocido de los veinte es sin duda el cloruro de sodio, también conocido como sal común. Todos los haluros de metales alcalinos estables tienen la fórmula MX (donde M es un metal alcalino y X es un halógeno). Todos son sólidos cristalinos iónicos blancos que tienen altos puntos de fusión.[171][172] Todos los haluros de metales alcalinos son solubles en agua, excepto el fluoruro de litio (LiF), que es insoluble en agua debido a su alta entalpía reticular. La alta entalpía reticular del fluoruro de litio se debe a los pequeños tamaños de los iones Li+ y F-, lo que hace que las interacciones electrostáticas entre ellos sean fuertes;[171] ocurre un efecto similar para el fluoruro de magnesio, consistente con la relación diagonal entre el litio y magnesio.
Complejos de coordinación[editar]

Los cationes de los metales alcalinos generalmente no forman complejos de coordinación con bases simples de Lewis debido a su baja carga de solo +1 y su tamaño relativamente grande; así, el ion Li+ forma la mayoría de los complejos, y los iones de los metales alcalinos más pesados se forman en menor medida (aunque se producen excepciones para los complejos débiles). El litio en particular tiene una química de coordinación muy rica en la que exhibe números de coordinación del 1 al 12, aunque la hexacoordinación octaédrica es su modo preferido. En solución acuosa, los iones de metales alcalinos existen como complejos hexahidratados octaédricos [M (H2O)6 )]+, con la excepción del ion litio, que debido a su pequeño tamaño forma complejos tetrahidratados tetraédricos [Li(H2O)4)]+; los metales alcalinos forman estos complejos porque sus iones son atraídos por las fuerzas electrostáticas de atracción hacia las moléculas polares de agua. Debido a esto, las sales anhidras que contienen cationes de metales alcalinos a menudo se usan como desecantes.[173] Los metales alcalinos también forman fácilmente complejos con éteres corona.
Soluciones de amoniaco[editar]
Los metales alcalinos se disuelven lentamente en amoníaco líquido, formando soluciones amoniacales de solvatado catión metálico M+ y solvatada de electrones e -, que reaccionan para formar gas de hidrógeno y la amida de metal alcalino (MNH2, donde M representa un metal alcalino) El proceso puede ser acelerado por un catalizador. Soluciones similares están formadas por metales alcalinotérreos como el calcio, estroncio, bario, así como los lantánidos divalentes, europio e iterbio. La sal de amida es bastante insoluble y se precipita fácilmente de la solución, dejando soluciones de amoníaco intensamente coloreadas de los metales alcalinos. A bajas concentraciones (por debajo de 3 M), la solución es azul oscuro y tiene diez veces la conductividad del cloruro de sodio acuoso; a concentraciones más altas (superiores a 3 M), la solución es de color cobre y tiene aproximadamente la conductividad de metales líquidos como el mercurio.[174][175] Además de la sal de amida de metal alcalino y los electrones solvatados, tales soluciones de amoníaco también contienen el catión de metal alcalino (M+), el átomo de metal alcalino neutro (M), las moléculas de metal alcalino diatómico (M2) y los aniones de metal alcalino (M-) Estos son inestables y eventualmente se convierten en la amida de metal alcalino y el hidrógeno gaseoso más termodinámicamente estable. Los electrones solvatados son poderosos agentes reductores y a menudo se usan en síntesis química.[174]
Compuestos organometálicos[editar]
Organolitio[editar]

Al ser el metal alcalino más pequeño, el litio forma la más amplia variedad de compuestos organometálicos más estables, que están unidos por enlaces covalentes. Los compuestos de organolitio son sólidos o líquidos volátiles, eléctricamente no conductores que se funden a bajas temperaturas y tienden a formar oligómeros con la estructura (RLi)x donde R es el grupo orgánico. Como la naturaleza electropositiva del litio pone la mayor parte de la densidad de carga del enlace en el átomo de carbono, creando efectivamente un carbanión, los compuestos organolíticos son bases y nucleófilos extremadamente poderosos. Para su uso como bases, los butillitios a menudo se usan y están disponibles comercialmente. Un ejemplo de un compuesto organolítico es el metil litio ((CH3Li)x), que existe en formas tetramérica (x = 4, tetraédrica) y hexamérica (x = 6, octaédrica).[178][179] Los compuestos de organolitio, especialmente el n- butil litio, son reactivos útiles en síntesis orgánica, como podría esperarse dada la relación diagonal del litio con el magnesio, que desempeña un papel importante en la reacción de Grignard.[180] : 102 Por ejemplo, los alquilitios y los arilitios pueden usarse para sintetizar aldehídos y cetonas por reacción con carbonilos metálicos. La reacción con el níquel tetracarbonilo, por ejemplo, procede a través de un complejo inestable de acil níquel carbonilo que luego se somete a una sustitución electrófila para dar el producto deseado de aldehído (usando H+ como electrófilo) o cetona (usando un haluro de alquilo).[180] : 105

Los alquilitios y los arillitios también pueden reaccionar con amidas N, N- disustituidas para dar aldehídos y cetonas, y cetonas simétricas al reaccionar con monóxido de carbono. Se descomponen térmicamente para eliminar un hidrógeno β, produciendo alquenos e hidruro de litio; otra ruta es la reacción de éteres con alquil y arillitios que actúan como bases fuertes.[182] : 105 En los disolventes no polares, los arillitios reaccionan como los carbaniones que son efectivamente, convirtiendo el dióxido de carbono en ácidos carboxílicos aromáticos (ArCO2 H) y las aril cetonas en carbinoles terciarios (Ar'2 C (Ar) OH). Finalmente, pueden usarse para sintetizar otros compuestos organometálicos a través del intercambio metal-halógeno.[182] : 106
Metales alcalinos más pesados[editar]
A diferencia de los compuestos organolíticos, los compuestos organometálicos de los metales alcalinos más pesados son predominantemente iónicos. La aplicación de compuestos organosódicos en la química está limitada en parte debido a la competencia de los compuestos organolíticos, que están disponibles comercialmente y exhiben una reactividad más conveniente. El principal compuesto organosódico de importancia comercial es el ciclopentadienuro de sodio. El tetrafenilborato de sodio también se puede clasificar como un compuesto organosódico ya que en estado sólido el sodio está unido a los grupos arilo. Los compuestos organometálicos de los metales alcalinos superiores son aún más reactivos que los compuestos organosódicos y de utilidad limitada. Un reactivo notable es la base de Schlosser, una mezcla de n- butil litio y terc- butóxido de potasio. Este reactivo reacciona con el propeno para formar el compuesto alilpotasio (KCH2 CHCH2). cis -2-buteno y trans -2-buteno se equilibran cuando están en contacto con metales alcalinos. Mientras que la isomerización es rápida con litio y sodio, es lenta con los metales alcalinos más pesados. Los metales alcalinos más pesados también favorecen la conformación congestionada estéricamente .[183] Se han reportado varias estructuras cristalinas de compuestos organopotásicos, estableciendo que ellos, como los compuestos de sodio, son poliméricos.[184] Los compuestos de organosodio, organopotasio, organorubidio y organocaesio son en su mayoría iónicos y son insolubles (o casi) en solventes no polares.[185]
Los derivados de alquilo y arilo de sodio y potasio tienden a reaccionar con el aire. Causan la escisión de éteres, generando alcóxidos. A diferencia de los compuestos de alquil litio, los alquilsodios y los alquil potasios no pueden fabricarse haciendo reaccionar los metales con haluros de alquilo porque se produce el acoplamiento de Wurtz[186] : 265
Como tales, deben hacerse haciendo reaccionar compuestos de alquilmercurio con sodio o potasio metálico en disolventes de hidrocarburos inertes. Mientras que el metilsodio forma tetrámeros como el metil litio, el metilpotasio es más iónico y tiene la estructura de arseniuro de níquel con aniones de metilo discretos y cationes de potasio.[187] : 265
Los metales alcalinos y sus hidruros reaccionan con hidrocarburos ácidos, por ejemplo ciclopentadienos y alquinos terminales, para dar sales. Se utilizan solventes líquidos de amoníaco, éter o hidrocarburos, el más común de los cuales es el tetrahidrofurano . El más importante de estos compuestos es el ciclopentadienuro de sodio, NaC5 H5, un precursor importante de muchos derivados de ciclopentadienilo de metales de transición.[188] : 265 De manera similar, los metales alcalinos reaccionan con ciclooctatetraeno en tetrahidrofurano para dar ciclooctatetraenuros de metal alcalino; por ejemplo, el ciclooctatetraenuro de dipotasio (K2C8H8) es un precursor importante de muchos derivados metálicos de ciclooctatetraenilo, como el uranoceno.[188] : 266 Los grandes y muy débilmente polarizantes cationes de metales alcalinos pueden estabilizar, aniones grandes, aromáticos polarizables radicales, como el de color verde oscuro naftalenuro de sodio, Na+ [C10H8•]-, un agente reductor fuerte.[188] : 266
Reacciones representativas de metales alcalinos[editar]
Reacción con oxígeno[editar]
Al reaccionar con el oxígeno, los metales alcalinos forman óxidos, peróxidos, superóxidos y suboxidos . Sin embargo, los tres primeros son más comunes. La siguiente tabla[189] muestra los tipos de compuestos formados en reacción con el oxígeno. El compuesto entre paréntesis representa el producto menor de la combustión.
| Metal alcalino | Óxido | Peróxido | Superóxido |
| Li | Li2O | (Li2O2) | |
| Na | (Na2O) | Na2O2 | |
| K | KO2 | ||
| Rb | RbO2 | ||
| Cs | CsO2 |
Los peróxidos de metales alcalinos son compuestos iónicos que son inestables en el agua. El anión peróxido se une débilmente al catión y se hidroliza, formando enlaces covalentes más fuertes.
Los otros compuestos de oxígeno también son inestables en el agua.
Reacción con azufre[editar]
Con azufre, forman sulfuros y polisulfuros.
Debido a que los sulfuros de metales alcalinos son esencialmente sales de un ácido débil y una base fuerte, forman soluciones básicas.
Reacción con nitrógeno[editar]
El litio es el único metal que se combina directamente con el nitrógeno a temperatura ambiente.
El Li3N puede reaccionar con agua para liberar amoníaco.
Reacción con hidrógeno[editar]
Con hidrógeno, los metales alcalinos forman hidruros salinos que se hidrolizan en agua.
(altas temperaturas)
Reacción con carbono[editar]
El litio es el único metal que reacciona directamente con el carbono para dar acetiluro de dilitio. Na y K pueden reaccionar con acetileno para dar acetiluros.[190]
Reacción con agua[editar]
Al reaccionar con el agua, generan iones de hidróxido y gas hidrógeno. Esta reacción es vigorosa y altamente exotérmica y el hidrógeno resultante puede inflamarse en el aire o incluso explotar en el caso de Rb y Cs.[191]
Reacción con otras sales[editar]
Los metales alcalinos son muy buenos agentes reductores. Pueden reducir los cationes metálicos que son menos electropositivos. El titanio se produce industrialmente mediante la reducción del tetracloruro de titanio con Na a 400 °C (proceso de Van Arkel).
Reacción con compuestos organohaluros[editar]
Los metales alcalinos reaccionan con derivados de halógeno para generar hidrocarburos a través de la reacción de Wurtz.
Metales alcalinos en amoniaco líquido[editar]

Los metales alcalinos se disuelven en amoniaco líquido u otros solventes donantes como aminas alifáticas o hexametilfosforamida para dar soluciones azules. Se cree que estas soluciones contienen electrones libres.[192]
Debido a la presencia de electrones solvatados, estas soluciones son agentes reductores muy potentes utilizados en síntesis orgánica. Otras reducciones[193] que pueden ser llevadas por estas soluciones son:
Extensiones[editar]

Aunque el francio es el metal alcalino más pesado que se ha descubierto, se han realizado algunos trabajos teóricos que predicen las características físicas y químicas de los hipotéticos metales alcalinos más pesados. Siendo el primer elemento del período 8, se predice que el elemento no descubierto ununenio (elemento 119) será el próximo metal alcalino después del francio y se comportará de manera muy parecida a sus congéneres más ligeros; sin embargo, también se predice que difiere de los metales alcalinos más ligeros en algunas propiedades.[195] : 1729–1730 Se predice que su química será más cercana a la del potasio[196] o el rubidio[195] : 1729–1730 lugar de cesio o francio. Esto es inusual ya que las tendencias periódicas, ignorando los efectos relativistas predecirían que el ununenio sería aún más reactivo que el cesio y el francio. Esta reactividad disminuida se debe a la estabilización relativista del electrón de valencia del ununennio, aumentando la primera energía de ionización del ununenio y disminuyendo los radios metálicos e iónicos;[196] este efecto ya se ve para el francio.[195] : 1729–1730 Esto supone que el ununenio se comportará químicamente como un metal alcalino, lo que, aunque probablemente, puede no ser cierto debido a los efectos relativistas.[197] La estabilización relativista del orbital 8 también aumenta la afinidad electrónica de ununenio mucho más allá de la de cesio y francio; de hecho, se espera que el ununenio tenga una afinidad electrónica mayor que todos los metales alcalinos más ligeros que él. Los efectos relativistas también causan una caída muy grande en la polarización del ununenio.[195] : 1729–1730 Por otro lado, se pronostica que el ununenio continuará la tendencia de que los puntos de fusión disminuyan bajando el grupo, y se espera que tenga un punto de fusión entre 0 °C y 30 °C.[195] : 1724

La estabilización del electrón de valencia de ununennio y, por lo tanto, la contracción del orbital 8s hacen que su radio atómico se reduzca a 240 pm,[198] : 1729–1730 muy cerca del rubidio (247 pm),[199] para que la química del ununenio en el estado de oxidación +1 sea más similar a la química del rubidio que a la del francio. Por otro lado, se predice que el radio iónico del ion Uue+ será mayor que el de Rb+, porque los orbitales 7p están desestabilizados y, por lo tanto, son más grandes que los orbitales p de las capas inferiores. El ununenio también puede mostrar el estado de oxidación +3,[198] : 1729–1730 que no se ve en ningún otro metal alcalino,[200] : 28 además del estado de oxidación +1 que es característico de los otros metales alcalinos y es También el principal estado de oxidación de todos los metales alcalinos conocidos: esto se debe a la desestabilización y expansión del spinor 7p3/2, lo que hace que sus electrones más externos tengan una energía de ionización más baja de lo que de otro modo se esperaría.[200] : 28 [198] : 1729–1730 De hecho, se espera que muchos compuestos de ununenio tengan un gran carácter covalente, debido a la participación de los electrones 7p3/2 en la unión.[201]
No se ha hecho tanto trabajo para predecir las propiedades de los metales alcalinos más allá del ununenio. Aunque una simple extrapolación de la tabla periódica (según el Principio de Aufbau) pondría el elemento 169, unhexennio, bajo ununenio, los cálculos de Dirac-Fock predicen que el siguiente elemento después de ununenio con propiedades de tipo alcalino puede ser el elemento 165, unhexpentio, que se predice que tiene la configuración electrónica [Og] 5g18 6f14 7d10 8s2 8p1/22 9s1.[202] : 1729–1730 [203] Este elemento tendría propiedades intermedias entre un metal alcalino y un elemento del grupo 11, y aunque sus propiedades físicas y atómicas estarían más cerca del primero, su química podría estar más cerca de la del segundo. Otros cálculos muestran que el unhexpentio seguiría la tendencia de aumentar la energía de ionización más allá del cesio, que tiene una energía de ionización comparable a la del sodio, y que también debería continuar la tendencia de disminuir los radios atómicos más allá del cesio, con un radio atómico comparable al del potasio .[202] : 1729–1730 Sin embargo, los electrones 7d de unhexpentium también pueden participar en reacciones químicas junto con el electrón 9s, posiblemente permitiendo estados de oxidación más allá de +1, de ahí el probable comportamiento del metal de transición de unhexpentium.[202] : 1732–1733 [204]
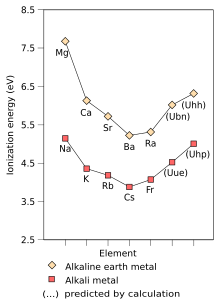
Debido a que los metales alcalinos y alcalinotérreos son elementos de bloque s, estas predicciones para las tendencias y propiedades de ununennio y unhexpentio también se mantienen de manera bastante similar para los metales alcalinotérreos correspondientes unbinilium (Ubn) y unhexhexium (Uhh).[202] : 1729–1733 Unsepttrium, elemento 173, puede ser un homólogo aún más pesado de ununenio; con una configuración electrónica predicha de [Usb] 6g1, vuelve a la situación similar a un metal alcalino de tener un electrón que se elimina fácilmente muy por encima de una cáscara p cerrada en energía, y se espera que sea aún más reactivo que el cesio.[205][206]
Las propiedades probables de otros metales alcalinos más allá de unsepttrium aún no se han explorado a partir de 2019, y pueden o no existir.[207] En los períodos 8 y superiores de la tabla periódica, los efectos relativistas y de estructura de caparazón se vuelven tan fuertes que las extrapolaciones de congéneres más claros se vuelven completamente inexactas. Además, los efectos relativistas y de estructura de caparazón (que estabilizan los orbitales s y desestabilizan y expanden los orbitales d, f y g de las capas superiores) tienen efectos opuestos, causando una diferencia aún mayor entre relativistas y no relativistas. cálculos de las propiedades de elementos con números atómicos tan altos.[208] : 1732–1733 El interés en las propiedades químicas de ununenio, unhexpentio y unsepttrio se debe al hecho de que se encuentran cerca de las ubicaciones esperadas de las islas de estabilidad, centradas en los elementos 122 (306Ubb) y 164 (482Uhq).[209][210][211]
Metales pseudoalcalinos[editar]
Muchas otras sustancias son similares a los metales alcalinos en su tendencia a formar cationes monopositivos. Análogamente a los pseudohalógenos, a veces se les ha llamado "metales pseudoalcalinos". Estas sustancias incluyen algunos elementos y muchos más iones poliatómicos ; Los iones poliatómicos son especialmente similares a los metales alcalinos en su gran tamaño y débil poder de polarización.[212]
Hidrógeno[editar]
El elemento hidrógeno, con un electrón por átomo neutro, generalmente se coloca en la parte superior del Grupo 1 de la tabla periódica por conveniencia, pero el hidrógeno normalmente no se considera un metal alcalino;[213] cuando se considera que es un metal alcalino, se debe a sus propiedades atómicas y no a sus propiedades químicas.[214] En condiciones típicas, existe hidrógeno puro como un diatómico gas que consta de dos átomos por molécula (H2);[215] sin embargo, los metales alcalinos solo forman moléculas diatómicas (como dilitio, Li2) a altas temperaturas, cuando están en estado gaseoso.[216]
El hidrógeno, como los metales alcalinos, tiene un electrón de valencia[217] y reacciona fácilmente con los halógenos[217] pero las similitudes terminan allí debido al pequeño tamaño de un protón desnudo H+ en comparación con los cationes de metales alcalinos.[217] Su colocación sobre el litio se debe principalmente a su configuración electrónica.[218] A veces se coloca por encima del carbono debido a sus electronegatividades similares[219] o al flúor debido a sus propiedades químicas similares.[219]
La primera energía de ionización del hidrógeno (1312.0 kJ / mol ) es mucho mayor que la de los metales alcalinos.[220][221] Como solo se requiere un electrón adicional para llenar la capa más externa del átomo de hidrógeno, el hidrógeno a menudo se comporta como un halógeno, formando el ion hidruro negativo, y muy ocasionalmente se considera un halógeno sobre esa base. (Los metales alcalinos también pueden formar iones negativos, conocidos como alcalinos, pero estos son poco más que curiosidades de laboratorio, siendo inestables. )[222][223] Un argumento en contra de esta ubicación es que la formación de hidruro a partir de hidrógeno es endotérmica, a diferencia de la formación exotérmica de haluros a partir de halógenos. El radio de la H- anión también no encaja la tendencia de aumentar el tamaño de bajar los halógenos: en efecto, H- es muy difusa, ya que su único protón no puede controlar fácilmente ambos electrones.[224] : 15–6 Se esperaba durante algún tiempo que el hidrógeno líquido mostrara propiedades metálicas;[225] si bien se ha demostrado que este no es el caso, bajo presiones extremadamente altas, como las que se encuentran en los núcleos de Júpiter y Saturno, el hidrógeno se vuelve metálico y se comporta como un metal alcalino; En esta fase, se conoce como hidrógeno metálico.[226] La resistividad eléctrica del hidrógeno metálico líquido a 3000 K es aproximadamente igual a la del rubidio y el cesio líquidos a 2000 K a las presiones respectivas cuando experimentan una transición de no metal a metal.[227]
La configuración electrónica de hidrógeno 1s1, aunque superficialmente similar a la de los metales alcalinos (ns1), es única porque no hay una subcapa 1p. Por lo tanto, puede perder un electrón para formar el hidrón H+, o ganar uno para formar el ion hidruro H-.[228] : 43 En el primer caso se parece superficialmente a los metales alcalinos; en el último caso, los halógenos, pero las diferencias debido a la falta de una subcapa 1p son lo suficientemente importantes como para que ninguno de los grupos se ajuste bien a las propiedades del hidrógeno.[228] : 43 El Grupo 14 también se ajusta bien en términos de propiedades termodinámicas, como la energía de ionización y la afinidad electrónica, pero no tiene sentido químico porque el hidrógeno no puede ser tetravalente. Por lo tanto, ninguna de las tres ubicaciones es completamente satisfactoria, aunque el grupo 1 es la ubicación más común (si se elige una) porque el hidrón es, con mucho, la más importante de todas las especies de hidrógeno monoatómico, siendo la base de la química ácido-base.[229] Como ejemplo de las propiedades poco ortodoxas del hidrógeno derivadas de su configuración electrónica inusual y su pequeño tamaño, el ion hidrógeno es muy pequeño (radio alrededor de 150 fm en comparación con los 50-220 pm tamaño de la mayoría de los otros átomos y iones) y, por lo tanto, no existe en sistemas condensados que no estén asociados con otros átomos o moléculas. De hecho, la transferencia de protones entre productos químicos es la base de la química ácido-base.[228] : 43 También es única la capacidad del hidrógeno para formar enlaces de hidrógeno, que son un efecto de los fenómenos contribuyentes de transferencia de carga, electrostáticos y correlativos de electrones.[229] Si bien también se conocen enlaces de litio análogos, en su mayoría son electrostáticos.[229] Sin embargo, el hidrógeno puede asumir el mismo papel estructural que los metales alcalinos en algunos cristales moleculares, y tiene una estrecha relación con los metales alcalinos más ligeros (especialmente el litio).[230]
Amonio y derivados[editar]

El ion amonio (NH+
4) tiene propiedades muy similares a los metales alcalinos más pesados, actuando como un intermediario de metales alcalinos entre el potasio y el rubidio,[231][232] y a menudo se considera un pariente cercano.[233][234] Por ejemplo, la mayoría de las sales de metales alcalinos son solubles en agua, una propiedad que comparten las sales de amonio.[235] Se espera que el amonio se comporte de manera estable como un metal (NH+
4 iones en un mar de electrones deslocalizados) a presiones muy altas (aunque menos que la presión típica donde ocurren las transiciones de comportamiento aislante a metálico, 100 GPa ), y posiblemente podría ocurrir dentro de los gigantes de hielo Urano y Neptuno, lo que puede tener un impacto significativo en sus campos magnéticos interiores.[233][234] Se ha estimado que la transición de una mezcla de moléculas de amoníaco y dihidrógeno a amonio metálico puede ocurrir a presiones justo por debajo de 25 GPa.[233] En condiciones estándar, el amonio puede formar una amalgama metálica con mercurio.[236]
Otros "metales pseudoalcalinos" incluyen los cationes de alquilamonio, en los cuales algunos de los átomos de hidrógeno en el catión de amonio son reemplazados por grupos alquilo o arilo. En particular, los cationes de amonio cuaternario ( NR+
4) son muy útiles ya que están cargados permanentemente, y a menudo se usan como una alternativa al costoso Cs+ para estabilizar aniones muy grandes y fácilmente polarizables como HI−
2[237] : 812–9 Los hidróxidos de tetraalquilamonio, como los hidróxidos de metales alcalinos, son bases muy fuertes que reaccionan con el dióxido de carbono atmosférico para formar carbonatos.[238] : 256 Además, el átomo de nitrógeno puede ser reemplazado por un átomo de fósforo, arsénico o antimonio (los picnógenos no metálicos más pesados), creando un fosfonio (PH+
4 ) o arsonio ( AsH+
4), catión que puede ser sustituido de manera similar.
Cobaltoceno y derivados[editar]
El cobaltoceno, Co (C5H5)2, es un metaloceno, el análogo de cobalto del ferroceno. Es un sólido púrpura oscuro. El cobaltoceno tiene 19 electrones de valencia, uno más de lo que generalmente se encuentra en los complejos metálicos de organotransición, como su pariente muy estable, el ferroceno, de acuerdo con la regla de los 18 electrones. Este electrón adicional ocupa un orbital que se está uniendo con respecto a los enlaces Co-C. En consecuencia, muchas reacciones químicas de Co (C5H5)2 se caracterizan por su tendencia a perder este electrón "extra", produciendo un catión de 18 electrones muy estable conocido como cobaltocenio. Muchas sales de cobaltocenio coprecipitan con sales de cesio, y el hidróxido de cobaltocenio es una base fuerte que absorbe dióxido de carbono atmosférico para formar carbonato de cobaltocenio.[239] : 256 Al igual que los metales alcalinos, el cobaltoceno es un agente reductor fuerte, y el decametilcobaltoceno es aún más fuerte debido al efecto inductivo combinado de los diez grupos metilo.[240] El cobalto puede ser sustituido por su congénere más pesado rodio para dar rodoceno, un agente reductor aún más fuerte.[241] El iridoceno (que implica iridio) presumiblemente sería aún más potente, pero no está muy bien estudiado debido a su inestabilidad.[242]
Talio[editar]

El talio es el elemento estable más pesado en el grupo 13 de la tabla periódica. En la parte inferior de la tabla periódica, el efecto del par inerte es bastante fuerte, debido a la estabilización relativista del orbital 6s y la energía de enlace decreciente a medida que los átomos aumentan de tamaño, de modo que la cantidad de energía liberada en la formación de dos enlaces más no es Vale la pena las altas energías de ionización de los electrones 6s.[243] : 226–7 Muestra el estado de oxidación +1[243] : 28 que muestran todos los metales alcalinos conocidos,[243] : 28 y los compuestos de talio con talio en su estado de oxidación +1 se parecen mucho a los compuestos de potasio o plata correspondientes estequiométricamente debido al iónico similar radios de Tl+ (164 pm ), K+ (152 pm) y Ag+ (129 pm) iones.[244][245] A veces se consideró un metal alcalino en Europa continental (pero no en Inglaterra) en los años inmediatamente posteriores a su descubrimiento,[245] : 126 y se colocó justo después del cesio como el sexto metal alcalino en la tabla periódica de 1869 de Dmitri Mendeleev y Julius, en la tabla periódica de 1868 de Lothar Meyer.[246] (La tabla periódica de 1871 de Mendeleev y la tabla periódica de 1870 de Meyer pusieron al talio en su posición actual en el grupo de boro y dejaron en blanco el espacio debajo del cesio).[246] Sin embargo, el talio también muestra el estado de oxidación +3,[243] : 28 que ningún metal alcalino conocido muestra[243] : 28 (aunque se predice que el ununenio, el séptimo metal alcalino no descubierto, posiblemente muestre la oxidación +3 estado).[247] : 1729–1730 El sexto metal alcalino ahora se considera francio.[248] Mientras que Tl+ se estabiliza por el efecto del par inerte, este par inerte de electrones 6s todavía puede participar químicamente, de modo que estos electrones son estereoquímicamente activos en solución acuosa. Además, los haluros de talio (excepto TlF) son bastante insolubles en agua, y TlI tiene una estructura inusual debido a la presencia del par inerte estereoquímicamente activo en talio.[249]
Cobre, plata y oro[editar]



Los metales del grupo 11 (o metales de acuñación), cobre, plata y oro, generalmente se clasifican como metales de transición dado que pueden formar iones con capas D incompletas. Físicamente, tienen los puntos de fusión relativamente bajos y los altos valores de electronegatividad asociados con los metales posteriores a la transición.[250] Químicamente, los metales del grupo 11 se comportan como los metales del grupo principal en sus estados de valencia +1 y, por lo tanto, están algo relacionados con los metales alcalinos: esta es una razón por la que previamente fueron etiquetados como "grupo IB", en paralelo con los metales alcalinos "grupo IA". En ocasiones se clasifican como metales posteriores a la transición.[251] Sus espectros son análogos a los de los metales alcalinos.[252] Sus iones monopositivos son paramagnéticos y no aportan color a sus sales, como los de los metales alcalinos.[253]
En la tabla periódica de 1871 de Mendeleev, el cobre, la plata y el oro se enumeran dos veces, una en el grupo VIII (con la tríada de hierro y los metales del grupo del platino), y una vez en el grupo IB. No obstante, el grupo IB se paréntesis para señalar que era tentativo. El criterio principal de Mendeleev para la asignación de grupo era el estado de oxidación máxima de un elemento: sobre esa base, los elementos del grupo 11 no podían clasificarse en el grupo IB, debido a la existencia de compuestos de cobre (II) y oro (III) conocidos en ese momento. hora.[254] Sin embargo, eliminar el grupo IB convertiría al grupo I en el único grupo principal (el grupo VIII fue etiquetado como grupo de transición) que carece de una bifurcación A – B.[254] Poco después, la mayoría de los químicos eligió clasificar estos elementos en el grupo IB y eliminarlos del grupo VIII para la simetría resultante: esta fue la clasificación predominante hasta el surgimiento de la tabla periódica moderna de 18 columnas, mediana y larga, que separó el álcali metales y metales del grupo 11.[254]
Los metales de acuñación se consideraban tradicionalmente como una subdivisión del grupo de metales alcalinos, debido a que compartían la configuración electrónica s1 característica de los metales alcalinos (grupo 1: p6 s1; grupo 11: d10s1). Sin embargo, las similitudes se limitan en gran medida a las estequiometrías de los compuestos +1 de ambos grupos, y no a sus propiedades químicas.[255] : 1177 Esto se deriva de la subshell d llena que proporciona un efecto de protección mucho más débil en el electrón s más externo que la subcapa p llena, de modo que los metales de acuñación tienen energías de primera ionización mucho más altas y radios iónicos más pequeños que los metales alcalinos correspondientes.[255] : 1177 Además, tienen puntos de fusión, durezas y densidades más altos, y reactividades y solubilidades más bajas en amoníaco líquido, además de tener un carácter más covalente en sus compuestos.[255] : 1177 Finalmente, los metales alcalinos están en la parte superior de la serie electroquímica, mientras que los metales de acuñación están casi en la parte inferior.[255] : 1177 La cáscara d llena de metales de acuñación se altera mucho más fácilmente que la subcapa p llena de metales alcalinos, de modo que las energías de ionización segunda y tercera son más bajas, lo que permite estados de oxidación más altos que +1 y una química de coordinación más rica, lo que le da al grupo 11 Metales claros Carácter de metal de transición.[255] : 1177 Particularmente notable es el oro que forma compuestos iónicos con rubidio y cesio, en el que forma el ion aurida (Au-) que también se presenta en forma solvatada en solución de amoníaco líquido; aquí el oro se comporta como un pseudohalógeno porque su configuración 5d10 6s1 tiene un electrón menos que la configuración cuasi-cerrada 5d10 6s2 de mercurio.[255] : 1177
Producción y aislamiento[editar]


La producción de metales alcalinos puros es algo complicada debido a su extrema reactividad con sustancias de uso común, como el agua.[256][257] A partir de sus minerales de silicato, todos los metales alcalinos estables se pueden obtener de la misma manera: el ácido sulfúrico se usa primero para disolver el ion de metal alcalino y los iones de aluminio (III) deseados del mineral (lixiviación), con lo cual la precipitación básica elimina los iones de aluminio del mezcla precipitándolo como el hidróxido. El carbonato de metal alcalino insoluble restante se precipita entonces selectivamente; la sal se disuelve en ácido clorhídrico para producir el cloruro. El resultado se deja evaporar y el metal alcalino se puede aislar.[257] El litio y el sodio generalmente se aíslan por electrólisis de sus cloruros líquidos, y se agrega cloruro de calcio para disminuir el punto de fusión de la mezcla. Los metales alcalinos más pesados, sin embargo, se aíslan más típicamente de una manera diferente, donde se usa un agente reductor (típicamente sodio para potasio y magnesio o calcio para los metales alcalinos más pesados) para reducir el cloruro de metal alcalino. El producto líquido o gaseoso (el metal alcalino) luego se somete a destilación fraccionada para la purificación.[257] La mayoría de las rutas a los metales alcalinos puros requieren el uso de electrólisis debido a su alta reactividad; uno de los pocos que no es la pirólisis de la azida de metal alcalino correspondiente, que produce el metal para sodio, potasio, rubidio y cesio y el nitruro para litio.[258] : 77
Las sales de litio tienen que ser extraída del agua de fuentes minerales, salares, y depósitos de salmuera. El metal se produce electrolíticamente a partir de una mezcla de cloruro de litio fundido y cloruro de potasio.[259]
El sodio se produce principalmente en el agua de mar y en los fondos marinos secos,[260] pero ahora se produce a través de la electrólisis del cloruro de sodio al reducir el punto de fusión de la sustancia a menos de 700 °C mediante el uso de una celda Downs .[261][262] Se puede producir sodio extremadamente puro a través de la descomposición térmica de la azida de sodio .[263] El potasio se encuentra en muchos minerales, como la silvita (cloruro de potasio).[260] Anteriormente, el potasio generalmente se elaboraba a partir de la electrólisis del cloruro de potasio o el hidróxido de potasio,[264] encontrado ampliamente en lugares como Canadá, Rusia, Bielorrusia, Alemania, Israel, Estados Unidos y Jordania, en un método similar a cómo se produjo el sodio. a finales de 1800 y principios de 1900.[265] También se puede producir a partir de agua de mar .[260] Sin embargo, estos métodos son problemáticos porque el metal de potasio tiende a disolverse en su cloruro fundido y se vaporiza significativamente a las temperaturas de funcionamiento, formando potencialmente el superóxido explosivo. Como resultado, ahora se produce metal de potasio puro reduciendo el cloruro de potasio fundido con metal de sodio a 850 °C.[266] : 74
Aunque el sodio es menos reactivo que el potasio, este proceso funciona porque a temperaturas tan altas el potasio es más volátil que el sodio y se puede destilar fácilmente, por lo que el equilibrio se desplaza hacia la derecha para producir más gas de potasio y casi se completa.[267] : 74
Durante varios años, en las décadas de 1950 y 1960, un subproducto de la producción de potasio llamado Alkarb fue una fuente principal de rubidio. El Alkarb contenía 21% de rubidio, mientras que el resto era potasio y una pequeña fracción de cesio.[268] Hoy, los mayores productores de cesio, por ejemplo la mina Tanco en Manitoba, Canadá, producen rubidio como subproducto de la polucita.[269] Hoy, un método común para separar el rubidio del potasio y el cesio es la cristalización fraccionada de un alumbre de rubidio y cesio (Cs, Rb) Al( SO4 )2 · 12 H2O, que produce alumbre de rubidio puro después de aproximadamente 30 recristalizaciones.[269][270] Las aplicaciones limitadas y la falta de un mineral rico en rubidio limitan la producción de compuestos de rubidio a 2 a 4 toneladas por año.[269] El cesio, sin embargo, no se produce a partir de la reacción anterior. En cambio, la extracción de mineral de polucita es el método principal para obtener cesio puro, extraído del mineral principalmente por tres métodos: digestión ácida, descomposición alcalina y reducción directa.[269][271] Ambos metales se producen como subproductos de la producción de litio: después de 1958, cuando el interés en las propiedades termonucleares del litio aumentó bruscamente, la producción de rubidio y cesio también aumentó correspondientemente.[272] : 71 Los metales puros de rubidio y cesio se producen al reducir sus cloruros con calcio metálico a 750 °C y baja presión.[272] : 74
Como resultado de su extrema rareza en la naturaleza,[273] mayoría del francio se sintetiza en la reacción nuclear 197Au+18O → 210Fr + 5n, produciendo francio-209, francio-210 y francio-211 .[274] La mayor cantidad de francio jamás reunida hasta la fecha es de aproximadamente 300,000 átomos neutros,[275] que se sintetizaron usando la reacción nuclear dada anteriormente.[275] Cuando se requiere específicamente el único isótopo natural de francio-223, se produce como la hija alfa del actinio-227, en sí mismo producido sintéticamente a partir de la irradiación de neutrones del radio natural-226, una de las hijas del uranio-238 natural.[276]
Aplicaciones[editar]
El litio, el sodio y el potasio tienen muchas aplicaciones, mientras que el rubidio y el cesio son muy útiles en contextos académicos, pero aún no tienen muchas aplicaciones.[277] : 68 El litio se usa a menudo en baterías de iones de litio, y el óxido de litio puede ayudar a procesar la sílice. El estearato de litio es un espesante y puede usarse para fabricar grasas lubricantes; Se produce a partir de hidróxido de litio, que también se utiliza para absorber dióxido de carbono en cápsulas espaciales y submarinos.[277] : 70 El cloruro de litio se utiliza como una aleación de soldadura fuerte para piezas de aluminio.[278] El litio metálico se usa en aleaciones con magnesio y aluminio para dar aleaciones muy resistentes y ligeras.[277] : 70
Los compuestos de sodio tienen muchas aplicaciones, la más conocida es el cloruro de sodio como sal de mesa . Las sales de sodio de los ácidos grasos se usan como jabón.[279] El metal de sodio puro también tiene muchas aplicaciones, incluido el uso en lámparas de vapor de sodio, que producen una luz muy eficiente en comparación con otros tipos de iluminación,[280][281] y pueden ayudar a suavizar la superficie de otros metales.[282][283] Al ser un agente reductor fuerte, a menudo se usa para reducir muchos otros metales, como el titanio y el circonio, de sus cloruros. Además, es muy útil como líquido de intercambio de calor en reactores nucleares reproductores rápidos debido a su bajo punto de fusión, viscosidad y sección transversal hacia la absorción de neutrones.[284] : 74
Los compuestos de potasio se usan a menudo como fertilizantes[285] : 73 [286] ya que el potasio es un elemento importante para la nutrición de las plantas. El hidróxido de potasio es una base muy fuerte y se usa para controlar el pH de varias sustancias.[287][288] El nitrato de potasio y el permanganato de potasio a menudo se usan como poderosos agentes oxidantes.[285] : 73 El superóxido de potasio se usa en máscaras para respirar, ya que reacciona con dióxido de carbono para dar carbonato de potasio y gas oxígeno. El potasio metal puro no se usa con frecuencia, pero sus aleaciones con sodio pueden sustituir al sodio puro en los reactores nucleares reproductores rápidos.[285] : 74
El rubidio y el cesio a menudo se usan en relojes atómicos.[289] Los relojes atómicos de cesio son extraordinariamente precisos; si se hubiera hecho un reloj en el momento de los dinosaurios, estaría apagado por menos de cuatro segundos (después de 80 millones de años).[290] Por esa razón, los átomos de cesio se usan como la definición del segundo.[291] Los iones de rubidio a menudo se usan en fuegos artificiales morados,[292] y el cesio se usa a menudo en fluidos de perforación en la industria del petróleo.[290][293]
El francio no tiene aplicaciones comerciales,[294][295][296] pero debido a la estructura atómica relativamente simple del francio, entre otras cosas, se ha utilizado en experimentos de espectroscopia, lo que lleva a más información sobre losniveles de energía y las constantes de acoplamiento entre partículas subatómicas.[297] Los estudios sobre la luz emitida por los iones francio-210 atrapados por láser han proporcionado datos precisos sobre las transiciones entre los niveles de energía atómica, similares a los predichos por la teoría cuántica.[298]
Rol biológico y precauciones[editar]
Metales[editar]
Los metales alcalinos puros son peligrosamente reactivos con el aire y el agua y deben mantenerse alejados del calor, fuego, agentes oxidantes, ácidos, la mayoría de los compuestos orgánicos, halocarbonos, plásticos y humedad. También reaccionan con dióxido de carbono y tetracloruro de carbono, por lo que los extintores normales son contraproducentes cuando se usan en incendios de metales alcalinos.[299] Algunos extintores de polvo seco de Clase D diseñados para incendios de metales son efectivos, privando al fuego de oxígeno y enfriando el metal alcalino.[300]
Los experimentos generalmente se realizan utilizando solo pequeñas cantidades de unos pocos gramos en una campana extractora. Pueden eliminarse pequeñas cantidades de litio por reacción con agua fría, pero los metales alcalinos más pesados deben disolverse en el isopropanol menos reactivo.[301][302] Los metales alcalinos deben almacenarse en aceite mineral o en una atmósfera inerte. La atmósfera inerte utilizada puede ser argón o gas nitrógeno, a excepción del litio, que reacciona con el nitrógeno.[301] El rubidio y el cesio deben mantenerse alejados del aire, incluso debajo del aceite, porque incluso una pequeña cantidad de aire difundido en el aceite puede desencadenar la formación del peróxido peligrosamente explosivo; Por la misma razón, el potasio no debe almacenarse bajo el aceite en una atmósfera que contenga oxígeno durante más de 6 meses.[303][304]
Iones[editar]

La química bioinorgánica de los iones de metales alcalinos ha sido ampliamente revisada.[305] Se han determinado estructuras cristalinas en estado sólido para muchos complejos de iones de metales alcalinos en péptidos pequeños, constituyentes de ácidos nucleicos, carbohidratos y complejos de ionóforos.[306]
El litio, naturalmente, solo se produce en trazas en sistemas biológicos y no tiene un papel biológico conocido, pero tiene efectos en el cuerpo cuando se ingiere.[307] El carbonato de litio se usa como estabilizador del estado de ánimo en psiquiatría para tratar el trastorno bipolar (depresión maníaca) en dosis diarias de aproximadamente 0.5 a 2 gramos, aunque hay efectos secundarios.[307] La ingestión excesiva de litio causa somnolencia, dificultad para hablar y vómitos, entre otros síntomas,[307] y envenena el sistema nervioso central,[307] cual es peligroso ya que la dosis requerida de litio para tratar el trastorno bipolar es solo un poco más baja que la dosis tóxica.[307][308] Su bioquímica, la forma en que el cuerpo humano lo maneja y los estudios realizados con ratas y cabras sugieren que es un oligoelemento esencial, aunque la función biológica natural del litio en humanos aún no se ha identificado.[309][310]
El sodio y el potasio se producen en todos los sistemas biológicos conocidos, generalmente funcionan como electrolitos dentro y fuera de las células.[311][312] El sodio es un nutriente esencial que regula el volumen sanguíneo, la presión arterial, el equilibrio osmótico y el pH ; El requerimiento fisiológico mínimo para el sodio es 500 miligramos por día.[313] El cloruro de sodio (también conocido como sal común) es la principal fuente de sodio en la dieta, y se usa como condimento y conservante, como para encurtidos y cecina; La mayor parte proviene de alimentos procesados.[314] La ingesta dietética de referencia para sodio es 1.5 gramos por día,[315] pero la mayoría de las personas en los Estados Unidos consumen más de 2.3 gramos por día,[316] la cantidad mínima que promueve la hipertensión;[317] esto a su vez causa 7,6 millones de muertes prematuras en todo el mundo.[318]
El potasio es el catión principal (ion positivo) dentro de las células animales,[319] mientras que el sodio es el catión principal fuera de las células animales.[319][320] Las diferencias de concentración de estas partículas cargadas provocan una diferencia en el potencial eléctrico entre el interior y el exterior de las células, conocido como potencial de membrana . El equilibrio entre el potasio y el sodio es mantenido por las proteínas transportadoras de iones en la membrana celular .[321] El potencial de membrana celular creado por los iones de potasio y sodio permite que la célula genere un potencial de acción, un "pico" de descarga eléctrica. La capacidad de las células para producir descargas eléctricas es crítica para las funciones corporales como la neurotransmisión, la contracción muscular y la función cardíaca.[321] La interrupción de este equilibrio puede ser fatal: por ejemplo, la ingestión de grandes cantidades de compuestos de potasio puede provocar hipercalemia que influye fuertemente en el sistema cardiovascular.[322][323] El cloruro de potasio se usa en los Estados Unidos para las ejecuciones de inyección letal.[322]
Debido a sus radios atómicos similares, el rubidio y el cesio en el cuerpo imitan al potasio y se absorben de manera similar. El rubidio no tiene un papel biológico conocido, pero puede ayudar a estimular el metabolismo,[324][325][326] y, de manera similar al cesio,[324][327] reemplaza el potasio en el cuerpo causando deficiencia de potasio.[324][326] La sustitución parcial es bastante posible y bastante no tóxica: un 70 kg persona contiene en promedio 0.36 g. de rubidio, y un aumento en este valor de 50 a 100 veces no mostró efectos negativos en las personas de prueba.[328] Las ratas pueden sobrevivir hasta un 50% de sustitución de potasio por rubidio.[326][329] El rubidio (y en mucho menor medida el cesio) puede funcionar como una cura temporal para la hipocalemia; Mientras que el rubidio puede sustituir adecuadamente al potasio fisiológicamente en algunos sistemas, el cesio nunca puede hacerlo.[325] Solo existe evidencia muy limitada en forma de síntomas de deficiencia para que el rubidio sea posiblemente esencial en las cabras; incluso si esto es cierto, las cantidades traza generalmente presentes en los alimentos son más que suficientes.[330][331]

La mayoría de la gente rara vez encuentra compuestos de cesio, pero la mayoría de los compuestos de cesio son levemente tóxicos. Al igual que el rubidio, el cesio tiende a sustituir al potasio en el cuerpo, pero es significativamente más grande y, por lo tanto, es un sustituto más pobre.[332] El exceso de cesio puede conducir a hipocalemia, arritmia y paro cardíaco agudo,[333] pero tales cantidades normalmente no se encontrarían en las fuentes naturales.[334] Como tal, el cesio no es un contaminante químico ambiental importante.[334] El valor de la dosis letal media (DL 50 ) para el cloruro de cesio en ratones es 2.3 gramos por kilogramo, que es comparable a los valores LD50 de cloruro de potasio y cloruro de sodio.[335] El cloruro de cesio se ha promovido como una terapia alternativa contra el cáncer,[336] pero se ha relacionado con la muerte de más de 50 pacientes, en quienes se utilizó como parte de un tratamiento contra el cáncer científicamente no validado.[337]
Los radioisótopos de cesio requieren precauciones especiales; el manejo inadecuado de las fuentes de rayos gamma de cesio-137 puede provocar la liberación de este radioisótopo y lesiones por radiación. Quizás el caso más conocido es el accidente de Goiânia en 1987, en el que un sistema de radioterapia mal dispuesto de una clínica abandonada en la ciudad de Goiânia, Brasil, fue eliminado de un depósito de chatarra, y la sal de cesio resplandeciente se vendió a curiosos., compradores sin educación. Esto condujo a cuatro muertes y lesiones graves por exposición a la radiación. Junto con el cesio 134, el yodo 131 y el estroncio 90, el cesio 137 se encontraba entre los isótopos distribuidos por el desastre de Chernobyl que constituyen el mayor riesgo para la salud.[338] Presumiblemente, los radioisótopos de francio también serían peligrosos debido a su alta energía de descomposición y su corta vida media, pero ninguno se ha producido en cantidades lo suficientemente grandes como para representar un riesgo grave.[339]
Véase también[editar]
- Tabla periódica de los elementos
- Metal
- Categoría:Elementos químicos por grupo
- Metales alcalinotérreos
- Elementos del bloque s
Notas[editar]
- ↑ En la versión de 1869 de la tabla periódica de Mendeleev, el cobre y la plata se colocaron en su propio grupo, alineados con el hidrógeno y el mercurio, mientras que el oro se colocó tentativamente bajo uranio y el eka-aluminio (no descubierto) en el grupo del boro.
- ↑ El número entre paréntesis se refiere a la incertidumbre de medición. Esta incertidumbre se aplica a las cifras menos significativas del número anterior al valor entre paréntesis (es decir, contando desde el dígito más a la derecha a la izquierda).[66]
- ↑ El valor indicado es el valor convencional adecuado para la transacción y el comercio; El valor real puede variar de 6.938 a 6.997 dependiendo de la composición isotópica de la muestra.[58]
- ↑ El elemento no tiene ningún nucleido estable, y un valor entre paréntesis indica el número de masa del isótopo más longevo del elemento.[57][58]
Referencias[editar]
- ↑ Harper, Douglas. «salary». Online Etymology Dictionary.
- ↑ Marggraf, Andreas Siegmund (1761). Chymische Schriften (en alemán). p. 167.
- ↑ du Monceau, H. L. D. «Sur la Base de Sel Marine». Mémoires de l'Académie Royale des Sciences (en francés): 65-68.
- ↑ Weeks, Mary Elvira (1932). «The discovery of the elements. IX. Three alkali metals: Potassium, sodium, and lithium». Journal of Chemical Education 9 (6): 1035. Bibcode:1932JChEd...9.1035W. doi:10.1021/ed009p1035.
- ↑ Siegfried, R. (1963). «The Discovery of Potassium and Sodium, and the Problem of the Chemical Elements». Isis 54 (2): 247-258. PMID 14147904. doi:10.1086/349704.
- ↑ Enghag, P. (2004). «11. Sodium and Potassium». Encyclopedia of the elements. Wiley-VCH Weinheim. ISBN 978-3-527-30666-4.
- ↑ Weeks, Mary Elvira (1932). «The discovery of the elements. IX. Three alkali metals: Potassium, sodium, and lithium». Journal of Chemical Education 9 (6): 1035. Bibcode:1932JChEd...9.1035W. doi:10.1021/ed009p1035.
- ↑ Siegfried, R. (1963). «The Discovery of Potassium and Sodium, and the Problem of the Chemical Elements». Isis 54 (2): 247-258. PMID 14147904. doi:10.1086/349704.
- ↑ Davy, Humphry (1808). «On some new phenomena of chemical changes produced by electricity, in particular the decomposition of the fixed alkalies, and the exhibition of the new substances that constitute their bases; and on the general nature of alkaline bodies». Philosophical Transactions of the Royal Society of London 98: 1-44. doi:10.1098/rstl.1808.0001.
- ↑ Shaposhnik, V. A. (2007). «History of the discovery of potassium and sodium (on the 200th anniversary of the discovery of potassium and sodium)». Journal of Analytical Chemistry 62 (11): 1100-1102. doi:10.1134/S1061934807110160.
- ↑ Ralph, Jolyon (24 de agosto de 2011). «Petalite: Petalite mineral information and data». Consultado el 27 de noviembre de 2011.
- ↑ a b Winter, Mark. «WebElements Periodic Table of the Element | Lithium | historical information». Consultado el 27 de noviembre de 2011.
- ↑ Weeks, Mary (2003). Discovery of the Elements. Whitefish, Montana, United States: Kessinger Publishing. p. 124. ISBN 978-0-7661-3872-8. Consultado el 10 de agosto de 2009.
- ↑ «Johan Arfwedson». Archivado desde el original el 5 de junio de 2008. Consultado el 10 de agosto de 2009.
- ↑ a b van der Krogt, Peter. «Lithium». Elementymology & Elements Multidict. Consultado el 5 de octubre de 2010.
- ↑ Clark, Jim (2005). «Compounds of the Group 1 Elements». chemguide. Consultado el 10 de agosto de 2009.
- ↑ Krebs, Robert E. (2006). The History and Use of Our Earth's Chemical Elements: A Reference Guide. Westport, Conn.: Greenwood Press. ISBN 978-0-313-33438-2.
- ↑ Leach, Mark R. (1999–2012). «The Internet Database of Periodic Tables». meta-synthesis.com. Consultado el 6 de abril de 2012.
- ↑ Kaner, Richard (2003). «C&EN: It's Elemental: The Periodic Table – Cesium». American Chemical Society. Consultado el 25 de febrero de 2010.
- ↑ Kirchhoff, G.; Bunsen, R. (1861). «Chemische Analyse durch Spectralbeobachtungen». Annalen der Physik und Chemie 189 (7): 337-381. Bibcode:1861AnP...189..337K. doi:10.1002/andp.18611890702.
- ↑ Weeks, Mary Elvira (1932). «The discovery of the elements. XIII. Some spectroscopic discoveries». Journal of Chemical Education 9 (8): 1413-1434. Bibcode:1932JChEd...9.1413W. doi:10.1021/ed009p1413.
- ↑ «caesium». Oxford English Dictionary (2.ª edición). Oxford University Press. 1989.
- ↑ Newlands, John A. R. (20 de agosto de 1864). «On Relations Among the Equivalents». Chemical News 10: 94-95. Archivado desde el original el 1 de enero de 2011. Consultado el 25 de noviembre de 2013.
- ↑ Newlands, John A. R. (18 de agosto de 1865). «On the Law of Octaves». Chemical News 12: 83. Archivado desde el original el 1 de enero de 2011. Consultado el 25 de noviembre de 2013.
- ↑ Leach, Mark R. (1999–2012). «The Internet Database of Periodic Tables». meta-synthesis.com. Consultado el 6 de abril de 2012.
- ↑ Mendelejew, Dimitri (1869). «Über die Beziehungen der Eigenschaften zu den Atomgewichten der Elemente». Zeitschrift für Chemie (en alemán): 405-406.
- ↑ Jensen, William B. (2003). «The Place of Zinc, Cadmium, and Mercury in the Periodic Table». Journal of Chemical Education (American Chemical Society) 80 (8): 952-961. Bibcode:2003JChEd..80..952J. doi:10.1021/ed080p952. Archivado desde el original el 11 de junio de 2010. Consultado el 6 de mayo de 2012.
- ↑ Royal Society of Chemistry. «Visual Elements: Group 1 – The Alkali Metals». Visual Elements. Royal Society of Chemistry. Archivado desde el original el 5 de agosto de 2012. Consultado el 13 de enero de 2012.
- ↑ a b Marco, Fontani (10 de setiembre de 2005). «The Twilight of the Naturally-Occurring Elements: Moldavium (Ml), Sequanium (Sq) and Dor (Do)» (en portugués). Lisboa. pp. 1-8. Archivado desde el original el 24 de febrero de 2006. Consultado el 8 de abril de 2007.
- ↑ Van der Krogt, Peter (10 de enero de 2006). «Francium». Elementymology & Elements Multidict. Consultado el 8 de abril de 2007.
- ↑ «Education: Alabamine & Virginium». 15 de febrero de 1932. Archivado desde el original el 30 de enero de 2011. Consultado el 1 de abril de 2007.
- ↑ MacPherson, H. G. (1934). «An Investigation of the Magneto-Optic Method of Chemical Analysis». Physical Review (American Physical Society) 47 (4): 310-315. Bibcode:1935PhRv...47..310M. doi:10.1103/PhysRev.47.310.
- ↑ «Francium». McGraw-Hill Encyclopedia of Science & Technology 7. McGraw-Hill Professional. 2002. pp. 493–494. ISBN 978-0-07-913665-7.
- ↑ a b c d Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria (2006). «Transactinides and the future elements». En Morss; Edelstein, Norman M.; Fuger, eds. The Chemistry of the Actinide and Transactinide Elements (3rd edición). Dordrecht, The Netherlands: Springer. ISBN 978-1-4020-3555-5.
- ↑ Lougheed, R. W.; Landrum, J. H.; Hulet, E. K.; Wild, J. F.; Dougan, R. J.; Dougan, A. D.; Gäggeler, H.; Schädel, M. et al. (1985). «Search for superheavy elements using 48Ca + 254Esg reaction». Physical Review C 32 (5): 1760-1763. Bibcode:1985PhRvC..32.1760L. PMID 9953034. doi:10.1103/PhysRevC.32.1760.
- ↑ van der Krogt, Peter. «Ununennium». Elementymology & Elements Multidict. Consultado el 14 de febrero de 2011.
- ↑ Lougheed, R. W.; Landrum, J. H.; Hulet, E. K.; Wild, J. F.; Dougan, R. J.; Dougan, A. D.; Gäggeler, H.; Schädel, M. et al. (1985). «Search for superheavy elements using 48Ca + 254Esg reaction». Physical Review C 32 (5): 1760-1763. Bibcode:1985PhRvC..32.1760L. PMID 9953034. doi:10.1103/PhysRevC.32.1760.
- ↑ Schadel, M.; Brüchle, W.; Brügger, M.; Gäggeler, H.; Moody, K.; Schardt, D.; Sümmerer, K.; Hulet, E.; Dougan, A. (1986). «Heavy isotope production by multinucleon transfer reactions with 254Es». Journal of the Less Common Metals 122: 411-417. doi:10.1016/0022-5088(86)90435-2.
- ↑ «Hunt for element 119 set to begin». Chemistry World. 12 de septiembre de 2017. Consultado el 9 de enero de 2018.
- ↑ «transuranium element (chemical element)». Encyclopædia Britannica. c. 2006. Consultado el 16 de marzo de 2010.
- ↑ Emsley, John (2011). Nature's Building Blocks: An A-Z Guide to the Elements (New edición). New York, NY: Oxford University Press. p. 593. ISBN 978-0-19-960563-7.
- ↑ Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria (2006). «Transactinides and the future elements». En Morss; Edelstein, Norman M.; Fuger, eds. The Chemistry of the Actinide and Transactinide Elements (3rd edición). Dordrecht, The Netherlands: Springer. ISBN 978-1-4020-3555-5.
- ↑ Lodders, Katharina (2003). «Solar System Abundances and Condensation Temperatures of the Elements». The Astrophysical Journal 591 (2): 1220-1247. Bibcode:2003ApJ...591.1220L. doi:10.1086/375492.
- ↑ Oddo, Giuseppe (1914). «Die Molekularstruktur der radioaktiven Atome». Zeitschrift für Anorganische Chemie 87: 253-268. doi:10.1002/zaac.19140870118.
- ↑ Harkins, William D. (1917). «The Evolution of the Elements and the Stability of Complex Atoms. I. A New Periodic System Which Shows a Relation Between the Abundance of the Elements and the Structure of the Nuclei of Atoms». Journal of the American Chemical Society 39 (5): 856-879. doi:10.1021/ja02250a002.
- ↑ North, John (2008). Cosmos an illustrated history of astronomy and cosmology (Rev. and updated edición). Univ. of Chicago Press. p. 602. ISBN 978-0-226-59441-5.
- ↑ Lodders, Katharina (2003). «Solar System Abundances and Condensation Temperatures of the Elements». The Astrophysical Journal 591 (2): 1220-1247. Bibcode:2003ApJ...591.1220L. doi:10.1086/375492.
- ↑ Morgan, J. W.; Anders, E. (1980). «Chemical composition of Earth, Venus, and Mercury». Proceedings of the National Academy of Sciences 77 (12): 6973-6977. Bibcode:1980PNAS...77.6973M. PMC 350422. PMID 16592930. doi:10.1073/pnas.77.12.6973.
- ↑ Albarède, Francis (2003). Geochemistry: an introduction. Cambridge University Press. ISBN 978-0-521-89148-6.
- ↑ «Abundance in Earth's Crust». WebElements.com. Consultado el 14 de abril de 2007.
- ↑ «List of Periodic Table Elements Sorted by Abundance in Earth's crust». Israel Science and Technology Homepage. Consultado el 15 de abril de 2007.
- ↑ «Lithium Occurrence». Institute of Ocean Energy, Saga University, Japan. Archivado desde el original el 2 de mayo de 2009. Consultado el 13 de marzo de 2009.
- ↑ «Some Facts about Lithium». ENC Labs. Archivado desde el original el 10 de julio de 2011. Consultado el 15 de octubre de 2010.
- ↑ Schwochau, Klaus (1984). «Extraction of metals from sea water». Inorganic Chemistry. Topics in Current Chemistry. 124/1984. pp. 91-133. ISBN 978-3-540-13534-0. doi:10.1007/3-540-13534-0_3.
- ↑ Wise, M. A. (1995). «Trace element chemistry of lithium-rich micas from rare-element granitic pegmatites». Mineralogy and Petrology 55 (13): 203-215. Bibcode:1995MinPe..55..203W. doi:10.1007/BF01162588.
- ↑ Butterman, William C. (2004). «Mineral Commodity Profile: Cesium». United States Geological Survey. Archivado desde el original el 22 de noviembre de 2009. Consultado el 27 de diciembre de 2009.
- ↑ a b Wieser, Michael E.; Berglund, Michael (2009). «Atomic weights of the elements 2007 (IUPAC Technical Report)». Pure Appl. Chem. (IUPAC) 81 (11): 2131-2156. doi:10.1351/PAC-REP-09-08-03. Consultado el 7 de febrero de 2012.
- ↑ a b c Wieser, Michael E.; Coplen, Tyler B. (2011). «Atomic weights of the elements 2009 (IUPAC Technical Report)». Pure Appl. Chem. (IUPAC) 83 (2): 359-396. doi:10.1351/PAC-REP-10-09-14. Consultado el 11 de febrero de 2012.
- ↑ CRC Handbook of Chemistry and Physics 4. CRC. 2006. p. 12. ISBN 978-0-8493-0474-3.
- ↑ Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. pp. 151-153. ISBN 978-0-19-850341-5.
- ↑ Gagnon, Steve. «Francium». Jefferson Science Associates, LLC. Archivado desde el original el 31 de marzo de 2007. Consultado el 1 de abril de 2007.
- ↑ Winter, Mark. «Geological information». Francium. The University of Sheffield. Consultado el 26 de marzo de 2007.
- ↑ «It's Elemental — The Periodic Table of Elements». Jefferson Lab. Archivado desde el original el 29 de abril de 2007. Consultado el 14 de abril de 2007.
- ↑ a b c d Royal Society of Chemistry. «Visual Elements: Group 1 – The Alkali Metals». Visual Elements. Royal Society of Chemistry. Archivado desde el original el 5 de agosto de 2012. Consultado el 13 de enero de 2012.
- ↑ Averill, Bruce A.; Eldredge, Patricia (2007). «21.3: The Alkali Metals». Chemistry: Principles, Patterns, and Applications with Student Access Kit for Mastering General Chemistry (1st edición). Prentice Hall. ISBN 978-0-8053-3799-0. Consultado el 24 de junio de 2013.
- ↑ «Standard Uncertainty and Relative Standard Uncertainty». CODATA reference. National Institute of Standards and Technology. Consultado el 26 de septiembre de 2011.
- ↑ Wieser, Michael E.; Berglund, Michael (2009). «Atomic weights of the elements 2007 (IUPAC Technical Report)». Pure Appl. Chem. (IUPAC) 81 (11): 2131-2156. doi:10.1351/PAC-REP-09-08-03. Consultado el 7 de febrero de 2012.
- ↑ Wieser, Michael E.; Coplen, Tyler B. (2011). «Atomic weights of the elements 2009 (IUPAC Technical Report)». Pure Appl. Chem. (IUPAC) 83 (2): 359-396. doi:10.1351/PAC-REP-10-09-14. Consultado el 11 de febrero de 2012.
- ↑ a b Royal Society of Chemistry. «Visual Elements: Group 1 – The Alkali Metals». Visual Elements. Royal Society of Chemistry. Archivado desde el original el 5 de agosto de 2012. Consultado el 13 de enero de 2012.
- ↑ a b c Clark, Jim (2005). «Atomic and Physical Properties of the Group 1 Elements». chemguide. Consultado el 30 de enero de 2012.
- ↑ Gray, Theodore. «Facts, pictures, stories about the element Cesium in the Periodic Table». The Wooden Periodic Table Table. Consultado el 13 de enero de 2012.
- ↑ Royal Society of Chemistry. «Visual Elements: Group 1 – The Alkali Metals». Visual Elements. Royal Society of Chemistry. Archivado desde el original el 5 de agosto de 2012. Consultado el 13 de enero de 2012.
- ↑ Krebs, Robert E. (2006). The History and Use of Our Earth's Chemical Elements: A Reference Guide. Westport, Conn.: Greenwood Press. ISBN 978-0-313-33438-2.
- ↑ The OpenLearn team (2012). «Alkali metals». OpenLearn. The Open University. Consultado el 9 de julio de 2012.
- ↑ a b c d Royal Society of Chemistry. «Visual Elements: Group 1 – The Alkali Metals». Visual Elements. Royal Society of Chemistry. Archivado desde el original el 5 de agosto de 2012. Consultado el 13 de enero de 2012.
- ↑ Gray, Theodore. «Alkali Metal Bangs». Theodore Gray. Consultado el 13 de mayo de 2012.
- ↑ Butterman, William C. (2004). «Mineral Commodity Profile: Cesium». United States Geological Survey. Archivado desde el original el 22 de noviembre de 2009. Consultado el 27 de diciembre de 2009.
- ↑ Lide, D. R., ed. (2003). CRC Handbook of Chemistry and Physics (84th edición). Boca Raton, FL: CRC Press.
- ↑ a b Royal Society of Chemistry. «Visual Elements: Group 1 – The Alkali Metals». Visual Elements. Royal Society of Chemistry. Archivado desde el original el 5 de agosto de 2012. Consultado el 13 de enero de 2012.
- ↑ Lide, D. R., ed. (2003). CRC Handbook of Chemistry and Physics (84th edición). Boca Raton, FL: CRC Press.
- ↑ Dye, James L.; Ceraso, Joseph M.; Lok, Mei; Barnett, B. L.; Tehan, Frederick J. (1974). «Crystalline salt of the sodium anion (Na−)». J. Am. Chem. Soc. 96 (2): 608-609. doi:10.1021/ja00809a060.
- ↑ Tehan, Frederick J.; Barnett, B. L.; Dye, James L. (1974). «Alkali anions. Preparation and crystal structure of a compound which contains the cryptated sodium cation and the sodium anion». J. Am. Chem. Soc. 96 (23): 7203-7208. doi:10.1021/ja00830a005.
- ↑ Dye, J. L. (1979). «Compounds of Alkali Metal Anions». Angew. Chem. Int. Ed. Engl. 18 (8): 587-598. doi:10.1002/anie.197905871.
- ↑ Redko, M. Y.; Huang, R. H.; Jackson, J. E.; Harrison, J. F.; Dye, J. L. (2003). «Barium azacryptand sodide, the first alkalide with an alkaline Earth cation, also contains a novel dimer, (Na2)2−». J. Am. Chem. Soc. 125 (8): 2259-2263. PMID 12590555. doi:10.1021/ja027241m.
- ↑ a b Redko, M. Y.; Vlassa, M.; Jackson, J. E.; Misiolek, A. W.; Huang, R. H.; Dye, J. L. (2002). «"Inverse sodium hydride": a crystalline salt that contains H+ and Na−». J. Am. Chem. Soc. 124 (21): 5928-5929. PMID 12022811. doi:10.1021/ja025655.
- ↑ Sawicka, A.; Skurski, P.; Simons, J. (2003). «Inverse Sodium Hydride: A Theoretical Study». J. Am. Chem. Soc. 125 (13): 3954-3958. PMID 12656631. doi:10.1021/ja021136v.
- ↑ Burgess, John (1978). Metal Ions in Solution. Chichester: Ellis Horwood. p. 20. ISBN 978-0-85312-027-8.
- ↑ Averill, Bruce A.; Eldredge, Patricia (2007). «21.3: The Alkali Metals». Chemistry: Principles, Patterns, and Applications with Student Access Kit for Mastering General Chemistry (1st edición). Prentice Hall. ISBN 978-0-8053-3799-0. Consultado el 24 de junio de 2013.
- ↑ Richens, David. T. (1997). The Chemistry of Aqua Ions. Wiley. ISBN 978-0-471-97058-3.
- ↑ Persson, Ingmar (2010). «Hydrated metal ions in aqueous solution: How regular are their structures?». Pure Appl. Chem. 82 (10): 1901-1917. doi:10.1351/PAC-CON-09-10-22. Consultado el 23 de agosto de 2014.
- ↑ a b Royal Society of Chemistry. «Visual Elements: Group 1 – The Alkali Metals». Visual Elements. Royal Society of Chemistry. Archivado desde el original el 5 de agosto de 2012. Consultado el 13 de enero de 2012.
- ↑ Clark, Jim (2005). «Reaction of the Group 1 Elements with Oxygen and Chlorine». chemguide. Consultado el 27 de junio de 2012.
- ↑ Shriver, Duward; Atkins, Peter (2006). Inorganic Chemistry. W. H. Freeman. p. 259. ISBN 978-0-7167-4878-6. Consultado el 10 de noviembre de 2012.
- ↑ a b Royal Society of Chemistry. «Visual Elements: Group 1 – The Alkali Metals». Visual Elements. Royal Society of Chemistry. Archivado desde el original el 5 de agosto de 2012. Consultado el 13 de enero de 2012.
- ↑ Andreev, S.V.; Letokhov, V.S.; Mishin, V.I. (1987). «Laser resonance photoionization spectroscopy of Rydberg levels in Fr». Phys. Rev. Lett. 59 (12): 1274-76. Bibcode:1987PhRvL..59.1274A. PMID 10035190. doi:10.1103/PhysRevLett.59.1274.
- ↑ Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria (2006). «Transactinides and the future elements». En Morss; Edelstein, Norman M.; Fuger, eds. The Chemistry of the Actinide and Transactinide Elements (3rd edición). Dordrecht, The Netherlands: Springer. ISBN 978-1-4020-3555-5.
- ↑ a b c d Thayer, John S. (2010). «Relativistic Effects and the Chemistry of the Heavier Main Group Elements». Relativistic Methods for Chemists. Challenges and Advances in Computational Chemistry and Physics 10: 81, 84. ISBN 978-1-4020-9974-8. doi:10.1007/978-1-4020-9975-5_2.
- ↑ Landau, A.; Eliav, E.; Ishikawa, Y.; Kaldor, U. (2001). «Benchmark calculations of electron affinities of the alkali atoms sodium to eka-francium (element 119)». J. Chem. Phys. 115 (6): 2389. Bibcode:2001JChPh.115.2389L. doi:10.1063/1.1386413.
- ↑ Jones, Cameron; Mountford, Philip; Stasch, Andreas; Blake, Matthew P. (22 de junio de 2015). «s-block Metal-Metal Bonds». En Liddle, Stephen T., ed. Molecular Metal-Metal Bonds: Compounds, Synthesis, Properties. John Wiley and Sons. pp. 23-24. ISBN 978-3-527-33541-1.
- ↑
- ↑
- ↑ «Universal Nuclide Chart». Nucleonica. Institute for Transuranium Elements. 2007–2012. Consultado el 17 de abril de 2011.
- ↑ Patton, I. Jocelyn; Waldbauer, L. J. (1926). «The Radioactivity of the Alkali Metals». Chemical Reviews 3: 81-93. doi:10.1021/cr60009a003.
- ↑ McLennan, J. C.; Kennedy, W. T. (1908). «On the radioactivity of potassium and other alkali metals». Philosophical Magazine. 6 16 (93): 377-395. doi:10.1080/14786440908636519.
- ↑ Sonzogni, Alejandro. «Interactive Chart of Nuclides». National Nuclear Data Center: Brookhaven National Laboratory. Archivado desde el original el 10 de octubre de 2018. Consultado el 4 de octubre de 2012.
- ↑ «Potassium-40». Human Health Fact Sheet. Argonne National Laboratory, Environmental Science Division. August 2005. Archivado desde el original el 7 de marzo de 2012. Consultado el 7 de febrero de 2012.
- ↑ Van der Krogt, Peter (10 de enero de 2006). «Francium». Elementymology & Elements Multidict. Consultado el 8 de abril de 2007.
- ↑ National Institute of Standards and Technology. «Radionuclide Half-Life Measurements». Archivado desde el original el 12 de agosto de 2016. Consultado el 7 de noviembre de 2011.
- ↑ Radioisotope Brief: Cesium-137 (Cs-137). U.S. National Center for Environmental Health
- ↑ The Radiological Accident in Goiânia. IAEA. 1988.
- ↑ Delacroix, D.; Guerre, J. P.; Leblanc, P.; Hickman, C. (2002). Radionuclide and Radiation Protection Data Handbook 2002 (2nd edición). Nuclear Technology Publishing. ISBN 978-1-870965-87-3.
- ↑ a b Royal Society of Chemistry. «Visual Elements: Group 1 – The Alkali Metals». Visual Elements. Royal Society of Chemistry. Archivado desde el original el 5 de agosto de 2012. Consultado el 13 de enero de 2012.
- ↑ a b c d Clark, Jim (2005). «Atomic and Physical Properties of the Group 1 Elements». chemguide. Consultado el 30 de enero de 2012.
- ↑ a b Clark, Jim (2005). «Atomic and Physical Properties of the Group 1 Elements». chemguide. Consultado el 30 de enero de 2012.
- ↑ L. Brown, Theodore; LeMay, Jr., H. Eugene; Bursten, Bruce E.; Burdge, Julia R. (2003). Chemistry: The Central Science (8th edición). US: Pearson Education. ISBN 978-0-13-061142-0.
- ↑ Royal Society of Chemistry. «Visual Elements: Group 1 – The Alkali Metals». Visual Elements. Royal Society of Chemistry. Archivado desde el original el 5 de agosto de 2012. Consultado el 13 de enero de 2012.
- ↑ Clark, Jim (2005). «Atomic and Physical Properties of the Group 1 Elements». chemguide. Consultado el 30 de enero de 2012.
- ↑ Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria (2006). «Transactinides and the future elements». En Morss; Edelstein, Norman M.; Fuger, eds. The Chemistry of the Actinide and Transactinide Elements (3rd edición). Dordrecht, The Netherlands: Springer. ISBN 978-1-4020-3555-5.
- ↑ Royal Society of Chemistry. «Visual Elements: Group 1 – The Alkali Metals». Visual Elements. Royal Society of Chemistry. Archivado desde el original el 5 de agosto de 2012. Consultado el 13 de enero de 2012.
- ↑ Clark, Jim (2005). «Reaction of the Group 1 Elements with Water». chemguide. Consultado el 18 de junio de 2012.
- ↑ Unión Internacional de Química Pura y Aplicada. «{{{title}}}». Compendium of Chemical Terminology. Versión en línea (en inglés).
- ↑ Clark, Jim (2005). «Atomic and Physical Properties of the Group 1 Elements». chemguide. Consultado el 30 de enero de 2012.
- ↑ Clark, Jim (2005). «Atomic and Physical Properties of the Group 1 Elements». chemguide. Consultado el 30 de enero de 2012.
- ↑ a b Royal Society of Chemistry. «Visual Elements: Group 1 – The Alkali Metals». Visual Elements. Royal Society of Chemistry. Archivado desde el original el 5 de agosto de 2012. Consultado el 13 de enero de 2012.
- ↑ Goldberg, David E. (1988). 3,000 Solved Problems in Chemistry (1st edición). McGraw-Hill. ISBN 978-0-07-023684-4. Section 17.43, page 321
- ↑ Theodore, Louis; Dupont, R. Ryan; Ganesan, Kumar, eds. (1999). Pollution Prevention: The Waste Management Approach to the 21st Century. CRC Press. p. 15 Section 27. ISBN 978-1-56670-495-3.
- ↑ a b c d e Clark, Jim (2005). «Atomic and Physical Properties of the Group 1 Elements». chemguide. Consultado el 30 de enero de 2012.
- ↑ a b Clark, Jim (2000). «Metallic Bonding». chemguide. Consultado el 23 de marzo de 2012.
- ↑ Clark, Jim (2005). «Atomic and Physical Properties of the Group 1 Elements». chemguide. Consultado el 30 de enero de 2012.
- ↑ Royal Society of Chemistry. «Visual Elements: Group 1 – The Alkali Metals». Visual Elements. Royal Society of Chemistry. Archivado desde el original el 5 de agosto de 2012. Consultado el 13 de enero de 2012.
- ↑ Clark, Jim (2005). «Reaction of the Group 1 Elements with Water». chemguide. Consultado el 18 de junio de 2012.
- ↑ Royal Society of Chemistry. «Visual Elements: Group 1 – The Alkali Metals». Visual Elements. Royal Society of Chemistry. Archivado desde el original el 5 de agosto de 2012. Consultado el 13 de enero de 2012.
- ↑ Gray, Theodore. «Alkali Metal Bangs». Theodore Gray. Consultado el 13 de mayo de 2012.
- ↑ a b Mason, Philip E. (26 Jan 2015). «Coulomb explosion during the early stages of the reaction of alkali metals with water». Nature Chemistry 7 (3): 250-254. Bibcode:2015NatCh...7..250M. PMID 25698335. doi:10.1038/nchem.2161.
- ↑ Buszek, Keith R. (2001) "Sodium Amalgam" in Encyclopedia of Reagents for Organic Synthesis, Wiley. doi 10.1002/047084289X.rs040
- ↑ «Sodium-Potassium Alloy (NaK)». BASF.Uso incorrecto de la plantilla enlace roto (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Kaner, Richard (2003). «C&EN: It's Elemental: The Periodic Table – Cesium». American Chemical Society. Consultado el 25 de febrero de 2010.
- ↑ Sevov, S.C. "Zintl Phases", pp. 113–132 in Intermetallic Compounds, Principles and Practice: Progress, Vol. 3. Westbrook, J.H.; Freisher, R.L.: Eds.; John Wiley & Sons. Ltd., Chichester, England doi 10.1002/0470845856 ISBN 978-0-470-84585-1
- ↑ S.M. Kauzlarich, Encyclopedia of Inorganic chemistry, 1994, John Wiley & Sons, ISBN 0-471-93620-0
- ↑ Hagen, A. P. (17 de septiembre de 2009). Inorganic Reactions and Methods, The Formation of Bonds to Group-I, -II, and -IIIB Elements. John Wiley & Sons. pp. 204-5. ISBN 978-0-470-14549-4.
- ↑ Matkovich, V. I. (6 de diciembre de 2012). Boron and Refractory Borides. Springer. pp. 262-92. ISBN 978-3-642-66620-9.
- ↑ Hermann, Andreas; McSorley, Alexandra; N. W., Ashcroft; Hoffmann, Roald (2012). «From Wade–Mingos to Zintl–Klemm at 100 GPa: Binary Compounds of Boron and Lithium». Journal of the American Chemical Society 2012 (134): 18606-18. PMID 23066852. doi:10.1021/ja308492g. Archivado desde el original el 27 de septiembre de 2020. Consultado el 21 de agosto de 2016.
- ↑ Averill, Bruce A.; Eldredge, Patricia (2007). «21.3: The Alkali Metals». Chemistry: Principles, Patterns, and Applications with Student Access Kit for Mastering General Chemistry (1st edición). Prentice Hall. ISBN 978-0-8053-3799-0. Consultado el 24 de junio de 2013.
- ↑ Housecroft, Catherine E.; Sharpe, Alan G. (2008). «Chapter 14: The group 14 elements». Inorganic Chemistry, 3rd Edition. Pearson. p. 386. ISBN 978-0-13-175553-6.
- ↑ NIST Ionizing Radiation Division 2001 – Technical Highlights. physics.nist.gov
- ↑ Emery, N. et al. (2008). «Review: Synthesis and superconducting properties of CaC6». Sci. Technol. Adv. Mater. 9 (4): 044102. Bibcode:2008STAdM...9d4102E. PMC 5099629. PMID 27878015. doi:10.1088/1468-6996/9/4/044102.
- ↑ Averill, Bruce A.; Eldredge, Patricia (2007). «21.3: The Alkali Metals». Chemistry: Principles, Patterns, and Applications with Student Access Kit for Mastering General Chemistry (1st edición). Prentice Hall. ISBN 978-0-8053-3799-0. Consultado el 24 de junio de 2013.
- ↑ S.M. Kauzlarich, Encyclopedia of Inorganic chemistry, 1994, John Wiley & Sons, ISBN 0-471-93620-0
- ↑ Hoch, Constantin; Wendorff, Marco; Röhr, Caroline (2002). «Tetrapotassium nonastannide, K4Sn9». Acta Crystallographica Section C 58 (4): I45-I46. PMID 11932511. doi:10.1107/S0108270102002032.
- ↑ Gregory, Duncan H.; O'Meara, Paul M.; Gordon, Alexandra G.; Hodges, Jason P.; Short, Simine; Jorgensen, James D. (2002). «Structure of Lithium Nitride and Transition-Metal-Doped Derivatives, Li3−x−yMxN (M= Ni, Cu): A Powder Neutron Diffraction Study». Chem. Mater. 14 (5): 2063-2070. doi:10.1021/cm010718t.
- ↑ Clark, Jim (2005). «Reaction of the Group 1 Elements with Oxygen and Chlorine». chemguide. Consultado el 27 de junio de 2012.
- ↑ Fischer, D.; Jansen, M. (2002). «Synthesis and structure of Na3N». Angew Chem 41 (10): 1755-1756. doi:10.1002/1521-3773(20020517)41:10<1755::AID-ANIE1755>3.0.CO;2-C.
- ↑ Fischer, D.; Cancarevic, Z.; Schön, J. C.; Jansen, M. Z. (2004). «Synthesis and structure of K3N». Z. Anorg. Allg. Chem. 630 (1): 156-160. doi:10.1002/zaac.200300280.. 'Elusive Binary Compound Prepared' Chemical & Engineering News 80 No. 20 (20 May 2002)
- ↑ Averill, Bruce A.; Eldredge, Patricia (2007). «21.3: The Alkali Metals». Chemistry: Principles, Patterns, and Applications with Student Access Kit for Mastering General Chemistry (1st edición). Prentice Hall. ISBN 978-0-8053-3799-0. Consultado el 24 de junio de 2013.
- ↑ H.G. Von Schnering, W. Hönle Phosphides – Solid-state Chemistry Encyclopedia of Inorganic Chemistry Ed. R. Bruce King (1994) John Wiley & Sons ISBN 0-471-93620-0
- ↑ Kahlenberg, Louis (2008). Outlines of Chemistry – A Textbook for College Students. READ BOOKS. pp. 324-325. ISBN 978-1-4097-6995-8.
- ↑ a b King, R. Bruce (1995). Inorganic Chemistry of Main Group Elements. Wiley-VCH. ISBN 978-0-471-18602-1.
- ↑ «Welcome to Arthur Mar's Research Group». University of Alberta. University of Alberta. 1999–2013. Archivado desde el original el 4 de diciembre de 2012. Consultado el 24 de junio de 2013.
- ↑ Clark, Jim (2005). «Reaction of the Group 1 Elements with Oxygen and Chlorine». chemguide. Consultado el 27 de junio de 2012.
- ↑ Clark, Jim (2005). «Reaction of the Group 1 Elements with Oxygen and Chlorine». chemguide. Consultado el 27 de junio de 2012.
- ↑ Averill, Bruce A.; Eldredge, Patricia (2007). «21.3: The Alkali Metals». Chemistry: Principles, Patterns, and Applications with Student Access Kit for Mastering General Chemistry (1st edición). Prentice Hall. ISBN 978-0-8053-3799-0. Consultado el 24 de junio de 2013.
- ↑ Lindsay, D. M.; Garland, D. A. (1987). «ESR spectra of matrix-isolated lithium superoxide». The Journal of Physical Chemistry 91 (24): 6158-61. doi:10.1021/j100308a020.
- ↑ Vol'nov, I. I.; Matveev, V. V. (1963). «Synthesis of cesium ozonide through cesium superoxide». Bulletin of the Academy of Sciences, USSR Division of Chemical Science 12 (6): 1040-1043. doi:10.1007/BF00845494.
- ↑ Tokareva, S. A. (1971). «Alkali and Alkaline Earth Metal Ozonides». Russian Chemical Reviews 40 (2): 165-174. Bibcode:1971RuCRv..40..165T. doi:10.1070/RC1971v040n02ABEH001903.
- ↑ Simon, A. (1997). «Group 1 and 2 Suboxides and Subnitrides — Metals with Atomic Size Holes and Tunnels». Coordination Chemistry Reviews 163: 253-270. doi:10.1016/S0010-8545(97)00013-1.
- ↑ Tsai, Khi-Ruey; Harris, P. M.; Lassettre, E. N. (1956). «The Crystal Structure of Tricesium Monoxide». Journal of Physical Chemistry 60 (3): 345-347. doi:10.1021/j150537a023.
- ↑ Okamoto, H. (2009). «Cs-O (Cesium-Oxygen)». Journal of Phase Equilibria and Diffusion 31: 86-87. doi:10.1007/s11669-009-9636-5.
- ↑ Band, A.; Albu-Yaron, A.; Livneh, T.; Cohen, H.; Feldman, Y.; Shimon, L.; Popovitz-Biro, R.; Lyahovitskaya, V. et al. (2004). «Characterization of Oxides of Cesium». The Journal of Physical Chemistry B 108 (33): 12360-12367. doi:10.1021/jp036432o.
- ↑ Brauer, G. (1947). «Untersuchungen über das System Cäsium-Sauerstoff». Zeitschrift für Anorganische Chemie 255 (1–3): 101-124. doi:10.1002/zaac.19472550110.
- ↑ Butterman, William C. (2004). «Mineral Commodity Profile: Cesium». United States Geological Survey. Archivado desde el original el 22 de noviembre de 2009. Consultado el 27 de diciembre de 2009.
- ↑ a b Royal Society of Chemistry. «Visual Elements: Group 1 – The Alkali Metals». Visual Elements. Royal Society of Chemistry. Archivado desde el original el 5 de agosto de 2012. Consultado el 13 de enero de 2012.
- ↑ Clark, Jim (2005). «Reaction of the Group 1 Elements with Oxygen and Chlorine». chemguide. Consultado el 27 de junio de 2012.
- ↑ Averill, Bruce A.; Eldredge, Patricia (2007). «21.3: The Alkali Metals». Chemistry: Principles, Patterns, and Applications with Student Access Kit for Mastering General Chemistry (1st edición). Prentice Hall. ISBN 978-0-8053-3799-0. Consultado el 24 de junio de 2013.
- ↑ a b Averill, Bruce A.; Eldredge, Patricia (2007). «21.3: The Alkali Metals». Chemistry: Principles, Patterns, and Applications with Student Access Kit for Mastering General Chemistry (1st edición). Prentice Hall. ISBN 978-0-8053-3799-0. Consultado el 24 de junio de 2013.
- ↑ Cotton, F. A.; Wilkinson, G. (1972). Advanced Inorganic Chemistry. John Wiley and Sons Inc. ISBN 978-0-471-17560-5.
- ↑ T. Kottke, D. Stalke (September 1993). «Structures of Classical Reagents in Chemical Synthesis: (nBuLi)6, (tBuLi)4, and the Metastable (tBuLi · Et2O)2». Angew. Chem. Int. Ed. Engl. 32 (4): 580-582. doi:10.1002/anie.199305801.
- ↑ Elschenbroich, C. "Organometallics" (2006) Wiley-VCH: Weinheim. ISBN 3-527-29390-6.
- ↑ Averill, Bruce A.; Eldredge, Patricia (2007). «21.3: The Alkali Metals». Chemistry: Principles, Patterns, and Applications with Student Access Kit for Mastering General Chemistry (1st edición). Prentice Hall. ISBN 978-0-8053-3799-0. Consultado el 24 de junio de 2013.
- ↑ Brown, T. L.; Rogers, M. T. (1957). «The Preparation and Properties of Crystalline Lithium Alkyls». Journal of the American Chemical Society 79 (8): 1859-1861. doi:10.1021/ja01565a024.
- ↑ a b Plantilla:Greenwood&Earnshaw2nd
- ↑ Dinnebier, R. E.; Behrens, U.; Olbrich, F. (1998). «Lewis Base-Free Phenyllithium: Determination of the Solid-State Structure by Synchrotron Powder Diffraction». Journal of the American Chemical Society 120 (7): 1430-1433. doi:10.1021/ja972816e.
- ↑ a b Plantilla:Greenwood&Earnshaw2nd
- ↑ Schlosser, Manfred (1988). «Superbases for organic synthesis». Pure Appl. Chem. 60 (11): 1627-1634. doi:10.1351/pac198860111627.
- ↑ Clegg, William; Conway, Ben; Kennedy, Alan R.; Klett, Jan; Mulvey, Robert E.; Russo, Luca (2011). «Synthesis and Structures of \(Trimethylsilyl)methylsodium and -potassium with Bi- and Tridentate N-Donor Ligands». European Journal of Inorganic Chemistry 2011 (5): 721-726. doi:10.1002/ejic.201000983.
- ↑ Averill, Bruce A.; Eldredge, Patricia (2007). «21.3: The Alkali Metals». Chemistry: Principles, Patterns, and Applications with Student Access Kit for Mastering General Chemistry (1st edición). Prentice Hall. ISBN 978-0-8053-3799-0. Consultado el 24 de junio de 2013.
- ↑ King, R. Bruce (1995). Inorganic Chemistry of Main Group Elements. Wiley-VCH. ISBN 978-0-471-18602-1.
- ↑ King, R. Bruce (1995). Inorganic Chemistry of Main Group Elements. Wiley-VCH. ISBN 978-0-471-18602-1.
- ↑ a b c King, R. Bruce (1995). Inorganic Chemistry of Main Group Elements. Wiley-VCH. ISBN 978-0-471-18602-1.
- ↑ "Inorganic Chemistry" by Gary L. Miessler and Donald A. Tar, 6th edition, Pearson
- ↑ "Inorganic Chemistry" by Cotton and Wilkinson
- ↑ "Inorganic Chemistry" by Gary L. Miessler and Donald A. Tar, 6th edition, Pearson
- ↑ "Inorganic Chemistry" by Gary L. Miessler and Donald A. Tar, 6th edition, Pearson
- ↑ "Inorganic Chemistry" by Gary L. Miessler and Donald A. Tar, 6th edition, Pearson
- ↑ a b c Pyykkö, Pekka (2011). «A suggested periodic table up to Z ≤ 172, based on Dirac–Fock calculations on atoms and ions». Physical Chemistry Chemical Physics 13 (1): 161-8. Bibcode:2011PCCP...13..161P. PMID 20967377. doi:10.1039/c0cp01575j.
- ↑ a b c d e Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria (2006). «Transactinides and the future elements». En Morss; Edelstein, Norman M.; Fuger, eds. The Chemistry of the Actinide and Transactinide Elements (3rd edición). Dordrecht, The Netherlands: Springer. ISBN 978-1-4020-3555-5.
- ↑ a b «transuranium element (chemical element)». Encyclopædia Britannica. c. 2006. Consultado el 16 de marzo de 2010.
- ↑ Gäggeler, Heinz W. (5–7 November 2007). «Gas Phase Chemistry of Superheavy Elements». Lecture Course Texas A&M. Archivado desde el original el 20 de febrero de 2012. Consultado el 26 de febrero de 2012.
- ↑ a b c Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria (2006). «Transactinides and the future elements». En Morss; Edelstein, Norman M.; Fuger, eds. The Chemistry of the Actinide and Transactinide Elements (3rd edición). Dordrecht, The Netherlands: Springer. ISBN 978-1-4020-3555-5.
- ↑ Royal Society of Chemistry. «Visual Elements: Group 1 – The Alkali Metals». Visual Elements. Royal Society of Chemistry. Archivado desde el original el 5 de agosto de 2012. Consultado el 13 de enero de 2012.
- ↑ a b Plantilla:Greenwood&Earnshaw2nd
- ↑ Thayer, John S. (2010). «Relativistic Effects and the Chemistry of the Heavier Main Group Elements». Relativistic Methods for Chemists. Challenges and Advances in Computational Chemistry and Physics 10: 81, 84. ISBN 978-1-4020-9974-8. doi:10.1007/978-1-4020-9975-5_2.
- ↑ a b c d Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria (2006). «Transactinides and the future elements». En Morss; Edelstein, Norman M.; Fuger, eds. The Chemistry of the Actinide and Transactinide Elements (3rd edición). Dordrecht, The Netherlands: Springer. ISBN 978-1-4020-3555-5.
- ↑ Pyykkö, Pekka (2011). «A suggested periodic table up to Z ≤ 172, based on Dirac–Fock calculations on atoms and ions». Physical Chemistry Chemical Physics 13 (1): 161-8. Bibcode:2011PCCP...13..161P. PMID 20967377. doi:10.1039/c0cp01575j.
- ↑ Fricke, Burkhard (1975). «Superheavy elements: a prediction of their chemical and physical properties». Recent Impact of Physics on Inorganic Chemistry. Structure and Bonding 21: 89–144. ISBN 978-3-540-07109-9. doi:10.1007/BFb0116498. Consultado el 4 de octubre de 2013.
- ↑ Fricke, Burkhard (1977). «Dirac-Fock-Slater calculations for the elements Z = 100, fermium, to Z = 173». Recent Impact of Physics on Inorganic Chemistry 19: 83-192. Bibcode:1977ADNDT..19...83F. doi:10.1016/0092-640X(77)90010-9. Archivado desde el original el 22 de marzo de 2016. Consultado el 25 de febrero de 2016.
- ↑ Kul'sha, A. V. «Есть ли граница у таблицы Менделеева?» [Is there a boundary to the Mendeleev table?]. www.primefan.ru (en ruso). Consultado el 8 de septiembre de 2018.
- ↑ Pyykkö, Pekka (2011). «A suggested periodic table up to Z ≤ 172, based on Dirac–Fock calculations on atoms and ions». Physical Chemistry Chemical Physics 13 (1): 161-8. Bibcode:2011PCCP...13..161P. PMID 20967377. doi:10.1039/c0cp01575j.
- ↑ Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria (2006). «Transactinides and the future elements». En Morss; Edelstein, Norman M.; Fuger, eds. The Chemistry of the Actinide and Transactinide Elements (3rd edición). Dordrecht, The Netherlands: Springer. ISBN 978-1-4020-3555-5.
- ↑ . 4th International Conference on the Chemistry and Physics of the Transactinide Elements. 5 de septiembre de 2011.
- ↑ Nuclear scientists eye future landfall on a second 'island of stability'. EurekAlert! (2008-04-06). Retrieved on 2016-11-25.
- ↑ Grumann, Jens; Mosel, Ulrich; Fink, Bernd; Greiner, Walter (1969). «Investigation of the stability of superheavy nuclei around Z=114 and Z=164». Zeitschrift für Physik 228 (5): 371-386. Bibcode:1969ZPhy..228..371G. doi:10.1007/BF01406719.
- ↑ Dietzel, P. D.; Kremer, R. K.; Jansen, M. (8 de enero de 2007). «Superoxide compounds of the large pseudo-alkali-metal ions tetramethylammonium, -phosphonium, and -arsonium.». Chem Asian J. 2 (1): 66-75. PMID 17441140. doi:10.1002/asia.200600306.
- ↑ «International Union of Pure and Applied Chemistry > Periodic Table of the Elements». IUPAC. Consultado el 1 de mayo de 2011.
- ↑ Folden, Cody (31 de enero de 2009). «The Heaviest Elements in the Universe». Saturday Morning Physics at Texas A&M. Archivado desde el original el 10 de agosto de 2014. Consultado el 9 de marzo de 2012.
- ↑ Emsley, J. (1989). The Elements. Oxford: Clarendon Press. pp. 22-23.
- ↑ Winter, Mark J. (1994) Chemical Bonding, Oxford University Press, ISBN 0-19-855694-2
- ↑ a b c King, R. Bruce (1995). Inorganic Chemistry of Main Group Elements. Wiley-VCH. ISBN 978-0-471-18602-1.
- ↑ «International Union of Pure and Applied Chemistry > Periodic Table of the Elements». IUPAC. Consultado el 1 de mayo de 2011.
- ↑ a b Cronyn, Marshall W. (August 2003). «The Proper Place for Hydrogen in the Periodic Table». Journal of Chemical Education 80 (8): 947-951. Bibcode:2003JChEd..80..947C. doi:10.1021/ed080p947.
- ↑ Huheey, J.E.; Keiter, E.A. and Keiter, R.L. (1993) Inorganic Chemistry: Principles of Structure and Reactivity, 4th edition, HarperCollins, New York, USA.
- ↑ James, A.M. and Lord, M.P. (1992) Macmillan's Chemical and Physical Data, Macmillan, London, UK.
- ↑ Redko, M. Y.; Vlassa, M.; Jackson, J. E.; Misiolek, A. W.; Huang, R. H.; Dye, J. L. (2002). «"Inverse sodium hydride": a crystalline salt that contains H+ and Na−». J. Am. Chem. Soc. 124 (21): 5928-5929. PMID 12022811. doi:10.1021/ja025655+.
- ↑ Sawicka, A.; Skurski, P.; Simons, J. (2003). «Inverse Sodium Hydride: A Theoretical Study». J. Am. Chem. Soc. 125 (13): 3954-3958. PMID 12656631. doi:10.1021/ja021136v.
- ↑ King, R. Bruce (1995). Inorganic Chemistry of Main Group Elements. Wiley-VCH. ISBN 978-0-471-18602-1.
- ↑ Cronyn, Marshall W. (August 2003). «The Proper Place for Hydrogen in the Periodic Table». Journal of Chemical Education 80 (8): 947-951. Bibcode:2003JChEd..80..947C. doi:10.1021/ed080p947.
- ↑ Wigner, E.; Huntington, H. B. (1935). «On the possibility of a metallic modification of hydrogen». Journal of Chemical Physics 3 (12): 764. Bibcode:1935JChPh...3..764W. doi:10.1063/1.1749590.
- ↑ Nellis, W. J.; Weir, S. T.; Mitchell, A. C. (1999). «Metallization of fluid hydrogen at 140 GPa (1.4 Mbar) by shock compression». Shock Waves 9 (5): 301-305. Bibcode:1999ShWav...9..301N. doi:10.1007/s001930050189.
- ↑ a b c Plantilla:Greenwood&Earnshaw2nd
- ↑ a b c Cronyn, Marshall W. (August 2003). «The Proper Place for Hydrogen in the Periodic Table». Journal of Chemical Education 80 (8): 947-951. Bibcode:2003JChEd..80..947C. doi:10.1021/ed080p947.
- ↑ Cousins, David M.; Davidson, Matthew G.; García-Vivó, Daniel (2013). «Unprecedented participation of a four-coordinate hydrogen atom in the cubane core of lithium and sodium phenolates». Chem. Commun. 49 (100): 11809-11811. PMID 24217230. doi:10.1039/c3cc47393g. Consultado el 7 de agosto de 2014.
- ↑ Dietzel, P. D.; Kremer, R. K.; Jansen, M. (8 de enero de 2007). «Superoxide compounds of the large pseudo-alkali-metal ions tetramethylammonium, -phosphonium, and -arsonium.». Chem Asian J. 2 (1): 66-75. PMID 17441140. doi:10.1002/asia.200600306.
- ↑ Leach, Mark R. «2002 Inorganic Chemist's Periodic Table». Consultado el 16 de octubre de 2012.
- ↑ a b c Stevenson, D. J. (20 de noviembre de 1975). «Does metallic ammonium exist?». Nature (Nature Publishing Group) 258 (5532): 222-223. Bibcode:1975Natur.258..222S. doi:10.1038/258222a0.
- ↑ a b Bernal, M. J. M.; Massey, H. S. W. (3 de febrero de 1954). «Metallic Ammonium». Monthly Notices of the Royal Astronomical Society (Wiley-Blackwell for the Royal Astronomical Society) 114 (2): 172-179. Bibcode:1954MNRAS.114..172B. doi:10.1093/mnras/114.2.172.
- ↑ «Solubility Rules!». chem.sc.edu.
- ↑ Reedy, J. H. (1 de octubre de 1929). «Lecture demonstration of ammonium amalgam». Journal of Chemical Education 6 (10): 1767. Bibcode:1929JChEd...6.1767R. doi:10.1021/ed006p1767.
- ↑ Plantilla:Greenwood&Earnshaw2nd
- ↑ King, R. Bruce (1995). Inorganic Chemistry of Main Group Elements. Wiley-VCH. ISBN 978-0-471-18602-1.
- ↑ King, R. Bruce (1995). Inorganic Chemistry of Main Group Elements. Wiley-VCH. ISBN 978-0-471-18602-1.
- ↑ Connelly, Neil G.; Geiger, William E. (1996). «Chemical Redox Agents for Organometallic Chemistry». Chemical Reviews 96 (2): 877-910. PMID 11848774. doi:10.1021/cr940053x.
- ↑ El Murr, N.; Sheats, J. E.; Geiger, W. E.; Holloway, J. D. L. (1979). «Electrochemical Reduction Pathways of the Rhodocenium Ion. Dimerization and Reduction of Rhodocene». Inorg. Chem. 18 (6): 1443-1446. doi:10.1021/ic50196a007.
- ↑ Keller, H. J.; Wawersik, H. (1967). «Spektroskopische Untersuchungen an Komplexverbindungen. VI. EPR-spektren von (C5H5)2Rh und (C5H5)2Ir». J. Organomet. Chem. (en alemán) 8 (1): 185-188. doi:10.1016/S0022-328X(00)84718-X.
- ↑ a b c d e Plantilla:Greenwood&Earnshaw2nd
- ↑ Shannon, R. D. (1976). «Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides». Acta Crystallogr A 32 (5): 751-767. Bibcode:1976AcCrA..32..751S. doi:10.1107/S0567739476001551. Archivado desde el original el 14 de agosto de 2020. Consultado el 7 de agosto de 2020.
- ↑ a b Crookes, William (1864). «On Thallium». Journal of the Chemical Society (Harrison & Sons) 17: 112-152. doi:10.1039/js8641700112.
- ↑ a b Leach, Mark R. (1999–2012). «The Internet Database of Periodic Tables». meta-synthesis.com. Consultado el 6 de abril de 2012.
- ↑ Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria (2006). «Transactinides and the future elements». En Morss; Edelstein, Norman M.; Fuger, eds. The Chemistry of the Actinide and Transactinide Elements (3rd edición). Dordrecht, The Netherlands: Springer. ISBN 978-1-4020-3555-5.
- ↑ Plantilla:RedBook2005.
- ↑ Mudring, Anja-Verena (2007). «Thallium Halides – New Aspects of the Stereochemical Activity of Electron Lone Pairs of Heavier Main-Group Elements». European Journal of Inorganic Chemistry 2007 (6): 882-890. doi:10.1002/ejic.200600975.
- ↑ Russell AM & Lee KL (2005) Structure-property relations in nonferrous metals. Wiley-Interscience, New York. p. 302. ISBN 0-471-64952-X
- ↑ Deming HG (1940) Fundamental Chemistry, John Wiley & Sons, New York, pp. 705–7
- ↑ Jensen, William B. (2003). «The Place of Zinc, Cadmium, and Mercury in the Periodic Table». Journal of Chemical Education (American Chemical Society) 80 (8): 952-961. Bibcode:2003JChEd..80..952J. doi:10.1021/ed080p952. Archivado desde el original el 11 de junio de 2010. Consultado el 6 de mayo de 2012.
- ↑ Bailar, J. C. (1973) Comprehensive inorganic chemistry, vol. 3, p. 16. ISBN 1-57215-291-5
- ↑ a b c Jensen, William B. (2003). «The Place of Zinc, Cadmium, and Mercury in the Periodic Table». Journal of Chemical Education (American Chemical Society) 80 (8): 952-961. Bibcode:2003JChEd..80..952J. doi:10.1021/ed080p952. Archivado desde el original el 11 de junio de 2010. Consultado el 6 de mayo de 2012.
- ↑ a b c d e f Plantilla:Greenwood&Earnshaw2nd
- ↑ Royal Society of Chemistry. «Visual Elements: Group 1 – The Alkali Metals». Visual Elements. Royal Society of Chemistry. Archivado desde el original el 5 de agosto de 2012. Consultado el 13 de enero de 2012.
- ↑ a b c Averill, Bruce A.; Eldredge, Patricia (2007). «21.3: The Alkali Metals». Chemistry: Principles, Patterns, and Applications with Student Access Kit for Mastering General Chemistry (1st edición). Prentice Hall. ISBN 978-0-8053-3799-0. Consultado el 24 de junio de 2013.
- ↑ King, R. Bruce (1995). Inorganic Chemistry of Main Group Elements. Wiley-VCH. ISBN 978-0-471-18602-1.
- ↑ Ober, Joyce A. «Lithium». United States Geological Survey. pp. 77-78. Archivado desde el original el 11 de julio de 2007. Consultado el 19 de agosto de 2007.
- ↑ a b c Royal Society of Chemistry. «Visual Elements: Group 1 – The Alkali Metals». Visual Elements. Royal Society of Chemistry. Archivado desde el original el 5 de agosto de 2012. Consultado el 13 de enero de 2012.
- ↑ Pauling, Linus. General Chemistry (1970 edición). Dover Publications.
- ↑ «Los Alamos National Laboratory – Sodium». Consultado el 8 de junio de 2007.
- ↑ Merck Index, 9th ed., monograph 8325
- ↑ Winter, Mark. «WebElements Periodic Table of the Elements | Potassium | Essential information». Webelements. Consultado el 27 de noviembre de 2011.
- ↑ Lemke, Charles H. (2001). «Sodium and Sodium Alloys». Kirk-Othmer Encyclopedia of Chemical Technology. ISBN 978-0-471-23896-6. doi:10.1002/0471238961.1915040912051311.a01.pub2.
- ↑ Plantilla:Greenwood&Earnshaw2nd
- ↑ Plantilla:Greenwood&Earnshaw2nd
- ↑ «Cesium and Rubidium Hit Market». Chemical & Engineering News 37 (22): 50-56. 1959. doi:10.1021/cen-v037n022.p050.
- ↑ a b c d Butterman, William C. (2003). «Mineral Commodity Profile: Rubidium». United States Geological Survey. Consultado el 4 de diciembre de 2010.
- ↑ bulletin 585. United States. Bureau of Mines. 1995.
- ↑ Burt, R. O. (1993). «Caesium and cesium compounds». Kirk-Othmer encyclopedia of chemical technology 5 (4th edición). New York: John Wiley & Sons, Inc. pp. 749-764. ISBN 978-0-471-48494-3.
- ↑ a b Plantilla:Greenwood&Earnshaw2nd
- ↑ Winter, Mark. «Geological information». Francium. The University of Sheffield. Consultado el 26 de marzo de 2007.
- ↑ Stancari, G.; Veronesi, S.; Corradi, L.; Atutov, S. N.; Calabrese, R.; Dainelli, A.; Mariotti, E.; Moi, L. et al. (2006). «Production of Radioactive Beams of Francium». Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment 557 (2): 390-396. Bibcode:2006NIMPA.557..390S. doi:10.1016/j.nima.2005.11.193.
- ↑ a b Orozco, Luis A. (2003). «Francium». Chemical and Engineering News 81 (36): 159. doi:10.1021/cen-v081n036.p159.
- ↑ Price, Andy (20 de diciembre de 2004). «Francium». Consultado el 19 de febrero de 2012.
- ↑ a b c Plantilla:Greenwood&Earnshaw2nd
- ↑ USGS (2011). «Lithium». Consultado el 4 de diciembre de 2011.
- ↑ «Soaps & Detergents: Chemistry». Consultado el 20 de julio de 2015.
- ↑ Lindsey, Jack L (1997). Applied illumination engineering. p. 112. ISBN 978-0-88173-212-2.
- ↑ Kane, Raymond; Sell, Heinz (2001). Revolution in lamps: A chronicle of 50 years of progress. p. 241. ISBN 978-0-88173-351-8.
- ↑ Stampers, National Association of Drop Forgers and (1957). Metal treatment and drop forging.
- ↑ Harris, Jay C (1949). Metal cleaning bibliographical abstracts. p. 76.
- ↑ Plantilla:Greenwood&Earnshaw2nd
- ↑ a b c Plantilla:Greenwood&Earnshaw2nd
- ↑ Cordel, Oskar (1868). Die Stassfurter Kalisalze in der Landwirthschalt: Eine Besprechung ... (en alemán). L. Schnock. Consultado el 29 de mayo de 2011.
- ↑ Toedt, John; Koza, Darrell; Cleef-Toedt, Kathleen Van (2005). «Personal Cleansing Products: Bar Soap». Chemical composition of everyday products. Greenwood Publishing Group. ISBN 978-0-313-32579-3.
- ↑ Schultz, H. (2006). «Potassium compounds». Ullmann's Encyclopedia of Industrial Chemistry. A22. p. 95. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a22_031.pub2.
- ↑ «Cesium Atoms at Work». Time Service Department—U.S. Naval Observatory—Department of the Navy. Archivado desde el original el 23 de febrero de 2015. Consultado el 20 de diciembre de 2009.
- ↑ a b Butterman, William C. (2004). «Mineral Commodity Profile: Cesium». United States Geological Survey. Archivado desde el original el 22 de noviembre de 2009. Consultado el 27 de diciembre de 2009.
- ↑ «The NIST reference on Constants, Units, and Uncertainty». National Institute of Standards and Technology.
- ↑ Koch, E.-C. (2002). «Special Materials in Pyrotechnics, Part II: Application of Caesium and Rubidium Compounds in Pyrotechnics». Journal Pyrotechnics 15: 9-24. Archivado desde el original el 13 de julio de 2011. Consultado el 3 de noviembre de 2011.
- ↑ Heiserman, David L. (1992). Exploring Chemical Elements and their Compounds. McGraw-Hill. pp. 201–203. ISBN 978-0-8306-3015-8.
- ↑ Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. pp. 151-153. ISBN 978-0-19-850341-5.
- ↑ Gagnon, Steve. «Francium». Jefferson Science Associates, LLC. Archivado desde el original el 31 de marzo de 2007. Consultado el 1 de abril de 2007.
- ↑ Winter, Mark. «Uses». Francium. The University of Sheffield. Archivado desde el original el 31 de marzo de 2007. Consultado el 25 de marzo de 2007.
- ↑ Gomez, E.; Orozco, L. A.; Sprouse, G. D. (7 de noviembre de 2005). «Spectroscopy with trapped francium: advances and perspectives for weak interaction studies». Rep. Prog. Phys. 69 (1): 79-118. Bibcode:2006RPPh...69...79G. doi:10.1088/0034-4885/69/1/R02.
- ↑ Peterson, I. (11 de mayo de 1996). «Creating, cooling, trapping francium atoms». Science News 149 (19): 294. doi:10.2307/3979560. Archivado desde el original el 4 de junio de 2011. Consultado el 11 de septiembre de 2009.
- ↑ Lerner, Michael M. (2013). «Standard Operating Procedure: Storage and Handling of Alkali Metals». Oregon State University. Consultado el 26 de agosto de 2016.
- ↑ Solomon, Robert E. (2002). Fire and Life Safety Inspection Manual. Jones & Bartlett Learning. p. 459. ISBN 978-0-87765-472-8.
- ↑ a b Lerner, Michael M. (2013). «Standard Operating Procedure: Storage and Handling of Alkali Metals». Oregon State University. Consultado el 26 de agosto de 2016.
- ↑ Angelici, R. J. (1999). Synthesis and Technique in Inorganic Chemistry. Mill Valley, CA: University Science Books. ISBN 978-0-935702-48-4.
- ↑ Martel, Bernard; Cassidy, Keith (1 de julio de 2004). «Rubidium». Chemical risk analysis: a practical handbook. p. 215. ISBN 978-1-903996-65-2.
- ↑ Wray, Thomas K. «Danger: peroxidazable chemicals». Environmental Health & Public Safety (North Carolina State University). Archivado desde el original el 8 de junio de 2011.
- ↑ Astrid, Sigel; Helmut, Sigel; Roland K.O., eds. (2016). The Alkali Metal Ions: Their Role in Life. Metal Ions in Life Sciences 16. Springer. ISBN 978-3-319-21755-0. doi:10.1007/978-3-319-21756-7.
- ↑ Katsuyuki, Aoki; Kazutaka, Murayama; Hu, Ning-Hai (2016). «Chapter 3. Solid State Structures of Alkali Metal Ion Complexes Formed by Low-Molecular-Weight Ligands of Biological Relevance». En Astrid, Sigel; Helmut, Sigel; Roland K.O., eds. The Alkali Metal Ions: Their Role in Life. Metal Ions in Life Sciences 16. Springer. pp. 27-101. ISBN 978-3-319-21755-0. doi:10.1007/978-3-319-21756-7_3.
- ↑ a b c d e Winter, Mark. «WebElements Periodic Table of the Elements | Lithium | biological information». Webelements. Consultado el 15 de febrero de 2011.
- ↑ Gray, Theodore. «Facts, pictures, stories about the element Lithium in the Periodic Table». theodoregray.com. Consultado el 9 de enero de 2012.
- ↑ Howland, Robert H. (September 2007). «Lithium: Underappreciated and Underused?». Psychiatric Annals 37 (9). doi:10.3928/00485713-20070901-06.
- ↑ Zarse, Kim; Terao, Takeshi; Tian, Jing; Iwata, Noboru; Ishii, Nobuyoshi; Ristow, Michael (August 2011). «Low-dose lithium uptake promotes longevity in humans and metazoans». European Journal of Nutrition 50 (5): 387-9. PMC 3151375. PMID 21301855. doi:10.1007/s00394-011-0171-x.
- ↑ Winter, Mark. «WebElements Periodic Table of the Elements | Potassium | biological information». WebElements. Consultado el 13 de enero de 2012.
- ↑ Winter, Mark. «WebElements Periodic Table of the Elements | Sodium | biological information». WebElements. Consultado el 13 de enero de 2012.
- ↑ «Sodium». Northwestern University. Archivado desde el original el 23 de agosto de 2011. Consultado el 21 de noviembre de 2011.
- ↑ «Sodium and Potassium Quick Health Facts». Consultado el 7 de noviembre de 2011.
- ↑ «Dietary Reference Intakes: Water, Potassium, Sodium, Chloride, and Sulfate». Food and Nutrition Board, Institute of Medicine, United States National Academies. 11 de febrero de 2004. Archivado desde el original el 6 de octubre de 2011. Consultado el 23 de noviembre de 2011.
- ↑ U.S. Department of Agriculture; U.S. Department of Health and Human Services (December 2010). Dietary Guidelines for Americans, 2010 (7th edición). p. 22. ISBN 978-0-16-087941-8. OCLC 738512922. Archivado desde el original el 27 de octubre de 2011. Consultado el 23 de noviembre de 2011.
- ↑ Geleijnse, J. M.; Kok, F. J.; Grobbee, D. E. (2004). «Impact of dietary and lifestyle factors on the prevalence of hypertension in Western populations». European Journal of Public Health 14 (3): 235-239. PMID 15369026. doi:10.1093/eurpub/14.3.235. Archivado desde el original el 1 de agosto de 2018. Consultado el 30 de agosto de 2017.
- ↑ Lawes, C. M.; Vander Hoorn, S.; Rodgers, A.; International Society of Hypertension (2008). «Global burden of blood-pressure-related disease, 2001». Lancet 371 (9623): 1513-1518. PMID 18456100. doi:10.1016/S0140-6736(08)60655-8. Archivado desde el original el 28 de enero de 2012.
- ↑ a b Winter, Mark. «WebElements Periodic Table of the Elements | Potassium | biological information». WebElements. Consultado el 13 de enero de 2012.
- ↑ Winter, Mark. «WebElements Periodic Table of the Elements | Sodium | biological information». WebElements. Consultado el 13 de enero de 2012.
- ↑ a b Hellgren, Mikko; Sandberg, Lars; Edholm, Olle (2006). «A comparison between two prokaryotic potassium channels (KirBac1.1 and KcsA) in a molecular dynamics (MD) simulation study». Biophys. Chem. 120 (1): 1-9. PMID 16253415. doi:10.1016/j.bpc.2005.10.002.
- ↑ a b Schonwald, Seth (2004). «Potassium Chloride and Potassium Permanganate». Medical toxicology. Lippincott Williams & Wilkins. pp. 903-5. ISBN 978-0-7817-2845-4.
- ↑ Markovchick, Vincent J.; Pons, Peter T. (2003). Emergency medicine secrets. Elsevier Health Sciences. p. 223. ISBN 978-1-56053-503-4.
- ↑ a b c Winter, Mark. «WebElements Periodic Table of the Elements | Rubidium | biological information». Webelements. Consultado el 15 de febrero de 2011.
- ↑ a b Relman, A. S. (1956). «The Physiological Behavior of Rubidium and Cesium in Relation to That of Potassium». The Yale Journal of Biology and Medicine 29 (3): 248-62. PMC 2603856. PMID 13409924.
- ↑ a b c Meltzer, H. L. (1991). «A pharmacokinetic analysis of long-term administration of rubidium chloride». Journal of Clinical Pharmacology 31 (2): 179-84. PMID 2010564. doi:10.1002/j.1552-4604.1991.tb03704.x. Archivado desde el original el 9 de julio de 2012.
- ↑ Winter, Mark. «WebElements Periodic Table of the Elements | Caesium | biological information». WebElements. Consultado el 13 de enero de 2012.
- ↑ Fieve, Ronald R.; Meltzer, Herbert L.; Taylor, Reginald M. (1971). «Rubidium chloride ingestion by volunteer subjects: Initial experience». Psychopharmacologia 20 (4): 307-14. PMID 5561654. doi:10.1007/BF00403562.
- ↑ Follis, Richard H., Jr. (1943). «Histological Effects in rats resulting from adding Rubidium or Cesium to a diet deficient in potassium». American Journal of Physiology. Legacy Content 138 (2): 246. doi:10.1152/ajplegacy.1943.138.2.246. Archivado desde el original el 11 de julio de 2012.
- ↑ Gottschlich, Michele M. (2001). The Science and Practice of Nutrition Support: A Case-based Core Curriculum. Kendall Hunt. p. 98. ISBN 978-0-7872-7680-5.
- ↑ Insel, Paul M.; Turner, R. Elaine; Ross, Don (2004). Nutrition. Jones & Bartlett Learning. p. 499. ISBN 978-0-7637-0765-1.
- ↑ Winter, Mark. «WebElements Periodic Table of the Elements | Caesium | biological information». WebElements. Consultado el 13 de enero de 2012.
- ↑ Melnikov, P.; Zanoni, L. Z. (June 2010). «Clinical effects of cesium intake». Biological Trace Element Research 135 (1–3): 1-9. PMID 19655100. doi:10.1007/s12011-009-8486-7.
- ↑ a b Pinsky, Carl; Bose, Ranjan; Taylor, J. R.; McKee, Jasper; Lapointe, Claude; Birchall, James (1981). «Cesium in mammals: Acute toxicity, organ changes and tissue accumulation». Journal of Environmental Science and Health, Part A 16 (5): 549-567. doi:10.1080/10934528109375003.
- ↑ Johnson, Garland T.; Lewis, Trent R.; Wagner, D. Wagner (1975). «Acute toxicity of cesium and rubidium compounds». Toxicology and Applied Pharmacology 32 (2): 239-245. PMID 1154391. doi:10.1016/0041-008X(75)90216-1.
- ↑ Sartori, H. E. (1984). «Cesium therapy in cancer patients». Pharmacol Biochem Behav 21 (Suppl 1): 11-13. PMID 6522427. doi:10.1016/0091-3057(84)90154-0.
- ↑ Wood, Leonie. «'Cured' cancer patients died, court told». The Sydney Morning Herald. 20 de noviembre de 2010.
- ↑ The Radiological Accident in Goiânia. IAEA. 1988.
- ↑ Price, Andy (20 de diciembre de 2004). «Francium». Consultado el 19 de febrero de 2012.

![{\displaystyle {\ce {LiR + [Ni(CO)4]^{-CO}-> Li+[RCONi(CO)3]-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4c9f7d7f9900b6c684d152c2b7e0e1ea4e5eeef1)
![{\displaystyle {\ce {Li+[RCONi(CO)3]- ->[{H+}][{solvente}] Li+ + RCHO + [(solvente)Ni(CO)3]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7a98a22736ba08102047e9ad327793dcba37eb7a)
![{\displaystyle {\ce {Li+[RCONi(CO)3]- ->[{R'Br}][{solvente}] Li+ + R'COR + [(solvente)Ni(CO)3]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d105613b04b7666ec222d2d228b43a1e6979783)



















