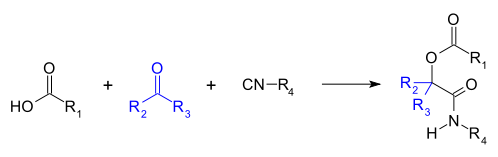Amida
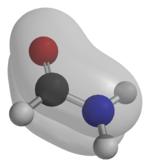
Una amida es un compuesto que se forma conceptual o químicamente por el reemplazo del hidroxilo de un oxácido por un sustituyente amino. En química orgánica, se le denomina por antonomasia como "amida" a las amidas de los ácidos carboxílicos (estrictamente, carboxamida). Se puede considerar como un derivado de un ácido carboxílico por sustitución del grupo —OH del ácido por un grupo —NH2, —NHR o —NRR' (llamado grupo amino).[1] Por esto su grupo funcional es del tipo RCONR'R'', siendo CO un carbonilo, N un átomo de nitrógeno, y R, R' y R'' radicales orgánicos o átomos de hidrógeno:
| Formamida (amida del ácido fórmico) |
Amida (carboxamida) (amida de ácido carboxílico) |
Urea o carbamida (amida del ácido carbónico) |
Cianimida (amida del ácido ciánico) |
Hexametilfosforamida (amida hexametilada del ácido fosfórico) |
Sulfamida (amida de ácido sulfúrico) |
Nitramida (amida de ácido nítrico) |
|---|---|---|---|---|---|---|

|

|
|

|
Cuando el grupo amida no es el principal, se nombra usando el prefijo carbamoil:[2]
CH3-CH2-CH(CONH2)-CH2-CH2-COOH → ácido 4-carbamoilhexanoico.
Todas las amidas, excepto la primera de la serie, son sólidas a temperatura ambiente[3] y sus puntos de ebullición son elevados, más altos que los de los ácidos correspondientes. Presentan excelentes propiedades disolventes y son bases muy débiles. Uno de los principales métodos de obtención de estos compuestos consiste en hacer reaccionar el amoníaco (o aminas primarias o secundarias) con ésteres. Las amidas son comunes en la naturaleza, y una de las más conocidas es la urea,[4] una diamida que no contiene hidrocarburos. Las proteínas y los péptidos están formados por amidas. Un ejemplo de poliamida de cadena larga es el nailon.[5] Las amidas también se utilizan mucho en la industria farmacéutica.
Poliamidas[editar]
La amida del ácido carbónico es denominada urea y sus derivados son el grupo funcional ureido.
Las diacilaminas son denominadas como grupo funcional imida y son análogas a los anhídridos carboxílicos, por ejemplo el carboxilio

Las poliamidas son compuestos que contienen grupos amida.[6] Algunos son sintéticas, como el nailon, pero también se encuentran en la naturaleza, en las proteínas,[7] formadas a partir de los aminoácidos, por reacción de un grupo carboxilo de un aminoácido con un grupo amino de otro. En las proteínas al grupo amida se le llama enlace peptídico.[8]
El nailon es una poliamida debido a los característicos grupos amida en la cadena principal de su formulación. Por ejemplo, el nailon 6 se obtiene por polimerización de la ε-caprolactama.
Ciertas poliamidas del tipo nailon son la poliamida-6, la poliamida-11, la poliamida-12, la poliamida-9,6, la poliamida-6,9, la poliamida-6,10 y la poliamida-6,12. Se pueden citar como ejemplo de poliamidas no lineales los productos de condensación de ácidos dimerizados de aceites vegetales con aminas.
Los péptidos, incluyendo las proteínas como la seda, a la que el nailon reemplazó, también son poliamidas. Estos grupos amida son muy polares y pueden unirse entre sí mediante enlaces por puente de hidrógeno. Debido a esto y a que la cadena del nailon es tan regular y simétrica, los nailones son a menudo cristalinos, y forman excelentes fibras.

Síntesis de amidas[editar]
La síntesis de amidas se puede llevar a cabo por diversos métodos.[9] El método más simple es la condensación de un ácido carboxílico con una amina. Esta reacción es termodinámicamente favorable en general, pero tiene una elevada energía de activación, debido principalmente a la primera desprotonación del ácido carboxílico y la protonación de la amina, lo cual forma un producto estable, el carboxilato de aminio. Esto reduce la reactividad. Además, se requieren altas temperaturas.[10]
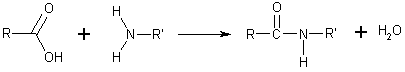
- RCO2H + R′R″NH
 RCO−
RCO−
2 + R′R″NH+
2 RC(O)NR′R″ + H2O
RC(O)NR′R″ + H2O
Se conocen muchos métodos para conducir el equilibrio hacia la derecha. En su mayor parte, estas reacciones implican "activar" el ácido carboxílico convirtiéndolo primero en un mejor electrófilo; tales como ésteres, cloruros de ácido (reacción de Schotten-Baumann) o anhídridos (método de Lumière-Barbier). Los métodos convencionales en la síntesis de péptidos usan agentes de acoplamiento tales como HATU, hidroxibenzotiazol (HOBt) o PyBOP.[11] Recientemente, han surgido reactivos novedosos a base de boro para la formación del enlace CO-N, incluyendo el uso de catalizadores de ácido 2-yodofenilborónico,[12] MIBA[13] y borato de tris(2,2,2-trifluoroetilo).[14][15]
| Nombre de la reacción | Sustrato | Detalles |
|---|---|---|
| Transposición de Beckmann | Cetona cíclica | Reactivo: hidroxilamina en medio ácido. Se forma una lactama. |
| Reacción de Schotten-Baumann | Halogenuro de acilo | Reactivo: amina con un halogenuro de acilo en medio básico
 |
| Reacción de Schmidt | Cetonas | Reactivo: Ácido hidrazoico
 |
| Hidrólisis de nitrilos[16] | Nitrilo | Reactivo: Agua en medio ácido
|
| Reacción de Willgerodt–Kindler | Aril alquil cetonas | Azufre y morfolina
 |
| Reacción de Passerini | Ácido carboxílico, cetona o aldehído | Reacción de tres componentes entre un ácido carboxílico, un compuesto carbonílico, como una cetona o un aldehído, y un isocianuro, para formar α-hidroxicarboxamidas. |
| Reacción de Ugi | Isocianuro, ácido carboxílico, cetona, amina primaria | Condensación de cuatro componentes entre un aldehído, una amina, un ácido carboxílico y un isocianuro para preparar derivados de α-aminoacil amidas. |
| Reacción de Bodroux[17][18] | Ácido carboxílico, reactivo de Grignard con un derivado de anilina ArNHR′ | 
|
| Transposición de Chapman [19][20] | Arilo, imino éter | Para N,N-diaril amidas. El mecanismo de reacción está basado en una sustitución nucleofílica aromática.[21] |
| Síntesis de amidas de Leuckart[22] | Isocianato | Reacción de un areno con un isocianato catalizado por cloruro de aluminio. Se forma una benzamida. |
| Reacción de Ritter[23] | Alquenos, alcoholes, o cualquier otra fuente de carbocatiónes | Amidas con el nitrógeno enlazado a un carbono terciario por medio de una reacción de adición entre un nitrilo y un carbocatión terciario en presencia de ácidos concentrados.
 |
| Adición fotolítica de una formamida a olefinas[24] | Alquenos terminales | Reacción de homologación radicalaria entre un alqueno termina y formamida. |
| Aminólisis de ésteres[25][26][27] | Ésteres | Reacción de aminólisis ácida de ésteres. |
Reacciones de amidas[editar]
Las principales reacciones de las amidas son:
- Hidrólisis ácida o básica: La amida se hidroliza en medio básico formando un carboxilato de metal o en medio ácido formando un ácido carboxílico.
- Deshidratación: En presencia de un deshidratante como cloruro de tionilo o pentóxido de fósforo se produce un nitrilo.
- Reducción: Las amidas pueden reducirse con hidruro de litio y aluminio a aminas.
- Transposición de Hofmann: En presencia de un halógeno en medio básico se produce una compleja reacción que permite la obtención de una amina con un carbono menos en su cadena principal.
Ejemplo de amida[editar]
- La acrilamida se emplea en distintas aplicaciones, aunque es más conocida por ser probablemente carcinógena y estar presente en bastantes alimentos al formarse por procesos naturales al cocinarlos.
- Son fuente de energía para el cuerpo humano.[28]
- Pueden ser vitaminas[29] en el cuerpo o analgésicos.[30]
Importancia y usos[editar]
Las amidas son comunes en la naturaleza y se encuentran en sustancias como los aminoácidos, las proteínas, el ADN y el ARN, hormonas y vitaminas.
La urea es utilizada para la excreción del amoníaco (NH3) en el ser humano y mamíferos. También es muy utilizada en la industria farmacéutica y en la industria del nailon.
Referencias[editar]
- ↑ Alejandrina, GALLEGO PICÓ; María, GARCINUÑO MARTÍNEZ Rosa; José, MORCILLO ORTEGA Mª; Ángel, VÁZQUEZ SEGURA Miguel (4 de diciembre de 2013). QUÍMICA BÁSICA. Editorial UNED. ISBN 9788436267846. Consultado el 18 de noviembre de 2017.
- ↑ Alejandrina, GALLEGO PICÓ; María, GARCINUÑO MARTÍNEZ Rosa; José, MORCILLO ORTEGA Mª; Ángel, VÁZQUEZ SEGURA Miguel (4 de diciembre de 2013). QUÍMICA BÁSICA. Editorial UNED. ISBN 9788436267846. Consultado el 18 de noviembre de 2017.
- ↑ Química para el Acceso a Ciclos Formativos de Grado Superior .e-book.. MAD-Eduforma. ISBN 9788466530453. Consultado el 18 de noviembre de 2017.
- ↑ Finck, Arnold (1988). Fertilizantes y fertilización: fundamentos y métodos para la fertilización de los cultivos. Reverte. ISBN 9788429110104. Consultado el 18 de noviembre de 2017.
- ↑ Society, American Chemical (2005). Química: un proyecto de la American Chemical Society. Reverte. ISBN 9788429170016. Consultado el 18 de noviembre de 2017.
- ↑ NEWELL, James (24 de agosto de 2016). Ciencia de materiales - aplicaciones en ingeniería. Alfaomega Grupo Editor. ISBN 9786077073116. Consultado el 18 de noviembre de 2017.
- ↑ Geissman, T. A. (1973). Principios de química orgánica. Reverte. ISBN 9788429171808. Consultado el 18 de noviembre de 2017.
- ↑ Química 2. Un enfoque constructivista. Pearson Educación. 2007. ISBN 9789702608448. Consultado el 18 de noviembre de 2017.
- ↑ Montalbetti, Christian A. G. N.; Falque, Virginie (14 de noviembre de 2005). «Amide bond formation and peptide coupling». Tetrahedron 61 (46): 10827-10852. doi:10.1016/j.tet.2005.08.031.
- ↑ Society, American Chemical (2005). Química: un proyecto de la American Chemical Society. Reverte. ISBN 9788429170016. Consultado el 18 de noviembre de 2017.
- ↑ Valeur, Eric; Bradley, Mark (2009). «Amide bond formation: beyond the myth of coupling reagents». Chem. Soc. Rev. 38: 606-631. doi:10.1039/B701677H.
- ↑ «Greener Methods: Catalytic Amide Bond Formation». Consultado el 22 de septiembre de 2016.
- ↑ «MIBA 96% | Sigma-Aldrich». www.sigmaaldrich.com. Consultado el 22 de septiembre de 2016.
- ↑ «Tris(2,2,2-trifluoroethyl) borate 97% | Sigma-Aldrich». www.sigmaaldrich.com. Consultado el 22 de septiembre de 2016.
- ↑ Sabatini, Marco T.; Boulton, Lee T.; Sheppard, Tom D. (1 de septiembre de 2017). «Borate esters: Simple catalysts for the sustainable synthesis of complex amides». Science Advances (en inglés) 3 (9): e1701028. Bibcode:2017SciA....3E1028S. ISSN 2375-2548. PMC 5609808. PMID 28948222. doi:10.1126/sciadv.1701028. Archivado desde el original el 18 de agosto de 2018. Consultado el 18 de agosto de 2018.
- ↑ Wenner, Wilhelm (1952). «Phenylacetamide». Organic Syntheses 32: 92. doi:10.15227/orgsyn.032.0092.
- ↑ Bodroux F. (1905). «none». Bull. Soc. Chim. France 33: 831.
- ↑ «Bodroux reaction». Institute of Chemistry, Skopje, Macedonia. Archivado desde el original el 24 de septiembre de 2015. Consultado el 18 de agosto de 2018.
- ↑ Schulenberg, J. W.; Archer, S. (1965). «The Chapman Rearrangement». Org. React. 14. doi:10.1002/0471264180.or014.01.
- ↑ Chapman, Arthur William (1925). «CCLXIX.—Imino-aryl ethers. Part III. The molecular rearrangement of N-phenylbenziminophenyl ether». Journal of the Chemical Society, Transactions 127: 1992. doi:10.1039/CT9252701992.
- ↑ March, Jerry. Advanced organic Chemistry, Reactions, mechanisms and structure (3rd edición). ISBN 0-471-85472-7.
- ↑ Leuckart, R. (1885). «Ueber einige Reaktionen der aromatischen Cyanate». Berichte der deutschen chemischen Gesellschaft 18: 873-877. doi:10.1002/cber.188501801182.
- ↑ Adams, Rodger; Krimen, L.I.; Cota, Donald J. (1969). Organic Reaction Volume 17. London: John Wiley & Sons, Inc. pp. 213-326. ISBN 9780471196150. doi:10.1002/0471264180.
- ↑ Monson, Richard (1971). Advanced Organic Synthesis: Methods and Techniques. Newyork: Academic Press. p. 141. ISBN 978-0124336803. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Corson, B. B.; Scott, R. W.; Vose, C. E. (1941). «Cyanoacetamide». Organic Syntheses 1: 179. doi:10.15227/orgsyn.009.0036.
- ↑ Jacobs, W. A. (1941). «Chloroacetamide». Organic Syntheses 1: 153. doi:10.15227/orgsyn.007.0016.
- ↑ Kleinberg, J.; Audrieth, L. F. (1955). «Lactamide». Organic Syntheses 3: 516. doi:10.15227/orgsyn.021.0071.
- ↑ Nutrición y Alimentación de Bovinos en El Trópico Bajo Colombiano. Corpoica. Consultado el 18 de noviembre de 2017.
- ↑ Macarulla, José M.; Goñi, Félix M. (1993). Biomoléculas: lecciones de bioquímica estructural. Reverte. ISBN 9788429173383. Consultado el 18 de noviembre de 2017.
- ↑ Fernández, Pedro Lorenzo (2 de marzo de 2015). Velázquez. Farmacología Básica y Clínica (eBook online). Ed. Médica Panamericana. ISBN 9788498354812. Consultado el 18 de noviembre de 2017.
Enlaces externos[editar]
 Wikimedia Commons alberga una categoría multimedia sobre Amida.
Wikimedia Commons alberga una categoría multimedia sobre Amida.