Isocianato

El isocianato es un grupo químico con fórmula -N=C=O. Los compuestos orgánicos que presentan esta funcionalidad (R-NCO) son también denominados isocianatos. Cuando una sustancia química presenta dos grupos isocianatos se denomina di-isocianato. Los diisocianatos son compuestos fundamentales en la síntesis de poliuretano.
No se ha de confundir el grupo isocianato con el cianato (-O-C=N) ni con el isocianuro (-N=C).
Química inorgánica vs. orgánica[editar]
Los isocianatos inorgánicos son las sales del ácido isociánico HNCO, que contienen el anión NCO-. La transformación del isocianato de amonio (H4NNCO) en urea (H2NC(=O)NH2) por Wöhler era la primera síntesis de un compuesto orgánico a partir de un precursor completamente inorgánico y acabó de esta manera con la teoría de la vis vitalis, la fuerza de vida que se presumía hasta este momento necesaria para generar los compuestos orgánicos.
Síntesis[editar]
Los isocianatos orgánicos son compuestos químicos que contienen el grupo funcional R-N=C=O. Existen vías para la síntesis de isocianatos, algunas de las cuales se exponen a continuación:
Fosgenación de aminas[editar]
Se forman a partir de la reacción de una amina con fosgeno (O=CCl2) mediante un intermediario de cloruro de carbamoilo.
R-NH2 + COCl2 → R-NCO + 2HCl
El fosgeno es altamente tóxico[1] por lo que la síntesis de diisocianatos ha de ser llevada a cabo con las precauciones requeridas. Los isocianatos son además en sí altamente tóxicos por lo que la precaución no se limita a su síntesis sino también a su posterior manipulación.[2]
Carbonilación directa y termólisis[editar]
Uno de los métodos alternativos a la fosgenacion para la síntesis de diisocianatos es el implementado por Mitsui Toatsu Chemicals y Atlantic Richfield basado en la descomposición térmica de los diuretanos formados tras el tratamiento del dinitrotolueno con alcoholes según:[3]
(RCOONH)C6H3CH3 → (OCN)2C6H3CH3 + 2(ROH)
Transposición de Curtius[editar]
Otra vía que evita el uso del fosgeno es mediante la descomposición térmica de las azidas de acilo correspondiente mediante la transposición de Curtius:[4]
R-CO-N3 → R-NCO + N2
Esta reacción se ha utilizado para desarrollar distintos mono[5],[6] y diisocianatos.[7] Para la síntesis de las azida de acilo se parte del haluro de acilo mediante su reacción con azida de sodio:
R-CO-X + NaN3 → R-CO-N3 + NaX
A partir de haluros de alquilo[editar]
Otra vía posible es a partir de la reacción entre los haluros de alquilo y los cianatos de metales alcalinos:
R-X + M-NCO → R-NCO + MX
De esta manera se han preparado isocianatos de butilo y etilo así como diisocianatos de hexametileno y p-xylyleno.[8]
Química del isocianato[editar]
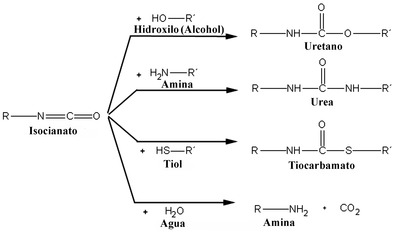
Los isocianatos son productos de partida en diversos procesos químicos, entre otros, en la obtención de los poliuretanos. El uretano se obtienen por reacción del ácido isocianúrico o su tautómero el ácido cianúrico con etanol. El grupo isocianato (-NCO) contiene un átomo de carbono altamente electrofílico que puede ser atacado por diferentes grupos nucleófilos provistos de hidrógenos lábiles, como es el caso del grupo hidroxilo, amina o tiol para dar uretanos,[9] ureas, tiocarbamatos, o con agua para mediante la transposición de Hofmann dar aminas, respectivamente, como se puede observar en la figura de la derecha.
Además de las reacciones presentadas en la figura de la derecha, a elevadas concentraciones del grupo isocianato y a altas temperaturas, el grupo isocianato puede reaccionar con aminas secundarias, como la de los uretanos para dar grupos alofanato o con ureas para dar grupo Biuret. En ambas reacciones el grupo N-H del uretano o urea, reacciona con el isocianato formando un punto de ramificación.
En la síntesis de algunos poliuretanos termoplásticos estas reacciones tratan de evitarse. Sin embargo, cuando se pretende obtener un poliuretano entrecruzado estas reacciones deben ser consideradas como interesantes.
Reactividad[editar]
El orden de reactividad de los uretanos con las distintas especies se resume en la siguiente tabla.[10],[11]
Tabla. Velocidades de reacción del grupo isocianato con distintos grupos químicos. Esta tabla es orientativa, ya que la velocidad dependería a su vez de la naturaleza del isocianato así como de la estructura interna de los compuestos.
| Compuesto con hidrógenos activos | Estructura típica | Producto de reacción | Velocidad relativa de reacción |
| Amina alifática primaria | R-NH2 | Urea | 100000 |
| Amina alifática secundaria | RR’NH | Urea | 20000-50000 |
| Amina aromática primaria | Ar-NH2 | Urea | 200-300 |
| Hidroxilo primario | RCH2-OH | Uretano | 100 |
| Agua | HOH | Amina (descarboxilación Hoffman) | 100 |
| Ácido carboxílico | RCOOH | Amida (descarboxilación) | 40 |
| Hidroxilo secundario | RR’CH-OH | Uretano | 30 |
| Urea | R-NH-CO-NH-R | Biuret | 15 |
| Hidroxilo terciario | RR’R”C-OH | Uretano | 0,5 |
| Uretano | R-NH-CO-O-R | Alofanato | 0,3 |
| Amida | RCO-NH2 | Urea | 0,1 |
Infrarrojo[editar]
El grupo isocianato (-N=C=O) presenta una banda de absorción a números de onda de en torno a 2273 cm-1. La desaparición de esta banda en la formación de uretanos permite el análisis cinético de la reacción mediante espectroscopia infrarroja.[12]
Toxicidad[editar]
Los isocianatos son altamente tóxicos debido a la alta reactividad del grupo isocianato. Los isocianatos más tóxicos son aquellos con altas presiones de vapor que debido a su volatilidad pueden ser inhalados por vías respiratorias, como es el caso del isocianato de metilo, agente principal del Desastre de Bhopal en una fábrica de pesticidas en la India.[13]
Véase también[editar]
Referencias[editar]
- ↑ Instituto de Seguridad e Higiene en el Trabajo, Gobierno de España. «Fosgeno-Ficha». Archivado desde el original el 17 de mayo de 2017. Consultado el 22 de octubre de 2012.
- ↑ ASEPEYO (Mutua de accidentes de trabajo). «Riesgo de exposición a isocianatos». Archivado desde el original el 4 de marzo de 2016. Consultado el 2005.
- ↑ Laborde et al (1994). Transformación catalítica del gas natural. IV. Derivados del gas de síntesis: fosgeno, isocianatos, ácido acético y alcoholes superiores. Información Tecnológica, 5, 41-48.
- ↑ Curtius, T. (1894). "20. Hydrazide und Azide organischer Säuren I. Abhandlung". Journal fër Praktische Chemie 50: 275–294
- ↑ Troparevsky, M. et al. (1972) Preparación de isociantos 14C. Buenos Aires, CNEA-311.
- ↑ Undecyl isocyanate (1944). Allen, CFH; Bell, A. Org. Synth., 24, 94
- ↑ Courey et al (1973) . Process for the preparaction of isocyanates from acyl azides. Us Paten 3725450.
- ↑ Molina, P; Tarraga, A (1995). 5.26. Functions with at least one oxigen, Y=C=O en "Comprehensive organic functional group transformations", vol. 5
- ↑ Christian Six, Frank Richter "Isocyanates, Organic" in Ulmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi 10.1002/14356007.a14_611
- ↑ Q. Lu; T. Hoye; C. Macosko. Reactivity of Common Functional Groups with Urethanes: Models for Reactive Compatibilization of Thermoplastic Polyurethane Blends. Journal of Polymer Science A: Polymer Chemistry, 40 (14): 2310-2328, 2002
- ↑ Poliuretanos.www.poliuretanos.com.br. Reagentes. 1.2-Isocianatos (Tabla 1.3).
- ↑ B. Fernández-d'Arlas y col. Kinetic and thermodynamic studies of the formation of a polyurethane based on 1,6-hexamethylene diisocyanate and poly(carbonate-co-ester)diol. Thermochimica Acta, 459, 94-103 (207).
- ↑ Viana, I (2010). Infierno químico de Bhopal. ABC
