Urea
| Urea | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Diaminometanona | ||
| General | ||
| Otros nombres | urea, carbamida, aminometanamida, diaminometanona | |
| Fórmula semidesarrollada | CO(NH2)2 | |
| Fórmula estructural | Ver imagen. | |
| Fórmula molecular | CON2H4 | |
| Identificadores | ||
| Número CAS | 57-13-6[1] | |
| Número RTECS | YR6250000 | |
| ChEBI | 16199 | |
| ChEMBL | CHEMBL985 | |
| ChemSpider | 1143 | |
| DrugBank | 03904 | |
| PubChem | 1176 | |
| UNII | 8W8T17847W | |
| KEGG | C00086 D00023, C00086 | |
| Propiedades físicas | ||
| Apariencia | blanco | |
| Densidad | 740 kg/m³; 0,74 g/cm³ | |
| Masa molar | 60 024 g/mol | |
| Punto de fusión | 405,8 K (133 °C) | |
| Estructura cristalina | sistema cristalino tetragonal | |
| Propiedades químicas | ||
| Acidez | 0.18 pKa | |
| Alcalinidad | 13.9 pKb | |
| Solubilidad en agua |
En agua: | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La urea (del griego ouron, a su vez del indoeuropeo awer, "humedad, flujo"[2][3]) o carbamida es un compuesto químico de fórmula CO(NH2)2. Se encuentra en mayor proporción en la orina, en el sudor y en la materia fecal. Es el principal producto terminal del metabolismo de las proteínas en los mamíferos, como los humanos. La orina humana contiene unos 20 g/L (gramos por litro); un adulto elimina de 25 a 39 g (gramos) diariamente.[cita requerida] Es uno de los pocos compuestos orgánicos que no tienen enlaces C-C o C-H.
En cantidades menores, se presenta en la sangre, en el hígado, en la linfa y en los fluidos serosos, y también en los excrementos de los peces y muchos otros animales. También se encuentra en el corazón, en los pulmones, en los huesos y en los órganos reproductivos, así como el semen. La urea se forma principalmente en el hígado como un producto final del metabolismo. El nitrógeno de la urea, que constituye el 80 % del nitrógeno en la orina, procede de la degradación de los diversos compuestos con nitrógeno, sobre todo de los aminoácidos de las proteínas en los alimentos. En los mamíferos la urea se forma en un ciclo metabólico denominado ciclo de la urea. La urea está presente también en los hongos así como en las hojas y semillas de numerosas legumbres y cereales.[cita requerida]
Debido a su momento dipolar, la urea es soluble en agua y en alcohol, y ligeramente soluble en éter.
Síntesis[editar]
Se obtuvo originalmente mediante la síntesis de Wöhler, que fue diseñada en 1828 por el químico alemán Friedrich Wöhler, y fue la segunda sustancia orgánica obtenida artificialmente, luego del oxalato de amonio.
En su uso industrial, la urea es producida a partir de amoniaco sintético y dióxido de carbono. Como se producen grandes cantidades de dióxido de carbono durante el proceso de fabricación de amoniaco como subproducto de los hidrocarburos (predominantemente gas natural, con menor frecuencia derivados del petróleo) u ocasionalmente del carbón, las plantas de producción de urea se encuentran casi siempre adyacentes al sitio donde se fabrica el amoniaco. Aunque el gas natural es la materia prima de amoniaco más económica y más ampliamente disponible, las plantas que lo utilizan no producen tanto dióxido de carbono del proceso como es necesario para convertir toda su producción de amoniaco en urea. A lo largo de los últimos años, se han desarrollado nuevas tecnologías como el proceso KM-CDR[4][5] para recuperar dióxido de carbono suplementario de los gases de escape de combustión producidos en el horno de reformado cocido de la planta de gas de síntesis de amoniaco, permitiendo de esta forma a los operadores de complejos de fertilizantes nitrogenados para evitar la necesidad de manejar y comercializar el amoniaco como un producto separado y también para reducir sus emisiones de gases de efecto invernadero a la atmósfera.

El proceso fundamental, desarrollado en 1922, también se denomina proceso de la urea de Bosch-Meiser, en honor a sus descubridores. Diversos procesos comerciales de urea se caracterizan por las condiciones bajo las cuales se forma urea y la forma en que los reactivos no convertidos se procesan adicionalmente. El mismo consiste en dos reacciones de equilibrio principales, con conversión incompleta de los reactivos. La primera es la formación de carbamato: la reacción exotérmica rápida del amoniaco líquido con dióxido de carbono gaseoso (CO2) a alta temperatura y presión para formar el carbamato de amonio (H2N-COONH4):[6]
- 2 NH3 + CO2
 H2N-COONH4 (ΔH = -117 kJ/mol a 110 atm y 160 °C)[7]
H2N-COONH4 (ΔH = -117 kJ/mol a 110 atm y 160 °C)[7]
La segunda reacción es la conversión a urea : la descomposición endotérmica, más lenta, del carbamato de amonio en urea y agua:
- H2N-COONH4
 (NH2)2CO + H2O (ΔH = +15.5 kJ/mol a 160-180 °C)[7]
(NH2)2CO + H2O (ΔH = +15.5 kJ/mol a 160-180 °C)[7]
La conversión total del NH3 y CO2 a urea es exotérmica,[8] y el calor de reacción de la primera reacción dirige a la segunda.
Al igual que todos los equilibrios químicos, estas reacciones se comportan de acuerdo con el principio de Le Chatelier, y las condiciones que más favorecen la formación de carbamato tienen un efecto desfavorable en el equilibrio de conversión de urea. Las condiciones del proceso son, por lo tanto, un compromiso: el efecto negativo en la primera reacción de la alta temperatura (alrededor de 190 °C) necesario para el segundo se compensa mediante la realización del proceso a alta presión (140-175 bar), que favorece la primera reacción. Aunque es necesario comprimir el dióxido de carbono gaseoso a esta presión, el amoniaco está disponible en la planta de amoniaco en forma líquida, que se puede bombear al sistema de forma mucho más económica. Para permitir que el lento tiempo de reacción de la formación de urea alcance el equilibrio, se necesita un gran espacio de reacción, por lo que el reactor de síntesis en una gran planta de urea tiende a ser un recipiente de presión masiva.
Debido a que la conversión de urea es incompleta, el producto debe separarse del carbamato de amonio sin modificar. En las primeras plantas "directas" de urea, esto se hizo bajando la presión del sistema a la atmosférica para permitir que el carbamato se descompusiera de nuevo en amoniaco y dióxido de carbono. Originalmente, como no era económico volver a comprimir el amoniaco y el dióxido de carbono para su reciclado, el amoniaco al menos se usaría para la fabricación de otros productos, por ejemplo, nitrato o sulfato de amonio. (El dióxido de carbono usualmente se desperdiciaba). Los esquemas de procesos posteriores hicieron que el reciclaje del amoniaco y el dióxido de carbono no utilizados fueran prácticos. Esto se logró despresurizando la solución de reacción en etapas (primero a 18-25 bares y luego a 2-5 bares) y pasándola en cada etapa a través de un descomponedor de carbamato calentado con vapor, luego recombinando el dióxido de carbono resultante y el amoniaco en una caída - condensador de carbamato de película y bombeo de la solución de carbamato en la etapa anterior.
Derivados[editar]
Los derivados de la urea formados por sustitución de alguno de los hidrógenos se denominan de tres maneras:
- Como productos sustituyentes de la urea. Por ejemplo metilurea CH3NHCONH2
- Si el grupo de la urea es denominado como sustituyente de otro compuesto principal, se utiliza el prefijo ureido- para el grupo H2N-CO-NH-. Por ejemplo, el nombre IUPAC de la citrulina es Ácido 2-amino-5-ureidopentanoico:
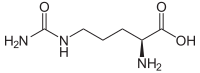
- Otro nombre que puede adquirir el grupo H2N-CO-NH- es carbamilamino. En el caso de la citrulina, también se puede llamar como Ácido 2-amino-5-carbamilaminopentanoico
Si hay sustituyentes en ambos nitrógenos se pueden utilizar los locantes N y N' o 1 y 3, respectivamente.
Utilizando la electrólisis para descomponer la orina se obtiene como gas (N2-K2-CO3) en el ánodo y (H2) en el cátodo. La urea es hidrolizada enzimáticamente a dióxido de carbono y amoniaco por la enzima ureasa.
Usos[editar]
- Fertilizante׃ El 91 % de la urea producida se emplea como fertilizante. Se aplica de forma directa al suelo y provee nitrógeno a la planta. También se utiliza la urea de bajo contenido de biuret (menor al 0.03 %) como fertilizante de uso foliar. Se disuelve en agua y se aplica a las hojas de las plantas, sobre todo frutales, cítricos.
- La urea como fertilizante presenta la ventaja de proporcionar un alto contenido de nitrógeno, esencial en el metabolismo de la planta ya que se relaciona directamente con la cantidad de tallos y hojas, quienes absorben la luz para la fotosíntesis. Además el nitrógeno está presente en las vitaminas y proteínas, y se relaciona con el contenido proteico de los cereales.
- La urea granulada es el principal fertilizante que suministra nitrógeno a la tierra para incrementar su productividad, ya que cuenta con la mayor concentración de nitrógeno. Se aplica a todos los cultivos.
- La urea se adapta a diferentes tipos de cultivos. Es necesario fertilizar, ya que con la cosecha se pierde una gran cantidad de nitrógeno. El grano se aplica al suelo, el cual debe estar bien trabajado y ser rico en bacterias. La aplicación puede hacerse en el momento de la siembra o antes. Luego el grano se hidroliza y se descompone.
- Debe tenerse mucho cuidado en la correcta aplicación de la urea al suelo. Si ésta es aplicada en la superficie, o si no se incorpora al suelo, ya sea por correcta aplicación, lluvia o riego, el amoniaco se vaporiza y las pérdidas son muy importantes. La carencia de nitrógeno en la planta se manifiesta en una disminución del área foliar y una caída de la actividad fotosintética.
- Para determinar la dosis adecuada para cada cultivo se suelen emplear herramientas de diagnóstico con el fin de obtener el mayor rendimiento de forma sustentable. En el caso del maíz, se utilizan herramientas como Maicero, que permite evaluar el comportamiento productivo del cultivo a dosis crecientes de fertilización nitrogenada, teniendo en cuenta escenarios de manejo, suelo y clima de la región del cultivo. Esta herramienta fue desarrollada por Profertil en asociación con CREA y la Facultad de Agronomía Argentina.[9]
- Fertilización foliar׃ La fertilización foliar es una antigua práctica, pero en general se aplican cantidades relativamente exiguas con relación a las de suelo, en particular de macronutrientes. Sin embargo varios antecedentes internacionales demuestran que el empleo de urea bajo de biuret permite reducir las dosis de fertilizantes aplicados al suelo, sin pérdida de rendimiento, tamaño y calidad de fruta.[cita requerida] Estudios realizados en Tucumán demuestran que las aplicaciones foliares de urea en bajas cantidades resultan tan efectivas como las aplicaciones al suelo.[cita requerida] Esto convalida la práctica de aplicar fertilizantes junto con las aplicaciones de otros agroquímicos como complemento de un programa de fertilización eficiente.
- Industria química y de los plásticos׃ Se encuentra presente en adhesivos, plásticos, resinas, tintas, productos farmacéuticos y acabados para productos textiles, papel, metales y tabaco. Como por ejemplo la resina urea formaldehído . Estas resinas tienen varias aplicaciones en la industria, como la producción de madera aglomerada. También se usa en la producción de cosméticos y pinturas.
- Suplemento alimenticio para el ganado: Se mezcla en el alimento del ganado y aporta nitrógeno, que es vital en la formación de las proteínas.
- Producción de drogas׃ Se usa como adulterante para la fabricación de drogas como la metanfetamina.
- Componente del aditivo Adblue o urea AUS32, aditivo que se utiliza para reducir las emisiones de óxidos de nitrógeno (NOx) causadas por los escapes de los motores diésel, mediante un proceso denominado reducción catalítica selectiva (RCA).
- Industria cosmética: La urea se utiliza en formulaciones cosméticas por su propiedad hidratante (5-20%) y sus propiedades exfoliantes o queratolíticas (30-50%). Ayuda a la remoción de células muertas y callosidades. En la piel interactúa con la proteína queratina rompiendo las interacciones del enlace hidrógeno que estabilizan su estructura secundaria.[10]
Historia[editar]
La urea fue descubierta por vez primera en la orina en 1727 por el científico neerlandés Herman Boerhaave,[11] aunque este descubrimiento se atribuye a menudo al químico francés Hilaire Rouelle.[12]
En 1828, el químico alemán Friedrich Wöhler obtuvo urea artificialmente mediante el tratamiento de cianato de plata con cloruro de amonio.[13][14][15]
- AgNCO + NH4Cl → (NH2)2CO + AgCl
Esta fue la primera vez que un compuesto orgánico era sintetizado artificialmente a partir de materiales de partida inorgánicos, sin la participación de organismos vivos. Los resultados de este experimento implícitamente desacreditaron el vitalismo, la teoría de que los productos químicos de los organismos vivos son fundamentalmente diferentes de los de materia inanimada. Este descubrimiento fue importante para el desarrollo de la química orgánica. Su descubrimiento hizo que Wöhler escribiese triunfante a Berzelius: «... Debo decirle que yo puedo hacer urea sin el uso de los riñones, ni hombre ni de perro. El cianato de amonio es la urea». Por este descubrimiento, algunos consideraran a Wöhler como el padre de la química orgánica.
Referencias[editar]
- ↑ Número CAS
- ↑ Sobre el origen etimológico de "urea" (Consultado lunes, 12 de septiembre del 2022.)
- ↑ Capítulo "El largo aliento de Hans Krebs", capítulo XIII (pp. 367-474) de Monteverde, E. (2015). Historias épicas de la medicina: demonios, pócimas, enfermedades y curaciones que alguna vez fueron mortales. México: Crítica. 488 pp. ISBN 978-607-8406-61-6 (Consultado lunes, 12 de septiembre del 2022.)
- ↑ Kishimoto S, Shimura R, Kamijo T (2008). MHI Proprietary Process for Reducing CO2 Emission and Increasing Urea Production. Nitrogen + Syngas 2008 International Conference and Exhibition. Moscow.
- ↑ Al-Ansari, F (2008). «Carbon Dioxide Recovery at GPIC». Nitrogen+Syngas 293: 36-38.
- ↑ «Inorganic Chemicals » AMMONIUM CARBAMATE». Hillakomem.com. 2 de octubre de 2008. Archivado desde el original el 5 de abril de 2011. Consultado el 18 de agosto de 2018.
- ↑ a b dadas, dadas. Thermodynamics of the Urea Process. Consultado el 5 de agosto de 2018.
- ↑ Meessen JH (2010). «Urea». Ullmann's Encyclopedia of Industrial Chemistry. ISBN 3527306730. doi:10.1002/14356007.a27_333.pub2.
- ↑ Clarín.com (7 de agosto de 2021). «Para un mejor aprovechamiento del nitrógeno y mayor cuidado ambiental». Clarín. Consultado el 19 de abril de 2022.
- ↑ «La urea en la piel. Una molécula con propiedades únicas.». Haut Boutique. 14 de abril de 2018. Consultado el 19 de septiembre de 2019.
- ↑
Boerhaave called urea "sal nativus urinæ" (the native, i.e., natural, salt of urine). Ver:
- La primera mención de la urea es como "the essential salt of the human body" en: Peter Shaw and Ephraim Chambers, A New Method of Chemistry … , vol 2, (London, England: J. Osborn and T. Longman, 1727), page 193: Process LXXXVII.
- Boerhaave, Herman Elementa Chemicae … , volume 2, (Leipzig ("Lipsiae"), (Germany): Caspar Fritsch, 1732), page 276.
- para una tradcción inglesa del pasaje ver: Peter Shaw, A New Method of Chemistry … , 2nd ed., (London, England: T. Longman, 1741), page 198: Process CXVIII: The native salt of urine
- Lindeboom, Gerrit A. Boerhaave and Great Britain … , (Leiden, Netherlands: E.J. Brill, 1974), page 51.
- Backer, H. J. (1943) "Boerhaave's Ontdekking van het Ureum" (descubrimiento de la urea de Boerhaave), Nederlands Tijdschrift voor Geneeskunde (Dutch Journal of Medicine), 87 : 1274–1278 (en neerlandés).
- ↑ Kurzer, Frederick; Sanderson, Phyllis M. (1956). «Urea in the History of Organic Chemistry». Journal of Chemical Education (American Chemical Society) 33 (9): 452-459. Bibcode:1956JChEd..33..452K. doi:10.1021/ed033p452. Consultado el 11 de octubre de 2011.
- ↑ Friedrich Wöhler (1828) "Ueber künstliche Bildung des Harnstoffs" (On the artificial formation of urea), Annalen der Physik und Chemie, 88 (2) : 253–256. Available in English at: Chem Team.
- ↑ Nicolaou, Kyriacos Costa; Tamsyn Montagnon (2008). Molecules That Changed The World. Wiley-VCH. p. 11. ISBN 978-3-527-30983-2.
- ↑ Gibb, Bruce C. (2009). «Teetering towards chaos and complexity». Nature Chemistry (Nature Publishing Group) 1 (1): 17-18. Bibcode:2009NatCh...1...17G. PMID 21378787. doi:10.1038/nchem.148. Consultado el 29 de junio de 2011.
Enlaces externos[editar]
 Wikimedia Commons alberga una categoría multimedia sobre Urea.
Wikimedia Commons alberga una categoría multimedia sobre Urea. Wikcionario tiene definiciones y otra información sobre urea.
Wikcionario tiene definiciones y otra información sobre urea.- Nomenclatura de la química orgánica IUPAC

