Carbamato de amonio
| Carbamato de amonio | ||
|---|---|---|
| General | ||
| Fórmula estructural |
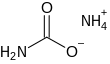 | |
| Fórmula molecular | [NH4][H2NCO2] | |
| Identificadores | ||
| Número CAS | 1111-78-0[1] | |
| Número RTECS | EY8575000 | |
| ChEMBL | CHEMBL3560381 | |
| ChemSpider | 451267 | |
| PubChem | 12550248 | |
| UNII | I2W9615SWP | |
| Propiedades físicas | ||
| Masa molar | 78,043 g/mol | |
El carbamato de amonio es un compuesto químico de fórmula [NH
4][H
2NCO
2] formado por el catión amonio NH+
4 y el anión carbamato NH
2COO−. Es un sólido blanco muy soluble en agua y menos en alcohol. El carbamato de amonio puede formarse por la reacción del amoníaco NH3 con el dióxido de carbono CO2, y se descompondrá lentamente en esos gases a temperaturas y presiones ordinarias. Es un producto intermedio en la síntesis industrial de urea (NH
2)
2CO, un importante fertilizante.[2]
Propiedades[editar]
Equilibrio sólido-gas[editar]
En un recipiente cerrado, el carbamato de amonio sólido está en equilibrio con el dióxido de carbono y el amoníaco[3][4][5].
[NH
2CO
2][NH
4] ⇌ CO
2 + 2NH
3
Las temperaturas más bajas desplazan el equilibrio hacia el carbamato.
A temperaturas más altas, el carbamato de amonio se condensa en urea:
[NH
2CO
2][NH
4] → (NH
2)
2CO + H
2O
Esta reacción fue descubierta por primera vez en 1870 por Bassarov, calentando carbamato de amonio en tubos de vidrio sellados a temperaturas que oscilaban entre 130 y 140 °C.[4]
Equilibrio en agua[editar]
A temperaturas y presiones ordinarias, el carbamato de amonio existe en soluciones acuosas en equilibrio con el amoníaco y el dióxido de carbono, y los aniones bicarbonato, HCO-3, y carbonato, CO2-3.[6][7][4] De hecho, las soluciones de carbonato o bicarbonato de amonio contendrán también algunos aniones carbamato.
- H
2NCO−
2 + 2H
2O ⇌ NH+
4 + HCO−
3 + OH−
- H
2NCO−
2 + H
2O ⇌ NH+
4 + CO2−
3
Estructura[editar]
La estructura del carbamato de amonio sólido ha sido confirmada por cristalografía de rayos X. Los centros de oxígeno forman enlaces de hidrógeno con el catión amonio.[8] Existen dos polimorfos, α y β, ambos en el sistema cristalino ortorrómbico pero que difieren en su grupo espacial. El polimorfo α está en el grupo espacial Pbca (n.º 61), mientras que el polimorfo β está en el Ibam (n.º 72). El polimorfo α es más volátil.[9]
Presencia natural[editar]
El carbamato de amonio desempeña un papel clave en la formación de carbamoil fosfato, necesario tanto para el ciclo de la urea como para la producción de pirimidinas. En esta reacción catalizada por enzimas, el ATP y el carbamato de amonio se convierten en ADP y fosfato de carbamoilo:[10][11]
ATP + [NH
2CO
2][NH
4] → ADP + H
2NC(O)OPO2−
3
Preparación[editar]
A partir de amoníaco líquido y hielo seco[editar]
El carbamato de amonio se prepara por reacción directa entre el amoníaco líquido y el hielo seco (dióxido de carbono sólido):[3]
2 NH
3 + CO
2 → [NH
2CO
2][NH
4]
También se prepara por reacción de los dos gases a alta temperatura (175-225 °C) y alta presión (150-250 bar).[12]
A partir de amoníaco gaseoso y dióxido de carbono[editar]
El carbamato de amonio también puede obtenerse burbujeando CO2 y NH3 gaseosos en etanol anhidro, 1-propanol o DMF a presión ambiente y 0 °C. El carbamato precipita y puede separarse por simple filtración, y el líquido que contiene el amoníaco sin reaccionar puede devolverse al reactor. La ausencia de agua impide la formación de bicarbonato y carbonato, y no se pierde amoníaco.[12]
Usos[editar]
Síntesis de urea[editar]
El carbamato de amonio es un producto intermedio en la producción industrial de urea. Una planta industrial típica que fabrica urea puede producir hasta 4000 toneladas al día[13] en este reactor y, a continuación, puede deshidratarse para obtener urea de acuerdo con la siguiente ecuación:
[NH
2CO
2][NH
4] → (NH
2)
2CO + H
2O
Formulaciones plaguicidas[editar]
El carbamato de amonio también ha sido aprobado por la Agencia de Protección del Medio Ambiente como ingrediente inerte presente en formulaciones de pesticidas de fosfuro de aluminio. Este plaguicida se utiliza habitualmente para el control de insectos y roedores en zonas donde se almacenan productos agrícolas. La razón del carbamato de amonio como ingrediente es hacer que la fosfina sea menos inflamable al liberar amoníaco y dióxido de carbono para diluir la fosfina formada por una reacción de hidrólisis.[14]
Laboratorio[editar]
El carbamato de amonio puede utilizarse como un buen agente amoniacal, aunque no tan fuerte como el propio amoniaco. Por ejemplo, es un reactivo eficaz para la preparación de diferentes ésteres β-amino-α,β-insaturados sustituidos. La reacción puede llevarse a cabo en metanol a temperatura ambiente y puede aislarse en ausencia de agua, con gran pureza y rendimiento.[15]
Preparación de carbamatos metálicos[editar]
El carbamato de amonio puede ser un reactivo de partida para la producción de sales de otros cationes. Por ejemplo, haciéndolo reaccionar con cloruro potásico sólido KCl en amoníaco líquido se puede obtener carbamato potásico NH
2COO−K+.[16] Los carbamatos de otros metales, como el calcio, pueden producirse haciendo reaccionar carbamato de amonio con una sal adecuada del catión deseado, en un disolvente anhidro como metanol, etanol o formamida, incluso a temperatura ambiente.[17]
Referencias[editar]
- ↑ Número CAS
- ↑ Jäger, Peter; Rentzea, Costin N.; Kieczka, Heinz (2000). «Carbamates and Carbamoyl Chlorides». ULLMANN'S Encyclopedia of Industrial Chemistry. ISBN 3527306730. doi:10.1002/14356007.a05_051.
- ↑ a b Brooks, L. A.; Audrieta, L. F.; Bluestone, H.; Jofinsox, W. C. (1946). «Ammonium Carbamate». Inorg. Synth. Inorganic Syntheses 2. pp. 85-86. ISBN 9780470132333. doi:10.1002/9780470132333.ch23.
- ↑ a b c Clark, K. G.; Gaddy, V. L.; Rist, C. E. (1933-10). «Equilibria in the Ammonium Carbamate-Urea-Water System». Industrial & Engineering Chemistry (en inglés) 25 (10): 1092-1096. ISSN 0019-7866. doi:10.1021/ie50286a008. Consultado el 25 de agosto de 2023.
- ↑ R. N. Bennett, P. D. Ritchie, D. Roxburgh and J. Thomson (1953): "The system ammonia + carbon dioxide + ammonium carbamate. Part I. — The equilibrium of thermal dissociation of ammonium carbamate". Transactions of the Faraday Society, volume 49, pages 925-929. doi 10.1039/TF9534900925
- ↑ Fabrizio Mani, Maurizio Peruzzini, and Piero Stoppioni (2006): "CO
2 absorption by aqueous NH
3 solutions: speciation of ammonium carbamate, bicarbonate and carbonate by a 13C NMR study". Green Chemistry, volume 8, issue 11, pages 995-1000. doi 10.1039/B602051H - ↑ George H. Burrows and Gilbert N. Lewis (1912): "The equilibrium between ammonium carbonate and ammonium carbamate in aqueous solution at 25°". Journal of the American Chemical Society, volume 34, issue 8, pages 993-995. doi 10.1021/ja02209a003
- ↑ Adams, J. M.; Small, R. W. H. (15 de noviembre de 1973). «The crystal structure of ammonium carbamate». Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry 29 (11): 2317-2319. doi:10.1107/S056774087300662X. Consultado el 25 de agosto de 2023.
- ↑ Kuhn, Norbert; Ströbele, Markus; Meyer, H.-Jürgen (2007). «Über die Identität eines sogenannten Ammoniumcarbonat-Präparates». Zeitschrift für anorganische und allgemeine Chemie 633 (4): 635-656. doi:10.1002/zaac.200600392.
- ↑ Goldberg, R. N. Apparent Equilibrium Constants for Enzyme-catalyzed reactions (2009). CRC Handbook of Chemistry and Physics, 7–19. Retrieved from https://www.nist.gov/manuscript-publication-search.cfm?pub_id=900943 Archivado el 4 de marzo de 2016 en Wayback Machine.
- ↑ Phosphorus Compounds: Advances in Research and Application: 2011 Edition
- ↑ a b Barzagli, Francesco; Mani, Fabrizio; Peruzzini, Maurizio (2011). «From greenhouse gas to feedstock: formation of ammonium carbamate from CO2 and NH3 in organic solvents and its catalytic conversion into urea under mild conditions». Green Chemistry (en inglés) 13 (5): 1267. ISSN 1463-9262. doi:10.1039/c0gc00674b. Consultado el 25 de agosto de 2023.
- ↑ «Dangote fertiliser plant and other fertilizer plants operating in Nigeria». 22 de marzo de 2022.
- ↑ United States Environmental Protection Agency. (2006). Inert Reassessment-Ammonium Carbamate [Data File]. Retrieved from http://www.epa.gov/opprd001/inerts/carbamate.pdf
- ↑ Mladen Litvić, Mirela Filipan, Ivan Pogorelić and Ivica Cepanec (2005): "Ammonium carbamate; mild, selective and efficient ammonia source for preparation of β-amino-α,β-unsaturated esters at room temperature". Green Chemistry, volume 7, issue 11, pages 771-774. doi 10.1039/B510276F
- ↑ Carl Theodor Thorssell and August Kristensson (1935): "Process for the production of potassium carbamate". US Patent 2002681, US31484228A
- ↑ Erns Kuss and Emil Germann (1935): "Production of metal carbamates". US Patent US2023890A
Enlaces externos[editar]
- Esta obra contiene una traducción derivada de «Ammonium carbamate» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
