Reactivo de Grignard
Los reactivos de Grignard son compuestos organometálicos de fórmula general R-Mg-X, donde R es un resto orgánico (alquílico o arílico) y X un halógeno. Los reactivos de Grignard son unos de los más importantes y versátiles en química orgánica debido a su rápida reacción con electrófilos, como por ejemplo el grupo carbonilo. Son importantes para la formación de enlaces de carbono-carbono, carbono-fósforo, carbono-estaño, carbono-silicio, carbono-boro y otros enlaces carbono-heteroátomo.[1][2] Por el descubrimiento de estos reactivos y sus reacciones, Victor Grignard recibió el premio Nobel de Química en 1912.
La reacción de Grignard generalizada es:

donde R1 = grupo orgánico alquilo o arilo;
Síntesis[editar]
Los reactivos de Grignard se sintetizan a partir de un halogenuro de alquilo o arilo al reaccionar con magnesio en presencia de un éter anhidro (seco):
Por ejemplo:
- CH3CH2Br + Mg → CH3CH2MgBr (bromuro de etilmagnesio)
Método experimental general:
Para que esta reacción tenga éxito, tanto los reactivos como el material utilizado deben estar completamente secos, y trabajar en atmósfera inerte. Sobre un matraz se coloca magnesio en forma de virutas o limaduras y se cubre con unos pocos mililitros del disolvente (dietil éter o tetrahidrofurano, generalmente; otra alternativa es el 2-Metiltetrahidrofurano más benigno con el medio ambiente). Se añade una pequeña cantidad de activante (usualmente dibromoetano o yodo) y, una vez activada la superficie del magnesio mediante la aplicación de calor, se comienza a adicionar la disolución del compuesto halogenado correspondiente previamente disuelto. Suele ser necesario calentar hasta que la reacción finaliza. Por último sólo es necesario filtrar la disolución (siempre bajo atmósfera inerte).
Para que tenga cierta estabilidad el reactivo de Grignard debe encontrarse solvatado. Esta reacción se lleva a cabo en disolventes nucleófilos que no tienen hidrógeno activo, como el éter dietílico anhidro o éteres superiores (dibutil éter, anisol, tetrahidrofurano...), como se ha comentado anteriormente. Llevan cada uno dos pares de electrones libres, que complejan al magnesio y proporcionan la estabilidad necesaria cumpliendo la regla del octeto.[3] Por ejemplo, el tetrahidrofurano formaría el siguiente complejo de bromuro de alquilmagnesio:
El equilibrio de Schlenk, llamado así por Wilhelm Schlenk , describe la composición molecular del compuesto de Grignard en función del disolvente empleado. Dependiendo del disolvente que estabilice el compuesto de Grignard en un complejo, se forman diferentes estructuras de los compuestos de Grignard.
Mecanismo[editar]
Mecánicamente la reacción de Grignard es una adición nucleófila en la que se añade el átomo de carbono polarizado negativamente (carbanión) del reactivo de Grignard al átomo de carbono de un grupo carbonilo. Por lo tanto, se forma un nuevo enlace carbono-carbono. Se cree que en el estado de transición de la reacción están involucradas dos moléculas del compuesto de Grignard, resultando un estado de transición de seis miembros cíclico.[4] El átomo de oxígeno del carbonilo del metal toma la forma de un alcóxido de metal. En el siguiente paso este átomo de oxígeno se protona por un ácido acuoso diluido y después se hidroliza por el ataque nucleófilo de una molécula de agua. Por desprotonación se produce el alcohol correspondiente.[5]

Propiedades químicas[editar]
El compuesto de Grignard tiene la fórmula general RMgX, donde X es el halógeno cloro, bromo o yodo. La velocidad de reacción cae del yoduro al cloruro. El cloruro da un mejor rendimiento que el bromuro o el yoduro.[6] Los fluoruros de alquilo o arilo normalmente no reaccionan para formar un compuesto de Grignard. Los compuestos muy reactivos, como los yoduros, pueden sufrir reacciones secundarias, como `por ejemplo, el acoplamiento de Wurtz.
En el compuesto de Grignard, el magnesio lleva una carga parcial positiva y el átomo de carbono vecino una carga parcial negativa. Esta polarización es tan fuerte que, por ejemplo, puede tener lugar un ataque nucleófilo en un átomo de carbono positivamente polarizado. Se puede expresar la fuerza de la polaridad por el carácter iónico, que es del 35%. Por lo tanto, se comporta de manera similar a un carbanión y, por lo tanto, también puede representarse como una fórmula de resonancia que posee enlaces iónicos separados por carga.[7]
Los compuestos de Grignard reaccionan con sustancias que tienen hidrógeno activo, como el agua, alcoholes, fenoles, ácidos carboxílicos, tioles o grupos amina. Esto se debe a que los compuestos de Grignard son fuertemente básicos. En la siguiente figura, el compuesto de Grignard se hidroliza, en contacto con agua, al alcano correspondiente y al hidróxido de haluro metálico (sal mixta):

Los haluros de alquilo o aril magnesio (compuesto de Grignard) se utilizan muy frecuentemente en química orgánica como un nucleófilo que ataca a grupos electrofílicos, tales como grupos carbonilo, y sirve para construir enlaces simples carbono-carbono:[8]

La importancia de los compuestos de Grignard es que son muy buenos nucleófilos. Reaccionan con electrófilos, como cetonas, aldehídos, ésteres y nitrilos, produciendo un nuevo enlace carbono-carbono. Los compuestos de Grignard reaccionan con dióxido de carbono para formar sales de magnesio de ácidos carboxílicos. Del mismo modo, reaccionan con disulfuro de carbono. La hidrólisis de los productos de reacción con dióxido de carbono produce ácidos carboxílicos, R-CO2H o ácidos ditiocarboxílicos, R-CS2H. En la reacción de los compuestos de Grignard con selenio elemental, las sustancias del tipo RSeMgX se forman mediante una reacción de inserción; su hidrólisis proporciona selenoles bajo la exclusión de oxígeno, en presencia de oxígeno atmosférico, los diselenuros se forman por oxidación de los selenoles. Un método para cuantificar los compuestos ácidos CH en una muestra con reactivos de Grignard es la reacción de Zerevitinov.
Reactividad general[editar]
Reacciones con compuestos carbonílicos[editar]
Los reactivos de Grignard reaccionan con una amplia variedad de compuestos carbonílicos. Aquí se muestra un esquema:

La aplicación más común de este tipo de reacción usada en la industria consiste en alquilar aldehídos o cetonas, como en el ejemplo:[9]

El grupo funcional acetal, un carbonilo protegido, no reacciona con el organomagnesiano.
Tales reacciones por lo general implican un tratamiento ácido acuoso, aunque esto rara vez se muestra en los esquemas de reacción. En los casos en que el reactivo de Grignard es la adición de un aldehído o cetona proquiral (por inducción asimétrica), el modelo Felkin-Anh o la regla de Cram pueden predecir qué estereoisómero se formará generalmente. Con facilidad, las 1,3-dicetonas y otros sustratos relacionados, los reactivos de Grignard RMgX reaccionan simplemente como una base, dando el anión enolato y liberando el alcano RH.
Reacción con otros electrófilos[editar]
Los reactivos de Grignard reaccionan con diversos electrófilos, actuando tanto como un nucleófilo para muchos casos y como una base para sustratos próticos:

Formación de enlaces con B, P, Si, Sn[editar]
Igual que los compuestos de organolitio, los reactivos de Grignard son útiles para la formación de enlaces carbono-heteroátomo:

Reacción con halogenuros de metales de transición[editar]
Los reactivos de Grignard reaccionan con muchos electrófilos metálicos. Por ejemplo, se produce la transmetalación al hacerlos reaccionar con cloruro de cadmio (CdCl2) para dar compuestos organometálicos de dialquilcadmio:[10]
Los compuestos organometálicos de dialquilcadmio se utilizan sobre todo en la preparación de cetonas a partir de haluros de ácido:
Reacciones de acoplamiento C-C[editar]
Un reactivo de Grignard también puede participar en una reacción de acoplamiento. Por ejemplo, el bromuro de nonilmagnesio reacciona con metil p-clorobenzoato para dar ácido p-nonilbenzoico, en presencia de tris(acetilacetonato) de hierro (III) (Fe(acac)3), después del tratamiento con NaOH para hidrolizar el éster, que se muestra de la siguiente manera.[11] Sin el Fe(acac)3, el reactivo de Grignard atacaría al grupo éster.
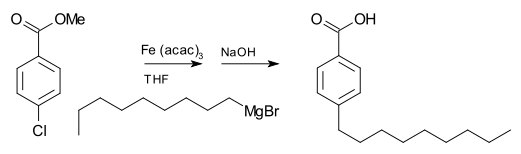
Para el acoplamiento de haluros de arilo con reactivos de Grignard de arilo, el cloruro de níquel en tetrahidrofurano (THF) es un buen catalizador. Adicionalmente, un catalizador eficaz para los acoplamientos de haluros de alquilo es el tetraclorocuprato de dilitio (Li2CuCl4), preparado por mezcla de cloruro de litio (LiCl) y cloruro de cobre (II) (CuCl2) en THF. El acoplamiento de Kumada-Corriu da acceso a estirenos (sustituidos):

Sustitución nucleófila alifática[editar]
Los reactivos de Grignard son nucleófilos y pueden dar reacciones de sustitución nucleófila con halogenuros de alquilo, por ejemplo en un paso clave en la producción industrial de naproxeno:

Reacción de Grignard estereoselectiva[editar]
Dado que muchas cetonas y todos los aldehídos son proquirales (excepto el formaldehído), como resultado en una reacción de Grignard a menudo se obtienen pares de enantiómeros o diastereómeros debido al centro estereogénico ya existente. Para extender la reacción de Grignard de forma estereoselectiva, Dieter Seebach usó el reactivo quiral TADDOL, un derivado del ácido tartárico. Aprovechando el equilibrio de Schlenk en la reacción con aldehídos se lograron del 84 al 96% de exceso enantiomérico.

Véase también[editar]
- Compuestos organometálicos
- Compuestos organolíticos
- Compuestos organocúpricos
- Síntesis orgánica
- Síntesis asimétrica
Enlaces químicos del carbono con el resto de átomos[editar]
| CH | He | |||||||||||||||||
| CLi | CBe | CB | CC | CN | CO | CF | Ne | |||||||||||
| CNa | CMg | CAl | CSi | CP | CS | CCl | CAr | |||||||||||
| CK | CCa | CSc | CTi | CV | CCr | CMn | CFe | CCo | CNi | CCu | CZn | CGa | CGe | CAs | CSe | CBr | CKr | |
| CRb | CSr | CY | CZr | CNb | CMo | CTc | CRu | CRh | CPd | CAg | CCd | CIn | CSn | CSb | CTe | CI | CXe | |
| CCs | CBa | CHf | CTa | CW | CRe | COs | CIr | CPt | CAu | CHg | CTl | CPb | CBi | CPo | CAt | Rn | ||
| Fr | CRa | Rf | Db | CSg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||
| ↓ | ||||||||||||||||||
| CLa | CCe | CPr | CNd | CPm | CSm | CEu | CGd | CTb | CDy | CHo | CEr | CTm | CYb | CLu | ||||
| Ac | CTh | CPa | CU | CNp | CPu | CAm | CCm | CBk | CCf | CEs | Fm | Md | No | Lr | ||||
| Química orgánica básica. | Muchos usos en Química. |
| Investigación académica, pero no un amplio uso. |
Enlace desconocido / no evaluado. |
Referencias[editar]
- ↑ Shirley, D. A. (1954). «The Synthesis of Ketones from Acid Halides and Organometallic Compounds of Magnesium, Zinc, and Cadmium». Org. React. 8: 28-58.
- ↑ Huryn, D. M. (1991). «Carbanions of Alkali and Alkaline Earth Cations: (ii) Selectivity of Carbonyl Addition Reactions». En Trost, B. M.; Fleming, I., eds. Comprehensive Organic Synthesis, Volume 1: Additions to C—X π-Bonds, Part 1. Elsevier Science. pp. 49-75. ISBN 978-0-08-052349-1.
- ↑ Heinz G. O. Becker, Werner Berger, Günter Domschke, Egon Fanghänel, Jürgen Faust, Mechthild Fischer, Fritjof Gentz, Karl Gewald, Reiner Gluch, Roland Mayer, Klaus Müller, Dietrich Pavel, Hermann Schmidt, Karl Schollberg, Klaus Schwetlick, Erika Seiler, Günter Zeppenfeld: Organikum. 19. Auflage. Barth, 1993, ISBN 3-335-00343-8, S. 564.
- ↑ Kazuhiro Maruyama; Toshimasa Katagiri (1989). «Mechanism of the Grignard reaction». Journal of Physical Organic Chemistry 2 (3): 205-213. doi:10.1002/poc.610020303.
- ↑ K. P. C. Vollhard, N. E. Schore (2005). H. Buntenschön, ed. Organische Chemie. Weinheim: Wiley-VCH. p. 351. ISBN 978-3-527-31380-8.
- ↑ K. Schwetlick (2009). Organikum. Wiley-VCH Verlag. pp. 563-572. ISBN 978-3-527-32292-3.
- ↑ K. P. C. Vollhardt, N. E. Schore (2005). Organische Chemie (4. edición). Wiley-VCH Verlag GmbH & Co. KGaA. pp. 348-349. ISBN 3-527-31380-X.
- ↑ V. Grignard (1900). Sur quelques nouvelles combinaisons organométalliques du magnèsium et leur application à des synthèses d’alcools et d’hydrocarbures 130. CR Hebd. Séances Acad. Sci., Ser. C. pp. 1322-1324. disponible en Gallica.
- ↑ Haugan, Jarle André; Songe, Pål; Rømming, Christian; Rise, Frode; Hartshorn, Michael P.; Merchán, Manuela; Robinson, Ward T.; Roos, Björn O. et al. (1997), «Total Synthesis of C31-Methyl Ketone Apocarotenoids 2: The First Total Synthesis of (3R)-Triophaxanthin», Acta Chimica Scandinavica 51: 1096-1103, doi:10.3891/acta.chem.scand.51-1096, consultado el 26 de noviembre de 2009 .
- ↑ «Unit 12 Aldehydes, Ketones and Carboxylic Acids». Chemistry Part II Textbook for class XII 2. India: National Council of Educational Research and Training. 2010. p. 355. ISBN 81-7450-716-7. Archivado desde el original el 20 de septiembre de 2018. Consultado el 29 de septiembre de 2013.
- ↑ A. Fürstner, A. Leitner, G. Seidel (2004). "4-Nonylbenzoic Acid". Org. Synth. 81: 33–42.




