Fenilitio
| Fenilitio | ||
|---|---|---|
 | ||
| General | ||
| Fórmula estructural |
 | |
| Fórmula molecular | C6H5Li | |
| Identificadores | ||
| Número CAS | 591-51-5[1] | |
| ChEBI | 51470 | |
| ChemSpider | 10254416 | |
| PubChem | 637932 | |
| Propiedades físicas | ||
| Masa molar | 84,0442 g/mol | |
El fenilitio es un agente organometálico de fórmula empírica C6H5Li. Se utiliza sobre todo como agente metalizante en síntesis orgánicas y como sustituto de los reactivos de Grignard para introducir grupos fenilo en síntesis orgánicas.[2] El fenilitio cristalino es incoloro; sin embargo, las soluciones de fenilitio presentan varios tonos de marrón o rojo dependiendo del disolvente utilizado y de las impurezas presentes en el soluto.[3]
Preparación[editar]
El fenilitio se produjo por primera vez mediante la reacción del litio metálico con el difenilmercurio:[4]
(C6Η5)2Ηg + 2Li → 2C6Η5Li + Ηg
La reacción de un haluro de fenilo con metal de litio produce fenilitio:
X-Ph + 2Li → Ph-Li + LiX
El fenilitio también puede sintetizarse con una reacción de intercambio metal-halógeno:
n-BuLi + X-Ph → n-BuX + Ph-Li
El método predominante para producir fenilitio en la actualidad son las dos últimas síntesis.
Reacciones[editar]
El uso principal del PhLi es facilitar la formación de enlaces carbono-carbono mediante reacciones nucleofílicas de adición y sustitución:
PhLi + R2C=O → PhR2COLi
La 2-fenilpiridina se prepara mediante la reacción del fenilitio con la piridina, un proceso que conlleva una vía de adición-eliminación:[5]
C6H5Li + C5H5N → C6H5-C5H4N + LiH
Estructura y propiedades[editar]
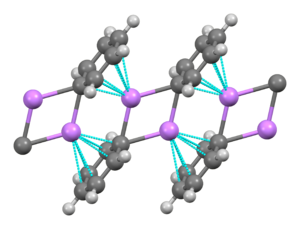
El fenilitio es un compuesto organolítico que forma cristales monoclínicos. El fenilitio sólido puede describirse como formado por subunidades diméricas Li2Ph2. Los átomos de Li y los carbonos ipso de los anillos de fenilo forman un anillo planar de cuatro miembros. El plano de los grupos fenilo es perpendicular al plano de este anillo Li2C2. Se produce un fuerte enlace intermolecular adicional entre estos dímeros de fenilitio y los electrones π de los grupos fenilo de los dímeros adyacentes, lo que da lugar a una estructura en escalera polimérica infinita. [6]
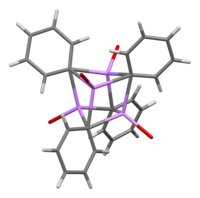
En solución, adopta diversas estructuras en función del disolvente orgánico. En tetrahidrofurano, se equilibra entre los estados monómero y dímero. En éter, como se comercializa habitualmente, el fenilitio existe como tetrámero. Cuatro átomos de Li y cuatro centros de carbono ipso ocupan vértices alternos de un cubo distorsionado. Los grupos fenilo se encuentran en las caras del tetraedro y se unen a tres de los átomos de Li más cercanos.
Las longitudes de enlace C-Li son de una media de 2,33 Å. Una molécula de éter se une a cada uno de los sitios de Li a través de su átomo de oxígeno. En presencia de LiBr, un subproducto de la reacción directa del litio con un haluro de fenilo, el complejo [(PhLi•Et2O)4] se convierte en [(PhLi•Et2O)3•LiBr]. El átomo de Li del LiBr ocupa uno de los sitios de litio en el cúmulo de tipo cubano y el átomo de Br se sitúa en un sitio de carbono adyacente.[7]
Referencias[editar]
- ↑ Número CAS
- ↑ Wiley-VCH, ed. (11 de marzo de 2003). Ullmann's Encyclopedia of Industrial Chemistry (en inglés) (1 edición). Wiley. ISBN 978-3-527-30385-4. doi:10.1002/14356007.a15_393. Consultado el 28 de enero de 2024.
- ↑ Gilman, H.; Zoellner, E. A.; Selby, W. M. (1932). «An Improved Procedure for the Preparation of Organolithium Compounds». Journal of the American Chemical Society 54 (5): 1957-1962. doi:10.1021/ja01344a033.
- ↑ Green, D. P.; Zuev, D. (2008). «Phenyllithium». Encyclopedia of Reagents for Organic Synthesis. Wiley and Sons. ISBN 978-0471936237. doi:10.1002/047084289X.rp076.pub2.
- ↑ Evans, J. C. W.; Allen, C. F. H. "2-Phenylpyridine" Organic Syntheses (1938), vol. 18, p. 70 doi 10.15227/orgsyn.018.0070
- ↑ Dinnebier, R. E.; Behrens, U.; Olbrich, F. (1998). «Lewis Base-Free Phenyllithium: Determination of the Solid-State Structure by Synchrotron Powder Diffraction». Journal of the American Chemical Society 120 (7): 1430-1433. doi:10.1021/ja972816e.
- ↑ Hope, H.; Power, P. P. (1983). «Isolation and Crystal Structures of the Halide-Free and Halide-Rich Phenyllithium Etherate Complexes [(PhLi•Et2O)4] and [(PhLi•Et2O)3•LiBr]». Journal of the American Chemical Society 105 (16): 5320-5324. doi:10.1021/ja00354a022.
Enlaces externos[editar]
- Esta obra contiene una traducción derivada de «Phenyllithium» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
