Teoría de los pares de electrones esqueléticos de un poliedro
En química la teoría de pares de electrones del esqueleto poliédrico proporciona reglas de cómputo de electrones útiles para predecir las estructuras de grupos de clústeres como boranos y carboranos.
Las reglas de cómputo de electrones fueron formuladas en 1971 por el químico británico Kenneth Wade[1] y luego desarrolladas por Michael Mingos[2] y otros; también se conocen como reglas de Wade o reglas de Wade/Mingos.[3] Las reglas están basadas en un tratamiento de orbital molecular del enlace.[4][5][6][7] Estas reglas han sido extendidas y unificadas como las Reglas mno de Jemmis.[8][9]
Pronosticando estructuras de clusters[editar]
Se utilizan diferentes reglas (4n, 5n, o 6n) dependiendo del número de electrones por vértice.
Las reglas 4n son bastante precisas para predecir las estructuras de clusters que tengan aproximadamente 4 electrones por vértice, como es el caso de muchos boranos y carboranos. Para tales grupos, las estructuras se basan en deltaedros, los cuales son poliedros en los que todas las caras son triangulares. Los clusters 4n se clasifican en closo-, nido-, aracno- o hifo-, si es que representan un deltaedro completo (closo-), o un deltaedro con uno (nido-), dos (aracno-) o tres (hifo-) vértices ausentes.
Sin embargo, los clusters hifo son relativamente raros debido a que el cómputo de electrones es lo suficientemente alto para empezar a llenar orbitales de antienlace y así desestabilizar la estructura 4n. Si el cómputo de electrones es cercano a 5 electrones por vértice, la estructura a menudo cambia a una regida por las reglas 5n, las cuales están basadas en poliedros triconectados.
Cuando el cómputo de electrones aumenta más, las estructuras de los clusters con cómputos de electrones 5n se vuelven inestables, así que se pueden implementar las reglas 6n. Los clusters 6n tienen estructuras basadas en anillos.
Puede usarse un tratamiento de orbital molecular para racionalizar el enlace de clusters 4n, 5n, y 6n.
Reglas 4n[editar]
Los siguientes poliedros son poliedros closo, y son la base para las reglas 4n; cada uno de estos tiene caras triangulares.[10] El número de vértices en el cluster determina en qué poliedro se basa la estructura.
| Número de vértices | Poliedro |
|---|---|
| 4 | Tetraedro |
| 5 | Bipirámide trigonal |
| 6 | Octaedro |
| 7 | Bipirámide pentagonal |
| 8 | D2d (trigonal) dodecaedro (biesfenoide romo) |
| 9 | Prisma triangular aumentado |
| 10 | Bipirámide cuadrada giroelongada |
| 11 | Icosaedro de borde contraído (octadecaedro) |
| 12 | Icosaedro (bipirámide pentagonal giroelongada) |
Utilizando el cómputo de electrones, se puede encontrar la estructura. n es el número de vértices en el cluster. Las reglas 4n se enumeran en la siguiente tabla.
| Cómputo de electrones | Nombre | Estructura predicha |
|---|---|---|
| 4n − 2 | Closo giroelongado | poliedro closo con n − 2 vértices con 2 caras cubiertas (aumentadas) |
| 4n | Closo aumentado | poliedro closo con n − 1 vértices con 1 cara cubierta |
| 4n + 2 | Closo | poliedro closo con n vértices |
| 4n + 4 | Nido | poliedro closo con n + 1 vértices con 1 vértice ausente |
| 4n + 6 | Aracno | poliedro closo con n + 2 vértices con 2 vértices ausentes |
| 4n + 8 | Hifo | poliedro closo con n + 3 vértices con 3 vértices ausente |

Cuando se cuentan electrones para cada cluster, el número de electrones de valencia se enumera. Por cada metal de transición presente, se restan 10 electrones del cómputo total de electrones. Por ejemplo, en Rh6(CO)16 el número total de electrones sería 6(9) + 16(2) - 6(10) = 86 – 6(10) = 26. Por lo tanto, el cluster es un poliedro closo porque n = 6, con 4n + 2 = 26.

También se consideran otras reglas cuando se predice la estructura de un cluster:
- Para los grupos que consisten mayoritariamente en metales de transición, cualquier elemento del grupo principal presente es a menudo contado como ligante o átomo intersticial, más que como vértice.
- Los átomos más grandes y electropositivos tienden a ocupar vértices de conectividad alta y los átomos más pequeños y electronegativos tienden a ocupar vértices de conectividad baja.
- En el caso especial de clusters de hidruro de boro, cada boro conectado a 3 o más vértices tiene un hidruro terminal, mientras un boro conectado a otros 2 vértices tiene 2 hidrógenos terminales. Si están presentes más hidrógenos, se colocan en posiciones de cara abierta para emparejar el número de coordinación de los vértices.
- Para el caso especial de clusters de metales de transición, se añaden ligandos a los centros metálicos para darle a los metales números de coordinación razonables, y si hay átomos de hidrógeno presentes se colocan en posiciones de puente para emparejar los números de coordinación de los vértices.
En general, las estructuras closo con n vértices son poliedros de n-vértices.
Para predecir la estructura de un cluster nido, se usa como punto de partida el cluster closo con n + 1 vértices; si el cluster está compuesto de átomos pequeños se remueve un vértice de alta conectividad, mientras que si el cluster está compuesto de átomos grandes será removido un vértice de baja conectividad .
Para predecir la estructura de un cluster aracno, se usa como el punto de partida el poliedro closo con n + 2 vértices, y el complejo nido de n+1 vértices se genera siguiendo la regla anterior; se remueve un segundo vértice adyacente al primero si el cluster está compuesto principalmente de átomos pequeños, se remueve un segundo vértice no adyacente al primero si el cluster está compuesto mayoritariamente de átomos grandes.
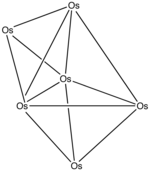
Ejemplo: Pb102−
- Cómputo de electrones: 10(Pb) + 2 (por la carga negativa) = 10(4) + 2 = 42 electrones.
- Ya que n = 10, 4n + 2 = 42, así que el cluster es una bipirámide cuadrada giroelongada closo.
Ejemplo: S42+
- Cómputo de electrones: 4(S) – 2 (por la carga positiva) = 4(6) – 2 = 22 electrones.
- Ya que n = 4, 4n + 6 = 22, así que el cluster es aracno.
- Empezando por un octaedro, se remueve un vértice de conectividad alta , y entonces será removido un vértice no adyacente.
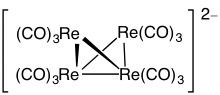
Ejemplo: Os6(CO)18
- Cómputo de electrones: 6(Os) + 18(CO) – 60 (para 6 átomos de osmio) = 6(8) + 18(2) – 60 = 24
- Ya que n = 6, 4n = 24, el cluster es un closo aumentado.
- Empezando por una bipirámide trigonal, es cubierta una cara. Los carbonilos han sido omitidos para mayor claridad.
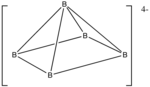
Ejemplo: B5H54−[11]
- Cómputo de electrones: 5(B) + 5(H) + 4 (por la carga negativa) = 5(3) + 5(1) + 4 = 24
- Ya que n = 5, 4n + 4 = 24, el cluster es nido.
- Empezando por un octaedro, se remueve uno de los vértices.
Las reglas también son útiles para predecir la estructura de carboranos. Ejemplo: C2B7H13
- Cómputo de electrones = 2(C) + 7(B) + 13(H) = 2(4) + 3(7) + 13(1) = 42
- Ya que n en este caso es 9, 4n + 6 = 42, el grupo es aracno.
El recuento para clusters deltaédricos se suele llevar a cabo contando electrones esqueléticos en vez del número total de electrones. El orbital esquelético (par de electrones) y los cómputos de electrones esqueléticos para los cuatro tipos de clusters deltaédricos son:
- Closo de n-vértices: (n+1) orbitales esqueléticos, (2n+2) electrones esqueléticos.
- Nido de n-vértices: (n+2) orbitales esqueléticos, (2n+4) electrones esqueléticos.
- Aracno de n-vértices: (n+3) orbitales esqueléticos, (2n+6) electrones esqueléticos.
- Hifo de n-vértices: (n+4) orbitales esqueléticos, (2n+8) electrones esqueléticos.
Los cómputos de electrones esqueléticos se determinan sumando el total de los siguientes números de electrones:
- 2 de cada unidad BH.
- 3 de cada unidad CH.
- 1 de cada átomo de hidrógeno adicional (además de los de las unidades de BH y CH).
- los electrones de carga aniónica.
Reglas 5n[editar]
Como se discutió anteriormente, la regla 4n trata principalmente clusters con cómputos de electrones de 4n+k, en los que aproximadamente 4 electrones se encuentran en cada vértice. Mientras más electrones se añaden por vértice, el número de los electrones por vértice se acerca a 5. Más allá de adoptar las estructuras basadas en deltaedros, los clusters del tipo 5n tienen estructuras basadas en una serie diferente de poliedros conocidos como poliedros triconectados, en los que cada vértice está conectado a otros 3 vértices. Los poliedros triconectados son los poliedros conjugados de los deltaedros. Los tipos comunes de poliedros triconectados se listan abajo.


| Número de vértices | Tipo de poliedro triconectado |
|---|---|
| 4 | Tetraedro |
| 6 | Prisma trigonal |
| 8 | Cubo |
| 10 | Prisma pentagonal |
| 12 | D2d Pseudo-octaedro (conjugado de biesfenoide romo) |
| 14 | Conjugado de prisma triangular triaumentado (asociaedro K5) |
| 16 | Trapezoedro truncado cuadrado |
| 18 | Conjugado de icosaedro de borde contraído |
| 20 | Dodecaedro |
Las reglas 5n son las siguientes.
| Cómputo total de electrones | Estructura predicha |
|---|---|
| 5n | poliedro triconectado de n-vértices |
| 5n+1 | poliedro triconectado de n–1 vértices con un vértice insertado en una arista |
| 5n+2 | poliedro triconectado de n–2 vértices con dos vértices insertados en aristas |
| 5n+k | poliedro triconectado de n-k vértices con k vértices insertados en aristas |
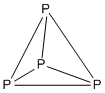
Ejemplo: P4
- Cómputo de electrones: 4(P)= 4(5)= 20
- Es de estructura 5n con n=4, así que es tetraédrico.
Ejemplo: P4S3
- Cómputo de electrones: 4(P)+ 3(S)= 4(5)+3(6)= 38
- Es de estructura 5n+3 con n=7. Tres vértices se insertan en las aristas.
Ejemplo: P4O6
- Cómputo de electrones: 4(P)+ 6(O)= 4(5)+ 6(6)= 56
- Es de estructura 5n+6 con n=10. Seis vértices se insertan en las aristas.
Reglas 6n[editar]
A medida que se añaden más electrones a un cluster 5n, el número de electrones por vértice se acerca a 6. En vez de adoptar estructuras basadas en las reglas 4n o 5n, los clusters tienden a adoptar estructuras regidas por las reglas 6n, las cuales están basadas en anillos. Las reglas para las estructuras 6n son las siguientes.
| Cómputo total de electrones | Estructura predicha |
|---|---|
| 6n–k | anillo de n-miembros con k/2 enlaces transanulares |
| 6n–4 | anillo de n-miembros con 2 enlaces transanulares |
| 6n–2 | anillo de n-miembros con 1 enlace transanular |
| 6n | anillo de n-miembros |
| 6n+2 | cadena de n-miembros (anillo de n-miembros con 1 enlace roto) |
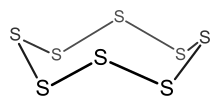
Ejemplo: S8
- Cómputo de electrones = 8(S) = 8(6) = 48 electrones.
- Ya que n = 8, 6n = 48, así que el cluster es un anillo de 8 miembros

Hexano (C6H14)
- Cómputo de electrones = 6(C)+ 14(H) = 6(4) + 14(1) = 38
- Ya que n=6, 6n=36 y 6n+2=38 así que el cluster es una cadena de 6 miembros.
Unidades de vértices isolobales[editar]
Si una unidad de vértice es isolobal con BH entonces puede, al menos en principio, ser sustituida con una unidad BH, aun cuando BH y CH no son isoelectrónicos. La unidad CH+ es isolobal, esta es la razón por la que las reglas son aplicables a los carboranos.
Esto puede ser explicado debido a un tratamiento de orbitales frontera.[10] Además hay unidades isolobales de metales de transición. Por ejemplo Fe(CO)3 proporciona 2 electrones. La explicación de esto es breve como se puede observar:
- Fe tiene 8 electrones de valencia.
- Cada grupo carbonilo es un donante neto de 2 electrones, después de que se cuentan los enlaces σ y π internos haciendo así 14 electrones.
- Se considera que 3 pares se involucran en el enlace σ de Fe - CO y 3 pares se involucran en la retrodonación π de Fe a CO reduciendo el cómputo de 14 a 2.
Enlaces en clusters[editar]
Poliedros[editar]
B2H6

Los enlaces en diboranos se describen mejor considerando que cada B tenga hibridación sp3. Dos orbitales híbridos sp3 en cada boro forman los enlaces a los hidrógenos terminales. Los orbitales sp3 restantes crean los enlaces con los hidrógenos puentes. Debido a que los ángulos en la estructura del diborano no son tetraédricos, es probable que los orbitales tengan también carácter sp2.
B6H62− Closo
Los átomos de boro se encuentran en cada vértice del octaedro y tienen hibridación sp.[11] Un sp híbrido irradia lejos de la estructura formando el enlace con el átomo de hidrógeno. El otro sp híbrido irradia al centro de la estructura formando un orbital molecular de enlace grande en el centro del cluster. Los orbitales sin hibridar restantes se encuentran a lo largo de la tangente de la estructura esférica creando más orbitales de enlace y antienlace entre los vértices de boro.[8]
El diagrama orbital se puede analizar de la siguiente forma:
Los 18 orbitales moleculares estructurales, (OMs), derivados de los 18 orbitales atómicos del boro son:
- 1 OM de enlace en el centro del cluster y 5 OMs de antienlace provenientes de los 6 orbitales radiales de hibridación sp.
- 6 OMs de enlace y 6 OMs de antienlace provenientes de los 12 orbitales p tangenciales.
El total de orbitales de enlace esqueléticos es por lo tanto 7, i.e. (n+1).
Clusters de átomos del grupo principal: El enlace en otros clusters del grupo principal sigue reglas similares a aquellas descritas para el enlace en clusters de boro. Los átomos en el vértice hibridan de tal forma que permiten la formación de la estructura de más baja energía.


Los 18 orbitales moleculares estructurales, (OMs), derivados de los 18 orbitales atómicos del boro son:
- 1 OM de enlace en el centro del cluster y 5 OMs de antienlace provenientes de los 6 orbitales radiales de hibridación sp.
- 6 OMs de enlace y 6 OMs de antienlace provenientes de los 12 orbitales p tangenciales.
El total de orbitales de enlace esqueléticos es por lo tanto 7, i.e. (n+1).
Clusters de metales de transición[editar]
Los clusters de metales de transición utilizan los orbitales d para el enlace para tener hasta nueve orbitales de enlace, en vez de solo los cuatro presentes en clusters de boro y del grupo principal.[12] También poseen más flexibilidad de enlazamiento en clusters de metales de transición dependiendo de si los pares de electrones metálicos de los vértices están involucrados en el enlace en los clusters o si aparecen como pares solitarios. Se discutirán brevemente los clusters de cloruros y carbonilos de metales de transición ya que representan extremos opuestos de la serie espectroquímica y muestran características importantes de las diferencias entre clusters de metales de transición con diferentes ligantes.[13] En clusters de cloruros la partición de energía de los orbitales d de valencia aumenta con la formación del cluster. El número y simetría de estos orbitales es dependiente del tipo y estructura de cada cluster individual.[13] En cambio en los clusters de carbonilo la partición de energía de los orbitales d de valencia es más grande antes de la formación del cluster.[13]
Referencias[editar]
- ↑ The structural significance of the number of skeletal bonding electron-pairs in carboranes, the higher boranes and borane anions, and various transition-metal carbonyl cluster compounds K. Wade J. Chem.
- ↑ A General Theory for Cluster and Ring Compounds of the Main Group and Transition Elements D. M. P. MINGOS Nature Physical Science 236, 99-102 doi:10.1038/physci236099a0
- ↑ The significance and impact of Wade's rules Alan J. Welch Chem.
- ↑ Wade, K. (1976).
- ↑ Girolami, G. (Fall 2008).
- ↑ Gilespie, R. J. (1979).
- ↑ Mingos, D. M. P (1984).
- ↑ a b Jemmis, Eluvathingal D.; Balakrishnarajan, Musiri M.; Pancharatna, Pattath D. (2001).
- ↑ Jemmis, Eluvathingal D.; Balakrishnarajan, Musiri M.; Pancharatna, Pattath D. (2002).
- ↑ a b Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (6th ed.
- ↑ a b Cotton, Albert (1990).
- ↑ King, R.B., Rouvray, D. H. (1977).
- ↑ a b c Kostikova, G.P., Korol'kov, D. V. (1985).
Referencias generales[editar]
- Greenwood, Norman N.; Earnshaw, Alan (1997). Química de los Elementos (2.º ed.). Butterworth-Heinemann. ISBN 0080379419.
- Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999), Química Inorgánica Avanzada (6.º ed.), Nueva York: Wiley-Interscience, ISBN 0-471-19957-5
