Testosterona (medicación)
| Testosterona (medicación) | ||
|---|---|---|
 | ||
 | ||
| Identificadores | ||
| PubChem | 6013 | |
| DrugBank | DB00624 | |
| ChemSpider | 5791 | |
| UNII | 3XMK78S47O | |
| KEGG | D00075 | |
| ChEBI | 17347 | |
| ChEMBL | 386630 | |
| Datos químicos | ||
| Fórmula | C19H28O2 | |
|
InChI=1S/C19H28O2/c1-18-9-7-13(20)11-12(18)3-4-14-15-5-6-17(21)19(15,2)10-8-16(14)18/h11,14-17,21H,3-10H2,1-2H3/t14-,15-,16-,17-,18-,19-/m0/s1
Key: MUMGGOZAMZWBJJ-DYKIIFRCSA-N | ||
Testosterona (T) es un medicamento sintético, que copia una hormona esteroide natural.[1] Es usado para tratar el hipogonadismo masculino y ciertos tipos de cáncer de mama.[1] También puede ser utilizada para incrementar la habilidad atlética en la forma de dopaje.[1] No está claro si el uso de testosterona para los niveles bajos debidos a la edad en la andropausia, es beneficioso o dañino.[2] Las presentaciones de testosterona pueden ser usadas en forma de gel o parche que es aplicado a la piel, inyección a un músculo, tableta colocada en la mejilla o tableta tomada por vía oral.[1]
Los efectos secundarios comunes de la testosterona incluyen acné, hinchazón y aumento de tamaño de los senos en los hombres.[1] Los efectos secundarios graves pueden incluir toxicidad hepática, enfermedad cardíaca y cambios de comportamiento.[1] Las mujeres y los niños que están expuestos pueden desarrollar masculinización.[1] Se recomienda que las personas con cáncer de próstata no usen el medicamento.[1] Puede causar daño al bebé si se usa durante el embarazo o la lactancia.[1] La testosterona se encuentra en la familia de los andrógenos de los medicamentos.[1]
La testosterona se aisló por primera vez en 1935 y se aprobó para uso médico en 1939.[3][4] Las tasas de uso han aumentado tres veces en los Estados Unidos entre 2001 y 2011.[5] Está en la Lista de medicamentos esenciales de la Organización Mundial de la Salud, los medicamentos más efectivos y seguros que se necesitan en un sistema de salud.[6] Está disponible como un medicamento genérico.[1] El precio depende de la dosis y forma del producto.[7] En 2016, fue el 146.º medicamento más recetado en los Estados Unidos con más de 4 millones de recetas.[8]
Usos médicos[editar]
El uso principal de la testosterona es el tratamiento de los hombres con muy poca o ninguna producción natural de testosterona, también denominado hipogonadismo o hipoandrogenismo (deficiencia de andrógenos).[9] Este tratamiento se conoce como terapia de reemplazo hormonal (TRH), o alternativamente, y más específicamente, como terapia de reemplazo de testosterona (TRT) o terapia de reemplazo de andrógenos (ART). Se utiliza para mantener los niveles de testosterona en suero en el rango masculino normal. La disminución de la producción de testosterona con la edad ha llevado a un interés en la suplementación con testosterona.[10]
Deficiencia[editar]
La deficiencia de testosterona (también denominada hipotestosteronismo o hipotestosteronemia) es una producción de testosterona anormalmente baja. Puede ocurrir debido a disfunción testicular (hipogonadismo primario) o disfunción hipotalámica-hipofisaria (hipogonadismo secundario) y puede ser congénita o adquirida.[11]
Niveles bajos debido al envejecimiento[editar]
Los niveles de testosterona pueden disminuir gradualmente con la edad.[12][13] La Administración de Drogas y Alimentos de los Estados Unidos (FDA) declaró en 2015 que ni los beneficios ni la seguridad del suplemento de testosterona se han establecido para niveles bajos de testosterona debido al envejecimiento.[2] La FDA ha exigido que las etiquetas de testosterona incluyan advertencias sobre un mayor riesgo de ataques cardíacos y accidentes cerebrovasculares.[2]
Hombres transgénero[editar]
Para aprovechar sus efectos virilizantes, la testosterona se administra a los hombres transgénero como parte de la terapia hormonal masculinizante,[14] valorada para el efecto clínico con un "nivel objetivo" del nivel promedio de testosterona del hombre.[15]
Mujeres[editar]
El tratamiento con testosterona es eficaz a corto plazo para el tratamiento del trastorno del deseo sexual hipoactivo (HSDD) en mujeres.[16] Sin embargo, su seguridad a largo plazo no está clara.[16] Debido a la falta de datos para respaldar su eficacia y seguridad, Endocrine Society recomienda el uso rutinario de testosterona en mujeres para tratar niveles bajos de andrógenos debido a hipopituitarismo, insuficiencia suprarrenal, extirpación quirúrgica de los ovarios, tratamiento con corticosteroides a altas dosis u otras causas.[16] Del mismo modo, debido a la falta de datos para respaldar su eficacia y seguridad, la Endocrine Society recomienda que no se use la testosterona en las mujeres para tratar la infertilidad; disfunción sexual debida a causas distintas de la HSDD; para mejorar la salud cognitiva, cardiovascular, metabólica y/u ósea; o para mejorar el bienestar general.[16]
Una revisión sistemática de 2014 y un meta-análisis de 35 estudios de más de 5.000 mujeres posmenopáusicas con función normal de la glándula suprarrenal encontraron que la terapia con testosterona estaba asociada con una mejora significativa en una variedad de dominios de la función sexual.[17] Tales dominios incluían la frecuencia de la actividad sexual, el orgasmo, la excitación y la satisfacción sexual entre otros.[17] Las mujeres que eran menopáusicas debido a la ovariectomía mostraron una mejoría significativamente mayor en la función sexual con testosterona en comparación con aquellas que tenían menopausia normal.[17] Además de los efectos beneficiosos sobre la función sexual, la testosterona se asoció con cambios en los lípidos de la sangre, incluidos niveles reducidos de colesterol total, triglicéridos y lipoproteínas de alta densidad y niveles elevados de lipoproteínas de baja densidad.[17] Sin embargo, tales cambios fueron pequeños en magnitud y su influencia a largo plazo en los resultados cardiovasculares no está clara.[17] Los cambios fueron más pronunciados con el undecanoato de testosterona oral en comparación con la testosterona parenteral (por ejemplo, transdérmica).[17] La testosterona no mostró ningún efecto significativo sobre el estado de ánimo depresivo o la ansiedad, medidas antropomorfas como el peso corporal o el índice de masa corporal o la densidad mineral ósea.[17] A la inversa, se asoció con una incidencia significativa de efectos secundarios androgénicos que incluyen acné e hirsutismo, y otros efectos secundarios androgénicos como aumento de peso, pérdida de cabello en patrones y profundización de la voz también se informaron en algunos ensayos, pero se excluyeron del metanálisis debido a datos insuficientes.[17] La calidad general de la evidencia se calificó como baja y se consideró no concluyente en ciertas áreas, por ejemplo, seguridad a largo plazo.[17]
Una revisión sistemática y un metaanálisis de 2017 sobre más de 3.000 mujeres posmenopáusicas también encontraron que la terapia de testosterona transdérmica fue eficaz para mejorar múltiples dominios de la función sexual en el tratamiento a corto plazo de la HSDD.[18] Los efectos adversos androgénicos como el acné y el hirsutismo fueron significativamente mayores en incidencia, mientras que no hubo diferencias significativas en "el aumento del vello facial, la alopecia, la profundización de la voz, los síntomas urinarios, el dolor de cabeza, la reacción del sitio al parche, los eventos adversos totales, los eventos adversos graves, los efectos adversos graves los eventos, las razones para retirarse del estudio y el número de mujeres que completaron el estudio" que se compararon en relación con los controles.[18]
Si bien las dosis suficientes de testosterona son efectivas para mejorar la función sexual en las mujeres posmenopáusicas, hay poco apoyo para la idea de que la testosterona es una hormona crítica para el deseo y la función sexual en mujeres bajo circunstancias fisiológicas normales.[19][20] Respecto a las dosis bajas de testosterona que dan como resultado niveles fisiológicos de testosterona (<50 ng/dL) no se ha encontrado que aumenten significativamente el deseo o la función sexual en las mujeres en la mayoría de los estudios.[19] De manera similar, parece haber poca o ninguna relación entre los niveles de testosterona total o libre dentro del rango fisiológico normal y el deseo sexual en mujeres premenopáusicas.[20][19] Solo altas dosis de testosterona que dan como resultado niveles suprafisiológicos de testosterona (> 50 ng/dL) aumentan significativamente el deseo sexual en las mujeres, con niveles de testosterona de 80 a 150 ng/dL que se describe que aumentan "ligeramente" el deseo sexual.[19][20] Respecto a esto, los hombres experimentan disfunción sexual a niveles de testosterona por debajo de 300 ng/dL, con hombres que tienen niveles de testosterona de aproximadamente 200 ng/dL a menudo experimentando tales problemas.[20] Las altas dosis de testosterona que se requieren para aumentar el deseo sexual en las mujeres pueden tener un riesgo significativo de masculinización con la terapia a largo plazo y pueden ser inapropiadas.[20][19] En 2003, la FDA rechazó Intrinsa, un parche de testosterona de 300 µg/día para el tratamiento de la disfunción sexual en mujeres posmenopáusicas, debido a su eficacia limitada (aproximadamente un evento sexual más satisfactorio por mes), preocupaciones sobre la seguridad y los posibles efectos adversos con el tratamiento a largo plazo, y preocupaciones sobre el uso inadecuado sin indicación.[19][20] Parece que en las mujeres, en lugar de testosterona, el estradiol puede ser la hormona más importante involucrada en el deseo sexual, aunque los datos sobre el uso clínico del estradiol para aumentar el deseo sexual en las mujeres son limitados.[19][21][22]
No hay productos de testosterona aprobados para uso en mujeres en los Estados Unidos y en muchos otros países.[23] Hay productos de testosterona aprobados para mujeres en Australia y algunos países europeos.[23] Los implantes de testosterona están aprobados para su uso en mujeres posmenopáusicas en el Reino Unido.[24][25] Los productos de testosterona para hombres pueden usarse sin indicación directa en mujeres en los Estados Unidos.[23] Alternativamente, los productos de testosterona para mujeres están disponibles en farmacias de compuestos en los Estados Unidos, aunque tales productos no están regulados y la calidad de fabricación no está garantizada.[26]
| Ruta | Medicación | Forma (s) | Marca (s) principal (es) | Rango de dosis | Frecuencia |
|---|---|---|---|---|---|
| Oral | Testosterona undecanoato a | Cápsula | Andriol | 40–80 mg | Cada 1-2 días |
| Metiltestosterona b | Tableta | Metandren; Estratest | 0.5-10 mg | Diario | |
| Normetandrona a, b | Tableta | Ginecoside | 5 mg | Diario | |
| Tibolona a | Tableta | Livial | 1.25–2.5 mg | Diario | |
| Prasterona (dehidroepiandrosterona) c | Tableta | <abbr title="<nowiki>Not applicable</nowiki>">N / A | 25–100 mg | Diario | |
| Sublingual | Testosterona d | Tableta | <abbr title="<nowiki>Not applicable</nowiki>">N / A | 0.25–0.5 mg | Diario |
| Metiltestosterona | Tableta | Metandren | 0,25 mg | Diario | |
| Transdérmico | Testosterona a | Parche | Intrínseca | 150–300 μg / día | Cada 3-4 días |
| Testosterona | Crema; Gel | AndroGel | 5-10 mg | Diario | |
| Vaginal | Testosterona d | Crema; Gel | <abbr title="<nowiki>Not applicable</nowiki>">N / A | Sin especificar | Cada 1-3 días |
| Prasteronae (dehidroepiandrosterona) | Inserto | Intrarosa | 6.5 mg | Diario | |
| Intramuscular | Enantato de testosterona b | Aceite | Delatestryl; Ditate-DS | 25–100 mg | Cada 4-6 semanas |
| Testosterona Cipionato B | Aceite | Depo-testosterona; Depo-Testadiol | 25–100 mg | Cada 4-6 semanas | |
| Enantato de testosterona ácido bencílico hidrazona b, e | Aceite | Climacteron | 150 mg | Cada 4-8 semanas | |
| Decanoato de nandrolona | Aceite | Deca-Durabolin | 25–50 mg | Cada 6-12 semanas | |
| Prasterona enantato a, b | Aceite | Gynodian Depot | 200 mg | Cada 4-6 semanas | |
| Subcutáneo | Testosterona | Implante | Testopel | 50–100 mg | Cada 3-6 meses |
| Notas al pie: a = No disponible o ya no está disponible en los Estados Unidos. b = Solo y/o en combinación con un estrógeno . c = sin receta . d = Compuesto solamente. e = Descontinuado. Fuentes: ver plantilla. | |||||
Fórmulas disponibles[editar]
La testosterona se ha comercializado para ser utilizada por vía oral, bucal, intranasal, transdérmica (parches), tópica (geles), intramuscular (inyección) y subcutánea (administración de implantes).[27][28][29] Se proporciona sin modificar y como un éster de testosterona como el cipionato de testosterona, el enantato de testosterona, el propionato de testosterona o el undecanoato de testosterona, que actúan como profármacos de la testosterona.[27][28][29] La vía de administración más común para la testosterona es mediante inyección intramuscular.[27] Sin embargo, se ha informado que AndroGel, una formulación en gel transdérmica de testosterona, se ha convertido en la forma más popular de testosterona en la terapia de reemplazo de andrógenos para el hipogonadismo en los Estados Unidos.[28]
| Ruta | Ingrediente | Forma | Dosis | Frecuencia | Nombres comerciales |
|---|---|---|---|---|---|
| Oral | Undecanoato de testosterona | Cápsulas | 40 mg | Dos a cuatro veces al día. | Andriol, Andriol Testocaps |
| Bucal | Testosterona | Pastillas | 30 mg | Dos veces al día | Estriado |
| Intranasal | Testosterona | Gel | 5.5 mg por pulverización (120 pulverizaciones por botella) | Tres veces al día | Natesto |
| Transdérmico | Testosterona | Parches no escrotales | 2.5, 4, 5 o 6 mg T por 24 horas | Una vez cada 1-2 días | Androderm, AndroPatch, TestoPatch |
| Parches no escrotales | 150 o 300 μg T por 24 horas | Una vez cada 3-4 días | Intrinsa | ||
| Parches escrotales | 4 o 6 mg T por 24 horas | Una vez al día | Testoderm | ||
| Gel tópico (1-2%) | 25, 50, 75, 100 o 125 mg T por aplicación | Una vez al día | AndroGel, Testim, TestoGel | ||
| Solución axilar (2%) | 30 mg T por aplicación | Una vez al día | Axiron | ||
| Inyección intramuscular | Testosterona a | Ampollas/viales | 25, 50 o 100 mg / ml | Una vez cada 2-3 días | Andronaq, Sterotate, Virosterone |
| Cipionato de testosterona | Ampollas/viales | 50, 100, 200 o 250 mg / ml | Una vez cada 1–4 semanas | Depo-testosterona | |
| Enantato de testosterona | Ampollas/viales | 50, 100, 180, 200 o 250 mg / ml | Una vez cada 1–4 semanas | Delatestryl | |
| Propionato de testosterona a | Ampollas/viales | 5, 10, 25, 50 o 100 mg / ml | Una vez cada 2-3 días | Testoviron | |
| Undecanoato de testosterona | Ampollas | 750 o 1000 mg por inyección | Una vez cada 10–14 semanas | Aveed, Nebido, Reandron | |
| Subcutáneo | Testosterona | Implantes | 50, 75, 100 o 200 mg | Una vez cada 3-6 meses | TestoImplant, Testopel |
| Abreviaturas: T = testosterona. Notas al pie: a = Mayormente descontinuado. Notas: (1): Esta tabla no incluye información de dosis, que no necesariamente puede extrapolarse de la información proporcionada. (2): Esta tabla no incluye productos combinados. (3): Algunas de estas formulaciones se han comercializado previamente, pero es posible que ya no estén disponibles (por ejemplo, parches escrotales de testosterona transdérmica, suspensión de testosterona intramuscular, propionato de testosterona intramuscular). (4): La disponibilidad de productos farmacéuticos de testosterona difiere según el país (ver Testosterona (medicamento) § Disponibilidad ). Fuentes: ver plantilla. | |||||
Uso no médico[editar]
Atletismo[editar]
La testosterona se usa como una forma de dopaje entre los atletas para mejorar el rendimiento.[30] La testosterona está clasificada como un agente anabólico y se encuentra en la Lista de sustancias y métodos prohibidos de la Agencia Mundial Antidopaje (AMA).[30] Los suplementos hormonales hacen que el sistema endocrino ajuste su producción y disminuya la producción natural de la hormona, por lo que cuando se suspenden los suplementos, la producción de hormonas naturales es menor de lo que era originalmente.
También se ha encontrado que los esteroides anabólico-androgénicos (AAS), incluida la testosterona y sus ésteres, mejoran el desarrollo muscular, la fuerza o la resistencia. Lo hacen directamente aumentando la síntesis de proteínas de los músculos. Como resultado, las fibras musculares se vuelven más grandes y se reparan más rápido que las de una persona promedio.
Después de una serie de escándalos y publicidad en la década de 1980 (como el desempeño mejorado de Ben Johnson en los Juegos Olímpicos de 1988), muchas organizaciones deportivas renovaron o reforzaron las prohibiciones del uso de AAS. La testosterona y otras AAS fueron designadas como "sustancias controladas" por el Congreso de los Estados Unidos en 1990, con la Ley de control de esteroides anabólicos.[31] Su uso es visto como un problema en el deporte moderno, particularmente debido a los esfuerzos realizados por los atletas y laboratorios profesionales para tratar de ocultar ese uso a los reguladores deportivos. El uso de esteroides, una vez más entró en el centro de atención recientemente como resultado del doble homicidio-suicidio del luchador profesional canadiense Chris Benoit en 2007; sin embargo, no hay evidencia que implique el uso de esteroides como un factor en el incidente.
Algunas atletas femeninas pueden tener niveles naturalmente más altos de testosterona que otras, y se les puede pedir que den su consentimiento para la verificación del sexo y ya sea una cirugía o drogas para disminuir los niveles de testosterona.[32] Esto ha resultado ser polémico, ya que la Corte de Arbitraje para el Deporte suspendió la política de la IAAF debido a la evidencia insuficiente de un vínculo entre los altos niveles de andrógenos y el mejor rendimiento deportivo.[33][34]
Detección de abuso[editar]
Se han empleado varios métodos para detectar el uso de testosterona por parte de los atletas, la mayoría basados en un análisis de orina. Estos incluyen la proporción de testosterona/epitestosterona (normalmente menos de 6), la proporción de testosterona/hormona luteinizante y la proporción de carbono 13/carbono 12 (la testosterona farmacéutica contiene menos carbono 13 que la testosterona endógena). En algunos programas de prueba, los resultados históricos de un individuo pueden servir como un intervalo de referencia para la interpretación de un hallazgo sospechoso. Otro enfoque que se está investigando es la detección de la forma administrada de testosterona, generalmente un éster, en el cabello.[35][36][37][38]
Contraindicaciones[editar]
Las contraindicaciones absolutas de la testosterona incluyen cáncer de próstata, hematocrito elevado (> 54%), insuficiencia cardíaca congestiva no controlada, otras enfermedades cardiovasculares y apnea obstructiva del sueño no controlada.[39] Algunas fuentes dicen que el cáncer de mama es una contraindicación absoluta de la terapia con testosterona,[39] pero los andrógenos, incluida la testosterona, también se han utilizado para tratar el cáncer de mama.[40] Las contraindicaciones relativas de la testosterona incluyen un elevado antígeno prostático específico (APE) en hombres con alto riesgo de cáncer de próstata debido a su origen étnico o familiar, síntomas graves del tracto urinario inferior y aumento del hematocrito (> 50%).[39]
Efectos secundarios[editar]
Los efectos adversos también pueden incluir efectos secundarios menores como piel grasa, acné y seborrea, así como la pérdida de cabello en el cuero cabelludo, que se puede prevenir o reducir con inhibidores de la 5α-reductasa.[41] En las mujeres, la testosterona puede producir hirsutismo (crecimiento excesivo de vello facial/corporal), profundización de la voz y otros signos de virilización. La testosterona exógena puede causar la supresión de la espermatogénesis en los hombres, lo que lleva, en algunos casos, a la infertilidad reversible.[42] La ginecomastia y la sensibilidad en las mamas pueden ocurrir con altas dosis de testosterona debido a la conversión periférica de testosterona por la aromatasa en cantidades excesivas de estrógeno, estradiol.[43] El tratamiento con testosterona, particularmente en dosis altas, también puede asociarse con cambios en el estado de ánimo, aumento de agresiones, aumento del deseo sexual, erecciones espontáneas y emisiones nocturnas.[44][45][46][47]
Otros efectos secundarios incluyen aumento del hematocrito, que puede requerir venopunción para tratar, y exacerbación de la apnea del sueño.[48]
La FDA declaró en 2015 que ni los beneficios ni la seguridad de la testosterona se han establecido para niveles bajos de testosterona debido al envejecimiento.[2] La FDA ha exigido que las etiquetas farmacéuticas de testosterona incluyan información de advertencia sobre la posibilidad de un mayor riesgo de ataques cardíacos y accidentes cerebrovasculares.[2] También ha requerido que la etiqueta incluya inquietudes sobre el abuso y la dependencia.[49]
Efectos adversos a largo plazo[editar]
Enfermedad cardiovascular[editar]
Los efectos adversos de la suplementación con testosterona pueden incluir un aumento de los eventos cardiovasculares (incluidos accidentes cerebrovasculares y ataques cardíacos) y muertes basado en tres estudios revisados por pares con hombres que toman reemplazo de testosterona.[50] Además, se ha informado un aumento del 30% en muertes y ataques cardíacos en hombres mayores.[51] Debido a un aumento en la incidencia de eventos cardiovasculares adversos en comparación con un grupo placebo, un ensayo de testosterona en hombres mayores con limitaciones de movilidad (TOM) (un ensayo aleatorio del Instituto Nacional de Envejecimiento) fue detenido prematuramente por el Comité de Supervisión de Seguridad y Datos.[52] El 31 de enero de 2014, los informes de accidentes cerebrovasculares, ataques cardíacos y muertes en hombres que tomaron reemplazo de testosterona aprobado por la FDA llevaron a la FDA a anunciar que investigaría el problema.[53] Más tarde, en septiembre de 2014, la FDA anunció, como resultado del "potencial de resultados cardiovasculares adversos", una revisión de la conveniencia y seguridad de la terapia de reemplazo de testosterona (TRT).[54][55][56] La FDA ahora requiere advertencias en el etiquetado de medicamentos de todos los productos de testosterona aprobados con respecto a la trombosis venosa profunda y el embolismo pulmonar.[57]
Hasta el año 2010, los estudios no habían mostrado ningún efecto sobre el riesgo de muerte, cáncer de próstata o enfermedad cardiovascular;[58][59] estudios más recientes, sin embargo, plantean inquietudes.[60] Un estudio de 2013, publicado en el Journal of American Medical Association, informó que "el uso de la terapia con testosterona se asoció significativamente con un mayor riesgo de resultados adversos". El estudio comenzó después de que un ensayo clínico aleatorizado previo de terapia con testosterona en hombres se suspendiera prematuramente "debido a eventos cardiovasculares adversos que aumentaban las preocupaciones sobre la seguridad del tratamiento con testosterona".[51]
Cáncer de próstata[editar]
Se supone que la testosterona en presencia de un cáncer de próstata de crecimiento lento aumenta su tasa de crecimiento. Sin embargo, la asociación entre la suplementación con testosterona y el desarrollo de cáncer de próstata no está comprobada.[61] Sin embargo, se advierte a los médicos sobre el riesgo de cáncer asociado con la suplementación con testosterona.[62]
Puede acelerar el crecimiento del cáncer de próstata preexistente en personas que han sufrido privación de andrógenos.[48] Se recomienda que los médicos examinen el cáncer de próstata con un examen rectal digital y un nivel de antígeno prostático específico (PSA) antes de comenzar la terapia, y que controlen los niveles de PSA y hematocrito de cerca durante la terapia.[12]
Los grupos étnicos tienen diferentes tasas de cáncer de próstata.[63] Las diferencias en las hormonas sexuales, incluida la testosterona, se han sugerido como una explicación de estas diferencias.[63] Esta aparente paradoja se puede resolver observando que el cáncer de próstata es muy común. En las autopsias, el 80% de los hombres de 80 años tienen cáncer de próstata.[64]
Embarazo y lactancia[editar]
La testosterona está contraindicada en el embarazo y no se recomienda durante la lactancia.[65] Los andrógenos como la testosterona son teratógenos y se sabe que causan daño fetal, como la producción de virilización y genitales ambiguos.
Interacciones[editar]
Inhibidores de la 5α-reductasa[editar]
Los inhibidores de la 5α-reductasa como la finasterida y la dutasterida pueden aumentar ligeramente los niveles circulantes de testosterona al inhibir su metabolismo.[66] Sin embargo, estos medicamentos lo hacen a través de la prevención de la conversión de testosterona en su metabolito más potente dihidrotestosterona (DHT), y esto resulta en una reducción drástica de los niveles circulantes de DHT (que circula a concentraciones relativas mucho más bajas).[66][67] Además, los niveles locales de DHT en los tejidos llamados androgénicos (que expresan 5α-reductasa) también se reducen notablemente,[66][67] y esto puede tener un fuerte impacto en ciertos efectos de la testosterona.[29][68] Por ejemplo, el crecimiento del vello corporal y facial, y el crecimiento del pene inducido por la testosterona puede ser inhibido por los inhibidores de la 5α-reductasa, y esto podría considerarse indeseable en el contexto de, por ejemplo, la inducción de la pubertad.[68][69] Por otro lado, los inhibidores de la 5α-reductasa pueden prevenir o reducir los efectos secundarios androgénicos adversos de la testosterona, como la pérdida de cabello en el cuero cabelludo, la piel grasa, el acné y la seborrea.[29] Además de la prevención de la conversión de testosterona en DHT, los inhibidores de la 5α-reductasa también previenen la formación de neuroesteroides como el 3α-androstanodiol de la testosterona, y esto puede tener consecuencias neuropsiquiátricas en algunos hombres.[70]
Inhibidores de la aromatasa[editar]
Los inhibidores de la aromatasa como el anastrozol previenen la conversión de la testosterona en estradiol por la aromatasa.[29] Como solo una pequeña fracción de la testosterona se convierte en estradiol, esto no afecta los niveles de testosterona, pero puede prevenir los efectos secundarios estrogénicos como la ginecomastia, que pueden ocurrir cuando se administra la testosterona en dosis relativamente altas.[29] Sin embargo, el estradiol ejerce una retroalimentación negativa sobre el eje hipotálamo-hipófisis-gonadal y, por este motivo, la prevención de su formación puede reducir esta retroalimentación y desinhibir la producción gonadal de testosterona, que a su vez puede aumentar los niveles de testosterona endógena.[71] La terapia con testosterona a veces se combina con un inhibidor de la aromatasa para hombres con hipogonadismo secundario que desean concebir hijos con sus parejas.[72]
Inhibidores del citocromo P450[editar]
Los inhibidores e inductores de las enzimas del citocromo P450 como el CYP3A4 se han asociado con poco o ningún efecto sobre los niveles de testosterona en circulación.
Antiandrógenos y estrógenos[editar]
Los antiandrógenos como el acetato de ciproterona, la espironolactona y la bicalutamida pueden bloquear los efectos androgénicos y anabólicos de la testosterona.[73][74] Los estrógenos pueden reducir los efectos de la testosterona al aumentar la producción hepática y, a su vez, los niveles circulantes de globulina fijadora de hormonas sexuales (SHBG, por sus siglas en inglés), una proteína transportadora que se une a andrógenos como la testosterona y la DHT, y por lo tanto reduce las concentraciones libres de estos andrógenos.[74][75]
Farmacología[editar]
Farmacodinamia[editar]
| Medicación | Proporción |
|---|---|
| Testosterona | 1:1 |
| Cipionato de testosterona | 1:1 |
| Enantato de testosterona | 1:1 |
| Metiltestosterona | 1:1 |
| Fluoximesterona | 1:2 |
| Oximetolona | 1:3 |
| Oxandrolona | 1:3–1:13 |
| Decanoato de nandrolona | 1:2.5–1:4 |
| Fuentes: ver plantilla. | |
La testosterona es un ligando de alta afinidad y agonista del receptor nuclear de andrógenos (AR). Además, la testosterona se une y activa a los receptores de andrógenos de membrana (mAR), como GPRC6A y ZIP9. La testosterona también se potencia mediante la transformación por la 5α-reductasa en el andrógeno DHT más potente en los llamados tejidos androgénicos, como la glándula prostática, las vesículas seminales , la piel y los folículos pilosos. En contraste con el caso de la testosterona, tal potenciación se produce en un grado reducido o en absoluto con la mayoría de los AAS sintéticos (así como con DHT), y esto es principalmente responsable de la disociación de los efectos anabólicos y androgénicos con estos agentes.[76] Además de la DHT, la testosterona se convierte a una tasa de aproximadamente 0.3% en el estrógeno estradiol a través de la aromatasa.[77] Esto ocurre en muchos tejidos, especialmente el tejido adiposo, el hígado y el cerebro, pero principalmente en el tejido adiposo.[77] La testosterona, después de la conversión en DHT, también se metaboliza en 3α-androstanediol, un neuroesteroide y potente modulador alostérico positivo del receptor GABA<sub id="mwAVA">A</sub>, y 3β-androstanediol, un agonista potente y preferencial de la ERβ.[78] Estos metabolitos, junto con el estradiol, pueden estar involucrados en varios de los efectos de la testosterona en el cerebro, incluidos los efectos antidepresivos, ansiolíticos, liberadores del estrés, gratificantes y pro-sexuales.[78]
Efectos en el cuerpo y cerebro[editar]
Los receptores de andrógenos se expresan ampliamente en todo el cuerpo, incluidos el pene, los testículos, los epidídimos, la próstata, las vesículas seminales, la grasa, la piel, los huesos, la médula ósea, los músculos, la laringe, el corazón, el hígado, los riñones, la hipófisis, el hipotálamo y otros a lo largo del cerebro.[79][80] A través de la activación de los receptores de andrógenos (al igual que los mAR), la testosterona tiene muchos efectos, incluidos los siguientes:[79][27]
- Promueve el crecimiento, la función y el mantenimiento de la glándula prostática, las vesículas seminales y el pene durante la pubertad y posteriormente.
- Promueve el crecimiento y mantenimiento de los músculos, particularmente de la parte superior del cuerpo.
- Causa que la grasa subcutánea se deposite en un patrón masculino y disminuye la grasa corporal en general.
- Suprime el desarrollo mamario inducido por los estrógenos, pero también puede producir ginecomastia a través de la conversión excesiva en estradiol si los niveles son demasiado altos.
- Mantiene la salud, integridad, apariencia e hidratación de la piel y disminuye la velocidad de envejecimiento de la piel, pero también puede causar piel grasa, acné y seborrea.
- Promueve el crecimiento del vello facial y corporal, pero también puede causar pérdida de cabello e hirsutismo en el cuero cabelludo.
- Contribuye al crecimiento óseo y provoca el ensanchamiento de los hombros en la pubertad.
- Modula la síntesis de proteínas hepáticas, como la producción de globulina fijadora de hormonas sexuales y muchas otras proteínas.
- Aumenta la producción de eritropoyetina en los riñones y, por lo tanto, estimula la producción de glóbulos rojos en la médula ósea y eleva el hematocrito.
- Ejerce una retroalimentación negativa sobre el eje hipotalámico-hipofisario-gonadal al suprimir la secreción de la hormona estimulante del folículo (FSH) de las gonadotropinas y la hormona luteinizante (LH) de la glándula pituitaria, inhibiendo así la producción de hormona sexual gonadal, así como la espermatogénesis y la fertilidad.
- Regula el sistema vasomotor y la temperatura corporal a través del hipotálamo, evitando así los sofocos o bochornos.
- Modula la función cerebral, con efectos en el estado de ánimo, la emocionalidad, la agresividad y la sexualidad, así como la cognición y la memoria.
- Aumenta el deseo sexual y la capacidad eréctil y causa erecciones espontáneas y emisiones nocturnas.
- Aumenta el riesgo de hiperplasia prostática benigna y cáncer de próstata y acelera la progresión del cáncer de próstata.
- Disminuye la proliferación mamaria y el riesgo de cáncer de mama.
Farmacocinética[editar]

La testosterona no es activa por vía oral, excepto en dosis extremadamente altas debido a la mala absorción y al metabolismo extenso de primer paso.[74] Además, los andrógenos esteroideos, incluida la testosterona, son hepatotóxicos y existe una posibilidad de lesión hepática con dosis altas de testosterona oral debido a la producción de concentraciones locales suprafisiológicas de fármaco en el hígado.[81] En lugar de ingestión oral, la testosterona se administra por vía parenteral en forma de geles y cremas tópicos, parches transdérmicos, tabletas bucales e implantes subdérmicos.[74][82] Además, se administra a través de inyección intramuscular de depósito en forma de profármacos éster de acción prolongada, como el cypionato de testosterona , el enantato de testosterona y el propionato de testosterona, así como el undecanoato de testosterona especialmente duradero.[74] El buciclato de testosterona es un éster de testosterona de acción aún más prolongada que se ha desarrollado, pero aún no ha sido aprobado para uso médico.[74]
Aunque la testosterona en sí no se usa oralmente, el undecanoato de testosterona está aprobado y se usa oralmente.[74] Debido a las propiedades químicas únicas que ofrece su muy larga cadena de éster, el undecanoato de testosterona omite parcialmente el metabolismo hepático de primer paso a través de la absorción del tracto gastrointestinal directamente al sistema linfático y luego a la circulación.[74] Del undecanoato de testosterona oral que llega a la circulación, 90 a 100% se transporta linfáticamente.[83] Este éster no es hepatotóxico en las dosis utilizadas.[74] Sin embargo, el undecanoato de testosterona oral tiene una farmacocinética variable y debe tomarse de dos a cuatro veces al día con alimentos.[74] Además del undecanoato de testosterona, la combinación de testosterona con un inhibidor de la 5α-reductasa como la dutasterida puede hacer que la testosterona sea activa por vía oral cuando se administra en forma de cápsulas llenas de aceite.[84] Esto es a través de la reducción del metabolismo hepático de primer paso de la testosterona.[84]
| Éster de testosterona | Formar | Ruta de administración | Vida media de eliminación | Tiempo medio de residencia |
|---|---|---|---|---|
| Undecanoato de testosterona | Cápsulas llenas de aceite | Oral | 1.6 horas | 3.7 horas |
| Propionato de testosterona | Solución de aceite | Inyección intramuscular | 0.8 días | 1.5 días |
| Enantato de testosterona | Solución de aceite de ricino | Inyección intramuscular | 4,5 días | 8.5 días |
| Undecanoato de testosterona | Solución de aceite de semilla de té | Inyección intramuscular | 20.9 días | 34.9 días |
| Undecanoato de testosterona | Solución de aceite de ricino | Inyección intramuscular | 33.9 días | 36.0 días |
| Testosterona buciclato una | Suspensión acuosa | Inyección intramuscular | 29.5 días | 60.0 días |
| Notas: El cipionato de testosterona tiene una farmacocinética muy similar a la de <abbr title="<nowiki>testosterone enanthate</nowiki>">TE . Notas al pie: a = Nunca comercializado. Fuentes: ver plantilla. | ||||
Absorción[editar]
La biodisponibilidad oral de la testosterona es muy baja y prácticamente despreciable.[27][85] La biodisponibilidad del undecanoato de testosterona oral es del 3 al 7%.[83][86] Los geles de testosterona tópicos tienen una biodisponibilidad del 10% cuando se administran en sitios recomendados para la piel, incluidos el abdomen, los brazos, los hombros y los muslos.[87] La biodisponibilidad de la testosterona a través del implante es prácticamente del 100%,[88] mientras que la biodisponibilidad de los medicamentos que se administran por vía intramuscular es generalmente de casi el 95%.[89]
Distribución[editar]
En circulación, 97.0 a 99.5% de testosterona se une a proteínas plasmáticas, con 0.5 a 3.0% sin unir.[90] Está estrechamente ligado a la SHBG y débilmente a la albúmina.[90] De la testosterona circulante, 30 a 44% está unido a SHBG, mientras que 54 a 68% está unido a albúmina.[90] La testosterona que no está unida se conoce como testosterona libre y la testosterona que está unida a la albúmina se conoce como testosterona biodisponible.[90] A diferencia de la testosterona que está unida a la SHBG, la testosterona biodisponible está unida a las proteínas plasmáticas lo suficientemente débil como para que, al igual que la testosterona libre, pueda ser biológicamente activa, al menos en cierta medida.[90] Cuando se hace referencia colectivamente (es decir, libre, biodisponible y unido a SHBG), la testosterona circulante se conoce como testosterona total.[90]
Metabolismo[editar]
Metabolismo de la testosterona en humanos |
La testosterona se metaboliza principalmente en el hígado mayormente (90%) mediante reducción a través de la 5α- y 5β-reductasa y conjugación mediante la glucuronidación y la sulfatación.[90][73][91] Los principales metabolitos urinarios de la testosterona son la glucuronida de androsterona y la glucuronida de etiocolanolona.[90][73][91][92]
La vida media de eliminación de la testosterona varía dependiendo de la vía de administración y formulación y de si está esterificada o no.[27] El undecanoato de testosterona oral (en cápsulas de aceite) tiene una vida media terminal de 1,6 horas.[79] Debido a su vida media terminal muy corta, el undecanoato de testosterona oral se toma de dos a cuatro veces por día.[79] A diferencia de la testosterona oral, otras formas de testosterona que incluyen geles y soluciones tópicas, parches transdérmicos y tabletas bucales tienen un efecto de liberación prolongada y se pueden administrar con menos frecuencia, a intervalos, según la ruta/formulación, de una vez al día, dos veces al día, o una vez cada dos días.[27][79]
Mientras que la vida media terminal de la testosterona no esterificada administrada por inyección intramuscular es muy corta de solo unos 10 minutos, la vida media terminal de los ésteres de testosterona intramuscular es mucho más larga.[27][79] Administradas en forma de soluciones de aceite, las vidas medias terminales son 0,8 días para el propionato de testosterona, 4,5 días para el enantato de testosterona, 20,9 días (en aceite de semilla de té) y 33,9 días (en aceite de hojalata) para el undecanoato de testosterona, y 29,5 días para Buciclato de testosterona.[27][79] Aunque no se dispone de valores exactos para el cipionato de testosterona intramuscular, se dice que su farmacocinética es la misma que la del enantato de testosterona, con patrones "extremadamente comparables" de liberación de testosterona.[29][79] Debido a su vida media terminal variable y diferente, los diferentes ésteres de testosterona intramuscular se administran con diferentes frecuencias.[93] El propionato de testosterona se inyecta dos o tres veces por semana, el enantato de testosterona y el cipionato de testosterona se inyectan una vez cada dos a cuatro semanas, y el undecanoato de testosterona y el buciclato de testosterona se inyectan una vez cada 10 a 14 semanas.[93] Debido a su duración relativamente corta, el propionato de testosterona ahora se usa relativamente poco y el undecanoato de testosterona es el éster de testosterona preferido para uso intramuscular.[27][79] El undecanoato de testosterona y el buciclato de testosterona se pueden inyectar por vía intramuscular de forma tan espaciada en el tiempo como cuatro veces al año.[27][79]
La semivida de absorción de los implantes de testosterona subdérmica es de 2,5 meses.[27] El intervalo de reemplazo es una vez cada cuatro o cinco meses.[94]
Eliminación[editar]
La testosterona y sus metabolitos se eliminan en la orina.[95] Se excreta principalmente como glucurónido de androsterona y glucurónido de etiocolanolona.[92] También se excreta en pequeña medida como otros conjugados como la glucosterona testosterona (1%), sulfato de testosterona (0,03%) y glucurónidos androstanodiol.[92][96] Solo una cantidad muy pequeña de testosterona (menos del 0,01%) se encuentra sin cambios en la orina.[95][96]
Química[editar]
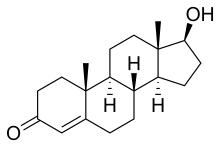
La testosterona es un esteroide de androstano de origen natural y también es conocida por el nombre químico androst-4-en-17β-ol-3-one.[97] Tiene un doble enlace entre las posiciones C4 y C5 (por lo que es un androsteno), un grupo cetona en la posición C3 y un grupo hidroxilo (alcohol) en la posición C17β.[97]
Derivados[editar]
Los ésteres de testosterona están sustituidos en la posición C17β con un resto de éster de ácido graso lipófilo de longitud de cadena variable.[98] Los principales ésteres de testosterona incluyen el cipionato de testosterona, el enantato de testosterona, el propionato de testosterona y el undecanoato de testosterona.[74][97][99] También se ha comercializado un profármaco éter C17β de testosterona, acetato de cloxotestosterona, aunque es poco conocido y se usa muy raramente o puede que incluso ya no lo sea.[97] Otro profármaco éter C17β de la testosterona, la silandrona, también existe pero nunca se comercializó, y es notable por su actividad oral.[97] Además de los profármacos éster y éter, también existen prohormonas androgénicas o precursores de testosterona, como la dehidroepiandrosterona (DHEA), androstenediol y androstenediona, y se convierten en testosterona en cantidades variables en la ingesta oral.[100] Sin embargo, a diferencia de los profármacos de éster y éter de testosterona, estas prohormonas son solo débilmente androgénicas/anabólicas.[100]
Todos los AAS sintéticos son derivados de la testosterona.[100] Los ejemplos destacados incluyen nandrolona (19-nortestosterona), metandienona (17α-metil-δ 1- testosterona) y estanozolol (un derivado 17α-alquilado de DHT). A diferencia de la testosterona, los AAS que son 17α-alquilados, como la metandienona y el estanozolol, son activos por vía oral. Esto se debe al impedimento estérico del metabolismo de la posición C17β durante el primer paso a través del hígado. En contraste, la mayoría de los AAS que no están alquilados con 17α, como la nandrolona, no son activos por vía oral y, en cambio, deben administrarse mediante inyección intramuscular. Esto es casi siempre en forma de éster; por ejemplo, en el caso de la nandrolona, como decanoato de nandrolona o fenilpropionato de nandrolona .
| Andrógino | Estructura | Ester | <abbr title="<nowiki>Relative molecular weight</nowiki>">Rel. <abbr title="<nowiki>Relative molecular weight</nowiki>">MW segundo | <abbr title="<nowiki>Relative testosterone content</nowiki>">Rel. <abbr title="<nowiki>Relative testosterone content</nowiki>">T do | Duración d | ||||
|---|---|---|---|---|---|---|---|---|---|
| Posición | Mitad | Tipo | Longitud a | Rango | Grupo | ||||
| Testosterona | - | - | - | - | 1.00 | 1.00 | 6 | Corto | |
| Propionato de testosterona | C17β | Ácido propanoico | Ácido graso de cadena recta | 3 | 1.19 | 0.84 | 5 | Corto | |
| Cipionato de testosterona | C17β | Ácido ciclopentilpropanoico | Ácido graso aromático | - (~ 6) | 1.43 | 0.70 | 4 | Moderado | |
| Enantato de testosterona | C17β | Ácido heptanoico | Ácido graso de cadena recta | 7 | 1,39 | 0.72 | 3 | Moderado | |
| Undecanoato de testosterona | C17β | Ácido undecanoico | Ácido graso de cadena recta | 11 | 1.58 | 0.63 | 2 | Largo | |
| Testosterona Buciclato E | C17β | Ácido bucíclico f | Ácido carboxílico aromático | - (~ 9) | 1.58 | 0.63 | 1 | Largo | |
| Notas al pie: a = Longitud del éster en los átomos de carbono para los ácidos grasos de cadena lineal o longitud aproximada del éster en los átomos de carbono para los ácidos grasos aromáticos . b = Peso molecular relativo. c = contenido relativo de testosterona en peso (es decir, potencia androgénica relativa). d = Duración por inyección intramuscular o subcutánea . e = Nunca comercializado. f = Ácido bucíclico = ácido trans -butilciclohexano-1-carboxílico. Fuentes: ver artículos individuales. | |||||||||
Historia[editar]
La testosterona se aisló y sintetizó por primera vez en 1935.[101] Poco después, en 1937, la testosterona llegó a estar disponible comercialmente como un fármaco en forma de gránulos y luego en forma de éster para la inyección intramuscular como el propionato de testosterona de acción relativamente corta.[29][27][102] La metiltestosterona, uno de los primeros AAS sintéticos y andrógenos activos por vía oral, se introdujo en 1935, pero se asoció con hepatotoxicidad y eventualmente se volvió en gran parte médicamente obsoleta.[102] A mediados de la década de 1950, se introdujeron los ésteres de testosterona de acción más prolongada, el enantato de testosterona y el cypionato de testosterona.[102] En gran parte reemplazaron al propionato de testosterona y se convirtieron en los principales ésteres de testosterona utilizados médicamente durante más de medio siglo.[102] En la década de 1970, se introdujo el undecanoato de testosterona para uso oral en Europa,[102] aunque el undecanoato de testosterona intramuscular ya había estado en uso en China durante varios años.[103] El undecanoato de testosterona intramuscular no se introdujo en Europa y los Estados Unidos hasta mucho más tarde (a principios de la década de 2000 y 2014, respectivamente).[90][104]
Sociedad y cultura[editar]
Uso[editar]
En los EE. UU. en la década de 2000, las empresas y las figuras de los medios populares han promocionado en gran medida las nociones de "andropausia" como algo paralelo a la menopausia; Estas nociones han sido rechazadas por la comunidad médica.[105][106] Además, la publicidad de las compañías farmacéuticas que venden testosterona y la hormona de crecimiento humana, así como las compañías de suplementos dietéticos que venden todo tipo de "refuerzos" para hombres de edad avanzada, han enfatizado la "necesidad" de los hombres de mediana edad o de edad avanzada de la testosterona.[107] Existe una condición médica llamada hipogonadismo de inicio tardío; según Thomas Perls y David J. Handelsman, que escribe en un editorial de 2015 en el Diario de la Sociedad Americana de Geriatría, parece que esta condición se diagnostica en exceso y es tratada en exceso.[107] Perls y Handelsman señalan que en los EE. UU., "las ventas de testosterona aumentaron de US$324 millones en 2002 a US$2 mil millones en 2012, y la cantidad de dosis de testosterona prescritas aumentó de 100 millones en 2007 a 500 millones en 2012, sin incluir las contribuciones adicionales de farmacias magistrales, Internet y ventas directas a pacientes".[107]
Nombres genéricos[editar]
Testosterone es el nombre genérico de testosterona en inglés e italiano y el INN, USAN, USP, BAN y DCIT de la droga, mientras que testostérone es su nombre francés y el DCF.[97][108][109] También se le conoce en latín como testosteronum, en español y portugués como testosterona, y en alemán, holandés y ruso, y otras lenguas eslavas como testosterona.[108][109] La escritura cirílica de la testosterona es тестостерон.[110]
Nombres comerciales[editar]

La testosterona se comercializa con un gran número de marcas en todo el mundo.[108] Las principales marcas de testosterona y/o sus ésteres incluyen Andriol, Androderm, AndroGel, Axiron, Delatestryl, Depo-Testosterone, Intrinsa, Nebido, Omnadren, Primoteston, Sustanon, Testim, TestoGel, TestoPatch, Testoviron y Tostran.[74][76][108]
Disponibilidad[editar]
Estados Unidos[editar]
Para noviembre de 2016, la testosterona no modificada (no esterificada) está disponible en los Estados Unidos en las siguientes formulaciones:[111]
- Geles tópicos: AndroGel, Fortesta, Testim, Testosterone (genérico)
- Soluciones tópicas: Axiron, testosterone (genérico).
- Parches transdérmicos: Androderm, Testoderm (descontinuado), Testoderm TTS (descontinuado), Testosterone (genérico)
- Geles Intranasales: Natesto
- Pastillas bucales: Striant
- Implantes de pellets: Testopel
Y los siguientes profármacos éster de testosterona están disponibles en los Estados Unidos en soluciones de aceite para inyección intramuscular:[111]
- Cipionato de testosterona: Depo-testosterone, cipionato de testosterona (genérico)
- Enantato de testosterona: Delatestryl, enantato de testosterona (genérico)
- Propionato de testosterona: Propionato de testosterona (genérico)
- Undecanoato de testosterona: Aveed
La testosterona no modificada también estaba disponible anteriormente para la inyección intramuscular, pero se descontinuó.[111]
El cipionato de testosterona y el enantato de testosterona estaban disponibles en combinación con el cipionato de estradiol y el valerato de estradiol, respectivamente, bajo las marcas comerciales Depo-Testadiol y Ditate-DS, respectivamente, como soluciones de aceite para inyección intramuscular, pero estas formulaciones se han descontinuado.[111]
A diferencia de Europa, Canadá y gran parte del resto del mundo, el undecanoato de testosterona oral no está disponible en los Estados Unidos.[111][112][113]
Canadá[editar]
Para noviembre de 2016, la testosterona está disponible en Canadá en forma de geles tópicos (AndroGel, Testim), soluciones tópicas (Axiron), parches transdérmicos (Androderm) y geles intranasales (Natesto).[114] Cipionato de testosterona (Depo-testosterona, Cypionate de testosterona (genérico)), enantato de testosterona (Delatestryl, PMS-Testosterone Enanthate), y propionato de testosterona (propionato de testosterona (genérico)) están disponibles como soluciones de aceite para inyección intramuscular y testosterona undecanoato -Testosterona, Taro-Testosterona) está disponible en forma de cápsulas orales.[114] Las tabletas bucales de testosterona y los implantes de pellets no parecen estar disponibles en Canadá.[114]
Otros países[editar]
La testosterona y/o sus ésteres están ampliamente disponibles en diversos países del mundo en una variedad de formulaciones.[108]
Estado legal[editar]
La testosterona y sus ésteres, junto con otros AAS, son sustancias controladas solo con receta en muchos países del mundo. En los Estados Unidos, son medicamentos de la Lista III de la Ley de sustancias controladas, en Canadá, son medicamentos de la Lista IV de la Ley de sustancias y medicamentos controlados, y en el Reino Unido, son medicamentos de Clase C de la Ley de uso indebido de drogas.[115][116]
Litigio[editar]
Para el año 2014, se están llevando a cabo una serie de demandas contra fabricantes de testosterona, que alegan una tasa significativamente mayor de apoplejía y ataque cardíaco en hombres de edad avanzada que usan suplementos de testosterona.[117]
Dopaje en los deportes[editar]
Hay muchos casos conocidos de dopaje en los deportes con testosterona y sus ésteres por atletas profesionales.
Investigación[editar]
Depresión[editar]
La testosterona se ha usado para tratar la depresión en hombres de mediana edad con niveles bajos de testosterona. Sin embargo, una revisión de 2014 no mostró beneficios en el estado de ánimo de los hombres con niveles normales de testosterona o en el estado de ánimo de los hombres mayores con niveles bajos de testosterona.[118] A la inversa, una revisión de 2009 encontró que la testosterona tenía un efecto antidepresivo en hombres con depresión, especialmente en aquellos con hipogonadismo, VIH/SIDA y en ancianos.[119]
Insuficiencia cardiaca[editar]
El reemplazo de testosterona puede mejorar significativamente la capacidad de ejercicio, la fuerza muscular y reducir los intervalos QT en hombres con insuficiencia cardíaca crónica (ICC). Durante el curso de 3 a 6 meses de los estudios revisados, la terapia con testosterona pareció ser segura y generalmente efectiva, y (descartando el cáncer de próstata) los autores no encontraron ninguna justificación para restringir absolutamente su uso en hombres con ICC.[120] Una revisión similar de 2012 también encontró una mayor capacidad de ejercicio y razonó los beneficios que pueden generar las mujeres.[121] Sin embargo, ambas revisiones abogan por ensayos controlados aleatorios más grandes, a más largo plazo.[120][121]
Anticoncepción masculina[editar]
La testosterona, como ésteres como el undecanoato de testosterona o el buciclato de testosterona, ha sido estudiada y promovida como un anticonceptivo masculino análogo a los anticonceptivos a base de estrógeno en las mujeres. De lo contrario, considerado un efecto adverso de la testosterona, la espermatogénesis reducida se puede suprimir aún más con la adición de una progestina como el enantato de noretisterona o butanoato de levonorgestrel, mejorando el efecto anticonceptivo.[122][123]
Anorgasmia[editar]
La testosterona está en desarrollo en una formulación intranasal de baja dosis para el tratamiento de la anorgasmia en mujeres.[124]
Pérdida del cabello del cuero cabelludo[editar]
Un estudio encontró que de 76 mujeres pre y posmenopáusicas con adelgazamiento del cabello, 63% experimentaron un nuevo crecimiento del cabello cuando se trataron con implantes de testosterona subcutánea que dieron como resultado niveles promedio de testosterona de más de 300 ng/dL para 12 meses.[125] Ninguna mujer informó pérdida de cabello o adelgazamiento durante el tratamiento con testosterona.[125]
Misceláneos[editar]
La terapia con testosterona puede mejorar el manejo de la diabetes tipo 2.[126] La testosterona baja se ha asociado con el desarrollo de la enfermedad de Alzheimer.[127][128]
Se han usado y estudiado andrógenos tópicos como la testosterona en el tratamiento de la celulitis en mujeres.[129]
Referencias[editar]
- ↑ a b c d e f g h i j k «Testosterone». Drugs.com. American Society of Health-System Pharmacists. 4 de diciembre de 2015. Archivado desde el original el 20 de agosto de 2016. Consultado el 3 de septiembre de 2016.
- ↑ a b c d e Staff (3 de marzo de 2015). «Testosterone Products: Drug Safety Communication – FDA Cautions About Using Testosterone Products for Low Testosterone Due to Aging; Requires Labeling Change to Inform of Possible Increased Risk of Heart Attack And Stroke». FDA. Archivado desde el original el 5 de marzo de 2015. Consultado el 5 de marzo de 2015.
- ↑ Taylor, William N (2002). Anabolic Steroids and the Athlete (2 edición). McFarland. p. 180. ISBN 978-0-7864-1128-3.
- ↑ Fischer, Jnos; Ganellin, C. Robin (2006). Analogue-based Drug Discovery (en inglés). John Wiley & Sons. p. 481. ISBN 9783527607495.
- ↑ «Testosterone therapy in the new era of Food and Drug Administration oversight». Translational Andrology and Urology 5 (2): 207-12. April 2016. PMC 4837303. PMID 27141448. doi:10.21037/tau.2016.03.13.
- ↑ «WHO Model List of Essential Medicines (19th List)». World Health Organization. April 2015. Archivado desde el original el 13 de diciembre de 2016. Consultado el 8 de diciembre de 2016.
- ↑ Hamilton, Richart (2015). Tarascon Pocket Pharmacopoeia 2015 Deluxe Lab-Coat Edition. Jones & Bartlett Learning. p. 197. ISBN 978-1-284-05756-0.
- ↑ «The Top 300 of 2019». clincalc.com. Consultado el 22 de diciembre de 2018.
- ↑ Winn, Katherine L. Margo|Robert (May 2006). «Testosterone Treatments: Why, When, and How? - American Family Physician». American Family Physician 73 (9): 1591-1598. Archivado desde el original el 3 de octubre de 2016. Consultado el 3 de octubre de 2016.
- ↑ «Androgen replacement therapy in the aging male». Reviews in Urology 5 (4): 216-26. 2003. PMC 1508369. PMID 16985841.
- ↑ «The male menopause: does it exist?: for: some men need investigation and testosterone treatment». The Western Journal of Medicine 173 (2): 76-8. Aug 2000. PMC 1070997. PMID 10924412. doi:10.1136/ewjm.173.2.76.
- ↑ a b Liverman, Catharyn T.; Blazer, Dan G.; ((Institute of Medicine (US) Committee on Assessing the Need for Clinical Trials of Testosterone Replacement Therapy)) (1 de enero de 2004). «Introduction». Testosterone and Aging: Clinical Research Directions. National Academies Press (US). ISBN 978-0-309-09063-6. doi:10.17226/10852.
- ↑ «In men older than 70 years, total testosterone remains stable while free testosterone declines with age. The Health in Men Study». European Journal of Endocrinology / European Federation of Endocrine Societies 156 (5): 585-94. May 2007. PMID 17468195. doi:10.1530/EJE-06-0714.
- ↑ «Gender dysphoria – Treatment». NHS Gov.uk. 21 de mayo de 2012. Archivado desde el original el 2 de noviembre de 2013. Consultado el 31 de octubre de 2013.
- ↑ Gorton, R. Nick. «Medical Therapy and Health Maintenance for Transgender Men: A Guide For Health Care Providers». Lyon-Martin Women's Health Services. Archivado desde el original el 30 de noviembre de 2016. Consultado el 11 de diciembre de 2016.
- ↑ a b c d «Androgen therapy in women: a reappraisal: an Endocrine Society clinical practice guideline». The Journal of Clinical Endocrinology and Metabolism 99 (10): 3489-510. Oct 2014. PMID 25279570. doi:10.1210/jc.2014-2260.
- ↑ a b c d e f g h i «Clinical review: The benefits and harms of systemic testosterone therapy in postmenopausal women with normal adrenal function: a systematic review and meta-analysis». J. Clin. Endocrinol. Metab. 99 (10): 3543-50. 2014. PMC 5393495. PMID 25279572. doi:10.1210/jc.2014-2262.
- ↑ a b «Efficacy and safety of transdermal testosterone in postmenopausal women with hypoactive sexual desire disorder: a systematic review and meta-analysis». Fertil. Steril. 107 (2): 475-482.e15. 2017. PMID 27916205. doi:10.1016/j.fertnstert.2016.10.028.
- ↑ a b c d e f g «Increasing women's sexual desire: The comparative effectiveness of estrogens and androgens». Horm Behav 78: 178-93. February 2016. PMC 4720522. PMID 26589379. doi:10.1016/j.yhbeh.2015.11.003.
- ↑ a b c d e f «Has testosterone passed the test in premenopausal women with low libido? A systematic review». Int J Women's Health 8: 599-607. 2016. PMC 5066846. PMID 27785108. doi:10.2147/IJWH.S116212.
- ↑ «Role of Estrogens and Estrogen-Like Compounds in Female Sexual Function and Dysfunction». J Sex Med 13 (3): 305-16. March 2016. PMID 26944462. doi:10.1016/j.jsxm.2015.11.015.
- ↑ «Sexual medicine: Transdermal oestrogen is effective». Nat Rev Urol 14 (11): 638. November 2017. PMID 28895561. doi:10.1038/nrurol.2017.152.
- ↑ a b c Lubna Pal; Raja A. Sayegh (21 de enero de 2017). Essentials of Menopause Management: A Case-Based Approach. Springer. pp. 180-. ISBN 978-3-319-42451-4.
- ↑ Rogerio A. Lobo; Jennifer Kelsey; Robert Marcus (22 de mayo de 2000). Menopause: Biology and Pathobiology. Academic Press. pp. 454-. ISBN 978-0-08-053620-0.
- ↑ Carrie Bagatell; William J. Bremner (27 de mayo de 2003). Androgens in Health and Disease. Springer Science & Business Media. pp. 374-. ISBN 978-1-59259-388-0.
- ↑ «Custom-compounded bioidentical hormone therapy: why so popular despite potential harm? The case against routine use». Climacteric 20 (3): 205-211. June 2017. PMID 28509626. doi:10.1080/13697137.2017.1285277.
- ↑ a b c d e f g h i j k l m Nieschlag, Eberhart; Behre, Hermann M. (6 de diciembre de 2012). Testosterone: Action - Deficiency - Substitution. Springer Science & Business Media. pp. 1-,9,298,309-331,349-353,366-367. ISBN 978-3-642-72185-4.
- ↑ a b c Shlomo Melmed (1 de enero de 2016). Williams Textbook of Endocrinology. Elsevier Health Sciences. pp. 760-769. ISBN 978-0-323-29738-7.
- ↑ a b c d e f g h William Llewellyn (2011). Anabolics. Molecular Nutrition Llc. pp. 385-394, 413, 426, 607, 666. ISBN 978-0-9828280-1-4.
- ↑ a b «S1. Anabolic Agents | List of Prohibited Substances and Methods». English. Archivado desde el original el 27 de mayo de 2016. Consultado el 6 de junio de 2016.
- ↑ «Anabolic Steroid Control Act». United States Sentencing Commission. 1990. Archivado desde el original el 30 de agosto de 2016. Consultado el 11 de noviembre de 2016.
- ↑ Karkazis, Katrina (11 de abril de 2014). «The Trouble With Too Much T». Consultado el 12 de abril de 2014.
- ↑ Fagan, Kate (13 de agosto de 2016). «Katie Ledecky is crushing records, so why are we still worried about Caster Semenya?». ESPN. Archivado desde el original el 18 de agosto de 2016. Consultado el 27 de agosto de 2016.
- ↑ Padawer, Ruth (28 de junio de 2016). «The Humiliating Practice of Sex-Testing Female Athletes». ISSN 0362-4331. Consultado el 27 de agosto de 2016.
- ↑ «Detection of testosterone administration based on the carbon isotope ratio profiling of endogenous steroids: international reference populations of professional soccer players». British Journal of Sports Medicine 43 (13): 1041-44. Dec 2009. PMC 2784500. PMID 19549614. doi:10.1136/bjsm.2009.058669.
- ↑ «Subject-based profiling for the detection of testosterone administration in sport». Drug Testing and Analysis 1 (1): 22-4. Jan 2009. PMID 20355155. doi:10.1002/dta.14.
- ↑ «Quantification of testosterone undecanoate in human hair by liquid chromatography-tandem mass spectrometry». Biomedical Chromatography 23 (8): 873-80. Aug 2009. PMID 19353724. doi:10.1002/bmc.1199.
- ↑ Disposition of Toxic Drugs & Chemicals in Man (8th edición). Foster City, Calif: Biomedical Publications. 2008. pp. 1501-04. ISBN 978-0-9626523-7-0.
- ↑ a b c Kavoussi, Parviz; Costabile, Raymond A.; Salonia, Andrea (19 de octubre de 2012). Clinical Urologic Endocrinology: Principles for Men's Health. Springer Science & Business Media. pp. 65-. ISBN 978-1-4471-4405-2.
- ↑ Michael Clinton Perry (2008). The Chemotherapy Source Book. Lippincott Williams & Wilkins. pp. 368-. ISBN 978-0-7817-7328-7.
- ↑ «Adverse effects of testosterone replacement therapy: an update on the evidence and controversy». Therapeutic Advances in Drug Safety 5 (5): 190-200. October 2014. PMC 4212439. PMID 25360240. doi:10.1177/2042098614548680.
- ↑ «Contraceptive efficacy of testosterone-induced azoospermia in normal men. World Health Organization Task Force on methods for the regulation of male fertility». Lancet 336 (8721): 955-9. October 1990. PMID 1977002. doi:10.1016/0140-6736(90)92416-F.
- ↑ «Treatment of testosterone-induced gynecomastia with the aromatase inhibitor, anastrozole». International Journal of Impotence Research 16 (1): 95-7. February 2004. PMID 14963480. doi:10.1038/sj.ijir.3901154.
- ↑ Yates, William R. (2000). «Testosterone in Psychiatry». Archives of General Psychiatry 57 (2): 155. ISSN 0003-990X. doi:10.1001/archpsyc.57.2.155.
- ↑ «The effect of testosterone levels on mood in men: a review». Psychosomatics 54 (6): 509-14. 2013. PMID 24016385. doi:10.1016/j.psym.2013.06.018.
- ↑ «Hormonal replacement and sexuality in men». Clin Endocrinol Metab 11 (3): 599-623. 1982. PMID 6814798. doi:10.1016/s0300-595x(82)80003-0.
- ↑ Bagatell, Carrie; Bremner, William J. (27 de mayo de 2003). Androgens in Health and Disease. Springer Science & Business Media. pp. 144, 259-261, 351. ISBN 978-1-59259-388-0.
- ↑ a b «Testosterone replacement therapy in patients with prostate cancer after radical prostatectomy». The Journal of Urology 190 (2): 639-44. Aug 2013. PMC 4544840. PMID 23395803. doi:10.1016/j.juro.2013.02.002.
- ↑ «Testosterone and Other Anabolic Androgenic Steroids (AAS): FDA Statement - Risks Associated With Abuse and Dependence». FDA. 25 de octubre de 2016. Archivado desde el original el 27 de octubre de 2016. Consultado el 26 de octubre de 2016.
- ↑ «Increased risk of non-fatal myocardial infarction following testosterone therapy prescription in men». PLoS ONE 9 (1): e85805. January 2014. Bibcode:2014PLoSO...985805F. PMC 3905977. PMID 24489673. doi:10.1371/journal.pone.0085805. Archivado desde el original el 4 de marzo de 2016.
- ↑ a b «Association of testosterone therapy with mortality, myocardial infarction, and stroke in men with low testosterone levels». JAMA 310 (17): 1829-36. Nov 2013. PMID 24193080. doi:10.1001/jama.2013.280386.
- ↑ «Adverse events associated with testosterone administration». The New England Journal of Medicine 363 (2): 109-22. 8 de julio de 2010. PMC 3440621. PMID 20592293. doi:10.1056/NEJMoa1000485.
- ↑ Staff (31 de enero de 2014). «FDA evaluating risk of stroke, heart attack and death with FDA-approved testosterone products» (PDF). U.S. Food and Drug Administration. Archivado desde el original el 19 de febrero de 2014. Consultado el 17 de septiembre de 2014.
- ↑ Tavernise, Sabrina (17 de septiembre de 2014). «F.D.A. Panel Backs Limits on Testosterone Drugs». Consultado el 18 de septiembre de 2014.
- ↑ Staff (5 de septiembre de 2014). «FDA Panel To Review Testosterone Therapy Appropriateness and Safety». Archivado desde el original el 4 de marzo de 2016. Consultado el 14 de septiembre de 2014.
- ↑ Staff (17 de septiembre de 2014). «Joint Meeting for Bone, Reproductive and Urologic Drugs Advisory Committee (BRUDAC) and the Drug Safety And Risk Management Advisory Committee (DSARM AC) – FDA background documents for the discussion of two major issues in testosterone replacement therapy (TRT): 1. The appropriate indicated population for TRT, and 2. The potential for adverse cardiovascular outcomes associated with use of TRT» (PDF). Food and Drug Administration. Archivado desde el original el 6 de septiembre de 2014. Consultado el 14 de septiembre de 2014.
- ↑ Staff (19 de junio de 2014). «FDA adding general warning to testosterone products about potential for venous blood clots». FDA. Archivado desde el original el 6 de octubre de 2014. Consultado el 9 de octubre de 2014.
- ↑ «Testosterone and cardiovascular risk in men: a systematic review and meta-analysis of randomized placebo-controlled trials». Mayo Clinic Proceedings 82 (1): 29-39. Jan 2007. PMID 17285783. doi:10.4065/82.1.29.
- ↑ «Clinical review 1: Adverse effects of testosterone therapy in adult men: a systematic review and meta-analysis». The Journal of Clinical Endocrinology and Metabolism 95 (6): 2560-75. Jun 2010. PMID 20525906. doi:10.1210/jc.2009-2575.
- ↑ «Testosterone Products: Drug Safety Communication – FDA Investigating Risk of Cardiovascular Events». FDA. 31 de enero de 2014. Archivado desde el original el 14 de febrero de 2014. Consultado el 3 de febrero de 2014.
- ↑ «Testosterone therapy and prostate carcinoma». Current Urology Reports 10 (6): 453-59. Nov 2009. PMID 19863857. doi:10.1007/s11934-009-0072-1.
- ↑ «Prostate cancer in men using testosterone supplementation». The Journal of Urology 174 (2): 534-38; discussion 538. Aug 2005. PMID 16006887. doi:10.1097/01.ju.0000165166.36280.60.
- ↑ a b «Population differences in the testosterone levels of young men are associated with prostate cancer disparities in older men». American Journal of Human Biology 22 (4): 449-55. 2010. PMID 20087895. doi:10.1002/ajhb.21016.
- ↑ «Human prostate cancer risk factors». Cancer 101 (10 Suppl): 2371-490. Nov 2004. PMID 15495199. doi:10.1002/cncr.20408. Resumen divulgativo – Mercer University School of Medicine.
- ↑ «Testosterone Pregnancy and Breastfeeding Warnings». Archivado desde el original el 1 de febrero de 2014. Consultado el 1 de febrero de 2014.
- ↑ a b c Jameson, J. Larry; de Kretser, David M.; Marshall, John C.; De Groot, Leslie J. (7 de mayo de 2013). Endocrinology Adult and Pediatric: Reproductive Endocrinology. Elsevier Health Sciences. pp. 1-. ISBN 978-0-323-22152-8.
- ↑ a b Blume-Peytavi, Ulrik; Whiting, David A.; Trüeb, Ralph M. (26 de junio de 2008). Hair Growth and Disorders. Springer Science & Business Media. pp. 182-. ISBN 978-3-540-46911-7.
- ↑ a b Bagatelle, Carrie; Bremner, William J. (27 de mayo de 2003). Androgens in Health and Disease. Springer Science & Business Media. pp. 78-. ISBN 978-1-59259-388-0.
- ↑ Laurence S. Baskin (6 de diciembre de 2012). Hypospadias and Genital Development. Springer Science & Business Media. pp. 37-. ISBN 978-1-4419-8995-6.
- ↑ Neurosteroids. Frontiers E-books. pp. 357-358. ISBN 978-2-88919-078-2.
- ↑ Simpson ER (September 2003). «Sources of estrogen and their importance». J. Steroid Biochem. Mol. Biol. 86 (3–5): 225-30. PMID 14623515. doi:10.1016/S0960-0760(03)00360-1.
- ↑ Nieschlag, volume editor, Eberhard Nieschlag, Hermann M. Behre, Susan; Behre, Hermann M.; Nieschlag, Susan (2009). Andrology : male reproductive health and dysfunction (3rd edición). Berlin: Springer. p. 459. ISBN 978-3-540-78354-1.
- ↑ a b c Wecker, Lynn; Watts, Stephanie; Faingold, Carl; Dunaway, George; Crespo, Lynn (1 de abril de 2009). Brody's Human Pharmacology. Elsevier Health Sciences. pp. 468-469. ISBN 978-0-323-07575-6.
- ↑ a b c d e f g h i j k l Becker, Kenneth L. (2001). Principles and Practice of Endocrinology and Metabolism. Lippincott Williams & Wilkins. pp. 1116, 1119, 1152, 1182-1185, 1195-1197, 2146. ISBN 978-0-7817-1750-2.
- ↑ Wein, Alan J.; Kavoussi, Louis R.; Partin, Alan W.; Peters, Craig A. (23 de octubre de 2015). Campbell-Walsh Urology. Elsevier Health Sciences. pp. 7207-. ISBN 978-0-323-26374-0.
- ↑ a b «Pharmacology of anabolic steroids». British Journal of Pharmacology 154 (3): 502-21. June 2008. PMC 2439524. PMID 18500378. doi:10.1038/bjp.2008.165.
- ↑ a b Burtis, Carl A.; Ashwood, Edward R.; Bruns, David E. (14 de octubre de 2012). Tietz Textbook of Clinical Chemistry and Molecular Diagnostics. Elsevier Health Sciences. pp. 1947-. ISBN 978-1-4557-5942-2.
- ↑ a b Dissociating behavioral, autonomic, and neuroendocrine effects of androgen steroids in animal models 829. 2012. pp. 397-431. ISBN 978-1-61779-457-5. doi:10.1007/978-1-61779-458-2_26.
- ↑ a b c d e f g h i j k Nieschlag, Eberhart; Behre, Hermann M.; Nieschlag, Susan (13 de enero de 2010). Andrology: Male Reproductive Health and Dysfunction. Springer Science & Business Media. pp. 49-54,441-446. ISBN 978-3-540-78355-8.
- ↑ Jerome F. Strauss; Robert L. Barbieri; Antonio R. Gargiulo (23 de diciembre de 2017). Yen & Jaffe's Reproductive Endocrinology E-Book: Physiology, Pathophysiology, and Clinical Management. Elsevier Health Sciences. pp. 292-. ISBN 978-0-323-58232-2.
- ↑ Smith, Eric Wane; Maibach, Howard I. (2 de noviembre de 2005). Percutaneous Penetration Enhancers, Second Edition. CRC Press. pp. 413-. ISBN 978-1-4200-3920-7.
- ↑ Bandeira, Francisco; Gharib, Hossein; Golbert, Airton; Griz, Luiz; Faria, Manuel (26 de octubre de 2013). Endocrinology and Diabetes: A Problem-Oriented Approach. Springer Science & Business Media. pp. 88-. ISBN 978-1-4614-8684-8.
- ↑ a b Lemke, Thomas L.; Williams, David A. (24 de enero de 2012). Foye's Principles of Medicinal Chemistry. Lippincott Williams & Wilkins. pp. 1360-. ISBN 978-1-60913-345-0.
- ↑ a b «Emerging medication for the treatment of male hypogonadism». Expert Opin Emerg Drugs 17 (2): 239-59. 2012. PMID 22612692. doi:10.1517/14728214.2012.683411.
- ↑ Karch, Steven B (21 de diciembre de 2006). Drug Abuse Handbook, Second Edition. CRC Press. pp. 700-. ISBN 978-1-4200-0346-8.
- ↑ Touitou, Elka; Barry, Brian W. (27 de noviembre de 2006). Enhancement in Drug Delivery. CRC Press. pp. 122-. ISBN 978-1-4200-0481-6.
- ↑ Jones, Hugh (25 de septiembre de 2008). Testosterone Deficiency in Men. OUP Oxford. pp. 89-. ISBN 978-0-19-954513-1.
- ↑ Bhasin, Shalender (13 de febrero de 1996). Pharmacology, Biology, and Clinical Applications of Androgens: Current Status and Future Prospects. John Wiley & Sons. pp. 462-. ISBN 978-0-471-13320-9.
- ↑ Conceptual Pharmacology. Universities Press. 2010. pp. 8-. ISBN 978-81-7371-679-9.
- ↑ a b c d e f g h i Melmed, Shlomo; Polonsky, Kenneth S.; Larsen, P. Reed; Kronenberg, Henry M. (11 de noviembre de 2015). Williams Textbook of Endocrinology. Elsevier Health Sciences. pp. 709, 711, 765. ISBN 978-0-323-34157-8.
- ↑ a b Becker, Kenneth L. (2001). Principles and Practice of Endocrinology and Metabolism. Lippincott Williams & Wilkins. pp. 1116, 1119, 1183. ISBN 978-0-7817-1750-2.
- ↑ a b c Thieme, Detlev; Hemmersbach, Peter (18 de diciembre de 2009). Doping in Sports. Springer Science & Business Media. pp. 53-. ISBN 978-3-540-79088-4.
- ↑ a b Yeung, Sai-Ching Jim; Escalante, Carmen P.; Gagel, Robert F. (2009). Medical Care of Cancer Patients. PMPH-USA. pp. 247-. ISBN 978-1-60795-008-0.
- ↑ Kumar, Parvenu; Clark, Michael L (4 de junio de 2012). Kumar and Clark's Clinical Medicine. Elsevier Health Sciences. pp. 976-. ISBN 978-0-7020-5304-7.
- ↑ a b Karch, Steven B.; Drummer, Olaf (26 de diciembre de 2001). Karch's Pathology of Drug Abuse (third edición). CRC Press. pp. 486-. ISBN 978-1-4200-4211-5.
- ↑ a b A. Labhart (6 de diciembre de 2012). Clinical Endocrinology: Theory and Practice. Springer Science & Business Media. pp. 450-. ISBN 978-3-642-96158-8.
- ↑ a b c d e f J. Elks (14 de noviembre de 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. pp. 641-642. ISBN 978-1-4757-2085-3.
- ↑ Jameson, J. Larry; De Groot, Leslie J. (25 de febrero de 2015). Endocrinology: Adult and Pediatric. Elsevier Health Sciences. pp. 2387-. ISBN 978-0-323-32195-2.
- ↑ Chapple, Christopher R.; Steers, William D. (10 de mayo de 2011). Practical Urology: Essential Principles and Practice: Essential Principles and Practice. Springer Science & Business Media. pp. 228-. ISBN 978-1-84882-034-0.
- ↑ a b c Gregory, Haff G.; Travis, Triplett N. (23 de septiembre de 2015). Essentials of Strength Training and Conditioning 4th Edition. Human Kinetics. pp. 229, 233. ISBN 978-1-4925-0162-6.
- ↑ Taylor, William N. (16 de enero de 2002). Anabolic Steroids and the Athlete (2nd edición). McFarland. pp. 180-. ISBN 978-0-7864-1128-3.
- ↑ a b c d e Hoberman, John (21 de febrero de 2005). Testosterone Dreams: Rejuvenation, Aphrodisia, Doping. University of California Press. pp. 134-. ISBN 978-0-520-93978-3.
- ↑ Mundy, Anthony R.; Fitzpatrick, John; Neal, David E.; George, Nicholas J. R. (26 de julio de 2010). The Scientific Basis of Urology. CRC Press. pp. 294-. ISBN 978-1-84184-749-8.
- ↑ «Testosterone Undecanoate—Schering AG». Drugs 5 (6): 368-369. 2004. PMID 15563244. doi:10.2165/00126839-200405060-00012.
- ↑ «Male Menopause». www.nhs.uk. NHS Choices. 8 de abril de 2016. Archivado desde el original el 9 de octubre de 2016. Consultado el 7 de octubre de 2016.
- ↑ Gorski, David (25 de noviembre de 2013). «"Low T": The triumph of marketing over science « Science-Based Medicine». Science-Based Medicine. Archivado desde el original el 11 de septiembre de 2016.
- ↑ a b c «Disease mongering of age-associated declines in testosterone and growth hormone levels». Journal of the American Geriatrics Society 63 (4): 809-11. April 2015. PMID 25809947. doi:10.1111/jgs.13391.
- ↑ a b c d e «Testosterone - International - Drugs.com». Drugs.com. Archivado desde el original el 13 de noviembre de 2016. Consultado el 12 de noviembre de 2016.
- ↑ a b Index Nominum 2000: International Drug Directory. Taylor & Francis. January 2000. ISBN 978-3-88763-075-1.
- ↑ Владимир Мюллер (15 de abril de 2016). Англо-русский словарь. Русско-английский словарь. 250 000 слов. ЛитРес. pp. 643-. ISBN 978-5-457-98308-3.
- ↑ a b c d e «Drugs@FDA: FDA Approved Drug Products». United States Food and Drug Administration. Archivado desde el original el 16 de noviembre de 2016. Consultado el 16 de noviembre de 2016.
- ↑ Morley, John E.; van den Berg, Lucretia (5 de noviembre de 1999). Endocrinology of Aging. Springer Science & Business Media. pp. 141-. ISBN 978-1-59259-715-4.
- ↑ Bagatell, Carrie; Bremner, William J. (27 de mayo de 2003). Androgens in Health and Disease. Springer Science & Business Media. ISBN 978-1-59259-388-0.
- ↑ a b c «Drug Product Database - Health Canada». Health Canada. 18 de marzo de 2010. Archivado desde el original el 19 de noviembre de 2016. Consultado el 13 de noviembre de 2016.
- ↑ Karch, Steven B (21 de diciembre de 2006). Drug Abuse Handbook, Second Edition. CRC Press. pp. 30-. ISBN 978-1-4200-0346-8.
- ↑ Linda Lane Lilley; Julie S. Snyder; Shelly Rainforth Collins (5 de agosto de 2016). Pharmacology for Canadian Health Care Practice. Elsevier Health Sciences. pp. 50-. ISBN 978-1-77172-066-3.
- ↑ Harris, Andrew. «Abbott Labs Sued by Five Men Claiming Androgel Injuries». Bloomberg.com. Bloomberg, L.P. Archivado desde el original el 14 de julio de 2014. Consultado el 16 de junio de 2014.
- ↑ «Impact of exogenous testosterone on mood: a systematic review and meta-analysis of randomized placebo-controlled trials». Annals of Clinical Psychiatry 26 (1): 19-32. Feb 2014. PMID 24501728. Archivado desde el original el 13 de enero de 2020. Consultado el 8 de abril de 2019.
- ↑ «Testosterone and depression: systematic review and meta-analysis». J Psychiatr Pract 15 (4): 289-305. July 2009. PMID 19625884. doi:10.1097/01.pra.0000358315.88931.fc.
- ↑ a b «Will testosterone replacement therapy become a new treatment of chronic heart failure? A review based on 8 clinical trials». Journal of Thoracic Disease 8 (5): E269-77. May 2016. PMC 4842839. PMID 27162680. doi:10.21037/jtd.2016.03.39.
- ↑ a b «Testosterone Supplementation in Heart Failure: A Meta-Analysis». Circulation: Heart Failure 5 (3): 315-21. May 2012. PMID 22511747. doi:10.1161/CIRCHEARTFAILURE.111.965632.
- ↑ «Male Hormonal Contraception: Where Are We Now?». Current Obstetrics and Gynecology Reports 5: 38-47. 2016. PMC 4762912. PMID 26949570. doi:10.1007/s13669-016-0140-8.
- ↑ «The current state of male hormonal contraception». Pharmacology & Therapeutics 163: 109-17. July 2016. PMID 27016468. doi:10.1016/j.pharmthera.2016.03.012.
- ↑ «Testosterone intranasal (low-dose)». Archivado desde el original el 6 de septiembre de 2017. Consultado el 5 de septiembre de 2017.
- ↑ a b «Female pattern hair loss». Int J Endocrinol Metab 11 (4): e9860. 2013. PMC 3968982. PMID 24719635. doi:10.5812/ijem.9860.
- ↑ «The dark side of testosterone deficiency: II. Type 2 diabetes and insulin resistance». Journal of Andrology 30 (1): 23-32. 2009. PMID 18772488. doi:10.2164/jandrol.108.005751.
- ↑ «Androgens, aging, and Alzheimer's disease». Endocrine 29 (2): 233-41. Apr 2006. PMID 16785599. doi:10.1385/ENDO:29:2:233.
- ↑ «Age-related testosterone depletion and the development of Alzheimer disease». JAMA 292 (12): 1431-32. Sep 2004. PMID 15383512. doi:10.1001/jama.292.12.1431-b.
- ↑ «Current concepts in aesthetic endocrinology». Gynecol. Endocrinol. 16 (6): 431-41. December 2002. PMID 12626029. doi:10.1080/gye.16.6.431.441.
