Plutonio
El plutonio es un elemento transuránico radiactivo con el símbolo químico Pu y el número atómico 94. Es un metal actínido con apariencia gris plateada que se oscurece cuando es expuesto al aire, formando una capa opaca cuando se oxida. El elemento normalmente exhibe seis estados alotrópicos y cuatro de oxidación. Reacciona con el carbono, los halógenos, nitrógeno y silicio. Cuando se expone al aire húmedo forma óxidos e hidruros que expanden hasta un 70% su volumen, que a su vez, se desprende en forma de polvo que puede inflamarse de forma espontánea. También es un elemento radiactivo y se puede acumular en los huesos. Estas propiedades hacen que manipular plutonio sea peligroso.
El plutonio es el elemento primordial más pesado en virtud a su isótopo más estable, el plutonio-244, con una semivida aproximada de 80 millones de años es tiempo suficiente para que el elemento se encuentre en pequeñas cantidades en la naturaleza.[2] El plutonio es principalmente un subproducto de la fisión nuclear en los reactores, donde algunos de los neutrones liberados por el proceso de fisión convierten núcleos de uranio-238 en plutonio.[3]
Uno de los isótopos del plutonio utilizados es el plutonio-239, que tiene una semivida de 24 100 años. El plutonio-239, junto con el plutonio-241 son elementos fisibles, esto quiere decir que el núcleo de sus átomos se puede dividir cuando es bombardeado con neutrones térmicos, liberando energía, radiación gamma y más neutrones. Esos neutrones pueden mantener una reacción nuclear en cadena, dando lugar a aplicaciones en armas y reactores nucleares.
El plutonio-238 tiene una semivida de 88 años y emite partículas alfa. Es una fuente de calor en los generadores termoeléctricos de radioisótopos, que son utilizados para proporcionar energía a algunas sondas espaciales. El plutonio-240 tiene una tasa elevada de fisión espontánea, aumentando el flujo de neutrones de cualquier muestra en la que se encuentre. La presencia de plutonio-240 limita el uso de muestras para armas o combustible nuclear y determina su grado. Los isótopos del plutonio son caros y difíciles de separar, por esto suelen fabricarse en reactores especializados.
El plutonio fue sintetizado por primera vez en 1940 por un equipo dirigido por Glenn T. Seaborg y Edwin McMillan en el laboratorio de la Universidad de California, Berkeley bombardeando uranio-238 con deuterio. Posteriormente se encontraron trazas de plutonio en la naturaleza. La producción de plutonio en cantidades útiles por primera vez fue una parte importante del Proyecto Manhattan durante la Segunda Guerra Mundial, que desarrolló las primeras bombas atómicas. La primera prueba nuclear ("Trinity", en julio de 1945), y la segunda bomba atómica usada para destruir una ciudad ("Fat Man" en Nagasaki, Japón en agosto de 1945) tenían núcleos de plutonio-239. Durante y después de la guerra, se realizaron experimentos con humanos sin consentimiento informado que estudiaban la radiación del plutonio y tuvieron lugar varios accidentes críticos, algunos de ellos letales. La eliminación de los residuos de plutonio de las centrales nucleares y el desmantelamiento de las armas nucleares construidas durante la Guerra Fría son preocupaciones sobre la proliferación nuclear y el medio ambiente. Otras fuentes de plutonio en el medio ambiente son consecuencia de las numerosas pruebas nucleares en la superficie (ahora prohibidas).
Historia
[editar]Descubrimiento
[editar]
Enrico Fermi y un equipo de científicos de la Universidad de Roma informaron de que habían descubierto el elemento 94 en 1934.[4] Fermi llamó al nuevo elemento hesperio y lo mencionó en su discurso del Nobel en 1938.[5] La muestra era en realidad una mezcla de bario, kriptón y otros elementos, pero esto no se conocía en ese momento porque la fisión nuclear todavía no se había descubierto.[6]
El plutonio (específicamente, plutonio-238) fue producido y aislado por primera vez el 14 de diciembre de 1940 y fue identificado químicamente el 23 de febrero de 1941 por el Dr. Glenn T. Seaborg, Edwin M. McMillan, J. W. Kennedy y A. C. Wahl, bombardeando uranio con deuterio en el ciclotrón de 150 cm de diámetro de la Universidad de California, Berkeley.[7][8] En el experimento de 1940, se produjo neptunio-238 en el bombardeo, pero se desintegró por emisión beta con una semivida corta de unos dos días, que indicaba la formación del elemento 94.[9]
Un documento científico del descubrimiento fue preparado por el equipo y enviado a la revista Physical Review en marzo de 1941.[9] El documento fue retirado antes de la publicación debido a que descubrieron que un isótopo de este nuevo elemento (plutonio-239) podría experimentar la fisión nuclear de forma que podría ser útil para la bomba atómica. La publicación fue retrasada hasta un año después del fin de la Segunda Guerra Mundial, debido a las preocupaciones sobre la seguridad.[10]
Edwin McMillan había nombrado recientemente el primer elemento transuránico debido al planeta Neptuno y sugirió que el elemento 94, siendo el siguiente elemento de la serie, fuera nombrado el que en ese momento era el siguiente planeta, Plutón.[11][nota 1] Seaborg originalmente consideró el nombre «plutio», pero después pensó que no sonaba tan bien como «plutonio».[12] Eligió las letras «Pu» como una broma, que fue aprobada sin previo aviso en la tabla periódica.[nota 2] Otros nombres alternativos considerados por Seaborg y otros fueron «ultimio» y «extremio», debido a la creencia errónea de que habían encontrado el último elemento posible en la tabla periódica.[13]
Primeras investigaciones
[editar]Después de unos pocos meses de estudio inicial, se encontró que la química básica del plutonio era parecida a la del uranio.[9] Las primeras investigaciones continuaron en el Laboratorio Metalúrgico de la Universidad de Chicago. El 18 de agosto de 1942, una cantidad muy pequeña fue aislada y medida por primera vez. Fueron producidos unos 50 mg de plutonio-239, junto con uranio y productos de la fisión, y solo se aisló 1 mg aproximadamente.[14] Este procedimiento permitió a los químicos determinar la masa atómica del nuevo elemento.[15][nota 3]
En noviembre de 1943 algunos trifluoruros de plutonio fueron reducidos para crear la primera muestra de plutonio metálico: unos pocos microgramos de perlas metálicas.[14] Se produjo suficiente plutonio para que fuera el primer elemento sintético visible a simple vista.[16]
Las propiedades nucleares del plutonio-239 también fueron estudiadas; los investigadores encontraron que, cuando un átomo es golpeado por un neutrón, se rompe (fisión), liberando más neutrones y energía. Esos neutrones pueden golpear otros átomos de plutonio-239 y así sucesivamente en una rápida reacción nuclear en cadena. Esto puede originar una explosión suficientemente grande como para destruir una ciudad si se concentra suficiente plutonio-239 para alcanzar la masa crítica.[9]
Producción en el Proyecto Manhattan
[editar]Durante la Segunda Guerra Mundial, el Gobierno federal de los Estados Unidos creó el Proyecto Manhattan, que fue el encargado de desarrollar la bomba atómica. Los tres principales sitios de investigación y producción del proyecto fueron la instalación de producción de plutonio en lo que ahora es Hanford Site, las instalaciones de enriquecimiento de uranio en Oak Ridge, Tennessee, y el laboratorio de investigación y diseño de armas, ahora conocido como Laboratorio Nacional de Los Álamos[17]

El primer reactor de producción que producía plutonio-239 fue el reactor de Grafito X-10. Empezó a funcionar en 1943 y fue construido en una instalación en Oak Ridge que después se convirtió en el Laboratorio Nacional Oak Ridge.[9][nota 4]
El 5 de abril de 1944, Emilio Segrè, en Los Álamos, recibió la primera muestra de plutonio producido por reactor de Oak Ridge.[18]
Bombas atómicas Trinity y Fat Man
[editar]La primera prueba de una bomba atómica, denominada Trinity y detonada el 16 de julio de 1945 cerca de Alamogordo, Nuevo México, contenía plutonio como su material de fisión.[14] En el diseño de la implosión del dispositivo se usó lentes explosivos convencionales para comprimir una esfera de plutonio en una masa supercrítica, que era bombardeado simultáneamente con neutrones desde el «Urchin»,[nota 5] un iniciador hecho de polonio y berilio.[9] En conjunto, estos aseguraron una reacción en cadena y una explosión. El arma en su totalidad pesaba más de 4 toneladas, a pesar de que solo habían sido utilizados 6,2 kilogramos de plutonio en su núcleo.[19] Aproximadamente el 20% del plutonio utilizado en el arma Trinity se sometió a fisión, lo que resultó en una explosión con una energía equivalente a aproximadamente 20 000 toneladas de TNT.[20]
Un diseño idéntico fue utilizado en la bomba atómica «Fat Man», lanzada sobre Nagasaki, Japón, el 9 de agosto de 1945, matando a 70 000 personas e hiriendo a otras 100 000.[9] La bomba «Little Boy» lanzada sobre Hiroshima tres días antes, usó uranio-235 y no plutonio. Fue hecha pública la existencia del plutonio solamente luego del anuncio de las primeras bombas atómicas.
Uso y residuos en la Guerra Fría
[editar]Durante la guerra fría fueron construidas grandes reservas de plutonio para armas nucleares, tanto por la Unión Soviética como por Estados Unidos. Los reactores estadounidenses de Hanford y Savannah River Site en Carolina del Sur producían 103 toneladas,[21] y se estimaba que se producían 170 toneladas de plutonio de grado militar en la Unión Soviética.[22] Cada año aún son producidas alrededor de 20 toneladas del elemento como un subproducto de la industria de energía nuclear.[23] Aproximadamente 1000 toneladas de plutonio pueden estar almacenadas junto con más de 200 toneladas de plutonio extraído desde armas nucleares.[9] El Instituto Internacional de Estudios para la Paz de Estocolmo estimaba que las reservas mundiales de plutonio en 2007 eran de 500 toneladas, divididas en partes iguales entre reservas civiles y armamentísticas.[24]
Experimentación médica
[editar]Durante y después del final de la Segunda Guerra Mundial, los científicos que trabajaban en el Proyecto Manhattan y en otros proyectos de investigación de armas nucleares, llevaron a cabo estudios de los efectos del plutonio en animales de laboratorio y en seres humanos.[25] Los estudios en animales revelaron que unos pocos miligramos de plutonio por kilogramo de tejido representan una dosis letal.[26]
En el caso de los seres humanos, dichos experimentos implicaban inyectar soluciones que contenían (por lo general) cinco microgramos de plutonio en pacientes hospitalarios que se creía que sufrían de una enfermedad terminal, o que tuvieran una esperanza de vida menor a diez años ya sea debido a la avanzada edad o por la condición de una enfermedad crónica.[25] Esta cantidad fue reducida a un microgramo en julio de 1945 después de que en los estudios en animales se constatara que la forma en la que el plutonio se distribuía en los huesos era más peligrosa que la del radio.[26] Muchos de estos experimentos dieron como resultado fuertes mutaciones. La mayoría de los sujetos de prueba —de acuerdo a lo dicho por Eileen Welsome— eran pobres, impotentes y enfermos.[27]
Características
[editar]El plutonio, como la mayoría de los metales, tiene una apariencia plateada brillante al principio, muy parecida a la del níquel, pero se oxida rápidamente a un gris opaco, aunque también se reportan amarillo y verde oliva.[28][29] A temperatura ambiente, el plutonio esta en su forma α (alfa). Esta, la forma estructural más común del elemento (alótropo), es casi tan dura y quebradiza como el hierro fundido gris, a menos que se alee con otros metales para hacerlo blando y dúctil. A diferencia de la mayoría de los metales, no es un buen conductor de calor o electricidad. Tiene un punto de fusión bajo. (640 °C) y un inusualmente alto punto de ebullición (3228 °C).[28]
La desintegración alfa, la liberación de un núcleo de helio de alta energía, es la forma más común de desintegración radioactiva para el plutonio.[30] Una masa de 5 kg de 239Pu contiene alrededor de 12,5 × 1024 átomos. Con una vida media de 24 100 años, aproximadamente 11,5 × 1012 de sus átomos se descomponen cada segundo emitiendo una partícula alfa de 5,16 MeV. Esto equivale a 9,68 vatios de potencia. El calor producido por la deceleración de estas partículas alfa las hace calientes al tacto.[11][31]
La resistividad es una medida de la fuerza con la que un material se opone al flujo de corriente eléctrica. La resistividad del plutonio a temperatura ambiente es muy alta para un metal, y se hace aún más alta con temperaturas más bajas, lo que es inusual para los metales.[32] Esta tendencia continúa hasta 100 K, por debajo de la cual la resistividad disminuye rápidamente para las muestras frescas.[32] La resistividad comienza a aumentar con el tiempo alrededor de los 20 K debido al daño por radiación, con la tasa dictada por la composición isotópica de la muestra.[32]
Debido a la autoirradiación, una muestra de plutonio se fatiga en toda su estructura cristalina, lo que significa que la disposición ordenada de sus átomos se ve interrumpida por la radiación con el tiempo.[33] La autoirradiación también puede conducir a recocido que contrarresta algunos de los efectos de la fatiga a medida que la temperatura aumenta por encima de los 100 K.[34]
A diferencia de la mayoría de los materiales, el plutonio aumenta en densidad cuando se funde, en un 2,5%, pero el metal líquido exhibe una disminución lineal en densidad con la temperatura.[32] Cerca del punto de fusión, el plutonio líquido tiene una viscosidad y tensión superficial muy alta en comparación con otros metales.[33]
Alótropos
[editar]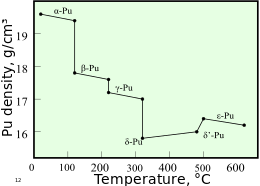
El plutonio normalmente tiene seis alótropos y forma un séptimo (zeta, ζ) a alta temperatura dentro de un rango de presión limitado.[35] Estos alótropos, que son diferentes modificaciones estructurales o formas de un elemento, tienen energías internas muy similares pero densidades y estructuras cristalinas significativamente variables. Esto hace que el plutonio sea muy sensible a los cambios de temperatura, presión o química, y permite cambios drásticos de volumen después de transiciones de fase de una forma alotrópica a otra.[33] Las densidades de los diferentes alótropos varían de 16,00 g/cm³ a 19,86 g/cm³.[23]
La presencia de estos muchos alótropos hace muy difícil el mecanizado del plutonio, ya que cambia de estado muy fácilmente. Por ejemplo, la forma α existe a temperatura ambiente en plutonio no aleado. Tiene características de mecanizado similares al hierro fundido pero cambia a la forma plástica y maleable β (beta) a temperaturas ligeramente más altas.[36] Las razones del complicado diagrama de fase no se entienden del todo. La forma α tiene una estructura monoclínica de baja simetría, de ahí su fragilidad, resistencia, compresibilidad y baja conductividad térmica.[35]
El plutonio en la forma δ (delta) normalmente existe en el rango de 310 °C a 452 °C pero es estable a temperatura ambiente cuando se alea con un pequeño porcentaje de galio, aluminio, o cerio, lo que mejora la trabajabilidad y permite su soldadura.[36] La forma δ tiene un carácter metálico más típico, y es más o menos tan fuerte y maleable como el aluminio.[35] En las armas de fisión, las ondas de choque explosivas utilizadas para comprimir un núcleo de plutonio también causarán una transición de la forma habitual de plutonio de fase δ a la forma más densa de α, ayudando significativamente a lograr la supercrítica.[37] La fase ε, el alótropo sólido de más alta temperatura, exhibe una autodifusión atómica anómicamente alta en comparación con otros elementos[33]
Fisión nuclear
[editar]
El plutonio es un metal radiactivo actínido cuyo isótopo, plutonio-239, es uno de los tres isótopos primarios fisibles (uranio-233 y uranio-235 son los otros dos); plutonio-241 también es altamente fisible. Para ser considerado fisionable, el núcleo atómico de un isótopo debe ser capaz de romperse o fisionarse cuando es golpeado por un neutrón de movimiento lento y liberar suficientes neutrones adicionales para sostener la reacción en cadena nuclear mediante la división de más núcleos.[38]
El plutonio-239 puro puede tener un factor de multiplicación (keff) mayor que uno, lo que significa que si el metal está presente en cantidad suficiente y con una geometría apropiada (por ejemplo, una esfera de tamaño suficiente), puede formar una masa crítica.[39] Durante la fisión, una fracción de la energía de unión nuclear, que mantiene un núcleo unido, se libera como una gran cantidad de energía electromagnética y cinética (gran parte de esta última se convierte rápidamente en energía térmica). La fisión de un kilogramo de plutonio-239 puede producir una explosión equivalente a 21 000 tons de TNT. Es esta energía la que hace que el plutonio-239 sea útil en armas nucleares y reactores.[11]
La presencia del isótopo plutonio-240 en una muestra limita su potencial de bomba nuclear, ya que el plutonio-240 tiene una tasa relativamente alta de fisión espontánea (~440 fisuras por segundo por gramo—más de 1000 neutrones por segundo por gramo),[40] elevando los niveles de neutrones de fondo e incrementando así el riesgo de predetonación.[41] El plutonio se identifica como grado de armamentístico, de grado combustible o de grado reactor según el porcentaje de plutonio 240 que contiene. El plutonio apto para armas contiene menos del 7% de plutonio 240. El plutonio apto para uso en reactores contiene de 7% a menos de 19%, y el de grado de reactor de potencia contiene 19% o más de plutonio-240. El Plutonio súper-grado, con menos del 4% de plutonio-240, se utiliza en armas de la Armada de los Estados Unidos almacenadas cerca de las tripulaciones de barcos y submarinos, debido a su menor radiactividad.[42] El isótopo plutonio-238 no es fisil pero puede sufrir fisión nuclear fácilmente con neutrones rápidos así como también desintegración alfa.[11]
Isótopos y síntesis
[editar]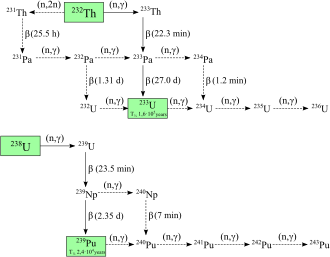
Se han caracterizado 20 isótopos radioactivos de plutonio. Los más longevos son el plutonio-244, con una vida media de 80,8 millones de años, el plutonio-242, con una vida media de 373 300 años, y el plutonio-239, con una vida media de 24 110 años. Todos los isótopos radioactivos restantes tienen una vida media inferior a 7000 años. Este elemento también tiene ocho estados meta-estables, aunque todos tienen vida media inferior a un segundo.[30]
Los isótopos conocidos del rango del plutonio en número de masa de 228 a 247. Los modos de desintegración primaria de los isótopos con unos números de masa inferior al del isótopo más estable, el plutonio-244, son la fisión espontánea y emisión alfa, que en su mayor parte forman uranio (92 protones) y neptunio (93 protones) como producto de desintegración (descuidando el amplio rango de núcleos hijos creados por procesos de fisión). El modo de desintegración primaria para los isótopos con un número de masas superior al del plutonio-244 es emisión beta, que en su mayor parte forman americio (95 protones) como productos de desintegración. El plutonio-241 es el isótopo padre de la serie de desintegración del neptunio, que se descompone a americio-241 mediante la emisión beta.[30][43]
El plutonio-238 y 239 son los isótopos más ampliamente sintetizados.[11] El plutonio-239 se sintetiza a través de la siguiente reacción utilizando uranio (U) y neutrones (n) a través de la desintegración beta (β-) con el neptunio (Np) como sustancia intermedia:[44]
Los neutrones de la fisión del uranio-235 son capturados por núcleos de uranio-238 para formar uranio-239; un desintegración beta convierte un neutrón en un protón para formar neptunio-239 (vida media de 2,36 días) y otra descomposición beta forma plutonio-239.[45] Egon Bretscher trabajando en el proyecto británico Tube Alloys predijo esta reacción teóricamente en 1940.[46]
El plutonio-238 se sintetiza bombardeando el uranio-238 con deuteróns (D, el núcleo de hidrógeno) en la siguiente reacción:[47]
En este proceso, un deuterón que golpea el uranio-238 produce dos neutrones y neptunio-238, que se descomponen espontáneamente al emitir partículas beta negativas para formar plutonio-238.[48].
Calor de desintegración y propiedades de la fusión
[editar]Los isótopos de plutonio se someten a una desintegración radiactiva, que produce calor de desintegración. Diferentes isótopos producen diferentes cantidades de calor por masa. El calor de decaimiento generalmente se enumera como vatio/kilogramo, o miliwatt/gramo. En piezas más grandes de plutonio (por ejemplo, una fosa de armas) y la remoción inadecuada de calor, el autocalentamiento resultante puede ser significativo. Todos los isótopos producen radiación gamma débil en desintegración.
| Isótopo | Modo de desintegración | vida media (años) | calor de desintegración (W/kg) | neutrones (1/(g-s)) | Comentario |
|---|---|---|---|---|---|
| 238Pu | alfa a 234U. | 87.74 | 560 | 2600 | Calor de descomposición muy alto. Incluso en pequeñas cantidades puede causar un autocalentamiento significativo. Utilizado por sí solo en un generador termoeléctrico radioisótopico. |
| 239Pu | alfa a 235U. | 24100 | 1.9 | 0.022 | El principal isótopo fisionable en uso. |
| 240Pu | alfa a 236U, fisión espontánea | 6560 | 6.8 | 910 | La principal impureza en muestras del isótopo 239Pu. El grado de plutonio se indica generalmente como porcentaje de 240Pu. La alta fisión espontánea dificulta el uso en armas nucleares. |
| 241Pu | beta-menos, a 241Am | 14.4 | 4.2 | 0.049 | Se desintegra a americio-241; su acumulación presenta un peligro de radiación en muestras más viejas. |
| 242Pu | alfa a 238U. | 376000 | 0.1 | 1700 |
Compuestos y química
[editar]
A temperatura ambiente, el plutonio puro es de color plateado pero gana un deslustre al oxidarse.[50] El elemento muestra cuatro estados de oxidación iónicos comunes en solución acuosa y uno raro:[23]
- Pu(III), como Pu3+ (lavanda azul)
- Pu(IV), como Pu4+ (marrón amarillento)
- Pu(V), como PuO+
2 (rosa pálido)[nota 6] - Pu(VI), como PuO20−
2 (naranja rosado) - Pu(VII), como PuO3−
5 (verde)-el ion heptavalente es raro.
El color que muestran las soluciones de plutonio depende tanto del estado de oxidación como de la naturaleza del anión ácido.[52] Es el anión ácido el que influye en el grado de complejidad—cómo se conectan los átomos a un átomo central— de la especie de plutonio. Además, se conoce el estado formal de oxidación +2 del plutonio en el complejo [K(2.2.2-cryptand)] [PuIICp″3], Cp″ = C5H3(SiMe3)2.[53]
El plutonio metálico se produce reaccionando tetrafluoruro de plutonio con bario, calcio o litio a 1200 °C.[54] Es atacado por ácidos, oxígeno, y vapor pero no por álcalis y se disuelve fácilmente en hidroclórico, hidroico, y ácido perclóricos..[55] El metal fundido debe mantenerse en un vacío o en una atmósfera inerte para evitar la reacción con el aire.[36] A 135 °C el metal se encenderá en el aire y explotará si se coloca en tetracloruro de carbono.[9]

El plutonio es un metal reactivo. En aire húmedo o argón húmedo, el metal se oxida rápidamente, produciendo una mezcla de óxidos e hidruros.[28] Si el metal se expone durante un tiempo suficientemente largo a una cantidad limitada de vapor de agua, se forma una capa de superficie polvorienta de PuO2.[28] También se forma hidruro de plutonio pero un exceso de vapor de agua forma solo PuO2.[55]
El plutonio muestra enormes y reversibles velocidades de reacción con hidrógeno puro, formando hidruro de plutonio.[33] También reacciona fácilmente con oxígeno, formando PuO y PuO2 así como óxidos intermedios; el óxido de plutonio llena un 40% más de volumen que el plutonio metálico. El metal reacciona con los halógenos, dando lugar a compuestos con la fórmula general PuX3 donde X puede ser F, Cl, Br o I y PuF4 también se ve. Se observan los siguientes oxihaluros: PuOCl, PuOBr y PuOI. Reaccionará con carbono para formar PuC, nitrógeno para formar PuN y silicio para formar PuSi2.[23][9]
El polvo de plutonio, sus hidruros y ciertos óxidos como Pu2O3 son pyrophoric, lo que significa que pueden inflamarse espontáneamente a temperatura ambiente y por lo tanto se manipulan en una atmósfera inerte y seca de nitrógeno o argón. El plutonio a granel se enciende solo cuando se calienta a más de 400 °C. Pu2O3 se calienta espontáneamente y se transforma en PuO2, que es estable en aire seco, pero reacciona con el vapor de agua cuando se calienta.[56]
Los crisoles utilizados para contener plutonio necesitan ser capaz de resistir sus fuertes propiedades reductoras. Los metales refractarios como el tántalo y tungsteno junto con los óxidos más estables, boruros, carburos, nitruros y silicidios pueden tolerar esto. La fusión en un horno de arco eléctrico puede utilizarse para producir pequeños lingotes de metal sin necesidad de un crisol.[36]
Se utiliza como simulante químico de plutonio para el desarrollo de tecnologías de contención, extracción y otras tecnologías.[57]
El ion es inestable en solución y se desproporcionará en Pu4+ y PuO20−
2.
Estructura electrónica
[editar]El plutonio es un elemento en el que los electrones 5f son la frontera de transición entre deslocalizado y localizado, por lo que se considera uno de los elementos más complejos.[58] El comportamiento anómalo del plutonio es causado por su estructura electrónica. La diferencia de energía entre los subsistemas 6d y 5f es muy baja. El tamaño de la capa 5f es suficiente para permitir que los electrones formen enlaces dentro de la red, en el mismo límite entre el comportamiento localizado y el enlace. La proximidad de los niveles de energía conduce a múltiples configuraciones de electrones de baja energía con niveles de energía casi iguales. Esto conduce a la competencia de 5fn7s2 y 5fn−16d17s2 de configuraciones, lo que causa la complejidad de su comportamiento químico. La naturaleza altamente direccional de las órbitas 5f es responsable de los enlaces covalentes direccionales en las moléculas y complejos de plutonio.[33]
Abundancia
[editar]Se pueden encontrar rastros de plutonio-238, plutonio-239, plutonio-240 y plutonio-244 en la naturaleza. Pequeños rastros de plutonio-239, unos pocos partes por trillón, y sus productos de descomposición se encuentran naturalmente en algunos minerales concentrados de uranio,[14] como el reactor de fisión nuclear natural en Oklo, Gabón.[59] La relación entre el plutonio-239 y el uranio en el yacimiento de uranio de Cigar Lake Mine oscila entre 2,4 × 10-12 y 44 × 10-12[60] Estas cantidades de trazas de 239Pu se originan de la siguiente manera: en raras ocasiones, 238U sufre una fisión espontánea, y en el proceso, el núcleo emite uno o dos neutrones libres con cierta energía cinética. Cuando uno de estos neutrones golpea el núcleo de otro 238U átomo, es absorbido por el átomo, que se convierte en 239U. Con una vida media relativamente corta, 239U se descompone a 239Np, que se descompone en 239Pu.[61][62] Finalmente, cantidades excesivamente pequeñas de plutonio-238, atribuidas a la extremadamente rara doble desintegración beta de uranio-238, han sido encontradas en muestras de uranio natural.[63]
Debido a su vida media relativamente larga de unos 80 millones de años, se sugirió que el plutonio-244 ocurre naturalmente como un nucleido primordial, pero no se pudieron confirmar los primeros informes de su detección.[64] Sin embargo, su larga vida media aseguró su circulación a través del sistema solar antes de su extinción,[65] y, de hecho, se han encontrado pruebas de la fisión espontánea de las vías de fisión extintas 244Pu en meteoritos.[66] La presencia anterior de 244Pu en el Sistema Solar temprano ha sido confirmada, ya que se manifiesta hoy en día como un exceso de sus hijas, ya sea 232Th. (de la vía de decaimiento alfa) o isótopos de xenón (de su fisión espontánea). Estos últimos son generalmente más útiles, porque las químicas del torio y del plutonio son bastante similares (ambos son predominantemente tetravalentes) y por lo tanto un exceso de torio no sería una evidencia fuerte de que parte de él se formó como una hija de plutonio.
Aplicaciones
[editar]Armas nucleares
[editar]
El isótopo plutonio-239 es un componente clave en las armas nucleares debido a su fácil fisión y su disponibilidad. Encapsulando el pozo de plutonio de la bomba en un pisón (una capa opcional de material denso) disminuye la cantidad de plutonio necesaria para alcanzar la masa crítica que refleja los neutrones que escapan de nuevo en el núcleo de plutonio. Esto reduce la cantidad de plutonio necesaria para alcanzar la criticidad de 16 kg a 10 kg, que es una esfera con un diámetro de unos 10 cm (4 in).[67] Esta masa crítica es aproximadamente un tercio de la del uranio-235.[11]
La bombas de plutonio tipo "Fat Man" producidas durante el Proyecto Manhattan usaban explosivos para comprimir el plutonio y obtener densidades significativamente más altas de lo normal, combinado con una fuente central de neutrones para iniciar la reacción y aumentar su eficiencia. De esta forma solo se necesitaban 6,2 kg de plutonio para un rendimiento equivalente a una explosión de 20 kilotones de TNT (Véase también diseño de armas nucleares) Hipotéticamente, tan solo son necesarios 4 kg de plutonio, tal vez menos, para hacer una bomba atómica usando diseños de ensamblado muy sofisticados.[68]
Combustible nuclear de mezcla de óxidos
[editar]Energía y fuente de calor
[editar]Precauciones
[editar]Toxicidad
[editar]El plutonio es el elemento químico más tóxico que existe y no por sus propiedades químicas sino por su radiación ionizante. Los isótopos y compuestos del plutonio son radiactivos y se acumulan en la médula ósea. La contaminación por óxido de plutonio se ha producido tras incidentes radiactivos y desastres nucleares, incluyendo accidentes nucleares militares donde armas nucleares han ardido.[69] Estudios de los efectos de estas pequeñas fugas, así como el extensivo envenenamiento por radiación y posteriores muertes después de los bombardeos atómicos sobre Hiroshima y Nagasaki, han aportado información considerable con respecto a los peligros, síntomas y pronósticos del envenenamiento por radiación, que en el caso de los japoneses sobrevivientes (Hibakusha), se demostró que no estaban relacionados en gran medida con la exposición directa al plutonio.[70]
Durante el decaimiento del plutonio, son liberados tres tipos de radiación, alfa, beta y gamma. La radiación alfa es muy destructiva por su alta masa (dos núcleos de Helio). Aunque solo puede recorrer cortas distancias (pero enormes, a escala celular) y no puede viajar a través de la capa exterior muerta de la piel humana, si llega al pulmón -aún en cantidades ínfimas- puede producir daños muy graves. La radiación beta puede penetrar la piel humana pero no puede atravesar el cuerpo. La radiación gamma puede ir a través de todo el cuerpo.[71] Los tres tipos de radiación son ionizantes. Una exposición aguda o de larga duración conlleva serios problemas de salud, incluyendo síndrome de irradiación aguda, daño genético, cáncer y hasta la muerte. El daño aumenta con la cantidad de exposición.
Potencial crítico
[editar]Es necesario evitar que el plutonio se acumule en cantidades cercanas a su masa crítica, debido a que la masa crítica del plutonio es de un tercio de la del uranio-235. La masa crítica del plutonio emite cantidades letales de neutrones y rayos gamma. El plutonio en estado líquido presenta una mayor probabilidad de formar una masa crítica que en estado sólido debido a la Termalización que produce el hidrógeno en el agua.
Inflamabilidad
[editar]El plutonio metálico se inflama fácilmente, especialmente si el material está dividido en partes finas. En un ambiente húmedo, el plutonio forma hidruros piroforicos en su superficie, que pueden incendiarse a temperatura ambiente. El plutonio expande hasta un 70% su volumen cuando se oxida y puede romper el contenedor.[56] La radiactividad del material en combustión es un peligro adicional. La arena de óxido de magnesio es probablemente el material más efectivo para extinguir un fuego de plutonio. Esta enfría el material combustible, actuando como un disipador, y también bloquea el oxígeno. Para manipular o almacenar el plutonio en cualquier forma es necesario tomar precauciones especiales; generalmente, se requiere una atmósfera seca de gas inerte.[56][nota 7]
Notas
[editar]- ↑ Esta no era la primera vez que alguien sugería que un elemento fuera llamado "plutonio". Una década después de que el Bario fuera descubierto, un profesor de la Universidad de Cambridge sugirió que fuera renombrado como "plutonio" ya que el elemento no era pesado (como sugería la raíz de origen griego "barys", por la que fue nombrado). El pensó que, ya que el Bario fue producido por la técnica relativamente nueva de la Electrólisis, su nombre debería estar relacionado con el fuego. Por lo tanto sugirió que fuera nombrado "plutonio", por el dios Romano del inframundo, Plutón.(Heiserman, 1992)
- ↑ Tal como lo expresa un artículo, refiriéndose a información que Seaborg dió en una charla: "La opción obvia para el símbolo hubiera sido Pl, pero de manera chistosa, Seaborg sugirió Pu, como las palabras que un niño exclamaría, 'Pee-Yoo' al sentir un olor feo. Seaborg pensó que recibiría grandes críticas por esa sugerencia, pero el comité de nombres aceptó el símbolo sin decir una palabra."
- Clark, David L.; Hobart, David E. (2000). «Reflections on the Legacy of a Legend: Glenn T. Seaborg, 1912–1999» (PDF). Los Alamos Science 26: 56-61, on 57. Consultado el 15 de febrero de 2009.
- ↑ El salon 405 del Laboratorio George Herbert Jones, donde se aisló por primera vez plutonio, fue nombrado como sitio de interés histórico nacional en mayo de 1967.
- ↑ Durante el Proyecto Manhattan, a menudo se hizo referencia al plutonio simplemente como "49": el número 4 era debido a el último dígito en 94 (número atómico del plutonio), y el 9 era por el último dígito en plutonio-239, el isótopo fisionable del plutonio y apto para armas usado en las bombas nucleares.
- Hammel, E.F. (2000). «The taming of "49" – Big Science in little time. Recollections of Edward F. Hammel, pp. 2–9. In: Cooper N.G. Ed. (2000). Challenges in Plutonium Science». Los Alamos Science 26 (1): 2-9. Consultado el 15 de febrero de 2009.
- Hecker, S.S. (2000). «Plutonium: an historical overview. In: Challenges in Plutonium Science». Los Alamos Science 26 (1): 1-2. Consultado el 15 de febrero de 2009.
- ↑ Urchin fue el nombre clave para el iniciador interno de neutrones, un dispositivo generador de neutrones que disparaba la detonación nuclear de las primeras bombas atómicas de plutonio, como la del proyecto Trinity (The Gadget) y Fat Man, una vez que la masa crítica haya sido montada por la fuerza de explosivos convencionales.
- ↑ El ión PuO+
2 es inestable en solución, por lo que se disociará en Pu4+ y PuO20−
2; el Pu4+ oxidará el resto de PuO+
2 a PuO20−
2, reduciéndose a su vez a Pu3+. Así, las soluciones acuosas de PuO+
2 tienden con el tiempo hacia una mezcla de Pu3+ y PuO2+
2. El UO+
2 es inestable por la misma razón.[51] - ↑ Hubo un gran incendio iniciado a causa del plutonio en la planta nuclear Rocky Flats cerca de Boulder (Colorado) en 1969. Albright, David; O'Neill, Kevin (1999). «The Lessons of Nuclear Secrecy at Rocky Flats». ISIS Issue Brief. Institute for Science and International Security (ISIS). Archivado desde el original el 8 de julio de 2008. Consultado el 7 de diciembre de 2008.
Referencias
[editar]- ↑ Magurno, B.A.; Pearlstein, S. (eds.) Workshop on nuclear data evaluation methods and procedures, Upton, NY, USA, 22 Septmber 1980, vol. II (1981), pp. 835 ff
- ↑ Hoffman, D. C.; Lawrence, F. O.; Mewherter, J. L.; Rourke, F. M. (1971). «Detection of Plutonium-244 in Nature». Nature 234 (5325): 132-134. Bibcode:1971Natur.234..132H. doi:10.1038/234132a0.
- ↑ "Contaminated Water Escaping Nuclear Plant, Japanese Regulator Warns". The New York Times.
- ↑ Holden, Norman E. (2001). «A Short History of Nuclear Data and Its Evaluation». 51st Meeting of the USDOE Cross Section Evaluation Working Group. Upton (NY): National Nuclear Data Center, Brookhaven National Laboratory. Consultado el 3 de enero de 2009.
- ↑ Fermi, Enrico (12 de diciembre de 1938). «Artificial radioactivity produced by neutron bombardment: Nobel Lecture» (PDF). Royal Swedish Academy of Sciences.
- ↑ Darden, Lindley (1998). «Enrico Fermi: "Transuranium" Elements, Slow Neutrons». The Nature of Scientific Inquiry. College Park (MD): Department of Philosophy, University of Maryland. Consultado el 3 de enero de 2008.
- ↑ Seaborg, Glenn T. «An Early History of LBNL: Elements 93 and 94». Advanced Computing for Science Department, Lawrence Berkeley National Laboratory. Archivado desde el original el 5 de noviembre de 2014. Consultado el 17 de septiembre de 2008.
- ↑ Glenn T. Seaborg. «The plutonium story». Lawrence Berkeley Laboratory, University of California. LBL-13492, DE82 004551.
- ↑ a b c d e f g h i j Emsley, 2001
- ↑ Stwertka, 1998
- ↑ a b c d e f Heiserman, 1992, p. 338
- ↑ Clark, David L.; Hobart, David E. (2000). «Reflections on the Legacy of a Legend: Glenn T. Seaborg, 1912–1999» (PDF). Los Alamos Science 26: 56-61, on 57. Consultado el 15 de febrero de 2009.
- ↑ PBS contributors (1997). «Frontline interview with Seaborg». Frontline. Public Broadcasting Service. Consultado el 7 de diciembre de 2008.
- ↑ a b c d Miner, 1968, p. 541
- ↑ NPS contributors. «Room 405, George Herbert Jones Laboratory». National Park Service. Archivado desde el original el 8 de febrero de 2008. Consultado el 14 de diciembre de 2008.
- ↑ Miner, 1968, p. 540
- ↑ LANL contributors. «Site Selection». LANL History. Los Alamos, New Mexico: Los Alamos National Laboratory. Consultado el 23 de diciembre de 2008.
- ↑ Sublette, Carey. «Atomic History Timeline 1942–1944». Washington (DC): Atomic Heritage Foundation. Archivado desde el original el 4 de enero de 2009. Consultado el 22 de diciembre de 2008.
- ↑ Sublette, Carey (3 de julio de 2007). «8.1.1 The Design of Gadget, Fat Man, and "Joe 1" (RDS-1)». Nuclear Weapons Frequently Asked Questions, edition 2.18. The Nuclear Weapon Archive. Consultado el 4 de enero de 2008.
- ↑ Malik, John (septiembre de 1985). The Yields of the Hiroshima and Nagasaki Explosions. Los Alamos. p. Table VI. LA-8819. Consultado el 15 de febrero de 2009.
- ↑ DOE contributors (2001). Historic American Engineering Record: B Reactor (105-B Building) (en inglés). Richland (WA): U.S. Department of Energy. p. 110. DOE/RL-2001-16. Consultado el 24 de diciembre de 2008.
- ↑ Cochran, Thomas B. (1997). Natural Resources Defense Council, Inc, ed. Safeguarding nuclear weapons-usable materials in Russia. International Forum on Illegal Nuclear Traffic (en inglés). Washington (DC). Archivado desde el original el 5 de julio de 2013. Consultado el 21 de diciembre de 2008.
- ↑ a b c d CRC, 2006, pp. 4–27
- ↑ Instituto Internacional de Estudios para la Paz de Estocolmo (2007). SIPRI Yearbook 2007: Armaments, Disarmament, and International Security (en inglés). Oxford University Press. p. 567. ISBN 9780199230211.
- ↑ a b Moss, William; Eckhardt, Roger (1995). «The Human Plutonium Injection Experiments» (PDF). Los Alamos Science (en inglés) (Los Alamos National Laboratory) 23: 188, 205, 208, 214. Consultado el 6 de junio de 2006.
- ↑ a b Voelz, George L. (2000). «Plutonium and Health: How great is the risk?». Los Alamos Science (Los Alamos (NM), Estados Unidos: Los Alamos National Laboratory) (26): 78-79.
- ↑ Longworth, R.C. (nov/dic de 1999). «Injected! Book review:The Plutonium Files: America's Secret Medical Experiments in the Cold War». The Bulletin of the Atomic Scientists (en inglés) 55 (6): 58-61.
- ↑ a b c d «Plutonium, Radioactive». Wireless Information System for Emergency Responders (WISER). Bethesda (MD): U.S. National Library of Medicine, National Institutes of Health. Archivado desde el original el 22 de agosto de 2011. Consultado el 23 de noviembre de 2008. (texto de dominio publico)
- ↑ «Nitric acid processing». Actinide Research Quarterly (Los Alamos (NM): Los Alamos National Laboratory) (3rd quarter). 2008. Consultado el 9 de febrero de 2010. «Mientras que el dióxido de plutonio es normalmente verde oliva, las muestras pueden ser de varios colores. Generalmente se cree que el color es una función de la pureza química, la estequiometría, el tamaño de las partículas y el método de preparación, aunque el color resultante de un determinado método de preparación no siempre es reproducible. (traducido)».
- ↑ a b c Sonzogni, Alejandro A. (2008). «Chart of Nuclides». Upton: National Nuclear Data Center, Brookhaven National Laboratory. Archivado desde el original el 21 de julio de 2011. Consultado el 13 de septiembre de 2008.
- ↑ Rhodes, 1986, pp. 659–660 Leona Marshall: "Cuando tienes un bulto en la mano, se siente caliente, como un conejo vivo"
- ↑ a b c d Miner, 1968, p. 544
- ↑ a b c d e f Hecker, Siegfried S. (2000). «Plutonium and its alloys: from atoms to microstructure». Los Alamos Science 26: 290-335. Consultado el 15 de febrero de 2009.
- ↑ Hecker, Siegfried S.; Martz, Joseph C. (2000). «Aging of Plutonium and Its Alloys». Los Alamos Science (Los Alamos, New Mexico: Los Alamos National Laboratory) (26): 242. Consultado el 15 de febrero de 2009.
- ↑ a b c d Baker, Richard D.; Hecker, Siegfried S.; Harbur, Delbert R. (1983). «Plutonium: A Wartime Nightmare but a Metallurgist's Dream». Los Alamos Science (Los Alamos National Laboratory): 148, 150-151. Consultado el 15 de febrero de 2009.
- ↑ a b c d Miner, 1968, p. 542
- ↑ «Plutonium Crystal Phase Transitions». GlobalSecurity.org.
- ↑ «Glossary – Fissile material». United States Nuclear Regulatory Commission. 20 de noviembre de 2014. Consultado el 5 de febrero de 2015.
- ↑ Asimov, 1988, p. 905
- ↑ Glasstone, Samuel; Redman, Leslie M. (Junio de 1972). «An Introduction to Nuclear Weapons». Atomic Energy Commission Division of Military Applications. p. 12. WASH-1038. Archivado desde el original el 27 de agosto de 2009.
- ↑ Gosling, 1999, p. 40
- ↑ «Plutonium: The First 50 Years». U.S. Department of Energy. 1996. DOE/DP-1037. Archivado desde el original el 18 de febrero de 2013.
- ↑ Heiserman, 1992, p. 340
- ↑ Kennedy, J. W.; Seaborg, G. T.; Segrè, E.; Wahl, A. C. (1946). «Properties of Element 94». Physical Review 70 (7–8): 555-556. Bibcode:1946PhRv...70..555K. doi:10.1103/PhysRev.70.555.
- ↑ Greenwood, 1997, p. 1259
- ↑ Clark, 1961, pp. 124–125.
- ↑ Seaborg, Glenn T.; McMillan, E.; Kennedy, J. W.; Wahl, A. C. (1946). «Radioactive Element 94 from Deuterons on Uranium». Physical Review 69 (7–8): 366. Bibcode:1946PhRv...69..366S. doi:10.1103/PhysRev.69.366.
- ↑ Bernstein, 2007, pp. 76-77.
- ↑ «Can Reactor Grade Plutonium Produce Nuclear Fission Weapons?». Council for Nuclear Fuel Cycle Institute for Energy Economics, Japan. May 2001. Archivado desde el original el 24 de febrero de 2021. Consultado el 21 de julio de 2019.
- ↑ Heiserman, 1992, p. 339
- ↑ Crooks, William J. (2002). «Nuclear Criticality Safety Engineering Training Module 10 – Criticality Safety in Material Processing Operations, Part 1». Archivado desde el original el 20 de marzo de 2006. Consultado el 15 de febrero de 2006. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Matlack, George (2002). A Plutonium Primer: An Introduction to Plutonium Chemistry and its Radioactivity. Los Alamos National Laboratory. LA-UR-02-6594.
- ↑ Windorff, Cory J.; Chen, Guo P; Cross, Justin N; Evans, William J.; Furche, Filipp; Gaunt, Andrew J.; Janicke, Michael T.; Kozimor, Stosh A. et al. (2017). «Identification of the Formal +2 Oxidation State of Plutonium: Synthesis and Characterization of {PuII[C5H3(SiMe3)2]3}−» [Identificación del estado formal de oxidación +2 del plutonio: Síntesis y caracterización de {PuII[C5H3(SiMe3)2]3}−]. J. Am. Chem. Soc. 139 (11): 3970-3973. PMID 28235179. doi:10.1021/jacs.7b00706.
- ↑ Eagleson, 1994, p. 840
- ↑ a b Miner, 1968, p. 545
- ↑ a b c DOE contributors (1994). «Primer on Spontaneous Heating and Pyrophoricity – Pyrophoric Metals – Plutonium». Washington (DC): U.S. Department of Energy, Office of Nuclear Safety, Quality Assurance and Environment. Archivado desde el original el 28 de abril de 2007.
- ↑ Crooks, W. J. (2002). «Low Temperature Reaction of ReillexTM HPQ and Nitric Acid». Solvent Extraction and Ion Exchange 20 (4–5): 543-559. doi:10.1081/SEI-120014371.
- ↑ Dumé, Belle (20 de noviembre de 2002). «Plutonium is also a superconductor». PhysicsWeb.org. Archivado desde el original el 12 de enero de 2012. Consultado el 21 de julio de 2019.
- ↑ «Oklo: Natural Nuclear Reactors». U.S. Department of Energy, Office of Civilian Radioactive Waste Management. 2004. Archivado desde el original el 20 de octubre de 2008. Consultado el 16 de noviembre de 2008.
- ↑ Curtis, David; Fabryka-Martin, June; Paul, Dixon; Cramer, Jan (1999). «Nature's uncommon elements: plutonium and technetium». Geochimica et Cosmochimica Acta 63 (2): 275-285. Bibcode:1999GeCoA..63..275C. doi:10.1016/S0016-7037(98)00282-8.
- ↑ Bernstein, 2007, pp. 75–77.
- ↑ Hoffman, D. C.; Lawrence, F. O.; Mewherter, J. L.; Rourke, F. M. (1971). «Detection of Plutonium-244 in Nature». Nature 234 (5325): 132-134. Bibcode:1971Natur.234..132H. doi:10.1038/234132a0.
- ↑ Peterson, Ivars (Octubre de 2017). «Uranium displays rare type of radioactivity». Science News (Wiley-Blackwell) 140 (23): 373. JSTOR 3976137. doi:10.2307/3976137. Consultado el 29 de junio de 2015. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Hoffman, D. C.; Lawrence, F. O.; Mewherter, J. L.; Rourke, F. M. (1971). «Detection of Plutonium-244 in Nature». Nature 234 (5325): 132-134. Bibcode:1971Natur.234..132H. doi:10.1038/234132a0. Nr. 34.
- ↑ Turner, Grenville; Harrison, T. Mark; Holland, Greg; Mojzsis, Stephen J.; Gilmour, Jamie (1 de enero de 2004). «Extinct $^{244}Pu$ in Ancient Zircons». Science 306 (5693): 89-91. Bibcode:2004Sci...306...89T. JSTOR 3839259. PMID 15459384. doi:10.1126/science.1101014.
- ↑ Hutcheon, I. D.; Price, P. B. (1 de enero de 1972). «Plutonium-244 Fission Tracks: Evidence in a Lunar Rock 3.95 Billion Years Old». Science 176 (4037): 909-911. Bibcode:1972Sci...176..909H. JSTOR 1733798. doi:10.1126/science.176.4037.909.
- ↑ Martin, James E. (2000). Physics for Radiation Protection (1st edición). Wiley-Interscience. p. 532. ISBN 0-471-35373-6.
- ↑ FAS contributors (1998). «Nuclear Weapon Design». Federation of American Scientists. Archivado desde el original el 28 de agosto de 2016. Consultado el 7 de diciembre de 2008.
- ↑ ATSDR contributors (2007). «Toxicological Profile for Plutonium, Draft for Public Comment». U.S. Department of Health and Human Services, Agency for Toxic Substances and Disease Registry (ATSDR). Archivado desde el original el 16 de mayo de 2008. Consultado el 22 de mayo de 2008.
- ↑ Little, M P (junio de 2009). «Cancer and non-cancer effects in Japanese atomic bomb survivors». J Radiol Prot 29 (2A): A43-59. Bibcode:2009JRP....29...43L. PMID 19454804. doi:10.1088/0952-4746/29/2A/S04.
- ↑ Plutonium, CAS ID #: 7440-07-5, Centers for Disease Control and Prevention (CDC) Agency for Toxic Substances and Disease Registry
Bibliografía
[editar]- CRC contributors (2006). David R. Lide, ed. Handbook of Chemistry and Physics (87th edición). Boca Raton (FL): CRC Press, Taylor & Francis Group. ISBN 0-8493-0487-3.
- Emsley, John (2001). «Plutonium». Nature's Building Blocks: An A–Z Guide to the Elements. Oxford (UK): Oxford University Press. pp. 324–329. ISBN 0-19-850340-7.
- Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements (2nd edición). Oxford (UK): Butterworth-Heinemann. ISBN 0-7506-3365-4.
- Heiserman, David L. (1992). «Element 94: Plutonium». Exploring Chemical Elements and their Compounds. New York (NY): TAB Books. pp. 337–340. ISBN 0-8306-3018-X.
- Miner, William N.; Schonfeld, Fred W. (1968). «Plutonium». En Clifford A. Hampel (editor), ed. The Encyclopedia of the Chemical Elements. New York (NY): Reinhold Book Corporation. pp. 540-546. LCCN 68029938.
- Stwertka, Albert (1998). «Plutonium». Guide to the Elements (Revised edición). Oxford (UK): Oxford University Press. ISBN 0-19-508083-1.
Véase también
[editar]- Ciclo del combustible nuclear
- Energía nuclear
- Física nuclear
- Ingeniería nuclear
- Efectos biológicos de la radiación
Enlaces externos
[editar]- Sutcliffe, W.G.; et al. (1995). «A Perspective on the Dangers of Plutonium». Lawrence Livermore National Laboratory. Archivado desde el original el 29 de septiembre de 2006.
- Johnson, C.M.; Davis, Z.S. (1997). «Nuclear Weapons: Disposal Options for Surplus Weapons-Usable Plutonium». CRS Report for Congress # 97-564 ENR. Consultado el 15 de febrero de 2009.
- IEER contributors (2005). «Physical, Nuclear, and Chemical, Properties of Plutonium». IEER. Consultado el 15 de febrero de 2009.
- Bhadeshia, H. «Plutonium crystallography».
- Samuels, D. (2005). «End of the Plutonium Age». Discover Magazine 26 (11).
- Pike, J.; Sherman, R. (2000). «Plutonium production». Federation of American Scientists. Archivado desde el original el 3 de febrero de 2009. Consultado el 15 de febrero de 2009.
- Nuclear Weapon Archive contributors. «Plutonium Manufacture and Fabrication». Nuclearweaponarchive.org.
- Ong, C. (1999). «World Plutonium Inventories». Nuclear Files.org. Consultado el 15 de febrero de 2009.
- LANL contributors (2000). «Challenges in Plutonium Science». Los Alamos Science. I & II (26). Consultado el 15 de febrero de 2009.
- NLM contributors. «Plutonium, Radioactive». NLM Hazardous Substances Databank. Consultado el 15 de febrero de 2009.
- Alsos contributors. «Annotated Bibliography on plutonium». Alsos Digital Library for Nuclear Issues. Archivado desde el original el 3 de febrero de 2009. Consultado el 15 de febrero de 2009.
- Chemistry in its element podcast (MP3) from the Royal Society of Chemistry's Chemistry World: Plutonium


![{\displaystyle {\ce {{^{238}_{92}U}+{^{1}_{0}n}->{^{239}_{92}U}->[\beta ^{-}][23.5\ {\ce {min}}]{^{239}_{93}Np}->[\beta ^{-}][2.3565\ {\ce {d}}]{^{239}_{94}Pu}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f9ba9e4744226a97ce8a41fd5b5e50b18cc259a9)
![{\displaystyle {\begin{aligned}{\ce {{^{238}_{92}U}+{^{2}_{1}D}->}}&{\ce {{^{238}_{93}Np}+2_{0}^{1}n}}\\&{\ce {^{238}_{93}Np->[\beta ^{-}][2.117\ {\ce {d}}]{^{238}_{94}Pu}}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1b584c932e52212178b2befe7a512a7b28f87d35)