Celiaquía
| Celiaquía | ||
|---|---|---|
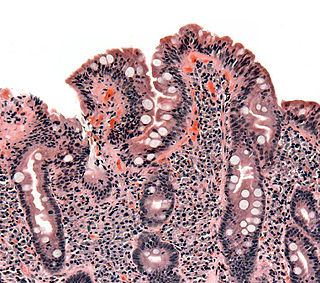 Biopsia de intestino delgado en la que se aprecia atrofia de las vellosidades intestinales, hiperplasia de las criptas y linfocitosis intraepitelial. | ||
| Especialidad | gastroenterología | |
| Sinónimos | ||
| ||



La celiaquía o enfermedad celíaca (EC) es un proceso crónico, multiorgánico autoinmune,[a] que lesiona primeramente el intestino y puede dañar cualquier órgano o tejido corporal.[14][17][18] Afecta a personas que presentan una predisposición genética.[19] [20] Está producida por una "intolerancia" permanente al gluten (conjunto de proteínas presentes en el trigo, avena, cebada y centeno –TACC– , y sus híbridos como el triticale, la espelta y el trigo Khorasan (kamut®)[21], y productos derivados de estos cereales),[22][23][24] pero no se trata de una simple intolerancia alimentaria ni mucho menos de una alergia, ni de un trastorno únicamente digestivo como tradicionalmente se consideraba.[25][26] Actualmente se sabe que es realmente una enfermedad sistémica,[19] [20] [27] ya que la respuesta inmunitaria anormal causada por el gluten puede dar lugar a la producción de diferentes autoanticuerpos que pueden atacar a cualquier parte del organismo.[14][18] Sin un tratamiento estricto, puede provocar complicaciones de salud muy graves, entre las que cabe señalar diversos tipos de cáncer (tanto del aparato digestivo, con un incremento del riesgo del 60 %, como de otros órganos), enfermedades cardiovasculares, trastornos neurológicos y psiquiátricos (conocidos como "neurogluten"), otras enfermedades autoinmunes y osteoporosis,[26] [28][29][30] [31][32][16][33] así como enfermedad celíaca refractaria (que no responde al tratamiento con la dieta) y en casos raros (principalmente en niños) la denominada "crisis celíaca", de aparición súbita y que puede ser mortal.[34][33][35][36][37]
No hay diferentes grados de gravedad de celiaquía sino distintas presentaciones: independientemente de si hay o no síntomas, de su tipo o intensidad, o de los órganos a los que afecten, el daño y el riesgo de complicaciones graves están siempre presentes si se consume gluten, aunque sean mínimas trazas por contaminación cruzada.[38]
Tras los recientes avances producidos en el conocimiento de la enfermedad celíaca, actualmente queda patente que no se puede identificar ni diagnosticar siguiendo los criterios empleados tradicionalmente, salvo en casos excepcionales.[39] Tanto los síntomas que se asociaban con la celiaquía como los criterios diagnósticos han evolucionado, la población tiene una creciente información y los profesionales de la salud necesitan actualizarse para adaptarse a esta nueva situación.[39]
Los síntomas que se creían siempre presentes en personas celiacas, que incluyen malabsorción grave con diarrea crónica, signos de malnutrición y retraso del crecimiento (presentación clásica), son actualmente excepcionales, especialmente en niños mayores de dos años y adultos. La mayoría de las personas de todas las edades presenta molestias digestivas leves o intermitentes y/o síntomas no digestivos (presentación no clásica).[39] Incluso una gran parte de enfermos celíacos son aparentemente asintomáticos a nivel digestivo,[19] [39] [40] [41] normalmente debido a que se han acostumbrado a vivir con un estado de mala salud crónica como si fuera normal[42][43] y al efecto opioide del gluten, que enmascara el daño intestinal.[44] Los síntomas que pueden aparecer son muy variados, no existe un patrón único definido, ni una clínica común para todos los pacientes, puesto que las presentaciones de la enfermedad son múltiples y muy diferentes. Puede cursar con diarrea o estreñimiento, con clínica digestiva florida o sin ningún síntoma digestivo, con pérdida de peso u obesidad, con retraso del crecimiento o crecimiento normal, con o sin abdomen abultado, con o sin otras enfermedades autoinmunes asociadas, etc.[39] Entre los signos y síntomas no digestivos, con frecuencia puede aparecer uno o más de los siguientes, que pueden fluctuar y variar con la edad: cansancio aumentado, dolores de cabeza, depresión, ansiedad, trastornos neurológicos, dolor de huesos o articulaciones, hormigueos o entumecimientos en manos o pies, huesos débiles y frágiles, problemas en la boca (como aftas, boca seca, alteraciones en el esmalte dental, lengua roja, lisa y brillante), dermatitis, procesos alérgicos, ferropenia o anemia, trastornos menstruales, infertilidad o abortos espontáneos, convulsiones, entre otros.[45][46] De hecho, a la celiaquía se la conoce como "la gran imitadora" o "la enfermedad de las múltiples caras".[47] [48] [49]
A diferencia de los criterios habitualmente utilizados por los expertos, las lesiones que la enfermedad celiaca provoca en el intestino delgado se limitan habitualmente a la presencia de una inflamación crónica de la mucosa duodenal, constituida principalmente por linfocitos, sin atrofia de las vellosides intestinales, especialmente en los niños mayores de dos años y los adultos. Actualmente, la presencia de atrofia de las vellosidades se considera un hallazgo menos frecuente.[19][50][51][52][40][53] También en contraposición de los criterios habitualmente empleados en la práctica clínica diaria, actualmente está reconocido que la celiaquía cursa frecuentemente con serología negativa (ausencia de anticuerpos específicos en sangre), especialmente la anti-transglutaminasa.[19][50][40][54][55][56][57] Esto se debe a que la anti-transglutaminasa se produce en la mucosa del intestino y con frecuencia, permanece depositada en ella sin pasar a la sangre.[20] [26][58] [59] Su evaluación en las biopsias duodenales es un nuevo método diagnóstico, que puede ayudar a detectar la enfermedad, pero es una técnica compleja, engorrosa y cara, por lo que su empleo no está generalizado en la práctica clínica habitual.[40][60][61] Esta prueba ha sido incluida en 2018 en España, como parte del nuevo protocolo para el diagnóstico precoz de la enfermedad celíaca.[62]
Clásicamente, se creía que se trataba de una enfermedad poco frecuente y que afectaba fundamentalmente a niños. Actualmente se sabe que la prevalencia mundial es elevada (aproximadamente 1-2 % de la población general)[18] y puede aparecer a cualquier edad.[32][45][63][64]
A fecha de 2019, se calcula que la mayoría de los celiacos en la mayoría de los países del mundo nunca llega a recibir un diagnóstico.[65] Esto es debido al escaso conocimiento sobre la celiaquía existente entre los profesionales de la salud, incluyendo médicos de cabecera, pediatras, gastroenterólogos y especialistas en general,[65][17][12][66] y a las dificultades del diagnóstico.[65][27][41][67] Cinco de cada seis celíacos (aproximadamente el 83 %) permanece sin diagnosticar.[42] En los niños, las cifras llegan a alcanzar el 90 %.[68] En aquellos que consiguen ser diagnosticados, el tiempo transcurrido desde el comienzo de los síntomas es habitualmente muy prolongado, con retrasos diagnósticos que pueden oscilar entre los siete y los cincuenta y nueve años,[69] período durante el que los pacientes acuden a repetidas consultas de diversos especialistas, los cuales por lo general, no piensan que la celiaquía pueda ser la enfermedad que causa sus diversas molestias.[70][71][72][73] No existe ninguna prueba que por sí sola pueda descartar la enfermedad celíaca.[27][74] Una gran parte de celiacos son diagnosticados por error como sensibilidad al gluten no celíaca.[40]
El único tratamiento actualmente disponible consiste en el seguimiento de una dieta sin gluten estricta y de por vida, cuyo cumplimiento continuado produce la mejoría de los síntomas y evita o disminuye la aparición de las numerosas enfermedades y complicaciones asociadas.[19][28] La media para la recuperación completa del intestino suele oscilar entre dos y cinco años.[10] La dieta sin gluten estricta parece tener un papel protector contra el desarrollo de cánceres en los celíacos[28] y es la única opción para prevenir contra ciertos raros tipos de cáncer, muy agresivos.[75] No obstante, el retraso en el diagnóstico de la celiaquia aumenta la probabilidad de desarrollar malignidad.[28] El efecto protector es más eficaz cuando la dieta sin gluten se inicia en edades tempranas,[76] especialmente durante el primer año de vida.[75]
El cumplimiento de la dieta en los celíacos es mucho peor de lo que tradicionalmente se consideraba por parte de los científicos y especialistas.[77] Estudios actuales demuestran que aproximadamente el 80 % de los celíacos continúa teniendo lesión intestinal, a pesar del tratamiento mantenido con la dieta sin gluten.[78] La principal causa de esta falta de recuperación es la ingesta inadvertida de gluten, principalmente debida a contaminaciones cruzadas.[12][79] Un meta-análisis de 2018 concluye que la mayoría de los celiacos, especialmente los adultos, pero también los niños, sigue ingiriendo gluten con regularidad, de manera involuntaria, a pesar de estar haciendo una dieta sin gluten.[80] Con frecuencia, las personas con una educación básica pobre y una baja comprensión de cómo se realiza una dieta sin gluten creen que están siguiendo estrictamente la dieta, pero están cometiendo errores frecuentes.[12][13] Un problema habitual es la poca conciencia del paciente para evitar las contaminaciones por gluten en la preparación de sus alimentos y otras fuentes comunes de gluten,[81] como la avena, las hostias de comunión, las bebidas malteadas, los medicamentos, los alimentos procesados, las comidas en restaurantes y eventos sociales.[81][82][83] Comer fuera supone un gran riesgo puesto que a pesar de ofrecer un menú "libre de gluten", muchos establecimientos (restaurantes, comedores escolares, etc.) no siguen estrictamente las normas para evitar la contaminación cruzada.[11][84] El gluten también puede afectar por inhalación.[85] A fecha de 2018, salvo en Brasil,[86] no es obligatorio en ningún país del mundo etiquetar los productos como "Sin Gluten" ni tampoco declarar la presencia de trazas de gluten, por lo que la simple lectura del listado de ingredientes no permite saber si un producto es seguro.[77][87][88] Si la supresión del gluten no es completa y mantenida de por vida, persisten el daño en la mucosa intestinal, la activación inmunitaria y el riesgo de desarrollar complicaciones de salud muy graves.[28]
Ninguno de los métodos que se emplean hasta la fecha (2018) para evaluar el cumplimiento estricto de la dieta sin gluten es objetivo ni fiable: cuestionarios rellenados por los pacientes, evaluación de los síntomas, determinación de los anticuerpos específicos de la celíaca y hallazgos en las biopsias duodenales.[10][80][89] Ni la ausencia de síntomas digestivos, ni la negatividad de los anticuerpos garantizan que exista una recuperación de la mucosa intestinal, cuya valoración mediante las biopsias es complicada.[10][11] Esto se debe a que las lesiones del intestino suelen consistir en cambios mínimos, sin atrofia de las vellosidades, difíciles de identificar.[10] Desde 2017 está disponible un nuevo método basado en la detección de gluten en muestras de orina o heces para uso profesional y desde enero de 2018 en versión para uso doméstico, que ha demostrado su eficacia en estudios científicos para controlar el cumplimiento de la dieta y detectar contaminaciones por trazas.[10][90]
Historia[editar]
Las primeras descripciones sobre celíacos datan de hace aproximadamente 2000 años. Fueron realizadas durante los siglos I y II d. C. por el médico griego Areteo de Capadocia, en la zona donde nació el cultivo de trigo y cebada durante el período Neolítico.[91] La describió como "... una enfermedad celíaca de naturaleza crónica ...",[91] nombre derivado de la palabra griega koiliakos (trastorno del intestino).[26]
Durante la década de 1940, el pediatra neerlandés Willem Karel Dicke observó que la escasez de trigo motivada por la Segunda Guerra Mundial disminuyó casi a cero las muertes de los niños celiacos y que una vez que el trigo estuvo de nuevo disponible, la tasa de mortalidad subió a los niveles previos.[92][93] En 1950 demostró que si se excluía el trigo, la avena y el centeno, la celiaquia mejoraba drásticamente.[91] Dos años más tarde, Anderson demostró que el gluten era el factor perjudicial.[26][94]
En 1962 se apuntó por primera vez que el linfoma de intestino delgado era una complicación de la enfermedad celíaca.[91] Actualmente, se conoce la asociación de la celiaquia sin tratamiento con diversos tipos de cáncer.[75][28]
En 1965 se confirmó la relación con la dermatitis herpetiforme.[91]
En 1992 se descubrió que la enfermedad celiaca también cursa sin atrofia vellositaria (inflamación intestinal sin atrofia de las vellosidades).[95][96]
En 2010, la comunidad científica reconoció oficialmente la sensibilidad al gluten no celíaca, en la que todas las pruebas para enfermedad celíaca son normales, pero hay una mejoría con la dieta sin gluten, aproximadamente 30 años después de que fueran descritos los primeros casos.[97][98][40][60]
Epidemiología[editar]

La celiaquía es un proceso con una elevada prevalencia mundial, que afecta aproximadamente al 1-2 % de la población general,[18] pero está aún claramente subestimada y, por tanto, insuficientemente diagnosticada.[27] [99] [100] [101] [102] [103] Representa un importante problema de Salud Pública a nivel mundial y es fundamental que exista un mayor conocimiento de las características clínicas de la enfermedad, para que los médicos, tanto generales como de digestivo, pediatras y de otras muchas especialidades, piensen en ella y la diagnostiquen con una mayor frecuencia y lo más precozmente posible.[19] [27] [66]
Aunque tiene una base genética bien definida, puede aparecer en cualquier edad de la vida, tanto en niños como en adultos, siendo un 20 % de los casos diagnosticados en individuos mayores de 60 años.[32][45] [63] [64]
Presenta una distribución universal bastante uniforme y afecta casi por igual a todas las razas. Se han descrito frecuencias similares en áreas geográficas muy distantes, como pueden ser Australia, Argentina e Israel, si bien es objeto de debate si el empleo de un único método serológico (cuantificación de los niveles sanguíneos del anticuerpo específico de la enfermedad celíaca anti-transglutaminasa tisular) puede llevar a infravalorar los resultados obtenidos.[27] [104][105][106]
En España se han realizado diversos estudios epidemiológicos que encuentran hallazgos similares tanto en población general como en donantes de sangre.[27][102][103] En una estimación aproximada, podría haber entre 3,5-4,5 millones de personas afectadas por celiaquía en toda Europa y entre 500 000-900 000 en España, de las que se calcula que en la actualidad solo en torno a un 10-20 % de los casos están realmente diagnosticados.
Etiología[editar]
La enfermedad celíaca es inducida por el consumo de gluten, un conjunto de proteínas contenidas en la harina de diversos cereales, fundamentalmente el trigo, pero también la avena, la cebada y el centeno, o cualquiera de sus variedades e híbridos (escanda, espelta, kamut y triticale, entre otros).[22][23][24][107] Se han documentado casos de celíacos que no mejoraban con la dieta sin gluten, debido a la inhalación de partículas ambientales.[85]
La enfermedad aparece en individuos genéticamente predispuestos. Su base hereditaria más conocida se relaciona con el sistema de antígenos leucocitarios de histocompatibilidad (HLA) de clase II y sus marcadores más habituales son el HLA-DQ2, que es el principal, apareciendo en el 85-95 % de los casos, y el HLA-DQ8 en una menor proporción (5-10 % de los casos), muy lejana del anterior.[27]
Un pequeño porcentaje de casos, generalmente inferior al 5 %, carece de estos dos marcadores conocidos de riesgo para desarrollar la celiaquía, por lo que es bastante probable que puedan encontrarse otros marcadores genéticos secundarios, preferentemente de clase HLA-I, y también otros más localizados del complejo principal de histocompatibilidad.[27]
Aparte del gluten, entre los factores ambientales que pueden desempeñar un cierto papel en el desencadenamiento y/o aparición de la enfermedad celíaca, se encuentran la lactancia materna, que en general retrasa (aunque no previene) la aparición de la enfermedad, la edad de introducción de los alimentos con gluten en la dieta del bebé, ciertas infecciones intestinales o los viajes a países tropicales o subdesarrollados, así como algunas intervenciones quirúrgicas abdominales en el adulto.[19][27]
Algunas circunstancias pueden ser el detonante del debut de la enfermedad, como una infección intestinal, una intervención quirúrgica abdominal, el embarazo, cambios de alimentación, viajes al extranjero, etc.[19]
Patogenia[editar]


La celiaquia se desencadena en personas genéticamente predispuestas como consecuencia de la interacción entre el gluten y otros factores ambientales exógenos, y la respuesta inmunitaria. Se induce por la ingesta de gluten, a través de una fracción denominada gliadina.[27]
La gliadina es la fracción soluble en alcohol del gluten. Es una proteína rica en residuos de glutamina y prolina, y contiene la mayor parte de los productos tóxicos. Las moléculas de gliadina no digeridas, tales como la fracción alfa (que contiene 33 aminoácidos), son resistentes a la degradación por las secreciones gástrica, intestinal y pancreática. La existencia de un aumento de la permeabilidad en la barrera epitelial del intestino delgado debido al aumento de la señalización por parte de la zonulina (independientemente de la predisposición genética, es decir, tanto en celíacos como en no celíacos la gliadina aumenta la síntesis intestinal de zonulina ) permite que estos péptidos la atraviesen y reaccionen con las células presentes en la submucosa o lámina propia, lo cual desencadena una respuesta inflamatoria mediada por linfocitos T colaboradores tipo 1. Esta respuesta se caracteriza por la producción de un proceso inflamatorio, desencadenado por linfocitos CD4+ a nivel de la lámina propia o submucosa, que reconocen a los péptidos de la gliadina que son presentados por las células dendríticas ayudadas por moléculas HLA de clase II, del tipo DQ2 y DQ8. A continuación, se libera una serie de citoquinas pro-inflamatorias tales como el interferón gamma (IFN-γ) y el factor de necrosis tumoral alfa (TNF-α), entre otras, que favorecen la producción de la hiperplasia de criptas y la aparición de la lesión epitelial.[27]
Los péptidos de gliadina también tienen la capacidad de activar la respuesta inmunitaria innata, caracterizada por una expresión aumentada de interleuquina 15 por parte de los enterocitos, lo que provoca la llegada y estimulación de los linfocitos intraepiteliales que expresan el receptor NK-G2D, un marcador natural de las células citolíticas (natural killer [NK]), las cuales son citotóxicas y destruyen las células del epitelio intestinal. El mecanismo de interacción entre los procesos que se producen en la submucosa y en el epitelio todavía no está del todo aclarado.[27]
Las lesiones que la celiaquía provoca en el intestino delgado de un celíaco no se limitan a la presencia de atrofia de las vellosidades intestinales, sino que con frecuencia consisten en cambios mínimos, con inflamación leve o moderada, especialmente en los niños mayores de dos años y los adultos.[19][50][51][52] [40]
Cursa frecuentemente con serología negativa (ausencia de anticuerpos específicos en sangre), especialmente la anti-transglutaminasa,[19][50][40] ya que está elevada en relación con la presencia de atrofia de vellosidades, que no se encuentra en jóvenes ni en adultos por lo general.[40][53][54][55][56][57]
Cuadro clínico[editar]
Las manifestaciones clínicas de la enfermedad celíaca son muy diferentes, según la edad de presentación de la enfermedad y otros factores exógenos.[27]
Los casos de presentación clásica de la enfermedad, que incluyen manifestaciones de un síndrome de malabsorción grave con esteatorrea y signos de malnutrición, son actualmente excepcionales, especialmente en niños mayores de 2 años y adultos. Incluso una parte de enfermos celíacos son completamente asintomáticos a nivel digestivo por períodos de tiempo prolongados.[19][41][39]
Lactantes[editar]
Puede debutar en los lactantes en los primeros 6 meses de la vida, provocada probablemente por la exposición a los niveles de gliadina no degradada presentes en la leche materna (superiores en el calostro) de mujeres que ingieren una dieta no exenta de gluten, pero lo más habitual es que se manifieste de forma más evidente, a partir de los 6 meses de vida, cuando comienzan a tomar los bebés las papillas de cereales en la alimentación, elaboradas habitualmente con harina de trigo. Existe un debate muy prolongado, acerca de cuándo se debería de introducir el gluten en la dieta del bebé. La opinión más generalizada y lo que parece más conveniente sería retrasarlo lo más posible, hasta que al menos haya cumplido el primer año.[111][112]
Niños[editar]
En los niños, la celiaquía suele debutar a partir de los 6 meses de edad y en las formas con síntomas digestivos intensos, aparece por lo general antes de los 2 años. Se presenta habitualmente en forma de intolerancia alimenticia, con náuseas y vómitos de repetición, acompañados normalmente de un cuadro de diarrea crónica, con distensión abdominal, pérdida de peso y retraso de crecimiento, que constituyen la denominada “forma clásica” o “tríada” característica de la enfermedad. Pero también se presenta con relativa frecuencia con síntomas variados tales como la falta de apetito, vómitos, irritabilidad e incluso estreñimiento pertinaz, que puede ser muy llamativo y en ocasiones se convierte en el síntoma principal.[27]

Cuando la enfermedad aparece más tardíamente, en niños mayores de 2 años, o en la adolescencia, pueden aparecer diversas manifestaciones extraintestinales, tales como anemia ferropénica, cefaleas migrañosas, artritis, pruebas hepáticas alteradas, síntomas neurológicos y afectación cutánea, entre otros.[113]
Las formas de presentación en el niño mayor (a partir de la edad de 2 años)[41] y en el adulto son muy variadas y menos características, por lo que se denominan «formas atípicas» o «no clásicas». La diarrea aparece en menos del 50 % de los pacientes y la pérdida de peso es poco llamativa.[114][115] De hecho, tanto niños como adultos con la enfermedad activa pueden desarrollar obesidad. Más del 50 % de los adultos presenta sobrepeso en el momento del diagnóstico y solo el 15 % está por debajo de su peso normal, con tasas algo inferiores en los niños.[51]
Adultos[editar]
En los adultos, la enfermedad celíaca se presenta con una frecuencia 2-3 veces mayor en las mujeres que en los varones, igual que ocurre en la mayor parte de las enfermedades autoinmunes. También la anemia ferropénica y la osteoporosis son procesos frecuentemente asociados con la celiaquía, especialmente en la mujer,[27] en las que se comete con frecuencia el error de atribuir la presencia de anemia ferropénica a los sangrados menstruales, sin realizar otras evaluaciones.[116]
Asimismo, los niveles de calcio sanguíneo no son indicativos del estado de la masa ósea, para lo que se requiere una densitometría, la cual no se suele realizar hasta el momento de la menopausia, por lo que muchos cuadros de descalcificación pasan inadvertidos durante la mayor parte de la vida de la paciente.[117]

Se ha descrito que la sintomatología de la celiaquía podría compararse gráficamente como un “iceberg”, en el que la parte visible y clínicamente manifiesta corresponde a las denominadas “formas clásicas”, que predominan en la temprana infancia, mientras que las “formas no clásicas” u oligosintomáticas son las que aparecen de forma predominante en los niños mayores de 2 años, adolescentes y adultos en general, constituyendo su parte oculta muy importante, ya que representan más del 75 % de los casos.[27][41]
Las manifestaciones extra-digestivas pueden ser múltiples y de naturaleza muy variada, como son la anemia crónica, la osteoporosis, el estreñimiento, diversos síntomas y signos neurológicos, lesiones cutáneas del tipo de la dermatitis herpetiforme, hipoproteinemia, hipocalcemia y/o pruebas de función hepática persistentemente alteradas.[118] Muchas de ellas están en relación con la presencia de carencias crónicas de diversos oligoelementos, por su dificultad de absorción intestinal, y otras son de carácter autoinmune. En conjunto forman una «amalgama proteiforme» de enfermedades asociadas, todas ellas con un denominador común, que es la intolerancia al gluten (Tabla 1).
Muchos pacientes presentan una larga historia de la enfermedad, basada en diversas y reiteradas molestias digestivas y extra-digestivas asociadas, que han precisado múltiples hospitalizaciones, habiendo recibido diferentes diagnósticos no bien definidos llegando incluso a someterse a diversas intervenciones quirúrgicas innecesarias, con indicaciones poco claras, antes de llegar al diagnóstico definitivo de enfermedad celiaca.[119]
En ocasiones, esta se diagnostica a través de una endoscopia digestiva alta indicada por otros motivos, como pueden ser síntomas de reflujo gastroesofágico o anemia crónica de origen no aclarado, y por esta razón se recomienda la toma de biopsias duodenales múltiples de forma rutinaria ante la menor duda o sospecha, para poder así confirmar su presencia, evitando tener que repetir la prueba, que resulta molesta por lo general.[120]
Síndrome del intestino irritable[editar]
Los pacientes con dispepsia funcional o síndrome de intestino irritable, de acuerdo con los criterios clínicos de Roma III, pueden ser en realidad celíacos en un 30-60 % de los casos, ya que presentan una sintomatología muy similar y el diagnóstico de estos procesos funcionales es en gran parte realizado por exclusión de otros procesos orgánicos digestivos, pero sin realizar, por lo general, ni pruebas funcionales ni toma de biopsias duodenales.[121]
Dermatitis herpetiforme[editar]
Las lesiones cutáneas que se agrupan bajo la denominación de dermatitis herpetiforme (DH) son muy características en la celiaquía. Se caracterizan por la aparición de múltiples vesículas, conteniendo un líquido de color claro o ambarino, que evolucionan con la aparición de costras y fisuras. Se distribuyen por cualquier parte del cuerpo, pero tienen especial predilección por la superficie extensora de las extremidades (codos y rodillas), así como por las palmas de las manos, planta de los pies, pudiendo afectar también al cuero cabelludo. Suelen tener un predominio por zonas de roces y presentan una distribución simétrica por lo general, afectando simultáneamente a ambos brazos o piernas. También pueden afectar al abdomen y ambos glúteos. Se acompañan de intenso picor, apareciendo con una frecuencia de uno por cada 4 pacientes celíacos (25 %).[122][123]
Tanto la exposición a los rayos ultravioletas de la luz solar como los microtraumas son factores externos desencadenantes, que favorecen la aparición y mantenimiento de las lesiones cutáneas típicas de la dermatitis herpetiforme.[124]
Son tan características, que se consideran “la enfermedad celíaca de la piel”, así como la «tarjeta de visita» del paciente celíaco, ya que su hallazgo aparece solo en individuos celiacos y, por tanto, su presencia por sí sola es un pilar fundamental para el diagnóstico de la celiaquía. Desaparecen por completo con la dieta sin gluten (DSG), que constituye su mejor y único tratamiento. Las lesiones cutáneas pueden reaparecer en pacientes que tienen en apariencia un buen seguimiento de la DSG, por transgresiones de la dieta tanto voluntarias como inadvertidas.[123]
Dificultad para la identificación de los síntomas[editar]
Muchas personas celíacas sin diagnosticar infravaloran sus múltiples y frecuentes molestias, tanto digestivas como generales, porque se han acostumbrado a vivir con un estado de mala salud crónica como si fuera normal, y solo son capaces de reconocer que en realidad sí tenían síntomas relacionados con la enfermedad celíaca cuando comienzan la dieta sin gluten y se hace evidente la mejoría, en contraste con la situación previa a la dieta.[42][43] Es difícil relacionar con la ingesta de gluten la aparición de los diversos y variados síntomas digestivos y extra-digestivos que presenta la celiaquía, por diversas razones que se exponen a continuación.
El gluten está presente en nuestra alimentación de manera continuada y de forma ininterrumpida, desde los primeros meses de la vida. Se ha confirmado la presencia en leche materna de altos niveles de gliadina no degradada (superiores en el calostro) en las mujeres que se alimentan de una dieta normal, que el bebé ingiere durante la lactancia.[125] Posteriormente, se introduce en la alimentación, generalmente a partir de los 6 meses de edad, en forma de cereales, papillas, panes, galletas, aditivos, etc.
En la práctica sucede que normalmente estamos comiendo gluten inadvertidamente en cualquiera de las comidas diarias en principio aparentemente libres de gluten, bien como aditivo o bien como consecuencia de la existencia de contaminaciones cruzadas.[42][126] A ello hay que sumar que las reacciones que origina pueden ser retardadas, horas, días o incluso semanas,[9] y que las lesiones causadas por el gluten en la mucosa duodenal tardan en desaparecer por completo de dos a cinco años desde el comienzo de la supresión estricta del gluten en la alimentación.[10]
Asimismo, el gluten ejerce un efecto opioide sobre el tubo digestivo, adormeciendo y ocultando sus reacciones naturales, y enmascarando el daño intestinal.[61][44] En ocasiones sucede que se pueden notar las intolerancias a otros alimentos (la más típica a la lactosa), pero pasan inadvertidas las reacciones al ingerir el gluten.
Además, hemos aprendido a convivir, aceptándolos como normales, con los numerosos síntomas digestivos difusos que alertan sobre la presencia de una posible celiaquía o de una sensibilidad al gluten no celíaca, que se suelen presentar de manera fluctuante e incluso con largos períodos de completa remisión, tales como malas digestiones, gases, distensión abdominal, heces deshechas, intolerancias a alimentos, etc.[118][127][128][129] Una gran parte de estos pacientes nunca consulta con el médico y quienes lo hacen, a menudo presentan un alto grado de ansiedad debido a la persistencia de sus síntomas, lo que provoca que el médico emita en ocasiones un juicio de neuroticismo, hipocondriasis o trastorno por somatización;[130] cerca del 60 % han sido diagnosticados de uno o más trastornos funcionales digestivos; y más de la mitad han sido sometidos a diversos estudios radiológicos y/o endoscópicos, sin obtener resultados para el alivio de sus síntomas.[131] La celiaquia es un trastorno de base genética de elevada penetrancia y con un muy alto porcentaje de infradiagnósticos, pues se estima que aproximadamente el 70-90 % de los celíacos está sin diagnosticar en la actualidad.[99][100][101][102][103] La posibilidad de existencia de casos sin reconocer entre familiares es, por tanto, muy elevada, lo que contribuye a esa aceptación de síntomas en el seno de las familias y a que no sean reconocidos como señales de alarma.
Tabla de síntomas y signos[editar]
Se debe considerar que:
- No existe un patrón común para poder encajar a todos los pacientes celíacos, ya que su sintomatología clínica es muy variada.
- Las formas de presentación de la enfermedad celíaca más frecuentes son las denominadas "no clásicas", que predominan en los adultos, pero que también aparecen en niños por encima de los 2 años y en jóvenes a cualquier edad.
- Las formas clásicas únicamente aparecen en niños menores de 2 años.
- Las presentaciones clínicas son múltiples y variadas, con presencia de uno o varios síntomas, signos y/o enfermedades asociadas, y variaciones en el mismo sujeto dependiendo de la edad.
- Es habitual presentar formas asintomáticas a pesar de estar activa la enfermedad, especialmente durante la adolescencia.
- Es preciso realizar una historia clínica completa desde la infancia del paciente, con búsqueda activa de la presencia de cualquier síntoma, signo y/o enfermedades asociadas, teniendo en cuenta las distintas manifestaciones de la enfermedad en el mismo sujeto, dependiendo de la edad.
- La presencia de otros casos en la familia, ayuda a orientar el diagnóstico. La enfermedad celíaca es una enfermedad autoinmune de base genética de elevada penetrancia y con un muy elevado porcentaje de infradiagnósticos (90 % de celíacos sin diagnosticar). Se debe realizar un estudio familiar buscando casos potenciales o manifiestos, que estaban previamente desconocidos.
- La enfermedad celíaca se puede presentar a cualquier edad de la vida y hasta un 20 % de los casos se diagnostica en pacientes mayores de 60 años.
| Tabla 1. MANIFESTACIONES DE LA ENFERMEDAD CELÍACA | ||
|
No existe un patrón para encajar al enfermo celíaco. Presentaciones que oscilan desde completamente asintomáticas a uno o varios de estos síntomas o signos, de manera continuada o intermitente en el mismo sujeto, que pueden modificarse o evolucionar según la edad. Es preciso realizar una historia clínica completa desde la infancia del paciente, con búsqueda activa de la presencia de cualquier síntoma, signo y/o enfermedad asociada, pasados o presentes. | ||
| SÍNTOMAS | SIGNOS | |
| PRESENTACIÓN CLÁSICA
(MINORITARIA) Predomina en niños pequeños (<2 años) |
Diarrea crónica.
Anorexia (falta de apetito). Náuseas y/o vómitos. Dolor abdominal recurrente. Pérdida de peso. Estreñimiento, en ocasiones muy llamativo en la infancia. Astenia (cansancio). Irritabilidad. Apatía. Desinterés. Desmotivación en general. Depresión. Trastornos del sueño. Intolerancias alimenticias (lactosa, fructosa, sorbitol, caseína de la leche de vaca, horceínas, etc.). |
Desnutrición leve, moderada e incluso intensa.
Distensión abdominal fluctuante. Hipotrofia muscular. Retraso estato-ponderal (retraso del crecimiento, retraso del desarrollo y/o pérdida de peso). Palidez de piel y mucosas. Edemas en tobillos. Lesiones cutáneas recurrentes. |
| PRESENTACIÓN NO CLÁSICA
(MAYORITARIA) Predomina en niños >2 años, jóvenes y adultos |
Frecuentemente asintomáticos.
Procesos recurrentes de vías respiratorias altas de naturaleza inmuno-alérgica:
Síntomas digestivos intermitentes y/o alternantes, con períodos de remisión:
Síntomas que simulan un síndrome del intestino irritable. Menarquia retrasada. Irregularidades menstruales. Trastornos reproductivos:
Disnea de medianos esfuerzos. Cefaleas recurrentes tipo migrañas. Crisis de tetania. Calambres musculares. Dolores musculares generalizados tipo fibromialgia. Dolores óseos y/o articulares. Antecedente de fracturas de repetición (ante traumatismos banales). Parestesias, Hormigueos. Caída del cabello. Uñas frágiles. Síntomas neuro-psiquiátricos:
|
Palidez de piel y/o mucosas.
Talla baja. Pérdida de peso. Sobrepeso. Hinchazón general fluctuante. Distensión abdominal. Erupciones cutáneas diversas:
Diversas colagenosis. Aftas bucales recurrentes. Polineuropatía periférica. Miopatía proximal. Hipoplasia del esmalte dentario. Debilidad muscular. Dolores óseos generalizados. Poliartritis localizada o difusa. Edemas maleolares. Crisis de tetania. Hematomas espontáneos múltiples. |
Grupos de riesgo y enfermedades asociadas[editar]
Los familiares de primer grado de un caso confirmado con biopsia duodenal presentan una prevalencia media en torno al 12 %. Los de segundo grado también tienen mayor grado de afectación que la población general, como se pone de manifiesto al realizar estudios familiares, que son muy convenientes siempre que se diagnostique a un paciente de enfermedad celíaca.[134][135]
Los pacientes con síndrome de Down presentan celiaquía asociada con una frecuencia aumentada, del orden del 5-12 %. También está incrementada en otras alteraciones genéticas como el síndrome de Turner, el síndrome de Williams, el déficit de IgA y una gran variedad de procesos de naturaleza autoinmunitaria. Por ejemplo, los pacientes con Diabetes Mellitus tipo 1 presentan una elevada frecuencia de enfermedad celíaca asociada, en un porcentaje que oscila entre el 3 y el 8 %. El tratamiento de la celiaquía con la dieta sin gluten (DSG) en la diabetes juvenil no es capaz de curarla, pero facilita enormemente la consecución de un mejor control metabólico, ayuda a prevenir ciertas complicaciones, mejora la calidad de vida de los pacientes y reduce notablemente las necesidades de insulina.[136]
Las enfermedades tiroideas se asocian con la enfermedad celíaca con una frecuencia media en torno al 5 %, pueden cursar con hiperfunción, hipofunción o normofunción y muestran una elevada prevalencia de anticuerpos antitiroideos positivos (en torno al 25 % de los casos). Al igual que ocurre en los diabéticos, en la mayor parte de los casos la DSG ayuda a corregir la disfunción tiroidea asociada, permite disminuir la dosis del tratamiento hormonal sustitutivo, e incluso consigue que este pueda retirarse.[137]
Además de la dermatitis herpetiforme, ejemplo claro de enfermedad cutánea inducida por el gluten, con manifestaciones extradigestivas asociadas,[122] la celiaquía puede presentarse asociada a muchas otras enfermedades de diversos órganos y de diversa naturaleza, como hepáticas, neurológicas, óseas, reumatológicas, cardíacas y renales, así como con diversas colagenosis y otros procesos varios.[138] [139][140] [141] (Tabla 2).
Algunos autores, como Ventura et al,[142] han relacionado la presencia de procesos autoinmunitarios en la enfermedad celíaca con el tiempo de exposición al gluten. Así, cuando la enfermedad se diagnostica tardíamente en la infancia o en la juventud, se estima que el riesgo relativo de presentar algún proceso autoinmunitario asociado a lo largo de la vida es de unas 7 veces mayor.
| Tabla 2. GRUPOS DE RIESGO Y ENFERMEDADES ASOCIADAS | ||
|
Familiares de primero y segundo grado. Síndrome de Down. Síndrome de Williams. Síndrome de Turner. Enfermedades autoinmunes y otras inmunopatías:
Enfermedades endocrinas:
Trastornos neurológicos y psiquiátricos:
|
Enfermedades hepáticas:
Enfermedades reumáticas:
Enfermedades cardíacas:
Enfermedades dermatológicas:
Otras asociaciones:
| |
Diagnóstico[editar]

El diagnóstico es más difícil en el adulto y niño mayor de 2 años, por tratarse en general de casos con una menor afectación digestiva, que con mayor frecuencia se asocian a síntomas no clásicos y pueden acompañarse de diversos procesos autoinmunitarios.[27][41][143] Actualmente se diagnostican más pacientes celíacos en la edad adulta que en la infancia.[144] [145]
El retraso medio en la celiaquía entre el comienzo de los síntomas y el momento del diagnóstico es habitualmente muy prolongado, con una media de unos diez años en la mayor parte de los casos, con límites amplios que pueden oscilar entre los 7 y los 59 años,[69] período durante el cual los pacientes acuden a repetidas consultas de diversos especialistas, los cuales por lo general, no piensan que la celiaquía pueda ser la enfermedad que causa sus diversas molestias.[70] [71] [72] [73]
Criterios diagnósticos[editar]

Lo principal para conseguir el diagnóstico de la enfermedad celíaca radica en que el médico piense en su posible existencia y la incluya en el diagnóstico diferencial, considerando la amplia variedad de signos y síntomas distintos que pueden aparecer en cada paciente, o en el mismo paciente por temporadas, y que hacen que pueda ser confundida u ocultada por muchos otros trastornos.[19][27][47][48][45] [146] El hecho de que la celiaquía curse con frecuencia con síntomas digestivos leves o inexistentes, pero con diversas enfermedades asociadas y síntomas no digestivos, hace que permanezca sin reconocer, pues los esfuerzos médicos se centran en diagnosticar y tratar las complicaciones, pero no se busca un posible origen en la enfermedad celiaca.[14]
Para realizar su diagnóstico, es imprescindible recoger una cuidadosa historia clínica del paciente, incluyendo sus antecedentes desde la temprana infancia, relacionando sus molestias con la ingestión de alimentos ricos en gluten, así como elaborar una completa historia familiar de celiaquía, problemas digestivos y una búsqueda activa de las enfermedades más frecuentemente asociadas a la celíaca, tales como trastornos autoinmunes, rinitis crónica recurrente, episodios de faringoamigdalitis, otitis, sinusitis, asma bronquial y otros procesos de naturaleza inmuno-alérgica.[45]
No existe ninguna prueba que por sí sola sea capaz de diagnosticar la enfermedad celíaca de manera concluyente o, por el contrario, excluirla definitivamente.[27][40]
Hay que reconocer la presencia de la celiaquía ante una amplia variedad de síntomas en apariencia independientes y dispersos, en combinación con una serie de alteraciones de laboratorio e histopatológicas. Como se llega más fácilmente al diagnóstico es con la combinación de los datos clínicos, analíticos, de la biopsia duodenal y de la respuesta a la dieta sin gluten (DSG).[27]
Para el estudio de las biopsias duodenales, es fundamental recurrir a la utilización sistemática de la clasificación de Marsh en todos los servicios de Anatomía Patológica. Su utilización ayuda mucho al reconocimiento de casos ocultos y dudosos, permite emplear un lenguaje común, clasificar mejor los hallazgos y comprender que no es imprescindible la presencia de atrofia vellositaria para confirmar el diagnóstico, pues, como sucede con los síntomas, el espectro morfológico de las lesiones duodenales es muy amplio.[19][27]
Marcadores serológicos[editar]
El primer paso ante la sospecha clínica de una enfermedad celíaca, consiste en la realización mediante un análisis de sangre de la determinación de la presencia de los denominados “marcadores serológicos” de la celiaquía, que son los anticuerpos frente al gluten. Los empleados habitualmente son los anticuerpos anti-transglutaminasa tisular del tipo 2 (anti-TGt, anti-TG o TGt), de la clase IgA. Su determinación es sencilla, rápida y asequible, estando disponible por la mayor parte de laboratorios clínicos.[50][19]
No obstante, una serología negativa (ausencia de anticuerpos en sangre) no permite excluir por sí sola, el diagnóstico de celiaquía. Como se recoge en el Protocolo de Diagnóstico Precoz de la Enfermedad Celíaca del Ministerio de Sanidad de España, tanto en la primera versión de 2008 como en la actualización de 2018 (páginas 49 y 65, respectivamente):[19][62]
Los marcadores serológicos (anti-TG) (anticuerpos anti-transglutaminasa) resultan de elección para iniciar el despistaje de los pacientes con mayor probabilidad de presentar EC (enfermedad celíaca). Una serología negativa no permite excluir el diagnóstico de EC. De hecho, una proporción de pacientes con enfermedad celíaca, que presentan formas histológicas leves e incluso con atrofia de vellosidades, no expresan anticuerpos antitransglutaminasa en el suero.
Esto es aplicable tanto a niños como adultos, como se recoge en la página 66 del Protocolo de Diagnóstico Precoz de la Enfermedad Celíaca del Ministerio de Sanidad de España de 2018:[62]
En pacientes pediátricos, ante una serología negativa, (...) a pesar de este resultado, si el paciente cuenta con una elevada probabilidad clínica, especialmente en grupos de riesgo, sería conveniente derivar al pediatra gastroenterólogo.
Anticuerpos Anti-Transglutaminasa tisular del tipo 2 (anti-TGt o TGt).[editar]
Los anticuerpos anti-transglutaminasa fueron descubiertos en estudios clínicos realizado solo en bebés o niños muy pequeños con presentación clásica, cuando se pensaba que la celiaquía era una enfermedad de la infancia en la que siempre había malabsorción, diarreas crónicas y atrofia de las vellosidades. Se difundió y generalizó por todo el mundo su empleo con gran optimismo como método único para seleccionar los pacientes con sospecha de celiaquía y así evitar la realización de biopsias "innecesarias". A pesar de que años después se ha comprobado su escaso o nulo valor en la mayoría de los casos y que los hallazgos no son representativos ni extrapolables al total de los enfermos, la mayoría de profesionales continúa empleándolos como método de criba para "descartar" la enfermedad celíaca si son negativos y así evitar la realización de biopsias duodenales.[147][55] [148]
Los anticuerpos anti-trasnglutaminasa son positivos aproximadamente en el 90 % de los casos en los que hay atrofia marcada de las vellosidades intestinales. Sin embargo, solo son positivos en el 10-20 % de los celiacos que tienen inflamación intestinal sin atrofia de vellosidades, que son las presentaciones de la enfermedad que predominan en niños mayores de 2 años y adultos, por lo que es muy frecuente el hecho de encontrar una gran mayoría de casos de enfermedad celíaca con serología negativa.[55] [148]
Asimismo, no hay una unificación de criterios y cada laboratorio clínico establece los límites de positividad en función de sus resultados y controles previos, pero recientes estudios demuestran que las diferentes casas comerciales señalan valores límites de sensibilidad diagnóstica para los anticuerpos anti-transglutaminasa que resultan muy elevados, por lo general. Las recomendaciones actuales de expertos en celiaquía son rebajar el umbral y, en la mayor parte de los casos, considerar positiva una discreta elevación de la anti-transglutaminasa (por encima de 2-3 U/ml).[45][149][150][151] El laboratorio debe expresar los resultados con cifras numéricas indicando la clase de inmunoglobulina, siendo insuficiente informar “positivo” o “negativo”, desperdiciando el potencial informativo de la cifra numérica.[152]
Siempre se deben cuantificar los niveles séricos de IgA del paciente, ya que si presenta una deficiencia marcada de IgA (menor de 0,05 g/l), se producen falsos negativos y hay que determinar los anticuerpos de la clase IgG, que en general son menos informativos, salvo los anti-péptidos deaminados de gliadina. La deficiencia selectiva de IgA se presenta con una frecuencia 10 veces mayor en pacientes con enfermedad celíaca (1/40) que en población general (1/400).
Otros[editar]
Otros marcadores serológicos disponibles son:
- Los anticuerpos anti-gliadina (AGA). Son poco informativos, por lo que ya no se emplean. Los del tipo IgG pueden estar elevados en el 50 % de las personas con sensibilidad al gluten no celíaca.[52][7][153]
- Los anticuerpos anti-endomisio (AEM). Son muy similares a los anticuerpos anti-transglutaminasa, pero engorrosos y con alto coste económico, por lo que se han dejado de utilizar.
- Los anticuerpos anti-péptidos deaminados de gliadina (anti-DGP). Fueron introducidos en el año 2000. Tienen especificidad similar a los anti-transglutaminasa. Los más empleados son los de la clase IgG. Pueden ser útiles en niños menores de 18 meses, puesto que en estas edades es muy poco probable que se positivicen los anticuerpos anti-transglutaminasa, y en pacientes con deficiencia de IgA.
Analíticas[editar]
Las analíticas necesarias ante todo paciente con sospecha de celiaquía, tanto al diagnóstico como al seguimiento, incluyen las siguientes determinaciones:
- Hemograma completo con Velocidad de Sedimentación
- Estudio de coagulación completo incluyendo TPA y Tasa de Protrombina
- Bioquímica completa que debe incluir:
- - Glucemia, Urea, Creatinina, Ácido Úrico
- - Calcio y Fósforo, Niveles de Hidroxi-Vitamina D3
- - Proteínas totales, Albúmina, Colesterol total, HDL y Triglicéridos
- - Sideremia, Transferrina, Índice de saturación y Ferritina
- - PCR (Proteína C Reactiva)
- - Pruebas hepáticas: FA, AST, ALT, GGT y Bilirrubina total y fraccionada
- - Hormonas tiroideas: TSH, T3 y Anticuerpos anti-TPO
- - Ácido Fólico y Vitamina B12
- - Sistemático de orina y sedimento
- - Cuantificación de inmunoglobulinas (IgG, IgA e IgM)
- - Determinación de ANAs (Anticuerpos antinucleares)
- - Serología de anticuerpos de celíaca: Niveles de anti-transglutaminasa IgA (determinar en IgG en caso de deficiencia selectiva de IgA) y anti-péptidos deaminados de gliadina IgA e IgG. Si bien no son específicos, determinar también niveles de anti-cuerpos anti-gliadina IgA e IgG (en ocasiones están elevados en la sensibilidad al gluten no celíaca).
- Marcadores genéticos: HLA-DQ2 y HLA-DQ8
Con esta amplia batería analítica, se pretende no solo detectar la presencia o no de la enfermedad celíaca, sino también valorar su repercusión en el funcionamiento global del organismo y la posible presencia de enfermedades asociadas.
El hemograma puede ser normal, o presentar alteraciones en alguno o varios de sus 3 componentes fundamentales:
1) Serie roja, representada por los glóbulos rojos, que se cuantifican mediante la determinación del Hematocrito (Hcto.) y los niveles de Hemoglobina (Hb), así como por su tamaño, evaluado mediante el Volumen corpuscular medio (VCM) y la Hemoglobina corpuscular media (HCM).
La anemia se determina cuando los valores de hemoglobina son inferiores a 12 g/dl. Si es ferropénica, los hematíes son pequeños e hipocromos (VCM y HCM descendidos). También puede haber anemia por deficiencia de ácido fólico y/o vit. B12, en cuyo caso los hematíes están aumentados de tamaño y de coloración (VCM y HCM aumentados).
2) Serie blanca, determinada mediante la cuantificación de los leucocitos o glóbulos blancos, cuyos valores normales están comprendidos entre 4500-9000/mm³. Se denomina leucopenia cuando están descendidos por debajo de 4500 y leucocitosis cuando están aumentados por encima de 9000. Ambas situaciones se observan en los celíacos. La leucopenia en relación con hiperesplenismo y en presencia de leucocitosis hay que descartar la presencia de una infección asociada a cualquier nivel. La fórmula leucocitaria puede ser normal en su distribución, pero es relativamente frecuente, el detectar cambios porcentuales en el sentido de un aumento relativo de linfocitos (linfocitosis) que se acompaña de un descenso de neutrófilos (neutropenia) de significado no aclarado. Igualmente observamos con cierta frecuencia la presencia de un aumento de eosinófilos (eosinofilia) probablemente en relación con la presencia de diversos procesos alérgicos asociados, así como discreta elevación de mastocitos y/o basófilos.
3) Recuento de plaquetas, puede ser normal (entre 200 000-400 000/mm³), pero también puede haber descenso moderado, denominado trombopenia (<200 000), en relación con hiperesplenismo, o por el contrario aumento global, que se denomina trombocitosis (>400 000) como consecuencia de procesos inflamatorios asociados.
El estudio de coagulación, habitualmente es normal, pero puede presentar diversas alteraciones, tales como aumento del TPA (tiempo de tromboplastina), alargamiento del tiempo de protrombina (TP) con descenso de su actividad porcentual, que puede ser debido a una deficiencia parcial de los niveles de vit. K, por déficit de absorción intestinal, o bien en pacientes que toman anticoagulantes orales dicumarínicos. Los niveles de Fibrinógeno, pueden en ocasiones estar aumentados, ya que se trata de un reactante de fase aguda, que se eleva en presencia de procesos inflamatorios asociados, de cualquier localización.
Biopsias duodenales[editar]
La biopsia del intestino delgado sigue considerándose el procedimiento de referencia; es decir, la prueba más importante para confirmar el diagnóstico de enfermedad celíaca, para el que se sigue considerando como “el patrón oro”. Debería realizarse siempre en caso de sospecha clínica, independientemente del resultado de los marcadores serológicos, pues los anticuerpos son habitualmente negativos en los celíacos.
Sin embargo, su interpretación es compleja y presenta a menudo limitaciones, por el frecuente hallazgo de cambios mínimos, tales como la linfocitosis intra-epitelial y cambios mínimos, especialmente en el adulto y niño mayor de 2 años. También hay que tener presente que las lesiones no son uniformes, sino que muestran una “distribución parcheada”, lo que limita su valor diagnóstico, por la posibilidad de que las muestras hayan sido tomadas de zonas sanas. Además, la atrofia de vellosidades es poco frecuente en los adultos y niños mayores de 2 años, ya que en ellos predominan las formas no clásicas.[41]
Las biopsias duodenales se obtienen mediante fibroendoscopia, ya que esta permite la exploración completa del esófago, estómago y duodeno, siendo este último el comienzo del intestino delgado y el lugar donde se realiza la toma de múltiples biopsias. Mediante una endoscopia digestiva alta (a través de la boca) se accede con facilidad al duodeno, donde se toman las muestras de biopsias (porciones milimétricas de tejido), mediante una pinza introducida a través del endoscopio. Su duración media es aproximadamente de unos 5 minutos. No requiere anestesia ni sedantes, aunque se pueden emplear. Su preparación solo precisa unas 7 horas de ayuno previo, pudiendo tomar líquidos hasta 2 horas antes. Es una prueba generalmente segura y bien tolerada; la toma de muestras en el intestino no produce dolor.[41]
Se deben tomar múltiples biopsias duodenales (entre 4-6), de suficiente tamaño, bien orientadas antes de enviarlas para analizar, de las distintas porciones del duodeno (proximales y distales) para evitar errores de muestra, debido a que en la celiaquía normalmente no hay una afectación uniforme del intestino, sino que las lesiones aparecen en zonas aisladas entre sí (parcheadas).[154][155] Las biopsias duodenales se analizan después al microscopio. Se deben realizar tinciones especiales de forma rutinaria, con anticuerpos monoclonales para marcadores de linfocitos T (CD3), con el fin de poder hacer con precisión el recuento de linfocitos intraepiteliales (LIEs).
Las indicaciones para llevar a cabo la toma de biopsias duodenales en el curso de una endoscopia digestiva alta son muy variadas, e incluyen no solo a pacientes con serología positiva de enfermedad celíaca para confirmar el diagnóstico, sino también a todos los que presentan diarrea crónica o recidivante, estreñimiento, anemia ferropénica de origen oscuro o refractaria al tratamiento sustitutivo por vía oral, osteoporosis prolongada, mala digestión continuada o dolor abdominal de repetición, ardores, anorexia (falta de apetito), intolerancia a la lactosa, pérdida de peso mantenida, dolores músculo-esqueléticos, afectaciones cutáneas, procesos auto-inmunitarios y/o alérgicos, trastornos neurológicos, etc., independientemente de que la serología sea o no, negativa (ausencia de anticuerpos en sangre).
Un error frecuente es prescindir de la toma de biopsias ante una mucosa de aspecto aparentemente normal. Las lesiones típicas de la celiaquía, consistentes en cambios mínimos, solo pueden ser localizadas a través de su estudio al microscopio. Únicamente cuando existe atrofia vellositaria avanzada, que es el hallazgo menos frecuente en adultos y niños mayores de 2 años, se observan signos macroscópicos apreciables a simple vista, tales como el “aspecto festoneado” de los pliegues mucosos, la disminución de su tamaño o la presencia de un “patrón en mosaico”.
La cápsula endoscópica resulta de gran utilidad para el estudio de la enfermedad celíaca, ya que permite la visualización de todo el intestino, detectando algunos casos subclínicos, o no diagnosticados por otros medios, pero presenta el gran inconveniente de no poder tomar biopsias. Por ello, se debe completar con la realización de una gastroscopia rutinaria con la finalidad de poder disponer de biopsias duodenales.
Hallazgos en las biopsias duodenales[editar]
|
El contacto del intestino con el gluten conduce a la aparición de un daño en la mucosa del intestino delgado que no se limita, como tradicionalmente se pensaba, a la atrofia de las vellosidades intestinales, sino que incluye una serie de cambios inflamatorios que son mucho más frecuentes que aquella. Las lesiones abarcan desde casos en los que únicamente se aprecia un aumento de la población de linfocitos intraepiteliales (enteritis linfocítica) hasta formas avanzadas de atrofia vellositaria.[19][50] Cualquiera de estas lesiones, incluso las formas más leves, puede cursar con diversos estados carenciales, incluyendo anemia, osteopenia u osteoporosis, y un amplio abanico de síntomas digestivos y extradigestivos;[19][50] y presentan riesgo de complicaciones importantes a largo plazo si permanecen sin diagnosticar ni tratar, incluyendo un aumento moderado de la mortalidad.[156]
Como se recoge en las páginas 26 y 27 del Protocolo de Diagnóstico Precoz de la Enfermedad Celíaca[19] del Ministerio de Sanidad de España:
Dado que las lesiones histológicas pueden ser parcheadas, se aconseja la toma de al menos 4 muestras para el análisis histológico. El resultado del estudio anatomopatológico permite confirmar la existencia de lesiones compatibles y establecer el estadio de la lesión (Clasificación de Marsh). El espectro de lesiones histológicas que presentan estos pacientes es amplio y oscila desde formas de enteritis linfocíticas, donde únicamente se encuentra un incremento de la población de linfocitos intraepiteliales (>25 %) [Marsh 1], hasta formas de atrofia grave de la mucosa [Marsh 3]. Es importante disponer de inmunotinciones para llevar a cabo el contaje de linfocitos intraepiteliales, cuando las tinciones con hematoxilina-eosina no son concluyentes. Solo de este modo pueden diagnosticarse con razonable seguridad las formas de enteritis linfocítica (>25 linfocitos/100 células epiteliales).
A partir de la edad de 2 años, las formas con atrofia de vellosidades disminuyen notablemente, ya que predominan las presentaciones con solo inflamación (infiltración de linfocitos o enteritis linfocítica), que son las que producen bajos niveles de anticuerpos en sangre.
Existe una relación directa entre la positividad de los anticuerpos anti-TGt y el grado de atrofia vellositaria presente en la mucosa duodenal, de tal manera que un mayor grado de atrofia, se corresponde con una mayor positividad de anticuerpos, como ocurre en las formas clásicas, predominantes en niños pequeños (menores de 2 años).[41] Por el contrario, cuando la biopsia duodenal es normal, o bien muestra cambios mínimos o presenta un grado de atrofia leve, los anticuerpos anti-TGt pueden ser negativos, como ocurre con frecuencia en los niños mayores de 2 años y adultos, en quienes predominan las formas no clásicas.[148][157]
En el celíaco tratado adecuadamente, la mucosa llega a normalizarse resultando indistinguible de la de un individuo sano, al cabo de un período medio aproximado de dos años, tras el comienzo de la DSG.
La determinación de depósitos de transglutaminasa tisular subepiteliales y alrededor de los vasos en la lámina propia es de utilidad para reforzar el diagnóstico de los casos dudosos. Esta prueba ha sido incluida en 2018 en España, como parte del nuevo protocolo para el diagnóstico precoz de la celiaquía.[62]
Escala de Marsh para la clasificación de los hallazgos en las biopsias duodenales[editar]

Los hallazgos de la biopsia duodenal deben ser interpretados con detalle por un patólogo experto, e interesado en el diagnóstico de esta enfermedad, siguiendo los criterios de Marsh modificados, que clasifica esta enfermedad en 4 tipos o estadios. Se puede tener una enfermedad celíaca con biopsia duodenal con solo un aumento en el porcentaje de linfocitos intraepiteliales o una duodenitis crónica (estadio 1 o infiltrativo, de dicha clasificación).
La observación al microscopio tras tinción de las muestras extraídas, mediante hematoxilina-eosina e inmunohistoquímica con marcadores específicos para teñir los linfocitos CD3, permite analizar la histología y el número y distribución de los linfocitos intraepiteliales.
Su cuantificación ayuda a conocer mejor el grado de lesión según el sistema más utilizado actualmente, como son los “criterios de Marsh” descritos en 1992[158] y revisados por Oberhüber en 1996.
Esta clasificación anatomopatológica de las biopsias duodenales debe emplearse de forma rutinaria para el estudio de las muestras. Se utiliza ampliamente en todo el mundo y ha demostrado de sobras su gran utilidad diagnóstica y el amplio espectro de alteraciones histológicas existentes en la celiaquía, que van desde una mucosa normal o con cambios mínimos hasta la atrofia de las vellosidades intestinales.
| |||||||||||||||||||||||||||
Según estos criterios, además de la atrofia de vellosidades, aparecen estas lesiones:
- Lesión tipo Marsh 0. Cambios preinfiltrativos.
- Lesión tipo Marsh 1. Se observan 20 o 25 linfocitos intraepiteliales (depende de la técnica de tinción) por cada 100 enterocitos. Se expresa mediante porcentaje. Es decir, se considera Marsh 1 cuando la infiltración linfocitaria (LIES) es superior al 20 % o 25 %. Esta enteritis linfocítica es el hallazgo histológico más habitual en la enfermedad celíaca del adulto y niño mayor de 2 años.
- Lesión tipo Marsh 2. Se observa el patrón anterior además de hiperplasia de criptas (están en la base de las vellosidades).
- Lesión tipo Marsh 3. Se observa el patrón anterior y además existe acortamiento (atrofia) de vellosidades. Se subdivide en:
- - Marsh 3a, si es parcial o leve;
- - Marsh 3b, si es subtotal;
- - Marsh 3c, si es total.
Errores frecuentes en la interpretación de las biopsias duodenales[editar]
Es importante reseñar que en la práctica se producen muchos falsos negativos por distintos motivos:
- Se consideran negativas por no presentar atrofia vellositaria, cuando en realidad es la lesión menos frecuente en los celíacos a partir de los 2 años de edad.
- No se toman suficientes muestras: las lesiones son parcheadas y se deben coger al menos 4-6 biopsias para minimizar el margen de error.
- Informes patológicos incompletos:
- - No se especifica la relación cripta/vellosidad.
- - No figura ni se cuantifica por tanto, el infiltrado linfocitario (LIEs) hallado.
- - No se clasifican los resultados según la escala Marsh.
- - Se aplica el nivel de corte antiguo de recuento de LIE del 40 % (abandonado hace tiempo), en lugar del vigente del 25 % para el Marsh 1.
- - No figura el inmunofenotipo de linfocitos intraepiteliales.Para evitar los frecuentes errores de diagnóstico ante informes patológicos incompletos, en los que únicamente figuran datos del tipo “sin alteraciones histológicas relevantes”, “inflamación inespecífica”, “duodenitis crónica”, etc., sin tener que someterse a una nueva gastroduodenoscopia, el paciente tiene derecho a reclamar sus muestras de biopsias duodenales, obtenidas tanto por el sistema sanitario público como por el privado, para su estudio por otro patólogo actualizado y experto en celiaquía.
Desde el punto de vista jurídico, las muestras deben considerarse como parte integrante de la historia clínica del paciente y en consecuencia, por analogía, se debe aplicar El Régimen de la Historia Clínica (Ley 41/2002 del 14 de noviembre básica reguladora de la autonomía del paciente y derechos y obligaciones en materia de información y documentación clínica). El paciente está legitimado para recoger la muestra o se le puede entregar quien él autorice. El responsable tanto de la custodia de la muestra biológica como de su conservación, es el Centro Hospitalario. En el momento que salga del hospital, el responsable será el receptor de la misma.[159]
Marcadores genéticos[editar]
Las evidencias apuntan a que la genética tiene una clara participación en la predisposición a la enfermedad celíaca, si bien el modo de herencia es aún desconocido. Actualmente, se estima que su heredabilidad ronda el 87 %.[160] Aproximadamente, el 56 % de la población general presenta genética de riesgo para desarrollar la enfermedad celíaca.[39]
Se conoce que está implicada la presencia de ciertos alelos del sistema HLA (antígenos linfocitarios humanos, ubicados en el brazo corto del cromosoma 6), el cual está encargado de vigilar que las células del organismo sean propias. Su presencia está relacionada con la aparición de diversas enfermedades autoinmunes y el análisis de histocompatibilidad imprescindible para la llevar a cabo ciertos trasplantes.
Explicado de un modo sencillo, el HLA-II presenta innumerables variaciones. De la misma forma que cada persona tiene una cara distinta, se podría decir que cada persona presenta un HLA diferente, aunque existe una serie de variaciones del HLA que predisponen a padecer ciertas enfermedades.
El HLA-DQ2 se presenta en un 90 % de los celíacos. No obstante, tenerlo positivo no implica que se tenga que desarrollar la enfermedad celíaca. De hecho, los celíacos son solo un 2-5 % de los portadores del HLA-DQ2.
Alrededor del 5 % de celiacos presenta el HLA DQ8.
Al menos el 5 % restante de celíacos no presentan ni el heterodímero DQ2, ni el DQ8, o solo tienen un alelo del DQ2, por lo que su presencia no es obligada para el diagnóstico. Hay en marcha estudios de nuevos marcadores genéticos relacionados con esta enfermedad.
Se han encontrado otros genes del sistema HLA-I, como el MICA y el MICB, asociados a diversos trastornos autoinmunitarios, entre ellos la enfermedad celíaca.[161]
La presencia de estos marcadores de susceptibilidad HLA-DQ2 y HLA-DQ8 es importante a la hora de realizar estudios familiares y de instaurar una dieta sin gluten (DSG) para analizar respuesta en pacientes cuyas pruebas diagnósticas no sean concluyentes. Véase apartado: Utilidad de la dieta sin gluten "de prueba" para confirmar el diagnóstico
Los gemelos monocigóticos tienen una alta concordancia para presentar celiaquía en algún momento de su vida, en torno al 75 %. En los dicigóticos, no se aprecian diferencias de riesgo respecto al resto de familiares de primer grado y la prevalencia media se sitúa alrededor del 25 %.[162]
Diagnóstico de casos dudosos o difíciles[editar]
Ante casos dudosos de enfermedad celíaca o de difícil diagnóstico, existen diversas estrategias que se pueden aplicar de acuerdo con las preferencias del paciente y su familia. Entre ellas figuran las siguientes:
a) Repetir periódicamente la analítica y serología buscando cambios manifiestos (de escasa utilidad).
b) Realizar un estudio familiar buscando casos potenciales o manifiestos que eran previamente desconocidos.
c) Llevar a cabo una nueva endoscopia con tomas de biopsia múltiples duodenales al cabo de unas semanas, con o sin sobrecarga de gluten (menos aceptada).
d) Hacer un tratamiento de prueba con dieta sin gluten (DSG) durante 6 meses mínimo, preferiblemente un año, observando la respuesta clínica, así como los cambios analíticos y serológicos (la más aconsejable).
Actualmente, la prueba de la provocación con gluten no se considera necesaria para la confirmación del diagnóstico de la celiaquia. Incluso se estima como potencialmente peligrosa, ya que puede presentar serios inconvenientes por la aparición de reacciones importantes tras su reintroducción.[45]
En casos dudosos, está plenamente justificado el instaurar una dieta sin gluten estricta durante un plazo mínimo de seis meses, realizando seguimiento clínico y analítico adecuados, para analizar la respuesta (“diagnóstico ex-iuvantibus”).[45]
El diagnóstico de enfermedad celíaca se confirma cuando existe una respuesta positiva a la DSG, que se calcula en un plazo medio de 6 meses.[27]
Cuando no se produce la mejoría esperada con la dieta sin gluten o esta se demora, hay que valorar muy cuidadosamente la presencia de otras intolerancias alimenticias asociadas (lactosa, fructosa, etc.) porque con la simple toma de leche sin lactosa puede mejorarse o la restricción de algún tipo de fruta. Otras causas de no mejoría son la presencia del llamado “gluten oculto” en algunos productos no bien etiquetados, así como las “contaminaciones cruzadas” comiendo en la mesa con otras personas que toman pan de trigo y desmigan con frecuencia de forma inadvertida, alimentos contaminados con migas o restos de harina durante su preparación o manipulación, etc.[163]
Utilidad de la dieta sin gluten "de prueba" para confirmar el diagnóstico[editar]
Pese a la sospecha clínica fundada, en diversas ocasiones nos encontramos con casos con serología negativa, y/o marcadores genéticos negativos, y/o biopsias duodenales con cambios mínimos o enteritis linfocítica limítrofe < 25 %.
En dichos casos, se debería proponer la realización de una dieta sin gluten (DSG) de prueba durante un mínimo de 6 meses, preferiblemente un año, con controles clínicos y analíticos antes y después de la retirada del gluten.[27][45] Se aconseja probar la DSG durante unos 6 meses como mínimo, preferiblemente un año, ya que con menos tiempo los cambios no se producen de forma significativa, sobre todo en pacientes que llevan padecimientos clínicos prolongados.
La DSG debe ser estricta, eliminando de la alimentación todos los productos que contengan o se cocinen con harina de trigo, centeno, cebada y avena (dieta TACC), que son los cuatro cereales con gluten, y sustituyéndolos por harina de maíz y arroz sin trazas de gluten, evitando contaminaciones inadvertidas y todo tipo de transgresiones dietéticas.
Con dicha dieta de prueba, en la mayoría de los casos, se produce una mejoría clínica significativa, con desaparición prácticamente total de la mayoría de las molestias, que se confirma además con una mejoría o normalización de la mayor parte de las alteraciones analíticas, previamente existentes.
Gracias a la realización de esta DSG, se confirmará el diagnóstico de enfermedad celíaca en la mayor parte de los casos previamente etiquetados como dudosos.
Consideraciones importantes sobre la prueba con la dieta sin gluten[editar]
En caso de no mejoría, antes de abandonar la prueba con la dieta sin gluten, hay que hacer una valoración muy cuidadosa tanto clínica como analítica, para tratar de evitar posibles errores de interpretación. Ver sección Mala respuesta a la dieta y persistencia de síntomas.
Pruebas de provocación[editar]
Actualmente no se consideran necesarias ni las pruebas de provocación, ni la repetición de las biopsias para la confirmación diagnóstica.
La prueba de la provocación con gluten está completamente contraindicada antes de la edad de cinco años y durante el crecimiento de la pubertad.[164] Incluso se considera potencialmente peligrosa a cualquier edad, ya que puede precipitar la aparición de reacciones importantes tras su reintroducción.[45]
Errores frecuentes[editar]
En el diagnóstico[editar]

Pese a que la celiaquía es una de las enfermedades con base genética más frecuentes, con una prevalencia media del 1-2 % en la población general y que puede debutar a cualquier edad de la vida, está claramente subestimada e infradiagnosticada, con aproximadamente un 85 % de los casos sin diagnosticar en la actualidad.[18][42] Existe un escaso conocimiento sobre la enfermedad celíaca entre los profesionales de la salud, que tiende a perpetuarse.[12][66]
La media estimada de tiempo que transcurre desde el comienzo de aparición de los síntomas hasta que el paciente consigue el diagnóstico, es de unos 20 años. Esta situación se puede explicar teniendo en cuenta que, a pesar de los avances realizados en los últimos años en la identificación de las múltiples manifestaciones de la enfermedad celíaca y a la reforma de los protocolos diagnósticos, estos conocimientos aún no han llegado a la mayoría de profesionales a los que acude a consultar el paciente por molestias variadas y diversas que presenta.
Se necesita una mayor conciencia de la celiaquía como un problema de salud común. Acortar el retardo diagnóstico, actualmente muy elevado, es imprescindible para reducir la carga innecesaria de la enfermedad. Vivir con una enfermedad celíaca sin diagnosticar incrementa el riesgo de consecuencias negativas sobre la salud y la mortalidad.[73] [165] [166] [167] [168] [169] [170] La correcta identificación y tratamiento con la dieta sin gluten (DSG) prevendrá de las numerosas complicaciones digestivas y extra-digestivas que pueden aparecer a corto, medio o largo plazo, entre las que cabe destacar especialmente enfermedades por carencias crónicas, procesos de naturaleza inmuno-alérgica, diferentes procesos autoinmunitarios, diversos tipos de cánceres, enfermedades cardiovasculares, trastornos neurológicos y psiquiátricos.[19][29][45][171] [172] [173] [174] [175]
Es importante que el paciente conozca toda esta problemática para que pueda participar de forma activa en la consecución de una mejor calidad de vida, utilizando las estrategias a su alcance, que pasan por la búsqueda de una atención médica especializada y el conocimiento del avance en la identificación de las variadas manifestaciones de la enfermedad celíaca y de las recientes modificaciones de los protocolos diagnósticos. El aumento de la capacidad de las personas para comprender y participar en su atención médica es una prioridad internacional.[176]
Los errores más frecuentes radican en la dificultad de la identificación y diagnóstico de la enfermedad celíaca ante presentaciones no clásicas, que son las más frecuentes, en las que la afectación digestiva es menor y/o intermitente y abundan las manifestaciones extra-digestivas, con serología negativa (ausencia de anticuerpos en sangre) y con biopsias duodenales que presentan cambios mínimos, sin atrofia vellositaria (Marsh 1).[177]
Como se recoge en las páginas 18, 25 y 42, respectivamente, del Protocolo de Diagnóstico Precoz de la Enfermedad Celíaca[19] del Ministerio de Sanidad de España:
Enfermedad pauci o monosintomática: Actualmente es la forma más frecuente de EC, tanto de la edad adulta como de la pediátrica, y puede cursar con síntomas intestinales y/o extraintestinales. El espectro histológico es variable, desde enteritis linfocítica a la atrofia total y el porcentaje de positividad de autoanticuerpos séricos es variable. EC: enfermedad celíaca
Serología negativa y elevada sospecha clínica: Recientes evidencias sugieren que la serología negativa no permite excluir con seguridad el padecimiento de la enfermedad. Ello resulta particularmente cierto en pacientes con lesiones histológicas poco avanzadas (Marsh 1 y 2). Por otro lado, el hecho de presentar alteraciones morfológicas poco relevantes (enteritis linfocítica, sin atrofia vellositaria) no excluye que el enfermo presente síntomas y signos de enfermedad clínicamente relevante (astenia, flatulencia, anemia, osteopenia, etc.). Por este motivo, ante la presencia de síntomas sospechosos con serología negativa, especialmente en grupos de riesgo, debe considerarse la posibilidad de derivar el caso para proseguir su evaluación en un medio especializado.
Recientes observaciones sugieren que la serología no goza de una elevada sensibilidad, especialmente en las formas histológicamente leves (enteritis linfocítica). Por esta razón, el gastroenterólogo debe de actuar con cautela y no rechazar la posibilidad de una EC, en presencia de síntomas sugestivos o compatibles. En este punto, es importante llevar a cabo un cribado intencionado de síntomas y signos cuya presencia obligaría a realizar exploraciones más avanzadas (tabla I). EC: enfermedad celíaca
En la valoración de la respuesta a la prueba con la dieta sin gluten[editar]
Cuando se utiliza la prueba con la dieta sin gluten (DSG) como método diagnóstico de los casos dudosos y no se produce ninguna mejoría, antes de abandonarla hay que hacer una valoración muy cuidadosa tanto clínica como analítica, para tratar de evitar posibles errores de interpretación.

En el diagnóstico en la infancia[editar]
Existe la creencia de que los especialistas en enfermedades de los niños son los profesionales que más casos detectan, si bien la realidad es que el anclaje en las ideas clásicas sobre la enfermedad celíaca, la aplicación sistemática de protocolos desfasados, la reticencia a someter a los niños a pruebas invasivas y el miedo a prescribir una dieta “de por vida”, dan como resultado que la mayoría de casos de celiaquía pasen desapercibidos durante la infancia. Las cifras de niños sin diagnosticar llegan a alcanzar el 90 %.[68]
Sin embargo, resulta especialmente importante poder detectar y tratar los casos de celiaquía que debutan en la infancia, pues la instauración a tiempo de una dieta sin gluten estricta evita la aparición de complicaciones presentes y futuras, algunas de ellas totalmente irrecuperables tales como el retraso en el crecimiento, el daño del esmalte dental por la presencia de anticuerpos antiesmalte [178] o algunas enfermedades autoinmunes asociadas, tales como la diabetes mellitus tipo 1.[50][19] [179] Los datos de diversos estudios sugieren que la prevalencia de enfermedades autoinmunes se relaciona con la duración de la exposición al gluten, ya que los niños diagnosticados de enfermedad celíaca antes de los 2 años no suelen presentar una incidencia aumentada de procesos autoinmunes. Al contrario, cuando la enfermedad se diagnostica tardíamente en la infancia o en la juventud, se estima que el riesgo relativo de presentar algún proceso autoinmunitario asociado a lo largo de la vida es de unas 7 veces mayor.[142]
Si bien las presentaciones clásicas de la enfermedad celíaca (con clínica digestiva aguda en forma de diarreas y signos de malabsorción) son más frecuentes en la infancia en comparación con la edad adulta, en los niños también predominan las presentaciones consideradas no clásicas,[19] especialmente a partir de los 2 años de vida, en las que la afectación digestiva es menor y/o intermitente y abundan las manifestaciones extra-digestivas, con serología negativa (ausencia de anticuerpos en sangre) y con biopsias duodenales que presentan cambios mínimos, sin atrofia vellositaria (Marsh 1).
Actualmente, en Pediatría prácticamente solo son derivados a los Servicios especializados de Gastroenterología los casos con síntomas clásicos y serología positiva, lo que está contribuyendo a privar a los gastroenterólogos de una visión de la enfermedad más ajustada a la realidad, perpetuar los errores en el reconocimiento y diagnóstico de la enfermedad celíaca y mantener las elevadas cifras de infradiagnóstico, con las consiguientes repercusiones en la salud de los enfermos a corto, medio y largo plazo.
Si bien la enfermedad celíaca puede debutar en cualquier momento de la vida, esta situación puede explicar una parte del creciente número de casos en los adultos, cuya enfermedad ha ido pasando sin diagnosticar desde su infancia o adolescencia. Actualmente, hay muchos más casos diagnosticados en adultos que en niños.
El diagnóstico de la enfermedad celíaca, debe basarse en la presencia de alguno o varios de los síntomas relacionados con la afectación intestinal o de cualquiera de los órganos o sistemas asociados, así como en la determinación de los marcadores serológicos, genéticos, los hallazgos en la biopsia intestinal y la respuesta a la dieta sin gluten, siendo esta última la prueba más informativa. Actualmente no se consideran necesarias ni las pruebas de provocación, ni la repetición de las biopsias para la confirmación diagnóstica.
El diagnóstico resulta mucho más sencillo en niños pequeños y es bastante más complicado en niños mayores de 2 años, por la frecuente negatividad de los marcadores serológicos.
La enfermedad celíaca puede debutar en los lactantes, aunque el solapamiento de síntomas con el cólico del lactante y/o la intolerancia a la leche dificulta y retrasa su reconocimiento y diagnóstico correctos, así como las presentaciones "no clásicas" que cursan con síntomas no clásicos, como el estreñimiento, que en muchas ocasiones llega a ser muy llamativo y llega a constituir el síntoma principal.[27]
Aunque no existe un perfil único para poder enmarcar a todos los celíacos, los cuadros con uno o varios de estos síntomas deberían alertar al pediatra de la presencia de una enfermedad celíaca: dermatitis de distinta índole (atópica, urticaria, queratosis folicular, etc.), afectaciones recurrentes de vías respiratorias (catarros, otitis, rinitis, sinusitis, faringitis, bronquitis, asma, etc.), procesos alérgicos, cefaleas y/o alteraciones del comportamiento (irritabilidad, apatía, tristeza, introversión, hiperactividad, autismo, etc.).[45][50][19][173][174]
Retraso del crecimiento[editar]
El retraso del crecimiento y desarrollo constituye uno de los síntomas clásicos de la enfermedad celíaca. Si bien no se produce en todos los casos, su presencia debería alertar con interés a los pediatras acerca de la probable existencia de una enfermedad celíaca subyacente asociada. La baja estatura puede ser el único signo de sospecha de una enfermedad celíaca. Es frecuente la presentación de la enfermedad celíaca monosintomática, es decir, con un solo síntoma o una sola enfermedad asociada.[180]
El retraso del crecimiento es totalmente irrecuperable en un celíaco si no se instaura una dieta sin gluten (DSG) durante el período de desarrollo. Por el contrario, el desarrollo se normaliza cuando la enfermedad celíaca es detectada y tratada tempranamente, y con esto se consigue que el niño llegue a alcanzar la talla marcada por su genética.
Un error frecuente a la hora de valorar el crecimiento en los niños es tomar como referencia la talla de sus progenitores, sin investigar en ellos una posible celiaquía no diagnosticada. Una de las características que se presentan con relativa frecuencia en pacientes cuyos síntomas y signos de enfermedad celíaca han pasado desapercibidos desde la infancia y, por lo tanto, sin diagnosticar ni tratar con la dieta sin gluten, es la talla baja o, mejor entendido, la talla por debajo de lo que marca su información genética y percentil para su edad. Hay que tener en cuenta que la enfermedad celíaca es una de las enfermedades con base genética más frecuentes, con una prevalencia media del 2 % en la población general y que puede debutar a cualquier edad de la vida, pero está claramente subestimada e infradiagnosticada, con aproximadamente un 70-90 % de los casos sin diagnosticar.[99][100][101][102][103]
La media estimada de tiempo transcurrido hasta que el paciente consigue el diagnóstico es de unos 20 años, siendo un 20 % de los casos diagnosticados en individuos mayores de 60 años.[181][182] [183] Esto se traduce en que las posibilidades de existencia de casos sin reconocer entre los familiares de primer grado, sean muy altas.
Incluso en los casos graves de retraso de crecimiento, en los que se llega a recurrir a costosos y a menudo traumáticos tratamientos, pues consisten en la aplicación diaria de dosis subcutáneas de hormona sintética del crecimiento durante varios años, correspondientes a la fase de desarrollo del niño, no está contemplada la realización de todo el protocolo para buscar la presencia de una posible enfermedad celíaca, como base de la insuficiencia de producción de la hormona del crecimiento (GH). La enfermedad celíaca aparece con frecuencia asociada a deficiencia de la GH. En pacientes celíacos, se puede observar una deficiencia de la GH antes del comienzo de la dieta libre de gluten (DSG),[184][185] [186] pero al cabo del tiempo, tras la instauración de la DSG, generalmente se normaliza y aparece una etapa de crecimiento,[187][185][188] con normalización de la función hipofisiaria.[187]
En los protocolos vigentes del Ministerio de Sanidad de España para administración y seguimiento del tratamiento (Criterios para la utilización racional de la hormona de crecimiento en niños,[189] aprobados el 30 de mayo de 2008, y Protocolo de seguimiento del tratamiento con hormona de crecimiento en niños)[190] se solicitan los “marcadores de enfermedad celíaca” (serología o presencia de anticuerpos específicos en sangre), páginas 2, 4 y 5, para selección y seguimiento de pacientes candidatos al tratamiento. Pero no se contempla en ningún momento la realización de un estudio completo, con biopsias duodenales, marcadores genéticos para enfermedad celíaca y búsqueda de enfermedades asociadas tanto en el niño como en sus familiares cercanos, pruebas imprescindibles para la correcta valoración de la presencia de una celiaquía y recogidas en el Protocolo de Diagnóstico Precoz de la Enfermedad Celíaca[19] del Ministerio de Sanidad de España. En dicho protocolo, página 49, punto 9 del decálogo, figura claramente lo siguiente:
9. Los marcadores serológicos (AAtTG) resultan de elección para iniciar el despistaje de los pacientes con mayor probabilidad de presentar EC. Una serología negativa no permite excluir el diagnóstico de EC. De hecho, una proporción de pacientes con enfermedad celíaca, que presentan formas histológicas leves e incluso con atrofia de vellosidades, no expresan anticuerpos antitransglutaminasa en el suero. EC: enfermedad celíaca
En los niños, especialmente a partir de los 2 años de vida, al igual que en los adultos, predominan las presentaciones consideradas no clásicas, en las que la afectación digestiva es menor y/o intermitente y abundan las manifestaciones extra-digestivas, con serología negativa (ausencia de anticuerpos en sangre) y con biopsias duodenales que presentan cambios mínimos, sin atrofia vellositaria (Marsh 1), como figura en la página 18 del mencionado Protocolo de Diagnóstico Precoz de la Enfermedad Celíaca.[19]
Enfermedad pauci o monosintomática: Actualmente es la forma más frecuente de EC, tanto de la edad adulta como de la pediátrica, y puede cursar con síntomas intestinales y/o extraintestinales. El espectro histológico es variable, desde enteritis linfocítica a la atrofia total y el porcentaje de positividad de autoanticuerpos séricos es variable. EC: enfermedad celíaca
Diagnóstico diferencial[editar]
No existe ninguna prueba que por sí sola pueda descartar la enfermedad celíaca.[27]
Junto con la celiaquía se presentan frecuentes situaciones, como puede ser la anemia crónica refractaria, dermatitis herpetiforme y otros tipos de dermatitis, diversas enfermedades neurológicas, ferropenia crónica, hipertransaminasemia de origen no aclarado, osteopenia u osteoporosis, procesos autoinmunes y alérgicos, cansancio excesivo, dolores musculoesqueléticos, etc. y como complicaciones más frecuentes la situación de refractariedad y la presencia de tumores malignos del intestino delgado tales como el linfoma de células T y el adenocarcinoma. Asimismo se han descrito tumores orofaríngeos y esofágicos, y cánceres de colon, hepatobiliares y de páncreas, con un riesgo ligeramente aumentado con respecto a la población general para la mayoría de ellos.[27]
Las dos principales entidades clínicas que solapan síntomas con celiaquía son la sensibilidad al gluten no celíaca (SGNC) y el síndrome del intestino irritable (SII). Al menos una parte de pacientes con enfermedad celíaca pasan muchos años tratados como si tuvieran el síndrome del intestino irritable.[71][72] Hasta un 30-60 % de los pacientes con SII pueden ser en realidad celiacos[121] y un porcentaje aún no determinado, presentar sensibilidad al gluten no celíaca, cuya prevalencia es por término medio unas 6 veces superior a la de la enfermedad celíaca.[191]
En teoría, la separación entre un paciente celíaco de uno que presenta sensibilidad al gluten no celíaca es fácil, ya que el primero tiene la serología (los anticuerpos) positivos, los marcadores genéticos compatibles y cambios histológicos sugestivos de enfermedad celíaca.
En la práctica clínica, especialmente en niños mayores de 2 años, adolescentes y adultos, con mucha frecuencia la serología en un paciente celíaco es normal[50] o está mínimamente elevada, con valores de transglutaminasa ligeramente superiores al límite actual recomendado de positividad de 2-3 U/ml,[45][149][150] pero que se consideran por muchos médicos como negativos, y la biopsia muestra con frecuencia lesiones de enteritis linfocítica con un aumento de la presencia de linfocitos intraepiteliales superior al 25 % (Marsh 1).[19] Estos pacientes presentan por lo general unos síntomas intensos y prolongados, similares a los pacientes que tienen atrofia de vellosidades (Marsh 3), y mejoran claramente con una dieta sin gluten.[192]
Resulta de gran utilidad la realización de una cuidadosa historia clínica, incluyendo los antecedentes personales desde la temprana infancia del paciente, así como la elaboración de una completa historia familiar de enfermedad celíaca, trastornos digestivos y procesos autoinmunes, y una búsqueda de las enfermedades más frecuentemente asociadas a la celiaquía, tales como la rinitis crónica recurrente, episodios de faringo-amigdalitis, otitis, sinusitis, asma bronquial y otros procesos de naturaleza inmuno-alérgica.[193]
Los pacientes con sensibilidad al gluten no celíaca se parecen a los celíacos con enteritis linfocítica, pero en ellos la serología es normal por lo general, los marcadores genéticos (HLA-DQ2/DQ8) son heterocigotos o claramente negativos, y aunque pueden presentar un incremento de los linfocitos intraepiteliales, su proporción es generalmente inferior al 25 %, por lo que no pueden ser catalogados como celíacos genuinos. Sin embargo, al igual que ellos, muestran una clara mejoría al ponerlos a dieta sin gluten (DSG), y se reproducen los síntomas cuando realizan transgresiones voluntarias o inadvertidas y empeoran definitivamente si retiran la DSG.
Más complicado es aún realizar un diagnóstico diferencial entre la sensibilidad al gluten no celíaca y el denominado síndrome del intestino irritable (SII), ya que ambas entidades presentan una sintomatología similar, siendo en ambas negativos los marcadores serológicos, genéticos de susceptibilidad, así como los hallazgos de la colonoscopia y gastroscopia, que igualmente son negativos.
Es difícil relacionar con la ingesta de gluten la aparición de los variados síntomas digestivos que provoca. El gluten está presente en nuestra alimentación de manera continuada e ininterrumpida desde los primeros meses de la vida, incluyendo la lactancia,[125] las reacciones pueden ser retardadas varias horas o incluso días y se suele estar ingiriendo gluten en cualquiera de las comidas diarias, en principio aparentemente libres de gluten, como aditivo y/o como consecuencia de contaminaciones cruzadas. Las lesiones inflamatorias causadas por el gluten en el intestino tardan en desaparecer por completo del orden de unos dos años, desde el momento de su supresión estricta en la alimentación. Además, el gluten ejerce un efecto anestésico sobre el tubo digestivo, que adormece y oculta sus reacciones naturales, lo que provoca que en ocasiones se noten las intolerancias a otros alimentos típicamente asociadas al daño del gluten (lactosa, sorbitol, fructosa, proteínas la leche y/o el maíz, etc.), pero pasen inadvertidas las reacciones al ingerirlo.[44][163] A todo esto se suma que hemos aprendido a convivir, aceptándolos como normales, con los numerosos síntomas digestivos difusos que alertan sobre la presencia de una posible celiaquía o de una sensibilidad al gluten no celíaca, que se suelen presentar de manera fluctuante e incluso con largos períodos de completa remisión, tales como malas digestiones, gases, distensión abdominal, heces deshechas, intolerancias a alimentos, etc.,[118][127][128][129] por lo que no se suele acudir a consulta médica por estos motivos. Una parte de pacientes que sí consulta presenta un alto grado de ansiedad por la persistencia de sus síntomas, lo cual provoca que el médico emita un juicio preconcebido de hipocondriasis, neuroticismo o trastorno por somatización, catalogándolo como un trastorno funcional.[130] La posibilidad de existencia de casos sin reconocer entre familiares como consecuencia del elevado infradiagnóstico tanto de la enfermedad celíaca como de la sensibilidad al gluten no celíaca es muy alta, lo que contribuye a esa aceptación de síntomas en el seno de las familias y a que no sean reconocidos como señales de alarma.
La mejor forma de diferenciar el síndrome del intestino irritable (SII) de la sensibilidad al gluten no celíaca es hacer una retirada del gluten completa y mantenida (DSG) durante un mínimo de 6 meses, preferiblemente un año, y si con ella se produce una mejoría clínica evidente, con remisión o desaparición completa de la sintomatología, se cambiará el diagnóstico de SII por el de sensibilidad al gluten no celíaca. Para tener una mayor seguridad, se puede realizar una “prueba de provocación” reintroduciendo el gluten en la dieta durante unos días, que reproducirá las molestias previas que presentaba el paciente.
Especialmente en niños mayores, jóvenes y adultos con largas demoras diagnósticas, es habitual no experimentar mejoría o incluso tener un aparente empeoramiento al comienzo de la DSG. Este fenómeno solo se produce en enfermos celíacos o sensibles al gluten. Antes de abandonar la prueba con la dieta sin gluten, hay que hacer una valoración muy cuidadosa tanto clínica como analítica, para tratar de evitar posibles errores de interpretación. Véase el apartado: Consideraciones importantes sobre la prueba con la dieta sin gluten
El tratamiento de la sensibilidad al gluten no celíaca es idéntico al de la enfermedad celíaca (EC), ya que en ambos casos existe una intolerancia permanente al gluten. Por ello, el único tratamiento realmente eficaz es el seguimiento de una dieta sin gluten (DSG) de forma estricta de por vida, sin efectuar transgresiones, para poder así conseguir una mejoría mantenida y eficaz, y prevenir la aparición de complicaciones asociadas.
| Tabla 5. Diagnóstico diferencial entre Enfermedad Celíaca, Sensibilidad al Gluten y Síndrome del Intestino Irritable | |||
| Enfermedad Celíaca | Sensibilidad al Gluten | Síndrome del Intestino Irritable | |
| Serología | TGt frecuentemente negativa o valores positivos (>2-3 U/ml) | TGt negativa (<2-3 U/ml) | TGt negativa (<2-3 U/ml) |
| Hallazgos histológicos en biopsias duodenales | Desde Marsh 1 (LIES>25 %) hasta Marsh 4 Hallazgo típico: Marsh 1 | Marsh 0 (LIES<25 %) | Marsh 0 (LIES<25 %) |
| Marcadores genéticos de susceptibilidad | HLA-DQ2/DQ8 o algún alelo | HLA-DQ2/DQ8 heterocigotos o claramente negativos | No hay asociación |
| Respuesta a la dieta sin gluten | SÍ | SÍ | NO |
| Síntomas extradigestivos | SÍ | SÍ | SÍ |
| Enfermedades autoinmunes asociadas | SÍ | NO | NO |
TGt= Anticuerpos anti-transglutaminasa tisular
LIES= Linfocitos Intraepiteliales
Tratamiento[editar]

El único tratamiento disponible en la actualidad es la dieta sin gluten (DSG), que debe realizarse de manera estricta y mantenida de por vida.[19] Consiste en eliminar los alimentos que en su composición, preparación o condimentación contengan harina procedente de cereales que poseen gluten, que son el trigo, la avena, el centeno y la cebada (dieta TACC), y cualquiera de sus variedades e híbridos (espelta, escanda, kamut, triticale,...), y productos derivados, evitando contaminaciones inadvertidas y todo tipo de transgresiones dietéticas.[19][27][194][107] La celiaquía presenta una base genética y no existen, ni están disponibles, por el momento, tratamientos farmacológicos para poder combatirla, por lo que no cabe la posibilidad de interrumpir ni suspender la dieta bajo ningún concepto. El consumo de gluten, sea voluntario o no, lleva consigo asumir riesgos potenciales de asociación de enfermedades que pueden llegar a ser muy graves, como cánceres tanto del aparato digestivo como de otros órganos, trastornos neurológicos y psiquiátricos, otras enfermedades autoinmunes y osteoporosis.[28][26][30][31][32][16] La dieta sin gluten estricta parece tener un papel protector y es la única opción para prevenir contra ciertos raros tipos de cáncer, muy agresivos.[28][75]
La mayoría de los alimentos naturales (sin procesar) que consumimos a diario no contiene gluten, por lo que, aunque se sustituyan los alimentos con gluten por alternativas sin él, la dieta resulta amplia y variada. El cambio principal es el sustituir la harina de trigo habitual por la de maíz seleccionado y sometido a mayores controles analíticos, y evitar el gluten no solo de forma directa (no consumiendo lo que claramente lo contiene), sino en la llamada contaminación cruzada: existe la posibilidad de que alimentos en principio libres de gluten puedan entrar en contacto en algún momento con gluten, lo que los convertiría en no aptos para su consumo (presencia de “trazas” de gluten en el producto final). La correcta elección de los alimentos y la adopción de una serie de medidas básicas para evitar las contaminaciones cruzadas son imprescindibles para eliminar o minimizar este riesgo.
Por otro lado, una gran parte de los alimentos procesados que se comercializan actualmente contiene gluten como aditivo, en forma de contaminación cruzada o incluso por adulteración.[195][196] Otras fuentes no sospechadas de gluten pueden ser productos farmacéuticos (incluyendo medicamentos recetados y de venta libre, gargarismos y colutorios, suplementos vitamínicos y minerales, productos a base de plantas medicinales, suplementos dietéticos, vendas adhesivas, esparadrapos y tiras adhesivas sanitarias), todo tipo de productos cosméticos y de cuidado personal (barras de labios, bálsamos y brillos labiales, pasta de dientes, enjuagues bucales, productos para el cuidado de la piel y el cabello, etc.), piensos y alimentos para animales de granja y mascotas, champús para perros y pasta de modelar para niños (como Play-Doh), entre otros.[196][197][198] Estos productos pueden ser la causa de contaminaciones inadvertidas por gluten, pues pueden llegar a la boca directamente o indirectamente, por los restos que quedan en las manos tras manipularlos.[197]
La DSG es una dieta sana porque es muy variada y obliga a fijarse más en la composición y en la preparación de los alimentos, incrementando el consumo de todo tipo de verduras y frutas, así como de alimentos naturales, no congelados ni elaborados, por lo que se reduce el consumo de aditivos y sodio.[12] Bien equilibrada, es una dieta segura, que no provoca ningún efecto secundario negativo.[60] No obstante, algunas personas se centran únicamente en la eliminación del gluten de la alimentación y restan importancia a la necesidad de planificar adecuadamente la dieta.[12] Una selección desequilibrada de los alimentos y una incorrecta elección de los productos comerciales libres de gluten alternativos, específicos para celíacos (aquellos que tradicionalmente se elaboran con harina de trigo, tales como panes, galletas, etc.), puede provocar ciertas deficiencias nutricionales. En general, estos productos alternativos no suelen estar fortificados, en comparación con sus equivalentes con gluten, por lo que puede haber una menor ingesta de hierro y vitaminas del grupo B; asimismo, contienen mayor cantidad de lípidos y carbohidratos.[12][199][200] Especialmente los niños consumen en exceso estos productos, lo que además provoca que disminuya el consumo de otro tipo de alimentos más saludables.[200] Estos desequilibrios nutritivos pueden ser prevenidos con una correcta educación dietética.[199][200]
La DSG produce una mejoría significativa de los síntomas, que por lo general se observa al cabo de unos días o de unas pocas semanas tras su instauración, aunque la recuperación completa de los daños intestinales es más tardía, pues no se produce hasta pasados varios meses después, o incluso varios años, especialmente en los niños mayores y los adultos. Se calcula una media que oscila entre dos y cinco años desde el comienzo de la dieta.[10]
Mala respuesta a la dieta y persistencia de síntomas[editar]
Es habitual en pacientes celíacos y sensibles al gluten, especialmente niños mayores, jóvenes y adultos con largas demoras diagnósticas, no experimentar mejoría o incluso presentar un aparente empeoramiento al comienzo de la dieta sin gluten. Este fenómeno se explica por la paulatina recuperación del tubo digestivo, antes adormecido por el efecto anestésico del gluten.[44] La dieta le devuelve su capacidad de reacción, con lo que las posibles contaminaciones accidentales se suelen volver a manifestar con síntomas intensos y pueden hacerse patentes otras intolerancias alimenticias, asociadas a la enfermedad celíaca y la sensibilidad al gluten no celíaca (lactosa, fructosa, sorbitol, etc.), tanto más frecuentes cuanto mayor haya sido el retraso diagnóstico, que previamente podían estar pasando inadvertidas. La simple toma de leche sin lactosa puede mejorar la situación, o también la restricción en el consumo de algún tipo de frutas. Solo los celíacos y las personas sensibles al gluten experimentan síntomas y diversos trastornos de salud si no mantienen la dieta sin gluten estrictamente y de por vida.[163]
Hay celíacos o sensibles al gluten que pueden tener sensibilidad asociada a la proteína de la leche de vaca e incluso a la horceína del maíz, en cuyo caso tienen que restringir o suprimir su consumo.[201] [202]

Otras causas de no mejoría son la presencia del llamado “gluten oculto” en algunos productos no bien etiquetados, las contaminaciones cruzadas y la presencia de otras condiciones clínicas asociadas a la propia enfermedad, que por sí solas pueden explicar la persistencia de los síntomas (déficit secundario de disacaridasas, insuficiencia pancreática exocrina, sobrecrecimiento bacteriano y colitis microscópica).[19]
Si en el momento del diagnóstico el paciente presenta deficiencias de vitaminas y minerales (hierro, calcio, etc.) puede tomar estos suplementos durante varias semanas o incluso meses, asegurándose que estos no contengan gluten, ni trazas, hasta su completa recuperación.
Es importante conocer que el gluten también está presente en muchos medicamentos, entre los excipientes con los que los elaboran.
Asimismo, el gluten figura entre los ingredientes de muchos productos cosméticos, bajo diferentes nombres difíciles de identificar. Es importante evitar el contacto con estos productos (pastas de dientes, barras de labios, geles, cremas, etc.), ya que, aunque la cantidad de gluten suele ser pequeña, este se puede ingerir por error, absorber a través de la piel o contaminar alimentos en su manipulación (cremas o restos de cremas en las manos, etc.).
Cumplimiento de la dieta sin gluten[editar]
Ninguno de los métodos que se emplean habitualmente (tanto en estudios científicos como en la práctica diaria) para evaluar el cumplimiento de la dieta es objetivo ni fiable: cuestionarios rellenados por los pacientes, evaluación de los síntomas, determinación de los anticuerpos específicos de la celiaquía y hallazgos en las biopsias duodenales.[89][10] De manera intencionada o no, habitualmente los pacientes no reconocen que realizan transgresiones de la dieta, ni son capaces de identificar las contaminaciones accidentales.[10] Estudios actuales demuestran que aproximadamente el 80 % de los celíacos continúa teniendo lesión intestinal, a pesar del tratamiento mantenido con la dieta sin gluten.[78] La principal causa de esta falta de recuperación es la ingesta inadvertida de gluten, principalmente debida a contaminaciones cruzadas.[12][79] Con frecuencia, las personas con una educación básica pobre y una baja comprensión de cómo se realiza una dieta sin gluten creen que están siguiendo estrictamente la dieta, pero están cometiendo errores frecuentes.[12][13] Un problema habitual es la poca conciencia del paciente de fuentes comunes de gluten,[81] como la contaminación cruzada, la avena, las hostias de comunión, las bebidas malteadas, los medicamentos, los alimentos procesados, las comidas en restaurantes y eventos sociales.[82][81][83] Si la supresión del gluten no es completa, persisten el daño en la mucosa intestinal, la activación inmunitaria y el riesgo de desarrollar complicaciones de salud muy graves, entre las que cabe señalar diversos tipos de cáncer (tanto del aparato digestivo, con un incremento del riesgo del 60 %, como de otros órganos), trastornos neurológicos y psiquiátricos (conocidos como "neurogluten"), otras enfermedades autoinmunes, enfermedades cardiovasculares y osteoporosis,[26][28][30][31][32][16][33][29] así como enfermedad celíaca refractaria (que no responde al tratamiento con la dieta)[34][33] y en casos raros (principalmente en niños) la denominada "crisis celíaca", que puede ser mortal.[36][37] La crisis celiaca no está incluida en los protocolos ni directrices médicas actuales y normalmente es confundida por los médicos con una diarrea o gastroenteritis infecciosa.[35]
Ni la ausencia de síntomas digestivos, ni la negatividad de los anticuerpos garantizan que exista una recuperación de la mucosa intestinal, cuya valoración mediante las biopsias es complicada.[10][11] Esto se debe a que las lesiones del intestino suelen consistir en cambios mínimos, sin atrofia de las vellosidades, difíciles de identificar.[10] Se han desarrollado nuevos métodos, aún no validados, para monitorizar el cumplimiento estricto de la dieta, como la medición de péptidos de gluten en las heces o la orina, que parecen ofrecer una alternativa realista.[10][11]
Contaminación cruzada[editar]
El gluten no solo debe evitarse de forma directa (no consumiendo lo que claramente lo contiene), sino en la llamada contaminación accidental o contaminación cruzada: existe la posibilidad de que alimentos en principio libres de gluten puedan entrar en contacto en algún momento con gluten, lo que los convertiría en no aptos para su consumo (presencia de “trazas” de gluten en el producto final).[6]
En el hogar de un celiaco, la mejor regla para evitar las contaminaciones inadvertidas por gluten consiste en eliminar los alimentos con gluten y sustituirlos por sus equivalentes sin gluten, ampliamente disponibles en la actualidad. De esta forma, toda la unidad familiar puede comer con tranquilidad la misma comida. Una vez excluido el gluten del domicilio, y salvo errores, las principales fuentes de contaminación radican en realizar comidas fuera del propio domicilio (bares, restaurantes, casas de familiares o amigos, etc.).[11][203][204][205][206] En estos lugares, incluso con las mejores intenciones en mente y pese a ofrecer comida "sin gluten", a menudo hay contaminación cruzada porque no siguen estrictamente las normas para evitarla.[84] (más información en Dieta sin gluten, sección Medidas básicas para evitar las contaminaciones cruzadas).
Límite de tolerancia[editar]
La cantidad de gluten capaz de causar daños en la salud de un celíaco es extremadamente reducida.[38] Una revisión sistemática de 2008 de los estudios científicos destinados a establecer la cantidad máxima considerada como "segura" concluyó que el límite es inferior a 10 miligramos al día.[207] Por esta razón, el uso de productos con un contenido de gluten menor de 20 ppm (partes por millón), es decir, menor a 20 miligramos de gluten por cada kilogramo de producto, parece garantizar que no se exceda el umbral de 10 miligramos de gluten por día.[38] 20 ppm es la cantidad máxima de gluten permitida para etiquetar los alimentos como "libres de gluten" o "sin gluten" por las directrices vigentes del Codex Alimentarius, elaborado por la OMS y la FAO.[208] No obstante, una parte de los celíacos no tolera tampoco estas cantidades de gluten consideradas como "seguras".[77][209]
La contaminación es acumulativa. Aunque tomadas individualmente, contaminaciones por trazas pueden no exceder el nivel máximo de ingesta diaria de gluten considerado como "seguro" para la salud, es imposible en la práctica evaluar la suma de todas estas contaminaciones diarias individuales para comprender si se ha excedido el umbral de 10 mg por día. La contaminación no se puede medir, porque no se puede prever, precisamente porque es accidental y se deriva de una serie de variables que de ninguna manera es posible mantener bajo control, salvo en un laboratorio experimental. Por lo tanto, el objetivo a lo largo de un día, y día tras día, es evitar las trazas de gluten por contaminación en todo momento y de manera estricta.[38] No hay diferentes grados de gravedad de enfermedad celíaca sino distintas presentaciones: independientemente de si hay o no síntomas, de su tipo o intensidad, o de los órganos a los que afecten, el daño y el riesgo de complicaciones graves están siempre presentes si se consume gluten de manera frecuente, por encima de este umbral de seguridad.[38]
| CONSUMO MEDIO DIARIO DE GLUTEN EN CELÍACOS[80]
(límite de seguridad 10 mg)[207] | ||
|---|---|---|
| Medido en orina | Medido en heces | |
| Adultos | 363 mg | 244 mg |
| Niños | 316 mg | edades 0-3 años: 155 mg
edades 4-12 años: 387 mg |
Un metaanálisis de 2018 que evaluó los estudios experimentales que se empezaron a realizar a partir de 2012 con determinaciones de péptidos de gluten en orina y heces, demuestra que los pacientes celíacos cometen errores mantenidos en la dieta, superando ampliamente los límites diarios considerados como seguros.[80] De hecho, en un estudio controlado de 3 meses de duración de celíacos que ya realizaban dieta sin gluten, los pacientes del grupo placebo (aquellos que no consumieron gluten, sin saberlo) mejoraron histológicamente. Es decir, los resultados de las biopsias duodenales al final del estudio demostraron una recuperación en comparación con la situación al inicio. Esto confirma que, pese a estar siguiendo una dieta sin gluten, estaban consumiendo cantidades significativas previamente a su inclusión en dicho ensayo.[80] Un estudio de 2017 demostró que la recuperación de la mucosa intestinal se correspondía con la ausencia de péptidos de gluten en la orina y viceversa, así como la escasa validez de la determinación de los anticuerpos en sangre.[10]
Dieta de eliminación de la contaminación por gluten[editar]
La dieta sin gluten tiene que ser estricta para conseguir la recuperación y mantenimiento de la salud y el objetivo ideal es "cero gluten".[82] No obstante, una dieta completamente desprovista de gluten es difícil, si no imposible, de conseguir en la práctica diaria, debido a la ubicuidad del gluten, que puede provocar la contaminación por trazas incluso en los alimentos menos sospechosos.[82][195][10]
Si bien cuando se habla de "sin gluten" se piensa en ausencia total de gluten, con los métodos actuales de detección es imposible probar un nivel cero de gluten en los alimentos.[82] En consecuencia, el etiquetado "sin gluten" no es sinónimo de "cero gluten". Por lo general las leyes permiten hasta 20 ppm, es decir, 20 partes por millón o 20 miligramos de gluten por cada kilogramo de producto.[208] Esto significa que en la alimentación diaria está presente un nivel mínimo de contaminación por gluten.[10] Una parte de los pacientes no tolera tampoco estas cantidades de gluten consideradas en general como "seguras" (véase Límite de tolerancia).[77][209]
La dieta de eliminación de la contaminación por gluten ha sido diseñada para intentar retirar cualquier posible fuente de exposición al gluten en la dieta y conseguir el objetivo "cero gluten", y de esta manera permitir que el sistema inmunitario entre en remisión.[77]
Es útil para determinar si la falta de mejoría con la dieta sin gluten es debida a que se ha desarrollado una enfermedad celíaca refractaria o a que hay una reacción a cantidades de gluten presentes por contaminación cruzada. También es de utilidad para superar contaminaciones puntuales, aplicada con una duración más reducida.[77]
El primer paso es retirar todos los alimentos procesados o congelados, incluyendo los que están etiquetados como libres de gluten. Solo se pueden comer alimentos frescos sin procesar, salvo ciertas excepciones como vinagre, aceite de oliva y sal común, siempre extremando las precauciones en la elección, adquisición, almacenamiento y manipulación de los alimentos para evitar contaminaciones cruzadas.[77][208]
Consta de dos fases, siendo la primera más restrictiva. No se permite en ningún momento los alimentos procesados ni congelados, el maíz ni otros granos (salvo arroz etiquetado sin gluten). Tras estas dos fases, se van reintroduciendo gradualmente los alimentos procesados y viendo tolerancia. Se dejan para el final los específicos de celíacos (aquellos que contienen cereales sin gluten, destinados a sustituir a los que tradicionalmente se elaboran con trigo u otros cereales con gluten, como el pan o las pastas alimenticias).[77] (Más información en Dieta sin gluten, sección Dieta de eliminación de la contaminación por gluten).
Es una dieta muy restrictiva y por lo tanto difícil de mantener a largo plazo. Se aplica bajo estricta supervisión de un profesional cualificado y especializado, y durante un tiempo limitado (un máximo de tres o cuatro meses).[77]
Controversias sobre la avena[editar]
La introducción de la avena en la dieta sin gluten ha sido un tema de debate en los últimos años.[210] Estudios y revisiones recientes han arrojado luz sobre esta cuestión.
Todas las variedades de avena contienen gluten.[211] Se trata de proteínas similares a la gliadina del trigo, denominadas aveninas, que actualmente se ha demostrado que son capaces de provocar reacción en personas que padecen trastornos relacionados con el gluten.[211] A esto se suma que la avena frecuentemente está contaminada con otros cereales con gluten.[23]
De hecho, la recomendación de la Federación de Celiacos es evitar la avena y la harina de avena, así como sus derivados a menos que el producto declare en su etiqueta como “alimento sin gluten”.
"Avena pura" se refiere a avena sin contaminar con otros cereales con gluten,[212] lo que incorrectamente se etiqueta como avena "sin gluten" o "libre de gluten". Esto se debe a que tradicionalmente se consideraba que el único problema con la avena era la contaminación con otros cereales con gluten, por lo que en muchos países está permitido desde hace tiempo el uso de "avena pura" en alimentos "sin gluten" y, en la mayoría de los casos, solo mediante la lectura detallada del listado de ingredientes es posible identificarlos.
Estudios actuales demuestran que las distintas variedades de avena tienen distintos grados de toxicidad.[23][212] Algunas variedades de avena pura parecen tener en teoría un bajo grado de toxicidad y algunos expertos opinan que podrían ser incluidas en la dieta sin gluten, pero sería imprescindible conocer exactamente la variedad empleada y no existe actualmente ninguna reglamentación al respecto.[212] El etiquetado como avena "avena pura", "avena sin gluten" o "avena libre de gluten" no se refiere a estas variedades, las cuales no han sido aún identificadas, no se han hecho estudios suficientes, ni se conoce el efecto a largo plazo en los celiacos del consumo de avena pura, por lo que aún no se pueden hacer recomendaciones firmes sobre si es o no posible la inclusión de "avena pura" en la dieta sin gluten.[213][214]
Símbolo de la espiga barrada[editar]

En algunos países desarrollados y otros en vías de desarrollo, se ha elaborado un símbolo universal de “producto sin gluten”, representado por una espiga de trigo encapsulada en un círculo con una barra por delante, denominada "espiga barrada".
Se encuentra regulado por la AOECS (Association Of European Coeliac Societies - Asociación de Celíacos Europeos), quien delega en sus asociaciones miembros la concesión de su uso y control. Las industrias deben certificarse en el ELS (European Licensing Systems - Sistema de Licencias Europeo) para poder utilizarlo.
Para que la espiga barrada tenga validez, debe figurar el número de registro concedido por la asociación. Si no se acompaña de ninguna expresión, significa que el producto contiene menos de 20 mg/kg (20 ppm).
Gluten en los medicamentos y productos farmacéuticos[editar]
Los productos farmacéuticos pueden contener gluten, incluyendo medicamentos recetados y de venta libre, gargarismos y colutorios, suplementos vitamínicos y minerales, productos a base de plantas medicinales y suplementos dietéticos, así como vendas adhesivas, esparadrapos y tiras adhesivas sanitarias.[196][197]
Medicamentos[editar]
En España, la legislación obliga a declarar en el prospecto de los medicamentos la presencia de gluten, cuando ha sido añadido como excipiente de forma intencionada.[215] No obstante, no es posible conocer si un medicamento contiene trazas de gluten, las cuales suponen un riesgo para las personas celíacas y deben ser evitadas.[215] Es probable que en este caso las trazas sean tan pequeñas que no supongan ningún riesgo, pero algunos autores consideran que para garantizar el uso seguro de los medicamentos deberían ser especificadas en el prospecto, el etiquetado y la ficha técnica.[197][215]
La legislación actual en España, y en otros países como Estados Unidos, no exige a los fabricantes el análisis ni la declaración de las trazas de gluten derivadas de residuos durante el proceso de producción de los principios activos o excipientes.[215] Asimismo, los excipientes y los procesos de fabricación pueden cambiar o no estar completamente descritos.[216][217]
La legislación actual solo exige analizar si hay gluten cuando se utiliza almidón de trigo, avena, cebada o centeno como excipiente.[215] En el caso de que se hayan empleado almidones de maíz, patata, arroz y sus derivados, solo obliga a analizar que no existan almidones de otro origen y especificar en el prospecto, el etiquetado y la ficha técnica del medicamento el almidón y la planta de la que procede.[215]
Solo algunos fabricantes realizan controles del producto final y declaran voluntariamente que sus productos son libres de trazas de gluten.[197][216] Un estudio del Grupo de Trabajo de Nutrición del Colegio Oficial de Farmacéuticos de Bizkaia destinado a confeccionar una guía de medicamentos genéricos con y sin gluten, concluyó que aunque los laboratorios aseguran que cumplen la legislación vigente, ninguno realiza análisis para comprobar el contenido final de gluten de los medicamentos genéricos que elaboran.[215]
Generalmente, los profesionales de la salud ignoran las fuentes potenciales de gluten[216] y los farmacéuticos no siempre disponen del tiempo necesario ni los recursos de información adecuados.[216] Por lo tanto, se convierte en labor de los pacientes comprobar si sus medicamentos contienten gluten o trazas de gluten.[216] Para aclarar las dudas y recabar la información precisa, el procedimiento indicado es realizar una consulta directamente con el laboratorio.[197]
Advertencias en medicamentos que contienen almidones de cereales con gluten[editar]
Según el artículo 34 del Real Decreto 1345/2007 y la Circular 02/2008 de la Agencia Española de Medicamentos y Productos Sanitarios, cuando un medicamento contenga como excipiente almidón de trigo, avena, cebada, centeno o cualquiera de sus derivados, además de la declaración obligatoria de su presencia, se deberá incluir la siguiente información:[215]
• Si el medicamento contiene menos de 20 ppm de gluten, se declarará su presencia, pero también se indicará: «es adecuado para pacientes celíacos» y «los pacientes con alergia a X (distinta de la enfermedad celíaca) no deben tomar este medicamento». • Si el medicamento contiene más de 20 ppm se incluirá la siguiente información: «este medicamento contiene almidón de X, que equivale a ‘x’ ppm de gluten, lo quedebe ser tenido en cuenta por los pacientes celíacos» y «los pacientes con alergia a X (distinta de la enfermedad celíaca) no deben tomar este medicamento».
Suplementos vitamínicos, minerales y dietéticos, y productos a base de plantas[editar]
Los suplementos vitamínicos, minerales y dietéticos y los productos a base de plantas medicinales no son medicamentos y por lo tanto no están regulados por la misma legislación que los medicamentos.[217] Por lo general, la lectura del etiquetado no es suficiente para aclarar si el producto contiene gluten o trazas.[217]
Pronóstico[editar]
El seguimiento estricto y continuado de la dieta sin gluten (DSG) produce una remisión clínica sostenida, y que tanto la esperanza de vida como el riesgo de mortalidad o de aparición de complicaciones relacionadas con la celiaquía sean similares a los de la población general.[27][28] El tiempo necesario para conseguir una completa recuperación de la mucosa intestinal oscila entre dos y cinco años desde el inicio de la dieta sin gluten.[10]
La ingesta continuada de gluten, incluso en forma de trazas, y el retraso diagnóstico son los dos factores más relacionados con el desarrollo de complicaciones.[27][28] La mayoría de las recaídas o recidivas que presentan los pacientes celíacos que siguen una dieta sin gluten son debidas a consumos inadvertidos o intencionados de alimentos que contienen gluten o que se han contaminado con gluten en cualquiera de las fases de su elaboración o preparación culinaria.[27][11]
Las personas celíacas sin tratamiento presentan un riesgo aumentado para el desarrollo de todo tipo de cánceres.[28] Los más frecuentes son los relacionadas con linfomas no Hodgkin de células B o T, bien sean intestinales o de otros órganos. El riesgo de desarrollar cánceres gastrointestinales es un 60 % superior al de la población general.[28] El riesgo de cáncer de esófago es elevado y en personas jóvenes, una causa importante de mortalidad es el adenocarcinoma del intestino delgado, provocado por la inflamación crónica de la mucosa intestinal.[28] También se han descrito en personas celíacas tumores orofaríngeos, de estómago, de colon, hepatobiliares, de páncreas, de vejiga, de mama y cerebrales, con un riesgo bajo, ligeramente superior al de población general para la mayoría de ellos.[27][30][32]
El riesgo de desarrollar cáncer disminuye una vez iniciado el tratamiento con la dieta sin gluten y por lo general se equipara con el de la población general, lo que indica que la dieta ejerce un papel protector frente al cáncer en los celíacos.[28] Asimismo, la dieta sin gluten es la única opción para prevenir contra el desarrollo de ciertos raros tipos de cáncer, muy agresivos.[75] El efecto protector de la dieta sin gluten es especialmente eficaz cuando esta se inicia durante el primer año de vida.[75]
Formas refractarias[editar]
Una pequeña parte de las personas con enfermedad celíaca puede llegar a desarrollar una complicación local, en las formas denominadas «refractarias» (que ya no responden al tratamiento con la dieta). Se han definido como aquellos pacientes que continúan teniendo síntomas de malabsorción (dolor abdominal, hinchazón fluctuante, diarreas y pérdida de peso) junto con persistencia de la atrofia de las vellosidades intestinales, durante más de doce meses a pesar de seguir estrictamente una dieta sin gluten. Se acompaña de un claro empeoramiento del estado general.[27][33] Las cifras estimadas de su incidencia son muy variables, con rangos que oscilan entre el 0,3 % y el 10 % de los casos de celiaquía.[33] Los retrasos diagnósticos y la exposición mantenida al gluten de la dieta parecen ser la causa del desarrollo de enfermedad celíaca refractaria.[33] Se han documentado casos de celiaquía refractaria debida a inhalación de partículas de gluten ambientales.[85]
No obstante, esta definición no está ajustada y puede conducir tanto a un infradiagnóstico como a un sobrediagnóstico de enfermedad refractaria. Por un lado, el requisito de la presencia de síntomas no está en consonancia con el hecho de que la mayoría de celíacos con enfermedad activa no presenta síntomas de malabsorción e incluso una parte son completamente asintomáticos a nivel digestivo, por lo que atendiendo a los síntomas podría no reconocerse una enfermedad refractaria. Por otro lado, la mayor parte de casos con atrofia de las vellosidades intestinales mantenida a pesar del tratamiento con la dieta se debe a ingestiones inadvertidas de gluten, por lo que en estos casos podría diagnosticarse por error una enfermedad refractaria.[33] Es necesaria una detallada revisión dietética.[82] Un problema habitual es la poca conciencia del paciente de fuentes comunes de gluten,[81] como la avena, las hostias de comunión, las bebidas malteadas, los medicamentos, los alimentos procesados, las comidas en restaurantes y eventos sociales.[82][81][83] En una pequeña parte de celíacos, las prolaminas del maíz parecen ser la causa del daño mantenido en la mucosa intestinal y se benefician de su retirada de la dieta.[82] Se ha desarrollado una dieta de eliminación de la contaminación por gluten que puede permitir determinar si la falta de mejoría con la dieta sin gluten es debida a que se ha desarrollado una enfermedad celíaca refractaria o a que hay una reacción a cantidades de gluten presentes por contaminación cruzada.[77] (ver sección Dieta de eliminación de la contaminación por gluten).
Estas formas refractarias se clasifican en 2 tipos de acuerdo con los hallazgos inmuno-histoquímicos observados en las biopsias duodenales. En el tipo 1 el fenotipo linfocitario intraepitelial es normal, constituido por linfocitos CD3 y CD8 positivos. En el tipo 2, la población linfocitaria intraepitelial se encuentra alterada, constituida por la expansión clonal de una sola estirpe linfocitaria, que expresa únicamente receptores CD3 en el citoplasma, sin que en la superficie haya receptores CD3 y CD8. Este tipo 2 precisa un seguimiento especial dado su elevado riesgo de progresión a linfoma intestinal primario de células T.[27]
El tratamiento de las formas refractarias consiste en un soporte nutricional adecuado, en el que la dieta sin gluten estricta se complemente con suplementos de vitaminas y minerales. En la mayor parte de los casos es conveniente el tratamiento con glucocorticoides, que en muchos de ellos por lo general producen una mejoría clínica. En los casos resistentes a los glucocorticoides, se suelen emplear los inmunosupresores, que se deben administrar con precaución debido a la posible aparición de efectos secundarios. Entre estos agentes, se han empleado en casos aislados el infliximab y el alemtuzumab, con buena respuesta. [218][219]
No existe aún un tratamiento ideal y el pronóstico de estos pacientes continúa siendo grave, especialmente en las formas tipo 2, en las que la supervivencia es del 44-58 % al cabo de cinco años.[33][220] Esta alta tasa de mortalidad se debe principalmente a que el 33-67 % de los casos progresa a linfoma intestinal primario de células T,[33] que provoca malabsorción grave con insuficiencia intestinal y requiere una nutrición parenteral total.[221] La mayoría de las personas en las que la enfermedad evolucionan a linfoma intestinal fallece durante los ocho meses siguientes al diagnóstico, con una tasa de supervivencia al cabo de cinco años de tan solo un 11 %.[33] Las formas tipo 1 tienen mucho mejor pronóstico, raramente progresan a linfoma[33] y se suele conseguir su recuperación total en el 80-90 % de los casos.[220] Se están desarrollando nuevos tratamientos, tales como los agentes bloqueadores de la interleucina 15 o el trasplante de médula ósea en las formas refractarias de tipo 2.[220]
Profilaxis[editar]
Actualmente, se conoce que ni la duración de la lactancia materna ni la edad de introducción del gluten en la dieta previenen el riesgo de desarrollar la enfermedad celíaca, si bien el retraso en la introducción del gluten se asocia con un retraso en la aparición de la enfermedad.[111][112]
La genética de riesgo (presencia de los haplotipos HLA-DQ2, HLA-DQ8 o alguno de sus alelos) constituye un importante factor predictivo de la posibilidad de desarrollar la enfermedad celíaca.[111][112]
Sensibilidad al gluten no celíaca[editar]

Desde finales del siglo XX y principios del siglo XXI, cada vez con mayor frecuencia se observan pacientes que presentan síntomas digestivos o extradigestivos similares a los de los celíacos, pero tienen serología y genética negativa y mínimas alteraciones en las biopsias duodenales.[222] [223]
Estos pacientes representan entre un 8-12 % de la población general y se benefician claramente del seguimiento con una dieta sin gluten, (DSG) que puede iniciarse en cualquier momento por un período de prueba (de 6 meses como mínimo) y si resulta favorable y eficaz, de forma prolongada durante toda su vida, al igual que los pacientes celíacos.[224] [172][191]
Esta entidad clínica se denomina sensibilidad al gluten no celíaca, sensibilidad al gluten, enteropatía sensible al gluten o enteritis linfocítica no celíaca. Suele acompañarse igualmente de manifestaciones extra-intestinales asociadas, entre las que se incluyen diversos síntomas neurológicos, tales como cefaleas, hormigueos en manos y pies, dolores músculo-esqueléticos, ataxia y cansancio aumentado sin motivo aparente. También se ha descrito su asociación con trastornos de índole psiquiátrica, como el autismo y algunos casos de esquizofrenia.[172][173][174][175]
Como ocurre con la enfermedad celíaca, es difícil relacionar con la ingesta de gluten la aparición de los variados síntomas digestivos y extra-digestivos que presenta la sensibilidad al gluten no celíaca. (Ver sección Dificultad para la identificación de los síntomas).
Asimismo, es habitual no experimentar mejoría o incluso tener un aparente empeoramiento al comienzo de la dieta sin gluten. (Ver sección Mala respuesta a la dieta y persistencia de síntomas).
Contaminación de los alimentos para celíacos[editar]
Los pacientes celíacos se encuentran con importantes problemas de tipo socioeconómico ya que los productos sin gluten son más caros y existe menor variedad. Uno de los problemas existentes en el mercado es que las harinas sin gluten (de arroz o maíz) muchas veces están "contaminadas" debido a que su fabricación se realiza en fábricas donde se utiliza harina de trigo. Desde la Universidad de Valladolid (UVA) se trabaja con empresas harineras para que separen su producción y empiecen a ofertar al mercado variedad de harinas sin gluten y para que se fabriquen productos sin gluten con calidad similar y a un precio asequible.[225]
Día de los celíacos[editar]

El Día Internacional de los Celíacos se celebra el 5 de mayo.[226]
En España, el 27 de mayo se celebra el Día Nacional del Celíaco.[227]
Véase también[editar]
- Dermatitis herpetiforme
- Dieta sin gluten
- Gluten
- Protocolo diagnóstico de la enfermedad celíaca
- Sensibilidad al gluten no celíaca
- Trastornos neurológicos relacionados con el gluten
- Transglutaminasa 2 o TG2
- Retículo endoplasmático 57 o ERp57
Notas[editar]
- ↑ [https://www.nlm.nih.gov/medlineplus/spanish/ency/article/000816.htm Un trastorno autoinmunitario ocurre cuando el sistema inmunitario ataca y destruye tejido corporal sano por error.
Referencias[editar]
- ↑ National Institutes of Health (NIH). «Dental Enamel Defects and Celiac Disease». Archivado desde el original el 17 de junio de 2016. Consultado el 5 de marzo de 2016. «Tooth defects that result from celiac disease may resemble those caused by too much fluoride or a maternal or early childhood illness. Dentists mostly say it’s from fluoride, that the mother took tetracycline, or that there was an illness early on».
- ↑ Ferraz EG, Campos Ede J, Sarmento VA, Silva LR (2012 Nov-Dec). «The oral manifestations of celiac disease: information for the pediatric dentist». Pediatr Dent (Revisión) 34 (7): 485-8. PMID 23265166. «The presence of these clinical features in children may signal the need for early investigation of possible celiac disease, especially in asymptomatic cases. (...) Pediatric dentists must recognize typical oral lesions, especially those associated with nutritional deficiencies, and should suspect the presence of celiac disease, which can change the disease’s course and patient’s prognosis.»
- ↑ Rashid M, Zarkadas M, Anca A, Limeback H (2011). «Oral manifestations of celiac disease: a clinical guide for dentists». J Can Dent Assoc (Revisión) 77: b39. PMID 21507289. «Delays in diagnosis can lead to a variety of complications, including nutritional deficiencies, such as anemia and osteoporosis, reproductive disorders, increased risk of developing other autoimmune disorders and intestinal lymphoma.»
- ↑ Giuca MR, Cei G, Gigli F, Gandini P (enero-febrero de 2010). «Oral signs in the diagnosis of celiac disease: review of the literature». Minerva Stomatol (Revisión) 59 (1-2): 33-43. PMID 20212408. «There are enough evidence making the correlation between CD and oral defects scientifically sustainable. This recognition should lead dentists to play more significant roles in screening for CD, as otherwise, if not properly diagnosed and not treated with a gluten-free diet, may eventually cause some malignancies.»
- ↑ Pastore L, Carroccio A, Compilato D, Panzarella V, Serpico R, Lo Muzio L (marzo de 2008). «Oral manifestations of celiac disease». J Clin Gastroenterol (Revisión) 42 (3): 224-32. PMID 18223505. doi:10.1097/MCG.0b013e318074dd98. «Patients with systematic dental enamel defects should be screened for CD even in the absence of gastrointestinal symptoms.»
- ↑ a b Academy of Nutrition and Dietetics (22 de abril de 2014). «Avoiding Gluten Cross-Contamination». Archivado desde el original el 17 de marzo de 2017. Consultado el 17 de marzo de 2017. «For people with celiac disease, even just a microscopic amount of gluten can cause a reaction and damage to the intestines, such as a single bread crumb on a plate or speck of wheat flour on manufacturing equipment.»
- ↑ a b Volta U, Caio G, De Giorgio R, Henriksen C, Skodje G, Lundin KE (Jun 2015). «Non-celiac gluten sensitivity: a work-in-progress entity in the spectrum of wheat-related disorders». Best Pract Res Clin Gastroenterol (Revisión) 29 (3): 477-91. PMID 26060112. doi:10.1016/j.bpg.2015.04.006.
- ↑ Bern EM, O'Brien RF (agosto de 2013). «Is it an eating disorder, gastrointestinal disorder, or both?». Curr Opin Pediatr (Revisión) 25 (4): 463-70. PMID 23838835. doi:10.1097/MOP.0b013e328362d1ad.
- ↑ a b Schuppan D, Pickert G, Ashfaq-Khan M, Zevallos V (Jun 2015). «Non-celiac wheat sensitivity: differential diagnosis, triggers and implications». Best Pract Res Clin Gastroenterol (Revisión) 29 (3): 469-76. PMID 26060111. doi:10.1016/j.bpg.2015.04.002.
- ↑ a b c d e f g h i j k l m n ñ o p Moreno ML, Rodríguez-Herrera A, Sousa C, Comino I (enero de 2017). «Biomarkers to Monitor Gluten-Free Diet Compliance in Celiac Patients». Nutrients (Revisión) 6 (9): 1. PMC 5295090. PMID 28067823. doi:10.3390/nu9010046.
- ↑ a b c d e f g See JA, Kaukinen K, Makharia GK, Gibson PR, Murray JA (Oct 2015). «Practical insights into gluten-free diets». Nat Rev Gastroenterol Hepatol (Review) 12 (10): 580-91. PMID 26392070. doi:10.1038/nrgastro.2015.156. «A lack of symptoms and/or negative serological markers are not reliable indicators of mucosal response to the diet. (La ausencia de síntomas y/o los marcadores serológicos negativos no son indicadores fiables de la respuesta de la mucosa intestinal a la dieta.)».
- ↑ a b c d e f g h i j See, JA; Kaukinen, K; Makharia, GK; Gibson, PR; Murray, JA (2015 Oct). «Practical insights into gluten-free diets». Nat Rev Gastroenterol Hepatol (Revisión) 12 (10): 580-91. PMID 26392070. doi:10.1038/nrgastro.2015.156.
- ↑ a b c Mulder CJ, van Wanrooij RL, Bakker SF, Wierdsma N, Bouma G (2013). «Gluten-free diet in gluten-related disorders». Dig Dis (Revisión) 31 (1): 57-62. PMID 23797124. doi:10.1159/000347180.
- ↑ a b c d e Leffler DA, Green PH, Fasano A (octubre de 2015). «Extraintestinal manifestations of coeliac disease» [Manifestaciones extra-intestinales de la enfermedad celíaca]. Nat Rev Gastroenterol Hepatol (Revisión) (en inglés) (Londres, Reino Unido) 12 (10): 561-7. PMID 26260366. doi:10.1038/nrgastro.2015.131. «Any organ from the central nervous system to joints, liver or teeth can be affected. Cualquier órgano, desde el sistema nervioso central hasta las articulaciones, el hígado o los dientes, puede verse afectado».
- ↑ Bressan P, Kramer P (29 de marzo de 2016). «Bread and Other Edible Agents of Mental Disease». Front Hum Neurosci (Revisión) 10: 130. PMC 4809873. PMID 27065833. doi:10.3389/fnhum.2016.00130.
- ↑ a b c d Hadjivassiliou M, Duker AP, Sanders DS (2014). «Gluten-related neurologic dysfunction». Handb Clin Neurol (Revisión) 120: 607-19. PMID 24365341. doi:10.1016/B978-0-7020-4087-0.00041-3.
- ↑ a b World Gastroenterology Organisation Global Guidelines (julio de 2016). «Celiac disease». Consultado el 30 de junio de 2017. «The most important obstacle to implementing the recommendations is poor awareness of celiac disease by patients and physicians. Among gastroenterologists, there is a sense that celiac disease does not require follow-up by a specialized physician after diagnosis and may be considered a minor condition in comparison with irritable bowel disease (IBD) and inflammatory bowel syndrome (IBS).(...) There is an urgent need to increase awareness among primary-care physicians and pediatricians about the wide diversity of clinical manifestations. El obstáculo más importante para implementar las recomendaciones es el pobre conocimiento de la enfermedad celíaca por parte de los pacientes y los médicos. Entre los gastroenterólogos, existe la sensación de que la enfermedad celíaca no requiere el seguimiento por un médico especialista después del diagnóstico y que puede considerarse una condición menor en comparación con el síndrome del intestino irritable (SII) y lA enfermedad inflamatoria intestinal(EII).(...) Existe una necesidad urgente de aumentar la conciencia entre los médicos de atención primaria y los pediatras acerca de la gran diversidad de manifestaciones clínicas».
- ↑ a b c d e Lundin KE, Wijmenga C (septiembre de 2015). «Coeliac disease and autoimmune disease-genetic overlap and screening». Nat Rev Gastroenterol Hepatol (Revisión) (en inglés) (Londres, Reino Unido) 12 (9): 507-15. PMID 26303674. doi:10.1038/nrgastro.2015.136. «The abnormal immunological response elicited by gluten-derived proteins can lead to the production of several different autoantibodies, which affect different systems.»
- ↑ a b c d e f g h i j k l m n ñ o p q r s t u v w x y z aa ab ac Polanco Allué, Isabel (2008). Ministerio de Sanidad y Consumo, ed. «Diagnóstico precoz de la enfermedad celíaca». Madrid, España. Archivado desde el original el 5 de octubre de 2018. Consultado el 8 de marzo de 2014.
- ↑ a b c Ciccocioppo R, Kruzliak P, Cangemi GC, Pohanka M, Betti E, Lauret E, Rodrigo L (octubre de 2015). «The Spectrum of Differences between Childhood and Adulthood Celiac Disease» [El espectro de diferencias entre la enfermedad celíaca de la infancia y la vida adulta]. Nutrients (Revisión) (en inglés) (Basel, Suiza) 7 (10): 8733-51. PMC 4632446. PMID 26506381. doi:10.3390/nu7105426.
- ↑ «¿Qué es el gluten?». www.celiacscatalunya.org. Consultado el 30 de julio de 2023.
- ↑ a b Tovoli F, Masi C, Guidetti E, Negrini G, Paterini P, Bolondi L (16 de marzo de 2015). «Clinical and diagnostic aspects of gluten related disorders». World J Clin Cases (Revisión) 3 (3): 275-84. PMC 4360499. PMID 25789300. doi:10.12998/wjcc.v3.i3.275.
- ↑ a b c d Penagini F, Dilillo D, Meneghin F, Mameli C, Fabiano V, Zuccotti GV (18 Nov 18 2013). «Gluten-free diet in children: an approach to a nutritionally adequate and balanced diet». Nutrients (Revisión) 5 (11): 4553-65. PMC 3847748. PMID 24253052. doi:10.3390/nu5114553.
- ↑ a b Kupper, C (abril de 2005). «Dietary guidelines and implementation for celiac disease». Gastroenterol (Revisión) 128 (4 Suppl 1): S121-7. PMID 15825119.
- ↑ The National Institute of Diabetes and Digestive and Kidney Diseases, National Institutes of Health, US Department of Health and Human Services, Bethesda, MD (2016). «Definition and Facts for Celiac Disease». Consultado el 3 de marzo de 2017.
- ↑ a b c d e f g Tommasini, A; Not, T; Ventura, A (agosto de 2011). «Ages of celiac disease: from changing environment to improved diagnostics» [Edades de la enfermedad celíaca: desde la modificación del ambiente al diagnóstico mejorado]. World J Gastroenterol (Revisión) (en inglés) 17 (32): 3665-71. PMID 21990947. doi:10.3748/wjg.v17.i32.3665.
- ↑ a b c d e f g h i j k l m n ñ o p q r s t u v w x y z aa ab ac ad ae af ag Rodrigo, Luis; Garrote, José A.; Vivas, Santiago (septiembre de 2008). «Enfermedad Celíaca». Med Clin (Barc) (Revisión) (Barcelona, España) 131 (7): 264-70. PMID 18775218. Archivado desde el original el 29 de noviembre de 2014. Consultado el 18 de noviembre de 2014.
- ↑ a b c d e f g h i j k l m n ñ Han Y, Chen W, Li P, Ye J (2015). «Association Between Coeliac Disease and Risk of Any Malignancy and Gastrointestinal Malignancy: A Meta-Analysis.». Medicine (Baltimore) (Meta-análisis) 94 (38): e1612. PMC 4635766. PMID 26402826. doi:10.1097/MD.0000000000001612.
- ↑ a b c Ciaccio EJ, Lewis SK, Biviano AB, Iyer V, Garan H, Green PH (26 de agosto de 2017). «Cardiovascular involvement in celiac disease». World J Cardiol (Revisión) 9 (8): 652-666. PMC 5583538. PMID 28932354. doi:10.4330/wjc.v9.i8.652.
- ↑ a b c d e Hourigan CS (junio de 2006). «The molecular basis of coeliac disease». Clin Exp Med (Revisión) 6 (2): 53-9. PMID 16820991.
- ↑ a b c Nadhem ON, Azeez G, Smalligan RD, Urban S (abril de 2015). «Review and practice guidelines for celiac disease in 2014». Postgrad Med (Revisión) 127 (3): 259-65. PMID 25702766. doi:10.1080/00325481.2015.1015926.
- ↑ a b c d e f g Green, PH; Jabri, B (agosto de 2003). «Coeliac disease» [Enfermedad celíaca]. Lancet (Revisión) (en inglés) 362 (9381): 383-91. PMID 12907013.
- ↑ a b c d e f g h i j k l Woodward J (3 de agosto de 2016). «Improving outcomes of refractory celiac disease - current and emerging treatment strategies». Clinical and experimental gastroenterology (Revisión) 9: 225-36. PMC 4976763. PMID 27536154. doi:10.2147/ceg.s87200.
- ↑ a b Lammers KM, Herrera MG, Dodero VI (27 de febrero de 2018). «Translational Chemistry Meets Gluten-Related Disorders». ChemistryOpen (Revisión) 7 (3): 217-232. PMC 5838388. PMID 29531885. doi:10.1002/open.201700197.
- ↑ a b Balaban DV, Dima A, Jurcut C, Popp A, Jinga M (febrero de 2019). «Celiac crisis, a rare occurrence in adult celiac disease: A systematic review». World J Clin Cases (Revisión) 7 (3): 311-319. PMC 6369385. PMID 30746372. doi:10.12998/wjcc.v7.i3.311.
- ↑ a b Fasano A, Catassi C (20 de diciembre de 2012). «Clinical practice. Celiac disease». N Engl J Med (Revisión) 367 (25): 2419-26. PMID 23252527. doi:10.1056/NEJMcp1113994. «celiac crisis, a rare life-threatening syndrome, mostly observed in children, that is characterized by severe diarrhea, hypoproteinemia, and metabolic and electrolyte imbalances. "crisis celíaca, un síndrome raro que pone en peligro la vida, principalmente observado en niños, que se caracteriza por diarrea severa, hipoproteinemia y desequilibrios metabólicos y electrolíticos"».
- ↑ a b de Almeida Menezes M, Cabral V, Silva Lorena SL (enero de 2017). «Celiac crisis in adults: a case report and review of the literature focusing in the prevention of refeeding syndrome». Rev Esp Enferm Dig 109 (1): 67-68. PMID 26912167. doi:10.17235/reed.2016.4073/2015.
- ↑ a b c d e «Le "contaminazioni" nella dieta senza glutine». Associazione Italiana Celiachia (AIC). Consultado el 17 de marzo de 2018.
- ↑ a b c d e f g Newnham ED (marzo de 2017). «Coeliac disease in the 21st century: paradigm shifts in the modern age». J Gastroenterol Hepatol (Revisión). 32 Suppl 1: 82-85. PMID 28244672. doi:10.1111/jgh.13704.
- ↑ a b c d e f g h i j Molina-Infante J, Santolaria S, Sanders DS, Fernández-Bañares F (May 2015). «Systematic review: noncoeliac gluten sensitivity». Aliment Pharmacol Ther (Revisión Sistemática) (en inglés) 41 (9): 807-20. PMID 25753138. doi:10.1111/apt.13155.
- ↑ a b c d e f g h i Ludvigsson, JF; Card, T; Ciclitira, PJ; Swift, GL; Nasr, I; Sanders, DS; Ciacci, C (abril de 2015). «Support for patients with celiac disease: A literature review» [Apoyo para pacientes con enfermedad celíaca: Una revisión de la literatura]. United European Gastroenterol J (Revisión) (en inglés) 3 (2): 146-59. PMC 4406900. PMID 25922674. doi:10.1177/2050640614562599.
- ↑ a b c d e Lionetti E, Gatti S, Pulvirenti A, Catassi C (junio de 2015). «Celiac disease from a global perspective» [Enfermedad celíaca desde una perspectiva global]. Best Pract Res Clin Gastroenterol. (Revisión) (en inglés) 29 (3): 365-79. PMID 26060103. doi:10.1016/j.bpg.2015.05.004.
- ↑ a b Ludvigsson JF, Card TR, Kaukinen K, Bai J, Zingone F, Sanders DS, Murray JA. (abril de 2015). «Screening for celiac disease in the general population and in high-risk groups». United European Gastroenterol J (Revisión) 3 (2): 106-20. PMC 4406899. PMID 25922671. doi:10.1177/2050640614561668.
- ↑ a b c d Pruimboom L, de Punder K (24 de noviembre de 2015). «The opioid effects of gluten exorphins: asymptomatic celiac disease». J Health Popul Nutr (Revisión) 33: 24. PMC 5025969. PMID 26825414. doi:10.1186/s41043-015-0032-y.
- ↑ a b c d e f g h i j k l m Rodrigo, L (2010). «Enfermedad celiaca». IT Sistema Nacional Salud (Revisión) 34 (2): 52.
- ↑ a b «Symptoms & Causes of Celiac Disease What are the symptoms of celiac disease?». National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK). junio de 2016. Consultado el 26 de mayo de 2018.
- ↑ a b Duggan JM (17 de mayo de 2004). «Coeliac disease: the great imitator» [Enfermedad celíaca: la gran imitadora]. Med J Aust (Revisión) (en inglés) 180 (10): 524-6. PMID 1513983.
- ↑ a b Rousset H (marzo de 2004). «A great imitator for the allergologist: intolerance to gluten» [Un gran imitador para el alergólogo: la intolerancia al gluten]. Eur Ann Allergy Clin Immunol (Revisión) (en inglés) 36 (3): 96-100. PMID 15137480.
- ↑ Medeiros L (abril de 2006). «Celiac disease. A condition with multiple faces» [Enfermedad celíaca. Una condición con múltiples caras]. Adv Nurse Pract (Revisión) (en inglés) 14 (4): 49-50, 52-4, 73. PMID 16972475.
- ↑ a b c d e f g h i j MINISTERIO DE SANIDAD Y POLÍTICA SOCIAL, ed. (octubre de 2008). «Nuevo protocolo de Detección Precoz de la Celiaquía». Boletín Impacto - D.G. Agencia de Calidad del SNS. Archivado desde el original el 23 de octubre de 2013. Consultado el 20 de abril de 2014.
- ↑ a b c Vivas S, Vaquero L, Rodríguez-Martín L, Caminero A (noviembre de 2015). «Age-related differences in celiac disease: Specific characteristics of adult presentation» [Diferencias relacionadas con la edad en la enfermedad celíaca: Características específicas de la presentación en adultos]. World J Gastrointest Pharmacol Ther (Revisión) (en inglés) (California, Estados Unidos) 6 (4): 207-12. PMC 4635160. PMID 26558154. doi:10.4292/wjgpt.v6.i4.207.
- ↑ a b c Elli L, Branchi F, Tomba C, Villalta D, Norsa L, Ferretti F, Roncoroni L, Bardella MT (21 de junio de 2015). «Diagnosis of gluten related disorders: Celiac disease, wheat allergy and non-celiac gluten sensitivity». World J Gastroenterol (Revisión) (en inglés) 21 (23): 7110-9. PMC 4476872. PMID 26109797. doi:10.3748/wjg.v21.i23.7110.
- ↑ a b Fasano A, Catassi C (20 de diciembre de 2012). «Clinical practice. Celiac disease». The New England Journal of Medicine (Revisión) (en inglés) 367 (25): 2419-26. PMID 23252527. doi:10.1056/NEJMcp1113994.
- ↑ a b Rodrigo L, Garrote JA, Vivas S (6 de septiembre de 2008). «Celiac disease». Med Clin (Barc) (Revisión) 131 (7): 264-70. PMID 18775218. doi:10.1016/S0025-7753(08)72247-4. «Estos marcadores presentan en general una elevada sensibilidad y especificidad (cercanas al 90 %) en presencia de atrofia marcada de las vellosidades intestinales. Sin embargo, muestran una notable disminución de la sensibilidad (del orden del 40-50 %) en casos con atrofia vellositaria leve o cambios mínimos.»
- ↑ a b c d Lewis NR, Scott BB (1 de julio de 2006). «Systematic review: the use of serology to exclude or diagnose coeliac disease (a comparison of the endomysial and tissue transglutaminase antibody tests)». Aliment Pharmacol Ther (Revisión) 24 (1): 47-54. PMID 16803602. doi:10.1111/j.1365-2036.2006.02967.x.
- ↑ a b Rostami Nejad M, Hogg-Kollars S, Ishaq S, Rostami K (2011). «Subclinical celiac disease and gluten sensitivity» [Enfermedad celíaca subclínica y sensibilidad al gluten]. Gastroenterol Hepatol Bed Bench (Revisión) (en inglés) 4 (3): 102-8. PMC 4017418. PMID 24834166.
- ↑ a b Bold J, Rostami K (2011). «Gluten tolerance; potential challenges in treatment strategies». Gastroenterol Hepatol Bed Bench (Revisión) 4 (2): 53-7. PMC 4017406. PMID 24834157.
- ↑ Lebwohl B, Sanders DS, Green PHR (28 de julio de 2017). «Coeliac disease». Lancet (Revisión). pii: S0140-6736 (17): 31796-8. PMID 28760445. doi:10.1016/S0140-6736(17)31796-8. «Seronegative coeliac disease was also associated with more severe villous atrophy (67 % vs 36 % of patients) and coexisting autoimmune diseases than seropositive coeliac disease. These findings support those reported by Salmi and colleagues,99 who found transglutaminase 2 autoantibodies deposited in the small bowel mucosa in patients with seronegative coeliac disease, despite their seronegativity. The authors indicated that, in seronegative coeliac disease, coeliac antibodies are bound to intestinal transglutaminase 2 autoantibodies with considerably high avidity, which occurs in a chronic immune reaction, rendering the antibodies unable to enter the circulation to cause seropositivity. Seronegative coeliac disease is, therefore, speculated to be associated with chronic, more severe forms of coeliac disease.»
- ↑ Giorgio F, Principi M, Losurdo G, Piscitelli D, Iannone A, Barone M, Amoruso A, Ierardi E, Di Leo A (8 de septiembre de 2015). «Seronegative Celiac Disease and Immunoglobulin Deficiency: Where to Look in the Submerged Iceberg?». Nutrients (Revisión) 7 (9): 7486-504. PMC 4586545. PMID 26371035. doi:10.3390/nu7095350.
- ↑ a b c Elli L, Villalta D, Roncoroni L, Barisani D, Ferrero S, Pellegrini N, Bardella MT, Valiante F, Tomba C, Carroccio A, Bellini M, Soncini M, Cannizzaro R, Leandro G (febrero de 2017). «Nomenclature and diagnosis of gluten-related disorders: A position statement by the Italian Association of Hospital Gastroenterologists and Endoscopists (AIGO)». Dig Liver Dis (Revisión) 49 (2): 138-146. PMID 27887897. doi:10.1016/j.dld.2016.10.016.
- ↑ a b Guandalini S, Polanco I (abril de 2015). «Nonceliac gluten sensitivity or wheat intolerance syndrome?». J Pediatr (Revisión) 166 (4): 805-11. PMID 25662287. doi:10.1016/j.jpeds.2014.12.039.
- ↑ a b c d Ministerio de Sanidad, Servicios Sociales e Igualdad de España (2018). «Protocolo para el diagnóstico precoz de la enfermedad celíaca».
- ↑ a b James, MW; Scott, BB (septiembre de 2001). «Revisión» [Enfermedad celíaca: ¿la causa de varios trastornos asociados?]. Eur J Gastroenterol Hepatol (en inglés) 13 (9): 1119-21. PMID 11564967.
- ↑ a b Catassi, C; Rätsch, IM; Fabiani, E; Rossini, M; Bordicchia, F; Candela, F; et al. (1994). «Coeliac disease in the year 2000 exploring the iceberg» [Enfermedad celíaca en el año 2000 explorando el iceberg]. Lancet (en inglés) 343 (8891): 200-3. PMID 7904667.
- ↑ a b c Cichewicz AB, Mearns ES, Taylor A, Boulanger T, Gerber M, Leffler DA, Drahos J, Sanders DS, Thomas Craig KJ, Lebwohl B (1 de marzo de 2019). «Diagnosis and Treatment Patterns in Celiac Disease». Dig Dis Sci (Revisión). PMID 30820708. doi:10.1007/s10620-019-05528-3.
- ↑ a b c Fasano A (abril de 2005). «Clinical presentation of celiac disease in the pediatric population». Gastroenterology (Revisión) 128 (4 Suppl 1): S68-73. PMID 15825129. doi:10.1053/j.gastro.2005.02.015. «The spectrum of clinical presentations is wide, and currently extraintestinal manifestations (eg, anemia or short stature) are more common than the classic malabsorption symptoms. A high degree of awareness among health care professionals and a liberal use of serologic CD tests can help to identify many of the nonclassic cases.41 Therefore, the primary care pediatrician has a central role in this process of case finding. (...) It is important to note that poor awareness of CD among health professionals tends to self-perpetuate for several reasons (...) Traducción: El espectro de presentaciones clínicas es amplio, y actualmente las manifestaciones extraintestinales (por ejemplo, anemia o talla baja) son más comunes que los síntomas clásicos de malabsorción. Un alto grado de conocimiento entre los profesionales de la salud y un uso liberal de las pruebas serológicas de enfermedad celíaca pueden ayudar a identificar muchos de los casos no clásicos. Por lo tanto, el pediatra de atención primaria tiene un papel central en este proceso de búsqueda de casos. (...) Es importante tener en cuenta que el escaso conocimiento sobre la enfermedad celíaca entre los profesionales de la salud tiende a perpetuarse por varias razones».
- ↑ Matthias T, Pfeiffer S, Selmi C, Eric Gershwin M (abril de 2010). «Diagnostic challenges in celiac disease and the role of the tissue transglutaminase-neo-epitope». Clin Rev Allergy Immunol (Revisión) 38 (2-3): 298-301. PMID 19629760. doi:10.1007/s12016-009-8160-z.
- ↑ a b Fedorak RN, Switzer CM, Bridges RJ (junio de 2012). «Canadian Digestive Health Foundation Public Impact Series 4: celiac disease in Canada. Incidence, prevalence, and direct and indirect economic impact». Can J Gastroenterol (Revisión) 26 (6): 350-2. PMC 3378282. PMID 22720277.
- ↑ a b Fuchs, V; Kurppa, K; Huhtala, H; Collin, P; Mäki, M; Kaukinen, K (agosto de 2014). «Factors associated with long diagnostic delay in celiac disease» [Factores asociados con los largos retrasos diagnósticos de la enfermedad celíaca]. Scand J Gastroenterol (en inglés) 20: 1-7. PMID 25139307. Archivado desde el original el 16 de agosto de 2017. Consultado el 17 de noviembre de 2014.
- ↑ a b Hopper, AD; Hadjivassiliou, M; Butt, S; Sanders, DS (2007 Sep 15). «Adult coeliac disease». BMJ (Revisión) 335 (7619): 558-62. PMID 17855325.
- ↑ a b c Card, TR; Siffledeen, J; West, J; Fleming, KM (julio de 2013). «An excess of prior irritable bowel syndrome diagnoses or treatments in Celiac disease: evidence of diagnostic delay» [Un exceso de previos diagnósticos o tratamientos de síndrome del intestino irritable en la enfermedad celíaca: evidencias del retraso diagnóstico]. Scand J Gastroenterol (en inglés) 48 (7): 801-7. PMID 23697749. doi:10.3109/00365521.2013.786130.
- ↑ a b c Barratt, SM; Leeds, JS; Robinson, K; Lobo, AJ; McAlindon, ME; Sanders, DS (noviembre de 2011). «Prodromal irritable bowel syndrome may be responsible for delays in diagnosis in patients presenting with unrecognized Crohn’s disease and celiac disease, but not ulcerative colitis» [El síndrome del intestino irritable prodrómico puede ser responsable de los retrasos en el diagnóstico en pacientes que presentan enfermedad de Crohn y enfermedad celíaca no reconocidas, pero no colitis ulcerosa]. Dig Dis Sci (en inglés) 56 (11): 3270-5. PMID 21695401. doi:10.1007/s10620-011-1783-y.
- ↑ a b c Norström, F; Lindholm, L; Sandström, O; Nordyke, K; Ivarsson, A (7 de noviembre de 2011). «Delay to celiac disease diagnosis and its implications for health-related quality of life» [Retraso en el diagnóstico de la enfermedad celíaca y sus implicaciones sobre la calidad de vida relacionada con la salud]. BMC Gastroenterol (en inglés) 11: 118. PMID 22060243. doi:10.1186/1471-230X-11-118.
- ↑ «National Institutes of Health Consensus Development Conference Statement on Celiac Disease, June 28-30, 2004». Gastroenterology (Revisión. Conferencia de consenso.) 128 (4 Suppl 1): S1-9. abril de 2005. PMID 15825115.
- ↑ a b c d e f Catassi C, Bearzi I, Holmes GK (abril de 2005). «Association of celiac disease and intestinal lymphomas and other cancers». Gastroenterology (Revisión) 128 (4 Suppl 1): S79-86. PMID 15825131.
- ↑ Szakács Z, Mátrai P, Hegyi P, Szabó I, Vincze Á, Balaskó M, Mosdósi B, Sarlós P, Simon M, Márta K, Mikó A, Pécsi D, Demcsák A, Bajor J (2 de noviembre de 2017). «Younger age at diagnosis predisposes to mucosal recovery in celiac disease on a gluten-free diet: A meta-analysis». PLoS One (Meta-análisis) 12 (11): e0187526. PMC 5695627. PMID 29095937. doi:10.1371/journal.pone.0187526.
- ↑ a b c d e f g h i j Leonard MM, Cureton P, Fasano A (18 de octubre de 2017). «Indications and Use of the Gluten Contamination Elimination Diet for Patients with Non-Responsive Celiac Disease». Nutrients 9 (10): pii: E1129. PMC 5691745. PMID 29057833. doi:10.3390/nu9101129.
- ↑ a b See, JA; Kaukinen, K; Makharia, GK; Gibson, PR; Murray, JA (2015 Oct). «Practical insights into gluten-free diets». Nat Rev Gastroenterol Hepatol (Revisión) 12 (10): 580-91. PMID 26392070. doi:10.1038/nrgastro.2015.156. «Interestingly, several studies show incomplete histological normalization of small bowel mucosa despite a strict GFD, and even 79 % of the treated patients have persistent villous atrophy. This finding could be explained by an inadvertent gluten intake. Curiosamente, varios estudios muestran normalización histológica incompleta de la mucosa del intestino delgado a pesar de una estricta GFD, e incluso el 79 % de los pacientes tratados tienen atrofia vellositaria persistente. Este hallazgo podría explicarse por una ingesta inadvertida de gluten.».
- ↑ a b Rostom A, Murray JA, Kagnoff MF (diciembre de 2006). «American Gastroenterological Association (AGA) Institute technical review on the diagnosis and management of celiac disease». Gastroenterology (Revisión) 131 (6): 1981-2002. PMID 17087937. doi:10.1053/j.gastro.2006.10.004.
- ↑ a b c d e Syage JA, Kelly CP, Dickason MA, Ramirez AC, Leon F, Dominguez R, Sealey-Voyksner JA (1 de febrero de 2018). «Determination of gluten consumption in celiac disease patients on a gluten-free diet». Am J Clin Nutr (Meta-análisis) 107 (2): 201-207. PMID 29529159. doi:10.1093/ajcn/nqx049.
- ↑ a b c d e f Freeman HJ (14 de febrero de 2008). «Refractory celiac disease and sprue-like intestinal disease». World J Gastroenterol (Revisión) 14 (6): 828-30. PMC 2687049. PMID 18240339.
- ↑ a b c d e f g h Ciacci C, Ciclitira P, Hadjivassiliou M, Kaukinen K, Ludvigsson JF, McGough N, Sanders DS, Woodward J, Leonard JN, Swift GL (abril de 2015). «The gluten-free diet and its current application in coeliac disease and dermatitis herpetiformis». United European Gastroenterol J (Revisión) 3 (2): 121-35. PMC 4406897. PMID 25922672. doi:10.1177/2050640614559263.
- ↑ a b c Taylor AK, Lebwohl B, Snyder CL, Green PHR (17 de septiembre de 2015). «Celiac Disease». GeneReviews® (Revisión).
- ↑ a b Welstead L (septiembre de 2015). «The Gluten-Free Diet in the 3rd Millennium: Rules, Risks and Opportunities». Diseases (Revisión) 3 (3): 136-149. PMC 5548243. PMID 28943615. doi:10.3390/diseases3030136.
- ↑ a b c Kasim S, Moriarty KJ, Liston R (junio de 2017). «Nonresponsive celiac disease due to inhaled gluten». N Engl J Med 356 (24): 2548-9. PMID 17568042.
- ↑ «Guia sobre Programa de Controle de Alergênicos». Agência Nacional de Vigilância Sanitária (ANVISA). 1 de abril de 2016. Archivado desde el original el 29 de abril de 2018. Consultado el 7 de abril de 2018.
- ↑ Allen KJ, Turner PJ, Pawankar R, Taylor S, Sicherer S, Lack G, Rosario N, Ebisawa M, Wong G, Mills ENC, Beyer K, Fiocchi A, Sampson HA (30 de abril de 2014). «Precautionary labelling of foods for allergen content: are we ready for a global framework?». World Allergy Organ J (Revisión) 7 (1): 10. PMC 4005619. PMID 24791183. doi:10.1186/1939-4551-7-10.
- ↑ «Questions and Answers: Gluten-Free Food Labeling Final Rule. What does gluten cross-contact mean in the context of the final rule?». Food and Drug Administration (FDA). 12 de diciembre de 2017. Consultado el 23 de marzo de 2018.
- ↑ a b Newnham ED (marzo de 2017). «Coeliac disease in the 21st century: paradigm shifts in the modern age». J Gastroenterol Hepatol (Revisión). 32 Suppl 1: 82-85. PMID 28244672. doi:10.1111/jgh.13704. «A significant weakness of all clinical studies in CD to date has been the absence of an objective measure of dietary compliance. Coeliac antibodies, intestinal histology, and symptoms are all imperfect tools for assessment of adherence. (Una debilidad significativa de todos los estudios clínicos sobre enfermedad celíaca hasta la fecha ha sido la ausencia de una medida objetiva del cumplimiento dietético. Los anticuerpos celíacos, la histología intestinal y los síntomas son todos herramientas imperfectas para la evaluación de la adherencia.)».
- ↑ «Dra. Moreno: “El test de detección de gluten -GlutenDetect- permite saber si se producen ingestas puntuales de la proteína”». Celicidad. 2 de abril de 2017. Consultado el 26 de marzo de 2018.
- ↑ a b c d e Losowsky, MS (2008). A history of coeliac disease 26 (2). pp. 112-20. PMID 18431060. doi:10.1159/000116768.
- ↑ van Berge-Henegouwen GP, Mulder CJ (1993). «Pioneer in the gluten free diet: Willem-Karel Dicke 1905-1962, over 50 years of gluten free diet». Gut 34 (11): 1473-5. PMC 1374403. PMID 8244125. doi:10.1136/gut.34.11.1473.
- ↑ Fasano A (2009). «Celiac Disease Insights: Clues to Solving Autoimmunity». Scientific American (August): 49-57.
- ↑ Anderson CM, French JM, Sammons HG, Frazer AC, Gerrard JW, Smellie JM (1952). «Coeliac disease; gastrointestinal studies and the effect of dietary wheat flour». Lancet 1 (17): 836-42. PMID 14918439. doi:10.1016/S0140-6736(52)90795-2.
- ↑ Dickson, BC; Streutker, CJ; Chetty, R (2006 Oct). «Coeliac disease: an update for pathologists». J Clin Pathol 59 (10): 1008-16. PMID 17021129.
- ↑ Murray, JA (marzo de 1999). «The widening spectrum of celiac disease». Am J Clin Nutr 69 (3): 354-65. PMID 10075317.
- ↑ Catassi C, Bai JC, Bonaz B, Bouma G, Calabrò A, Carroccio A, Castillejo G, Ciacci C, Cristofori F, Dolinsek J, Francavilla R, Elli L, Green P, Holtmeier W, Koehler P, Koletzko S, Meinhold C, Sanders D, Schumann M, Schuppan D, Ullrich R, Vécsei A, Volta U, Zevallos V, Sapone A, Fasano A (Sep 2013). «Non-Celiac Gluten sensitivity: the new frontier of gluten related disorders». Nutrients (Revisión) 5 (10): 3839-53. PMC 3820047. PMID 24077239. doi:10.3390/nu5103839.
- ↑ Fasano A, Sapone A, Zevallos V, Schuppan D (May 2015). «Nonceliac gluten sensitivity». Gastroenterology (Revisión) 148 (6): 1195-204. PMID 25583468. doi:10.1053/j.gastro.2014.12.049.
- ↑ a b c Mäki, M; Mustalahti, K; Kaikkonen, J; Kulmala, P; Haapalaliti, M; Karttunen, T; et al. (junio de 2003). «Prevalence of celiac disease among children in Finland». N Engl J Med 348 (25): 2517-24. PMID 12815137.
- ↑ a b c Fasano, A; Berti, I; Gerarduzzi, T; Not, T; Colletti, RB; Drago, S; et al. (2003). «Prevalence of celiac disease in at-risk and not-at-risk groups in the United States: a large multicenter study». Arch Intern Med 163 (3): 286-92. PMID 12578508.
- ↑ a b c West, J; Logan, RF; Hill, PG; Lloyd, A; Lewis, S; Hubbard, R; et al. (2003). «Seroprevalence, correlates, and characteristics of undetected coeliac disease in England». Gut 52 (7): 960-5. PMID 12801951.
- ↑ a b c d Riestra, S; Fernández, E; Rodrigo, L; García, S; Ocio, G (2000). «Prevalence of coeliac disease in the general population in northern Spain. Strategies of serologic screening». Scand J Gastroenterol 35 (4): 398-402. PMID 10831263.
- ↑ a b c d García Novo, MD; Garfia, C; Acuña Quirós, MD; Asensio, J; Zancada, G; Barrio Gutiérrez, S; et al. (junio de 2007). «Prevalence of celiac disease in apparently healthy blood donors in the autonomous community of Madrid». Rev Esp Enferm Dig 99 (6): 337-42. PMID 17883297.
- ↑ Hovell, CJ; Collett, JA; Vautier, G; Cheng, AJ; Sutanto, E; Mallon, DF; et al. (septiembre de 2001). «High prevalence of coeliac disease in a population-based study from Western Australia: a case for screening?». Med J Aust 175 (5): 247-50. PMID 11587254.
- ↑ Gómez, JC; Selvaggio, GS; Viola, M; Pizarro, B; La Motta, G; De Barrio, S; et al. (septiembre de 2001). «Prevalence of celiac disease in Argentina: screening of an adult population in the La Plata area». Am J Gastroenterol 96 (9): 2700-4. PMID 11569698.
- ↑ Shamir, R; Lerner, A; Shinar, E; Lahat, N; Sobel, E; Bar-or, R; et al. (octubre de 2002). «The use of a single serological marker underestimates the prevalence of celiac disease in Israel: a study of blood donors». Am J Gastroenterol 97 (10): 2589-94. PMID 12385444.
- ↑ a b Biesiekierski JR (2017). «What is gluten?». J Gastroenterol Hepatol (Revisión). 32 Suppl 1: 78-81. PMID 28244676. doi:10.1111/jgh.13703.
- ↑ a b Fasano, A (2011 Jan). «Zonulin and its regulation of intestinal barrier function: the biological door to inflammation, autoimmunity, and cancer». Physiol Rev 91 (1): 151-75. PMID 21248165. doi:10.1152/physrev.00003.2008. Archivado desde el original el 26 de agosto de 2015.
- ↑ Hollon, J; Puppa, EL; Greenwald, B; Goldberg, E; Guerrerio, A; Fasano, A (2015 Feb 27). «Effect of gliadin on permeability of intestinal biopsy explants from celiac disease patients and patients with non-celiac gluten sensitivity». Nutrients 7 (3): 1565-76. PMID 25734566. doi:10.3390/nu7031565.
- ↑ Fasano, A (2012 Oct). «Intestinal permeability and its regulation by zonulin: diagnostic and therapeutic implications». Clin Gastroenterol Hepatol 10 (10): 1096-100. PMC 3458511. PMID 22902773. doi:10.1016/j.cgh.2012.08.012.
- ↑ a b c Lionetti, E; Castellaneta, S; Francavilla, R; Pulvirenti, A; Tonutti, E; Amarri, S; Barbato, M; et al., SIGENP (Italian Society of Pediatric Gastroenterology, Hepatology, and Nutrition) Working Group on Weaning and CD Risk (octubre de 2014). «Introduction of gluten, HLA status, and the risk of celiac disease in children». N Engl J Med 371 (14): 1295-303. PMID 25271602. doi:10.1056/NEJMoa1400697.
- ↑ a b c Vriezinga, SL; Auricchio, R; Bravi, E; Castillejo, G; Chmielewska, A; Crespo Escobar, P; Kolaček, S; et al. (octubre de 2014). «Randomized feeding intervention in infants at high risk for celiac disease». N Engl J Med 371 (14): 1304-15. PMID 25271603. doi:10.1056/NEJMoa1404172.
- ↑ D’Amico, MA; Holmes, JU; Stavropoulos, SN; Frederick, M; Levy, J; De Felice, AR; et al. (2005). «Presentation of pediatric celiac disease in the United States: prominent effect of breastfeeding». Clin Pediatr 44: 249-58.
- ↑ Lo, W; Sano, K; Lebwohl, B; Diamond, B; Green, PH (2003). «Changing presentation of celiac disease». Dig Dis Sci 48: 395-8.
- ↑ Dickey, W; Bodkin, S (1998). «Prospective study of body mass index of patients with celiac disease». BMJ 317: 1290.
- ↑ Bilbao Garay, Javier (2006). «Anemias carenciales I: anemia ferropénica». IT del Sistema Nacional de Salud - Ministerio de Sanidad y Consumo de España 30 (2/2006): 35-41. Archivado desde el original el 5 de marzo de 2016. Consultado el 3 de agosto de 2014.
- ↑ García-Manzanares, A; Lucendo, AJ (2013). «Metabolismo óseo y osteoporosis en la enfermedad celíaca». Enfermedad celíaca y sensibilidad al gluten no celíaca: 325-344. doi:10.3926/oms.57.
- ↑ a b c Green, PH (2005). «The many faces of celiac disease: clinical presentation of celiac disease in the adult population». Gastroenterology 128 (4 Suppl 1): S74-8. PMID 15825130. doi:10.1053/j.gastro.2005.02.016.
- ↑ Ciacci, C; Cavallaro, R; Romano, R; Galletta, DS; Labanca, F; Marino, M; et al. (2001). «Increased risk of surgery in undiagnosed celiac disease». Dig Dis Sci 46: 2206-8.
- ↑ Riestra, S; Domínguez, F; Fernández-Ruiz, E; García-Riesco, E; Nieto, R; Fernández, E; et al. (2006). «Usefulness of duodenal biopsy during routine upper gastrointestinal endoscopy for diagnosis of celiac disease». World J Gastroenterol 12: 5028-32.
- ↑ a b Vivas, S; Ruiz de Morales, JM; Martínez, J; González, MC; Martín, S; Martín, J; et al. (2003). «Human recombinant anti-transglutaminase antibody testing is useful in the diagnosis of silent coeliac disease in a selected group of at risk patients». Eur J Gastroenterol Hepatol 15: 479-83.
- ↑ a b Reunala, T (1998). «Dermatitis herpetiformis; coeliac disease of the skin». Ann Med 30: 416-8.
- ↑ a b Grupo de Trabajo Sobre Enfermedad Celíaca y Sensibilidad al Gluten No Celíaca. «Vídeo con 53 fotos de Dermatitis Herpetiforme. Voz en off: Síntomas * Diagnóstico * Diagnóstico difererencial * Tratamiento». Archivado desde el original el 18 de agosto de 2021. Consultado el 18 de agosto de 2021.
- ↑ Alonso-Llamazares, J; Gibson, LE; Rogers, RS (2007). «Clinical, pathologic and immunopathologic features of dermatitis herpetiformis : review of the Mayo Clinic experience». Int Jour Dermatol 46: 910-9.
- ↑ a b Bethune MT, Khosla C (febrero de 2008). «Parallels between pathogens and gluten peptides in celiac sprue». PLoS Pathog (Revisión) 4 (2): e34. PMC 2323203. PMID 18425213. doi:10.1371/journal.ppat.0040034.
- ↑ Verdu EF, Armstrong D, Murray JA (junio de 2009). «Between celiac disease and irritable bowel syndrome: the "no man's land" of gluten sensitivity». Am J Gastroenterol (Revisión) 104 (6): 1587-94. PMC 3480312. PMID 19455131. doi:10.1038/ajg.2009.188.
- ↑ a b Sanders, DS; Carter, MJ; Hurlstone, DP; Pearce, A; Ward, AM; McAlindon, ME (2001). «Association of adult coeliac disease with irritable bowel syndrome: a case-control study in patients fulfilling ROME IIcriteria referred to secondary care». Lancet 358 (9292): 1504-8. doi:10.1016/S0140-6736(01)06581-3.
- ↑ a b Sanders, DS; Hurlstone, DP; Stokes, RO; Rashid, F; Milford-Ward, A; Hadjivassiliou, M; et al. (2002). «Changing face of adult coeliac disease: experience of a single university hospital in South Yorkshire». Postgrad Med J 78 (915): 31-3. doi:10.1136/pmj.78.915.31.
- ↑ a b Green, PHR; Stavropoulos, SN; Panagi, SG; Goldstein, SL; Mcmahon, DJ; Absan, H; et al. (2001). «Characteristics of adult celiac disease in the USA: results of a national survey». Am J Gastroenterol 96: 126-31. doi:10.1111/j.1572-0241.2001.03462.x.
- ↑ a b Locke III, GR; Weaver, AL; Melton III, LJ; Talley, NJ (2004). «Psycochocial factors in functional gastrointestinaldisorders». Am J Gastroenterol 99: 350-7.
- ↑ Montoro, M; Domínguez Cajal, M (2013). «Enfermedad celíaca en el adulto». Enfermedad celíaca y sensibilidad al gluten no celíaca: 233-284.
- ↑ Pennisi M, Bramanti A, Cantone M, Pennisi G, Bella R, Lanza G (15 de septiembre de 2017). «Neurophysiology of the "Celiac Brain": Disentangling Gut-Brain Connections». Front Neurosci (Revisión) 11: 498. PMC 5591866. PMID 28928632. doi:10.3389/fnins.2017.00498.
- ↑ Makhlouf S, Messelmani M, Zaouali J, Mrissa R (15 de diciembre de 2017). «Cognitive impairment in celiac disease and non-celiac gluten sensitivity: review of literature on the main cognitive impairments, the imaging and the effect of gluten free diet». Acta Neurol Belg (Revisión). PMID 29247390. doi:10.1007/s13760-017-0870-z.
- ↑ Rodrigo, L; Riestra, S; Fuentes, D; González, S; López-Vázquez, A; López-Larrea, C; et al. (2004). «Diversas formas clínicas de presentación de la enfermedad celíaca dentro de la misma familia». Rev Esp Enferm Dig 96: 612-9.
- ↑ Rodrigo, L; Fuentes, D; Riestra, S; Niño, P; Álvarez, N; López-Vázquez, A; et al. (2007). «,Prevalencia aumentada de enfermedad celíaca en familiares de primer y segundo grado: descripción de una familia con 19 miembros estudiados». Rev Esp Enferm Dig 99: 149-55.
- ↑ Hansen, D; Brock-Jacobsen, B; Lund, E; Bjørn, C; Hansen, LP; Nielsen, C; et al. (2006). «Clinical benefit of a gluten-free diet in type 1 diabetic children with screening-detected celiac disease: a population-based screening study with 2 years’ follow-up». Diabetes Care 29: 2452-6.
- ↑ Sategna-Guidetti, C; Bruno, M; Mazza, E; Carlino, A; Predebon, S; Tagliabue, M; et al. (1998). Autoimmune thyroid diseases and coeliac disease 10. pp. 927-31.
- ↑ Collin, P; Mäki, M (1994). «Associated disorders in celiac disease; clinical aspects». Scand J Gastroenterol 29: 769-75.
- ↑ Riestra, S; Fernández, E; Rodrigo, L (1999). «Afectación hepática en la enfermedad celíaca». Rev Esp Enferm Dig 91: 846-52.
- ↑ Hadjivassiliou, M; Grunewald, RA; Chattopadhyay, AK; Davies-Jones, GA; Gibson, A; Jarratt, JA; et al. (1998). «Clinical, radiological and neuro-physiological characteristics of gluten ataxia». Lancet 352: 1582-5.
- ↑ Mustalahti, H; Collin, P; Sievanen, H; Salmi, J; Mäki, M (1999). «Osteopenia in patients with clinically silent celiac disease.warrants screening». Lancet 354: 744-5.
- ↑ a b Ventura, A; Magazzu, G; Greco, L (1999). «Duration of exposure to gluten and risk for autoimmune disorders in patients with celiac disease». Gastroenterology 117: 297-303.
- ↑ Vivas, S; Ruiz de Morales, JM; Fernández, M; Hernando, M; Herrero, B; Casqueiro, J; Gutiérrez, S (2008 Sep). «Age-related clinical, serological, and histopathological features of celiac disease». Am J Gastroenterol 103 (9): 2360-5 quiz 2366. PMID 18702652. doi:10.1111/j.1572-0241.2008.01977.x.
- ↑ Tack, GJ; Verbeek, WH; Schreurs, MW; Mulder, CJ (2010 Apr). «The spectrum of celiac disease: epidemiology, clinical aspects and treatment». Nat Rev Gastroenterol Hepatol 7 (4): 204-13. PMID 20212505. doi:10.1038/nrgastro.2010.23. Archivado desde el original el 29 de noviembre de 2014. Consultado el 18 de noviembre de 2014.
- ↑ Lucendo, AJ; García-Manzanares, A; Arias, A; Fuentes, D; Álvarez, N; Pérez, I; Guagnozzi, D; Rodrigo, L (2011 Dec). Coeliac Disease in the 21st Century: No Longer “Kids’ Stuff” 4 (6). pp. 268-76. doi:10.4021/gr376e.
- ↑ Vriezinga SL, Schweizer JJ, Koning F, Mearin ML (Sep 2015). «Coeliac disease and gluten-related disorders in childhood». Nat Rev Gastroenterol Hepatol (Revisión) 12 (9): 527-36. PMID 26100369. doi:10.1038/nrgastro.2015.98.
- ↑ Dickey, W; Hughes, DF; McMillan, SA (2000). «Reliance on serum endomysial antibody testing underestimates the true prevalence of celiac disease by one fifth». Scand J Gastroenterol 35: 181-3.
- ↑ a b c Abrams, JA; Brar, P; Diamond, B; Rotterdam, H; Green, PH (2006). «Utility in clinical practice of immunoglobulin a anti-tissue transglutaminase antibody for the diagnosis of celiac disease». Clin Gastroenterol Hepatol 4: 726-30. PMID 16630760. doi:10.1016/j.cgh.2006.02.010.
- ↑ a b Mariné, M; Fernández-Bañares, F; Alsina, M; et al. (2009). «Impact of mass screening for gluten-sensitive enteropathy in working population». World J Gastroenterol 15: 1331-8.
- ↑ a b Fernández, E; Riestra, S; Rodrigo, L; Blanco, C; López-Vázquez, A; Fuentes, D; et al. (2005). «Comparison of six human anti-transglutaminase ELISA-tests in the diagnosis of celiac disease in the Saharawi population». World J Gastroenterol 11: 3762-6.
- ↑ Mariné, M; Farré, C; Alsina, M; Vilar, P; Cortijo, M; Salas, A; et al. (2011 Feb). «The prevalence of coeliac disease is signifcantly higher in children compared with adults». Aliment Pharmacol Ther 33 (4): 477-486. PMID 21166832. doi:10.1111/j.1365-2036.2010.04543.x.
- ↑ Farré, C (2013). «Utilidad de la serología en el cribado, diagnóstco y seguimiento de los pacientes con enfermedad celíaca». Enfermedad celíaca y sensibilidad al gluten no celíaca: 151-170.
- ↑ Aziz I, Hadjivassiliou M, Sanders DS (Sep 2015). «The spectrum of noncoeliac gluten sensitivity». Nat Rev Gastroenterol Hepatol (Revisión) 12 (9): 516-26. PMID 26122473. doi:10.1038/nrgastro.2015.107.
- ↑ Green PH, Lebwohl B, Greywoode R (May 2015). «Celiac disease». J Allergy Clin Immunol (Revisión) 135 (5): 1099-106. PMID 25956012. doi:10.1016/j.jaci.2015.01.044.
- ↑ Pinto-Sánchez MI, Bercik P, Verdu EF, Bai JC (2015). «Extraintestinal manifestations of celiac disease». Dig Dis (Revisión) 33 (2): 147-54. PMID 25925916. doi:10.1159/000369541.
- ↑ Walker MM, Murray JA (agosto de 2011). «An update in the diagnosis of coeliac disease». Histopathology (Revisión) 59 (2): 166-79. PMID 21054494. doi:10.1111/j.1365-2559.2010.03680.x. «The correct diagnosis is crucial, as recent studies show a modest but increased mortality in this disease, both in those with and without villous atrophy and even those with latent disease, i.e. positive antibodies and a normal duodenal biopsy. Traducción: El diagnóstico correcto es fundamental, ya que estudios recientes muestran una modesto incremento de la mortalidad en esta enfermedad, tanto en aquellos con y sin atrofia de las vellosidades e incluso en aquellos con enfermedad latente, es decir, anticuerpos positivos y una biopsia duodenal normal.».
- ↑ Donaldson, MR; Firth, SD; Wimpee, H; Leiferman, KM; Zone, JJ; Horsley, W; et al. (2007). «Correlation of duodenal histology with tissue transglutaminase and endomysial antibody levels in pediatric celiac disease». Clin Gastroenterol Hepatol 5: 567-73.
- ↑ Marsh, MN (1992). «Gluten major histocompatibility complex, and the small intestine: a molecular and immunobiologic approach to the spectrum of gluten sensitivity («celiac sprue»)». Gastroenterology 102: 330-54.
- ↑ Isabel Guerra Merino y Félix Mª Gutiérrez Mendiguren. «Recomendaciones para la cesión de material anatomopatológico / Muestras biológicas». Libro Blanco de la Anatomía Patológica en España - Suplemento del 2011.
- ↑ Fernandez-Jimenez, N; Plaza-Izurieta, L; Bilbao, JR (2013). «La Enfermedad Celíaca: Marcadores genéticos». Enfermedad celíaca y sensibilidad al gluten no celíaca: 103-121. doi:10.3926/oms.23.
- ↑ López-Vázquez, A; Rodrigo, L; Fuentes, D; Riestra, S; Bousoño, C; García-Fernández, S; et al. (2002). «MHC class I chain related gene A (MICA) modulates the development of coeliac disease in patients with the high risk heterodimer DQA1*0501/DQB1*0201». Gut 50: 336-40. PMC 1773124. PMID 11839711. doi:10.1136/gut.50.3.336.
- ↑ Hogberg, L; Falth-Magnusson, K; Grodzinsky, E; Stenhammar, L (2003). «Familial prevalence of coeliac disease: a twenty-year follow-up study». Scand J Gastroenterol 38 (61-5).
- ↑ a b c Lebwohl B, Sanders DS, Green PH (6 de enero de 2018). «Coeliac disease». Lancet (Revisión) 391 (10115): 70-81. PMID 28760445. doi:10.1016/S0140-6736(17)31796-8.
- ↑ Ontiveros N, Hardy MY, Cabrera-Chavez F (2015). «Assessing of Celiac Disease and Nonceliac Gluten Sensitivity». Gastroenterology Research and Practice (Revisión) 2015: 723954. PMC 4429206. PMID 26064097. doi:10.1155/2015/723954.
- ↑ Cosnes, J; Cellier, C; Viola, S; Colombel, JF; Michaud, L; Sarles, J; Hugot, JP; Ginies, JL; Dabadie, A; Mouterde, O; Allez, M; Nion-Larmurier, I; Groupe D'Etude et de Recherche Sur la Maladie Coeliaque (2008). «Incidence of autoimmune diseases in celiac disease: Protective effect of the gluten-free diet». Clin Gastroenterol Hepatol 6: 753-758. doi:10.1016/j.cgh.2007.12.022.
- ↑ Rubio-Tapia, A; Kyle, RA; Kaplan, EL; Johnson, DR; Page, W; Erdtmann, F; Brantner, TL; Kim, WR; Phelps, TK; Lahr, BD; et al. (2009). «Increased prevalence and mortality in undiagnosed celiac disease». Gastroenterology 137: 88-93. doi:10.1053/j.gastro.2009.03.059.
- ↑ Silano, M; Volta, U; Mecchia, AM; et al. (2007). «Delayed diagnosis of coeliac disease increases cancer risk». BMC Gastroenterol 7: 8.
- ↑ Brousse, N (2005). «Malignant complications of coeliac disease». Best Pract Res Clin Gastroenterol 19 (3): 401-412.
- ↑ Holmes, GK; Prior, P; Lane, MR; et al. (1989). Malignancy in coeliac disease - effect of a gluten free diet 30. pp. 333-338.
- ↑ Cellier, C; Flobert, C; Cormier, C; et al. (2000). «Severe osteopenia in symptom-free adults with a childhood diagnosis of coeliac disease». Lancet 355: 806.
- ↑ Isasi, C; Colmenero, I; Casco, F; Tejerina, E; Fernandez, N; Serrano-Vela, JI; Castro, MJ; Villa, LF (2014). «Fibromyalgia and non-celiac gluten sensitivity: a description with remission of fibromyalgia». Rheumatol Int.
- ↑ a b c Lundin, KE; Alaedini, A (2012). «Non-celiac gluten sensitivity». Gastrointest Endosc Clin N Am 22: 723-34.
- ↑ a b c Barcia, G; Posar, A; Santucci, M; et al. (2008). «Autism and coeliac disease». J Autism Dev Disord 38: 407-8.
- ↑ a b c Valicenti-McDermott, MD; McVicar, K; Cohen, HJ; et al. (2008). «Gastrointestinal symptoms in children with an autism spectrum disorder and language regression». Pediatr Neurol 39: 392-8.
- ↑ a b Kalaydjian, AE; Eaton, W; Cascella, N; et al. (2006). «The gluten connection: the association between schizophrenia and celiac disease». Acta Psychiatr Scand 113: 82-90.
- ↑ Theo Raynor, D K (2012). «Health literacy». BMJ 344 (e2188).
- ↑ van der Windt DA, Jellema P, Mulder CJ, Kneepkens CM, van der Horst HE (2010). «Diagnostic testing for celiac disease among patients with abdominal symptoms: a systematic review». JAMA 303 (17): 1738-46. PMID 20442390. doi:10.1001/jama.2010.549. «Most studies used similar histological criteria for diagnosing celiac disease (Marsh grade ≥III), but the level of damage may vary across populations. Only 4 studies presented the proportion of patients in whom only partial villous atrophy was found (Marsh grade of IIIA), which ranged from 4% to 100%. The presence of positive serum antibodies has been shown to correlate with the degree of villous atrophy, and patients with celiac disease who have less severe histological damage may have seronegative findings. This could be important, especially in primary care, in which levels of mucosal damage may be lower, and consequently, more patients with celiac disease may be missed. TRADUCCIÓN: La mayoría de los estudios utilizaron criterios histológicos similares para el diagnóstico de la enfermedad celíaca (grado de Marsh ≥3 ), pero el nivel de daño puede variar entre las distintas poblaciones. Sólo 4 estudios presentaron la proporción de pacientes en los que sólo se encontró atrofia de las vellosidades parcial (grado de Marsh 3a), que osciló entre el 4% y el 100%. La presencia de anticuerpos séricos positivos se ha demostrado que se correlaciona con el grado de atrofia de las vellosidades, y los pacientes con celiaquía que tienen daño histológico menos intenso pueden tener resultados serológicos negativos. Esto podría ser importante, especialmente en Atención Primaria, en la que los niveles de daño de la mucosa pueden ser menores y, por lo tanto, más pacientes con enfermedad celíaca puede pasarse por alto.»
- ↑ Debra Marcos Fonalleras, Ana Sánchez Garrido, Óscar González Bernardo, Luis Rodrigo Sáez (2005). «Manual del Residente de Aparato Digestivo - Capítulo 29. Enfermedad celíaca». ENE.
- ↑ Scaramuzza, AE; Mantegazza, C; Bosetti, A; et al. (2013). «Type 1 diabetes and celiac disease: The effects of gluten free diet on metabolic control». World J Diabetes 4: 130-4.
- ↑ Ludvigsson, JF; Leffler, DA; Bai, JC; et al. (2013). «The Oslo definitions for coeliac disease and related terms». Gut 62 (43-52). doi:10.1136/gutjnl-2011-301346.
- ↑ James, MB; Scott, BB (2001). «Celiac disease: the cause of the various associated disorders?». Eur J Gastroenterol Hepatol 13: 1119-21.
- ↑ Catassi, C; Ratsch, IM; Fabiani, E; Rossini, M; Bordicchia, F; Candela, F; et al. (1994). «Coeliac disease in the year 2000 exploring the iceberg». Lancet 343: 200-3.
- ↑ Green, PH; Jabri, B (2003). «Coeliac disease». Lancet 362: 383-91.
- ↑ Peracchi, M; Molteni, N; Cantalamessa, L; Bardella, MT; Peracchi, G; Orsatti, A; Faggioli, P; Bianchi, PA (1992 May). «Abnormal growth hormone responsiveness to stimuli in women with active celiac sprue». Am J Gastroenterol 87 (5): 580-3.
- ↑ a b Giovenale, D; Meazza, C; Cardinale, GM; Farinelli, E; Mastrangelo, C; Messini, B; Citro, G; Del Vecchio, M; Di Maio, S; Possenti, I; Bozzola, M (2007 Oct). «Growth hormone treatment in prepubertal children with celiac disease and growth hormone deficiency». J Pediatr Gastroenterol Nutr 45 (4): 433-7.
- ↑ Cacciari, E; Salardi, S; Volta, U; et al. (1985 Jun 29). «Can antigliadin antibody detect symptomless coeliac disease in children with short stature?». Lancet 1 (8444): 1469-71.
- ↑ a b Meazza, C; Pagani, S; Laarej, K; Cantoni, F; Civallero, P; Boncimino, A; Bozzola, M (2009 Jun). «Short stature in children with coeliac disease». Pediatr Endocrinol Rev 6 (4): 457-63.
- ↑ Fanciulli, G; Delitala, G (2001 Sep). «Gluten-free diet normalizes GH secretion in a girl with celiac disease». J Endocrinol Invest 24 (8): 644-5.
- ↑ Ministerio de Sandidad de España, ed. (30 de mayo de 2008). «Criterios para la utilizacion racional de la hormona de crecimiento en niños». Archivado desde el original el 5 de marzo de 2016. Consultado el 29 de abril de 2014.
- ↑ Ministerio de Sandidad de España (ed.). «Protocolo de seguimiento del tratamiento con hormona de crecimiento en niños». Archivado desde el original el 5 de marzo de 2016. Consultado el 29 de abril de 2014.
- ↑ a b Carroccio, A; Mansueto, P; Iacono, G; et al. (2012). «Non-celiac wheat sensitivity diagnosed by double-blind placebo-controlled challenge: exploring a new clinical entity». Am J Gastroenterol 107: 1898-906.
- ↑ Santaolalla, R; Fernández-Bañares, F; Rodríguez, R; et al. (2008). «Diagnostic value of duodenal anti-tissue transglutaminase antibodies in gluten-sensitive enteropathy». Aliment Pharmacol Ther 27: 820-9.
- ↑ MINISTERIO DE SANIDAD, SERVICIOS SOCIALES E IGUALDAD, ed. (2010). «Enfermedad celiaca». IT del Sistema Nacional de Salud. Volumen 34, Nº 2/2010.
- ↑ Polanco Allué, Isabel. ICM, ed. «Libro blanco de la ENFERMEDAD CELIACA». Lettergraf, S.L.
- ↑ a b Comino, I; Real, A; Moreno, ML; Cebolla, A; Sousa, C (2013). «Detección de la fracción inmunotóxica del gluten: aplicaciones en seguridad alimentaria y en la monitorización de pacientes celíacos». Enfermedad celíaca y sensibilidad al gluten no celíaca: 433-445. doi:10.3926/oms.24.
- ↑ a b c Day L, Augustin MA, Batey IL, Wrigley CW (2006). «Wheat-gluten uses and industry needs». Trends in Food Science & Technology (Revisión) 17 (2): 82- 90. doi:10.1016/j.tifs.2005.10.003.
- ↑ a b c d e f National Institutes of Health (Estados Unidos) (junio de 2016). «Treatment for Celiac Disease». Consultado el 9 de junio de 2017.
- ↑ Flamez B, Clark AA, Sheperis CJ (2014). «Celiac Disease. Psychological Developmental and Family Counseling Issues». The Family Journal 22 (2): 226-30. doi:10.1177/1066480713515407.
- ↑ a b Lamacchia, C; Camarca, A; Picascia, S; Di Luccia, A; Gianfrani, C (2014 Jan 29). «Cereal-based gluten-free food: how to reconcile nutritional and technological properties of wheat proteins with safety for celiac disease patients». Nutrients 6 (2): 575-90. PMC 3942718. PMID 24481131. doi:10.3390/nu6020575.
- ↑ a b c Penagini F, Dilillo D, Meneghin F, Mameli C, Fabiano V, Zuccotti GV (18 de noviembre de 2013). «Gluten-free diet in children: an approach to a nutritionally adequate and balanced diet». Nutrients 5 (11): 4553-65. PMC 3847748. PMID 24253052. doi:10.3390/nu5114553.
- ↑ Cabrera-Chávez, F; Rouzaud-Sández, O; Sotelo-Cruz, N; et al. (2009). «Bovien milk caseins and transglutaminase-treated cereal prolamins are differentially recognized by IgA of celiac disease patients according to their age». J Agric Food Chem 57: 3754-9.
- ↑ Cabrera-Chávez, F; Iamet, S; Miriani, M; et al. (2012). «Maize prolamins resistant to peptic-tryptic digestion maintain immune-recognition by IgA from some celiac disease patients». Plant Foods Hum Nutr 67: 24-30.
- ↑ Makharia GK (2014). «Current and emerging therapy for celiac disease». Front Med (Lausanne) 1: 6. PMC 4335393. PMID 25705619. doi:10.3389/fmed.2014.00006.
- ↑ Biesiekierski JR, Iven J (abril de 2015). «Non-coeliac gluten sensitivity: piecing the puzzle together.». United European Gastroenterol J (Revisión) 3 (2): 160-5. PMC 4406911. PMID 25922675. doi:10.1177/2050640615578388.
- ↑ Silvester JA, Graff LA, Rigaux L, Walker JR, Duerksen DR (septiembre de 2016). «Symptomatic suspected gluten exposure is common among patients with coeliac disease on a gluten-free diet.». Aliment Pharmacol Ther 44 (6): 612-9. PMC 5283559. PMID 27443825. doi:10.1111/apt.13725.
- ↑ «Regole Generali per la Ristorazione Senza Glutine». Associazione Italiana Celiachia (AIC). Consultado el 25 de marzo de 2018.
- ↑ a b Akobeng AK, Thomas AG (1 de junio de 2008). «Systematic review: tolerable amount of gluten for people with coeliac disease». Aliment Pharmacol Ther (Revisión) 27 (11): 1044-52. PMID 18315587. doi:10.1111/j.1365-2036.2008.03669.x.
- ↑ a b c CODEX STAN 118-2008. Versión revisada de 2008 disponible para descarga desde el enlace CODEX STAN 118-1979 Standard for Foods for Special Dietary Use for Persons Intolerant to Gluten
- ↑ a b Hadjivassiliou M, Grünewald RA, Davies-Jones GA (mayo de 2002). «Gluten sensitivity as a neurological illness». J Neurol Neurosurg Psychiatry (Revisión) 72 (5): 560-3. PMC 1737870. PMID 11971034. doi:10.1136/jnnp.72.5.560.
- ↑ Pulido, OM; Gillespie, Z; Zarkadas, M; Dubois, S; Vavasour, E; Rashid, M; Switzer, C; et al. (2009). «Introduction of oats in the diet of individuals with celiac disease: a systematic review». Adv. Food Nutr. Res 57: 235-85.
- ↑ a b Biesiekierski JR (2017). «What is gluten?». J Gastroenterol Hepatol (Revisión). 32 Suppl 1: 78-81. PMID 28244676. doi:10.1111/jgh.13703. «Similar proteins to the gliadin found in wheat exist as secalin in rye, hordein in barley, and avenins in oats and are collectively referred to as “gluten”. Derivatives of these grains such as triticale and malt and other ancient wheat varieties such as spelt and kamut also contain gluten. The gluten found in all of these grains has been identified as the component capable of triggering the immune-mediated disorder, coeliac disease. (Existen proteínas similares a la gliadina que se encuentra en el trigo, como las secalinas en el centeno, las hordeínas en la cebada y las aveninas en la avena, y se denominan colectivamente “gluten”. Derivados de estos granos, tales como el triticale y la malta, y otras variedades de trigo antiguas, tales como la espelta y el kamut, también contienen gluten. El gluten encontrado en todos estos granos ha sido identificado como el componente capaz de desencadenar el trastorno mediado por el sistema inmunitario, la enfermedad celíaca)».
- ↑ a b c Comino I, Moreno Mde L, Sousa C (7 de noviembre de 2015). «Role of oats in celiac disease». World J Gastroenterol 21 (41): 11825-31. PMC 4631980. PMID 26557006. doi:10.3748/wjg.v21.i41.11825. «It is necessary to consider that oats include many varieties, containing various amino acid sequences and showing different immunoreactivities associated with toxic prolamins. As a result, several studies have shown that the immunogenicity of oats varies depending on the cultivar consumed. Thus, it is essential to thoroughly study the variety of oats used in a food ingredient before including it in a gluten-free diet.»
- ↑ de Souza MC, Deschênes ME, Laurencelle S, Godet P, Roy CC, Djilali-Saiah I (2016). «Pure Oats as Part of the Canadian Gluten-Free Diet in Celiac Disease: The Need to Revisit the Issue.». Can J Gastroenterol Hepatol (Revisión) 2016: 1576360. PMC 4904650. PMID 27446824. doi:10.1155/2016/1576360.
- ↑ Haboubi NY, Taylor S, Jones S (octubre de 2006). «Coeliac disease and oats: a systematic review». Postgrad Med J (Revisión sistemática) 82 (972): 672-8. PMC 2653911. PMID 17068278. doi:10.1136/pgmj.2006.045443.
- ↑ a b c d e f g h Pérez-Díez C, Guillén-Lorente S, Palomo-Palomo P (13 de mayo de 2017). «[What medication should be prescribed to a patient with coeliac disease?]». Semergen (Revisión). S1138-3593(17)30038-2. PMID 28511881. doi:10.1016/j.semerg.2017.01.012.
- ↑ a b c d e King AR; University of Kansas Drug Information Center Experiential Rotation Students, August 2012 (octubre de 2013). «Gluten Content of the Top 200 Medications: Follow-Up to the Influence of Gluten on a Patient's Medication Choices». Hosp Pharm 48 (9): 736-43. PMC 3857120. PMID 24421547. doi:10.1310/hpj4809-736.
- ↑ a b c Mangione RA, Patel PN (septiembre-octubre de 2008). «Caring for patients with celiac disease: the role of the pharmacist». J Am Pharm Assoc (Revisión) 48 (5): e125-35; quiz e136-9. PMID 18826893. doi:10.1331/JAPhA.2008.08014.
- ↑ Gillet, HR; Arnott, ID; NcIntyre, M; Campbell, S; Dahele, A; Priest, M; et al. (2002). «Successful infliximab treatment for steroid-refractory celiac disease: a case report». Gastroenterology 122: 800-5.
- ↑ Vivas, S; Ruiz de Morales, JM; Ramos, F; Suárez Vilela, D (2006). «Alemtuzumab for refractory celiac disease in a patient at risk for enteropathy-associated T-cell lymphoma». N Engl J Med 354: 2514-5.
- ↑ a b c Cellier, C; Delabesse, E; Helmer, C; Patey, N; Matuchansky, C; Jabri, B; et al. (2000). «Refractory sprue, coeliac disease, and enteropathy associated T-cell lymphoma». Lancet 356: 203-8.
- ↑ Kelly CP, Bai JC, Liu E, Leffler DA (mayo de 2015). «Advances in diagnosis and management of celiac disease». Gastroenterology (Revisión) 148 (6): 1175-86. PMC 4409570. PMID 25662623. doi:10.1053/j.gastro.2015.01.044.
- ↑ Catassi, C; Bai, JC; Bonaz, B; et al. (2013). «Non-Celiac Gluten sensitivity: the new frontier of gluten related disorders». Nutrients 5: 3839-53.
- ↑ Biesiekierski, JR; Muir, JG; Gibson, PR; et al. (2013). «Is gluten a cause of gastrointestinal symptoms in people without celiac disease?». Curr Allergy Asthma Rep 13 (6): 631-8.
- ↑ Mooney, PD; Aziz, I; Sanders, DS; et al. (2013). «Non-celiac gluten sensitivity: clinical relevance and recommendations for future research». Neurogastroenterol Motil 25: 864-71.
- ↑ [1] investigadores-de-la-universidad-de-valladolid-elaboran-nuevas-harinas-y-productos-aptos-para-celiacos
- ↑ «5 de Mayo - Día Internacional del Celíaco». Archivado desde el original el 6 de mayo de 2018. Consultado el 5 de mayo de 2018.
- ↑ «27 de Mayo, Día Nacional Del Celiaco.». Federación de Asociaciones de Celiacos de España (FACE). Archivado desde el original el 6 de mayo de 2018. Consultado el 5 de mayo de 2018.
Enlaces externos[editar]
- Vídeo: Síntomas de la enfermedad celíaca. Grupo de Trabajo sobre Enfermedad Celíaca. Entrevista al Dr. Luis Rodrigo Sáez, autor de la Información Terapéutica sobre Enfermedad Celíaca del Ministerio de Sanidad, Servicios Sociales e Igualdad de España (IT del Sistema Nacional de Salud, Volumen 34, N.º 2/2010) y pionero mundial en el estudio de la relación entre gluten y fibromialgia.
- Vídeo: Celiaquía en niños: síntomas y errores diagnósticos (1 de 2). Grupo de Trabajo sobre Enfermedad Celíaca. Entrevista al Dr. Luis Rodrigo Sáez (2018)
- Vídeo: Celiaquía en niños: síntomas y errores diagnósticos (2 de 2). Grupo de Trabajo sobre Enfermedad Celíaca. Entrevista al Dr. Luis Rodrigo Sáez (2018)
- Cuando el gluten ataca al cerebro, reportaje en XL Semanal
- mobiCeliac (App para dispositivos móviles con información relevante para celíacos en España. Única app para celíacos en España recomendada en el European Directory of Health Apps 2012-2013).
- Decreto 218/2023 Reglamentación de la Ley Nº 26.588 sobre Enfermedad Celíaca en la República Argentina.



