Análisis retrosintético
El análisis retrosintético es una técnica para diseñar síntesis orgánicas. Esto se consigue transformando mentalmente la molécula objetivo en una secuencia de estructuras precursoras cada vez más sencillas, hasta alcanzar aquellas que sean asequibles comercialmente o simples. Es una técnica desarrollada por el químico estadounidense E.J. Corey en su libro The Logic of Chemical Synthesis.[1] Se emplea en química computacional.
El objetivo de un análisis retrosintético es la simplificación estructural.
A menudo, una síntesis tendrá más de una posible ruta sintética. Así pues esta técnica viene bien para descubrir diferentes alternativas de síntesis y compararlas siguiendo criterios de sencillez y lógica.
Definiciones[editar]
Desconexión[editar]
Es un proceso mental, imaginario donde se rompen enlaces de una forma lógica dando lugar a fragmentos o sintones. Una desconexión se puede considerar lógica si:
- Existe un mecanismo de "reconexión" razonable.
- Conduce a fragmentos relativamente estables.
- Representa la mayor simplificación posible.
Igualmente nada impide recurrir durante el análisis a desconexiones aparentemente ilógicas si se consideran útiles.
Transformada[editar]
Exactamente lo contrario de una reacción; expresar los materiales de partida de un producto.
- Reacción: AB
- Transformada: BA
La flecha equivaldría a la expresión: "Proviene de".
Sintón[editar]
Fragmento, idealizado, de la molécula. El compuesto orgánico (o reactivo) equivalente al sintón sería su equivalente sintético.

Retrón[editar]
Elemento estructural necesario para poder llevar a cabo una cierta transformada (o desconexión).
Árbol retrosintético[editar]
Representación gráfica en forma de árbol de varias de las posibles rutas retrosintéticas.
Molécula objetivo[editar]
El compuesto final deseado.
Conexiones-Desconexiones C-C[editar]

Para diseñar la construcción de un esqueleto de carbono y la propuesta de una retrosíntesis hay que tener las siguientes consideraciones:[2]
- Los grupos funcionales tanto en la molécula precursora, los grupos funcionales resultantes en los intermediarios después de cada reacción de conexión C-C, el uso de interconversiones de grupos funcionales para activar o proteger grupos y los grupos funcionales de la molécula objetivo, así como las reacciones implicadas de acuerdo a su quimioselectividad.
- La estereoquímica del precursor y de la molécula objetivo. Hay que tener en cuenta la selectividad y especificidad de la estereoquímica y los sitios de reacción, así como el interés en la pureza estereoquímica.
- El número de pasos requeridos.
- El costo-beneficio y el rendimiento.
- El tipo de reacciones requeridas para conectar los distintos carbonos de acuerdo a la propuesta de los diferentes sintones, así como la disponibilidad de los precursores y los reactivos. En el análisis, el químico reconoce los grupos funcionales en una molécula y desconecta por métodos que corresponden a reacciones de reconexión conocidas y confiables.
Se pueden considerar la formación de enlaces C-C como conexiones C-C intermoleculares (dos moléculas se conectan en al menos dos carbonos; las más utilizadas), desconexiones C-C bimoleculares (al romperse el enlace C-C se forman dos moléculas distintas; son de menor uso), conexiones C-C intramoleculares (se forma un carbociclo nuevo), desconexiones C-C intramoleculares (un ciclo se rompe formando un esqueleto lineal nuevo) y las transposiciones estructurales (dos carbonos se desconectan en un lugar de la molécula y reconectan en otro).
La conexión-desconexión de los enlaces químicos C-C se pueden clasificar por su mecanismo en heterolíticos (realizados por reacciones nucleófilo-electrófilo), homolíticas (por medio de especies radicalarias de carbono), o a través de mecanismos de cierre o ensamblaje concertado (dos especies neutras apolares que cierran por mecanismos pericíclicos). A continuación se clasifican las reacciones orgánicas más conocidas de acuerdo a su tipo de conexión-desconexión C-C.[2]
- Conexiones C-C heterolíticas:
- Reacción aldólica y sus variantes, es decir, la adición de un carbanión (sintón negativo) a un carbonilo (sintón positivo):
- Requieren enolatos como intermediarios carbaniónicos: Condensación aldólica, Condensación de Knoevenagel, síntesis de Guerbet, condensación de Thorpe, condensación de Tischtschenko, condensación de Baylis-Hillman, Condensación de Mannich, Condensación de Darzens, condensación de Henry, condensación de Ivanov. Las enzimas que catalizan las condensaciones aldólicas son las sintasas EC 2.3.3.
- Requieren organometálicos especiales como intermediarios carbaniónicos: Síntesis de Grignard, Síntesis de aldehídos de Bodroux-Chichibabin, Síntesis de aldehídos de Bouveault, Reacción de Arens-van Dorp, Condensación de Barbier, condensación de Blaise, condensación de Reformatsky, condensación de Favorskii
- Requieren cianuros como intermediarios carbaniónicos: cianhidrinación, síntesis de Strecker, condensación de Passerini.
- Utilizan iluros como como intermediarios carbaniónicos: condensación de Hammick, olefinación de Wittig, olefinación de Julia, olefinación de Takai.
- Condensación acetoacética y sus variantes, es decir, la adición de un carbanión a un derivado carboxílico con eliminación de un grupo saliente y la recuperación del carbonilo (Condensación de Claisen, Síntesis de cetonas de Gilman, homologación de Arndt-Eistert, síntesis de Fujimoto-Belleau, Síntesis de aldehídos de Grundmann, Reacción de Nierenstein, condensación de Stobbe, Síntesis de cetonas de Weinreb) La biosíntesis de policétidos y ácidos grasos procede por condensaciones tipo Claisen con tioésteres, por ejemplo, palmitato sintasa (EC 2.3.1.85), la chalcona sintasa (EC 2.3.1.74), eritronólido sintasa (EC 2.3.1.94) y tetraciclina policétido sintasa (EC 2.3.1.260).
- Condensación aciloínica y sus variantes, es decir, la adición de un carbanión de polaridad invertida (unpouling) como la condensación benzoínica. La tiamina cataliza condensacones tipo aciloína, como el caso de la acetolactato sintasa (EC 2.2.1.6.) y la transcetolasa (EC 2.2.1.1. ).
- Condensación de Michael y sus variantes, es decir la adición de Michael de un carbanión a un compuesto carbonílico α,β-insaturado (Reacción de Benary, Anillación de Danheiser, reacción de Stetter), ciclización de Nazarov.
- Acilación y alquilación de Friedel-Crafts y sus variantes, es decir, la conexión C-C entre un anillo aromático y un electrófilo por mecanismo de SEA (Reacción de Kolbe, acoplamiento de Ullmann, proceso de Baeckeland, Síntesis de Bally-Scholl, Síntesis de Bardhan-Sengupta, Reacción de Betti, Reacción de Blanc, Síntesis de tetralina de Darzens, formilación de Duff, formilación de Vilsmeier-Haack, formilación de Reimer-Tiemman, formilación de Gattermann-Koch, acilación de Hoesch, transposición de Fries, Síntesis de von Baeyer, arilación de Gomberg-Bachmann, Condensación de Pechmann, reacción de Quelet, reacción de Tscherniac-Einhorn.
- Acoplamientos de organometálicos: Síntesis de Heck, Síntesis de Suzuki-Miyaura, Reacción de Sonogashira, acoplamiento de Negishi, Reacción de Pauson-Khand, hidroformilaciones, Síntesis de Rosenmund-von Braun, Síntesis de anillos largos de Ruzicka, acoplamiento de Stille, Reacción Tsuji–Trost
- Alquilación de compuestos organometálicos y carbaniones (acetiluros, triclorometiluros, cianuros, enolatos, síntesis malónica, síntesis de alcanos de Gilman, Acoplamiento de Cadiot-Chodkiewicz, Acoplamiento de Castro-Stephens, Reacción de Frankland-Duppa, Síntesis de Pelouze). Las enzimas que transfieren metilos son las metiltransferasas (EC 2.1.1).
- Adiciones electrofílicas en donde un alqueno se conecta con otro o con pares electrónicos de carbonos de acuerdo a la regla de Markornikov, como las carbonilaciones, la reacción de Prins.
- Desconexiones C-C heterolíticas:
- Retrocondensación aldólica. Las enzimas que catalizan este tipo de reacciones son las C-C liasas (EC 4.1.).
- Retrocondensación de Claisen
- Oxidación de Baeyer-Villiger
- Descarboxilaciones polares, particularmente la descarboxilación de Krapcho.
- Fragmentación de Eschenmoser
- Transposiciones heterolíticas:
- Transposición de Wagner-Meerwein y sus variantes es decir, aquellas que son promovidas por un carbocatión, como la transposición pinacólica. La enzima 2-acetolactato mutasa (EC 5.4.99.3) cataliza este tipo de reacciones durante la biosíntesis de la valina.
- Transposición de Baker-Venkataraman
- Transposición del ácido bencílico
- Conexiones C-C homolíticas:
- Acoplamiento pinacólico
- Polimerización polifenólica por acción de las lactoperoxidasas (EC 1.11.1.7).
- Desconexiones C-C homolíticas:
- Conexiones C-C concertadas (NOTA: Las desconexiones son reversibles con las conexiones):
- Cicloadiciones (La Reacción de Diels Alder es la más conocida. Reacción de Paterno-Büchi). También se han reportado con bencino. Síntesis de olefinas Barton-Kellogg.
- Electrociclizaciones, Ciclación de Bergman
- Transposiciones pericíclicas
- Síntesis de indol de Fischer
Ejemplo[editar]
Podemos ver representados varios de los conceptos anteriormente definidos en el siguiente ejemplo:
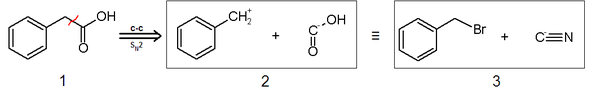
1: Molécula objetivo; 2: Sintones; 3: Equivalentes sintéticos.
En el ejemplo de análisis retrosintético del ácido fenilacético (1), dos sintones son identificados para la desconexión (C-C) y transformada (SN2) planteadas: el sintón nucleófilo "-COOH" y el electrófilo "PhCH2+". Ambos sintones son estructuras imaginarias, sobre el papel. Sus correspondientes equivalentes sintéticos son los que llevarán a cabo la reacción para producir el producto deseado. En este ejemplo, el anión cianuro es el equivalente sintético para el sintón carboxilo, mientras que el bromuro de bencilo lo sería para el sintón bencilo.
En el sentido sintético tendríamos lo siguiente:
- PhCH2Br + NaCN → PhCH2CN + NaBr
- PhCH2CN + 2 H2O → PhCH2COOH + NH3
En la primera etapa tenemos una sustitución nucleófila y en la siguiente la hidrólisis del grupo ciano.
Estrategias[editar]
Estrategias de control de grupos funcionales[editar]
Transformaciones de grupos funcionales sin alterar el esqueleto de carbono. Cuando solo se cambia la naturaleza del grupo funcional puede proceder una interconversión de grupo funcional (sus siglas en inglés, FGI). Por ejemplo, la oxidación de un alcohol secundario a cetona, la deshidratación de un alcohol para formar un alqueno o la hidrólisis de una amida no sustituida en el nitrógeno pueden ser considerados en esta categoría. Un caso especial es la conexión (o desconexión) entre heteroátomos, en donde dos esqueletos distintos desconectados entre sí se encuentran vinculados por medio de un puente heteroatómico. Tal es el caso cuando se llevan a cabo esterificaciones, acilaciones de aminas para formar amidas sustituidas, bases de Schiff, éteres, cetales, etc. En la regioisomerización funcional un grupo funcional o sustituyente migra a otra posición del esqueleto sin alterarlo (como en el caso de las transposiciones alílica, de Bamberger, de Fischer-Hepp, de Neber, de Wallach, de Lobry de Bruyn–van Ekenstein, entre otras). En este punto debe considerarse la quimioselectividad de las reacciones que serán empleadas. Por ejemplo, el NaBH4 es capaz de reducir de forma quimioselectiva un grupo cetona a alcohol secundario en presencia de un grupo éster dentro de la misma molécula sin afectar a este último, mientras que un reductor más potente como el LiAlH4 reduciría ambos grupos a alcohol. El uso de grupos protectores debe ser considerado en este tipo de estrategias.[2]
En las estrategias retrosintéticas basadas en el control de grupos funcionales, normalmente el paso clave es la inserción de un grupo funcional que puede modificarse a voluntad para alterar la estereoquímica, la composición o conectividad y luego es eliminado para habilitar una transformación clave, como el aumento de acidez de un hidrógeno, activación de radicales libres estables, reacción regioespecífica con metales, etc.
Estrategias estereoquímicas[editar]
Durante la síntesis de diversos compuestos, se requiere de cierta especificidad estereoquímica. Cuando se requiere utilizar una determinada reacción hay que tener en cuenta tanto la estereoselectividad como la estereoespecificidad. La síntesis asimétrica es una síntesis orgánica que preserva, introduce o favorece una quiralidad deseada. Las transformaciones estereoquímicas pueden eliminar o transferir la quiralidad deseada, simplificando así el objetivo. Por ejemplo la Reacción de Mitsunobu puede invertir la configuración de un alcohol (epimerización).
Estrategias estructura-objetivo[editar]
Las características principales de un enfoque estructura-objetivo es que la mayor parte de la estrategia sintética se basa en la síntesis de un intermediario altamente simplificador. Esto permite la implementación de múltiples técnicas retrosintéticas.[3] Por ejemplo, se puede partir del cortisol como precursor de diversos compuestos derivados con un esqueleto esteroide similar.
Estrategias basadas en transformación[editar]
Las estrategias basadas en el enfoque basado en la transformación consisten en aplicar una estrategia sintética altamente simplificadora, sobre todo en los pasos finales. El objetivo es que un precursor requiera mecanísticamente diversas reacciones (cascadas, transposiciones, transformaciones que ensamblan múltiples enlaces C-C) para obtener el producto final y experimentalmente solo se requiere un activante o procedimiento que inicia el proceso sin intervenir en los pasos intermedios. La aplicación de transformaciones al análisis retrosintético puede conducir a reducciones poderosas en la complejidad molecular. Desafortunadamente, los retrones potentes basados en transformadas rara vez están presentes en moléculas complejas, y a menudo se necesitan pasos sintéticos adicionales para establecer su presencia. Tres ejemplos de este tipo de estrategia son la síntesis del ácido endiándrico, la síntesis de Corey de la estrona[4] y las biotransformaciones realizadas por un microorganismo específico.
Una variante de esta estrategia son las denominadas reacciones one-pot (literalmente traducido como "reacciones de un sólo recipiente"). Estas son estrategias para mejorar la eficiencia de una reacción química mediante la cual un reactivo se somete a sucesivas reacciones químicas en un solo reactor. Esto es muy deseado por los químicos porque evitar un largo proceso de separación y la purificación de los compuestos químicos intermedios ahorraría tiempo y recursos al tiempo que aumentaría el rendimiento químico. Algunos ejemplos de estas síntesis son la síntesis de piridina de Hantzsch o la Síntesis del índigo de Baeyer-Drewson.
Estrategias topológicas[editar]
La formación de estructuras lineales, ramificadas, policíclicas o heterocíclicas también entran en un tratado especial acerca de las estrategias requeridas para lograr obtener un tipo particular de estructura. Así, hay diversos tratados acerca de síntesis de ciclos de tres, cuatro, cinco, seis miembros, etc. alifáticos o aromáticos, carbocíclicos o heterocíclicos. Por ejemplo, existen diversas estrategias para sintetizar indoles: Bischler-Möhlau, Bartoli, Fischer, Fukuyama, Gassman, Madelung, Reissert, etc.
Normalmente la síntesis de productos naturales con esqueletos policíclicos complejos se basan en estrategias topológicas, como el caso de la síntesis de la manzamina, alcaloides indoloiridoides como la estricnina o de limonoides.
- Se recomiendan las desconexiones que preservan las estructuras de anillo.
- Se desaconsejan las desconexiones que crean anillos de más de 7 miembros.
Los macrociclos son generalmente sintetizados por métodos especiales a partir de moléculas más pequeñas y se plantean dos posibilidades básicas:
- En una reacción intermolecular, en la que dos o más moléculas se unen en una reacción para formar un anillo
- En una reacción intramolecular, donde una o varias moléculas reaccionan para formar un anillo.
Debido a que la formación de macrociclos utiliza la misma química que la que interviene en la polimerización, deben tomarse medidas para prevenir la polimerización y que esta no ocurra. Tradicionalmente, esto implica el uso de química de alta dilución, empleando una gran cantidad de disolvente y bajas concentraciones para prevenir que las moléculas reaccionen con otras moléculas. Además, con frecuencia se necesita que los reactivos sean añadidos poco a poco. A baja concentración, la molécula tiene más probabilidades de reaccionar consigo misma que con otra molécula. Esto es generalmente poco eficiente, utilizando grandes cantidades de disolventes y obteniendo rendimientos bajos.[5]
Por último, también debe tenerse en cuenta los casos en donde puede competir la polimerización contra la ciclización. Por ejemplo cuando se lleva a cabo la doble esterificación intramolecular del ácido láctico en ciertas condiciones se forma la lactida mientras que esterificaciones múltiples intermoleculares conllevan a la formación del ácido poliláctico.[6]
Referencias[editar]
- ↑ J., Corey, E. (1995, ©1989). The logic of chemical synthesis. John Wiley. ISBN 0471115940. OCLC 45734016.
- ↑ a b c Zweifel, George (2007). «1.- SYNTHETIC DESIGN». Modern Organic Synthesis. W. H. Freeman. p. 2-18. ISBN 1429281901.
- ↑ Jones, S. B .; Simmons, B .; Mastracchio, A .; MacMillan, D. W. C. Nature, 2011, 475, 183
- ↑ Corey, E. J.; Ohno, M., Mitra, R. B.; Vatakancherry, P. A. J. Am. Chem. Soc. 1964, 86, 487.
- ↑ 1937-, Melson, Gordon A., (1979). Coordination chemistry of macrocyclic compounds. Plenum Press. ISBN 0306401401. OCLC 4491761.
- ↑ VanWouwe, Pieter; Dusselier, Michiel; Vanleeuw, Evelien; Sels, Bert (10 de mayo de 2016). «Lactide Synthesis and Chirality Control for Polylactic acid Production». ChemSusChem (en inglés) 9 (9): 907-921. ISSN 1864-564X. doi:10.1002/cssc.201501695. Consultado el 26 de enero de 2018.
Bibliografía[editar]
- E. J. Corey, X-M. Cheng, The Logic of Chemical Synthesis, Wiley, New York, 1995, ISBN 0-471-11594-0.
Enlaces externos[editar]
- Centre for Molecular and Biomolecular Informatics Archivado el 12 de febrero de 2005 en Wayback Machine. En inglés.


