Oxidación de Baeyer-Villiger
La oxidación de Baeyer-Villiger (BMVO) es una reacción orgánica en la que se oxida un aldehído o una cetona para obtener un éster por tratamiento con peroxoácidos o peróxido de hidrógeno.[1][2] Las principales características de la oxidación de Baeyer-Villiger son su estereoespecificidad y su regioquímica.[3] Esta reacción toma el nombre de dos químicos, el alemán Johann Friedrich Wilhelm Adolf von Baeyer (1835-1917) y el químico suizo Victor Villiger (1868-1934).[4]
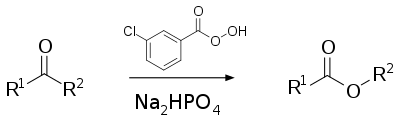
Los reactivos normalmente empleados para llevar a cabo esta reacción son el ácido m-cloroperoxibenzoico (MCPBA), el ácido peracético, o el ácido peroxitrifluoroacético.[5] El reactivo original en la publicación de 1899 es el ácido de Caro descubierto un año antes.[6] Para evitar transesterificación o hidrólisis, se añade con frecuencia un agente tampón (Buffer). Los más comunes son los de fosfato sódico y bicarbonato de sodio.
Mecanismo[editar]
El mecanismo de reacción de esta ruptura oxidativa consta de dos pasos:
- 1) La adición del grupo peróxido al carbonilo, con formación de un intermediario tetraédrico.[7]
- 2) La migración concertada de uno de los carbonos adyacentes al oxígeno con la pérdida de un ácido carboxílico (en el caso de utilizar un peroxoácido), o un alcohol (si se utiliza hidroperóxido). Si la migración de carbono es quiral, la estereoquímica se conserva.
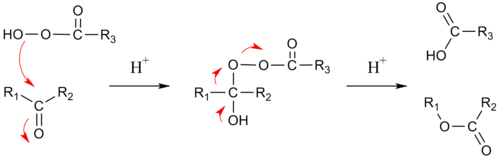

- Aptitudes migratorias: H > Alquilo terciario > ciclohexilo > alquilo secundario, arilo > alquilo primario > metilo
En el estado de transición para el segundo paso, el ángulo diedro R-C-O-O debe ser de 180 ° con el fin de maximizar la interacción entre el enlace sigma R-C y el enlace sigma antienlazante del O-O. Este paso también es asistido por dos o tres unidades de peroxiácido que promueven que el protón del hidroxilo de transporte a su nueva posición.[7]
Para cetonas asimétricas, el grupo que migra es generalmente el que puede estabilizar más la carga positiva. Las cetonas endocíclicas, aun las tensionadas (Por ejemplo, ciclobutanonas, norbornanonas) reaccionan con el peróxido de hidrógeno u otros hidroperóxidos para formar lactonas. Los aldehídos suelen producir ácidos carboxílicos, aunque los formiatos también se puede formar si el grupo que migra es un alquilo terciario, un grupo vinilo rico en electrones o un anillo aromático (reacción de Dakin). A veces el alcohol se forma cuando el formiato es inestable al disolverse en agua.
Oxidación de Baeyer-Villiger biológica[editar]
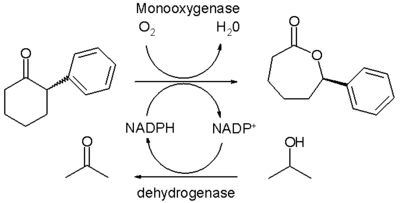
La oxidación de Baeyer-Villiger también puede ser realizada por biocatálisis por la acción de la enzima Baeyer-Villiger monooxigenasa o BVMO. Se han investigado técnicas experimentales para utilizar esta enzima de modo que se siga conservando la enantioselectividad y el rendimiento en estas reacciones con menor producción de desechos tóxicos (Véase química verde). Las principales dificultades son el confinamiento en el agua como medio de reacción, la especificidad de sustrato, la dependencia de la estequiométrica, además de los costes de los cofactores como el NADPH y los costos asociadas a BVMO debido a los largos pasos de purificación que se requieren. Oxidaciones in vivo con células microbianas metabólicamente activas presentan complicaciones por su cuenta.
En un estudio,[8] la purificación de las enzimas es dirigida y la monooxigenasa especial es termoestable y aislada de una cepa específica de E. coli. Esta enzima convierte la 2-fenilciclohexanona racémica en presencia de oxígeno para dar su correspondiente (R)-lactona con un rendimiento químico del 50% y 94% de exceso enantiomérico en un sistema bifásico de agua y hexano. El cofactor NADPH se regenera en cada ciclo catalítico por la acción de una segunda enzima deshidrogenasa como catalizador de sacrificio que consume el isopropanol. La solubilidad del reactivo orgánico y el producto es baja en la fase acuosa evitando así la inhibición.
Véase también[editar]
Referencias[editar]
- ↑ Baeyer, A.; Villiger, V. (1899). «Einwirkung des Caro'schen Reagens auf Ketone» (abstract). Ber. 32 (3): 3625-3633. doi:10.1002/cber.189903203151.
- ↑ Baeyer, A.; Villiger, V. (1900). «Ueber die Einwirkung des Caro'schen Reagens auf Ketone» (abstract). Ber. 33 (1): 858-864. doi:10.1002/cber.190003301153.
- ↑ Crudden, C. M.; Chen, A. C.; Calhoun, L. A. (2000). «A Demonstration of the Primary Stereoelectronic Effect in the Baeyer-Villiger Oxidation of α-Fluorocyclohexanones». Angew. Chem. Int. Ed. 39 (16): 2851-2855. doi:10.1002/1521-3773(20000818)39:16<2851::AID-ANIE2851>3.0.CO;2-Y.
- ↑ Krow, G. R. Org. React. 1993, 43, 251. (doi: 10.1002/0471264180.or043.03)
- ↑ Burton, J.W.; Clark, J.S.; Derrer, S.; Stork, T.C.; Bendall, J.G.; Holmes, A.B. (1997). «Synthesis of Medium Ring Ethers. 5. The Synthesis of (+)-Laurencin» (Abstract). J. Am. Chem. Soc. 119 (32): 7483-7498. doi:10.1021/ja9709132. Archivado desde el original el 5 de octubre de 2008. Consultado el 5 de enero de 2011.
- ↑ Michael Renz, Bernard Meunier (1999). «100 Years of Baeyer-Villiger Oxidations». European Journal of Organic Chemistry 1999 (4): 737-750. doi:10.1002/(SICI)1099-0690(199904)1999:4<737::AID-EJOC737>3.0.CO;2-B.
- ↑ a b The Role of Hydrogen Bonds in Baeyer-Villiger Reactions Shinichi Yamabe and Shoko Yamazaki J. Org. Chem.; 2007; 72(8) pp 3031 - 3041; (Article) doi 10.1021/jo0626562
- ↑ Frank Schulz; François Leca; Frank Hollmann; Manfred T Reetz (2005). «Towards practical biocatalytic Baeyer-Villiger reactions: applying a thermostable enzyme in the gram-scale synthesis of optically active lactones in a two-liquid-phase system» (PDF). Beilstein Journal of Organic Chemistry 1 (10): 10. PMC 1399458. PMID 16542025. doi:10.1186/1860-5397-1-10. Archivado desde el original el 8 de octubre de 2007.
