Amoníaco
| Amoníaco | ||
|---|---|---|
 Estructura química | ||
 Estructura tridimensional | ||
| Nombre IUPAC | ||
| Azano | ||
| General | ||
| Otros nombres |
Hidruro de nitrógeno Trihidruro de nitrógeno Espíritus de Hartshorn | |
| Fórmula estructural |
 | |
| Fórmula molecular | NH3 | |
| Identificadores | ||
| Número CAS | 7664-41-7[1] | |
| Número RTECS |
BO0875000 (anhidro) BQ9625000 (soluciones) | |
| ChEBI | 16134 | |
| ChEMBL | CHEMBL1160819 | |
| ChemSpider | 217 | |
| DrugBank | DB11118 | |
| PubChem | 134988186 | |
| UNII | 5138Q19F1X | |
| KEGG | C00014 D02916, C00014 | |
| Propiedades físicas | ||
| Apariencia |
Incoloro Olor penetrante y desagradable | |
| Densidad | 0,723 kg/m³; 0,000723 g/cm³ | |
| Masa molar | 17,021 g/mol | |
| Punto de fusión | 195,42 K (−78 °C) | |
| Punto de ebullición | 239,81 K (−33 °C) | |
| Punto de descomposición | 773 K (500 °C) <head> | |
| Temperatura crítica | 405,5 K (132 °C) | |
| Presión crítica | 111.52 atm | |
| Índice de refracción (nD) | 1.355 | |
| Propiedades químicas | ||
| Acidez | 9.24[2] pKa | |
| Alcalinidad | 5[3] pKb | |
| Solubilidad en agua | 89.9 g/100 ml (0 °C) | |
| Momento dipolar | 1.42 D | |
| Familia | 15 | |
| Termoquímica | ||
| ΔfH0gas | -45.92 kJ/mol | |
| ΔfH0líquido | -40.2 kJ/mol | |
| S0gas, 1 bar | 192.77 J·mol–1·K | |
| Capacidad calorífica (C) |
4700 kJ/kg·K (liq) 80.08 J/mol·K | |
| Peligrosidad | ||
| SGA |
    | |
| Punto de inflamabilidad | 284 K (11 °C) | |
| NFPA 704 |
1
3
0
| |
| Temperatura de autoignición | 924 K (651 °C) | |
| Frases R | R10, R23, R34, R50 | |
| Frases S | (S1/2), S9, S16, S26, S36/37/39, S45, S61 | |
| Frases H | H221, H314, H331, H400 | |
| Límites de explosividad | 15–28 %[4] | |
| Riesgos | ||
| Ingestión | Es peligroso. Síntomas incluyen náusea y vómitos, daño a los labios, boca y esófago. | |
| Inhalación | Los vapores son extremadamente irritantes y corrosivos. | |
| Piel | Disoluciones concentradas pueden producir quemaduras severas y necrosis. | |
| Ojos | Puede causar daños permanentes, incluso en cantidades pequeñas. | |
| Más información | Hazardous Chemical Database | |
| Compuestos relacionados | ||
| Hidruros relacionados |
Arsina Fosfina Estibina Bismutina | |
| Hidruros de nitrógeno relacionados |
Hidrazina Ácido azothídrico | |
| Otros compuestos | Hidróxido de amonio | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El amoníaco, amoniaco,[5][6] azano, espíritu de Hartshorn, trihidruro de nitrógeno o gas de amonio es un compuesto químico de nitrógeno con la fórmula química NH3. Es un gas incoloro con un característico olor repulsivo. El amoníaco contribuye significativamente a las necesidades nutricionales de los organismos terrestres por ser un precursor de fertilizantes. Directa o indirectamente, el amoníaco es también un elemento importante para la síntesis de muchos fármacos y es usado en diversos productos comerciales, sirve para la elaboración de cosméticos y tintura de cabello, y la fabricación de desinfectantes y limpiadores de cocina. Pese a su gran uso, el amoníaco es cáustico, tóxico y peligroso. La producción industrial del amoníaco en 2012 fue de 198 000 000 toneladas, lo que equivale a un 35 % de incremento con respecto al año 2006, con 146 500 000 toneladas.[7]
El NH3 hierve a los -33.34 °C a una presión de una atmósfera, esto ayuda a que pueda conservarse en estado líquido, bajo presión a temperaturas bajas. Sin embargo, a temperaturas mayores a 405.5 K (temperatura crítica) ningún aumento en la presión producirá la condensación de este gas. Si la presión aumenta por encima del valor crítico de 111.5 atm, cualquier aumento por encima de este valor aumenta la compresión de las moléculas del gas, pero no se forma una fase líquida definida. El amoníaco casero o hidróxido de amonio (NH4OH), es una solución de NH3 en agua. La concentración de dicha solución es medida en unidades de la Escala Baumé, con 26 grados baumé (cerca del 30 % por peso de amoníaco) como concentración típica del producto comercial.[8]
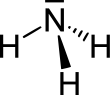
Según la teoría de repulsión entre pares de electrones de la capa de valencia, los pares electrónicos de valencia del nitrógeno en la molécula se orientan hacia los vértices de un tetraedro, distribución característica cuando existe hibridación sp³. Existe un par solitario, por lo que la geometría de la molécula es piramidal trigonal (grupo puntual de simetría C3v). En disolución acuosa se puede comportar como una base y formarse el ion amonio, NH4+, con un átomo de hidrógeno en cada vértice de un tetraedro.
El amoníaco, a temperatura ambiente, es un gas incoloro de olor muy penetrante y nauseabundo. Se produce naturalmente por descomposición de la materia orgánica y también se fabrica industrialmente. Es fácilmente soluble y se evapora rápidamente. Generalmente se vende en forma líquida.
La cantidad de amoníaco producido industrialmente cada año es casi igual a la producida por la naturaleza. El amoníaco es producido naturalmente en el suelo por bacterias, por plantas y animales en descomposición y por desechos animales. El amoníaco es esencial para muchos procesos biológicos.
La mayor parte (más del 80 %) del amoníaco producido en plantas químicas es usada para fabricar abonos y para su aplicación directa como abono. El resto es usado en textiles, plásticos, explosivos, en la producción de pulpa y papel, alimentos y bebidas, productos de limpieza domésticos, refrigerantes y otros productos. También se usa en sales aromáticas.
Por su pH alcalino, es capaz de reaccionar con ácidos produciendo sales de amonio.
Su nombre fue dado por el químico sueco Torbern Bergman (1735-1784) al gas obtenido en los depósitos de sal cerca del templo de Amón, en Libia (del griego: ἀμμωνιακόν [ammōniakón] ‘lo perteneciente a Amón’).[9][10]
Aparición natural[editar]
El amoníaco se encuentra en pequeñas cantidades en la atmósfera, siendo producido por la putrefacción de la materia nitrogenada proveniente de plantas y animales. El amoníaco y sales de amonio también se encuentran en pequeñas cantidades en el agua de lluvia, donde el cloruro de amonio y sulfato de amonio se encuentran en zonas volcánicas; los cristales de bicarbonato de amonio se han encontrado en la Patagonia, en el guano. El riñón segrega amoníaco para neutralizar el exceso de ácido.[11] Las sales de amoníaco se encuentran distribuidas a través de suelo fértil y en el océano. El amoníaco también se encuentra en otras partes del sistema solar: en Marte, Júpiter, Saturno, Urano, Neptuno y Plutón. Las sustancias que contienen amoníaco, o aquellas que son similar a él, se llaman amoniacales.
Propiedades[editar]
El amoníaco es un gas incoloro con un olor desagradable y nauseabundo. Es más ligero que el aire, su densidad es 0.589 veces la del aire de la atmósfera. Se condensa fácilmente por sus fuertes puentes de hidrógeno entre las moléculas; el líquido hierve a –33.3 °C y se congela a los –77.7 °C en cristales blancos.[12]
El amoníaco se puede desodorizar fácilmente reaccionando con algún ácido. Así se forman sales de amonio sin olor, ya que se comporta como una base.
- Sólido
La simetría del cristal es cúbico, su símbolo pearson es CP16, grupo espacial P 213 No.198, constante de red 0.5125 nm.[13]
- Líquido
El amoníaco líquido posee fuertes fuerzas ionizantes reflejando su alta constante dieléctrica de 22. El amoníaco líquido tiene una muy alta entalpía de vaporización (23.35 kJ/mol, cf. agua 40.65 kJ/mol, metano 8.19 kJ/mol, fosfina 14.6 kJ/mol) y puede ser usado en laboratorios en vasos no aislados sin refrigeración.
- Solubilidad en agua
El amoníaco es miscible con agua. En una solución acuosa puede separarse por ebullición. La solución acuosa de amoníaco es una base. La concentración máxima de amoníaco en agua tiene una densidad de 0.880 g/cm³ (880 kg/m³) y es frecuentemente conocido como 'amoníaco 0.880'.
El amoníaco casero o hidróxido de amonio es una solución de NH3 en agua. La concentración de dicha solución es medida en unidades de la Escala Baumé, con 26 grados baumé (cerca del 30 % por peso de amoníaco) como concentración típica del producto comercial.3
- Combustión
El amoníaco no se quema ni sostiene la combustión por sí mismo, excepto en mezclas de combustible con el 15 a 25 % de aire. Cuando se mezcla con oxígeno se quema con una llama de color verde amarillento pálido. A alta temperatura y en la presencia de un catalizador, el amoníaco se descompone en sus elementos constituyentes. La combustión ocurre cuando la clorina pasa a amonio, formando nitrógeno y cloruro de hidrógeno; si la clorina esta en exceso, se forma el explosivo tricloruro de nitrógeno o tricloramina (NCl3).
Estructura[editar]
La molécula de amoníaco tiene una forma trigonal piramidal, como lo predice la teoría de repulsión de los pares de electrones de la capa de valencia, con un ángulo de enlace determinado de 106.7°.[14] El átomo central de nitrógeno tiene cinco electrones externos con un electrón adicional de cada átomo de hidrógeno. Esto da un total de ocho electrones, o cuatro pares de electrones que se acomodan tetraédricamente. Tres de esos pares de electrones se usan como enlaces pares, lo que deja un par de electrones libres. Este par repele más fuertemente los pares de enlaces, entonces el ángulo del enlace no es de 109.5° como se esperaría por un acomodo tetraedral, sino de 106.7°.[14] El átomo de nitrógeno en la molécula tiene un par de electrones libres, lo cual provoca que el amoníaco sea una base, aceptador de protones. Esta forma le da a la molécula un momento dipolo y lo hace una molécula polar. La polaridad de la molécula y, especialmente, su habilidad para formar puentes de hidrógeno, hace que el amoníaco sea altamente miscible en agua. El amoníaco es moderadamente básico, una solución acuosa a 1 M tiene un pH de 11.6 y si un ácido fuerte es agregado a la solución hasta que la solución alcance un pH neutral de (pH=7), 99.4 %, las moléculas amoníaco se protonan. La temperatura y la salinidad también afectan la proporción de NH4+. Lo resultante tiene una forma regular y es isoelectrónico con metano.
La molécula de amoníaco fácilmente experimenta inversión del nitrógeno a temperatura ambiente; una analogía útil es que cuando una sombrilla gira al revés en un fuerte viento. La barrera de energía a esta inversión es de 24.7 kJ/mol, y la frecuencia resonante es de 23.79 GHz, correspondiente a la radiación de un microondas con una longitud de onda de 1.260 cm. La absorción a esta frecuencia fue la primera espectroscopia de microondas observada.[15]
Anfotericidad[editar]
Una de las características más importantes del amoníaco es su basicidad. El amoníaco es considerado una base débil. Se combina con ácidos para formar sales; con ácido clorhídrico forma cloruro de amonio; con ácido nítrico, nitrato de amonio, etc. De cualquier modo, el amoníaco perfectamente seco no se combina con cloruro de hidrógeno completamente seco; el agua es necesaria para que se lleve a cabo la reacción[16] Como una demostración del experimento, las botellas abiertas con amoníaco concentrado y ácido clorhídrico producen nubes de cloruro de amonio, que parecen salir "de la nada" mientras las sales forman donde se encuentran las dos nubes de difusión de las moléculas, entre las dos botellas.
- NH3 + HCl → NH4Cl
Las sales producidas por acción del amoníaco en ácidos son conocidos como compuesto de amonio, los cuales contienen el ion de amonio. (NH4+).
Aunque el amoníaco es conocido como base débil, también funciona como un ácido muy débil. Es una sustancia prótica si es capaz de formar aminas (las cuales contienen el ion NH2− ). Por ejemplo, el litio disuelto en amoníaco líquido para dar una solución de litio amina.
- Li + NH3 → LiNH2 + ½ H2
Auto disociación[editar]
Así como el agua, el amoníaco sufre autoionización molecular para formar sus bases y ácidos conjugados.
- 2 NH
3 (aq) NH+
NH+
4 (aq) + NH−
2 (aq)
En presión y temperatura estándar, K=[NH+
4][NH−
2] = 10−30
Combustión[editar]
La combustión del amoníaco da nitrógeno y agua es una reacción exotérmica:
- 4 NH3 + 3 O2 → 2 N2 + 6 H2O (g) (ΔH°r = −1267.20 kJ/mol)
El poder calorífico, ΔH°c, expresado por mol de amoníaco y formando condensación de agua, es -382.81 kJ/mol. El dinitrógeno es el producto termodinámico de una combustión del amoníaco: todos los óxidos de nitrógeno son inestables con respecto a N2 y O2, el cual es el principio que está detrás del convertido catalítico. Como sea, los óxidos de nitrógeno pueden ser formados por productos cinéticos en la presencia de una catálisis apropiada, una reacción de gran importancia industrial en la producción de ácido nítrico:
- 4 NH3 + 5 O2 → 4 NO + 6 H2O
Una reacción subsecuente lleva NO2
- 2 NO + O2 → 2 NO2
La combustión de amoníaco en aire es muy difícil en la ausencia de un catalizador, pues la temperatura de la llama es normalmente menor que la de encendido de la mezcla de amoníaco con aire. El rango inflamable del amoníaco en el aire es del 16 % al 25 %.[17]
Formación de otros compuestos[editar]
En química orgánica, el amoníaco puede actuar como nucleófilo en reacciones de sustitución nucleofílica. Se pueden formar aminas por la reacción del amoníaco con haloalcanos, aunque el -NH2 resultando es también nucleofílico y aminas secundarias y terciarias se forman como subproductos. Un exceso de amoníaco ayuda a minimizar sustituciones múltiples, y neutraliza a los haluros de hidrógenos formados. La metilamina es preparada comercialmente por la reacción de amoníaco con clorometano, y la reacción de amoníaco con ácido 2-bromopropanoico se ha usado para preparar alanina racémica en un rendimiento al 70 %. La etanolamina se prepara por una reacción de oxidación con etileno: la reacción a veces permite producir dietalonamina y trietalonamina.
Las amidas pueden ser preparas por una reacción de amoníaco con derivados ácidos carboxílicos. El cloruro de acilo es el más reactivo, pero el amoníaco debe estar presente en al menos el doble para neutralizar el ácido clorhídrico formado. Los ésteres y anhídridos también reaccionan con el amoníaco para formar amidas. Las sales amonio de ácidos carboxílicos pueden estar deshidratadas en amidas tanto tiempo que no haya térmicamente grupos sensitivos presentes: temperaturas de 150 °C a 200 °C son requeridas.
El hidrógeno en el amoníaco puede ser reemplazado por metales, así el magnesio quema en el gas con la formación de nitruro de magnesio Mg3N2, y cuando el gas pasa sobre sodio o potasio sobre calentado, sodamida, NaNH2, y potasamida, KNH2, se forman. Donde necesariamente en nomenclatura IUPAC, se prefiere "azano" como nombre del anomíaco: por lo tanto la cloramina se llamaría "cloroazano", no cloroamoníaco.
El amoníaco pentavalente es conocido como λ5-amino, o más comúnmente como hídrico de amonio. Es sólido cristalino es estable solamente en altas presiones, y se descompone de nuevo en amoníaco trivalente y gas hidrógeno en condiciones normales. Se ha investigado esta sustancia como posible combustible en 1966.[18]
Amoníaco como ligando[editar]
El amoníaco puede funcionar como un ligando en complejo de metales de transición. Es un donor-σ, en medio de las series espectroquímicas, y muestra un comportamiento intermedio en duro-blando. Algunos complejos de amoníaco incluyen 'tetraamminediaquacopper'([Cu(NH3)4(H2O)2]2+), ([Ag(NH3)2]+) que es la especie activa del agente de Tollen's. La formación de este complejo también puede distinguirse entre precipitados de diferentes haluros de plata: cloruro de plata (AgCl) es soluble en una solución de amoníaco diluido (2M), el bromuro de plata (AgBr) es soluble solo en una solución de amoníaco concentrado, donde el yoduro de plata (AgI) es insoluble en amoníaco líquido.
Los complejos de cromo se conocieron en el siglo XIX, y formaron la base de la teoría revolucionaria de Alfred Werner, sobre la estructura de la coordinación de compuestos. Werner notó solamente dos isómeros ("fac"- y "mer"-) del complejo [CrCl3(NH3)3] puede formarse, y concluyó que los ligados deben estar acomodados alrededor de los iones de metales en los vértices de un octahedron. Esta propuesta ha disido confirmada desde entonces por la cristalografía de rayos X.
Un amoníaco ligando unido a un ion metal es marcadamente más ácido que una molécula libre de amoníaco, aunque la desprotonación en una solución acuosa aún es raro. Un ejemplo es la reacción Calomel:
- Hg2Cl2 + 2 NH3 → Hg + HgCl(NH2) + NH4+ + Cl−
Amoníaco en teoría de grupos[editar]
El grupo puntual para amoníaco es C3v cuando el eje mayor va a través del nitrógeno vertical. Cuando el eje mayor está hilado ya sea en sentido de las manecillas del reloj o al contrario, en 120°, cada hidrógeno se mueve en la localización previa de otro hidrógeno. Otro aspecto del grupo puntal de C3v incluye tres planos verticales de simetrías que intercepta al nitrógeno y a uno de los hidrógenos permitiendo a los otros dos que se reflejen el uno con otro.
La matriz matemática para este subgrupo particular es complicado desde que las matrices producidas por las rotaciones o las reflexiones son reducibles comparadas a otras matrices que son irreducibles. Por eso, una transformación similar debe ser hecha en cada porción de la matriz que es reducible. La transformación similar para el amoníaco viene de los cálculos del diagrama orbital molecular de simetría adaptado a una combinación lineal para la contribución de enlaces de cada uno de los hidrógenos.
Detección[editar]
- Esta sección es sobre detección en el laboratorio.
Amoníaco en solución[editar]
El amoníaco y las sales de amonio pueden ser fácilmente detectadas, en rastros minutos, añadiendo la solución de Nessler, la cual le da una coloración amarilla en presencia del menor rastro amoníaco o sales de amonio. La cantidad de amoníaco en sales amonio puede ser estimado cuantitativamente por destilación de sales con hidróxido de sodio o hidróxido de potasio, el amoníaco evoluciona estando absorbido en un volumen conocido en ácido sulfúrico estándar y el exceso de ácido después determina el análisis volumétrico; o el amoníaco puede ser absorbido en ácido clorhídrico y el cloruro de amonio se forma tan precipitado como el hexacloroplatinato de amonio, (NH4)2PtCl6.
Amoníaco gaseoso[editar]
Los palos de azufre se queman para detectar pequeñas fugas en los sistemas de refrigeración de amoníaco. Cantidades más grandes pueden ser detectadas calentando las sales con un álcali cáustico o con óxido de calcio, cuando el olor característico del amoníaco sea aparente. El amoníaco es un irritante y la irritación aumenta con la concentración; el límite permitido de exposición es 25 ppm, y letal arriba 500 ppm.[19] Concentraciones más altas son difícilmente detectadas por detectores convencionales, el tipo de defectos se escoge de acuerdo a la sensibilidad requerida (semiconductor, catalítico, electroquímico). Se han propuesto sensores holográficos para detectar concentraciones arriba del 12.5 % en volumen.[20]
Nitrógeno amoniacal (NH3-N)[editar]
El nitrógeno amoniacal (NH3-N) es una medida comúnmente usada para examinar la cantidad de iones amonio, derivados naturalmente del amoníaco, y regresado a amoníaco por procesos orgánicos, en agua o desechos líquidos. Es una medida usada principalmente para cuantificar valores en el tratamiento de desperdicio y sistemas de purificación de agua, así como medida de la salud reservas de agua natural y hecha por el hombre. Se mide en unidades de mg/L (miligramos/Litros).
Historia[editar]

Los Romanos le dieron el nombre de 'sal ammoniacus' (sal de amoníaco) a los depósitos de cloruro de amoníaco colectados cerca del templo de Amun (en griego Ἄμμων" Ammon) en la antigua Libia por la proximidad del templo.[21] Las sales de amoníaco se conocen desde tiempo antiguos; así es que el término de "Hammoniacus sal" aparece en las escrituras de Plinio,[22] aunque no se sabe si el término es idéntico al término moderno de "sal-ammoniac" (cloruro de amonio).[23]
En la forma de sal de amoníaco, el amoníaco fue importante en la alquimia medieval, como en el siglo VIII, se mencionó por químico Persa Jābir ibn Hayyān,[24] y los alquimistas desde el siglo XIII, siendo mencionado por Albertus Magnus.[12] También fue utilizado por tintoreros en la Edad Media en forma de orina fermentada para alterar el color de los tintes vegetales. En el siglo XV, Basilius Valentinus demostró que el amoníaco podía ser obtenido por la acción de álcalis en sal de amoníaco. En un periodo posterior, cuando las sales de amoníaco se obtenían de la destilación de pezuñas y cuernos de los bueyes y neutralizando el carbonato resultante con ácido clorhídrico.[25]
El amoníaco gaseoso fue aislado por primera vez por Joseph Priestley en 1774 y fue nombrado por él como "aire alcalino".[26] Once años después en 1785, Claude Louis Berthollet encontró su composición.[12]
La producción de amoníaco a partir del nitrógeno del aire (e hidrógeno) fue inventada por Fritz Haber y Robert LeRossignol. La patente fue enviada en 1909 (USPTO N° 1.202.995) y concedida en 1916. Luego Carl Bosch desarrolló la producción industrial (proceso de Haber-Bosch). Su primer uso fue en una escala industrial en Alemania durante la Primera Guerra Mundial.[7] El amoníaco fue usado para producir explosivos para sostener refuerzos de guerra.[27] El Premio Nobel de Química de 1918 fue concedido a Fritz Haber "por la síntesis del amoníaco a partir de sus elementos".El proceso ha llegado a ser la principal fuente de nitrógeno fijado en el mundo, mejorando el rendimiento de los cultivos y mitigando el hambre a millones de personas en el planeta.
Anterior a la disponibilidad del gas natural barato, el hidrógeno como precursor de la producción de amoníaco se llevaba a cabo con electrólisis del agua o usando el proceso de cloro-álcali.
Usos[editar]
Fertilizante[editar]
Aproximadamente el 83 % del amoníaco en el 2004 se utilizaba como fertilizantes o sales, soluciones o anhídridos. Cuando se aplicaba en suelo, ayudaba a incrementar el rendimiento de los cultivos como el maíz y el trigo. El 30 % del nitrógeno agricultural usado en los Estados Unidos es en forma de anhídrido y en el mundo, 110 millones de toneladas se usan cada año.[28]
Precursor de compuestos de nitrógeno[editar]
El amoníaco es directa o indirectamente el precursor de la mayor parte de los compuestos que contienen nitrógeno. Virtualmente, todos los compuestos sintéticos de nitrógeno son derivados del amoníaco. Uno de los derivados más importantes el ácido nítrico. El material clave se genera gracias al proceso de Ostwald por oxidación de amoníaco con aire sobre un catalizador de platino, con una temperatura entre 700 °C y 800 °C y 9 atmósferas. El óxido nítrico es un intermediario en esta reacción.[29]
- NH3 + 2 O2 → HNO3 + H2O
El ácido nítrico es usado para la producción de fertilizantes, explosivos, etc.
Limpiador[editar]
El amoníaco casero es una solución de NH3 en agua (hidróxido de amoníaco) usado con el propósito de limpiar superficies. Uno de sus usos más comunes es limpiar cristal, porcelana y acero inoxidable. También se usa frecuentemente para limpiar hornos y absorbiendo elementos para ablandar en la suciedad. El amoníaco casero tiene una concentración peso de 5 a 10 % de amoníaco.
Fermentación[editar]
Soluciones de amoníaco de entre el 16 % y el 25 % se usan en fermentaciones industriales como fuente de nitrógeno para microorganismos y ajustar su pH durante la fermentación.
Agente antimicrobiano para alimentos[editar]
En 1895, se sabía que el amoníaco era un antiséptico fuerte. Por esto se requiere 1.4 gramos por litro para preservar el caldo.[30] En un estudio, amoníaco anhídrido destruyó 99.999 % de bacterias zoonóticas (Zoonosis) en tres tipos de alimento para animales.[31] El anhídrido de amoníaco se usa actualmente para eliminar contaminación microbiana.[32][33] La baba rosa está hecha de recortes de carne grasosos eliminando la grasa con calor y centrifugación, luego tratándolo con amoníaco para reducir la presencia de E. coli a niveles indetectables.[34] Ha habido preocupaciones sobre la seguridad del proceso, así como las quejas de los consumidores sobre su sabor y mal olor.[35]
Fertilizante agrícola[editar]
En forma de amoníaco anhidro tiene un uso como fertilizante aumentando los niveles de nitrógeno del suelo.
Usos menores y emergentes[editar]
Refrigeración - R717[editar]
Gracias a las propiedades de vaporización del amoníaco, es útil como un refrigerante.[7] Era usado comúnmente antes de la popularización del empleo de los compuestos clorofluorocarbonados. El amoníaco anhídrido es usado incansablemente en la industria de la refrigeración y para las pistas de hockey por su alta eficiencia de conversión de energía y bajo costo. No obstante, tiene la desventaja de ser tóxico, lo que le restringe su uso doméstico y a pequeña escala. Junto con su uso moderno de refrigeración por compresión de vapor, se utilizó junto con hidrógeno y agua en refrigeración de absorción. El ciclo de Kalina, depende ampliamente del rango de ebullición de la mezcla de amoníaco y agua.
Para remediación de emisión de gases[editar]
El amoníaco es usado para depurar SO2 de combustibles calientes, y el producto resultante es convertido sulfato de amoníaco para usarse como fertilizante. El amoníaco neutraliza la contaminación de los óxidos de nitrógeno (NOx) emitidos por los motores diésel. Esta tecnología, llamada SCR (Reducción Selectiva Catalítica), se basa en un catalizador a base de vanadio.[36]
El amoníaco puede ser usado para mitigar derrames de gases de fosgeno.[37]
Como combustible[editar]


El amoníaco fue usado durante la Segunda guerra mundial como combustible para camiones en Bélgica, y su motor y energía solar mayor a 1900. El amoníaco líquido también fue combustible de los motores de reacción XLR99 que prenderían X-15. Aunque no es un combustible fuerte, no deja duda en el uso del motor del cohete y su densidad aproximada coincide con la densidad del oxidante, oxígeno líquido, lo cual simplificó el diseño de la aeronave.
El amoníaco se ha propuesto como una alternativa práctica al combustible fósil para la combustión de motores internos.[38] El valor calorífico del amoníaco es 22.5 Mj/kg, que es aproximadamente la mitad del diésel. Un motor normal, en el cual el vapor del agua no se condensa, el valor calorífico el amoníaco sería menos del 21 %.
El amoníaco no puede ser usado fácilmente en el ciclo Otto por sus bajos niveles de octano. Aunque con la menor de las modificaciones a los carburadores y una reducción drástica en el radio de compresión, lo cual requeriría nuevos pistones, un motor de gasolina puede funcionar exclusivamente con amoníaco, en una fracción baja de su poder antes de la conversión del consumo de combustibles más potentes.
El tanque de un automóvil puede almacenar amoníaco líquido siempre y cuando el tanque este presurizado apropiadamente, dependiendo de la temperatura. Dependiendo de las propiedades termodinámicas del amoníaco son tales que a -30 °C, la presión del tanque tendría que ser 1,896 bar (27,5 psi), aproximadamente lo mismo que un neumático de un vehículo. A 30 °C tendría que ser 11,72 bar (170 psi) para mantener el amoníaco líquido. Si la presión del tanque fuera liberada, el amoníaco líquido se tornaría gaseoso y alzar la presión a ese nivel. Los compresores comunes de aire de neumáticos operan a esta presión, para que la presión del tanque no sea una barrera para el uso del combustible.
Como sea, hay otras barreras para extender su uso. En términos de suministros primos de amoníaco, las plantas tendrían que ser construidas para incrementar los niveles de producción, lo cual requeriría una inversión mayor monetaria y energética. Aun cuando es el segundo compuesto químico más producido, la escala de producción de amoníaco es una pequeña fracción del petróleo usado en el mundo. Puede ser manufacturo de energías renovables, así como la energía nuclear. Noruega produjo amoníaco con electrólisis de agua por muchos años desde 1913, produciendo fertilizante para Europa. Si se produce del carbono, el CO2 puede ser embargado, pero la captura y almacenamiento de las plantas de carbono aún no llegan ni a la fase de prototipo.
En 1981, una compañía Canadiense convirtió un Chevrolet Impala 1981 para que funcionara con amoníaco.[39][40] Desde Detroit hasta San Francisco con una sola recarga de amoníaco.[41]
Los motores de amoníaco que usan el amoníaco como un fluido de trabajo, se han propuesto y usado ocasionalmente.[42] El principio es similar al que se usa como locomoción, pero con el amoníaco se usa un fluido, en lugar de aire comprimido. Los motores de amoníaco se han usado experimentalmente en el sigo XIX por Goldsworthy Gurney en el Reino Unido y en Nueva Orleans.[43]
Como estimulante[editar]

El amoníaco, como vapor liberado por sales aromáticas, tiene un uso importante como estimulante respiratorio. El amoníaco es comúnmente usado en la manufactura ilegal de metanfetaminas a través de una reducción de Birch.[45] El método Birch para hacer metanfetamina es peligroso porque son extremadamente reactivas los metales alcalinos y el amoníaco líquido, y la temperatura líquida del amoníaco lo hace susceptible a explotar cuando los reactivas son añadidos.
En la Industria Textil[editar]
El amoníaco líquido es usado para el tratamiento de materiales de algodón, dándole propiedades como mercerización, usando metales álcalis, se usa para prelavar lana.[46]
Gas de levantamiento[editar]
En una presión y temperatura estándar, el amoníaco es menos denso que una atmósfera, y tiene aproximadamente 60 % de poder de levantamiento del hidrógeno o helio. El amoníaco se usa a veces para llenar globos meteorológicos como un gas de levantamiento, por su relativo alto punto de ebullición (comparado al helio o hidrógeno), el amoníaco potencialmente puede ser refrigerado y licuado en una nave para reducir la elevación y añadir lastre (y regresarlo como gas con el mismo fin).
Tratamiento de la madera[editar]
El amoníaco también se usa para oscurecer madera del roble blanco en muebles. Los vapores de amoníaco reaccionan con los taninos naturales en la madera, provocando un cambio de color.[47]
Precauciones de seguridad[editar]

La Administración de Seguridad y Salud Ocupacional de los Estados Unidos, ha delimitado un máximo de 15 minutos a la exposición del amoníaco líquido en 35 ppm por volumen en el aire del ambiente y 8 horas a 25 ppm por volumen.[48] El Instituto Nacional para la Seguridad y Salud Ocupacional (NIOSH), recientemente redujo el riesgo inmediato de vida y salud de 500 a 300 basados en interpretaciones conservativas más recientes de la investigación original en 1943. El riesgo inmediato a la vida y salud es el nivel en el que un trabajador sano pueda ser expuesto 30 minutos sin sufrir daños irreversibles a la salud. Otras organizaciones tienen niveles de exposición variante. Los estándares de la Marina estadounidense permitía concentraciones máximas de: Exposición continua (60 días) a 25 ppm, o una hora con 400 ppm.[49] El vapor de amoníaco tiene un hedor agudo, irritante y desagradable que actúa como prevención de potencial exposición peligrosa. El hedor promedio en el ambiente son 5 ppm, un nivel muy abajo de cualquier peligro o daño. La exposición a concentraciones muy altas de gas de amoníaco puede dar como resultado daño en los pulmones, y posiblemente la muerte.[48] Aun cuando el amoníaco es regulado en los Estados Unidos como un gas inflamable, entra en la definición de un gas tóxico al inhalarlo y requiere seguridad específica al transportarlo en cantidades más grandes a 3,500 galones.[50]
Toxicidad[editar]
La toxicidad de las soluciones de amoníaco no suelen causar problemas a los humanos o a otros mamíferos, por un mecanismo específico que existe para prevenir su almacenamiento en la sangre. El amoníaco se convierte en fosfato de carbonilo por la enzima carbonil fosfato sintetasa, y luego entra al Ciclo de la Urea para ser incorporado a los aminoácidos o excretado en la orina. De cualquier modo, los peces y anfibios no tienen este mecanismo, pues normalmente eliminan el amoníaco de sus cuerpos con excreción directa. El amoníaco incluso en concentraciones diluidas es altamente tóxico para animales acuáticos, y por esa razón es clasificado "peligroso para el ambiente".
Acuicultura[editar]
Se cree que la toxicidad del amoníaco es una causa de la aún inexplorada pérdida de peces en criaderos. El exceso de amoníaco puede acumularse y causar alteraciones metabólicas o incrementar el pH en el cuerpo del organismo expuesto. La tolerancia varía entre las diferentes especies de peces.[51] En concentraciones menores, alrededor de 0.05 mg/L, el amoníaco no-ionizado es dañino para los peces y puede provocar un descenso en el crecimiento, reducir la fertilidad y fecundidad e incrementar el estrés y la susceptibilidad a infecciones por bacterias y enfermedades.[52] En exposición a un exceso de amoníaco, los peces pueden sufrir pérdidas en el equilibrio, hiperexcitabilidad, incremento de la actividad respiratoria, absorción de oxígeno y aumento del ritmo cardiaco.[51] En concentraciones que excedan los 2.00 mg/L, el amoníaco provoca daños en los tejidos, letargo extremo, convulsiones, coma y la muerte.[51][53] Con experimentos se ha demostrado que la concentración letal para los peces en general varía de 0.2 a 2.00 mg/L[53]
Durante el invierno, cuando se reduce la alimentación administrada a las acuícolas, los niveles de amoníaco pueden incrementarse. Las temperaturas menores a la del ambiente reducen la tarifa de fotosíntesis de las algas, por lo que menos amoníaco es eliminado por algas. En este tipo de ambiente, especialmente a larga escala, no hay remedios rápidos para tratar altos niveles de amoníaco. Se recomienda prevención antes que corrección para reducir el daños a los peces[53] y en sistemas de agua abierta, el circundante ambiente.
Información de almacenamiento[editar]
Similar al propano, el amoníaco anhídrido ebulle con una temperatura menor a la del ambiente con una presión estándar. Un recipiente para almacenar amoníaco capaz de contenerlo en 250 psi, es apropiado para su almacenamiento.[54] Los compuestos de amoníaco no deben entrar en contacto con bases (salvo que se busque realizar una reacción química específica), pues se pueden liberar cantidades peligrosas de amoníaco.
Uso casero[editar]
Soluciones de amoníaco (5-10 % por peso) se usan en limpiadores caseros, particularmente para cristal. Estas soluciones son irritantes para los ojos y la membrana mucosa, y en una menor proporción para la piel. Se debe tener precaución en nunca mezclar estas soluciones con cualquier líquido que contenga blanqueadores, pues puede provocar un gas peligroso. Mezclarlo con productos que contengan clorina u oxidantes poderosos, como blanqueadores caseros, pueden llevar a producir gases peligrosos como la cloramina.[55]
Uso en el laboratorio de soluciones de amoníaco[editar]

Los peligros de soluciones de amoníaco dependen en su concentración: Soluciones con amoníaco "diluido" tienen usualmente entre 5-10 % por peso (5.62 mol/l); las soluciones concentradas usualmente están preparadas con un aproximado del 25 % por peso. Con un 25 % en peso, la solución tiene una densidad de 0.907 g/cm³ (907 kg/m³), y una solución que tiene una densidad menor estará más concentrada. La siguiente tabla clasifica las soluciones de amoníaco.
| Concentración por masa (m/m) |
Molaridad | Concentración masa/volumen (m/v) |
Clasificación |
|---|---|---|---|
| 5–10% | 2.87–5.62 mol/L | 48.9–95.7 g/L | Irritante (Xi) |
| 10–25% | 5.62–13.29 mol/L | 95.7–226.3 g/L | Corrosivo (C) |
| >25% | >13.29 mol/L | >226.3 g/L | Corrosivo (C) Peligroso para el ambiente (N) |
El vapor de amoníaco de soluciones concentradas de amoníaco son severamente irritantes a los ojos y el tracto respiratorio, y estas soluciones solo pueden ser manejadas en una campana de humo. Soluciones saturadas ("0.880") pueden desarrollar una presión significativa en una botella cerrada en un clima cálido, y la botella deberá ser abierta con cuidado; esto no es normalmente un problema para soluciones al 25 % ("0.900").
Las soluciones de amoníaco no deben mezclarse con halógenos, pues se forman productos tóxico y/o explosivos. El contacto prolongado de soluciones de amoníaco con sales de plata, mercurio o yodo pueden también resultar en productos explosivos: dichas mezclas son formadas normalmente en análisis cualitativos inorgánicos, y deben ser ligeramente acidificadas pero no concentradas antes de que el análisis sea completado.
Uso en el laboratorio de Anhídrido de amoníaco (gas o líquido)[editar]
El anhídrido de amoníaco es clasificado como tóxico (""T"") y peligroso para el medio ambiente (""N""). El gas es inflamable (Temperatura de autoignición: 651 °C) y puede formar mezclas explosivas con el aire (16-25 %). La exposición permitida en los Estados Unidos es de 50 ppm, mientras que la concentración para el daño inmediato a la vida y salud se estima que está en 300ppm. La exposición repetidas a niveles más bajos de amoníaco, disminuye la sensibilidad al olor del gas: normalmente el hedor es detectable en concentraciones menores a 50 ppm, pero individuos insensibilizados no podrían detectarlo inclusive a concentraciones de 100ppm. El anhídrido de amoníaco corroe aleaciones de cobre y zinc, así como el latón no debe ser usado para almacenar el gas. El amoníaco líquido también puede atacar al caucho y a ciertos plásticos.
El amoníaco reacciona violentamente con halógenos. El triyoduro de nitrógeno, un explosivo primario, el cual se forma cuando el amoníaco entra en contacto con el yodo. El amoníaco provoca la polimerización explosiva del óxido de etileno. También forma compuestos fulminantes explosivos con el oro, plata, mercurio, germanio o telurio. También se han reportado reacciones violentas con soluciones de acetaldehído, hipoclorito, peróxidos y ferricianuro potásico.
Síntesis industrial[editar]
Principios químicos[editar]
El NH3 se obtiene por el método denominado proceso Haber-Bosch (Fritz Haber y Carl Bosch recibieron el Premio Nobel de Química en los años 1918 y 1931). El proceso consiste en la reacción directa entre el nitrógeno y el hidrógeno gaseosos
N2(g) + 3H2(g) → 2NH3(g) ΔH° = -46,2 kJ/mol ΔS° < 0
25 °C K = 6,8.10¬5 atm 850 °C K = 7,8.10¬-2 atm Estos valores se obtienen por medio de la ecuación de van't Hoff. Es una reacción muy lenta, puesto que tiene una elevada energía de activación, consecuencia de la estabilidad del N2. La solución al problema fue utilizar un catalizador (óxido de hierro que se reduce a Fe0 en la atmósfera de H2). Debido a que la reacción cuenta con más moles del lado de los reactivos (4 moles) que del lado de los productos (2 moles), al aumentar la presión se favorece la formación del producto. Aunque termodinámicamente la reacción transcurre mejor a bajas temperaturas, esta síntesis se realiza a altas temperaturas para favorecer la energía cinética de las moléculas y aumentar así la velocidad de reacción. Además se va retirando el amoníaco a medida que se va produciendo para favorecer todavía más la síntesis de productos.
Producción a partir de reformación[editar]
El método de Haber-Bosch utiliza dos materias primas: hidrógeno y nitrógeno. El hidrógeno necesario es producido a partir de la reformación de gas natural, de GLP o de nafta con vapor de agua, siendo el gas natural la alimentación más usual. La planta se divide en dos secciones: el front-end o parte frontal de la planta, donde se genera la mezcla de hidrógeno y nitrógeno necesaria para sintetizar el amoníaco, y el back-end o parte posterior de la planta, que es la sección donde se convierte el producto a partir de ambos reactivos.
La planta suele constar de las siguientes unidades:
Front-end:
- Hidrogenación: el gas de alimentación a planta suele contener compuestos azufrados tales como mercaptanos, los cuales son un veneno para algunos de los catalizadores presentes en la planta aguas abajo. Con el fin de eliminarlos, este primer reactor de la planta cuenta con catalizador (en general a base de cobalto-molibdeno (tipo "CoMo") o de níquel-molibdeno (tipo "NiMo"), el cual facilita la reacción de los mercaptanos con hidrógeno, eliminar el azufre de los compuestos azufrados orgánicos y formando como producto de la reacción sulfuro de hidrógeno mediante la siguiente reacción (ej. para mercaptano): RSH + H2 → RH+H2S. La corriente de alimentación suele encontrarse a una presión de entre 10 y 40 kgf/cm²g y es calentada hasta una temperatura de entre 350 y 400 °C antes de ingresar al reactor adiabático (recipiente a presión con aislación térmica). Debido a que el proceso de hidrogenación requiere de hidrógeno para poder realizar la hidrogenación, una pequeña corriente de hidrógeno de reciclo proveniente del metanador es agregada a la corriente de alimentación previamente al ingreso al reactor.
- Desulfuración: el gas libre de compuestos orgánicos azufrados y cierto contenido de sulfuro de hidrógeno (en el orden de las 0-20 ppm en función del origen de la materia prima) es alimentado a este reactor, que básicamente es un lecho de óxido de zinc, el cual absorbe el sulfuro de hidrógeno. Este reactor suele operar a condiciones de presión y temperatura similares al reactor anterior. La reacción que se lleva a cabo en este reactor es la siguiente: H2S + ZnO H2O + ZnS, quedando el azufre retenido en el lecho. El mismo tiene una capacidad limitada de absorción de azufre, y para un volumen determinado de absorbente, a mayor contenido de azufre, menor vida útil. El contenido de sulfuro de hidrógeno a la salida es prácticamente indetectable, usualmente en el orden de las 20-100 ppb.
- Pre-reformación: este reactor está presente en plantas relativamente modernas en caso de que la alimentación sea un gas natural pesado (rico en hidrocarburos superiores) o alguna corriente más pesada, tal como GLP, ROG (gas de cola de refinerías, del inglés refinery off gas) o nafta. Este reactor, al igual que los anteriores, es un reactor adiabático y relleno con catalizador a base de níquel. La reacción de pre-reformación es catalítica en medio heterogéneo. Previo al ingreso, la corriente de alimentación es mezclada con una corriente de vapor y calentada a una temperatura de 450-550 °C. Dentro del reactor los hidrocarburos pesados (alcanos, principalmente etano y superiores) reaccionan de acuerdo a la siguiente reacción: CnHm + nH2O (n + m/2) H2 + nCO. Los hidrocarburos más pesados son reformados casi en su totalidad, por el contrario del metano, el cual prácticamente no reacciona. En paralelo con la reacción de reformación se presenta la reacción de conversión (shift, en inglés), la cual convierte parte del CO producido con vapor de agua para generar más hidrógeno (y dióxido de carbono como subproducto) de acuerdo a la siguiente reacción: CO + H2 CO2 + H2O. La naturaleza de este reactor depende de la alimentación. La primera reacción (reformación) es fuertemente endotérmica (consume calor) y la segunda reacción es exotérmica (libera calor). Ambas reacciones son de equilibrio, y en general las corrientes "livianas" (p. ej. gas natural) tienen un perfil endotérmico (la primera reacción es preponderante), con un perfil de temperatura decreciente a lo largo del lecho. Por otro lado, en las alimentaciones pesadas (ej. GLP, nafta) la reacción de shift tiene mayor peso: el perfil de temperatura suele disminuir en la primera parte del reactor, donde la reformación es la reacción preponderante, pero suele aumentar en la segunda mitad del lecho, donde la reacción de shift es preponderante. El aumento de temperatura de la segunda mitad suele ser mayor que la caída de temperatura en la primera mitad del lecho y por lo tanto el ΔT total del reactor es exotérmico. La corriente de salida de este reactor es una corriente rica en metano, con un muy bajo contenido de etano e hidrocarburos superiores, y con un contenido moderado de CO, CO2, siendo esta corriente aún rica en vapor de agua.
- Reformación primaria: esta unidad es el "corazón" del front-end ya que es en la cual la mayor parte de metano y otros hidrocarburos son convertido a hidrógeno. La reacción se lleva a cabo en un reformador (a veces llamado reformador primario, o reformador de vapor) y la reacción también es una reacción catalizada en medio heterogéneo. El reformador consta de una cantidad de tubos verticales los cuales están ubicados dentro de un horno de escala industrial. La cantidad de tubos y las dimensiones del horno varían en función de la capacidad de planta, pero una unidad grande puede tener 100-200 tubos, con un diámetro de 100-150 mm cada uno y con una altura de 12-15 m. Este horno (el reformador propiamente dicho) cuenta en su interior con una serie de quemadores, los cuales calientan los tubos desde afuera hacia adentro. Los tubos cuentan en su interior con catalizador a base de níquel,[56] y el gas al pasar por el tubo reacciona con la misma reacción de reformación mencionada en el pre-reformador. La principalmente diferencia con el pre-reformador es que esta corriente cuenta prácticamente con un único hidrocarburo: el metano, el cual es el más difícil de reformar ya que la reacción es fuertemente endotérmica. Al pasar el gas por el tubo, la reacción absorbe el calor que es transmitido desde el exterior del tubo por el horno, logrando de esta forma desplazar el equilibrio químico hacia el lado de los productos. Al igual que en el pre-reformador, esta reacción es de equilibrio, y si bien se logra convertir gran parte del metano a hidrógeno, la corriente de salida cuenta con remanente de metano no reformado. La corriente de salida es rica en hidrógeno, y también rica en vapor de agua. Cuenta además con un contenido menor de metano, de CO y de CO2. Si bien la reacción es endotérmica, al recibir los tubos una carga de calor considerable desde el exterior, el perfil de temperatura a través del tubo es ascendente: la temperatura de entrada a los tubos suele ser de 500-550 °C y la de salida en el orden de los 800-850 °C. Los tubos suelen tener flujo descendente, aunque esto depende del diseño puntual de la planta, y las temperaturas recién mencionadas son ejemplos, variando los valores de planta en planta. El gas de salida de esta unidad de denomina gas de síntesis.
- Reformación secundaria: esta unidad tiene como objetivo convertir el metano que no reaccionó en el reformador primario. La unidad consiste de un reactor adiabático relleno de catalizador a base de níquel, y al igual que en el reformador primario y el pre-reformador, las reacciones que ocurren son las mismas, también catalíticas y de fase heterogénea, además de la reacción de combustión del metano y del hidrógeno. En la parte de superior del reactor hay un quemador, el cual es alimentado con aire (previamente calentado). El oxígeno contenido en el aire, al entrar en contacto con la mezcla proveniente del reformador primario, hace combustión, en parte del hidrógeno presente, y en parte del metano presente. Esta combustión logra que la temperatura de la corriente de entrada, la cual ya cuenta con una temperatura considerable luego de haber sido calentada en el reformador primario (hasta una temperatura del orden de los 800-850 °C), aumente aún más su temperatura hasta alcanzar una temperatura del orden de los 1200 °C. A esta temperatura, el remanente de metano que no había sido convertido en el reformador primario sí logra reaccionar en su mayor parte. A la salida del reformador primario, la corriente consta principalmente de hidrógeno y vapor de agua, de monóxido y dióxido de carbono, y de un contenido bastante bajo de metano (el cual fue prácticamente convertido en su totalidad a hidrógeno). Está corriente también tiene un contenido de nitrógeno considerable, el cual fue aportado por el aire alimentado. La cantidad de aire alimentado a la unidad es tal que la relación de hidrógeno-nitrógeno al final del front-end se encuentre entre 2.8 y 3.1, recordando que la relación del amoníaco (NH3) es 3.
- Conversión de alta temperatura (HTS): la corriente proveniente del reformador secundario, la cual se encuentra a una temperatura en el orden de los 1000 °C, es enfriada, o bien mediante la inyección de vapor (plantas antiguas), o bien mediante una caldera de recuperación de calor (la mayoría de las plantas existentes). Luego de alcanzar una temperatura del orden de los 350 °C la corriente ingresa al convertidor de alta temperatura, usualmente llamado HTS (del inglés high temperature shift), o también llamado mutador de alta temperatura. Dicho reactor es un reactor adiabático y cuenta con un catalizador a base de hierro, y promovido con otros materiales (cromo y cobre entre otros[57]), el cual cataliza la reacción de shift mencionada con anterioridad. Este reactor logra típicamente convertir el 80-90 % del CO presente en la alimentación en CO2, generando aún más hidrógeno en la reacción. Al ser la reacción de shift una reacción exotérmica, la temperatura de salida del reactor es mayor a la de entrada.
- Conversión de baja temperatura (LTS): la corriente proveniente del HTS es enfriada (mediante quench con vapor/agua en plantas antiguas, o más usualmente mediante el uso de una caldera de recuperación de calor) e ingresa a este reactor, que al igual que el anterior es un reactor adiabático, con una temperatura típica en el orden de los 200 °C. El mismo cuenta con catalizador a base de cobre, y promovido con otras sustancias (Zn y Al entre otros[58]), el cual cataliza la misma reacción que en el caso del HTS pero a temperaturas relativamente bajas. Al igual que en el caso anterior, el perfil de temperatura asciende con el avance de la reacción, o sea, la temperatura de entrada (por la parte superior del reactor) es menor a la de salida (por la parte inferior del reactor).
- Eliminación de CO2: debido a que el CO y el CO2 son venenos para el catalizador de síntesis de amoníaco instalado aguas abajo, se instala esta unidad la cual toma la corriente proveniente del LTS y la despoja casi en su totalidad del CO2. La corriente de entrada cuenta con un contenido de CO muy bajo (típicamente del orden del 0.3 % molar en base seca) pero de un contenido de CO2 considerable, del orden del 15-20 %, ya que en ambos reactores shift convirtieron casi la totalidad del monóxido de carbono a dióxido de carbono. Existen una cantidad de procesos patentados ofrecidos para esta operación (ej. BASF, Catacarb, Vetrocoke, etc.), pero en general la unidad cuenta con una (o dos) columna absorbedora, la cual tiene una solución que retiene el dióxido de carbono, y una columna regeneradora, la cual regenera la solución eliminando el CO2. La solución utilizada puede ser MEA, MDEA o carbonato de potasio. Una gran parte de las plantas tienen la finalidad de producir amoníaco para ser utilizado como materia prima para la producción de urea para su uso como fertilizante. En estos casos, dado que la urea se produce a partir de dióxido de carbono y de amoníaco, el CO2 separado en esta unidad es enviado a la sección de síntesis de urea para su uso como materia prima.
- Metanación: la corriente proveniente de la sección de eliminación de dióxido de carbono es principalmente una corriente rica en hidrógeno y nitrógeno, con un bajo contenido de metano y con trazas de CO. El objetivo de este reactor es eliminar el CO. Con este objetivo se hace reaccionar la corriente sobre un catalizador a base de níquel, el cual cataliza la reacción de CO con hidrógeno para formar metano y agua. La reacción es la misma reacción que la de reformación pero en el sentido inverso, recordando que esta es una reacción de equilibrio. Siendo que la reacción de reformación era fuertemente endotérmica, y que esta reacción es la inversa, la metanación resulta ser una reacción fuertemente endotérmica y la temperatura del reactor aumenta considerablemente a través del lecho. A la salida del reactor la corriente consiste principalmente en nitrógeno e hidrógeno, en una relación cercana a 3 (la requerida para sintetizar el amoníaco, NH3) y un muy bajo contenido de metano e inertes provenientes del aire, tales como argón.
Back-end:
La sección de back-end consta principalmente de un reactor (el convertidor de amoníaco) de una serie de equipos auxiliares para enfriar la corriente de salida del reactor. También cuenta con un compresor el cual eleva la presión de la corriente proveniente del front-end hasta la presión de trabajo requerida para la síntesis de amoníaco. Existen diversos diseños de reactor ofrecidas por distintos tecnólogos (ej. Haldor Topsoe, Casale, Kellogg, reactores tipo TVA, etc.) y cada convertidor tiene sus características propias, sus ventajas y sus desventajas. Algunos reactores son verticales, otros horizontales; algunos tienen flujo radial, otros flujo axial, y otros flujo mixto; algunos tienen un lecho, otros tienen dos lechos, etc. De todas formas una característica común a todos ellos es que requieren un catalizador para que la reacción tenga lugar, siendo en la actualidad el utilizado en casi todas las plantas a base de hierro y promovido con otros compuestos.[59] Los reactores suelen operar en un rango de temperatura de 400-500 °C y a presiones muy elevadas, en el orden de los 200-350 kgf/cm²g. Como se explicó anteriormente, la reacción está fuertemente balanceada hacia el lado de los reactivos, y por lo tanto la concentración de amoníaco no es demasiado alta: en una planta operando en condiciones estables la concentración de entrada al convertidor suele rondar el 5 % y a la salida el 15 %.
Manejo del producto[editar]
- Límite inflamable inferior: 19 % en volumen.
- Límite inflamable superior: 25 % en volumen.
- Temperatura de autoignición: 651 °C.
- Extinción del fuego: riego de agua o niebla de agua, dióxido de carbono, espuma de alcohol, productos químicos secos.
- Medidas de control: protección respiratoria adecuada como uso de máscaras o equipos de respiración asistida. Procedimientos de trabajo seguro. Fuentes para el lavado de los ojos y duchas de seguridad en el lugar de trabajo.
- Manipular con guantes.
- No ingerir.
Amoníaco como solvente líquido[editar]
El amoníaco líquido es conocido y comúnmente estudiado como un solvente ionizante no-acuoso. Su propiedad más conspicua es la habilidad de disolver metales álcali para formar soluciones altamente coloradas y eléctricamente conductivas conteniendo electrones solvatados. Además de estas soluciones, mucha de la química en el amoníaco líquido puede ser clasificado por analogía con reacciones relacionadas en soluciones acuosas. La comparación de las propiedades físicas del NH3 con aquellas del agua, muestra que el NH3 tiene un menor punto de ebullición, de fusión, densidad, viscosidad y constante dieléctrica; esto es al menos en parte por los enlaces débiles del hidrógeno en NH3 y porque dicho enlace no puede formar redes reticuladas, pues cada molécula de NH3 tiene un solo par de electrones libres comparado con dos por cada molécula de H2O. La constante de disociación del NH3 a -50 °C es 10−33 mol2·l−2.
Solubilidad de sales[editar]
| Solubilidad (g de sal por 100 g de NH3 líquido ) | |
|---|---|
| Acetato de amonio | 253.2 |
| Nitrato de amonio | 389.6 |
| Nitrato de litio | 243.7 |
| Nitrato de sodio | 97.6 |
| Nitrato de potasio | 10.4 |
| Fluoruro de sodio | 0.35 |
| Cloruro de sodio | 157.0 |
| Bromuro de sodio | 138.0 |
| Yoduro de sodio | 161.9 |
| Tiocianato de sodio | 205.5 |
El amoníaco líquido es un solvente ionizante, aunque menos que el agua, disuelve bastantes compuestos, incluyendo nitratos, nitritos, cianuros y tiocianatos. La mayoría de las sales amonio son solubles y actúan como ácidos en soluciones de amoníaco líquido. La solubilidad de las sales de halógeno incrementa desde el flúor hasta el yodo. Una solución saturada de nitrato de amonio coticen 0.083 moles de solito por mol de amoníaco y tiene una presión de vapor de menos de 1 bar en 25 °C.
Soluciones de metales[editar]
El amoníaco líquido disuelve a los metales álcali y a otros metales electropositivos como el magnesio, calcio, estroncio, bario, europio e iterbio. En bajas concentraciones, se forman soluciones de tono azul oscuro: estas contienen cationes y electrones solvatados, electrones libres que están rodeados por una jaula de moléculas de amoníaco.
Estas soluciones son muy útiles y fuertes agentes reductores. En concentraciones altas, las soluciones son metálicas en apariencias y en conductividad eléctrica. En temperaturas bajas, los dos tipos de solución pueden coexistir como fases inmiscibles.
Propiedades redox del amoníaco líquido[editar]
| E° (V, amoníaco) | E° (V, agua) | |
|---|---|---|
| Li+ + e− ⇌ Li | −2.24 | −3.04 |
| K+ + e− ⇌ K | −1.98 | −2.93 |
| Na+ + e− ⇌ Na | −1.85 | −2.71 |
| Zn2+ + 2e− ⇌ Zn | −0.53 | −0.76 |
| NH4+ + e− ⇌ ½ H2 + NH3 | 0.00 | — |
| Cu2+ + 2e− ⇌ Cu | +0.43 | +0.34 |
| Ag+ + e− ⇌ Ag | +0.83 | +0.80 |
El rango de estabilidad termodinámica de soluciones con amoníaco líquido es muy estrecho, como el potencial de oxidación a dinitrógeno, potencial normal de electrodo(N2 + 6NH4+ + 6e− ⇌ 8NH3), es solo +0.04 V. En práctica, la oxidación a dinitrógeno y reducción de dihidrógeno son lentas. Esto es especialmente verdad en soluciones reductoras: las soluciones de los metales álcali mencionadas anteriormente son estables por varios días, descomponiendo lentamente la amiba metal y dihidrógeno. La mayor parte de los estudios sobre el amoníaco líquido en soluciones son hechos en condiciones reductoras; sin embargo, la oxidación del líquido de amoníaco es lenta y hay riesgo de explosión.
Efectos nocivos en el organismo[editar]
Inhalación[editar]
En concentraciones elevadas irrita la garganta, inflama los pulmones, daña las vías respiratorias y los ojos. Según aumenta la concentración puede llegar a producir edema pulmonar ( El edema pulmonar a menudo es causado por insuficiencia cardíaca congestiva. Cuando el corazón no es capaz de bombear sangre al cuerpo de manera eficiente, esta se puede represar en las venas que llevan sangre a través de los pulmones hasta el lado izquierdo del corazón.
A medida que la presión en estos vasos sanguíneos se incrementa, el líquido es empujado hacia los espacios de aire (alvéolos) en los pulmones. Este líquido reduce el movimiento normal del oxígeno a través de los pulmones. Esto y el aumento de la presión pueden llevar a dificultad para respirar) o la muerte cuando supera las 5000 ppm. Si la persona inhaló el tóxico, trasládela inmediatamente a un sitio donde pueda tomar aire fresco, e inmediatamente después acudir rápidamente al médico.
Contacto con la piel[editar]
El amoníaco puede producir irritación de la piel, sobre todo si la piel se encuentra húmeda. Además, puede llegar a quemar y ampollar la piel al cabo de unos pocos segundos de exposición con concentraciones atmosféricas superiores a 300 ppm. Si el químico está en la piel o en los ojos, enjuague con agua abundante al menos por 15 minutos, a ser posible con vinagre diluido o ácido bórico ya que los ácidos lo neutralizan.
Ingestión[editar]
Este compuesto es gaseoso en condiciones atmosféricas normales siendo poco probable su ingestión. Sin embargo, en caso de producirse, puede destruir la mucosa gástrica, provocando severas patologías e incluso la muerte. De hecho, la bacteria Helicobacter pylori segrega amoníaco a partir de la urea y por ese motivo es que se destruye la mucosa gástrica o duodenal provocando úlcera péptica.
Si la persona ingirió el producto químico, no debe provocarse el vomito; inmediatamente debe solicitarse valoración médica en una unidad de urgencias.
A juzgar por su olor molesto y penetrante es poco probable su ingestión, no obstante, sí es muy frecuente en caso de ingerir alimentos como pescados o mariscos en descomposición (cuyas proteínas al degradarse forman este compuesto); motivo por el cual es imprescindible cuidar la calidad y frescura de los mismos a fin de evitar intoxicaciones alimentarias.
Tratamientos en los pacientes[editar]
- Broncoscopia: colocación de una cámara a través de la garganta para observar las quemaduras en las vías respiratorias y en los pulmones.
- Endoscopia: colocación de una cámara a través de la garganta para observar las quemaduras en el esófago y el estómago.
- Líquidos por vía intravenosa (IV).
- Medicamentos para tratar los síntomas.
- Medicamento para neutralizar el efecto del tóxico (un antídoto).
- Oxígeno y soporte respiratorio.
- Desbridamiento cutáneo (extirpación quirúrgica de la piel quemada).
- Lavado de la piel (irrigación), quizá con intervalos de pocas horas durante varios días.
El papel del amoníaco en sistemas biológicos y en enfermedades humanas[editar]

El amoníaco es una importante fuente de nitrógeno para sistemas vivos. Aunque el nitrógeno atmosférico abunda (más del 75 %), algunos seres vivos son capaces de usar el nitrógeno atmosférico en su forma diatómica, N2 gas. Entonces, la fijación de nitrógeno es requerida para la síntesis de aminoácidos, los cuales son la base de la proteína. Algunas plantas usan el amoníaco del nitrógeno atmosférico.[61]
Biosíntesis[editar]
En determinados organismos, el amoníaco es producido por el nitrógeno atmosférico por la enzima llamada nitrogenasa. El proceso general se llama fijación de nitrógeno. Aunque difícilmente los métodos biomiméticos sean competitivos con el "Proceso de Haber", un esfuerzo intenso se ha direccionado hacia el mecanismo biológico de fijación de nitrógeno. El interés científico en este problema es motivado por una estructura inusual del sitio activo de la enzima, que consiste de un conjunto Fe7MoS9.
El amoníaco también es un producto metabólico de los aminoácidos, catalizador por enzimas como la Glutamato deshidrogenasa. La excreción de amoníaco es común en animales marinos. En humanos, es fácilmente convertido a urea, que es menos tóxica, así como menos básica. La urea es el mayor componente del peso seco de la orina. La mayoría de los reptiles, aves, insectos y caracoles secretan ácido úrico como desechos nitrogenados.
En fisiología[editar]
El amoníaco también juega un papel en las fisiologías normal y anormal. Es biosintetizado a través del metabolismo normal de los aminoácidos y es tóxico en altas concentraciones.[62] El hígado convierte amoníaco a urea a través de varias series de reacciones conocidas como el ciclo de la urea. Disfunciones en el hígado, como la cirrosis, pueden llevar tener una cantidad alta de amoníaco en la sangre (hiperamonemia). Del mismo modo, defectos en la enzima responsable del ciclo de la urea, como la ornitina transcarbamilasa, pueden provocar hiperamonemia. La hiperamonemia lleva a la confusión y a un estado de coma de encefalopatía hepática, así como las enfermedades comunes en personas con problemas en el ciclo de la urea.[63]
El amoníaco es importante para el balance normal ácido/base. Después de la formación de amonio de glutamina, α-cetoglutarato puede ser degradado para producir dos moléculas de bicarbonato, los cuales funcionan posteriormente como buffers para ácidos dietéticos. El amoníaco es excretado en la orina, perdiendo ácidos. El amoníaco puede difundirse a través de sí mismo los túmulos renales, combinado con iones de hidrógeno, para permitir futura excreción de ácidos.[64]
Excreción[editar]
Los iones de amoníaco son productos tóxicos desechados del metabolismo de animales. En peces e invertebrados acuáticos, se excreta directamente al agua. En mamífero, tiburones y anfibios, se convierte en el ciclo de la urea a urea, porque es menos tóxico y es un proceso eficiente. En aves, reptiles y caracoles terrestres, el amonio metabólico es convertido en ácido úrico, que es sólido, y por tanto es excretado con una pérdida mínima de agua[65]
En astronomía[editar]

El amoníaco se ha detectado en la atmósfera de los planetas de gas gigante, incluyendo Júpiter, junto con otros gases como el metano, hidrógeno y helio. En el interior de Saturno hay cristales congelados de amoníaco.[66] Se encuentra naturalmente en Deimos y Fobos, las dos lunas de Marte.
Espacio interestelar[editar]
El amoníaco fue detectado en un principio en el espacio en 1968, basado en emisiones de microondas desde la dirección del núcleo galáctico.[67] Esta fue la primera molécula poliatómica detectada. La sensibilidad de la molécula en un amplio rango de excitaciones y la facilidad con que se puede observar un número de regiones ha hecho al amoníaco una de las moléculas más importantes para los estudios de las nubes moleculares.[68] La relativa intensidad de líneas de amoníaco pueden ser usadas para medir la temperatura del medio emisor.
Las siguientes especies isotópicas de amoníaco se han detectado:
- NH3, 15NH3, NH2D, NHD2, y ND3
La detección del triple deuterio amoníaco fue considerado una sorpresa fue el deuterio es relativamente escaso. Se cree que las bajas temperaturas permiten a esa molécula subsistir y acumularse.[69]
Desde su descubrimiento interestelar, NH3 ha probado ser una herramienta espectroscopia invaluable en el estudio del medio interestelar. Con un largo número de transiciones, es sensible a un amplio rango de condiciones de excitación, NH3 ha sido ampliamente detectado astronómicamente -su detección ha sido reportada en cientos de artículos-.
El estudio del amoníaco interestelar ha sido importante para diversas áreas de investigación en las últimas décadas.
Formación interestelar y mecanismos[editar]

La abundancia interestelar de amoníaco ha sido medida en varios ambientes. El radio de [NH3]/[H2] se ha estimado desde 10−7 en pequeñas nubes oscuras[70] hasta 10−5 en el denso núcleo del complejo de nube molecular de Orión.[71] Aunque un total de 18 rutas de producción han sido propuestas,[72] el principal mecanismo de formación de NH3 interestelar es la siguiente reacción:
- NH4+ + e− → NH3 + H·
La constante de cambio "k" en esta reacción depende de la temperatura del ambiente, con un valor de 5.2×10−6 a 10 K.[73] La constante fue calculada de la fórmula "k = a(T/300)B". Para la reacción de formación primaria, a = 1.05×10−6 y B = −0.47. Asumiendo una abundancia de NH4+ de 3×10−7 y una abundancia de electrones de 10−7 típico de nubes moleculares, la formación procede a un cambio de 1.6×10−9 cm−3s−1 en una nube molecular con una densidad total de 105 cm−3.[74]
Todas las demás propuestas de reacción de formación tienen constantes con valores entre 2 y 13 órdenes de magnitud menores, haciendo que las contribuciones a la abundancia del amoníaco sean relativamente insignificantes.[75] Como ejemplo de una de las contribuciones mencionadas está:
- H2 + NH2 → NH3 + H
Tiene un cambio constante de 2.2×10−15. Asumiendo que las densidades de 105 and NH2/H2 ratio of 10−7 para H2, esta reacción procede en con un cambio de 2.2×10−12, más de 3 órdenes de magnitud más lentos que la reacción primaria anterior.
Algunas otras posibles reacciones de formación son:
- H− + NH4+ → NH3 + H2
- PNH3+ + e− → P + NH3
Mecanismos interestelares de destrucción[editar]
Hay 113 reacciones propuestas que llevan a la destrucción del NH3. De estas, 39 fueron tabuladas en extensas tablas de química junto con compuestos de carbono, nitrógeno y oxígeno.[76] Una revisión del amoníaco interestelar cita las siguientes reacciones como los principales mecanismos de disociación:[68]
- (1) NH3 + H3+ → NH4+ + H2
- (2) NH3 + HCO+ → NH4+ + CO
Con cambios constantes de 4.39×10−9[77] y 2.2×10−9,[78] respectivamente. Las ecuaciones (1,2) corren con un cambio de 8.8×10−9 and 4.4×10−13, respectivamente. Estos cálculos asumen el cambio dado de constantes y abundancias de [NH3]/[H2] = 10−5, [H3+]/[H2] = 2×10−5, [HCO+]/[H2] = 2×10−9, y densidades totales de n = 105, típicas de frías y densas, nubes moleculares.[79] Claramente, entre estas dos reacciones primarias, la ecuación (1) es la reacción dominante de destrucción, con un cambio de ~10,000 veces más rápido que la ecuación (2). Esto se debe a la relativa alta abundancia de H3+.
Detección de antenas individuales[editar]
Observaciones de radio de NH3 del Radiotelescopio de Effelsberg reveló que la línea de amoníaco está separada en dos componentes –un fondo rígido y núcleo sin forma–. El fondo corresponde bien con la localización previamente detectada de CO.[80] El telescopio 25 m Chilbolton en Inglaterra detectó señales de radio de amoníano en regiones H II, HNH2O, objetos H-H y otros objetos asociados con las formación de estrellas. Una comparación con la line de emisión indica que velocidades turbulentas o sistemáticas no incrementan en el centro del núcleo de las nubes moleculares[81]
La radiación de microondas del amoníaco fue observada en diversos objetos galácticos incluyendo W3(OH), Orión (constelación), W43, W51, y cinco fuentes en el centro galáctico. La alta detección del cambio indica que es una molécula común en el medio interestelar y que las regiones de alta densidad son comunes en la galaxia[82]
Estudios Interferométricos[editar]
Observaciones VLA en siete regiones con flujos de alta velocidad gaseosos revelaron condensaciones de menos de 0.1 pc en L1551, S140 y Cefeo. Tres condensaciones individuales fueron detectadas en Cefeo, una de ellas era una figura muy alongada. Pueden jugar un rol importante en crear flojos bipolares en la región.[83]
Amoníaco extragaláctico fue imaginado usando VLA en IC 342. La temperatura del gas caliente está arriba de los 70 K, lo cual fue inferido de las líneas del radio de amoníaco y parece estar asociado con porciones más internas de la barra nuclear vista en CO.[84] NH3 fue también monitoreada por VLA hacia la muestra de cuatro regiones galácticas ultracompactadas HII: G9.62+0.19, G10.47+0.03, G29.96−0.02, y G31.41+0.31. Basándose en diagnósticos de temperatura y densidad, se concluye que en general que tales cúmulos son probablemente los lugares de formación de estrella en una fase evolutiva temprana antes del desarrollo de una región HII ultracompacta.[85]
Detecciones a infrarrojo[editar]
Absorciones a 2.91 micrómetros de amoníaco sólido fueron grabados de granos interestelares en el Objeto Becklin-Neugebauer y probablemente en NGC 2264-IR. Esta detección ayudó a explicar la forma física de los previamente poco entendidos líneas de absorción de hielo.[86]
Un espectro del anillo de Júpiter fue obtenido del observatorio Kuiper Airborne, cubriendo los 100 a 300 cm−1 del rango de espectro. Análisis del espectro provee información de propiedades globales de amoníaco en gas y la neblina de hielo de amoníaco.[87]
Un total de 149 posiciones de nubes negras fueron revisadas para evidencia de "núcleos densos" usando la inversión de línea de (J,K) = (1,1) deNH3. En general, los núcleos no tienen figura de esfera, con radios rondando entre 1.1 a 4.4. También se encontró que núcleos con estrellas tienen líneas más amplias que núcleos sin estrellas.[88]
El amoníaco se detectó también en Nebula de Draco y en una o quizá dos nubes moleculares, que están asociadas con el cirrus infrarrojo.[89]
Observaciones de Nubes Oscuras Cercanas[editar]
Balanceando y estimulando una emisión con una emisión espontánea, es posible construir una relación entre las temperatura de excitación y la densidad. Más sin embargo, desde los niveles transitorios del amoníaco, se puede aproximar a un nivel 2 en un sistema de bajas temperaturas, este cálculo es sencillo. Esta premisa puede ser aplicada a nubes negras, regiones que se sospecha tienen extremadamente bajas temperaturas y posibles sitios para la futura formación de estrellas. Detecciones de amoníaco en nubes negras muestra líneas estrechas —indicando que no solo son bajas temperaturas, pero también un nivel bajo de turbulencia en la nube–. La línea de cálculos del radio provee una medida de la temperatura de la nube que es independiente de previas observaciones de CO. Las observaciones del amoníaco fueron consistentes con las medidas de CO de rotación de temperaturas de ~10 K. Con esto, las densidades pueden ser determinadas, y han sido calculadas en un rango de entre 104 y 105 cm−3 en nubes negras. Trazando el mapa de NH3, se concluye que tiene medidas cotidianas de las nubes de 0.1 pc y masas cercanas a una masa solas. Estos sitios fríos con núcleos densos son sitios donde se formará una estrella.
Regiones UC HII[editar]
Regiones HII ultra compactadas están entre los mejores trazadores de formación de estrellas de gran masa. EL material denso alrededor de regiones UCHII es primariamente molecular. Desde un completo estudio de formación de estrellas masivas, necesariamente involucra la nube de donde se formó la estrella, el amoníaco es una herramienta invaluable para comprender este material molecular que rodea. Puesto que este material molecular puede ser resuelto espacialmente, es posible constreñir los recursos de calor/ionizantes, temperaturas, masas y tamaño de las regiones. Los componentes de la velocidad Doppler desplazada permite la separación de distintas regiones de gas molecular que puede trazar flujos y núcleos calientes originados de la formación de estrellas.
Detección extragaláctica[editar]
El amoníaco ha sido detectado en galaxias externas, y por simultáneamente medir varías líneas, es posible directamente medir la temperatura del gas en estas galaxias. Las líneas del radio implican que las temperaturas son calientes (~ 50 K), originadas de nubes densas con tamaños de decenas de pc. Esta imagen es consistente con la imagen de nuestra Vía Láctea—núcleos moleculares densos y calientes se forman alrededor de estrellas que se están formando incrustadas en nubes con material molecular en la escala de varios cientos de pc (nubes moleculares gigantes).
Bibliografía[editar]
- Bretherick, L., ed. (1986). Hazards in the Chemical Laboratory (4ta edición). Londres: Royal Society of Chemistry. ISBN 0-85186-489-9. OCLC 16985764.
- «Aqua Ammonia». airgasspecialtyproducts.com. Archivado desde el original el 19 de noviembre de 2010. Consultado el 28 de noviembre de 2010.
Referencias[editar]
- ↑ Número CAS
- ↑ Río, Rosario Solera del (2014). Aspectos biológicos de la digestión anaeróbica II.2. Ediciones Paraninfo, S.A. ISBN 9788484767008. Consultado el 9 de enero de 2018.
- ↑ Bailey, Philip S.; Bailey, Christina A. (1998). Química orgánica: conceptos y aplicaciones. Pearson Educación. ISBN 9789701701201. Consultado el 9 de enero de 2018.
- ↑ Matheson Gas Data Book. «Lower and Upper Explosive Limits for Flammable Gases and Vapors (LEL/UEL)» (PDF) (en inglés). Matheson Gas Products. p. 443. Archivado desde el original el 30 de septiembre de 2019. Consultado el 2 de octubre de 2016.
- ↑ Real Academia Española. «amoniaco». Diccionario de la lengua española (23.ª edición). Consultado el 29 de junio de 2022.
- ↑ Real Academia Española y Asociación de Academias de la Lengua Española (2023). «-iaca». Diccionario panhispánico de dudas (2.ª edición, versión provisional). Consultado el 29 de junio de 2022.
La acentuación etimológica latina es -íaco [í - a - ko], con hiato entre las dos vocales en contacto; pero también es correcta la acentuación llana -iaco [iá - ko], con diptongo en lugar de hiato. En el español americano, la norma culta prefiere la acentuación esdrújula ([maníako]); en el español de España es más corriente la pronunciación llana ([maniáko]). Se recomienda adecuar la grafía a la pronunciación, de modo que quien pronuncie un hiato escriba -íaco y quien pronuncie un diptongo escriba -iaco.
- ↑ a b c Max Appl (2006). Ammonia, in Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a02_143.pub2.
- ↑ «Ammonium hydroxide physical properties». Archivado desde el original el 27 de noviembre de 2007.
- ↑ «ammoniac definition» (en inglés). Consultado el 26 de junio de 2009. «ammōniakón (neut. of ammōniakós of Ammon; see -i-, -ac ), applied to a salt and a gum resin prepared near the Shrine of Ammon in Libya».
- ↑ «ammonia» (en inglés). Archivado desde el original el 24 de septiembre de 2009. Consultado el 27 de junio de 2009. «In 1782 the term ‘ammonia’ was coined for this colourless, pungent gas by the Swedish chemist, Torbern Bergman.»
- ↑ Kirschbaum, B; Sica, D; Anderson, F. P. (1999). «Urine electrolytes and the urine anion and osmolar gaps.». The Journal of laboratory and clinical medicine 133 (6): 597-604. ISSN 0022-2143. PMID 10360635. doi:10.1016/S0022-2143(99)90190-7.
- ↑ a b c Chisholm, 1911.
- ↑ Hewat, A. W.; Riekel, C. (1979). «The crystal structure of deuteroammonia between 2 and 180 K by neutron powder profile refinement». Acta Crystallographica Section A 35 (4): 569. Bibcode:1979AcCrA..35..569H. doi:10.1107/S0567739479001340.
- ↑ a b CRC Handbook of Chemistry and Physics, 94th ed. http://www.hbcpnetbase.com Archivado el 24 de julio de 2017 en Wayback Machine.. Páginas 9-26. Consultado el 18 de junio de 2013.
- ↑ Cleeton, C. E.; Williams, N. H. (1934). «Electromagnetic Waves of 1.1cm. Wave-Length and the Absorption Spectrum of Ammonia». Physical Review 45 (4): 234. Bibcode:1934PhRv...45..234C. doi:10.1103/PhysRev.45.234.
- ↑ Baker, H. B. (1894). J. Chem. Soc. 65: 612.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. p. 485. ISBN 0-08-022057-6.
- ↑ Sterrett, K. F. ; Caron, A. P. (1966). «High pressure chemistry of hydrogenous fuels». Northrop Space Labs. Archivado desde el original el 23 de agosto de 2011. Consultado el 23 de febrero de 2015.
- ↑ (OSHA) Source: Dangerous Properties of Industrial Materials (Sixth Edition) by N. Irving Sax
- ↑ J. L. Martinez Hurtado and C. R. Lowe (2014), Ammonia-Sensitive Photonic Structures Fabricated in Nafion Membranes by Laser Ablation, ACS Applied Materials & Interfaces 6 (11), 8903-8908. http://pubs.acs.org/doi/abs/10.1021/am5016588
- ↑ «Ammonia». h2g2 Eponyms. BBC.CO.UK. 11 de enero de 2003. Archivado desde el original el 2 de noviembre de 2007. Consultado el 8 de noviembre de 2007.
- ↑ Chisholm, 1911 cites Pliny Nat. Hist. xxxi. 39
- ↑ «Sal-ammoniac». Webmineral. Consultado el 7 de julio de 2009.
- ↑ Haq, Syed Nomanul (28 de febrero de 1995). Names, Natures and Things: The Alchemist Jabir Ibn Hayyan and His Kitab Al-Ahjar (Book of Stones). Springer. ISBN 978-0-7923-3254-1. Consultado el 22 de junio de 2010.
- ↑ Maurice P. Crosland (2004). Historical Studies in the Language of Chemistry. Courier Dover Publications. p. 72. ISBN 0-486-43802-3.
- ↑ Abraham, Lyndy (1990). Marvell and alchemy. Aldershot Scolar. ISBN 0-85967-774-5.
- ↑ Smith, Roland (2001). Conquering Chemistry. Sydney: McGraw-Hill. ISBN 0-07-470146-0.
- ↑ David Brown (18 de abril de 2013). «Anhydrous ammonia fertilizer: abundant, important, hazardous». Washington Post. Consultado el 23 de abril de 2013.
- ↑ Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 0-12-352651-5.
- ↑ Samuel Rideal (1895). Disinfection and Disinfectants: An Introduction to the Study of. London: Charles Griffin and Company. p. 109.
- ↑ Tajkarimi, Mehrdad et al.; Riemann, H. P.; Hajmeer, M. N.; Gomez, E. L.; Razavilar, V.; Cliver, D. O. (2008). «Ammonia disinfection of animal feeds — Laboratory study». International Journal of Food Microbiology 122 (1-2): 23-28. PMID 18155794. doi:10.1016/j.ijfoodmicro.2007.11.040.
- ↑ "Evaluation of Treatment Methods for Reducing Bacteria in Textured Beef Archivado el 11 de agosto de 2011 en Wayback Machine.", Jensen, Jean L et al., American Society of Agricultural and Biological Engineers Annual Meeting 2009
- ↑ Reference Document: Antimicrobial Interventions for Beef Archivado el 18 de septiembre de 2018 en Wayback Machine., Dawna Winkler and Kerri B. Harris, Center for Food Safety, Department of Animal Science, Texas A&M University, May 2009, page 12
- ↑ Moss, Michael (3 de octubre de 2009). «The Burger That Shattered Her Life». The New York Times.
- ↑ Moss, Michael (31 de diciembre de 2009). «Safety of Beef Processing Method Is Questioned». The New York Times.
- ↑ «Diesel: Greener Than You Think». Consultado el 7 de julio de 2009.
- ↑ «Phosgene: Health and Safety Guide». International Programme on Chemical Safety. 1998.
- ↑ «Ammonia as a Transportation Fuel IV». Norm Olson – Iowa Energy Center. 15-16 October 2007. Archivado desde el original el 7 de febrero de 2012.
- ↑ Ammonia Powered Car en YouTube.
- ↑ «Watch 'Ammonia Fuel'». Greg Vezina. Consultado el 7 de julio de 2009.
- ↑ «NH3Car.com».
- ↑ «Ammonia Motors». aqpl43.dsl.pipex.com. 1 de octubre de 2007. Archivado desde el original el 17 de noviembre de 2010. Consultado el 28 de noviembre de 2010.
- ↑ «Copia archivada». Archivado desde el original el 3 de marzo de 2019. Consultado el 3 de marzo de 2019.
- ↑ The Gazette Staff (6 de octubre de 2009). «Anhydrous ammonia tank locks have flaws». Cedar Rapids Gazette.
- ↑ «Illinois Attorney General | Basic Understanding Of Meth». Illinoisattorneygeneral.gov. Archivado desde el original el 10 de septiembre de 2010. Consultado el 21 de mayo de 2011.
- ↑ Włochowicz, A.; Stelmasiak, E. (1983). «Change in thermal properties of wool after treatment with liquid ammonia». Journal of Thermal Analysis and Calorimetry 26 (1): 17. doi:10.1007/BF01914084.
- ↑ «Fuming white oak».
- ↑ a b «Toxic FAQ Sheet for Ammonia». Agency for Toxic Substances and Disease Registry (ATSDR). September 2004.
- ↑ Ammonia, IDLH Documentation
- ↑ Is Anhydrous Ammonia covered under the Hazardous Materials Safety Permit Program? from the website of the United States Department of Transportation (DOT)
- ↑ a b c Oram, Brian. [http://www.water-research.net/index.php/ammonia-in-groundwater- runoff-and-streams «Ammonia in Groundwater, Runoff, and Streams»]. The Water Centre. Consultado el 3 de diciembre de 2014. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Hargreaves, J.A.; Tucker, C.S. (2004). Managing ammonia in fish ponds. Southern Regional Aquaculture Center.
- ↑ a b c Sergeant, Chris (5 de febrero de 2014). «The Management of Ammonia Levels in an Aquaculture Environment». Water/Wastewater. Consultado el 3 de diciembre de 2014.
- ↑ Electronic Code of Federal Regulations:. Ecfr.gpoaccess.gov. Retrieved on 22 December 2011.
- ↑ Rizk-Ouaini, Rosette; Ferriol, Michel; Gazet, Josette; Saugier-Cohen Adad, Marie Therese (2006). «Oxidation reaction of ammonia with sodium hypochlorite. Production and degradation reactions of chloramines». Bulletin de la Societe Chimique de France 4: 512. ISBN 3527306730. doi:10.1002/14356007.a02_143.pub2.
- ↑ «Haldor Topsoe non alkali catalyst for steam reforming R-67-7H».
- ↑ «Haldor Topsoe high temperature shift catalyst SK-201-2».
- ↑ «Haldor Topsoe low temperature shift catalyst LK-821-2».
- ↑ «Haldor Topsoe ammonia synthesis catalyst KM1». Archivado desde el original el 25 de septiembre de 2015. Consultado el 12/09/15.
- ↑ Karl S. Roth, MD. «eMedicine Specialties > Metabolic Diseases > Hyperammonemia». Consultado el 7 de julio de 2009.
- ↑ Adjei, M. B.; Quesenberry, K. H. and Chamblis, C. G. (June 2002). «Nitrogen Fixation and Inoculation of Forage Legumes». University of Florida IFAS Extension. Archivado desde el original el 20 de mayo de 2007.
- ↑ «PubChem Substance Summary». Consultado el 7 de julio de 2009.
- ↑ Zschocke, Johannes, and Georg Hoffman (2004). Vademecum Metabolism. Friedrichsdorf, Germany: Milupa GmbH.
- ↑ Rose, Burton, and Helmut Rennke (1994). Renal Pathophysiology. Baltimore: Williams & Wilkins. ISBN 0-683-07354-0.
- ↑ Campbell, Neil A.; Jane B. Reece (2002). «44». Biology (6th edición). San Francisco: Pearson Education, Inc. pp. 937–938. ISBN 0-8053-6624-5.
- ↑ Edited by Kirk Munsell. Image page credit Lunar and Planetary Institute. NASA. "NASA's Solar Exploration: Multimedia: Gallery: Gas Giant Interiors Archivado el 20 de febrero de 2006 en Wayback Machine.". Retrieved 26 April 2006.
- ↑ Cheung, A. C.; Rank, D. M.; Townes, C. H.; Thornton, D. D. and Welch, W. J. (1968). «Detection of NH3 molecules in the interstellar medium by their microwave emission». Phys. Rev. Lett. 21 (25): 1701. Bibcode:1968PhRvL..21.1701C. doi:10.1103/PhysRevLett.21.1701.
- ↑ a b Ho, P. T. P. and Townes, C. H. (1983). «Interstellar ammonia». Ann. Rev. Astron. Astrophys. 21 (1): 239-70. Bibcode:1983ARA&A..21..239H. doi:10.1146/annurev.aa.21.090183.001323.
- ↑ Millar, T. J. (2003). «Deuterium Fractionation in Interstellar Clouds». Space Science Reviews 106 (1): 73-86. Bibcode:2003SSRv..106...73M. doi:10.1023/A:1024677318645.
- ↑ Ungerechts, H., Walmsley, C. M., Winnewisser, G.; Walmsley; Winnewisser (1980). «Ammonia and cyanoacetylene observations of the high-density core of L-183 (L-134-N)». Astron. Astrophys. 88: 259. Bibcode:1980A&A....88..259U.
- ↑ Genzel, R.; Downes, D.; Ho, P. T. P. (1982). «NH3 in Orion-KL – A new interpretation». Astrophysics Journal 259: L103. Bibcode:1982ApJ...259L.103G. doi:10.1086/183856.
- ↑ «The UMIST data for Astrochemistry». Consultado el 7 de julio de 2009.
- ↑ Vikor, L.; Al-Khalili, A.; Danared, H.; Djuric, N.; Dunn, G. H.; Larsson, M.; Le Padellec, A.; Rosaen, S. et al. (1999). «Branching fractions of dissociative recombination of NH4+ and NH2+ molecular ions». Astronomy and Astrophysics 344: 1027. Bibcode:1999A&A...344.1027V.
- ↑ van Dishoeck, E. F.; and Black, J. H. (1986). «Comprehensive models of diffuse interstellar clouds – Physical conditions and molecular abundances». Astrophys. J. Suppl. Ser. 62: 109-145. Bibcode:1986ApJS...62..109V. doi:10.1086/191135.
- ↑ «astrochemistry.net». astrochemistry.net. Consultado el 21 de mayo de 2011.
- ↑ Prasad, S. S. and Huntress, W. T. (1980). «A model for gas phase chemistry in interstellar clouds». The Astrophysical Journal Supplement Series 43: 1. Bibcode:1980ApJS...43....1P. doi:10.1086/190665.
- ↑ Lininger, W.; Albritton, D. L.; Fehsenfeld, F. C.; Schmeltekopf, A. L.; Ferguson, E. E. (1975). «Flow–drift tube measurements of kinetic energy dependences of some exothermic proton transfer rate constants». J. Chem. Phys. 62 (9): 3549. Bibcode:1975JChPh..62.3549L. doi:10.1063/1.430946.
- ↑ Smith, D.; Adams, N. G. (1977). «Reactions of CH+n IONS with ammonia at 300 K». Chemical Physics Letters 47 (1): 145. Bibcode:1977CPL....47..145S. doi:10.1016/0009-2614(77)85326-8.
- ↑ Wooten, A.; Bozyan, E. P.; Garrett, D. B. (1980). «Detection of C2H in cold dark clouds». Astrophysical Journal 239: 844. Bibcode:1980ApJ...239..844W. doi:10.1086/158168.
- ↑ Wilson, T. L., Downes, D., Bieging, J.; Downes; Bieging (1979). «Ammonia in Orion». AAp 71: 275. Bibcode:1979A&A....71..275W.
- ↑ MacDonald, G. H., Little, L. T., Brown, A. T., Riley, P. W., Matheson, D. N., Felli, M.; Little; Brown; Riley; Matheson; Felli (1981). «Detection of new ammonia sources». MNRAS 195: 387. Bibcode:1981MNRAS.195..387M.
- ↑ Morris, M., Zuckerman, B., Palmer, P., Turner, B. E. (1973). «Interstellar ammonia». APJ 186: 501. Bibcode:1973ApJ...186..501M. doi:10.1086/152515.
- ↑ Torrelles, J. M., Ho, P. T. P., Rodriguez, L. F., Canto, J. (1985). «VLA observations of ammonia and continuum in regions with high-velocity gaseous outflows». APJ 288: 595. Bibcode:1985ApJ...288..595T. doi:10.1086/162825.
- ↑ Ho, P. T. P., Martin, R. N.,Turner, J. L., Jackson, J. M. (1990). «VLA imaging of extragalactic ammonia – Hot gas in the nucleus of IC 342». APJL 355: L19. Bibcode:1990ApJ...355L..19H. doi:10.1086/185728.
- ↑ Cesaroni, R., Churchwell, E., Hofner, P., Walmsley, C. M., Kurtz, S.; Churchwell; Hofner; Walmsley; Kurtz (1994). «Hot ammonia toward compact HII regions». AAP 288: 903. Bibcode:1994A&A...288..903C.
- ↑ Knacke, R. F., McCorkle, S., Puetter, R. C., Erickson, E. F., Kraetschmer, W. (1982). «Observation of interstellar ammonia ice». APJ 260: 141. Bibcode:1982ApJ...260..141K. doi:10.1086/160241.
- ↑ Orton, G. S., Aumann, H. H., Martonchik, J. V., Appleby, J. F. (1982). «Airborne spectroscopy of Jupiter in the 100- to 300-cm−1 region: Global properties of ammonia gas and ice haze». Icarus 52 (1): 81. Bibcode:1982Icar...52...81O. doi:10.1016/0019-1035(82)90170-1.
- ↑ Benson, P. J., Myers, P. (1989). «A survey for dense cores in dark clouds». APJS 71: 89. Bibcode:1989ApJS...71...89B. doi:10.1086/191365.
- ↑ Mebold, U., Heithausen, A., Reif, K.; Heithausen; Reif (1987). «Ammonia in the galactic halo and the infrared cirrus». AAP 180: 213. Bibcode:1987A&A...180..213M.
Enlaces externos[editar]
 Varios autores (1910-1911). «Ammonia». En Chisholm, Hugh, ed. Encyclopædia Britannica. A Dictionary of Arts, Sciences, Literature, and General information (en inglés) (11.ª edición). Encyclopædia Britannica, Inc.; actualmente en dominio público.
Varios autores (1910-1911). «Ammonia». En Chisholm, Hugh, ed. Encyclopædia Britannica. A Dictionary of Arts, Sciences, Literature, and General information (en inglés) (11.ª edición). Encyclopædia Britannica, Inc.; actualmente en dominio público.- International Chemical Safety Card 0414 (anhydrous ammonia), ilo.org.
- International Chemical Safety Card 0215 (aqueous solutions), ilo.org.
- «Ammoniac et solutions aqueuses» (en francés). Institut National de Recherche et de Sécurité. Archivado desde el original el 11 de diciembre de 2010.
- Emergency Response to Ammonia Fertilizer Releases (Spills) for the Minnesota Department of Agriculture.ammoniaspills.org
- National Institute for Occupational Safety and Health – Ammonia Page, cdc.gov
- NIOSH Pocket Guide to Chemical Hazards - Ammonia, cdc.gov
- ATSDR en Español - ToxFAQs: Amoníaco. Departamento de Salud y Servicios Humanos de Estados Unidos.
- ATSDR en Español - Resumen de Salud Pública: Amoníaco. Departamento de Salud y Servicios Humanos de Estados Unidos.
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del amoníaco.



