Diferencia entre revisiones de «Helio»
Sin resumen de edición |
m Revertidos los cambios de 190.66.237.68 (disc.) a la última edición de Gsrdzl |
||
| Línea 1: | Línea 1: | ||
{{Ficha de elemento químico |
|||
| ⚫ | |||
|bgcolor = c0ffff |
|||
|nombre = Helio |
|||
|anterior = [[Hidrógeno]] |
|||
|posterior = [[Litio]] |
|||
|símbolo = He |
|||
|número = 2 |
|||
|superior = - |
|||
|inferior = [[Neón]] |
|||
|serie_química = [[Gases nobles]] |
|||
|grupo = [[Elementos del grupo 18|18]] |
|||
|periodo = [[Elementos del periodo 1|1]] |
|||
|bloque = [[Elementos del bloque p|p]] |
|||
|densidad = 0,1785 |
|||
|apariencia = Incoloro |
|||
|masa_atómica = 4,0026 |
|||
|radio_medio = |
|||
|radio_atómico = 31 |
|||
|radio_covalente = 32 |
|||
|radio_van_der_waals = 140 |
|||
|configuración_electrónica = 1[[Orbital atómico|s]]<sup>s</sup> |
|||
|electrones_por_nivel = 2 |
|||
|estados_oxidación = 0 (desconocido) |
|||
|estructura_cristalina = hexagonal |
|||
|estado = [[Gas]] |
|||
|P_fusión = 0,95 |
|||
|P_ebullición = 4,22 |
|||
|E_fusión = 5,23 |
|||
|E_vaporización = 0,0845 |
|||
|velocidad = 970 |
|||
|electronegatividad = Sin datos |
|||
|calor_específico = 5193 |
|||
|cond_eléctrica = Sin datos |
|||
| ⚫ | |||
|E_ionización1 = 2372,3 |
|E_ionización1 = 2372,3 |
||
|E_ionización2 = 5250,5 |
|E_ionización2 = 5250,5 |
||
| Línea 38: | Línea 71: | ||
El núcleo del átomo de helio-4, que es exactamente igual a una [[partícula alfa]],<ref>{{cita libro|apellido=Halliday|nombre=David|apellido2=Resnick|nombre2=Robert|apellido3=Krane|nombre3=Kenneth|título=Física|edición= tercera|editorial=Compañía Editorial Mexicana|volumen=2|isbn=968-26-1255-1|páginas=610}}</ref> es particularmente interesante. La razón de esto se debe a que experimentos de dispersión de electrones de alta energía han mostrado que su carga decrece de forma [[función exponencial|exponencial]] a partir de un máximo en su punto central, exactamente de la misma manera en que decrece la densidad de carga en su propia [[Orbital atómico|nube de electrones]]. Esta simetría refleja principios físicos similares: el par de neutrones y de protones en el núcleo del helio obedecen las mismas reglas mecánico-cuánticas que los dos electrones del helio —aunque las partículas en el núcleo están sujetas a diferentes potenciales que los unen—. De esta manera, estos [[fermión|fermiones]] (es decir, tanto protones como electrones y neutrones) ocupan completamente los orbitales 1s en pares, ninguno de ellos posee [[momento angular]] orbital y cada uno de ellos cancela el [[espín]] intrínseco del otro. El añadir otra de cualquiera de estas partículas requeriría momento angular y liberaría sustancialmente menos energía (de hecho, ningún núcleo con cinco [[nucleón|nucleones]] es estable). Por esta razón, este arreglo para estas partículas es extremadamente estable energéticamente, y dicha estabilidad da lugar a muchos fenómenos cruciales inherentes al helio en la naturaleza. |
El núcleo del átomo de helio-4, que es exactamente igual a una [[partícula alfa]],<ref>{{cita libro|apellido=Halliday|nombre=David|apellido2=Resnick|nombre2=Robert|apellido3=Krane|nombre3=Kenneth|título=Física|edición= tercera|editorial=Compañía Editorial Mexicana|volumen=2|isbn=968-26-1255-1|páginas=610}}</ref> es particularmente interesante. La razón de esto se debe a que experimentos de dispersión de electrones de alta energía han mostrado que su carga decrece de forma [[función exponencial|exponencial]] a partir de un máximo en su punto central, exactamente de la misma manera en que decrece la densidad de carga en su propia [[Orbital atómico|nube de electrones]]. Esta simetría refleja principios físicos similares: el par de neutrones y de protones en el núcleo del helio obedecen las mismas reglas mecánico-cuánticas que los dos electrones del helio —aunque las partículas en el núcleo están sujetas a diferentes potenciales que los unen—. De esta manera, estos [[fermión|fermiones]] (es decir, tanto protones como electrones y neutrones) ocupan completamente los orbitales 1s en pares, ninguno de ellos posee [[momento angular]] orbital y cada uno de ellos cancela el [[espín]] intrínseco del otro. El añadir otra de cualquiera de estas partículas requeriría momento angular y liberaría sustancialmente menos energía (de hecho, ningún núcleo con cinco [[nucleón|nucleones]] es estable). Por esta razón, este arreglo para estas partículas es extremadamente estable energéticamente, y dicha estabilidad da lugar a muchos fenómenos cruciales inherentes al helio en la naturaleza. |
||
Como ejemplo de estos hechos debidos a la alta estabilidad de la configuración electrónica del helio está la baja reactividad química de este elemento (la más baja de todos los elementos), así como la falta de interacción de sus átomos entre ellos mismos. Esto produce los [[Punto de fusión|puntos de fusión]] y de [[Punto de ebullición|ebullición]] más bajos de todos los elementos. De la misma manera, la estabilidad energética del núcleo de helio-4 da lugar a una fácil producción de estos núcleos en reacciones atómicas que involucran tanto emisión de partículas pesadas como [[fusión nuclear]]. Cierta cantidad de helio-3 estable se produce en reacciones de fusión a partir del hidrógeno, pero es una fracción mucho menor comparada con el helio-4. La estabilidad del helio-4 es la razón por la cual el hidrógeno se convierte en esta forma de helio en el [[Sol]], en vez de helio-3, [[deuterio]] u otros elementos más pesados. Asimismo es parcialmente responsable del hecho de que la partícula alfa es por mucho el tipo de [[Barión|partícula bariónica]] expelida por los núcleos atómicos. Dicho de otra manera, la [[desintegración alfa]] es mucho más común que la desintegración en núcleos más pesados.<ref>{{cita libro |apellido=Rapp |nombre=Donald |título=Quantum Mechanics |idioma=inglés |año=1971 |editorial=Holt, Rinehart and Winston, Inc. |ubicación= Estados Unidos de América |isbn=03-081294-1 |páginas=336-342}}</ref> |
|||
=== Fases de gas y de plasma === |
=== Fases de gas y de plasma === |
||
Revisión del 01:46 17 mar 2010
El helio es un elemento químico de número atómico 2, símbolo He y una masa atómica de 4,0026. A pesar de que su configuración electrónica es 1s2, el helio no figura en el grupo 2 de la tabla periódica de los elementos, junto al hidrógeno en el bloque s, sino que se coloca en el grupo 18 del bloque p, ya que al tener el nivel de energía completo presenta las propiedades de un gas noble. Es decir, es inerte (no reacciona) y al igual que éstos, es un gas monoatómico incoloro e inodoro. El helio tiene el menor punto de ebullición de todos los elementos químicos y sólo puede ser solidificado bajo presiones muy grandes. Es además el segundo elemento químico en abundancia en el universo tras el hidrógeno, encontrándose en la atmósfera trazas debido a la desintegración de algunos elementos. En algunos depósitos naturales el gas se encuentra en cantidad suficiente para la explotación.
El helio se emplea para el llenado de globos y dirigibles, como líquido refrigerante de materiales superconductores criogénicos y como gas envasado en el buceo a gran profundidad. También se utiliza en criogenia (su principal uso, lo que representa alrededor de un cuarto de la producción mundial), en la refrigeración de los imanes superconductores. En particular, la aplicación comercial más importante es en los escáneres de resonancia magnética. Industrialmente el helio se usa como protección para la soldadura por arco y otros procesos (como el crecimiento de cristales de silicio), lo cuales representan la mitad de su uso.[1]
En la Tierra, la ligereza de helio ha provocado la evaporación de la nube de gas y polvo del que el planeta se formaba, por lo que es relativamente poco frecuente en el volumen en la atmósfera terrestre. El helio ha sido en su mayoría creado por la desintegración radiactiva natural de los elementos radioactivos pesados (torio y uranio). Estos sistemas constan de núcleos de helio-4. Este helio radiogénico es atrapado por el gas natural en concentraciones de hasta el 7% en volumen, de la que se extrae comercialmente por un de proceso de separación a baja temperatura llamado destilación fraccionada.
Características principales
El átomo de helio
El helio en la mecánica cuántica
El helio es un elemento químico cuyo átomo es el más simple de resolver utilizando las reglas de la mecánica cuántica después del átomo de hidrógeno. El helio se compone de dos electrones en órbita alrededor de un núcleo que contiene dos protones junto con uno o dos neutrones, dependiendo del isótopo. Sin embargo, como en la mecánica newtoniana, ningún sistema que consiste de más de dos partículas se pueden resolver con un enfoque de análisis matemático exacto (véase problema de los tres cuerpos) y el helio no es la excepción. Así, los métodos matemáticos son necesarios, incluso para resolver el sistema de un núcleo y dos electrones. Sin embargo, tales métodos de la química computacional se han utilizado para crear una imagen mecánica cuántica de los electrones de helio vinculante que tiene una precisión del 2% del valor correcto,[2] en unos pocos pasos de cálculo. En estos modelos se encuentra que cada electrón en las pantallas de helio en parte el núcleo de la otra, es de aproximadamente 1,69 unidades, no los 2 cargos de un clásico "núcleo desnudo" de helio.
El átomo de hidrógeno se utiliza ampliamente para ayudar a resolver el átomo de helio. El modelo atómico de Bohr dio una explicación muy precisa de todo el espectro de hidrógeno, pero cuando se trataba de helio se derrumbó. Werner Heisenberg desarrolló una modificación del análisis de Bohr, sino que se trataba de un medio integral de los valores de los números cuánticos. La teoría del funcional de la densidad se utiliza para obtener los niveles de estado de energía del átomo de helio, junto con el método de Hartree-Fock.
En condiciones normales de presión y temperatura el helio es un gas monoatómico no inflamable, pudiéndose licuar sólo en condiciones extremas (de alta presión y baja temperatura).
Tiene el punto de solidificación más bajo de todos los elementos químicos, siendo el único líquido que no puede solidificarse bajando la temperatura, ya que permanece en estado líquido en el cero absoluto a presión normal. De hecho, su temperatura crítica es de tan sólo 5,19K o -267.96 grados centígrados. Los sólidos 3He y 4He son los únicos en los que es posible, incrementando la presión, reducir el volumen más del 30%. El calor específico del gas helio es muy elevado y el helio vapor muy denso, expandiéndose rápidamente cuando se calienta a temperatura ambiente.
El helio sólido sólo existe a presiones del orden de 100 MPa a 15 K (-248,15 °C). Aproximadamente a esa temperatura, el helio sufre una transformación cristalina, de estructura cúbica a estructura hexagonal compacta. En condiciones más extremas se produce un nuevo cambio, empaquetándose los átomos en una estructura cúbica centrada en el cuerpo. Todos estos empaquetamientos tienen energías y densidades similares, debiéndose los cambios a la forma en la que los átomos interactúan.
Estabilidad del núcleo del helio-4 debida a su relación con la capa de electrones
El núcleo del átomo de helio-4, que es exactamente igual a una partícula alfa,[3] es particularmente interesante. La razón de esto se debe a que experimentos de dispersión de electrones de alta energía han mostrado que su carga decrece de forma exponencial a partir de un máximo en su punto central, exactamente de la misma manera en que decrece la densidad de carga en su propia nube de electrones. Esta simetría refleja principios físicos similares: el par de neutrones y de protones en el núcleo del helio obedecen las mismas reglas mecánico-cuánticas que los dos electrones del helio —aunque las partículas en el núcleo están sujetas a diferentes potenciales que los unen—. De esta manera, estos fermiones (es decir, tanto protones como electrones y neutrones) ocupan completamente los orbitales 1s en pares, ninguno de ellos posee momento angular orbital y cada uno de ellos cancela el espín intrínseco del otro. El añadir otra de cualquiera de estas partículas requeriría momento angular y liberaría sustancialmente menos energía (de hecho, ningún núcleo con cinco nucleones es estable). Por esta razón, este arreglo para estas partículas es extremadamente estable energéticamente, y dicha estabilidad da lugar a muchos fenómenos cruciales inherentes al helio en la naturaleza.
Como ejemplo de estos hechos debidos a la alta estabilidad de la configuración electrónica del helio está la baja reactividad química de este elemento (la más baja de todos los elementos), así como la falta de interacción de sus átomos entre ellos mismos. Esto produce los puntos de fusión y de ebullición más bajos de todos los elementos. De la misma manera, la estabilidad energética del núcleo de helio-4 da lugar a una fácil producción de estos núcleos en reacciones atómicas que involucran tanto emisión de partículas pesadas como fusión nuclear. Cierta cantidad de helio-3 estable se produce en reacciones de fusión a partir del hidrógeno, pero es una fracción mucho menor comparada con el helio-4. La estabilidad del helio-4 es la razón por la cual el hidrógeno se convierte en esta forma de helio en el Sol, en vez de helio-3, deuterio u otros elementos más pesados. Asimismo es parcialmente responsable del hecho de que la partícula alfa es por mucho el tipo de partícula bariónica expelida por los núcleos atómicos. Dicho de otra manera, la desintegración alfa es mucho más común que la desintegración en núcleos más pesados.[4]
Fases de gas y de plasma

El helio es el gas noble menos reactivo después del neón y por tanto, el segundo elemento menos reactivo de todos los elementos. Es inerte y monoatómico en todas las condiciones estándar. Debido a su baja masa atómica, es la fase gaseosa, su conductividad térmica, calor específico, y la velocidad del sonido son mayores que cualquier otro gas, excepto por el hidrógeno. Por razones similares, y también debido al pequeño tamaño de los átomos de helio, la tasa de difusión del helio a través de los sólidos es tres veces mayor que la del aire y alrededor del 65% del hidrógeno.[5]

El helio es menos soluble en agua que cualquier otro gas conocido,[6] y el índice de refracción es más cercano a la unidad que la de cualquier otro gas.[7] El helio tiene un coeficiente Joule-Thomson negativo a temperatura ambiente normal, lo que significa que se calienta cuando se le permite expandir libremente. Sólo por debajo de su temperatura de inversión Joule-Thomson (de 32 a 50 K a 1 atmósfera) se enfría en la expansión libre.[5] Una vez preenfriado debajo de esta temperatura, el helio puede licuarse mediante el enfriamiento de expansión.
La mayor parte del helio extraterrestre se encuentra en un estado de plasma, con propiedades muy diferentes de los del helio atómico. En el plasma, los electrones del helio no están obligados a estar en su núcleo, lo que hace que su conductividad eléctrica sea muy alta, aun cuando el gas es sólo parcialmente ionizado. Las partículas cargadas son altamente influenciadas por los campos magnéticos y eléctricos. Por ejemplo, en el viento solar, junto con el hidrógeno ionizado, las partículas interactúan con la magnetósfera de la Tierra, dando lugar a la corriente de Birkeland y a la aurora.[8]
Fases líquida y sólida
A diferencia de cualquier otro elemento, el helio líquido se mantendrá así hasta el cero absoluto a presiones normales. Este es un efecto directo de la mecánica cuántica: en concreto, la energía del punto cero del sistema es demasiado alta para permitir la congelación. El helio sólido requiere una temperatura de 1 a 1.5 ºK (alrededor de -272 °C o -457 °F) y alrededor de 25 bar (2,5 MPa) de presión.[9] A menudo es difícil distinguir el helio sólido del líquido ya que el índice de refracción de las dos fases es casi el mismo. El sólido tiene un marcado punto de fusión y estructura cristalina, pero es muy compresible. Aplicar presión en un laboratorio puede reducir su volumen en más del 30%.[10] Con un módulo de compresibilidad del orden de 50 MPa,[11] es 50 veces más compresible que el agua. El helio sólido tiene una densidad de 0,214 ± 0,006 g/ml a 1,15 ºK y 66 atm, la densidad proyectada a 0 ºK y 25 bar (2,5 MPa) es 0,187 ± 0,009 g/ml.[12]
Helio I
Por debajo de su punto de ebullición de 4,22 ºK, y por encima del punto lambda de 2,1768 ºK, el isótopo del helio-4 existe en un estado normal de líquido incoloro, llamado helio I.[5] Al igual que otros líquidos criogénicos, el helio se reduce cuando se calienta y se contrae cuando se baja su temperatura. Por debajo del punto lambda, sin embargo, el helio no se reduce y se expande a medida que la temperatura desciende aún más.
El helio tiene un índice de refracción similar al de un gas, de 1,026, lo que hace que su superficie sea muy difícil de ver. Flotadores de espuma de poliestireno se utilizan a menudo para mostrar la superficie.[5] Este líquido incoloro, tiene una muy baja viscosidad y una densidad de 0,145 g/mL, que es sólo una cuarta parte del valor esperado de la física clásica.[5] La mecánica cuántica es necesaria para explicar esta propiedad y, por tanto, ambos tipos de helio líquido se llaman fluidos cuánticos, lo que significa que muestran las propiedades atómicas a escala macroscópica. Esto puede ser un efecto del porqué su punto de ebullición está tan cerca del cero absoluto, impidiendo que el movimiento molecular aleatorio oculte las propiedades atómicas (energía térmica).[5]
Helio II

El helio líquido por debajo de su punto lambda muestra características sumamente inusuales, en un estado llamado helio II. La ebullición del helio II no es posible debido a su alta conductividad térmica; la entrada de calor causa la evaporación del líquido directo a gas. El isótopo de helio-3 también tiene una fase de superfluido, pero sólo a temperaturas mucho más bajas. Como resultado, se sabe menos sobre las propiedades de este tipo en el isótopo de helio-3.[5]
El helio II es un superfluido, un estado cuántico de la materia con propiedades extrañas. Por ejemplo, cuando fluye a través de capilares tan delgados como de 10-7 a 10-8 m, no tiene viscosidad medible. Sin embargo, cuando las mediciones se realizaron entre dos discos en movimiento, se observó una viscosidad comparable a la de helio gaseoso. La teoría actual explica este fenómeno utilizando un modelo de dos fluidos para el helio II. En este modelo, el helio líquido por debajo del punto lambda se considera que contiene una proporción de átomos de helio en un estado fundamental, que son superfluidos, flujo de viscosidad exactamente igual a cero, y una proporción de átomos de helio en un estado excitado, que se comportan más como un fluido ordinario.[13]
En el efecto fuente, se construye una cámara que está conectada a un depósito de helio II por medio de un disco sinterizado a través del cual el helio superfluido pasa fácilmente pero los que no son superfluidos no pueden. Si se calienta el interior del contenedor, el helio deja de ser superfluido. A fin de mantener el equilibrio de la fracción de helio superfluido, a través de fugas de helio superfluido y aumenta la presión, haciendo que el líquido salga del recipiente.[14]
La conductividad térmica del helio II es mayor que la de cualquier otra sustancia conocida, un millón de veces mayor que la del helio y varios cientos de veces la del cobre.[5] Esto se debe a la conducción de calor se produce por un mecanismo cuántico excepcional. La mayoría de los materiales que conducen calor tienen una banda de electrones de valencia libres que sirven para transferir el calor. El helio II no tiene banda de valencia, pero conduce bien el calor. El flujo de calor se rige por las ecuaciones que son similares a la ecuación de onda utilizadas para caracterizar la propagación del sonido en el aire. Cuando se introduce calor, se mueve a 20 metros por segundo a 1,8 ºK a través de helio II como ondas en un fenómeno conocido como segundo sonido.[5]
El helio II también presenta un efecto progresivo. Cuando una superficie se extiende más allá del nivel de helio II, el helio II se mueve a lo largo de la superficie, contra la fuerza de gravedad. Se mueve en 30 nm de espesor de película, independientemente del material de superficie. Esta película se llama película Rollin y lleva el nombre del hombre que primero se caracteriza este rasgo, Bernard V. Rollin.[5][15][16] Las ondas que se propagan a través de una película de Rollin se rigen por la misma ecuación de ondas de gravedad en aguas poco profundas, pero en lugar de la gravedad, la fuerza de restauración es la fuerza de van der Waals.[17] Estas ondas son conocidas como tercer sonido.[18]
Compuestos
Dado que el helio es un gas noble, en la práctica no participa en las reacciones químicas, aunque bajo la influencia de descargas eléctricas o bombardeado con electrones forma compuestos con el wolframio, yodo, flúor y fósforo.
El helio tiene una valencia cero y no es químicamente reactivo bajo condiciones normales.[19] Es un aislante eléctrico a menos que esté ionizado. Al igual que los demás gases nobles el helio tiene un niveles de energía metaestable, lo que le permite seguir ionizado con una descarga eléctrica con un voltaje por debajo de su potencial de ionización.[5] El helio puede formar compuestos inestables, conocidos como excímeros, cuando se somete a una descarga luminiscente eléctrica, a un bombardeo de electrones, o bien es un plasma por otra razón. Los compuestos moleculares HeNe, HgHe10 y WHe2, y los iones moleculares se han creado de esta manera.[20] Esta técnica también ha permitido la producción de la molécula neutra He2, que tiene un gran número de sistemas de banda, y HgHe, que aparentemente sólo se mantienen unidos por fuerzas de la polarización.[5] En teoría, otros compuestos reales también podrían ser posibles, como el helio fluorohídrico (HHeF), que sería análogo al argón fluorhídrico, descubierto en 2000.[21] Los cálculos indican que dos nuevos compuestos conteniendo una mezcla de helio-oxígeno podría ser estable.[22] Dos nuevas especies moleculares, predecidos teóricamente, CsFHeO y N(CH3)4FHeO, son los derivados de un metaestable [HEO-F], anión teorizado en 2005 por un grupo de Taiwán. Si es confirmado por la experiencia, estos compuestos terminarán la inercia química del helio, y el único elemento inerte será el neón.[23]
Isótopos

Existen ocho isótopos conocidos del helio, pero tan sólo el 3He y el 4He son estables. en la atmósfera terrestre hay un átomo de 3He por cada millón de átomos 4He.[24] A diferencia de otros elementos, la abundancia isotópica del helio varía mucho por su origen, debido a los diferentes procesos de su formación. El isótopo más común, el 4He, se produce en la Tierra mediante la desintegración alfa de elementos radiactivos más pesados; las particulas alfa que aparecen están completamente ionizadas en su núcleo de 4He. El 4He tiene un núcleo unusualmente estable debido a que sus nucleones están ordenados en un cubiertas completas. Además, se formó en grandes cantidades durante la nucleosíntesis primordial.[25]
El 3He está presente hoy en día en la tierra tan sólo en rastros (la mayoría data desde la formación de la Tierra), aunque algunas caen a la Tierra al ser atrapados en polvo cósmico.[26] Algunos rastros también son producidos mediante la desintegración beta del tritio.[27]
Algunas rocas de la corteza terrestre tienen distintos rangos de isótopos que varían hasta cantidades con factor de diez dígitos, los cuales pueden ser usados para investigar el origen de las rocas así como la composición del manto terrestre.[26] El 3He es mucho más abundante en las estrellas como producto de la fusión nuclear. Por consiguiente, en el medio interestelar, la proporción de 3He y 4He es alrededor de 100 veces más grande que la que hay en la Tierra.[28] Material extraplanetario, tales como regolitos de asteroides y lunar, tienen rastros d 3He que fue bombardeado por los vientos solares. La superficie de la Luna tiene concentraciones de 3He en el orden de 0.01 ppm.[29][30] Algunas personas, comenzando con Gerald Kulcinski en 1986,[31] han propuesto explorar la Luna, excavar los regolitos lunares, y utilizar el 3He para fusión. Es posible producir isótopos exóticos de helio, los cuales rápidamente se descomponen en otras sustancias. El isótopo de más corta duración es el 5He, con un periodo de semidesintegración de 7.6×10–22 segundos. El 6Hese descompone emitiendo una partícula beta y su periodo de desintegración es de 0,8 segundos. El 7He también emite partículas beta así como rayos gamma. Tanto el 7He y el 8He se crean mediante algunas reacciones nucleares.[5] el yHe y el 8He sin conocidos por tener un halo nuclear. El 2He (2 protones, sin neutrones) es un radioisótopo que se desintegra por emisión de protones en protio (hidrógeno), con un periodo de desintegración de 3×10–27 segundos.[5]
Abundancia y obtención
Abundancia natural
El helio es el segundo elemento más abundante del universo tras el hidrógeno y constituye alrededor del 23% de la masa bariónica del universo.[24] La gran mayoría del helio se formó durante la nucleosíntesis del Big Bang, en los tres primeros minutos. Como tal, la medición de su abundancia contribuye a los modelos cosmológicos. En las estrellas, el helio se forma por la fusión nuclear del hidrógeno en cadenas de reacción protón-protón y del ciclo CNO, parte de la nucleosíntesis estelar.[25]
En la atmósfera terrestre la concentración de helio por volumen es de tan sólo 5,2 partes por millón[32][33] y su concentración es prácticamente constante a pesar de la contínua producción de nuevo helio debido a que la mayoría del helio en la atmósfera se escapa al espacio debido a distintos procesos.[34][35] En la Heterosfera terrestre, el helio y otros gases ligeros son los elementos más abundantes.
Casi todo el origen del helio en la Tierra es el resultado de la desintegración radiactiva, y por tanto, un globo de helio terrestre es en esencia una bolsa de partículas alfa. El helio se encuentra en grandes cantidades en los minerales de uranio y torio, incluyendo cleveite, pechblenda, carnotita y monacita, porque emiten partículas alfa (núcleos de helio, He2 +) para que los electrones se combinan de inmediato tan pronto como la partícula es detenido por la roca. De esta manera, se estima que 3.000 toneladas de helio se generan al año en toda la litosfera.[36][37][38] En la corteza terrestre, la concentración de helio es de 8 partes por billón. En el mar, la concentración es de sólo 4 partes por trillón. También hay pequeñas cantidades en los manantiales de aguas minerales, gas volcánico, y el hierro meteórico. Debido a que el helio es atrapado en una manera similar por una capa impermeable de roca como el gas natural, las mayores concentraciones en el planeta se encuentran en el gas natural, del que se deriva de helio más comercial. La concentración varía en una amplia gama de unas pocas ppm hasta más del 7% en un campo de gas de pequeño en el Condado de San Juan, Nuevo México.[39][40]
Extracción moderna
Para el uso en gran escala, el helio se extrae por destilación fraccionada del gas natural, que contiene hasta un 7% de helio.[41] Como el helio tiene un punto de ebullición más bajo que cualquier otro elemento, baja temperatura y alta presión se utilizan para licuar casi todos los otros gases (principalmente nitrógeno y metano). El resultado del helio crudo se purifica por sucesivas exposiciones a temperaturas bajas, en la que casi todos los restantes de nitrógeno y otros gases se precipitan fuera de la mezcla gaseosa.[5] El carbón activado se utiliza como una fase de purificación final, que da como resultado helio Grado A, con una pureza del 99,995%.[5]. En la fase final de la producción, la mayoría del helio que se produce es licuado por medio de un proceso criogénico. Esto es necesario para aplicaciones que requieren helio líquido y también permite a los proveedores de helio para reducir el costo del transporte de larga distancia, como el mayor de los contenedores de helio líquido tiene más de cinco veces la capacidad de los más grandes remolques.[42][43]
En 2008, alrededor de 169 millones de metros cúbicos estándar (SCM) de helio se extrae del gas natural o retirada de las reservas de helio, con aproximadamente el 78% de los Estados Unidos, el 10% de Argelia, y la mayoría del resto de Rusia, Polonia y Qatar.[44] En los Estados Unidos, la mayoría de helio se extrae del gas natural de los campos de gas en las inmediaciones en Kansas, Oklahoma y Texas.[45] En 2000, EE.UU. tiene reservas probadas de helio, de alrededor de 147 mil millones de pies cúbicos estándar (4,2 mil millones SCM). Esta cantidad es suficiente para unos 25 años de uso mundial, o de 35 años de consumo de EE.UU., aunque los factores en el ahorro y el procesamiento de impacto se espera que el número de reserva efectiva. Se estima que la base resourse de helio aún no probadas de gas natural en los EE.UU. sea de 31 a 53 billion SCM, o aproximadamente un orden de magnitud más que las reservas probadas.[46]
El helio se extrae del gas natural, ya que está presente en el aire a sólo una fracción de la de neón, pero la demanda es mucho mayor. El helio puede ser sintetizado por el bombardeo de litio o boro con protones de alta velocidad, pero este un método económicamente totalmente inviable de la producción.[47]
Agotamiento en los suministros de helio
Las reservas actuales de helio se están utilizando mucho más rápido de lo que se repone. Dada esta situación, son las principales preocupaciones que el suministro de helio pueden agotarse pronto, sobretodo en las reservas más grandes del mundo, en Amarillo, Texas, se espera que se agote en los próximos ocho años. Esto podría ser prevenibles si los actuales usuarios capturar y reciclar el petróleo y el gas si las compañías hacen uso de técnicas de captura en la extracción de gas.[48][49]
Aplicaciones
El helio es más ligero que el aire y a diferencia del hidrógeno no es inflamable, siendo además su poder ascensional un 8% menor que la de éste, por lo que se emplea como gas de relleno en globos y zepelines publicitarios, de investigación atmosférica e incluso para realizar reconocimientos militares.
Aún siendo la anterior la principal el helio tiene más aplicaciones:
- Las atmósferas helio-oxígeno se emplean en la inmersión a gran profundidad, ya que el helio es inerte, menos soluble en la sangre que el nitrógeno y se difunde 2,5 veces más deprisa que él, todo lo cual reduce el tiempo requerido para la descompresión, aunque ésta debe comenzar a mayor profundidad, y elimina el riesgo de narcosis por nitrógeno (borrachera de las profundidades).
- Por su bajo punto de licuefacción y evaporación puede utilizarse como refrigerante en aplicaciones a temperatura extremadamente baja como en imanes superconductores e investigación criogénica a temperaturas próximas al cero absoluto.
- En cromatografía de gases se usa como gas portador inerte.
- La atmósfera inerte de helio se emplea en la soldadura por arco y en la fabricación de cistales de silicio y germanio, así como para presurizar combustibles líquidos de cohetes.
- En túneles de viento supersónicos.
- Como agente refrigerante en reactores nucleares.
- El helio líquido encuentra cada vez mayor uso en las aplicaciones médicas de la imagen por resonancia magnética (RMI).
- Se utiliza en equipos láser como uno de los gases, el más común es el Helio-Neón.
En 2008 la producción total mundial de helio fue de 32 millones de kg. El mayor uso (alrededor del 22% del total en 2008) fue en aplicaciones criogénicas, la mayoría de los cuales comprende el enfriamiento de los imanes superconductores de medicina (véase imagen por resonancia magnética).[50] Otros usos importantes (por un total de cerca de 78% de uso en 1996) fueron en los sistemas de presurización y purga, el mantenimiento de atmósferas controladas, y la soldadura.[51]
El helio se utiliza para muchos propósitos que requieren algunas de sus propiedades únicas, tales como su bajo punto de ebullición, baja densidad, baja solubilidad, alta conductividad térmica, o su inercia. El helio está disponible comercialmente en forma líquida o gaseosa. Como un líquido, puede ser suministrada en recipientes pequeños llamados Dewars que permiten llevar hasta 1.000 litros de helio, o en los contenedores ISO de gran tamaño que tienen una capacidad nominal tan grande como 42 m3. En forma gaseosa, pequeñas cantidades de helio se suministran en cilindros de alta presión que puede recibir hasta 8 m3 (300 pies cúbicos), mientras que grandes cantidades de gas de alta presión son ofrecidos en remolques que tienen una capacidad de hasta 4.860 m3.
- Dirigibles, globos y cohetes
Debido es más ligero que el aire, dirigibles y los globos son inflados con helio para la elevación. Mientras que el hidrógeno es aproximadamente un 7% más boyante, el helio tiene la ventaja de ser no inflamable (además de ser retardante del fuego). En los cohetes, el helio se utiliza como un medio de llenado para desplazar a los combustibles y oxidantes en los tanques de almacenamiento y para condensar el hidrógeno y el oxígeno para producir combustible para cohetes. También se utiliza para depurar el combustible y el oxidante de los equipos de apoyo en tierra, antes del lanzamiento y de comprobar la validez de hidrógeno líquido frío en vehículos espaciales. Por ejemplo, el propulsor Saturno V utiliza en el programa Apolo necesarios cerca de 370.000 m3 (13 millones de pies cúbicos) de helio para poner en marcha el cohete.
- Comercial y recreacional
El helio es menos denso que el aire atmosférico, por lo que va a cambiar el timbre de la voz de una persona cuando se inhala (véase altura).[52] Sin embargo, la inhalación de una fuente comercial típica, como la utilizada para rellenar globos, puede ser peligrosa debido al riesgo de asfixia por falta de oxígeno, y el número de contaminantes que pueden estar presentes. Estos pueden incluir trazas de otros gases, además de usarse en el aceite lubricante en aerosol.
Por su baja solubilidad en el tejido nervioso, las mezclas de helio, como trimix, heliox y Heliair se utilizan para el buceo de profundidad para reducir los efectos de la narcosis.[53][54] A profundidades por debajo de 150 metros (490 pies) de pequeñas cantidades de hidrógeno se agregan a una mezcla de helio-oxígeno para contrarrestar los efectos del síndrome de alta presión nerviosa.[55] A estas profundidades de la baja densidad de helio se encuentra a reducir considerablemente el esfuerzo de la respiración.
Los láseres de helio-neón tienen varias aplicaciones, incluyendo lectores de código de barras.
- Detección de fugas industriales

Una de las aplicaciones industriales para el helio es la detección de fugas. Debido a que se difunde a través de sólidos en tres veces la tasa de aire, el helio se utiliza como gas indicador para detectar fugas en el equipo de alto vacío y recipientes de alta presión.[56]
Si se necesita conocer la tasa de fuga total del producto de prueba (por ejemplo en bombas de calor o sistemas de aire acondicionado), el objeto se coloca en una cámara de prueba, el aire de la cámara se extrae con bombas de vacío y el producto es lleno de helio a presión específica. El helio que se escapa a través de las fugas es detectado por un dispositivo sensible (espectrómetro de masas). El procedimiento de medición es automática y normalmente se llama helio Integral de prueba. En una prueba sencilla, el producto está lleno de helio y un operador es la búsqueda manual de la fuga con un dispositivo de mano llamado sniffer.[57]
Por su inercia y alta conductividad térmica, su transparencia de neutrones, y porque no forma isótopos radiactivos en condiciones de reactor, el helio se utiliza como medio de transmisión de calor en algunos reactores nucleares de gas enfriado.[56] El helio se utiliza como gas de protección en los procesos de soldadura por arco en los materiales que están contaminados con facilidad por vía aérea.
El helio se utiliza como gas protector en el crecimiento de cristales de silicio y germanio, en titanio y la producción de circonio, y en cromatografía de gases, porque es inerte. Debido a su inercia, conductividad térmica, alta velocidad del sonido, y el alto valor del coeficiente de capacidad de calor, también es útil en túneles de viento supersónico y las instalaciones de impulso.[58][59]
El helio, mezclado con un gas más pesado, como el xenón, es útil para la refrigeración termoacústica debido a la elevada tasa de calor resultante de la capacidad y número de Prandtl .bajo[60] La inercia de helio tiene ventajas ambientales sobre los sistemas de refrigeración convencionales, que contribuyen al agotamiento de la capa de ozono o al calentamiento global.[61]
- Uso científico

El uso del helio reduce los efectos distorsionadores de las variaciones de temperatura en el espacio entre las lentes de algunos telescopios, debido a su muy bajo índice de refracción. Este método es especialmente utilizado en telescopios solares en un apretado tubo de vacío, donde el telescopio sería demasiado pesado.[62][63]
La edad de las rocas y los minerales que contienen uranio y torio puede estimarse midiendo el nivel de helio con un proceso conocido como el helio de citas.
El helio líquido se utiliza para enfriar ciertos metales a las temperaturas extremadamente bajas necesarias para la superconductividad, como en imanes superconductores para la resonancia magnética. El Gran Colisionador de Hadrones del CERN usa 96 toneladas de helio líquido para mantener la temperatura a 1,9 ºK.[64] El helio a baja temperatura, también se usa en criogenia.
El helio es un gas portador utilizado para cromatografía de gases. La tasa de fugas de buques industriales (generalmente cámaras de vacío y tanques criogénicos) se mide a través de helio debido a su diámetro molecular pequeño y porque es inerte. No existe otra sustancia inerte que filtrará a través de micro-fisuras o micro-poros en la pared de un buque a un ritmo mayor que el helio. Un detector de fugas de helio (véase espectrómetro de masas) se utiliza para encontrar fugas en buques. Las fugas de helio a través de grietas, no debe confundirse con la penetración de gas a través de un material a granel. Mientras que el helio se ha documentado las constantes de permeabilidad a través de vidrios, cerámicas y materiales sintéticos, gases inertes como el helio no se extenderán a la mayoría de los metales a granel.[65]
Historia
Descubrimiento científico
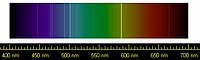
La primera evidencia del helio se observó el 18 de agosto 1868 como una línea de color amarillo brillante con una longitud de 587,49 nanómetros en la cromosfera del sol. La línea fue detectada por el astrónomo francés Pierre Janssen durante un eclipse solar total en Guntur, India.[66] Esta línea en uh principio se suponía era de sodio. El 20 de octubre del mismo año, el astrónomo inglés Joseph Norman Lockyer observó una línea amarilla en el espectro solar, la cual nombró línea D3 Fraunhofer porque estaba cerca de la conocidas líneas de sodio D1 y D2.[5] Llegó a la conclusión de que era causada por un elemento existente en el Sol desconocido en la Tierra. Eduard Frankland confirmó los resultados de Janssen y propuso el nombre helium para el nuevo elemento, en honor al dios griego del sol (Helios) al que se añadió el sufijo -ium ya que se esperaba que el nuevo elemento fuera metálico.[67][68][69]
En 1882, el físico italiano Luigi Palmieri detectó helio en la Tierra por primera vez, a través de su línea espectral D3, cuando analizó la lava del Monte Vesubio.[70]
El 26 de marzo de 1895 Sir William Ramsay aisló el helio al tratar la cleivita (una variedad de la uranita que contiene por lo menos un 10% de tierras raras) con ácidos minerales. Ramsey en realidad buscaba argón, pero después de separar el nitrógeno y el oxígeno del gas liberado por el ácido sulfúrico, notó una brillante línea amarilla que coincidía con la línea D3 observada en el espectro solar.[5][71][72][73] Las muestras fueron identificadas como helio por Lockyer y el físico británico William Crookes. Fue además aislado independientemente de la clevita el mismo año por los químicos Per Teodor Cleve y Abraham Langlet en Uppsala (Suecia), quienes pudieron obtener suficiente cantidad del gas para determinar acertadamente su peso atómico.[24][74][75] El helio también fue aislado por el geoquímico estadounidense William Francis Hillebrand, aunque éste atribuyó las líneas al nitrógeno.
En 1907 Ernest Rutherford y Thomas Royds mostraron que las partículas alfa son núcleos de helio. En 1908 el físico alemán Heike Kamerlingh Onnes produjo helio líquido enfriando el gas hasta 0,9 K,[76] lo que le hizo merecedor del premio Nobel. En 1926 su discípulo Willem Hendrik Keesom logró por vez primera solidificar el helio.[77]
En 1938, el físico ruso Pyotr Leonidovich Kapitsa descubrió que el helio IV casi no tiene viscosidad a temperaturas cercanas al cero absoluto, un fenómeno que ahora se llama superfluidez.[78] Este fenómeno está relacionado con la condensación de Bose-Einstein. En 1972, el mismo fenómeno se observó en el helio-3, pero a temperaturas mucho más cerca del cero absoluto, por los físicos estadounidenses Douglas D. Osheroff, David M. Lee y Robert C. Richardson. El fenómeno en el helio IV se cree que en relación con la vinculación de helio-3 para que los fermiones creen bosones, en analogía a los pares de Cooper que producen la superconductividad.[79]
Extracción y uso

Después de una operación de perforación de petróleo en 1903 en Dexter, Kansas, se produjo un géiser de gas que no se quemaba. El geólogo Erasmus Haworth recogió muestras de los gases de escape y se las llevó a la Universidad de Kansas en Lawrence, donde, con la ayuda de químicos Hamilton Cady y David McFarland, descubrió que el gas consistía, en volumen, 72% de nitrógeno, 15% de metano (un porcentaje único combustible con el oxígeno suficiente), 1% de hidrógeno, y 12%, un gas no identificado.[80] Con más análisis, Cady y McFarland descubrió que el 1,84% de la muestra de gas es helio.[81][82] Esto demostró que a pesar de su rareza global de la Tierra, el helio se concentró en grandes cantidades en virtud de las Grandes Planicies de América, disponible para la extracción como un subproducto del gas natural.[83] La mayor reserva de helio se encontraban en los campos de gas del suroeste de Kansas, de Texas y Oklahoma.
Esto permitió a los Estados Unidos convertirse en el principal proveedor mundial de helio. Tras una sugerencia de Sir Richard Threlfall, la Marina de los Estados Unidos patrocinó tres pequeñas plantas experimentales de producción de helio durante la Primera Guerra Mundial. El objetivo era proporcionar globos de barrera con el gas más ligero no inflamable. Un total de 5.700 m3 (200.000 pies cúbicos) de 92% de helio se produce en el programa a pesar de que menos de un metro cúbico de gas habían sido adquiridos. Parte de este gas de helio se utilizó en la primera aeronave, de la Marina de EE.UU., que hizo su primer viaje de Hampton Roads, Virginia, a Bolling Field en Washington DC, el 1 de diciembre de 1921. [84]
Aunque el proceso de extracción, el uso de licuefacción de gas de baja temperatura, no se desarrolló a tiempo para ser significativas durante la Primera Guerra Mundial, la producción continuó. El helio se utiliza principalmente como un gas de elevación más ligeros que el de aeronaves. La demanda fue mayor durante la Segunda Guerra Mundial, así como las demandas de soldadura por arco. El espectrómetro de masas de helio también fue vital en la bomba atómica del Proyecto Manhattan.[85]
El gobierno de los Estados Unidos creó la Reserva Nacional de helio en 1925 en Amarillo, Texas, con el objetivo de suministrar helio a aeronaves militares en tiempo de guerra y aeronaves comerciales en tiempos de paz. Debido a un embargo militar de EE.UU. contra Alemania que el suministro de helio era restringido, el LZ-129 Hindenburg se vio obligado a utilizar el hidrógeno como gas elevador. El uso de helio tras la Segunda Guerra Mundial estaba deprimido, pero la reserva se amplió en la década de 1950 para garantizar el suministro de helio líquido como refrigerante para crear oxígeno y combustible para los cohetes de hidrógeno (entre otros usos) durante la carrera espacial y la Guerra Fría. El uso de helio en los Estados Unidos en 1965 fue de más de ocho veces el consumo máximo de tiempo de guerra.[86]
La Oficina de Minas de EE.UU. dispuso de cinco plantas privadas para recuperar de helio a partir de gas natural. Para este programa de conservación de helio, la Oficina construyó 684 km de tuberías en Bushton, Kansas para conectar las plantas con el campo de gas, cerca de Amarillo, Texas. Esta mezcla de helio y nitrógeno fue inyectada y almacenada en el campo de gas de Cliffside hasta que se necesite, cuando luego se purifica.[87]
En 1995, mil millones de metros cúbicos de gas se ha recaudado y la deuda era de 1.4 billones de dólares, lo que llevó al Congreso de los Estados Unidos para eliminar la reserva en 1996. El helio producido entre 1930 y 1945 fue aproximadamente 98,3% de pureza (nitrógeno 2%), el cual fue suficiente para llenar los dirigibles. En 1945, se usó una pequeña cantidad de helio, para el uso de la soldadura.[88]
Durante muchos años, Estados Unidos ha producido más del 90% de helio que puede utilizarse comercialmente en el mundo, mientras que las plantas de extracción en Canadá, Polonia, Rusia y otros países producen el resto.[89] A mediados de la década de 1990, una nueva planta en Arzew, Argelia entró en funcionamiento y produjo 17 millones de metros cúbicos de helio, con una producción suficiente para cubrir toda la demanda de Europa. Mientras tanto, en el año 2000, el consumo de helio dentro de los EE.UU. había aumentado a más de 15 millones de kg.[90] Entre 2004 y 2006, dos plantas adicionales, una en Ras laffen, Qatar y la otra en Skikda, Argelia fueron construidas, pero a principios de 2007, Ras laffen está funcionando al 50%, y Skikda aún no ha sido puesta en marcha. Argelia se convirtió rápidamente en el segundo principal productor de helio.[42] A través de este tiempo, tanto el consumo de helio, como los costos de producción de helio aumentaron.[91] Entre 2002 y 2007 el precio del helio se duplicó, y en 2008 sólo los principales proveedores aumentaron sus precios en un 50%.[92]
Precauciones
Un efecto producido al inhalar helio es hacer la voz humana más aguda. Esto se debe a que el helio es menos denso que el aire, por lo que las cuerdas vocales pueden vibrar a mayor frecuencia, pues tienen menor resistencia que superar (Helium FAQ). Aunque este efecto pueda resultar curioso, es peligroso realizarlo excesivamente, ya que el helio puede provocar asfixia. Un gas que produce el efecto contrario es el Hexafluoruro de azufre, es decir, hace la voz humana más grave al inhalarlo.
Los depósitos de helio gas de 5 a 10 K deben almacenarse como si contuvieran líquido debido al gran incremento de presión que se produce al calentar el gas a temperatura ambiente.
Efectos biológicos
La velocidad del sonido en el helio es casi tres veces la velocidad del sonido en el aire. Debido a la frecuencia fundamental de una cavidad llena de gas es proporcional a la velocidad del sonido en el gas, cuando es inhalado helio se produce un aumento correspondiente en las alturas de las frecuencias de resonancia de las cuerdas vocales.[93] (El efecto contrario, la reducción de frecuencias, se puede obtener por la inhalación de un gas denso como el hexafluoruro de azufre).
La inhalación de helio puede ser peligroso si se hace en exceso, ya que el helio es un gas asfixiante y desplaza al oxígeno necesario para la respiración normal.[94] La respiración de helio puro continua, causa la muerte por asfixia en pocos minutos. La inhalación de helio directamente de cilindros a presión es extremadamente peligrosa, ya que la alta velocidad de flujo puede resultar en la ruptura de los tejidos pulmonares.[94][95] Sin embargo, la muerte causada por el helio es muy rara, con sólo dos muertos registrados entre 2000 y 2004 en los Estados Unidos.[95]
A altas presiones (más de 20 atm o dos MPa), una mezcla de helio y oxígeno (heliox) puede conducir al síndrome de alta presión nerviosa, una especie de revertir el efecto anestésico, añadiendo una pequeña cantidad de nitrógeno a la mezcla puede aliviar el problema.
Véase también
- Efecto Leidenfrost
- Gas noble
- Origen inorgánico del petróleo
- Superfluidez
- Tabla periódica de los elementos
- Viscosidad
Referencias
- ↑ Helium: Up, Up and Away?Melinda Rose, Contributing Editor, Photonics Spectra, Oct. 2008. Accessed Feb 27, 2010 Entertaining and more up to day article on the helium industry. For a more authoritative but older 1996 pie chart showing US helium use by sector, showing much the same result, see the U.S. Geological Survey chart reproduced in the section on applications below.
- ↑ Watkins, Thayer. «Magnetic susceptibility of the elements and inorganic compounds». San Jose State University.
- ↑ Halliday, David; Resnick, Robert; Krane, Kenneth. Física 2 (tercera edición). Compañía Editorial Mexicana. p. 610. ISBN 968-26-1255-1.
- ↑ Rapp, Donald (1971). Quantum Mechanics (en inglés). Estados Unidos de América: Holt, Rinehart and Winston, Inc. pp. 336-342. ISBN 03-081294-1
|isbn=incorrecto (ayuda). - ↑ a b c d e f g h i j k l m n ñ o p q Clifford A. Hampel (1968). The Encyclopedia of the Chemical Elements. New York: Van Nostrand Reinhold. pp. 256-268. ISBN 0442155980.
- ↑ Weiss, Ray F. (1971). «Solubility of helium and neon in water and seawater». J. Chem. Eng. Data 16 (2): 235-241. doi:10.1021/je60049a019.
- ↑ Stone, Jack A.; Stejskal, Alois (2004). «Using helium as a standard of refractive». Metrologia 41: 189-197. doi:10.1088/0026-1394/41/3/012.
- ↑ Buhler, F.; Axford, W. I.; Chivers, H. J. A.; Martin, K. (1976). «Helium isotopes in an aurora». J. Geophys. Res. 81 (1): 111-115. doi:10.1029/JA081i001p00111.
- ↑ «Solid Helium». Department of Physics University of Alberta. 05-10-2005. Consultado el 20 de julio de 2008.
- ↑ Malinowska-Adamska, C.; Soma, P.; Tomaszewski, J. (2003). «Dynamic and thermodynamic properties of solid helium in the reduced all-neighbours approximation of the self-consistent phonon theory». Physica status solidi (b) 240 (1): 55-67. doi:10.1002/pssb.200301871.
- ↑ Malinowska-Adamska, C.; Soma, P.; Tomaszewski, J. (2003). «Dynamic and thermodynamic properties of solid helium in the reduced all-neighbours approximation of the self-consistent phonon theory». Physica status solidi (b) 240 (1): 55-67. doi:10.1002/pssb.200301871.
- ↑ Henshaw, D. B. (1958). «Structure of Solid Helium by Neutron Diffraction». Physical Review Letters 109 (2): 328-330. doi:10.1103/PhysRev.109.328.
- ↑ Hohenberg, P. C.; Martin, P. C. (2000). «Microscopic Theory of Superfluid Helium». Annals of Physics 281 (1–2): 636-705 12091211. doi:10.1006/aphy.2000.6019.
- ↑ Warner, Brent. «Introduction to Liquid Helium». NASA. Archivado desde el original el 1 de septiembre de 2005. Consultado el 05-01-2007.
- ↑ Fairbank, H. A.; Lane, C. T. (1949). «Rollin Film Rates in Liquid Helium». Physical Review 76 (8): 1209-1211. doi:10.1103/PhysRev.76.1209.
- ↑ Rollin, B. V.; Simon, F. (1939). «On the "film" phenomenon of liquid helium II». Physica 6 (2): 219-230. doi:10.1016/S0031-8914(39)80013-1.
- ↑ Ellis, Fred M. (2005). «Third sound». Wesleyan Quantum Fluids Laboratory. Consultado el 23 de julio de 2008.
- ↑ Bergman, D. (1949). «Hydrodynamics and Third Sound in Thin He II Films». Physical Review 188 (1): 370-384. doi:10.1103/PhysRev.188.370.
- ↑ Lide, D. R., ed. (2005), CRC Handbook of Chemistry and Physics (86th ed.), Boca Raton (FL): CRC Press, ISBN 0-8493-0486-5
- ↑ Hiby, Julius W. (1939). «Massenspektrographische Untersuchungen an Wasserstoff- und Heliumkanalstrahlen (H3+, H2-, HeH+, HeD+, He-)». Annalen der Physik 426 (5): 473-487. doi:10.1002/andp.19394260506.
- ↑ Ming Wah Wong (2000). «Prediction of a Metastable Helium Compound: HHeF». Journal of the American Chemical Society 122 (26): 6289-6290. doi:10.1021/ja9938175.
- ↑ Grochala, W. (2009). «On Chemical Bonding Between Helium and Oxygen». Polish Journal of Chemistry 83: 87-122.
- ↑ «Collapse of helium’s chemical nobility predicted by Polish chemist». Consultado el 15 de mayo de 2009.
- ↑ a b c Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. pp. 175-179. ISBN 0-19-850341-5.
- ↑ a b Weiss, Achim. «Elements of the past: Big Bang Nucleosynthesis and observation». Max Planck Institute for Gravitational Physics. Consultado el 23 de junio de 2008.; Coc, A. et al. (2004). «Updated Big Bang Nucleosynthesis confronted to WMAP observations and to the Abundance of Light Elements». Astrophysical Journal 600: 544. doi:10.1086/380121.
- ↑ a b Anderson, Don L.; Foulger, G. R.; Meibom, A. (02-09-2006). «Helium Fundamentals». MantlePlumes.org. Consultado el 20 de julio de 2008.
- ↑ Novick, Aaron (1947). «Half-Life of Tritium». Physical Review 72: 972-972. doi:10.1103/PhysRev.72.972.2.
- ↑ Zastenker G. N. et al. (2002). «Isotopic Composition and Abundance of Interstellar Neutral Helium Based on Direct Measurements». Astrophysics 45 (2): 131-142. doi:10.1023/A:1016057812964. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda) - ↑ «Lunar Mining of Helium-3». Fusion Technology Institute of the University of Wisconsin-Madison. 19 de octubre de 2007. Consultado el 9 de julio de 2008.
- ↑ Slyuta, E. N.; Abdrakhimov, A. M.; Galimov, E. M. (2007). «The estimation of helium-3 probable reserves in lunar regolith» (PDF). Lunar and Planetary Science XXXVIII. Consultado el 20 de julio de 2008.
- ↑ Hedman, Eric R. (16 de enero de 2006). «A fascinating hour with Gerald Kulcinski». The Space Review. Consultado el 20 de julio de 2008.
- ↑ Oliver, B. M.; Bradley, James G. (1984). «Helium concentration in the Earth's lower atmosphere». Geochimica et Cosmochimica Acta 48 (9): 1759-1767. doi:10.1016/0016-7037(84)90030-9.
- ↑ «The Atmosphere: Introduction». JetStream - Online School for Weather. National Weather Service. 29 de agosto de 2007. Consultado el 12-07-2008.
- ↑ Lie-Svendsen, Ø.; Rees, M. H. (1996). «Helium escape from the terrestrial atmosphere: The ion outflow mechanism». Journal of Geophysical Research 101 (A2): 2435-2444. doi:10.1029/95JA02208. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda) - ↑ Strobel, Nick (2007). «Atmospheres». Nick Strobel's Astronomy Notes. Consultado el 25 de septiembre de 2007.
- ↑ Cook, Melvine A. (1957). «Where is the Earth's Radiogenic Helium?». Nature 179: 213. doi:10.1038/179213a0.
- ↑ Aldrich, L. T.; Nier, Alfred O. (1948). «The Occurrence of He3 in Natural Sources of Helium». Phys. Rev. 74: 1590-1594. doi:10.1103/PhysRev.74.1590. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda) - ↑ Morrison, P.; Pine, J. (1955). «Radiogenic Origin of the Helium Isotopes in Rock». Annals of the New York Academy of Sciences 62 (3): 71-92. doi:10.1111/j.1749-6632.1955.tb35366.x.
- ↑ Zartman, R. E.; Wasserburg, G. J.; Reynolds, J. H. (1961). «Helium Argon and Carbon in Natural Gases». Journal of Geophysical Research 66 (1): 277-306. doi:10.1029/JZ066i001p00277. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda) - ↑ Broadhead, Ronald F. (2005). «Helium in New Mexico – geology distribution resource demand and exploration possibilities» (PDF). New Mexico Geology 27 (4): 93-101. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda) - ↑ Winter, Mark (2008). «Helium: the essentials». University of Sheffield. Consultado el 14 de julio de 2008.
- ↑ a b Smith, E.M.; Goodwin, T.W.; Schillinger, J. (2003). «Challenges to the Worldwide Supply of Helium in the Next Decade» (PDF). Advances in Cryogenic Engineering. 49 A (710): 119-138. doi:10.1063/1.1774674. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda) - ↑ Cai, Z. et al. (2007). Modelling Helium Markets (PDF). University of Cambridge. Consultado el 14 de julio de 2008.
- ↑ «Helium». Mineral Commodity Summaries. U.S. Geological Survey. 2009. pp. 74-75. Consultado el 19 de diciembre de 2009.
- ↑ Belyakov, V.P.; Durgar'yan, S. G.; Mirzoyan, B. A. (1981). «Membrane technology—A new trend in industrial gas separation». Chemical and Petroleum Engineering 17 (1): 19-21. doi:10.1007/BF01245721.
- ↑ The Impact of Selling the Federal Helium Reserve Committee on the Impact of Selling the Federal Helium Reserve, Commission on Physical Sciences, Mathematics, and Applications, Commission on Engineering and Technical Systems, National Research Council. Publisher: The National Academies Press. Date: 2000. PAPERBACK ISBN-10: 0-309-07038-4;ISBN-13: 978-0-309-07038-6. Accessed March 2, 2010. For web PDF see [http://www.nap.edu/openbook.php?record_id=9860&page=44R See table 4.2 for the reserve estimate and page 47 for the unproven reserve estimate
- ↑ Dee, P. I.; Walton E. T. S. (1933). «A Photographic Investigation of the Transmutation of Lithium and Boron by Protons and of Lithium by Ions of the Heavy Isotope of Hydrogen». Proceedings of the Royal Society of London 141 (845): 733-742. doi:10.1098/rspa.1933.0151.
- ↑ «Helium Supplies Endangered, Threatening Science And Technology?». Science Daily. 2008. Consultado el 26 de agosto de 2009.
- ↑ Jenkins, Emily (2000). «A Helium Shortage?». Wired. Consultado el 26 de agosto de 2009.
- ↑ Helium sell-off risks future supply. Michael Banks. Physics World. Jan. 27, 2010. accessed Feb. 27., 2010.
- ↑ Pie chart showing estimated fractional categories of U.S. helium use, originally drawn in a U.S. Department of the Interior, U.S. Geological Survey. 1996. in: Mineral Industry Surveys: Helium. Reston, Va.: USGS. Taken from The Impact of Selling the Federal Helium Reserve. PAPERBACK ISBN-10: 0-309-07038-4;ISBN-13: 978-0-309-07038-6. Chapter 3, Figure 3.1, in [http://www.nap.edu/openbook.php?record_id=9860&page=27. This site. Accessed Feb. 27, 2010.
- ↑ «Physics in speech». phys.unsw.edu.au. Consultado el 20 de julio de 2008.
- ↑ Fowler, B; Ackles KN, Porlier G (1985). «Effects of inert gas narcosis on behavior—a critical review». Undersea Biomedical Research Journal 12 (4): 369-402. PMID 4082343. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda); - ↑ Thomas, J. R. (1976). «Reversal of nitrogen narcosis in rats by helium pressure». Undersea Biomed Res. 3 (3): 249-59. PMID 969027. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda) - ↑ Rostain, J. C.; Gardette-Chauffour, M. C.; Lemaire, C.; Naquet, R. (1988). «Effects of a H2-He-O2 mixture on the HPNS up to 450 msw». Undersea Biomed. Res. 15 (4): 257-70. OCLC 2068005. PMID 3212843. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda) - ↑ a b Considine, Glenn D., ed. (2005). «Helium». Van Nostrand's Encyclopedia of Chemistry. Wiley-Interscience. pp. 764-765. ISBN 0-471-61525-0.
- ↑ Hablanian, M. H. (1997). High-vacuum technology: a practical guide. CRC Press. p. 493. ISBN 0824798341.
- ↑ Beckwith, I.E.; Miller, C. G. (1990). «Aerothermodynamics and Transition in High-Speed Wind Tunnels at Nasa Langley». Annual Review of Fluid Mechanics 22: 419-439. doi:10.1146/annurev.fl.22.010190.002223.
- ↑ Morris, C.I. (2001). Shock Induced Combustion in High Speed Wedge Flows (PDF). Stanford University Thesis.
- ↑ Belcher, James R. et al (1999). «Working gases in thermoacoustic engines». The Journal of the Acoustical Society of America 105 (5): 2677-2684. PMID 10335618. doi:10.1121/1.426884.
- ↑ Makhijani, Arjun; Gurney, Kevin (1995). Mending the Ozone Hole: Science, Technology, and Policy. MIT Press. ISBN 0262133083.
- ↑ Jakobsson, H. (1997). «Simulations of the dynamics of the Large Earth-based Solar Telescope». Astronomical & Astrophysical Transactions 13 (1): 35-46. doi:10.1080/10556799708208113.
- ↑ Engvold, O.; Dunn, R.B.; Smartt, R. N.; Livingston, W. C. (1983). «Tests of vacuum VS helium in a solar telescope». Applied Optics 22: 10-12. doi:10.1364/AO.22.000010. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda) - ↑ LHC Guide booklet «CERN - LHC: Facts and Figures». CERN. Consultado el 30 de abril de 2008.
- ↑ Jack W. Ekin (2006). Experimental Techniques for Low-Temperature measurements. Oxford University Press. ISBN 0198570546.
- ↑ Kochhar, R. K. «French astronomers in India during the 17th - 19th centuries» (en inglés). Consultado el 8 de marzo de 2010.
- ↑ Sir Norman Lockyer - descubrimiento del helio (en inglés)".
- ↑ «Helium». Oxford English Dictionary. 2008. Consultado el 20 de julio de 2008.
- ↑ Thomson, W. (1872). Frankland and Lockyer find the yellow prominences to give a very decided bright line not far from D, but hitherto not identified with any terrestrial flame. It seems to indicate a new substance, which they propose to call Helium. Rep. Brit. Assoc. xcix.
- ↑ Stewart, Alfred Walter (2008). Recent Advances in Physical and Inorganic Chemistry. BiblioBazaar, LLC. p. 201. ISBN 0554805138.
- ↑ Ramsay, William (1895). «On a Gas Showing the Spectrum of Helium, the Reputed Cause of D3 , One of the Lines in the Coronal Spectrum. Preliminary Note». Proceedings of the Royal Society of London 58: 65-67. doi:10.1098/rspl.1895.0006.
- ↑ Ramsay, William (1895). «Helium, a Gaseous Constituent of Certain Minerals. Part I». Proceedings of the Royal Society of London 58: 80-89. doi:10.1098/rspl.1895.0010.
- ↑ Ramsay, William (1895). «Helium, a Gaseous Constituent of Certain Minerals. Part II--». Proceedings of the Royal Society of London 59: 325-330. doi:10.1098/rspl.1895.0097.
- ↑ (en alemán) Langlet, N. A. (1895). «Das Atomgewicht des Heliums». Zeitschrift für anorganische Chemie (en german) 10 (1): 289-292. doi:10.1002/zaac.18950100130.
- ↑ Weaver, E.R. (1919). «Bibliography of Helium Literature». Industrial & Engineering Chemistry.
- ↑ van Delft, Dirk (2008). «Little cup of Helium, big Science» (PDF). Physics today: 36-42. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda) - ↑ «Coldest Cold». Time Inc. 10-06-1929. Consultado el 27 de julio de 2008.
- ↑ Kapitza, P. (1938). «Viscosity of Liquid Helium below the λ-Point». Nature 141: 74. doi:10.1038/141074a0.
- ↑ Osheroff, D. D.; Richardson, R. C.; Lee, D. M. (1972). «Evidence for a New Phase of Solid He3». Phys. Rev. Lett. 28 (14): 885-888. doi:10.1103/PhysRevLett.28.885.
- ↑ McFarland, D. F. (1903). «Composition of Gas from a Well at Dexter, Kan». Transactions of the Kansas Academy of Science 19: 60-62. doi:10.2307/3624173. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda) - ↑ «The Discovery of Helium in Natural Gas». American Chemical Society. 2004. Consultado el 20 de julio de 2008.
- ↑ Cady, H.P.; McFarland, D. F. (1906). «Helium in Natural Gas». Science 24 (611): 344. PMID 17772798. doi:10.1126/science.24.611.344.
- ↑ Cady, H.P.; McFarland, D. F. (1906). «Helium in Kansas Natural Gas». Transactions of the Kansas Academy of Science 20: 80-81. doi:10.2307/3624645. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda) - ↑ Emme, Eugene M. comp., ed. (1961). «Aeronautics and Astronautics Chronology, 1920–1924». Aeronautics and Astronautics: An American Chronology of Science and Technology in the Exploration of Space, 1915–1960. Washington, D.C.: NASA. pp. 11-19. Consultado el 20 de julio de 2008.
- ↑ Hilleret, N. (1999). «Leak Detection» (PDF). En S. Turner, ed. CERN Accelerator School, vacuum technology: proceedings: Scanticon Conference Centre, Snekersten, Denmark, 28 May – 3 June 1999. Geneva, Switzerland: CERN. pp. 203-212. «At the origin of the helium leak detection method was the Manhattan Project and the unprecedented leak-tightness requirements needed by the uranium enrichment plants. The required sensitivity needed for the leak checking led to the choice of a mass spectrometer designed by Dr. A.O.C. Nier tuned on the helium mass.»
- ↑ Williamson, John G. (1968). «Energy for Kansas». Transactions of the Kansas Academy of Science (Kansas Academy of Science) 71 (4): 432-438. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda) - ↑ «Conservation Helium Sale» (PDF). Federal Register 70 (193): 58464. 06-10-2005. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda) - ↑ «Executive Summary». nap.edu. Consultado el 20 de julio de 2008.
- ↑ Mullins, P.V.; Goodling, R. M. (1951). Helium. Bureau of Mines / Minerals yearbook 1949. pp. 599-602. Consultado el 20 de julio de 2008.
- ↑ «Helium End User Statistic» (PDF). U.S. Geological Survey. Consultado el 20 de julio de 2008.
|accessdate=y|fechaacceso=redundantes (ayuda) - ↑ Kaplan, Karen H. (June 2007). «Helium shortage hampers research and industry». Physics Today 60 (6) (American Institute of Physics). pp. 31-32. doi:10.1063/1.2754594. Consultado el 20 de julio de 2008.
- ↑ Basu, Sourish (October 2007). «Updates: Into Thin Air». Scientific American 297 (4) (Scientific American, Inc.). p. 18. Consultado el 04-08-2008. Parámetro desconocido
|editor-nombre=ignorado (se sugiere|nombre-editor=) (ayuda); Parámetro desconocido|editor-apellido=ignorado (se sugiere|apellido-editor=) (ayuda) - ↑ Ackerman MJ, Maitland G (1975). «Calculation of the relative speed of sound in a gas mixture». Undersea Biomed Res 2 (4): 305-10. PMID 1226588. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda) - ↑ a b Grassberger, Martin; Krauskopf, Astrid (2007). «Suicidal asphyxiation with helium: Report of three cases Suizid mit Helium Gas: Bericht über drei Fälle». Wiener Klinische Wochenschrift (en german & English) 119 (9–10): 323-325. PMID 17571238. doi:10.1007/s00508-007-0785-4.
- ↑ a b Engber, Daniel (13 de junio de 2006). «Stay Out of That Balloon!». Slate.com. Consultado el 14 de julio de 2008.
Referencias externas
- WebElements.com (inglés)
- EnvironmentalChemistry.com (inglés)
- Es Elemental (inglés)
- Elementos Químicos: Helio (español)
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del helio. (español)
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Helio.
Wikimedia Commons alberga una galería multimedia sobre Helio.



