Síndrome de Down
| Síndrome de Down | ||
|---|---|---|
 Rasgos faciales del síndrome de Down. | ||
| Especialidad |
genética médica neurología | |
| Síntomas | Retraso en el crecimiento físico, rasgos faciales característicos, discapacidad intelectual leve a moderada. | |
| Diagnóstico | Detección prenatal, pruebas genéticas | |
| Sinónimos | ||
| ||
El síndrome de Down es un trastorno genético causado por la trisomía del cromosoma 21 o de una parte de él. Se caracteriza por un grado variable de discapacidad intelectual y unos rasgos físicos que le dan un aspecto reconocible. Debe su nombre a John Langdon Down, que fue el primero en describir esta alteración genética en 1866, aunque nunca llegó a descubrir las causas que la producían. En julio de 1958, un joven investigador llamado Jérôme Lejeune descubrió que el síndrome es una alteración en el mencionado par de cromosomas.
No se conocen con exactitud las causas que provocan el exceso cromosómico. Sin embargo, los factores de riesgo son que los padres hayan concebido un hijo con síndrome de Down, que cualquiera de los padres sea portador de la translocación genética para el síndrome de Down y la edad avanzada de la madre. Aunque haya riesgo en cualquier edad, la probabilidad de concebir un hijo con síndrome de Down aumenta gradualmente después de los 35 años, debido a que el accidente genético de la división cromosómica anormal es más común en los óvulos más antiguos, aún así, la mayoría de los niños con síndrome de Down tienen madres jóvenes, simplemente porque las mujeres menores de 35 tienen muchos más hijos que las mayores.[1] Las personas con síndrome de Down tienen probabilidad superior a la de población de padecer algunas enfermedades especialmente de corazón, aparato digestivo y sistema endocrino debido al exceso de proteínas sintetizadas por el cromosoma de más. Los avances actuales en el descifrado del genoma humano están revelando algunos de los procesos bioquímicos subyacentes a la discapacidad intelectual, pero en la actualidad no existe ningún tratamiento farmacológico que haya demostrado que mejora las capacidades intelectuales de estas personas.[2][3][4][5][6]
Historia
[editar]
El dato arqueológico más antiguo del que se tiene noticia sobre el síndrome de Down es el hallazgo de un cráneo en un Pueblo sajón del siglo VII, en el que se describieron anomalías estructurales compatibles con un varón con dicho síndrome.[7]
La pintura al temple sobre madera La Virgen y el Niño de Andrea Mantegna (1430 - 1506) parece representar un niño con rasgos que evocan de la trisomía,[8] así como el cuadro del Sir Joshua Reynolds (1773), Retrato de Lady Cockburn con sus tres hijos, en el que aparece uno de los hijos con rasgos faciales típicos del SD.[9]
El primer informe documentado de un niño con SD se atribuye a Jean Étienne Dominique Esquirol en 1838[10] y en sus inicios se denominaba «cretinismo»[11] o «idiocia furfurácea». P. Martin Duncan en 1886 describe textualmente a «una niña de cabeza pequeña, redondeada, con ojos achinados, que dejaba colgar la lengua y apenas pronunciaba unas pocas palabras».[12]
En ese año, el médico inglés John Langdon Down trabajaba como director del Asilo para Retrasados Mentales de Earlswood en Surrey realizando un exhaustivo estudio a muchos de sus pacientes. Con esos datos publicó en el London Hospital Reports un artículo titulado: «Observaciones en un grupo étnico de retrasados mentales»,[13] donde describía pormenorizadamente las características físicas de un grupo de pacientes que presentaban muchas similitudes, su capacidad de imitación y su sentido del humor.
Las primeras descripciones del síndrome achacaban su origen a diversas enfermedades de los progenitores y establecían su patogenia con base en una involución o retroceso a un estado de filogenia más «primitivo».

Alguna teoría más curiosa indicaba la potencialidad de la tuberculosis para «romper la barrera de especie» de modo que padres occidentales podían tener hijos «orientales» (o «mongólicos» en expresión del Doctor Down por las similitudes faciales de estos individuos con los grupos nómadas del centro de Mongolia). Tras varias comunicaciones científicas, finalmente en 1909 G. E. Shuttleworth mencionó por primera vez la edad materna avanzada como un factor de riesgo para la aparición del síndrome.[14] De camino a la denominación el síndrome fue rebautizado como «idiocia Kalmukia» o «niños inconclusos».
En cuanto a su etiología, en el año 1932 el oftalmólogo neerlandés Petrus Johannes Waardenburg hace referencia por vez primera a un reparto anormal de material cromosómico como posible causa del SD.[15] En 1956 Tjio y Levan demuestran 46 cromosomas en el humano y poco después, en el año 1959, Lejeune, Gautrier y Turpin demuestran que las personas con SD portan 47 cromosomas. Lo último lo demostró de manera simultánea la inglesa Pat Jacobs.
En 1961 un grupo de científicos (entre los que se incluía un familiar del Dr. Down) propusieron el cambio de «idiocia mongoloide» a la denominación actual de «síndrome de Down» ya que los términos «mongol» o «mongolismo» podían resultar ofensivos.[16] En 1965 la OMS (Organización Mundial de la Salud) hace efectivo el cambio de nomenclatura tras una petición formal del delegado de Mongolia.[17] Lejeune propuso la alternativa de «trisomía 21», poco tiempo después del descubrimiento de en qué par de cromosomas se encontraba el exceso de material genético.
Epidemiología
[editar]El Estudio Colaborativo Español de Malformaciones Congénitas (ECEMC) informaba en el año 2004 una prevalencia neonatal de 7,11 cada 10 000 recién nacidos con tendencia a disminuir de manera estadísticamente significativa.[18]
Según la Sociedad Nacional de Síndrome de Down (National Down Syndrome Society, NDSS). Actualmente hay más de 400 000 personas con Síndrome de Down en Estados Unidos.[19]
Parece existir una relación estadística (sin que se conozcan los mecanismos) entre algunas enfermedades maternas como Hepatitis, Mycoplasma hominis tipo 1, Herpes simple tipo II y Diabetes[20] y un aumento en la incidencia de aparición de SD; No obstante esa relación estadística no es tan intensa como en el caso de la edad materna. Algún autor[21] también ha relacionado la baja frecuencia coital así como el uso de anovulatorios y espermicidas con la aparición del síndrome.
La probabilidad de tener un hijo con SD es mayor a la media para aquellos padres que han tenido otro previamente. Típicamente la probabilidad de tener otro hijo con SD en cada embarazo subsiguiente es de una por cada cien recién nacidos vivos. Esto hay que ponderarlo para cada caso con el riesgo propio de la madre según su edad. Los antecedentes familiares igualmente incrementan ese riesgo.
Los varones con síndrome de Down se consideran estériles[22] pero las mujeres conservan con frecuencia su capacidad reproductiva. En su caso también se incrementa la probabilidad de engendrar hijos con SD hasta 50% aunque pueden tener hijos sin trisomía.
Etiología
[editar]Cada célula del ser humano posee en su núcleo 23 pares de cromosomas. Cada progenitor aporta a su descendencia la mitad de la información genética, en forma de un cromosoma de cada par. 22 de esos pares se denominan autosomas y el último corresponde a los cromosomas sexuales (X o Y).
Tradicionalmente los pares de cromosomas se describen y nombran en función de su tamaño, del par 1 al 22 (de mayor a menor), más el par de cromosomas sexuales antes mencionado. El cromosoma 21 es el más pequeño, en realidad, por lo que debería ocupar el lugar 22, pero un error en la convención de Denver del año 1960, que asignó el síndrome de Down al par 21 ha perdurado hasta nuestros días, y por razones prácticas se mantiene esta nomenclatura.[23]
El cromosoma 21 contiene aproximadamente el 1% de la información genética de un individuo en algo más de 400 genes, aunque hoy en día solo se conoce con precisión la función de unos pocos.
Trisomía libre
[editar]Código CIE-10: Q90.0
El síndrome de Down se produce por la aparición de un cromosoma más en el par 21 original (tres cromosomas: «trisomía» del par 21) en las células del organismo. La nomenclatura científica para ese exceso cromosómico es 47, XX,+21 o 47, XY,+21; según se trate de una mujer o de un varón, respectivamente. La mayor parte de las personas con este síndrome (95%) deben el exceso cromosómico a un error durante la segunda división meiótica (aquella por la que los gametos, óvulos o espermatozoides, pierden la mitad de sus cromosomas). Esta variante se llama «trisomía libre» o regular, y el error se debe en este caso a una disyunción incompleta del material genético de uno de los progenitores. (En la formación habitual de los gametos el par de cromosomas se separa, de modo que cada progenitor solo transmite la información de uno de los cromosomas de cada par. Cuando no se produce la disyunción se transmiten ambos cromosomas).
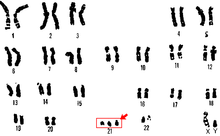
No se conocen con exactitud las causas que originan la disyunción errónea. Como en otros procesos similares se han propuesto hipótesis multifactoriales (exposición ambiental, envejecimiento celular…) sin que se haya conseguido establecer relación directa entre algún agente causante y la aparición de la trisomía. El único factor que presenta una asociación estadística estable con el síndrome es la edad materna, lo que parece apoyar las teorías que hacen hincapié en el deterioro del material genético con el paso del tiempo.
En aproximadamente un 15% de los casos el cromosoma extra es transmitido por el espermatozoide y en el 85 % restante por el óvulo.[24]
Translocación
[editar]
Código CIE-10: Q90.2
Después de la trisomía libre, la causa más frecuente de aparición del exceso de material genético es la translocación. En esta variante el cromosoma 21 extra (o un fragmento de él) se encuentra «pegado» a otro cromosoma (frecuentemente a uno de los dos cromosomas del par 14), por lo cual el recuento genético arroja una cifra de 46 cromosomas en cada célula. En este caso no existe un problema con la disyunción cromosómica, pero uno de ellos porta un fragmento «extra» con los genes del cromosoma «translocado». A efectos de información genética sigue tratándose de una trisomía 21 ya que se duplica la dotación genética de ese cromosoma.
La frecuencia de esta variante es aproximadamente de un 3 %[25] de todos los SD y su importancia estriba en la necesidad de hacer un estudio genético a los progenitores para comprobar si uno de ellos era portador sin saberlo de la translocación, o si esta se produjo por primera vez en el embrión. (Existen portadores «sanos» de translocaciones en los que se recuentan 45 cromosomas, uno de los cuales está translocado, o pegado, a otro).
Mosaicismo
[editar]Código CIE-10: Q90.1
La forma menos frecuente de trisomía 21 es la denominada «mosaico» (en torno al 2 %[26] de los casos). Esta mutación se produce tras la concepción, por lo que la trisomía no está presente en todas las células del individuo con SD, sino solo en aquellas que proceden de la primera célula mutada. El porcentaje de células afectadas puede abarcar desde unas pocas a casi todas, según el momento en que se haya producido la segregación anómala de los cromosomas homólogos.
Expresión del exceso de material genético
[editar]La expresión bioquímica del síndrome consiste en el aumento de diferentes enzimas. Una de las más conocidas e importantes es la superóxido dismutasa (codificada por el gen SOD-1), que cataliza el paso del anión superóxido hacia peróxido de hidrógeno. En condiciones normales esto contribuye al sistema de defensa antioxidante del organismo, pero su exceso determina la acumulación de H2O2, lo que puede provocar peroxidación de lípidos y proteínas y dañar el ADN. Otros genes implicados en la aparición de trastornos asociados al SD son:[27]
- COL6A1: su expresión incrementada se relaciona con defectos cardíacos
- ETS2: su expresión incrementada puede ser causa de alteraciones músculo esqueléticas
- CAF1A: la presencia incrementada de este gen puede interferir en la síntesis de ADN
- Cystathione Beta Synthase (CBS): su exceso puede causar alteraciones metabólicas y de los procesos de reparación del ADN
- DYRK: en el exceso de proteínas codificadas por este gen parece estar el origen de la discapacidad cognitiva
- CRYA1: su sobreexpresión puede originar cataratas (opacidad precoz del cristalino)
- GART: la expresión aumentada de este gen puede alterar los procesos de síntesis y reparación del ADN
- IFNAR : es un gen relacionado con la síntesis de interferón, por lo que su exceso puede provocar alteraciones en el sistema inmunitario.
Se encuentran también en el cromosoma 21 varios micro ARNs, cuya sobreexpresión se ha relacionado con la desregulación de ciertos genes diana localizados fuera del cromosoma 21.[28][29] Uno de los microARNs sobreexpresados es miR–155, que se ha visto implicado en la regulación de genes implicados en la afectación cardíaca como TFAM,[30] en defectos cognitivos como MeCP2, que también se encuentra alterado por otros mecanismos en el síndrome de Rett.[31]
Expresión génica diferencial expresada en dominios
[editar]En el año 2014 se publicó un estudio novedoso realizado a partir de los fibroblastos de gemelos monocigóticos discordantes para síndrome de Down. Uno de los gemelos padecía el síndrome y el otro no. Este hecho permitió estudiar la variabilidad genómica debida al síndrome de Down eliminando la variación genética entre muestras.
El estudio del transcriptoma de dichos fibroblastos mostró diferencias en la expresión de 182 genes. Además se observó una menor expresión de proteínas implicadas en rutas de señalización y respuesta inflamatoria. Uno de los hechos más destacados es que se encontraron dominios cromosómicos bien definidos con distintos perfiles de expresión, alternando regiones de expresión aumentada con otras regiones de expresión disminuida. Tras estas observaciones se concluyó que la expresión génica diferencial en síndrome de Down no se organiza aleatoriamente, sino que sigue un patrón específico a lo largo de los cromosomas. Estos dominios de expresión génica desregulada se conocen como GEDDs (Gene expression dysregulation domains). En paralelo se realizó el estudio del transcriptoma de fibroblastos de gemelos monocigóticos sanos y no se observaron estos dominios GEDDs. La organización en dominios en los gemelos discordantes podría ser atribuida fundamentalmente a la copia extra del cromosoma 21. Además, la expresión génica en el contexto de célula trisómica podría estar menos afinada y ser menos dinámica.
Anteriormente a estos descubrimientos se había descrito ya la organización en dominios de los cromosomas de mamíferos con la identificación de los LADs (Lamina associated domains), cuya característica fundamental era la inhibición generalizada de la expresión génica. Estas regiones presentan una baja densidad de genes y una expresión génica disminuida entre otras características. Los genes en LADs están sobreexpresados en el gemelo con síndrome de Down, al contrario de los genes localizados fuera de los LADs. De la comparación entre estos dominios lámina-asociados y los GEDDs se obtuvieron dos conclusiones fundamentales: que la interacción genoma-lámina nuclear podría estar modificada en núcleos trisómicos (derepresión en células trisómicas) y que la topología de los dominios LAD no se perturba por la presencia de un cromosoma extra.
En cuanto al entorno cromatínico en estos dominios de expresión génica desregulada, no se observan cambios en la topología del genoma de los fibroblastos con síndrome de Down, lo que sugiere la existencia de posibles modificaciones epigenéticas en los dominios cromosómicos de células trisómicas. La comparación de los cambios de metilación de ADN entre el gemelo sano y el gemelo con síndrome de Down, y la posterior comparación con los GEDDs muestra que la alteración de la expresión génica no puede ser explicada completamente por los cambios en la metilación. Algunos estudios anteriores han descrito que el ciclo celular es más largo en el núcleo trisómico sin afectar al tiempo de replicación. Esto resultaría en un mayor tiempo de cromatina abierta y por tanto un aumento en la transcripción. Por último, cambios en la actividad transcripcional podrían estar influenciados por cambios en las marcas de la cromatina como H3K4me3. Los GEDDs coinciden con modificaciones de histonas metiladas en fibroblastos trisómicos.
Como conclusión, se podría decir que la presencia de un pequeño fragmento de ADN extra en el genoma (1%) puede alterar el transcriptoma entero. Esto es interesante porque la perturbación de la regulación génica puede ser común a otras anomalías cromosómicas. Los mecanismos que están detrás de esta organización en dominios GEDD pueden explicarse de dos formas. La primera es que la sobreexpresión de uno o más genes del HSA21 modifica el entorno cromatínico del compartimento nuclear en células trisómicas, lo que alteraría el transcriptoma y daría lugar a los distintos fenotipos. La segunda explicación sería que los GEDD aparecen como resultado del material cromosómico extra en la trisomía del 21.
Cuadro clínico
[editar]El SD es la causa más frecuente de discapacidad cognitiva psíquica congénita. Representa el 25 % de todos los casos de discapacidad cognitiva. Se trata de un síndrome genético más que de una enfermedad aunque tiene síntomas de ser una enfermedad y se asocia con frecuencia a algunas. La expresión genotípica final es muy variada de unas personas a otras. Como rasgos comunes se pueden reseñar su fisionomía peculiar, una hipotonía muscular generalizada, un grado variable de discapacidad cognitiva y retardo en el crecimiento.
En cuanto al fenotipo, se han descrito más de 100 rasgos peculiares asociados al SD, que pueden presentarse en un individuo en un número muy variable. De hecho ninguno se considera constante o patognomónico, aunque la evaluación conjunta de los que aparecen suele ser suficiente para el diagnóstico. La gravedad y variabilidad de los distintos fenotipos en la población dependen en gran medida del fondo genético y epigenético del individuo.
Algunos de los rasgos más importantes son un perfil facial y occipital planos, braquiocefalia (predominio del diámetro transversal de la cabeza), hendiduras palpebrales oblicuas, diástasis de rectos (laxitud de la musculatura abdominal), raíz nasal deprimida, pliegues epicánticos (pliegue de piel en el canto interno de los ojos), cuello corto y ancho con exceso de pliegue epidérmico nucal, microdoncia, paladar ojival, clinodactilia del quinto dedo de las manos (crecimiento recurvado hacia el dedo anular), pliegue palmar único, y separación entre el primero y segundo dedo del pie. Las enfermedades que se asocian con más frecuencia son las cardiopatías congénitas y enfermedades del tracto digestivo (celiaquía, atresia/estenosis esofágica o duodenal, colitis ulcerosa...). Los únicos rasgos presentes en todos los casos son la atonía muscular generalizada (falta de un tono muscular adecuado, lo que dificulta el aprendizaje motriz) y la discapacidad cognitiva, aunque en grados muy variables.[32] Presentan, además, un riesgo superior al de la población general para el desarrollo de enfermedades como leucemia (leucemia mieloide aguda), diabetes, hipotiroidismo, miopía, o luxación atloaxoidea (inestabilidad de la articulación entre las dos primeras vértebras, atlas y axis, secundaria a la hipotonía muscular y a la laxitud ligamentosa). Todo esto determina una media de esperanza de vida entre los 50 y los 60 años, aunque este promedio se obtiene de una amplia horquilla interindividual (las malformaciones cardíacas graves o la leucemia, cuando aparecen, pueden ser causa de muerte prematura). El grado de discapacidad intelectual también es muy variable, aunque se admite como hallazgo constante una discapacidad ligera o moderada. No existe relación alguna entre los rasgos externos y el desarrollo intelectual de la persona con SD.
| Características | Porcentaje de aparición[33] | Características | Porcentaje de aparición |
|---|---|---|---|
| Discapacidad cognitiva | 100 % | Microdoncia total o parcial | 60 % |
| Retraso del crecimiento | 100 % | Puente nasal deprimido | 60 % |
| Dermatoglifos atípicos | 90 % | Clinodactilia del 5.º dedo | 52 % |
| Diástasis de músculos abdominales | 80 % | Hernia umbilical | 51 % |
| Hiperlaxitud ligamentosa | 80 % | Cuello corto | 50 % |
| Hipotonía | 80 % | Manos cortas/braquidactilia | 50 % |
| Braquiocefalia/región occipital plana | 75 % | Cardiopatía congénita | 45 % |
| Genitales hipotróficos | 75 % | Pliegue palmar transversal | 45 % |
| Hendidura palpebral | 75 % | Macroglosia | 43 % |
| Extremidades cortas | 70 % | Pliegue epicántico | 42 % |
| Paladar ojival | 69 % | Estrabismo | 40 % |
| Oreja redonda de implantación baja | 60 % | Manchas de Brushfield (iris) | 35 % |
Enfermedades asociadas más frecuentes
[editar]Cardiopatías
[editar]Entre un 40 y un 50% de los recién nacidos con SD presentan una cardiopatía congénita, es decir, una patología del corazón presente en el momento del nacimiento,[34] y esta es la causa principal de mortalidad en niños con SD. Algunas de estas enfermedades solo precisan vigilancia para comprobar que su evolución es adecuada, mientras que otras pueden necesitar tratamiento quirúrgico urgente. Casi la mitad de ellas se corresponden con defectos del septo aurículo-ventricular (ausencia de cierre más o menos completa de la pared que separa aurículas y ventrículos). Una tercera parte (en torno al 30 % según las fuentes) son defectos de cierre del septo ventricular (pared que separa los ventrículos entre sí), y con menos frecuencia se encuentran otras enfermedades como ostium secundum,[35] ductus arterioso persistente[36] o tetralogía de Fallot.[37]
En general casi todos estos defectos provocan paso inapropiado de sangre desde las cavidades izquierdas del corazón a las derechas, lo que aumenta la circulación pulmonar. La tetralogía de Fallot, en cambio, provoca un cortocircuito inverso, por lo que disminuye el flujo sanguíneo pulmonar y aparece cianosis (color azulado por la deficiente oxigenación de la sangre), sobre todo en crisis de llanto o esfuerzos. Esta es una patología grave que precisa cirugía, habitualmente en el primer año de vida, para reparar los defectos. Es frecuente que el examen clínico del recién nacido no ofrezca datos de sospecha por lo que pueden quedar sin diagnosticar en la etapa neonatal hasta un 50 % de los recién nacidos con cardiopatía congénita. Por este motivo se recomienda la realización de una ecografía del corazón a todo recién nacido con SD.[38] En la etapa de adolescencia o adulto joven pueden aparecer defectos en las válvulas cardíacas (Con mayor frecuencia, prolapso de la válvula mitral). Los adultos con SD presentan, en cambio, menor riesgo de arterioesclerosis y unas cifras de tensión arterial inferiores a las de la población general, por lo que se consideran un grupo poblacional protegido frente a enfermedad coronaria (angina de pecho, infarto de miocardio…).[39]
 |
 |
Alteraciones gastrointestinales
[editar]La frecuencia de aparición de anomalías o malformaciones digestivas asociadas al SD es muy superior a la esperada en población general: en torno al 10 % de las personas con SD presentan alguno de estos trastornos. La lista de anomalías y su expresión clínica (gravedad con la que se presentan) es muy amplia y variable, pero las que presentan una mayor incidencia son la atresia esofágica, la atresia o estenosis duodenal, las malformaciones anorrectales, el megacolon agangliónico (enfermedad de Hirschsprung) y la celiaquía. La atresia esofágica consiste en la interrupción de la luz del esófago (este se encuentra «obstruido» por un desarrollo incompleto).
El riesgo de aparición en niños con SD es casi 30 veces superior al de la población general, y precisa tratamiento quirúrgico precoz para impedir aspiración de saliva y alimento a la vía aérea y permitir el tránsito adecuado de alimentos hasta el estómago. Un cuadro similar se presenta en la atresia o estenosis duodenal (atresia: obstrucción total, estenosis: obstrucción parcial), pero en este caso en la porción de intestino situada inmediatamente tras el estómago. Puede deberse a una compresión mecánica del páncreas por una anomalía en su desarrollo denominada «páncreas anular». Esta malformación (la atresia duodenal) aparece hasta en el 8 % de los niños recién nacidos con SD.[40]
El ano imperforado es la malformación anorrectal más frecuente en niños con SD: se ha descrito una incidencia del 2-3 %[41] (es decir, dos o tres da cada cien niños recién nacidos con SD lo presentan), mientras que su aparición en la población general se estima en torno a uno de cada 5000. Su diagnóstico es clínico y su tratamiento quirúrgico. Otros trastornos relativamente frecuentes son el megacolon, o dilatación excesiva de la porción distal del tracto digestivo por un defecto en la relajación y la enfermedad celíaca (intolerancia digestiva al gluten), que aparecen también con una frecuencia superior a la que se presenta en recién nacidos sin el síndrome.
Trastornos endocrinos
[editar]Las personas con SD de cualquier edad tienen un riesgo superior al promedio de padecer trastornos tiroideos. Casi la mitad presentan algún tipo de patología de tiroides durante su vida. Suele tratarse de hipotiroidismos leves adquiridos o autoinmunes que en muchos casos no precisan tratamiento, aunque cuando su gravedad lo requiere deben instaurarse lo más precozmente posible para no ver comprometido el potencial de desarrollo intelectual.
Trastornos de la visión
[editar]Más de la mitad (60 %) de las personas con SD presentan durante su vida algún trastorno de la visión susceptible de tratamiento o intervención. El astigmatismo, las cataratas congénitas o la miopía son las enfermedades más frecuentes. Dada la enorme importancia que la esfera visual supone para el aprendizaje de estos niños se recomiendan controles periódicos que corrijan de manera temprana cualquier déficit a este nivel.
Trastornos de la audición
[editar]La particular disposición anatómica de la cara de las personas con SD determina la aparición frecuente de hipoacusias de transmisión (déficits auditivos por una mala transmisión de la onda sonora hasta los receptores cerebrales). Esto es debido a la presencia de enfermedades banales, pero muy frecuentes como impactaciones de cerumen, otitis serosas, colesteatomas o estenosis del conducto auditivo, lo que ocasiona la disminución de la agudeza auditiva hasta en el 80 % de estos individuos.
Trastornos odontoestomatológicos
[editar]Las personas con SD tienen una menor incidencia de caries, pero suelen presentar con frecuencia trastornos morfológicos por malposiciones dentarias, agenesia (ausencia de formación de alguna pieza dentaria), o retraso en la erupción dentaria. Son necesarias revisiones periódicas para una corrección precoz de los trastornos más importantes o que comprometan la función masticatoria o fonatoria.
Inmunodeficiencia y susceptibilidad a las infecciones
[editar]Las personas con SD presentan ciertas anomalías inmunológicas de características e intensidad variables que no son fácilmente asimilables a las inmunodeficiencias catalogadas. Son la causa principal de la mayor susceptibilidad de estas personas a ciertas enfermedades infecciosas. Otros factores inherentes a SD contribuyen a ello: sus frecuentes contactos con otras personas con discapacidad funcional neurológica en centros de educación o atención especial, la intensa afectividad de estas personas y la frecuente coexistencia de otras anomalías, como las cardiopatías, que también comportan un mayor riesgo o vulnerabilidad a las infecciones.[42]
Las infecciones del tracto respiratorio representan actualmente la segunda causa de fallecimiento (tras las cardiopatías congénitas) y la primera causa de hospitalizaciones y complicaciones en niños con SD.[42]
Diagnóstico
[editar]
A partir de 1979 se dispone en los laboratorios de una prueba en sangre que permite establecer una sospecha diagnóstica para varios defectos congénitos (espina bífida y otros defectos del tubo neural). Esta prueba es la determinación de los valores de AFP (alfa-fetoproteína), que se encuentran aumentados en los embriones que presentan estos trastornos del desarrollo. Varios años después se establece una relación estadística entre valores bajos de esta proteína y la aparición de trastornos cromosómicos, en especial del SD. En años posteriores se descubrieron algunas asociaciones similares con otras sustancias en sangre materna. Hoy día es común la determinación de AFP, estriol y hCG (Gonadotropina coriónica humana) para determinar el riesgo de aparición del SD. A esto se le llama «triple prueba». Algunos laboratorios incluyen la determinación de inhibina (cuádruple prueba). Los valores de estas sustancias en sangre, así como datos acerca de la edad materna y los antecedentes personales y familiares permiten calcular un riesgo de aparición de SD, pero no suponen un diagnóstico de certeza. Determinadas mediciones que se realizan durante las ecografías (longitud del fémur, grosor del pliegue nucal, y otras) también aportan información para el cálculo de ese riesgo, pero tampoco permiten establecer el diagnóstico definitivo.
Para detectar la anormalidad cromosómica durante el periodo prenatal de forma inequívoca se emplean técnicas de conteo cromosómico, por lo que es necesario disponer de alguna célula fetal. El acceso al material celular embrionario puede suponer un cierto riesgo, tanto para la madre como para el feto, por lo que su indicación se circunscribe a aquellos embarazos en los que se haya detectado un riesgo de aparición de la trisomía superior al de la población general (triple prueba positiva, edad materna superior a 35 años o paterna superior a 50, antecedentes familiares o personales de SD, o progenitores portadores de una traslocación equilibrada u otras alteraciones cromosómicas).
La técnica más frecuentemente utilizada para la obtención de material genético fetal es la amniocentesis. Esta técnica se empezó a generalizar en la década de 1960, y consiste en la punción ecoguiada de la cavidad amniótica por vía abdominal. Se consigue así una muestra de líquido amniótico, de donde es posible obtener células fetales para su estudio. Debe realizarse preferentemente entre las semanas 14 a 17 del embarazo. Es una técnica relativamente inocua y poco molesta, pero comporta un riesgo del 1-2 % de aborto, lesión fetal, o infección materna.
A mediados de la década de 1980 se comenzó a usar otra técnica, denominada biopsia de vellosidades coriónicas: se obtiene un fragmento de material placentario por vía vaginal o a través del abdomen, normalmente entre las semanas 8 y 11 del embarazo. Esta técnica se puede realizar antes de que exista la suficiente cantidad de líquido amniótico necesaria para que se pueda llevar a cabo la amniocentesis, y el estudio cromosómico es más rápido pues no se necesita el cultivo celular para obtener una muestra suficientemente grande. Presenta un riesgo para la madre y el feto similar al de la amniocentesis.
Desde el año 2012 existe un test de determinación de ADN fetal en sangre materna que permite obtener resultados con una sensibilidad próxima al 100 % (aunque resultados positivos requieren confirmación mediante amniocentesis).[43]
Tratamiento
[editar]La mejoría en los tratamientos de las enfermedades asociadas al SD ha aumentado la esperanza de vida de estas personas, desde los 14 años hace unas décadas, hasta casi la normalidad (60 años, en países desarrollados) en la actualidad. A lo largo de los últimos 150 años se han postulado diferentes tratamientos empíricos (hormona tiroidea, hormona del crecimiento, ácido glutámico, dimetilsulfóxido, complejos vitamínicos y minerales, 5-Hidroxitriptófano o piracetam) sin que ninguno haya demostrado en estudios longitudinales a doble ciego que su administración provoque ningún efecto positivo significativo en el desarrollo motor, social, intelectual o de expresión verbal de las personas con SD. No existe hasta la fecha ningún tratamiento farmacológico eficaz para el SD, aunque los estudios puestos en marcha con la secuenciación del genoma humano permiten augurar una posible vía de actuación (enzimática o genética), eso sí, en un futuro todavía algo lejano.
Los únicos tratamientos que han demostrado una influencia significativa en el desarrollo de los niños con SD son los programas de Atención Temprana, orientados a la estimulación precoz del sistema nervioso central durante los seis primeros años de vida. Especialmente durante los dos primeros años el SNC presenta un grado de plasticidad muy alto lo que resulta útil para potenciar mecanismos de aprendizaje y de comportamiento adaptativo.[44][45] Los individuos con grandes dificultades para el aprendizaje a menudo han sido internados en instituciones, pero se ha comprobado que deben vivir en su domicilio, donde desarrollan de forma más completa todo su potencial. La adaptación curricular permite en muchos casos una integración normalizada en colegios habituales, aunque deben tenerse en cuenta sus necesidades educativas especiales. La edad mental que pueden alcanzar está todavía por descubrir, y depende directamente del ambiente educativo y social en el que se desarrollan. Cuando este es demasiado protector, los chicos y chicas tienden (al igual que ocurriría en una persona sin SD) a dejarse llevar, descubriendo escasamente sus potencialidades. Los contextos estimulantes ayudan a que se generen conductas de superación que impulsan el desarrollo de la inteligencia. Como consecuencia, es imposible determinar los trabajos y desempeños que pueden conseguir durante la vida adulta. Potenciar sus iniciativas y romper con los planteamientos estáticos que históricamente les han perseguido son compromisos sociales ineludibles que las sociedades actuales deben atender.
Recientemente, se ha publicado un ensayo clínico en el que se describe una moderada mejora con un tratamiento que combina la estimulación cognitiva con la administración de un compuesto presente en el té verde, la epigalocatequina galato. Un equipo multidisciplinar dirigido por los doctores Mara Dierssen y Rafael de la Torre ha demostrado que la epigalocatequina galato provoca una mejoría sensible en la capacidad intelectual y la salud física de los afectados. Dicho compuesto afecta al gen DYRK1A, relacionado con la formación del cerebro y sobreactivado por el cromosoma extra del síndrome de Down; este gen produce un exceso de proteínas asociadas a las alteraciones cognitivas que este compuesto devuelve a sus niveles normales.[46]
Atención temprana
[editar]Todos los niños precisan de estímulos para el correcto desarrollo de sus capacidades motrices, cognitivas, emocionales y adaptativas. Los niños con SD no son una excepción, aunque sus procesos de percepción y adquisición de conocimientos son algo diferentes a los del resto de la población: Las capacidades visuales de los niños con SD son, por ejemplo, superiores a las auditivas, y su capacidad comprensiva es superior a la de expresión, por lo que su lenguaje es escaso y aparece con cierto retraso, aunque compensan sus deficiencias verbales con aptitudes más desarrolladas en lenguaje no verbal, como el contacto visual, la sonrisa social o el empleo de señas para hacerse entender. La atonía muscular determina también diferencias en el desarrollo de la habilidad de caminar, o en la motricidad fina. Todos esos aspectos deben ser contemplados en programas específicos de atención temprana (durante los primeros seis años de vida) para estimular al máximo los mecanismos adaptativos y de aprendizaje más apropiados. Intentar enseñar a leer a un niño con SD utilizando métodos convencionales, por ejemplo, puede convertirse en una tarea muy difícil, si no se tiene en cuenta su superior capacidad visual. Hoy día existen métodos gráficos (a partir de tarjetas, o fichas, que asocian imagen y palabra) que están consiguiendo resultados muy superiores al clásico encadenado de letras en estos niños.[47] Además el objetivo de estos programas no es tan solo la adquisición de habilidades, sino que estas se alcancen mucho antes, permitiendo continuar con programas educativos que integren al máximo a la persona con SD en entornos normalizados.[48]
Vacunaciones
[editar]
Un buen número de las infecciones que con frecuencia padecen estos niños son inmunoprevenibles, de modo que las vacunas vienen a ser una herramienta importante en la mejora de los niveles de salud de estas personas. Los expertos recomiendan como vacunaciones sistemáticas de los niños con SD, las siguientes:[42]
- Hepatitis B.
- Difteria, tétanos y tosferina.
- Sarampión, rubéola y parotiditis.
- Poliomielitis.
- Gripe.
- Enfermedad neumocócica.
- Hepatitis A.
- Enfermedad por Haemophilus influenzae tipo b.
- Varicela.
- Rotavirus.
Las pautas de vacunación son variables según la edad y la historia vacunal de cada individuo, y serán determinadas por los médicos pediatras o médicos de familia en cada caso.[42][49]
Pronóstico
[editar]Se desconocen todavía los mecanismos que provocan la discapacidad en las personas con SD, aunque la secuenciación del genoma humano y diversos estudios llevados a cabo en sujetos con translocaciones parciales están empezando a servir para descubrir los genes responsables del cuadro. Estos mapas fenotípicos también se han comparado con algunos casos de monosomía 21 (cuadro de ausencia de uno de los dos cromosomas del par 21, la situación contraria al SD) obteniéndose así mapas de rasgos asociados al exceso o defecto de dosis cromosómica.[50] En las próximas décadas todo este conocimiento sobre el funcionamiento y expresión de los genes permitirá, con seguridad, establecer nuevas estrategias terapéuticas capaces de revertir los trastornos cognitivos asociados al síndrome de Down, y muchos de sus problemas asociados.
En 1981 se diseñó el primer Programa de Salud específico para personas con SD, pero el más ampliamente aceptado y difundido en la comunidad científica es el diseñado por el Down Syndrome Medical Interest group (DSMIG).[51] En estos programas de salud se contemplan las actuaciones preventivas mínimas para un adecuado diagnóstico precoz y seguimiento de las enfermedades o complicaciones que se pueden presentar, mejorando significativamente el pronóstico de estas personas. Por otra parte los programas, cada vez más extendidos, de estimulación precoz, y el cambio progresivo de mentalidad que la sociedad está experimentando con respecto a la discapacidad intelectual son los principales motivos de la gran transformación que se está viviendo en torno a las personas con SD. Hace apenas unas décadas estas personas eran apartadas de la sociedad en instituciones, o escondidas por sus progenitores, basándose en un falso complejo de culpa. A pesar del enorme esfuerzo que aún queda pendiente se ha comprobado cómo un entorno basado en la aceptación, en la adaptación de los métodos de aprendizaje y en la virtud de la diversidad está dotando a las personas con SD de la autonomía suficiente como para trabajar, vivir en pareja o desarrollar habilidades artísticas impensables hace muy poco tiempo.[52]

Legislación
[editar]En México
[editar]En abril de 2020, la Suprema Corte de Justicia de la Nación invalidó la nueva Ley para la Atención Integral de las Personas con Síndrome de Down en la Ciudad de México, pues no se realizó la debida consulta con la comunidad directamente involucrada, es decir, con las personas que tienen el síndrome. El poder legislativo de esa ciudad recibió un plazo de noventa días para cumplir con este requisito y, mientras tanto, seguirá aplicándose el texto de la ley en vigor (la Ley para la Atención Integral de las Personas con Síndrome de Down en la CDMX).[54][55]
En Inglaterra
[editar]La ley británica del aborto permite abortar a los niños con síndrome de Down hasta el día mismo del parto, si bien cualquier otro aborto está prohibido a partir de las 24 semanas de gestación.[56]
Cultura y síndrome de Down
[editar]Cine
[editar]- Charly (1967), dirigida por Cliff Robertson.
- Johnny Stecchino (1991), de Roberto Benigni.
- El octavo día (Le huitième jour), de Jaco van Dormael (1996).
- Todo por ella (Jewel), de Paul Shapiro (2001).
- Tinta roja (película peruana) (Nelson), de Francisco Lombardi (2000).
- Yo soy Sam (2001), dirigida por Jessie Nelson e interpretada por Sean Penn (2001).
- Te quiero, Eugenio, dirigida por Francisco José Fernández (2002).[57]
- El cazador de sueños (Dreamcatcher, basada en la novela homónima de Stephen King), dirigida por Lawrence Kasdan (2003).
- León y Olvido, de Xavier Bermúdez (2004).
- Vida y color, de Santiago Tabernero (2005).
- Las palabras de Vero, de Octavi Masiá (2005).
- Desayuno en Plutón (2005), dirigida por Neil Jordan.
- Diario de un escándalo (2006), dirigida por Richard Eyre.
- Yo, también (2009), dirigida por Álvaro Pastor y Antonio Navarro e interpretada por Lola Dueñas y Pablo Pineda.
- Anita (2009), dirigida por Marcos Carnevale e interpretada por Alejandra Manzo.
- La historia de Jan (2016), dirigida por Bernardo Moll Otto.[58]
- Campeones (2018), dirigida por Javier Fesser.
- The Peanut Butter Falcon (2019), dirigida por Tyler Nilson y Michael Schwartz y protagonizada por Zack Gottsagen, Shia LaBeouf, Dakota Johnson y Bruce Dern.
Literatura
[editar]- La niña que nunca creció (The Child Who Never Grew), de Pearl S. Buck (1950).
- Los bufones de Dios, de Morris West.
- «Los ojos rotos» (relato incluido en Modelos de mujer), de Almudena Grandes (1996).
- María Caracolito, de Pipo Pescador (1997).
- El mensaje de los pájaros, de Joan Manuel Gisbert (2001).
- El cazador de sueños, de Stephen King.
- El meu germà Pol, de Isabel-Clara Simó.
- El río del Edén, de José María Merino.[59]
- A ira dos mansos (La ira de los mansos), de Manuel Esteban.[60]
- Mi hermano persigue dinosaurios, de Giacomo Mazzariol. Edit. Nube de Tinta (marzo de 2017).
Deporte
[editar]- Trisome Games, la I Olimpiada para Personas con Síndrome de Down, celebrada en Florencia en 2016.
- Sara Marín, gimnasta ganadora de cinco medallas de oro.
Televisión
[editar]- Life Goes On: Llamada también La vida sigue su curso o Corky, la vida continúa (1989-1993); trata sobre un chico con síndrome de Down que sufre acoso y discriminación por su condición.
Véase también
[editar]Referencias
[editar]- ↑ «Síndrome de Down - Síntomas y causas - Mayo Clinic». www.mayoclinic.org. Consultado el 24 de octubre de 2021.
- ↑ Flórez, J. «El tratamiento farmacológico del síndrome de Down.» En: Síndrome de Down. IAMER, Madrid 1983, pp. 209-228. Flórez J. Nuevos tratamientos. Revista Síndrome de Down, 1999; 16: 49-51.
- ↑ Leshin L. «Nutritional supplements for Down syndrome; a highly questionable approach.» www.ds-health.com.
- ↑ https://www.ndss.org/about-down-syndrome/down-syndrome/
- ↑ Tiempo, Casa Editorial El (9 de junio de 2017). «Comienza la carrera más especial en Colombia». El Tiempo. Consultado el 21 de noviembre de 2021.
- ↑ Tiempo, Casa Editorial El (19 de mayo de 2005). «ALEJANDRO ESCALLÓN LLOREDA:». El Tiempo. Consultado el 21 de noviembre de 2021.
- ↑ Pueschel SM. «A historical viewpoint: Down Syndrome growing and learning.» Down Syndrome. Human potentials for children series. Kansas City: Pueschel SM editor Canning, Murphy, Zaumer, Andrews and Mc Meel, Inc. 1981: 37-39.
- ↑ La Virgen y el Niño de Andrea Mantegna (1430-1506). Museum of Fine Arts, George Nixon Black, Fund., Boston.
- ↑ Pueschel SM. Síndrome de Down. Hacia un futuro mejor. Fundación Síndrome de Down de Cantabria. España: Masson. 1991: 31-36. No obstante, el hijo representado en dicho cuadro llegó a Almirante de la marina británica (Sir George Cockburn), por lo que varios autores ponen en duda que padeciera el síndrome.
- ↑ Sindoor SD. «Down syndrome. A review of the literature.» Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1997; 84: 5279-5285.
- ↑ El cretinismo es el nombre dado a la discapacidad cognitiva de causa tiroidea (déficit de hormonas tiroideas). La confusión es fruto de la alta prevalencia de casos de hipotiroidismo en los niños con SD.
- ↑ Scheerenberger RC. A history of mental retardation. Baltimore: Paul H. Brookes Publishing Co. 1983: 56-58.
- ↑ http://www.neonatology.org/classics/down.html
- ↑ Shuttelworth: «Mongolian imbecility.» Brit. Med. J., 2:661, 1909
- ↑ Carnevale, A. «Aspectos genéticos del Síndrome de Down.» I Ciclo de conferencias sobre Síndrome de Down. México: Instituto John Langdon Down 1973: 42-43.
- ↑ Allen, Gordon, C. E. Benda, J. A. Böök, C. O. Carter, C. E. Ford, E. H. Y. Chu, E. Hanhart, George Jervis, W. Langdon-Down, J. Lejeune, H. Nishimura, J. Oster, L. S. Penrose, P. E. Polani, Edith L. Potter, Curt Stern, R. Turpin, J. Warkany, y Herman Yannet (1961). "Mongolism (Correspondence)". The Lancet 1 (7180): 775.
- ↑ Howard-Jones, Norman (1979). "On the diagnostic term "Down's disease"". Medical History 23 (1): 102-104.
- ↑ [1]
- ↑ «Down Syndrome Facts | National Down Syndrome Society». NDSS. Consultado el 24 de octubre de 2021.
- ↑ Guía de manejo del síndrome de Down. Sociedad Española de Pediatría Extrahospitalaria. Consultada el 12/05/2007
- ↑ German, 1968.
- ↑ En realidad se han reportado tres casos de gestaciones en las que el padre era un portador de la trisomía, pero esas excepciones no han variado la idea general, en la medicina oficial, de que los varones son infértiles: “Fertility in men with Down syndrome, a case report”, Fertility and Sterility 2006;86:1765.e1-3. También en Zuhlke, C., Thies, U., Braulke, I., Reis, A., Schirren, C. «Down syndrome and male fertility: PCR-derived fingerprinting, serological and andrological investigations.» Clin Genet 1994;46:324-6.(Hay que tener en cuenta que tres casos entre millones son una proporción que no permite extrapolar conclusiones generales)
- ↑ Denver Conference (1960): «A proposed standard system of nomenclature of human mitotic chromosomes.» Lancet i: 1063-1065
- ↑ [»http://www.down21.org/salud/port_salud.html «La formación de los gametos —óvulo u ovocito y espermatozoide—, el proceso de la meiosis y la formación de trisomías por no-disyunción.»] Fundación Iberoamericana Down21. Consultada el 27 de mayo de 2007.
- ↑ 3,37 % para el CMD, Josep M. Corretger et al. (2005). Síndrome de Down. Aspectos médicos actuales. Ed. Masson, para la Fundación Catalana del Síndrome de Down.
- ↑ 2,06 % en CMD, Josep M. Corretger et al (2005). Síndrome de Down: aspectos médicos actuales. Ed. Masson, para la Fundación Catalana del Síndrome de Down.
- ↑ «Human Chromosome 21.» Consultada el 26 de mayo de 2007.
- ↑ Keck-Wherley J (Oct 2011). «Abnormal microRNA expression in Ts65Dn hippocampus and whole blood: contributions to Down syndrome phenotypes.». Dev Neurosci 33 (5): 451-67. PMID 22042248. doi:10.1159/000330884.
- ↑ Bofill-De Ros X (Nov 2015). «Genome-wide miR-155 and miR-802 target gene identification in the hippocampus of Ts65Dn Down syndrome mouse model by miRNA sponges.». BMC Genomics 16 (1): 907. PMID 26546125. doi:10.1186/s12864-015-2160-6.
- ↑ Quiñones-Lombraña A (Jul 2015). «Chromosome 21-derived hsa-miR-155-5p regulates mitochondrial biogenesis by targeting Mitochondrial Transcription Factor A (TFAM)». Biochim Biophys Acta 1852 (1): 1420-7. PMID 25869329. doi:10.1016/j.bbadis.2015.04.004.
- ↑ Kuhn DE (Jan 2010). «Chromosome 21-derived microRNAs provide an etiological basis for aberrant protein expression in human Down syndrome brains.». J Biol Chem 285 (2): 1529-43. PMID 19897480. doi:10.1074/jbc.M109.033407.
- ↑ Tomados de Josep M. Corretger et al. (2005). Síndrome de Down: Aspectos médicos actuales. Ed. Masson, para la Fundación Catalana del Síndrome de Down, Siegfried M. Pueschel (2002) Síndrome de Down: Hacia un futuro mejor y Pilar Arranz Martínez (2002). Niños y jóvenes con Síndrome de Down. Egido Editorial.
- ↑ Series de porcentajes obtenidas en un amplio estudio realizado por el CMD (Centro Médico Down) de la Fundación Catalana del Síndrome de Down Fundación Catalana del Síndrome de Down sobre 796 personas con SD. Estudio completo en Josep M. Corretger et al. (2005). Síndrome de Down: Aspectos médicos actuales. Ed. Masson, para la Fundación Catalana del Síndrome de Down. ISBN 84-458-1504-0. Pp. 24-32.
- ↑ Freemam, S. B., Taft, L. F., Dooley, K. J., Allran, K., Sherman, S. L., Hassold, T. J., Khoury, M. J., Saker, D. M. «Population based study of congenital heart defects in Down syndrome.» Am J Med Genet 1998; 80 (3): 213-7.
- ↑ Comunicación anómala entre aurículas situada en la parte media del tabique.
- ↑ Comunicación anómala entre la aorta descendente y el tronco de la arteria pulmonar. Esta comunicación, normal en el estadio fetal, se cierra espontáneamente al nacimiento. Cuando esto no sucede se habla de Persistencia del Conducto Arterioso, PCA o Ductus Arterioso Persistente
- ↑ Se trata de una malformación compleja en la que coinciden cuatro problemas: una CIV (Comunicación Interventricular), una obstrucción de la vía pulmonar, un crecimiento de la Aorta, acabalgada sobre los ventrículos, y una hipertrofia del ventrículo derecho.
- ↑ McElhinney DB, Straka M, Goldmuntz E, Zackai EH. «Correlation between abnormal cardiac physical examination and echocardiographic finding in neonates with Down syndrome.» Am J Med Genet. 2002 Dec 1; 113 (3): 238-41.
- ↑ Murdoch, J. C., Rodger, J. C., Rao, S. S., Fletcher, C. D., Dunnigan, M. G.: «Down's syndrome: an atheroma-free model?» Br. Med. J. 1977; 2: 226-8.
- ↑ Buchin PJ, Levy JS, Schullinger JN. «Down's syndrome and the gastrointestinal tract.» J Clin Gastroenterol 1986 Apr; 8(2): 111-4.
- ↑ Corretger, Josep M. et al. (2005). Síndrome de Down: Aspectos médicos actuales. Ed. Masson, para la Fundación Catalana del Síndrome de Down. ISBN 84-458-1504-0.
- ↑ a b c d e Corretger Rauet, J. M., Comité Asesor de Vacunas de la Asociación Española de Pediatría: «Vacunaciones en el niño con síndrome de Down.» Rev Pediatr Aten Primaria. 2014;16:159-67].
- ↑ [2]
- ↑ Flórez, J. Troncoso, M. V. y Dierssen, M. (1997) «Formación de las personas con SD: Para la autonomía y no para la dependencia.»
- ↑ Santoyo Velasco, C. (1991) «Notas sobre la plasticidad del desarrollo psicológico y las interacciones tempranas.» Revista Intercontinental de Psicología y Educación VOL. 4, NO. 2, 175-183.
- ↑ [3] El País.
- ↑ Oelwein (1995). Teaching Reading to Children with Down Syndrome: A Guide for Parents and Teacher.
- ↑ Hines, S. & Benet, F. (1997). «Eficacia de la intervención temprana en los niños con síndrome de Down.» Revista Síndrome Down, 14: 5-10.
- ↑ Moreno Pérez, D., Álvarez García, F. J., De Arístegui Fernández, J., Cilleruelo Ortega, M. J., Corretger Rauet, J. M., García Sánchez, N. y cols. «Calendario de vacunaciones de la Asociación Española de Pediatría: recomendaciones 2014.» Rev Pediatr Aten Primaria. 2014;16:13-20
- ↑ Epstein, C. J. (2000). El futuro de la investigación biológica en el Síndrome de Down.
- ↑ Cohen, W. «Health care guidelines for individuals with Down syndrome: 1999 revision.» Down Syndrome Quarterly. 1999; 4 (3).
- ↑ Rondal, J., Perera, J., Nadel, L. (2000). Síndrome de Down. Revisión de los últimos conocimientos.
- ↑ Programa de Salud basado en el elaborado por la Federación Española del Síndrome de Down, según las recomendaciones del Down Syndrome Medical Interest group (DSMIG) y en el Grupo de trabajo AEPap / PAPPS semFYC Archivado el 28 de septiembre de 2007 en Wayback Machine.. Consultadas el 12 de mayo de 2007.
- ↑ Nota "Anula la Corte la ley para atender a personas con síndrome de Down en la Ciudad de México", de Eduardo Murillo. La Jornada, miércoles, 22 de abril de 2020, sección Sociedad, p. 35 (Consultado miércoles, 22 de abril de 2020)
- ↑ Nota de 2018 en la página de la Comisión de Derechos Humanos de la Ciudad de México
- ↑ «Reino Unido avala abortar niños con síndrome de Down hasta el mismo día del parto». El Debate (periódico digital). 25 de noviembre de 2022. Consultado el 2 de enero de 2023.
- ↑ Reseña de la película
- ↑ La historia de Jan (2016), consultado el 8 de julio de 2020.
- ↑ «José María Merino, Premio Nacional de Narrativa 2013», Europa Press, Madrid, 25 de octubre de 2013.
- ↑ «http://blog.xerais.gal/destacados/ganadores-dos-xerais-2016/ Premio Xerais Premio Xerais de novela 2016.
Bibliografía
[editar]- Pueschel, Siegfried M. (2002) Síndrome de Down: Hacia un futuro mejor. Ed. Masson ISBN 1-55766-452-8.
- Down, J. H. L. (1886). «Observations on an ethnic classification of idiots.» London Hospital. Clinical Lectures and Reports, 3: 259-262.
- Corretger, Josep M. et al. (2005). Síndrome de Down: Aspectos médicos actuales. Ed. Masson, para la Fundación Catalana del Síndrome de Down. ISBN 84-458-1504-0.
- Martínez Acebal, Azucena y Joaquín Fernández Toral (1999). Síndrome de Down: Aspectos sociológicos, Médicos y Legales. ISBN 84-86889-65-0.
- Arranz Martínez, Pilar (2002). Niños y jóvenes con Síndrome de Down. Egido Editorial. ISBN 84-95879-09-3.
- Candel, I. Programa de Atención temprana. Intervención en niños con síndrome de Down y otros problemas del desarrollo. Ed. CEPE, Madrid, 1999.
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre Síndrome de Down.
Wikimedia Commons alberga una categoría multimedia sobre Síndrome de Down.- En MedlinePlus hay más información sobre Síndrome de Down
- OMIM 190685
- Genetics Home Reference
- Programas de salud para adultos con síndrome de Down
- Un breve ensayo literario sobre el síndrome de Down: "Bienvenidos a Holanda" Archivado el 14 de julio de 2014 en Wayback Machine.




