Oro
El oro es un elemento químico cuyo número atómico es 79. Está ubicado en el grupo 11 de la tabla periódica. Es un metal precioso blando de color dorado. Su símbolo es Au (del latín aurum, ‘brillante amanecer’). Además, es uno de los metales más apreciados en joyería por sus propiedades físicas, al tener baja alterabilidad, ser muy maleable, dúctil y brillante, y valorado por su rareza, al ser un metal difícil de encontrar en la naturaleza.
Es un metal de transición blando, brillante, amarillo, pesado, maleable y dúctil. El oro no reacciona con la mayoría de los productos químicos, pero es sensible y soluble al cianuro, al mercurio, al agua regia, al cloro y a la lejía. Este metal se encuentra normalmente en estado puro, en forma de pepitas y depósitos aluviales. Es un elemento que se crea gracias a las condiciones extremas en el núcleo colapsante de las supernovas. Cuando la reacción de una fusión nuclear cesa, las capas superiores de la estrella se desploman sobre el núcleo estelar, comprimiendo y calentando la materia hasta el punto de que los núcleos más ligeros, como por ejemplo el hierro, se fusionan para dar lugar a los metales más pesados (uranio, oro, etc.). Un estudio sugiere que el oro del planeta provino de la colisión de estrellas de neutrones.[1]
Los depósitos primarios de oro en la corteza se forman a partir de gases y líquidos muy calientes, metasomáticos, que se elevan desde el interior de la Tierra, los cuales se trasladan a la superficie a través de fallas de la corteza terrestre.[2]
En heráldica, representa todo poder económico y es símbolo de vanidad.
Consideraciones lingüísticas
- Etimología: La palabra «oro» proviene del latín aurum.[2]
- Sustantivo. Existen otras acepciones de la palabra.
- Siglas y abreviaciones. El símbolo químico del oro es “Au”.
- Expresiones lingüísticas. Hay expresiones idiomáticas empleadas en el lenguaje español que son reconocidas por la Real Academia Española (“regla de oro”, “oportunidad de oro”, “siglo de oro”, “letras de oro”, “el tiempo es oro”).
- Adjetivo. Las cualidades particulares del oro han engendrado la raíz de los calificativos áureo y dorado en algunas expresiones (“regla áurea”, “sueño dorado”).
Historia

El oro ha sido conocido y utilizado por los artesanos desde el Calcolítico. Artefactos de oro fabricados desde el IV milenio a. C., como los provenientes de la necrópolis de Varna (primer oro trabajado del mundo[3]), han sido encontrados en los Balcanes. Otros artefactos de oro, como los sombreros de oro y el disco de Nebra, aparecieron en Europa Central desde el II milenio a. C. en la Edad del Bronce. El oro se conoce desde la prehistoria. En el Antiguo Egipto, el faraón Dyer (3000 a. C.) llevaba en su título un jeroglífico referente al metal, y también se menciona varias veces en el Antiguo Testamento. Se ha considerado uno de los metales más preciosos a lo largo de la Historia, y como "valor patrón" se ha empleado profusamente, acuñado en monedas.
En la antigüedad algunos creían que ingerir sus alimentos diarios servidos en platos de oro podría prolongar su tiempo de vida y retardar el envejecimiento. También durante la gran peste negra en Europa algunos alquimistas pensaron que podrían curar a los enfermos haciéndoles ingerir oro finamente pulverizado.
Características

El oro exhibe un color amarillo en bruto. Es considerado como el metal más maleable y dúctil que se conoce.[2] Una onza (31,10 g) de oro puede moldearse en una lámina que cubra 28 m².[cita requerida] Como es un metal blando, son frecuentes las aleaciones con otros metales con el fin de proporcionarle dureza.
Además, es un buen conductor del calor y de la electricidad, y no le afecta el aire ni la mayoría de los agentes químicos. Tiene una alta resistencia a la alteración química por parte del calor, la humedad y la mayoría de los agentes corrosivos, y así está bien adaptado a su uso en la acuñación de monedas y en la joyería.
Se trata de un metal muy denso, con un alto punto de fusión y una alta afinidad electrónica. Sus estados de oxidación más importantes son 1+ y 3+. También se encuentra en el estado de oxidación 2+, así como en estados de oxidación superiores, pero es menos frecuente. La estabilidad de especies y compuestos de oro con estado de oxidación III, frente a sus homólogos de grupo, hay que razonarla considerando los efectos relativistas sobre los orbitales 5d del oro.
La química del oro es más diversa que la de la plata, su vecino inmediato de grupo: seis estados de oxidación exhibe –I a III y V. El oro –I y V no tiene contrapartida en la química de la plata. Los efectos relativistas, contracción del orbital 6s, hacen al oro diferente con relación a los elementos más ligeros de su grupo: formación de interacciones Au-Au en complejos polinucleares. Las diferencias entre Ag y Au hay que buscarlas en los efectos relativistas que se ejercen sobre los electrones 5d y 6s del oro. El radio covalente de la tríada de su grupo sigue la tendencia Cu < Ag >- Au; el oro tiene un radio covalente ligeramente menor o igual al de la plata en compuestos similares, lo que podemos asignar al fenómeno conocido como “contracción relativista + contracción lantánida”.
Electrones solvatados en amoniaco líquido reducen al oro a Au-. En la serie de compuestos MAu (M: Na, K, Rb, Cs) se debilita el carácter metálico desde Na a Cs. El CsAu es un semiconductor con estructura CsCl y se describe mejor como compuesto iónico: Cs+Au-. Hay que resaltar los compuestos iónicos del oro del tipo RbAu y CsAu con estructura tipo CsCl (8:8), ya que se alcanza la configuración tipo pseudogás noble del Hg (de 6s1 a 6s²) para el ion Au- (contracción lantánida + contracción relativista máxima en los elementos Au y Hg). El subnivel 6s se acerca mucho más al núcleo y simultáneamente el 6p se separa por su expansión relativista. Con esto se justifica el comportamiento noble de estos metales. La afinidad electrónica del Au, –222,7 kJ mol−1, es comparable a la del yodo con –295,3 kJ mol−1. Recientemente se han caracterizado óxidos (M+)3Au-O2-(M = Rb, Cs) que también exhiben propiedades semiconductoras.
Reactividad
El oro es sumamente inactivo. Es inalterable por el aire, el calor, la humedad y la mayoría de los agentes químicos, aunque se disuelve en mezclas que contienen cloruros, bromuros o yoduro. También se disuelve en otras mezclas oxidantes, en cianuros alcalinos y en agua regia, una mezcla de ácido nítrico y ácido clorhídrico. Una vez disuelto en agua regia, se obtiene ácido cloroáurico, que se puede transformar en oro metal con disulfito de sodio. El oro se vuelve soluble al estar expuesto al cianuro.
Isótopos
El oro sólo tiene un isótopo estable,197Au, el cual es también su único isótopo de origen natural. 36 radioisótopos han sido sintetizados variando en masa atómica entre 169 y 205. El más estable de estos es 195Au con un periodo de semidesintegración de 186,1 días. 195Au es también el único isótopo que se desintegra por captura electrónica. El menos estable es 171Au, el cual se desintegra por emisión de protones con un periodo de semidesintegración de 30 µs. La mayoría de radioisótopos del oro con masas atómicas por debajo de 197 se desintegran por alguna combinación de emisión de protones, desintegración α y desintegración β+. Las excepciones son 195Au, el cual se desintegra por captura electrónica, y 196Au, el cual tiene un camino de desintegración β- menor. Todos los radioisótopos del oro con masas atómicas por encima de 197 se desintegran por desintegración β-.[4]
Por lo menos 32 isómeros nucleares han sido también caracterizados, variando en masa atómica entre 170 y 200. Dentro de este rango, sólo 178Au, 180Au, 181Au, 182Au y 188Au no tienen isómeros. El isómero más estable del oro es 198 m²Au con un periodo de semidesintegración de 2,27 días. El isómero menos estable del oro es 177 m²Au con un periodo de semidesintegración de sólo 7 ns. 184 m1Au tiene tres caminos de desintegración: desintegración β+, transición isomérica y desintegración alfa. Ningún otro isómero o isótopo del oro tiene tres caminos de desintegración.[4]
Compuestos
No existe evidencia del estado de oxidación IV, pero si para el Au(V) en el fluoruro AuF5 (rojo oscuro, d>60C, inestable, polimérico y diamagnético;su estructura consiste en octaedros AuF6 unidos por los vértices, generando un polímero monodimensional) y en el anión complejo [AuF6]- (oxidante fuerte, el más fuerte de las especies metálicas [MF6]-,donde tenemos una configuración de bajo espín d6).
El oro forma bastantes complejos pero pocos compuestos sencillos. No se ha aislado un óxido con Au(I), pero si el AuO que contiene Au+ y Au3+, pero el estado I solo es estable en estado sólido o en forma de complejos estables como el anión lineal [Au(CN)2]-, ya que en disolución se desproporciona en oro y oro(III).
El óxido Au2O3 se obtiene, como precipitado amorfo, Au2O3.nH2O, de color marrón, en medio alcalino a partir del halurocomplejo planocuadrado [AuCl4]-. El Au2O3 cristalino, polímero monodimensional, se obtiene mejor por vía hidrotermal y su estructura se genera con grupos planocuadrados [AuO4] unidos por vértices; es poco estable, como es de esperar, y descompone en Au y O2 a 150 °C.
La cloración de polvo de oro a 200 °C da moléculas diméricas planas de Au2Cl6, rojo (d>160 °C), que es el reactivo de partida para preparar muchos compuestos de oro; cuando se calienta a 160 °C produce el AuCl. Se conocen los tres monohaluros AuX (X = Cl, Br, I) cuya estructura se define por cadenas en zig-zag,...X-Au-X..., con puentes angulares Au-X-Au (72º-90º).
El ion dicianoaurato [Au(CN)2]- de gran importancia metalúrgica se forma con facilidad cuando se hace reaccionar oro con disoluciones de cianuros en presencia de aire o agua oxigenada. El Au(III) es d8 e isoelectrónico con Pt(II), teniendo sus complejos preferencia por la geometría plana cuadrada. La disolución de oro en agua regia o de Au2O3 en ácido clorhídrico concentrado nos da el ion tetracloroaurato(III), [AuCl4]-, que se usa como “oro líquido” para decorar cerámicas y vidrios, ya que cuando se calienta deja una película de oro. La evaporación de estas disoluciones producen cristales amarillos de (H3O)[AuCl4].3H2O; las disoluciones acuosas de esta sal generan un medio fuertemente ácido. Este anión tetracloroaurato(III),[AuCl4]-, se hidroliza fácilmente a [AuCl3OH]-.
El “tricloruro de oro” (Au2Cl6) y el “ácido cloroáurico” ((H3O)[AuCl4].3H2O) son algunos de los compuestos más comunes de oro.
También existen otros aniones planocuadrados del tipo [AuX4]-, siendo X: F-,Cl-, Br-, I-, CN-, SCN- y NO3-; este último es uno de los pocos ejemplos auténticos donde el ion nitrato actúa como ligando monodentado, al igual que en los complejos equivalentes de Pd(II) y Pt(II).
Por otro lado se conocen cationes complejos con amoniaco, aminas, piridina y con ligandos quelatos como etilendiamina: [Au(NH3)4]3+ y [AuCl2(py)2]+. En el complejo [Au Cl2 (en)2]+ aparece una coordinación rara para el Au(III) en un entorno octaédrico distorsionado.
La mayoría de los compuestos que se cree que contienen oro(II) en realidad son compuestos de valencia mixta, como el dicloruro de oro que en realidad es el tetrámero (AuI)2(AuIII)2Cl8 donde aparece Au(III) planocuadrado y Au(I) lineal y su color oscuro se origina por la transferencia de carga entre ambos centros metálicos.
También forma cúmulos de oro (compuestos clúster), aspecto desconocido en la química del cobre, su homólogo de grupo más ligero. En este tipo de compuestos hay enlaces entre los átomos de oro que están favorecidos por los efectos relativistas. A algunos de estos compuestos se les denomina “oro líquido”. El clúster trimetálico más voluminoso caracterizado por difracción de rayos-X corresponde al macroanión,[(Ph3P)10 Au12Ag12PtCl7]-, en cuya formación juega un rol importante el oro. Este contiene 25 átomos de elementos vecinos del bloque d y sin participación de metales ligeros de la primera serie de transición: 12Au + 12Ag + 1Pt. Esta clase de clúster queda definida estructuralmente por dos icosaedros Au6Ag6 unidos por un vértice común de oro, situándose en el centro de un icosaedro un átomo de platino y en el segundo el atómo central es de oro.
Aplicaciones



De la producción mundial de oro el 70 % se utiliza en joyería, el 20 % en reservas e inversiones y solo al 10 % se le da usos industriales.[5]
El oro puro o de 24 kt (quilates) es demasiado blando para ser usado normalmente y se endurece aleándolo con plata y/o cobre, con lo cual podrá tener distintos tonos de color o matices. El oro y sus muchas aleaciones se emplean bastante en joyería, en relación con el intercambio monetario (para la fabricación de monedas y como patrón monetario), como mercancía, en medicina, en alimentos y bebidas, en la industria, en electrónica y en química comercial.

El oro se conoce y se aprecia desde tiempos remotos, no solamente por su belleza y resistencia a la corrosión, sino también por ser más fácil de trabajar que otros metales y menos costosa su extracción. Debido a su relativa rareza, comenzó a usarse como moneda de cambio y como referencia en las transacciones monetarias internacionales. Hoy por hoy, los países emplean reservas de oro puro en lingotes que dan cuenta de su riqueza, véase patrón oro.
En joyería fina se denomina oro alto o de 18 kt aquel que tiene 18 partes de oro y 6 de otro metal o metales (75 % en oro), oro medio o de 14 kt al que tiene 14 partes de oro y 10 de otros metales (58,33 % en oro) y oro bajo o de 10 kt al que tiene 10 partes de oro por 14 de otros metales (41,67 % en oro). En joyería, el oro de 18 kt es muy brillante y vistoso, pero es caro y poco resistente; el oro medio es el de más amplio uso en joyería, ya que es menos caro que el oro de 18 kt y más resistente, y el oro de 10 kt es el más simple. Debido a su buena conductividad eléctrica y resistencia a la corrosión, así como una buena combinación de propiedades químicas y físicas, se comenzó a emplear a finales del siglo XX como metal en la industria.
En joyería se utilizan diferentes aleaciones de oro alto para obtener diferentes colores, a saber:
- Oro azul = 75% de oro y 25% de hierro.
- Oro gris = 75% de oro, 15% de níquel y 10% de cobre.
- Oro rojo = 75% de oro y 25% de cobre.
- Oro rosa = 75% de oro, 5% de plata y 20% de cobre.
- Oro amarillo = 75% de oro, 12,5% de plata y 12,5% de cobre.
- Oro verde = 75% de oro y 25% de plata.
- Oro blanco = 75% de oro, 16% de paladio y 9% de plata.
Cabe mencionar que el color que se obtiene, excepto en oro blanco, es predominantemente amarillo, es decir, el “oro verde” no es verde, sino amarillo con una tonalidad verdosa.
Medicina
En la actualidad se le ha dado algunos usos terapéuticos: algunos tiolatos (o parecidos) de oro (I) se emplean como antiinflamatorios en el tratamiento de la artritis reumatoide y otras enfermedades reumáticas.[6] No se conoce bien el funcionamiento de estas sales de oro. El uso de oro en medicina es conocido como crisoterapia.
La mayoría de estos compuestos son poco solubles y es necesario inyectarlos. Algunos son más solubles y se pueden administrar por vía oral. Este tratamiento suele presentar bastantes efectos secundarios, generalmente leves, pero es la principal causa de que los pacientes lo abandonen.
El cuerpo humano no absorbe bien este metal, pero sus compuestos pueden ser tóxicos. Hasta el 50 % de pacientes con artrosis tratados con medicamentos que contenían oro han sufrido daños hepáticos y renales.
Oro como valor especulativo
- El oro es utilizado como cobertura contra el dólar, la inflación, tasas de interés y crisis económicas. La Reserva Federal (FED) acaba de subir las tasas de interés en los Estados Unidos en 25 puntos porcentuales (nueva tasa oscilara ente 0.5 y 0.75 %), esta decisión ha impulsado al dólar a niveles máximos de hace 14 años, esto ha provocando una caída en los metales preciosos como el oro y la plata, en la actualidad el precio del oro cotiza en una tendencia bajista en el mediano y largo plazo. la presidenta de la FED, Janet Yellen, dijo que la entidad podría subir hasta en tres oportunidades las tasas de interés en el 2017, esto siempre y cuando el mercado laboral y la economía de EE. UU. sigan creciendo, por tanto no olvidar que un dólar alto encarece el precio de las materias primas, para que suba el oro tendría que bajar el precio del dólar.
- Algunos tenedores de oro lo almacenan en forma de lingotes o monedas con finalidad especulativa. Sin embargo, el economista Martin Feldstein no cree que el oro sirva como una cobertura contra la inflación o depreciación de la moneda. En cambio otros economistas, como Baur, Lucey o Hillier, opinan que el oro no sólo sirve como cobertura, sino que sirve como valor refugio durante las crisis económicas.[7]
- El código ISO 4217 de la moneda de oro es XAU.
- Las modernas monedas de oro con fines de inversión, colección o especulación no requieren buenas propiedades de desgaste mecánico; por lo general son de oro fino en 24 kt, aunque el American Gold Eagle y el británico Soberano de Oro continúan siendo acuñados en metal de 22 kt en la tradición histórica; y el sudafricano Krugerrand, mostrado en público por primera vez en 1967, también es 22 kt. El ejemplar especial de la moneda canadiense Hoja de Arce de Oro tiene la pureza de oro más alta de cualquier moneda de oro, el 99,999 % o 0,99999, mientras que el ejemplar popular de la moneda de oro canadiense Hoja de Arce de Oro tiene una pureza un poco inferior, de 99,99 %.
- Hay otras monedas de oro puro al 99,99 % disponibles. En 2006, la Fábrica de moneda de Estados Unidos (United States Mint) comenzó la producción de la moneda de oro American Buffalo con una pureza del 99,99 %. La moneda de oro australiana Canguros de Oro (Gold Kangaroos) se acuñó por primera vez en 1986 como Nugget australiano de oro, pero cambió el diseño del reverso en 1989. Otras monedas populares modernas son la moneda de oro Filarmónica de Viena y el Panda de Oro Chino.
- Su uso especulativo ha creado una burbuja de oro[8] que estalló el 16 de abril de 2013, que fue una jornada histórica en la que el precio de la onza se desplomó un 9 %, el mayor descenso en un solo día desde 1983 (el mayor en 30 años), pero en dos sesiones ha bajado un 13,5 %, con lo que el precio de la onza quedó en 1351 dólares. En lo que va de año 2013, acumula bajadas de casi un 20 % (19,5 %).[9]
- Tras el mínimo de noviembre de 2013, en el que se alcanzó la cifra de 1187 dólares por cada onza de oro, un mínimo que no se alcanzaba desde 2010, el año 2014 empezó con una dinámica positiva que colocó el precio del oro por encima de los 1400 dólares apenas llegados a febrero de 2014, un aumento del 24 % muy importante en los primeros meses de 2014.
Otras aplicaciones
- El oro ejerce funciones críticas en comunicaciones, naves espaciales, motores de aviones de reacción y otros muchos productos.
- Su alta conductividad eléctrica y resistencia a la oxidación ha permitido un amplio uso como capas delgadas electrodepositadas sobre la superficie de conexiones eléctricas para asegurar una conexión buena, de baja resistencia.
- Como la plata, el oro puede formar fuertes amalgamas con el mercurio que a veces se emplea en empastes dentales.
- El oro coloidal (nanopartículas de oro) es una solución intensamente coloreada que se está estudiando en muchos laboratorios con fines médicos y biológicos[cita requerida]. También es la forma empleada como pintura dorada en cerámicas.
- El ácido cloroaúrico se emplea en fotografía.
- El isótopo de oro 198Au, con un periodo de semidesintegración de 2,7 días, se emplea en algunos tratamientos de cáncer y otras enfermedades.
- Se emplea como recubrimiento de materiales biológicos permitiendo ser visto a través del microscopio electrónico de barrido (SEM).
- Se emplea como recubrimiento protector en muchos satélites debido a que es un buen reflector de la luz infrarroja.
- En la mayoría de las competiciones deportivas es entregada una medalla de oro al ganador, entregándose también una de plata al subcampeón y una de bronce al tercer puesto.
- Se ha iniciado su uso en cremas faciales o para la piel.
- Se utiliza para la elaboración de flautas traveseras finas debido a que se calienta con mayor rapidez que otros materiales facilitando la interpretación del instrumento.
- El oro se usó en los primeros cables eléctricos en vez del cobre, debido a su gran conductividad. Sin embargo, fue sustituido por plata debido a que se producían robos. Asimismo, por los robos cambiaron la plata por cobre.[cita requerida]
Minería



Debido a que es relativamente inerte, se suele encontrar como metal, a veces como pepitas grandes, pero generalmente se encuentra en pequeñas inclusiones en algunos minerales, vetas de cuarzo, pizarra, rocas metamórficas y depósitos aluviales originados de estas fuentes. El oro está ampliamente distribuido y a menudo se encuentra asociado a los minerales cuarzo y pirita, y se combina con teluro en los minerales calaverita, silvanita y otros. Los romanos extraían mucho oro de las minas españolas, pero hoy en día muchas de las minas de este país están agotadas.
El oro se extrae por lixiviación con cianuro. El uso del cianuro facilita la oxidación del oro formándose Au (CN)22- en la disolución. Para separar el oro se vuelve a reducir empleando, por ejemplo, cinc. Se ha intentado reemplazar el cianuro por algún otro ligando debido a los problemas medioambientales que genera, pero o no son rentables o también son tóxicos. En la actualidad hay miles de comunidades en todo el mundo en lucha contra compañías mineras por la defensa de sus formas de vida tradicionales y contra los impactos sociales, económicos y medioambientales que la actividad minera de extracción de oro por lixiviación con cianuro genera en su entorno.
Hay una gran cantidad de oro en los mares y océanos, siendo su concentración de entre 0,1 µg/kg y 2 µg/kg, pero en este caso no hay ningún método rentable para obtenerlo.
El oro puede encontrarse en la naturaleza en los ríos. Algunas piedras de los ríos contienen pepitas de oro en su interior. La fuerza del agua separa las pepitas de la roca y las divide en partículas minúsculas que se depositan en el fondo del cauce.
Los buscadores de oro localizan estas partículas de oro de los ríos mediante la técnica del bateo. El utensilio utilizado es la batea, un recipiente con forma de sartén. La batea se llena con arena y agua del río y se va moviendo provocando que los materiales de mayor peso, como el oro, sean depositados en el fondo y la arena superficial se desprenda.
Así pues, el bateo de oro es una técnica de separación de mezclas heterogéneas.
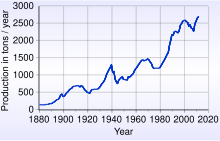
Producción minera
La producción mundial de oro durante el 2014 alcanzó un total de 2860 toneladas métricas de oro fino. El principal país productor fue China, seguido por Australia y Rusia.
|
Países exportadores
Los principales países exportadores del Oro a nivel mundial son Suiza, Reino Unido y Hong Kong.[16]
| N° | País/Región | Valor de Exportación (en dólares) |
|---|---|---|
| - | Mundo | USD 308.000 millones |
| 1 | USD 65.300 millones | |
| 2 | USD 41.600 millones | |
| 3 | USD 40.800 millones | |
| 4 | USD 15.800 millones | |
| 5 | USD 13.400 millones | |
| 6 | USD 12.500 millones | |
| 7 | USD 10.000 millones | |
| 8 | USD 8.450 millones | |
| 9 | USD 5.740 millones | |
| 10 | USD 5.670 millones |
El oro forma parte de lo que se conoce como minerales en conflicto. Los cuatro minerales de conflicto más habituales conocidos como los 3TG por las siglas de los minerales en inglés: tin (casiterita), tungsten (wolframita), tantalum (coltán) y gold (mineral de oro)[17].
Ensayos
El método de ensayo a fuego consiste en producir una fusión de la muestra usando reactivos fundentes adecuados para obtener dos fases líquidas: una escoria constituida principalmente por silicatos complejos y una fase metálica constituida por plomo, el cual colecta los metales nobles de interés (Au y Ag). Los dos líquidos se separan en dos fases debido a su respectiva inmiscibilidad y gran diferencia de densidad, estos solidifican al enfriar. El plomo sólido (con los metales nobles colectados) es separado de la escoria como un régulo. Este régulo de plomo obtenido es oxidado en caliente en copela de magnesita y absorbido por ella, quedando en su superficie el botón de oro y plata, elementos que se determinan posteriormente por método gravimétrico (por peso) o mediante espectroscopia de absorción atómica.
Toxicidad
Algunos medicamentos como el tiosulfato de oro, la aurotioglucosa, el tiomalato de sodio y oro (miocrisine), etc.; pueden provocar un cuadro de intoxicación por oro. Produciendo efectos adversos como exantemas cutáneos, erupciones papulosas, herpes simple y dermatitis exfoliativa grave. En el sistema digestivo, estos fármacos pueden causar salivación, gusto metálico, náuseas, vómito y diarrea, apareciendo hepatosis y nefritis. En el sistema nervioso puede aparecer anemia aplástica, granulocitopenia y púrpura trombocitopénica. El tratamiento consiste en suspender la medicación, administrar dimercaprol por vía intramuscular y tratar los síntomas.[18]

En la cultura popular
El oro ha tenido mucha referencia en sentido figurado en el habla y cultura populares, por ejemplo:
- La regla de oro que refiere a ciertas normas humanas y luego ha sido tomada en varias disciplinas científicas, con un significado particular en cada una de ellas.
- Cuando se califica algo como valioso o apreciado se dice que es “de oro”.
- “Oro negro” se refiere al petróleo, por ser riqueza natural no renovable a nivel mundial.
- “Oro rosa” puede referirse a los camarones, por ser medio de subsistencia de quienes explotan su captura.
- “Oro verde” es otro nombre con el que se conoce al henequén en Yucatán, al aguacate en Michoacán, a las esmeraldas en Colombia, a la planta de coca en Perú, al cannabis y a la soja.
- “Oro blanco” es el calificativo frecuentemente adjudicado al platino y en otras ocasiones al clorhidrato de cocaína. También se le conoce al algodón por los campesinos que se dedican a su cultivo, además del marfil que se obtiene ilegalmente de los colmillos de los elefantes.
- “Oro rojo” se llama al coral rojo (Corallium rubrum) por los artesanos y joyeros que trabajan con él para hacer diversas manufacturas y ornatos. Este coral es un pólipo que forma colonias poco ramificadas de hasta 20 cm. Los pólipos son de color blanco y la estructura que los une es roja. Se encuentra a partir de 15 metros de profundidad. Por otro lado, también “oro rojo” es el calificativo que se utiliza en el bajo mundo para referirse a la sangre humana traficada ilegalmente.
- “Oro líquido” se conoce al aceite de oliva, por la similitud de color entre estas dos sustancias.
- El miedo irracional al oro es la crisofobia, que no hay que confundir con su variante, la aurantrofobia (fobia al dinero).
- No todo lo que brilla es oro, como proverbio.
- El oro no es un elemento esencial para ningún ser vivo. Sin embargo, en la antigüedad algunos creían que ingerir sus alimentos diarios servidos en platos de oro podría prolongar su tiempo de vida y retardar el envejecimiento. También durante la gran peste negra en Europa algunos alquimistas pensaron que podrían curar a los enfermos haciéndoles ingerir oro finamente pulverizado.[[cr}}
- El oro laminado es una lámina de oro que se ha aplicado a un metal de menor valor. [19]
Véase también
Referencias
- ↑ Landau, Elizabeth (18 de julio de 2013). «Todo el oro del planeta provino de la colisión de estrellas de neutrones». cnn.com. Consultado el 21 de septiembre de 2018.
- ↑ a b c «Metalurgia». Banco de la República de Colombia. 2008. Archivado desde el original el 19 de noviembre de 2012. Consultado el 19 de septiembre de 2010.
- ↑ «La Caixa saca de un largo olvido al enigmático pueblo tracio». Terra. Archivado desde el original el 28 de junio de 2012. Consultado el 9 de mayo de 2010.
- ↑ a b Audi, G. (2003). «The NUBASE Evaluation of Nuclear and Decay Properties». Nuclear Physics A (Atomic Mass Data Center) 729: 3-128. doi:10.1016/j.nuclphysa.2003.11.001.
- ↑ http://oilprice.com/Metals/Gold/Gold-Mining-Boom-Increasing-Mercury-Pollution-Risk.html Gold Mining Boom Increasing Mercury Pollution Risk
- ↑ Messori, L.; Marcon, G. (2004). «Gold Complexes in the treatment of Rheumatoid Arthritis». En Sigel, Astrid, ed. Metal ions and their complexes in medication. CRC Press. pp. 280-301. ISBN 978-0-8247-5351-1.
- ↑ «El oro como valor refugio.»
- ↑ Nota de prensa: El auge del compro oro
- ↑ «El precio del oro se da un batacazo: en un solo día cae a niveles de 1983.»
- ↑ U.S. Geological Survey, [1]
- ↑ U.S. Geological Survey
- ↑ «Los 10 principales países productores de oro en el mundo». Mineria en Linea. 14 de agosto de 2018.
- ↑ «La producción minera de oro alcanzó un nuevo récord histórico en 2018: 3.503 toneladas». Oroinformacion. 4 de abril de 2019.
- ↑ {{cita web |url= https://oroinformacion.com/la-mineria-china-quiere-aumentar-su-produccion-de-oro-con-adquisiciones-en-australia/
- ↑ a b «Perú sigue siendo mayor productor de oro en América Latina y sexto en el mundo». Andina.Pe. 8 de mayo de 2018.
- ↑ http://atlas.media.mit.edu/es/profile/hs92/7108/
- ↑ «Qué impacto tiene tu PC en el medio ambiente».
- ↑ Calabrese, Alberto I.; Astolfi, Emilio A. (enero de 1969). Toxicología. Buenos Aires, Argentina: Kapelusz. p. 147. OCLC 14501248.
- ↑ https://www.cotizaciondemetales.com/blog/141-que-es-el-oro-laminado-y-cual-es-su-precio. Consultado el 7 de abril de 2020. Falta el
|título=(ayuda)
Bibliografía
- Cotton, F. A.; Wilkinson, G.; Murillo, C. A.; Bochman, M. Advanced Inorganic Chemistry, A comprehensive Text, 6th Ed., Wiley & Sons, 1999.
- Hans-Jürgen Quadbeck-Seeger(Ed.); Faust, Rüdiger; Knaus, Günter & Siemeling, Ulrich. World Records in Chemistry, Wiley-VCH, 1999.
- Holleman, A. F. & Wiberg, Egon. Inorganic Chemistry, Academic Press, 2001.
- Housecraft, C. E. & Sharpe, A. G. Química inorgánica, 2.ª edición, Pearson Prentice Hall, 2006.
- Wulfsberg, G. Inorganic Chemistry, 1st Ed., University Science Books, 2000.
Enlaces externos
 Wikcionario tiene definiciones y otra información sobre oro.
Wikcionario tiene definiciones y otra información sobre oro. Wikiquote alberga frases célebres de o sobre Oro.
Wikiquote alberga frases célebres de o sobre Oro.



