Enfermedad de Chagas
| Enfermedad de Chagas | ||
|---|---|---|
 Microfotografía con tinción de Giemsa de Trypanosoma cruzi (CDC). | ||
| Especialidad |
infectología parasitología | |
| eMedicine | med/327 | |
| Sinónimos | ||
| ||
La enfermedad de Chagas, también conocida como tripanosomiasis americana o Mal de Chagas-Mazza,[nota 1] es una enfermedad parasitaria tropical, generalmente crónica, causada por el protozoo flagelado Trypanosoma cruzi.[1]
Se considera que la enfermedad de Chagas es endémica de América, distribuyéndose desde México hasta Sudamérica, aunque existen vectores y reservorios incluso en el sur de los Estados Unidos, y en la actualidad se considera una enfermedad, aunque esporádica, con casos identificados en Canadá y EE.UU.[2] Se estima que son infectadas por la enfermedad de Chagas entre 15 y 17 millones de personas cada año, de las cuales mueren unas 50.000. La enfermedad tiene mayor prevalencia en las regiones rurales más pobres de América Latina.[3]
La etapa aguda infantil se caracteriza por fiebre, linfadenopatía, aumento del tamaño de hígado y bazo y, en ocasiones, miocarditis o meningoencefalitis con pronóstico grave. En la etapa crónica, a la cual llegan entre el 30% y el 40% de todos los pacientes chagásicos, suele haber cardiomiopatía difusa grave o dilatación patológica (megasíndromes) del esófago y colon (megaesófago y megacolon respectivamente). La importancia de esta parasitosis radica en su elevada prevalencia, grandes pérdidas económicas por incapacidad laboral, y muerte repentina de personas aparentemente sanas.[4][5][6][7]
Reconocida por la OMS como una de las 13 enfermedades tropicales más desatendidas del mundo,[8] y por la Organización Panamericana de la Salud como una enfermedad de la pobreza,[9] la enfermedad de Chagas ha sido un azote para la humanidad desde la antigüedad, y sigue siendo un problema relevante social y económico en muchos países de América Latina.[10]
Concepto
El término MeSH, introducido en 1992, describe la enfermedad de Chagas como:
La infección por el parásito protozoario Trypanosoma cruzi, una forma de Tripanosomiasis endémica en América Central y del Sur. Lleva el nombre del médico brasileño Carlos Chagas, quien descubrió el parásito. La infección por el parásito (sólo resultado serológico positivo) se distingue de las manifestaciones clínicas que se desarrollan años después, como la destrucción de los ganglios parasimpáticos; miocardiopatía chagásica y disfunción del esófago o del colon.[11]MeSH
También se la conoce como Tripanosomiasis americana o enfermedad de Chagas-Mazza, en honor a los médicos Carlos Chagas y Salvador Mazza.[12][13]
Historia
Entre los antecedentes para conocer el origen y la dispersión de la enfermedad de Chagas existen conjeturas con base en relatos de cronistas españoles, revisiones de publicaciones arqueológicas, así como la actual distribución de los triatominos en América han sugerido que Triatoma infestans, importante transmisor de Trypanosoma cruzi en Sudamérica, se adaptó al humano hace aproximadamente 2.000 o 2.500 años.[14]
Enfermedad en las civilizaciones precolombinas
Se ha propuesto que inicialmente la transmisión del parásito ocurría entre mamíferos silvestres y vectores. Los primeros humanos que habitaron el continente pudieron incorporarse a dicho ciclo cuando desplazaron a los mamíferos locales de las cavernas infestadas de triatominos y las ocuparon con fines religiosos o para pintar en ellas.[15] Así mismo, la domesticación de algunos mamíferos pudo favorecer que los vectores infectados se establecieran en el peridomicilio y más tarde se domesticaran.[16]
Existe evidencia del contacto de las civilizaciones precolombinas en el hallazgo de restos momificados en diferentes lugares de América con signos de la enfermedad.[10] Se encontraron manifestaciones de la enfermedad durante la autopsia de 35 momias exhumadas en el desierto chileno, fechadas con la técnica del carbono 14 entre los años 470 a. C. y 600 d. C.[17] En restos momificados procedentes de Chihuahua, México en los que se aplicaron técnicas paleoparasitológicas y moleculares se encontró ADN de T. cruzi en restos de tejido muscular, digestivo y cardíaco humano.[15]
Enfermedad durante la conquista y colonia

Existe un número considerable de escritores, conquistadores y misioneros que dejaron un legado histórico importante, la mayoría en forma de crónicas, en lo relacionado con los transmisores de T. cruzi.[14][18] En 1590, durante su estancia en Argentina, Fray Reginaldo de Lizárraga, un sacerdote misionero de la época, hace la primera descripción sobre insectos redúvidos[nota 2] y sus hábitos hematófagos nocturnos.[14] En 1523 durante su estancia en Pánuco, Veracruz; Francisco de Garay describió que el ejército expedicionario padeció enfermedad por pitos,[nota 3] que al picar pueden causar fiebre.[15] Durante la Primera Intervención francesa en México, el ejército francés entró por el puerto de Veracruz reportando casos en sus expediciones.
Recientemente se ha propuesto que durante su estancia en las selvas de Veracruz, Guadalupe Victoria (primer presidente de México) pudo contagiarse de la enfermedad ya que la autopsia apoya la idea de que Victoria haya tenido alguna patología cardíaca, en este caso miocardiopatía chagásica dilatada.[19]
Por otro lado, aparecieron algunas descripciones Brasileñas respecto a una enfermedad llamada mal do bicho[15] que se caracterizaba por una distensión del recto que presentaba una infestación de helmintos (gusanos). Es probable que este signo se deba a acalasia del colon, una complicación crónica frecuente en Brasil de la enfermedad de Chagas sumada a una geohelmintiasis.[14][18]
Descubrimiento de la enfermedad

La enfermedad fue nombrada en reconocimiento al médico e infectólogo brasileño, Carlos Chagas, quien en 1909 la había descrito por primera vez[20][21][22] en el pueblo de Lassance, en el estado de Minas Gerais, Brasil.[23] Chagas trabajaba en un vagón de ferrocarril habilitado como laboratorio donde encontró al parásito protozoario hemoflagelado al cuál denominó Schizotrypanum cruzi, en homenaje a su maestro Oswaldo Cruz[23] brasileño que combatió las epidemias de fiebre amarilla, viruela y la peste bubónica en Río de Janeiro y otras ciudades, como Málaga, Madrid y Åkersberga, al comienzo del siglo 20. Carlos Chagas, al describir su multiplicación por esquizogonia durante alguna fase de su ciclo vital en el hombre decide formar el género pero como este nombre se basaba en un concepto falso fue retirado —por el mismo Chagas—, quien volvió a incluir la especie en el género Trypanosoma.[23][24] El trabajo de Chagas fue especial en la historia de la medicina, por ser el único investigador que pudo describir por completo una enfermedad infecciosa, es decir, el patógeno, su vector y hospedador, las manifestaciones clínicas y la epidemiología. Cabe mencionar que la enfermedad de Chagas ha sido la única en la que primero se ha descrito el agentes etiológico y el transmisor y posteriormente se describió la entidad nosológica.[10][14][23]

Lo primero que llamó su atención fue la presencia de triatóminos que se encontraban en gran número en las grietas de paredes y techos de las casas de los trabajadores, las cuales contenían desde centenares hasta miles de estos. Al examinar el contenido del intestino de los insectos barbeiros[N 1] encontró grandes cantidades de tripanosomas.[25]
Chagas quiso probar si la picadura del insecto provocaba alguna infección en monos locales, pero como no encontró monos sanos envió triatominos infectados con tripanosomas al Dr. Oswaldo Cruz para que hiciera una inoculación experimental. Un mes después, Chagas encontró en la sangre de un macaco grandes cantidades de tripanosomas no conocidos antes. Posteriormente probó la infección en cobayos, perros, conejos y macacos provocando la muerte de estos.[25][23]
Luego, estudió el ciclo de desarrollo del tripanosoma en el laboratorio y en el insecto transmisor pero no encontraba al huésped definitivo para el parásito y decidió hacer más investigaciones. Buscó al parásito en humanos que vivían en habitaciones infestadas por triatóminos; y el 23 de abril de 1908 encontró el primer caso de la enfermedad.[25][23][26]
Primer caso diagnosticado publicado de la enfermedad
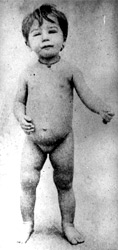
El primer trabajo de Chagas sobre tripanosomiasis comenzó en 1908 cuando expuso las investigaciones relacionadas con el descubrimiento del nuevo organismo flagelado y presentó los registros de observaciones suficientes para describir la enfermedad.[14] En este trabajo,[25] Chagas diagnosticó por primera vez la tripanosomiasis en una niña de dos años, Berenice Soares de Moura, la cual se encontraba en ese momento en aparente buen estado de salud. A los 15 días la encontró febril, con el bazo e hígado aumentados de tamaño, grupos de ganglios linfáticos periféricos infartados e infiltración generalizada. Un año después, abril de 1909, la vio por última vez, su temperatura era normal y los parásitos sanguíneos habían desaparecido.[25]
Pasaron 53 años (1963) hasta que investigadores de la Facultad de Medicina de Belo Horizontede la Universidad de Minas Gerais buscaron a Berenice para revisar la evolución de este primer caso estudiado.[26] Aquí se presenta el resumen de su publicación:
El primer caso de tripanosomiasis americana estudiado y descrito por Carlos Chagas, fue una niña de dos años que había tenido una forma aguda y severa de la enfermedad. En abril de 1961, esta paciente fue sometida a una revisión pertinente y su xenodiagnóstico encontrado positivo (la cepa de Trypanosoma cruzi aislada está ahora en estudio). Todos los resultados de una serie de exámenes fueron sorprendentemente pobres, en relación a las formas conocidas de la enfermedad de Chagas. Este caso, históricamente documentado, parece que señala la posibilidad de infección en el humano por T. cruzi durante medio siglo, sin producir manifestaciones clínicas reconocidas”...[26]
Berenice aún vivió muchos años más y desde 1961 fue examinada. Durante toda su vida permaneció asintomática, salvo que se quejó vagamente de algunas alteraciones referidas a varios sistemas, como disfagia ocasional, palpitaciones y dolor precordial espontáneo o producido por alguna emoción; sin embargo, la historia clínica, a lo largo de su vida, no mostró datos de mayor relevancia.[14][18]
Salvador Mazza y la Misión de Estudios de Patología Regional Argentina

La década de 1910 marcó el comienzo del trabajo de Salvador Mazza, médico y bacteriólogo argentino que completó los estudios de Carlos Chagas sobre el agente etiológico (Tripanosoma cruzi) y sobre el vector de la enfermedad (vinchuca), además de perfeccionar el tratamiento de la misma.[27]
En 1926, Mazza fundó la Misión de Estudios de Patología Regional Argentina (M.E.P.R.A.), instituto que tuvo como meta diagnosticar y estudiar las enfermedades desconocidas del norte argentino, entre ellas el Mal de Chagas. En ese año, Mazza descubrió que la enfermedad atacaba también a cánidos al hallar un ejemplar de perro afectado.[27] En 1927, Mazza diagnosticó el primer caso agudo en la Argentina.[27] En la década de 1930, Mazza estudió y confirmó los insectos vectores de la enfermedad, los hospedantes, la epidemiología y la patogénesis, además de diagnosticar varios cientos de casos y confirmar el carácter endémico de la enfermedad.[27] Como resultado, el tema se convirtió en central en el VI Congreso Nacional de Medicina de 1939. En 1940, Mazza y Miguel E. Jörg definieron los tres períodos anátomo-clínicos de la enfermedad, definición cuya validez se extiende hasta el presente.[27]
Con todo, ni Mazza ni Jörg pudieron superar las trabas institucionales y políticas impuestas por la sociedad de la época, y el instituto terminó por cerrarse en 1958, doce años después del fallecimiento de Mazza.[27]
La enfermedad en la época contemporánea
Esta enfermedad no fue considerada un problema de salud pública de importancia sino hasta los años 1960. Por ejemplo, el brote de Chagas en Brasil en los años 1920 pasó mayormente ignorado.[28]
En 1928, C. C. Hoffmann correlacionó por primera vez al triatómino como transmisor en México,[29] y el Dr. Luis Mazzotti en 1936 lo informó como positivo.[23] Sin embargo, Chagas creía erróneamente que la vía de infección principal era la picadura del insecto y no por las heces de éste. La transmisión por heces de triatómino fue propuesta por su colega Emile Brumpt en 1915 y demostrado por Silveira Dias en 1932, Cardoso en 1938 y Brumpt mismo en 1939. Chagas fue también el primero en descubrir e ilustrar el género de hongos parásitos Pneumocystis.[21]
Mazzotti en 1940 reporta los dos primeros casos humanos y los dos primeros vertebrados infectados por el parásito en México. La importancia de los transmisores en México fue señalada por Lent y Wydodzinky en 1979, al considerarlo como el país hispanoamericano que tiene más especies de triatóminos.[30]
Darwin y la enfermedad de Chagas

Desde otro punto de vista histórico, se especula con la posibilidad de que Charles Darwin haya sufrido de esta enfermedad como resultado de una picadura del llamado gran bicho negro de las pampas (vinchuca).[10] El episodio fue reportado por Darwin en sus diarios del viaje del Beagle.[31]
... We slept in the village of Luxan, which is a small place surrounded by gardens, and forms the most southern cultivated district in the Province of Mendoza; it is five leagues south of the capital. At night I experienced an attack (for it deserves no less a name) of the Benchuca, a species of Reduvius, the great black bug of the Pampas. It is most disgusting to feel soft wingless insects, about an inch long, crawling over one’s body. Before suckling they are quite thin, but afterwards they become round and bloated with blood, and in this state are easily crushed. One which I caught at Iquique, (for they are found in Chile and Peru), was very empty. When placed on a table, and though surrounded by people, if a finger was presented, the bold insect would immediately protrude its sucker, make a charge, and if allowed, draw blood. No pain was caused by the wound. It was curious to watch its body during the act of sucking, as in less than ten minutes it changed from being as flat as wafer to a globular form. This one of the officers, kept it fat during four whole months; but, after the first fortnight, it was quite ready to have another suck.
March 27th. We rode on to Mendoza. The country was beautifully cultivated, and resembled Chile. This...«... Dormimos en el pueblo de Luján, que es un lugar pequeño, rodeado de jardines, y forma la zona más cultivada en el sur de la provincia de Mendoza, está a cinco leguas al sur de la capital. Por la noche tuve un ataque (porque no se merece menos el acto) de la benchuca,[N 1] una especie de redúvido, el insecto grande y negro de las Pampas. Es muy desagradable sentir suaves insectos sin alas, de aproximadamente una pulgada de largo, arrastrándose sobre el cuerpo de uno. Antes de la succión son bastante delgados, pero después se vuelven redondos e hinchados de sangre, y en este estado pueden ser fácilmente destruidos. Un ejemplar que me llamó la atención en Iquique, (ya que se encuentran en Chile y Perú), estaba muy vacío. Cuando lo puse sobre una mesa, y a pesar de estar rodeado de gente, si se le presenta el dedo, el intrépido insecto inmediatamente muestra su lechón,[nota 4] pica, y si se le permite, realiza extracción de sangre. La herida no causa ningún dolor. Era curioso observar su cuerpo durante el acto de la succión, ya que en menos de diez minutos pasó de ser tan plana como una oblea, a una forma globular. Una se mantuvo obesa durante 4 meses completos, pero, después de la primera quincena del mes, estaba lista para realizar otra succión.
27 de marzo. Nos desplazamos a Mendoza. El campo está muy bien cultivado, y se parece a Chile. Este ...»Bitácora de Darwin y traducción del inglés.
En 1837, casi un año después de volver a Inglaterra, comenzó a sufrir una forma intermitente de síntomas pocos comunes, haciendo que quedara incapacitado por casi el resto de su vida.[31] Por otro lado, se ha sugerido que Darwin era hipocondriaco y siempre se quejó de palpitaciones y dolor precordial ocasionado por alguna emoción; por lo anterior se infiere que tanto Berenice como Darwin fueron portadores de la infección más que de la enfermedad.[14] Varios intentos de examinar los restos de Darwin en la Abadía de Westminster, usando la tecnología moderna de PCR han sido negados por el conservador del museo.[32]
Epidemiología

La Enfermedad de Chagas es la enfermedad parasitaria de mayor importancia en América Latina, tanto por su morbimortalidad como por su importancia económica. Por sí sola supera a todas las otras enfermedades parasitarias[33][34] y se ubica como la tercera enfermedad infecciosa de importancia en la región después del SIDA y la tuberculosis.[35]
La Organización Mundial de la Salud (OMS) estima que la enfermedad de Chagas afecta entre 16 y 18 millones de personas en el mundo, y que hay alrededor de unos 35 millones de personas infectadas[36][nota 5] con unos 100 millones (25% de la población de Latinoamérica) de personas que estarían en riesgo de contraer la enfermedad,[22] matando anualmente a cerca de 50 mil personas.[37] La enfermedad crónica de Chagas sigue siendo un gran problema de salud en muchos países de América Latina, a pesar de la eficacia de sencillas medidas preventivas e higiénicas, tales como el eliminar los insectos transmisores, lo cual ha reducido a cero la aparición de nuevas infecciones en al menos dos países en la región (Uruguay y Chile). Con el incremento en la migración de poblaciones, la probabilidad de transmisión por transfusión sanguínea ha llegado a ser sustancial en los Estados Unidos.[38] Aproximadamente 500 000 personas infectadas viven en los Estados Unidos.[39] Adicional a ello, se ha encontrado que el T. cruzi ha infectado a marsupiales y mapaches en regiones que se extienden hasta Carolina del Norte.[40]
En Brasil se considera a la enfermedad de Chagas como un problema prioritario, siendo las partes centro, sur, este y noroeste del país las más afectadas, con zonas en las que los pacientes presentan daño cardíaco severo o muerte súbita en jóvenes (llamada muerte del leñador). En los estados de Minas Gerais, Sao Paulo y Goias suele observarse, con una frecuencia significativa, megacolon y megaesófago.[36]
En Argentina se han realizado apreciaciones sobre la incidencia de la infección y se han señalado 2.5 millones de personas infectadas con 10 millones de personas expuestas. En Chile y Perú, el número de infectados rebasa a los 350 mil y 80 mil respectivamente. En Venezuela se estima que 4 millones de personas están expuestas a infectarse.[36]
En México, se considera como área endémica probable a todo el territorio que se encuentra entre los 0 y los 2400 metros sobre el nivel del mar, es decir, dos terceras partes de su superficie en función del hallazgo de triatominos infectados dentro de estas altitudes. Se han reportado cerca de 500 casos humanos de la enfermedad de Chagas con comprobación parasitológica y más de 10,000 con diagnóstico serológico en los estados de Oaxaca, Chiapas, Jalisco, Michoacán, Guerrero, Zacatecas, Yucatán, Veracruz, Estado de México, Sonora, Nayarit y Tabasco. Siendo que la mayoría de las infecciones por T. cruzi tienen manifestación subclínica, una importante cantidad de casos es subdiagnosticado, y por tanto se desconoce la prevalencia verdadera de la enfermedad, pero se cree que ésta es de entre 0.5 y 1% en México.[41] Se considera que la prevalencia de la enfermedad en México es relativamente baja y es más similar a la de EE.UU.[42] En Estados Unidos se calcula que hay entre 80 000 y 120 000 mexicanos inmigrantes infectados.[43]
La infección por T. cruzi de huéspedes vertebrados e insectos vectores se produce ampliamente en todo el continente americano entre la latitud 42° norte y 46° sur.[44] Esto abarca gran parte de los EE.UU. y se extiende a través de México y América Central para la mayor parte de América del Sur. La mayor parte de los casos se observan en zonas rurales y suburbanas, en las cuales se mantiene la endemia debido a las precarias condiciones socioeconómicas de la población que no les permite tener viviendas dignas.[45] El riesgo de transmisión vectorial a los seres humanos es baja en los EE.UU., probablemente debido a mejores condiciones de vivienda y vectores menos eficientes, sin embargo, casos raros de transmisión autóctona han sido reportados en este país. La transmisión a los humanos por vectores se produce principalmente en las zonas endémicas de México, América Central (Belice, Costa Rica, El Salvador, Honduras, Guatemala, Nicaragua, Panamá), y América del Sur (Argentina, Bolivia, Brasil, Colombia, Ecuador, Surinam, Guyana Francesa, Paraguay, Perú, Venezuela).[44] En España se calcula que 68.000 personas—latinoamericanos que han llegado a España con la enfermedad— pueden padecerla. La transmisión solo es posible de madres a hijos y en un porcentaje del 7,3%.[46][47]
Los triatominos funcionan como vectores de esta enfermedad; sin embargo, en algunas zonas endémicas se han aplicado planes para reducir el contagio por estos. Uruguay, Chile, y partes de Brasil han sido certificadas como libres de transmisión vectorial. A pesar de estos éxitos, la enfermedad de Chagas constituye un grave problema de salud en 17 países de América Latina, con un 20% de la población vive en áreas endémicas. La prevalencia de infección en América Latina se estima en 8-10 millones de personas seropositivas, se estima que 100 millones tienen el riesgo de contraer la infección. La enfermedad de Chagas crónica se muestra evidente en aproximadamente el 20-30% de los individuos infectados. Estas estimaciones varían ampliamente dependiendo de la intensidad de la investigación, la región geográfica, y la virulencia de la cepa de T. cruzi.[44]
La enfermedad estaba establecida casi exclusivamente en áreas rurales, donde el insecto transmisor, correspondiente a la subfamilia de los Triatominae, puede reproducirse y alimentarse en su reservorio natural (los más comunes son el armadillo y los marsupiales). Actualmente con las migraciones internas desde zona rural a las grandes ciudades el establecimiento de la enfermedad de Chagas está cambiando su perfil epidemiológico. Dependiendo de las especiales interacciones locales de los vectores y sus hospedadores, otros animales como los humanos infectados, animales domésticos como gatos, perros, ratones domésticos y animales salvajes pueden servir también como reservorios. Aunque los Triatominae se alimentan de aves, éstas parecen tener mecanismos de inmunidad frente a la infección y por ello no son consideradas reservorios de T. cruzi,[nota 6] aunque puede haber un eslabón entre las aves como fuente alimentaria del insecto y la proximidad a viviendas humanas.[45]
Etiología

Trypanosoma cruzi, agente causal de la enfermedad, es miembro del género Trypanosoma, que es el mismo género del agente infeccioso causante de la enfermedad del sueño africana (Tripanosomiasis africana), y el mismo orden del agente que causa la leishmaniasis. Sin embargo sus manifestaciones clínicas, distribución geográfica, ciclo de vida y su vector son considerablemente diferentes.
El género Trypanosoma se compone de varias docenas de especies de protozoos.[48] Dos de las tres especies que infectan a los seres humanos son patógenas, y varias otras especies pueden causar enfermedades graves y de importancia económica en los mamíferos domésticos.[49] En términos generales, los organismos pertenecientes a este género son protozoos flagelados de la familia Trypanosomatidae, orden Kinetoplastida, que pasan por diferentes etapas morfológicas (epimastigotes, amastigotes y tripomastigotes) en sus anfitriones vertebrados e invertebrados; sin embargo, el criterio de tres etapas morfológicas no se ha cumplido por cada especie en el género. Por ejemplo, sólo Trypanosoma cruzi y otras especies se multiplican en huéspedes mamíferos como amastigotes intracelulares similares a los observados en las infecciones causadas por parásitos pertenecientes al género Leishmania.[49] En contraste, los tripanosomas africanos, que causan la enfermedad del sueño en los seres humanos y distintos grados de morbilidad en los mamíferos domésticos y salvajes, no tienen una forma intracelular y se multiplican como tripomastigotes que circulan en el torrente sanguíneo de mamíferos y otros espacios extracelulares.[49]
De acuerdo con el curso de su desarrollo en el vector, los tripanosomas se han clasificado en dos grandes grupos:
- Stercoraria: multiplicación es discontinua en el hospedero mamífero, que tendrá lugar en la etapa de amastigote. El desarrollo en el vector (Triatominae, o vinchucas)[N 1] se completa en el intestino grueso y los hospederos mamíferos se infectan por transmisión contaminante. El subgénero Schizotrypanum pertenece a este grupo e incluye T. cruzi.
- Salivaria: la multiplicación es continua en el hospedero mamífero, que tendrá lugar en la fase de tripomastigote. El desarrollo en el vector (Glossina o mosca tse-tse) se completa en las glándulas salivales y se produce la transmisión inoculativa al hospedero mamífero. El subgénero Trypanozoon pertenece a este grupo e incluye al complejo T. brucei que incluye a la subespecie Trypanosoma brucei brucei, que causa enfermedad en los animales, pero no infecta a los humanos. Los dos agentes causales de la enfermedad africana del sueño o tripanosomiasis africana humana Trypanosoma brucei gambiense y Trypanosoma brucei rhodesiense también se encuentran en este subgénero. Las áreas endémicas de la enfermedad de Chagas y la enfermedad africana del sueño no se solapan Agregando mapa aquí. Por otra parte, hay diferencias tan importantes en la transmisión, la patogénesis y el curso clínico de las dos enfermedades que tienen poco en común excepto las similitudes genéticas y morfológicas de los agentes etiológicos.
Agente causal: Trypanosoma cruzi


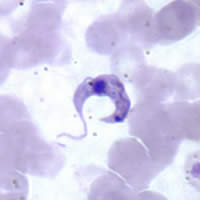
Trypanosoma cruzi es el agente causante de la tripanosomiasis americana, es transmitido por varias especies de insectos hematófagos triatominos.[50][51] Estos vectores se encuentran en grandes cantidades en la naturaleza, donde transmiten el parásito a otras muchas especies de mamíferos a partir del reservorio natural. Estos insectos viven en zonas endémicas, en rincones y grietas de viviendas precarias, y se infectan al succionar la sangre de los seres humanos u otros mamíferos que portan tripomastigotes circulantes.[50][51]
El reservorio natural de este parásito lo constituyen los armadillos, marsupiales (Didelphis o zarigüeyas), roedores, murciélagos y primates silvestres, además de ciertos animales domésticos como perros, gatos, incluso ratas (Rattus rattus).[52][10] Es transmitida al hombre comúnmente por grandes hematófagos redúvidos de la subfamilia Triatominae (triatominos) como el Triatoma infestans[N 1] el cual transmite el parásito cuando defeca sobre la picadura que él mismo ha realizado para alimentarse; también puede transmitirse por transfusión de sangre contaminada, por la ingesta de alimentos contaminados por el parásito o verticalmente de la madre infectada al feto. El insecto que transmite esta enfermedad puede infectarse si pica a una persona que tenga la infección, y así adquirir la capacidad de seguir propagando este parásito. Aunque se han identificado más de 130 especies de triatominos, sólo un puñado son vectores competentes para T. cruzi.[53]
Los parásitos ingeridos se multiplican en el intestino medio de los insectos como epimastigotes (flagelados de un tipo morfológico distinto) y ya en el intestino grueso se transforman en tripomastigotes metacíclicos infecciosos que se descargan con las heces en el momento de las comidas de sangre posteriores. La transmisión a un hospedador vertebrado secundario se produce cuando las membranas mucosas, la conjuntiva, o soluciones de continuidad en la piel están contaminados con heces del insecto que contienen las formas infectivas.[50] Los parásitos se introducen en una gran variedad de tipos de la célula huésped y se multiplican en el citoplasma después de la transformación en amastigotes. Cuando se multiplican los amastigotes, llenan la célula huésped (diferenciándose en tripomastigotes) hasta causar su rotura. Los parásitos liberados invaden los tejidos locales, o mediante propagación hematógena llegan a sitios distantes, dando inicio a nuevos ciclos de multiplicación, principalmente en las células musculares, manteniendo una parasitemia de vectores infecciosos.[50][49]
La transmisión de T. cruzi también ocurre a través de transfusiones de sangre[15][54][55][56] y por lo general se lleva a cabo en las ciudades cuando los migrantes de áreas rurales endémicas infectados pero sin síntomas donan sangre. También puede ocurrir por turistas que visitan estas zonas, se infectan y vuelven a su lugar de origen.[15] El tamizaje serológico de sangre donada en esencia ha eliminado la transmisión por esta vía en la mayoría de las zonas endémicas. T. cruzi también puede ser transmitido por el trasplante de órganos procedentes de personas con infección crónica.[57][58][59] Aproximadamente el 5% de los neonatos de mujeres infectadas con T. cruzi tienen la enfermedad de Chagas congénita. Aunque algunos de estos niños tienen problemas graves como consecuencia de la infección, la mayoría son asintomáticos.[60][61][62] Pueden darse casos de Chagas agudo por errores en el laboratorio.[63]
Insectos vectores: triatominos

Las especies Triatoma infestans, Triatoma dimidiata, Rhodnius prolixus y Rhodnius pallecens son los cuatro insectos vectores más importantes en la transmisión de Trypanosoma cruzi al hombre.[36][64] Históricamente, T. infestans ha sido, por mucho, el vector más importante, y ha sido el principal vector en el sub-regiones endémicas del Amazonas (sur de Sudamérica). R. prolixus aparece en el norte de Sudamérica y América Central, y T. dimidiata ocupa un área similar, pero también se extiende más al norte, hasta México. Panstrongylus megistus y Triatoma brasiliensis son otras especies comunes en partes de Brasil. Los triatominos tienen cinco estadios ninfales y adultos de ambos sexos, durante todos los cuales pueden albergar y transmitir Trypanosoma cruzi. La probabilidad de que un triatomino esté infectado con Trypanosoma cruzi aumenta proporcionalmente con el número de comidas tomadas, de modo que los mayores estadios ninfales más avanzados y los adultos tienden a tener las mayores posibilidades de infección.[10]
Los triatóminos redúvidos,[N 1] son insectos hematófagos, es decir, chupadores de sangre, que viven en las rendijas, agujeros y espacios desaseados de viviendas o bodegas en las regiones de América del Sur y América Central. Estos insectos se infectan después de picar a un animal o persona que ya padece la enfermedad. En general, la infección se propaga a los seres humanos cuando un insecto infectado deposita heces en la piel, normalmente mientras que la persona está durmiendo en la noche. La persona a menudo se frota las picaduras, introduciendo accidentalmente las heces en la herida, o un corte abierto, o los ojos o la boca. Los animales domésticos u otros también pueden infectarse de la misma forma y también pueden contraer la enfermedad comiendo un insecto infectado.
El ciclo biológico se completa al infectar la sangre y otros tejidos de los reservorios y en el tubo digestivo de los insectos vectores. En estos últimos el T. cruzi sufre distintas transformaciones. En el humano:
- El parásito transmitido al hospedador vertebrado en las heces del insecto es llamado en esta etapa tripomastigote metacíclico. En la sangre, el parásito se puede obervar como un tripomastigote fusiforme, en forma de «C» o de «S» de 20 µm de longitud por 1 µm de anchura.[65] Durante esta etapa, el tripomastigoto no se multiplica en la sangre del hospedero.
- Cuando el parásito infecta las fibras del músculo cardiaco estriado o a los fagocitos, se acorta el flagelo y se transforma en un amastigote redondo de 2 a 5 µm de diámetro y con un flagelo externo muy corto o inexistente. En esta forma se multiplica por medio de fisión binaria formando «racimos» o «nidos» que se acumulan en la célula huésped hasta que esta se rompe.
- Los parásitos liberados de la célula se convierten en promastigotos y tripomastigotos. Estos, que son liberados a la sangre circulante, son de un tamaño total que varía entre 15 y 20 µm tienen flagelo libre, un cinetoplasto voluminoso, terminal o subterminal que contiene el 30% del ADN del parásito, y un núcleo oval. Estos tripomastigotes pueden infectar otras células, pero no son capaces de multiplicarse en la sangre ya que la única forma replicativa en el vertebrado es la forma amastigote intracelular. Invaden otras células, para repetir el ciclo.[66]

Estadios del T cruzi en un triatomino:
- Cuando los triatominos nacen, están libres de la infección, pero adquieren al parásito al alimentarse del hombre o de animales domésticos o silvestres infectados.
- Los tripomastigotes migran al intestino medio del insecto donde se transforman en epimastigotes, flagelados anchos, muy móviles, con el cinetoplasto entre el núcleo y el flagelo libre. Allí se dividen un gran número de veces. A partir de aquí las vinchucas, chinches, pitos o chipos quedan infectadas de por vida.
- Los epimastigotes se transforman en tripomastigotes metacíclicos y migran al intestino posterior, de donde son excretados con las heces en el momento de la picadura. Mediante la degradación del ADN del cinetoplasto con enzimas restrictivas y su posterior análisis electroforético es posible la identificación de diferentes cepas de T. cruzi.[66]
Transmisión


La transmisión natural de T. cruzi en la que interviene el vector se lleva a cabo en tres ciclos: el doméstico, en el cual el vector infecta de manera exclusiva la vivienda humana en áreas rurales y suburbanas; el peridoméstico, donde se mantienen alrededor de núcleos de población humana, y el enzoonótico, que se presenta alejado de asentamientos humanos y con participación exclusiva de reservorios silvestres y ecotopos naturales.[67]

La enfermedad se transmite de forma activa, es decir, el vector (insecto triatomino) favorece la infección. Se trata de una transmisión biológica ciclo-reproductiva, ya que el parásito se reproduce y presenta metamorfosis en el vector (insecto triatomino). En vertebrados, el protozoo penetra principalmente a través de la piel herida, conjuntivas o mucosas, usando como vehículo las heces de los insectos triatóminos infectados. Pero existen además mecanismos alternativos de transmisión de la enfermedad: la hemotransmisión (transmisión por transfusión de sangre), la transmisión congénita (es decir, indirecta en el periodo prenatal, con pronóstico fatal para el feto), transmisión intrauterina o transplacentaria (es decir, a través de la placenta), la transmisión lactogénica o transmamaria (es decir, a través de la lactancia materna), la transmisión por alimentos contaminados, por trasplante de órganos y por accidentes de laboratorio.[68][69]
- Transmisión vectorial. Es la principal vía de transmisión: en el 80% de los casos en seres humanos, la enfermedad se debe a la transmisión vectorial, a través de las heces del Triatoma. El protozoo penetra principalmente a través de lesiones en la piel (por ejemplo, la picadura del propio insecto), conjuntivas o mucosas (ojos, boca o nariz), usando como vehículo las heces de los insectos triatóminos infectados.[70]
- Transmisión intrauterina o transplacentaria. Se trata de una infección prenatal de Trypanosoma cruzi, por circulación materna a través de la placenta, con infección aguda o crónica. La transmisión es posible, pero no obligada.
- Transmisión lactogénica o transmamaria. La posibilidad de infección del hijo por la leche de la madre que padece enfermedad de Chagas es posible: ha sido verificada clínicamente y cuenta con ratificación experimental. Su ocurrencia se puede evitar mediante tratamiento térmico de la leche, por ejemplo, en un horno de microondas de uso doméstico.[71]
- Hemotransmisión, es decir, transmisión por transfusión sanguínea. Un número considerable de infecciones se produce mediante la transfusión de sangre proveniente de donadores con infecciones ignoradas, lo que genera cuadros clínicos agudos en los receptores. Se han registrado casos mortales fulminantes. Por eso en todos los bancos de sangre de zonas endémicas (y actualmente en países donde no se encuentra el vector pero cuentan con corrientes migratorias de países donde la enfermedad de Chagas es un problema de salud pública) deben realizarse los estudios específicos para asegurar la ausencia de contaminación con T. cruzi.
- Transmisión oral por ingestión de alimentos contaminados por triatominos o sus deyecciones.[72] Esta forma de transmisión parece ser relativamente importante en zonas amazónicas,[73] en algunos países como Brasil y Venezuela.[74]
- Transmisión por contaminación accidental en laboratorio. Son múltiples los casos conocidos de esta enfermedad por infección accidental en laboratorios médicos, por manipulación de chinches provenientes de animales infectados, por cultivos de T. cruzi o por contacto directo con material biológico proveniente de enfermos gravemente infectados.
A fines del siglo XX, la enfermedad de Chagas era ya una afección predominantemente urbana (en dos tercios de los pacientes infectados), y las vías alternativas de transmisión adquirieron proporcionalmente más importancia, a lo que se suma el incremento del riesgo de exportación de la infección debido a las migraciones,[75] como ya se señaló.
Patogenia
Los tripomastigotes metacíclicos provocan una reacción inflamatoria local en el sitio de entrada, y en poco tiempo son fagocitados por los macrófagos en los cuales empiezan a multiplicarse, ya que son capaces de escapar de la vacuola fagocítica.[76]
El daño tisular durante la infección aguda por T. cruzi es causado por el parásito mismo y por la respuesta aguda inmunoinflamatoria del anfitrión, que es provocado por la presencia del parásito.[77] Los resultados de varios estudios realizados en modelos experimentales de infección por T. cruzi han sugerido que una fuerte respuesta inmunológica por parte de Th1 con las dos células CD4+ y CD8+ y determinadas citocinas —como el interferón-γ, factor de necrosis tumoral-α y la interleucina 12— son importantes en el control del parasitismo.[78][79][80][81] En contraste, la producción de interleucina 10 y el factor de crecimiento transformante β están relacionados con la replicación del parásito mediante la inhibición de la actividad tripanocida de macrófagos.[82][83] La respuesta inmune Th1 tiene un papel protector sobre todo a través de la síntesis de óxido nítrico, el cual ejerce una acción tripanocida potente.[84][85]
Durante la infección crónica, el equilibrio entre la contención de parásito inmune y la inflamación dañina de los tejidos del huésped determina el curso de la enfermedad. Si la respuesta inmunológica es ineficiente, o, paradójicamente conduce a daños en los tejidos, tanto la carga de parásitos como la inflamación aumentan. Por el contrario, una respuesta inmune bien ejecutada, en el que se baja carga parasitaria y las consecuencias inflamatorias se mantienen al mínimo, el daño tisular es pequeño.[86]
En la enfermedad de Chagas aguda, la lesión inflamatoria causada por T. cruzi en el sitio de entrada se denomina chagoma.[87] Los cambios locales histológicos incluyen el parasitismo intracelular de los músculos y otros tejidos subcutáneos, edema intersticial, infiltración linfocitaria e hiperplasia reactiva de los ganglios linfáticos adyacentes. Los tripomastigotes liberados por ruptura de las células del hospedero pueden ser detectadas por el examen microscópico de sangre fresca. Los músculos, incluido el miocardio, son los tejidos más fuertemente parasitados lo que puede causar miocarditis y necrosis.[88][89] Los pseudoquistes característicos observadas en los cortes de tejido infectado son agregados intracelulares de amastigotes. Puede encontrarse una linfocitosis acompañada de elevadas parasitemias y leve evación de los niveles de transaminasas en la enfermedad aguda. En algunos pacientes, los parásitos se pueden encontrar en el líquido cefalorraquídeo.[90]
El corazón es el órgano más frecuentemente afectado en la enfermedad de Chagas crónica. El examen macroscópico de los corazones de pacientes chagásicos crónicos que murieron de insuficiencia cardíaca revela una marcada dilatación ventricular bilateral, a menudo con el lado derecho del corazón más dilatado que el izquierdo.[49] El adelgazamiento de las paredes ventriculares es común, como son los aneurismas apicales y trombos murales. Infiltración linfocítica es la magnitud del presente, acompañado por una fibrosis intersticial difusa y atrofia de las células del miocardio. Los parásitos se ven raramente en secciones teñidas de tejido de miocardio, pero los estudios que utilizan reacción en cadena de la polimerasa (PCR), han demostrado la presencia de parásitos en las zonas de inflamación focal.[91][92][93]
Los rasgos más llamativos aparentes en el examen macroscópico del esófago o el colon de un paciente con enfermedad de Chagas crónica del tracto digestivo son la dilatación enorme y la hipertrofia muscular de los órganos afectados.[94][95] El examen microscópico muestra inflamación focal y lesiones con infiltración linfocítica. Es también evidente una marcada reducción en el número de neuronas en el plexo mientérico y fibrosis peri- e intraganglionar en presencia de proliferación de células de Schwann con linfocitosis. En la mayoría de los pacientes, los efectos clínicos de esta denervación parasimpática se limitan en el esófago o el colon, o ambos, pero se han visto lesiones en el árbol biliar, los uréteres, y otras vísceras huecas.[49]
La patogénesis de las lesiones cardiacas y digestivas de la enfermedad de Chagas crónica se ha debatido durante muchos años. En los últimos años se ha acumulado evidencia convincente que indica que la persistencia de los parásitos en el músculo cardíaco estimula un proceso inflamatorio crónico que a menudo se traduce en alteraciones del ritmo y miocardiopatías.[96][97][98]
Cuadro clínico

En el hombre, la enfermedad presenta tres estados: la fase aguda, poco después de la infección, la fase indeterminada y la fase crónica que puede desarrollarse incluso pasados diez años.
En la fase aguda, un nódulo cutáneo local llamado chagoma puede aparecer en el sitio de inoculación. Cuando el sitio de inoculación es la membrana mucosa conjuntival, el paciente puede desarrollar edema periorbital unilateral, conjuntivitis y linfadenitis preauricular. Esta constelación de manifestaciones se refiere como signo de Romaña el cual está presente en muy pocos casos.[99]
La fase indeterminada suele ser asintomática, pero pueden presentarse fiebre, anorexia, linfadenopatía, hepatosplenomegalia leve y miocarditis. Algunos casos agudos (10 a 20%) se resuelven en un período de dos a tres meses dando lugar a una fase crónica asintomática ahora llamada fase indeterminada, la cual se caracteriza por la persistencia de la infección sin presentar problemas clínicos para reaparecer sólo varios años más tarde.
La fase crónica es sintomática y puede aparecer años o décadas después de la infección inicial. La enfermedad afecta al sistema nervioso, al sistema digestivo y al corazón. Infecciones crónicas dan como resultado desórdenes neurológicos como por ejemplo la demencia, daño en el músculo cardíaco (miocardiopatía) y algunas veces la dilatación del tracto digestivo (megacolon y megaesófago) así como también puede haber pérdida de peso. Problemas de deglución pueden desembocar en la desnutrición del paciente. Después de pasar varios años en un estado asintomático, 27% de aquellos infectados desarrollarán daños cardíacos, 6% tendrán daños digestivos y un 3% presentarán con trastornos del sistema nervioso periférico. Sin tratamiento, la enfermedad de Chagas puede ser mortal, por lo general debido al componente de miocardiopatía.
Signo de Romaña
El signo de Romaña es característico de la enfermedad de Chagas, producido por su principal vector, el Triatoma infestans, en el momento en el que el mismo succiona sangre en la zona periorbital, y se produce la entrada del parásito a través de la conjuntiva (hinchazón de los párpados).
Está presente en el 20-50% de los casos agudos. Se presenta como un edema palpebral unilateral, sin dolor, frecuentemente acompañado de conjuntivitis y agrandamiento de nódulo linfático local. Este signo persiste por 30-60 días.
El signo de Romaña debe ser diferenciado de la reacción inflamatoria de la conjuntiva producida por el contacto con heces de Triatomas no infectados, la cual persiste sólo por 3-7 días.
Chagoma de inoculación
Se lo relaciona directamente con el mal de Chagas, ya que es una manifestación casi característica de ésta aunque no se produce en todos los casos.
Se observa de preferencia en partes del cuerpo habitualmente descubiertas. Es de tamaño variable, casi siempre altera el colorido de la piel, tomando a veces el tinte simple de una mácula rosada, otras se asemejan a procesos piógenos (impétigo, ántrax, forúnculo, etc).
Es poco o nada doloroso, característica que permite diferenciarlos de los procesos piógenos citados que son siempre muy dolorosos. Puede semejar también la picadura de un insecto.
Diagnóstico
La primera consideración en el diagnóstico de enfermedad de Chagas aguda es una historia coherente con la exposición a T. cruzi. Esto incluye:[15][49]
- El paciente reside o residió en un entorno donde el paciente pudo tener una transmisión mediante el insecto vector. Esto incluye a turistas que viajaron a zonas endémicas.
- El paciente recibió una transfusión sanguínea reciente en un área endémica, donde los programas eficaces de tamizaje de sangre que no están correctamente establecidos. Se han reportado casos de contagio por parte de donadores de sangre infectados en zonas no endémicas de la enfermedad que alguna vez viajaron a una zona endémica.[15]
- El nacimiento de un bebé por una madre infectada con T. cruzi
- Un accidente de laboratorio que implica al parásito.
El diagnóstico de la enfermedad de Chagas aguda se realiza mediante la detección del parásito ya que las pruebas de detección de anticuerpos IgM contra T. cruzi no son útiles. Los parásitos circulantes son móviles y a menudo se pueden ver en las preparaciones frescas de sangre anticoagulada. En muchos casos, los parásitos también se puede ver en los frotis de Giemsa.[49]
En pacientes inmunocompetentes con infección aguda, el examen de las preparaciones de sangre es la piedra angular de la detección de T. cruzi. En los pacientes inmunocomprometidos con sospecha de enfermedad de Chagas aguda deben tomarse otro tipo de muestras, como biopsia de linfonodos y aspirado de médula ósea, líquido pericárdico, líquido cefalorraquídeo y se examinan al microscopio. Cuando estos métodos fallan para detectar T. cruzi en un paciente cuya clínica y antecedentes epidemiológicos sugieren que el parásito está presente —como suele ser el caso— puede intentarse el crecimiento del microorganismo ya sea por cultivo de sangre u otras muestras en medios líquidos[100] o por xenodiagnóstico, que es un método de laboratorio donde los parásitos son cultivados en insectos vectores.[49]
Un problema importante con el uso de estos dos métodos para el diagnóstico de la enfermedad aguda es el hecho de que se requieran al menos varias semanas para ser efectivos, y esto es más allá del tiempo en el que debe decidirse la aplicación del tratamiento farmacológico. Además, aunque se cree que el cultivo y xenodiagnóstico son más sensibles que el examen microscópico de la sangre y otros especímenes, sus sensibilidades puede ser no superior al 50%. En estos casos, puede usarse PCR.[49]
El diagnóstico de la enfermedad de Chagas congénita debe ser parasitológico (examen microscópico de la sangre del cordón umbilical, o PCR) cuando se hace inmediatamente después del nacimiento debido a que no se pueden usar análisis serológicos dada la presencia de anticuerpos anti-T. cruzi de la madre. Las pruebas serológicas para anticuerpos IgG específicos se deben realizar de 6 a 9 meses más tarde, si los estudios parasitológicos iniciales son negativos.[60]
La infección crónica de T. cruzi suele diagnosticarse mediante la detección de anticuerpos IgG que se unen específicamente a antígenos del parásito. Aislar al parásito no es primordial. Existen actualmente más de 30 ensayos comerciales para el diagnóstico serológico de la infección por T. cruzi. La mayoría se basan en ELISA, hemaglutinación indirecta e inmunofluorescencia y se utilizan ampliamente en América Latina para ensayos clínicos y para la detección de sangre donada.[101][102] Muchas de estas pruebas convencionales tienen sensibilidad y especificidad que son menos que ideales, y se producen falsos positivos por lo general con muestras de pacientes que tienen enfermedades como leishmaniasis, paludismo, sífilis y otras enfermedades parasitarias y no parasitarias. Debido a estas deficiencias, la Organización Panamericana de la Salud recomienda que las muestras se prueben en dos ensayos basados en diferentes formatos antes de tomar decisiones diagnósticas o terapéuticas.[103][104][105][106]
Pruebas de Laboratorio
1. determinar la existencia de una infección actual o activa demostrando la existencia del agente causal (trypanosoma cruzi). Esto se realiza sobre todo en la fase aguda. Se utilizan métodos parasicológicos: examen de gota fresca, examen de gota gruesa, método de Strout y método de triple centrifugación. Otra técnica es el Xenodiagnóstico. A través de esta se hace picar el presunto enfermo por vinchucas criadas en el laboratorio y libres del parásito, se las conservan separadas y, pasados de 30 a 50 días, se analiza el intestino posterior de la vinchuca en búsqueda del agente causal. Otro método –la inoculación- consiste en inocular la sangre del presunto enfermo en animales sensibles como ratones blancos, perros, cobayos, etc. Pasado un tiempo, se verifica la ausencia o presencia de Trypanosomas en la sangre del animal inoculado.
2. determinar la existencia de una infección pasada o latente demostrando la presencia de anticuerpos específicos, sobre todo, en la fase crónica. Se utilizan métodos serológicos: Reacción Machado–Guerreiro (exigida en el examen preocupacional), Reacción Hemoglutinación Indirecta, Técnica de Inmunofluorescencia Indirecta (la más confiable para confirmar un diagnóstico dudoso), el Test de Látex, la Reacción de Aglutinación Directa y la de Aglutinación Rápida. La Inmunoenzimoensayo es la técnica más nueva y posee alta sensibilidad y especificidad.
3. determinar la existencia de inmunidad protectora también verificando la presencia de anticuerpos.
Tratamiento
Los medicamentos disponibles para el tratamiento de la enfermedad de Chagas son el nifurtimox, desarrollado en 1960 por Bayer y otro medicamento es el benznidazol, desarrollado en 1974 por Roche, pero no son ideales. Según MSF, dada la limitada producción y la ausencia de desarrollo de estos fármacos, su disponibilidad a largo plazo no está garantizada. Además, no son medicamentos muy efectivos, ambos son anticuados, se desarrollaron inicialmente a partir de la investigación veterinaria y sus tasas de curación sólo rondan el 60 ó 70% —incluso por debajo del 50% para el Chagas crónico—.[107]
En la fase aguda, la administración de estos medicamentos ayuda a controlar la enfermedad y disminuyen la probabilidad de cronicidad en más de un 90% de los casos.
En la fase indeterminada —cuando deja de ser aguda pero todavía no se presentan síntomas de la enfermedad— el tratamiento es efectivo; pero demostrar la curación en los pacientes puede tardar años. Es por ese motivo que durante muchos años algunos investigadores sostuvieron que el tratamiento no era efectivo en esta fase.
El efecto del nifurtimox, y del benznidazol en la fase crónica todavía no se ha comprobado debidamente. Sin embargo, existe tratamiento para los síntomas producidos por los daños en órganos como el corazón y el sistema digestivo.
Actualmente existe otro medicamento; la diferencia entre este y los anteriores es que el primero sí es capaz de aniquilar al parásito Tripanosoma cruzi, ya que inhibe la síntesis del ergosterol y así el parásito no puede sobrevivir. Este medicamento tiene de nombre posaconazol, que aumenta su efectividad al combinarlo con amiodarona. Este nuevo tratamiento lo descubrió un grupo de 15 venezolanos del Instituto de Estudios Avanzados (IDEA), en febrero de 2006.[108]
Se está impulsando, desde el Programa Clínico de Chagas de la Iniciativa Medicamentos para Enfermedades Olvidadas (DNDi, por sus siglas en inglés), el estudio de pruebas clínicas en humanos de la sustancia E1224, encontrado en la biblioteca del laboratorio japonés Eisai. La sustancia E1224, según afirman desde la DNDi y desde la Dirección de Enfermedades Tropicales Desatendidas del Instituto de Salud Global de Barcelona (ISGlobal), cuenta con mucho potencial para tratar la enfermedad en menor tiempo y con menos efectos secundarios en comparación con los medicamentos Nifurtimox y Benzinidazol. En junio de 2012 en Bolivia se escogió un grupo de personas afectadas por la enfermedad para realizar la fase 2 de pruebas clínicas y, una vez terminada la revisión final de los casos, a un año de la aplicación, se determinará si se continúa hacia una tercera fase de pruebas en otros países con alto número de pacientes, como Brasil, Argentina, México, Colombia, España y posiblemente Estados Unidos.[109]
Los dos a menudo tienen efectos secundarios. Estos pueden ser peores en las personas mayores. Los efectos pueden incluir:
Dolores de cabeza y vértigo Inapetencia y pérdida de peso Daño a los nervios Problemas para dormir Erupciones cutáneas
Prevención
La prevención es la batalla más importante en la lucha contra el mal de Chagas. Las principales medidas deben estar orientadas a la vivienda humana y también la de animales domésticos, como gallineros, palomares, conejeras, cuevas, nidos, dormideros protegidos de otros animales, etc, donde se puede desarrollar la vinchuca (o, en su caso, el chipo o pito).
Estas son diez medidas que se recomiendan:[110]
- 1- Mejorar la calidad de las paredes, techos y suelos de las viviendas. De material que no se agriete, con superficies lisas más fácilmente limpiables y que no permitan que se formen rendijas y huecos donde puedan refugiarse los insectos.
- 2- Mantener la vivienda y todos sus enseres correctamente higienizados, limpios.
- 3- Utilizar insecticidas modernos que permitan matar la vinchuca (o, en su caso, el chipo o pito).
- 4- Facilitar la tarea de los rociadores de insecticida, colaborando con ellos en todo cuanto sea necesario.
- 5- Conocer la vinchuca (o, en su caso, el chipo o pito), aprender a identificarla y diferenciarla de otros insectos.
- 6- Si ha sido picado por vinchucas (o, en su caso, por chipos o pitos), consultar inmediatamente al médico.
- 7- Si el médico le diagnostica la enfermedad, siga fielmente todas sus indicaciones. Los controles son fundamentales.
- 8- Ante cualquier duda, consultar al médico y hacerlo cuantas veces se crea conveniente.
- 9- Denunciar a la autoridad sanitaria correspondiente la existencia de vinchucas (o, en su caso, de chipos o pitos).
- 10- Identificar a la vinchuca (o, en su caso, el chipo o pito) por la zona donde se encuentre.
Véase también
- Trypanosoma cruzi
- Fecaloma
- Hematofagia
- Salvador Mazza
- Misión de Estudios de Patología Regional Argentina
- Miguel Eduardo Jörg
- Kiyoshi Shiga
- Francisco José Ayala
- Universidad Nacional del Nordeste
- Tren Hospital ALMA
- Manual de Chagas Elaborado por Dr. Enrique Manzullo
- Estudio longitudinal de la cardiopatía chagásica crónica Presentado: Noviembre 1982. Premio H. Ruggiero: Al mejor trabajo de Enfermedades Infecciosas año: 1978. Premio Accésit Premio Furman: al mejor trabajo de Cardiopatía Chagásica año:1983
Principales vectores que afectan al ser humano:
