ELISA

ELISA (acrónimo del inglés Enzyme-Linked ImmunoSorbent Assay: ‘ensayo por inmunoadsorción ligado a enzimas’) es una técnica de inmunoensayo en la cual se detecta un antígeno inmovilizado mediante un anticuerpo enlazado a una enzima capaz de generar un producto detectable, como un cambio de color o algún otro tipo; en ocasiones, con el fin de reducir los costos del ensayo, existe un anticuerpo primario que reconoce al antígeno y que a su vez es reconocido por un anticuerpo secundario que lleva enlazado la enzima antes mencionada. La aparición de colorantes permite medir indirectamente, mediante espectrofotometría, el antígeno en la muestra.
Se usa en muchos laboratorios para determinar si un anticuerpo particular está presente en la muestra de sangre de un paciente. Aunque el procedimiento es rutinario y sencillo, involucra a un gran número de variables, tales como selección de reactivo, temperatura, medición de volumen y tiempo, que si no se ajustan correctamente, puede afectar los pasos sucesivos y el resultado de la prueba.
La técnica ELISA fue propuesta como una alternativa al radioinmunoensayo, ya que este último suponía un riesgo para la salud debido a los isotopos radiactivos utilizados.
Esta técnica se diferencia de otras basadas en la reacción Ag-Ac en que la unión a una superficie sólida permite la identificación de reacciones específicas y, por lo tanto, la obtención de resultados cuantitativos.
Usos[editar]
La interacción antígeno-anticuerpo en el laboratorio puede ser utilizada para determinar si un paciente tiene una infección o una enfermedad autoinmune. Pero como prueba diagnóstica, posee diversas limitaciones que conviene conocer:
- En primer lugar, un resultado positivo que confirma la presencia de anticuerpos no significa necesariamente que el paciente esté enfermo. El cuerpo de una persona que ha estado enferma y que ya se ha recuperado puede seguir produciendo anticuerpos. Esto originaría un falso positivo.
- En segundo lugar, hay personas que producen una baja cantidad de anticuerpos, por lo que estos pueden pasar desapercibidos y no ser medidos, dando lugar a un falso negativo. Sería el caso, por ejemplo, de personas que padezcan una inmunodeficiencia, o que se encuentren en el periodo ventana de la infección en el momento de realizar la prueba, o que estén infectadas por una cepa extraña.
- En tercer lugar, pueden aparecer falsos negativos cuando se da inespecificidad entre antígeno-anticuerpo.
En estos casos de diagnóstico de enfermedad, es recomendable la eliminación (mediante centrifugación) de células de la sangre que puedan interferir con el ensayo y puedan ocasionar un resultado falso positivo, careciendo aquel de especificidad. También, debemos tener en cuenta que cuando se trata de diagnosticar una enfermedad que posee un valor predictivo positivo bajo en una determinada población —es decir, que esa enfermedad tiene muy baja incidencia en dicha población—, es necesario volver a confirmar el resultado positivo mediante otro método de diagnóstico independiente. Normalmente, se lleva a cabo un western blot donde se detecta la presencia de varios anticuerpos, simultáneamente, frente a la misma infección en una muestra. El resultado del western se considera positivo cuando aparecen al menos 5 bandas, que indica que 5 anticuerpos diferentes están presentes en el sujeto frente a esa infección. Es entonces cuando se diagnostica como positivo a dicho paciente.
Este principio tiene muchas de las propiedades de un inmunoensayo ideal: es versátil, robusto y simple en su realización, mediante el uso de la fase sólida, una separación fácil entre la fracción retenida y la fracción libre.
Además se han propuesto y desarrollado diferentes métodos de amplificación de la señal (luminiscentes, cascadas enzimáticas...) que han permitido elevar la sensibilidad de algunos ELISA a la obtenida en el RIA (radioinmunoensayo) hormonal.
Este método ha tenido una enorme aplicación en todos aquellos campos en los que se precisaba la cuantificación de productos mediante anticuerpos: diagnóstico clínico, detección viral, clasificación de anticuerpos en isotipos, búsqueda de anticuerpos monoclonales, etc.
Dispositivos empleados en ELISA[editar]

Se han ensayado numerosas fases sólidas, desde los tubos de cristal de los orígenes hasta las actuales microplacas de 96 pocillos de plástico tratado, para aumentar su capacidad de adsorción (en su superficie) de moléculas, y con fondos de pocillo ópticamente claros que permitan realizar las medidas de densidad óptica en instrumentos específicos, espectrofotómetros de lectura de placas que han recibido el nombre de lectores ELISA. Actualmente se están desarrollando dispositivos de mayor capacidad —por ejemplo, con 384 y 1536 pocillos—, adecuados para los sistemas de screening masivo de los sistemas robotizados (HTS, High-throughput system).
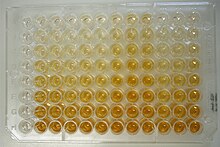
Los lectores ELISA son espectrofotómetros capaces de realizar lecturas seriadas de cada uno de los pocillos de la placa ELISA. A diferencia de un espectrofotómetro convencional, con capacidad de leer todas las longitudes de onda del ultravioleta y el visible de manera continua, los lectores de ELISA disponen de sistemas de filtros que solo permiten la lectura de una o pocas longitudes de onda; son la que se corresponden con las necesarias para determinar la densidad óptica de los cromógenos más comúnmente utilizados.
Fases de un ensayo ELISA[editar]

- Unión del antígeno (o del anticuerpo) a los pocillos. La unión de anticuerpos o antígenos se realiza con facilidad a la superficie de plásticos tratados que tienen gran afinidad por proteínas. Así, el procedimiento de recubrimiento de los pocillos debe realizarse cuidadosamente. Si se usa mucho antígeno, se pueden obtener falsos positivos. Por el contrario, si se usa poco antígeno, esto dará lugar a una reacción falsa negativa.
- Conjugación del anticuerpo o del antígeno con una enzima (peroxidasa, fosfatasa alcalina...). El anticuerpo conjugado a la enzima se emplea en los ensayos directos e indirectos, sandwich, etc. El antígeno marcado se emplea en ensayos de competición de antígeno. Dicha unión anticuerpo-enzima o antígeno-enzima ha de producirse durante un determinado período de tiempo en aras de producir una solución coloreada y que pueda ser valorada visualmente o cuantificada por medio de un espectrofotómetro (normalmente a una longitud de onda de 414 nm). Si no transcurre el tiempo adecuado para que se dé la reacción, no se evidenciará ningún color, interpretándose este resultado como un falso negativo y disminuyendo la sensibilidad de la técnica.
- Revelado de la reacción enzimática. Después de un lavado para eliminar todas las moléculas marcadas no fijadas en forma de inmunocomplejos, se añade el sustrato enzimático, se incuba durante un tiempo estandarizado por cada casa comercial, en el cual se producirá una reacción enzimática, luego se frena esta reacción mediante el uso de una solución stop y se lee la densidad óptica mediante espectrofotometría.
- Formación de una o más capas de inmunocomplejos. En el caso del antígeno unido a la placa, se puede detectar mediante un anticuerpo anti-antígeno marcado (ELISA directo) o empleando un anticuerpo primario anti-antígeno y un secundario anti-primario marcado (ELISA indirecto). Este segundo método permite la amplificación de la señal al poderse unir uno o más anticuerpos secundarios a cada anticuerpo primario. En el caso del anticuerpo unido a la placa, se incuba con una mezcla de antígeno y antígeno marcado. Se ensayan diferentes relaciones de antígeno frío frente a una cantidad fija de antígeno marcado. Es el ensayo de competición del antígeno. En esta etapa es muy importante controlar los factores tiempo y temperatura de incubación para evitar la aparición de falsos negativos. En el caso del tiempo, si es inferior a 15 minutos, no ocurrirá la interacción antígeno-anticuerpo y el color no será evidente al final del ensayo, dando un falso negativo. Por su parte, si la temperatura de incubación es muy baja, la formación del complejo antígeno-anticuerpo tampoco se completará en el tiempo establecido, mientras que si es muy alta, las proteínas (antígeno y anticuerpo) se desnaturalizan y, por tanto, disminuyen su capacidad para interaccionar, dando igualmente falsos negativos.
Tipos de ensayos ELISA[editar]

Se han desarrollado múltiples variantes de ensayos ELISA que permiten la cuantificación de un antígeno en solución, la detección de un anticuerpo en una solución (por ejemplo en el clonaje de anticuerpos monoclonales) o la determinación de la subclase (idiotipo) de un anticuerpo. A continuación se describen los más comunes.[1]
- ELISA directo (ensayo ELISA simple de dos capas). Las placas ELISA se preparan recubriendo los pocillos con las soluciones en las que se sospecha se encuentra el antígeno. Se incuban con anticuerpos marcados. Indican la presencia de antígeno en la solución analizada. Es necesario incluir controles negativos que serán muestras del mismo tipo que las analizadas (sangre, orina...), pero en las que se tenga la certeza de la ausencia del antígeno buscado. Asimismo se incluyen controles positivos (soluciones donde se encuentra el antígeno buscado).[2]
- ELISA indirecto. Las placas ELISA se preparan de la misma forma a la anterior. Los controles positivos y negativos son los mismos. El sistema de detección emplea dos anticuerpos: uno primario contra el antígeno y uno secundario marcado contra el primario. La detección tiene mayor sensibilidad por presentar una amplificación de señal debida a la unión de dos o más anticuerpos secundarios por cada primario. Es el ensayo más popular, como lo es la inmunofluorescencia indirecta, pues un mismo secundario marcado y un mismo sistema enzimático permiten cuantificar una gran variedad de antígenos; por eso es un método más polivalente y barato, aunque se pierda algo de precisión por tener un eslabón más con respecto al método directo. La dilución de la solución que contiene el anticuerpo primario —por ejemplo, suero sanguíneo— es un factor muy importante a tener en cuenta para evitar la aparición de falsos negativos, ya que si la muestra está muy diluida, no saldrá positiva si la titulación de anticuerpos es muy baja. (Es decir, aunque los anticuerpos están presentes, la prueba no da positivo porque la concentración de anticuerpos específicos contra el antígeno que está pegado en el fondo del pocillo no es suficiente como para dar una señal detectable.).
- El ELISA indirecto es el método de elección para detectar la presencia de anticuerpos séricos contra el virus de la inmunodeficiencia humana (VIH), agente causante del síndrome de inmunodeficiencia adquirida (SIDA). Según esta técnica, proteínas recombinantes de la envoltura y el núcleo del VIH se adsorben como antígenos en fase sólida a los pocillos. Las personas afectadas de VIH producen anticuerpos séricos contra epítopos en estas proteínas víricas. En general, el ELISA indirecto permite detectar anticuepos séricos contra VIH desde las primeras seis semanas de una infección.[3]
- ELISA inhibidor o competitivo: Este tipo de ELISA es el más complejo. Se utiliza para detectar o cuantificar antígenos presentes en bajas cantidades. Se denomina así ya que se utiliza un antígeno de referencia que competirá con el antígeno de la muestra por la unión al anticuerpo. El procedimiento simplificado sería el siguiente:
- El antígeno de referencia se inmoviliza sobre la placa.
- Por otro lado, un exceso de anticuerpo primario sin marcar se incuba con la muestra que contiene el antígeno de interés, dando lugar a la formación de complejos antígeno-anticuerpo
- Se añade la mezcla antígeno-anticuerpo a la placa, donde el antígeno de referencia competirá con el antígeno de la muestra por unirse al anticuerpo
- Se lava la placa eliminando los complejos antígeno-anticuerpo solubles
- Se añade a la placa un anticuerpo secundario marcado con una enzima que se unirá al anticuerpo primario anclado al antígeno de referencia.
- Se añade el sustrato que al reaccionar con la enzima proporcionará una señal visible.
- ELISA «sándwich» (Ensayo de captura de antígeno y detección mediante inmunocomplejos). Se trata de un ensayo muy empleado en el que se recubre el pocillo con un primer anticuerpo anti-antígeno. Después de lavar el exceso de anticuerpo, se aplica la muestra problema en la que se encuentra el antígeno, que será retenido en el pocillo al ser reconocido por el primer anticuerpo. Después de un segundo lavado que elimina el material no retenido, se aplica una solución con un segundo anticuerpo anti-antígeno marcado. Así, pues, cada molécula de antígeno estará unida a un anticuerpo en la base que lo retiene y un segundo anticuerpo, al menos, que lo marca. Este ensayo tiene una gran especificidad y sensibilidad debido a la amplificación de señal que permite el segundo anticuerpo.
- ELISPot. ELISpot es un método altamente sensible en la inmunología para enumerar las células que producen una citoquina dada. Las células se estimularon en una placa de microtitulación per-recubierta con un anticuerpo específico anti-analito. En respuesta a la estimulación, las células liberan citocinas que se unen al anticuerpo anti-analito. Después de una etapa de lavado, que elimina las células de los pozos, la ubicación de citoquinas secretadas se visualiza mediante un anticuerpo de detección marcado con enzima y su sustrato cromogénico correspondiente. El resultado final es un conjunto de manchas de color, cada uno de los cuales representa un área donde se había localizado una célula que secreta la citoquina. Existe un método de ELISpot estándar y una variación denominada de células dendríticas DC-ELISpot para la detección de las células tras la estimulación con oligopéptidos y antígenos de proteína, respectivamente.

Utilidades diagnósticas[editar]
Cáncer: identificación de biomarcadores para su diagnóstico en etapas tempranas
Hepatitis B:
- Detección del antígeno de superficie del VHB (agHBS
- Detección de anticuerpos contra el antígeno del core del VHB (agHBS). Estos pueden ser IgG, que persisten durante toda la vida, o IgM, que solo duran 6 meses, por lo que indican hepatitis B aguda.
Detección de anticuerpos antiplaquetarios para el diagnóstico de enfermedades como la púrpura trombocitopénica inmune (PTI) o el lupus sistémico eritematoso.[4]
Detección de VIH mediante la determinación simultánea de anticuerpos anti- VIH y antígeno p24.[5]
Quimioluminiscencia[editar]

Durante determinadas reacciones químicas, la luz generada por este fenómeno constituye una alternativa conveniente y muy sensible para las mediciones de absorbancia en ELISA. Los tipos de ELISA que recurren a la quimioluminiscencia utilizan un sustrato que genera luz, en lugar del sustrato cromógeno de las reacciones ELISA ordinarias. Tales son los casos de la oxidación del compuesto luminol por peróxido de hidrógeno y la enzima peroxidasa de rábano (HRP), que producen luz. La luz que se genera en dichas reacciones puede detectarse gracias a su capacidad de sensibilizar una película fotográfica. La medición cuantitativa de la emisión de luz puede hacerse mediante el uso de un luminómetro.
La ventaja de las pruebas de quimioluminiscencia sobre las cromógenas es la mejoría de la sensibilidad. En general, el límite de detección puede aumentarse al menos diez veces si se cambia un sustrato cromógeno por uno que emita luz, y más de doscientas veces cuando se adicionan agentes potenciadores.
Marcadores enzimáticos más comúnmente utilizados[editar]
En la tabla siguiente se recogen los marcadores enzimáticos más comúnmente empleados en ensayos ELISA, los sustratos que se emplean para su revelado y el modo de prepararlos.
- Enzima sustrato tampón
- HRP (peroxidasa de rábano) OPD 10 mg/25 mL de tampón citrato sódico 0,15 M pH 5; añadir microL de 30 % peróxido de hidrógeno 30 %.
- TMB 2,5 mg/250 microL de DMSO; hasta 25 ml con tampón citrato sódico 0,1 M pH 6; añadir 5 microL de peróxido de hidrógeno 30 %.
- ABTS 60 mg/100 mL de tampón citrato sódico 0,1 M pH 6; añadir 35 microL de peróxido de hidrógeno 30 %; parar con fluoruro sódico 1,25 %; leer a 405 nm.
- DAB 10 mg/20 mL de tampón Tris 50 mM pH 7,4; filtrar y añadir 20 microL de peróxido de hidrógeno 1 %.
- CNP 6 mg en 1 mL de metanol; añadir 10 mL de tampón Tris 50 mM pH 7,4; filtrar y añadir 40 microL de peróxido de hidrógeno 30 %.
- AEC 80 mg en 1 mL de N,N'-dimetilformamida + 200 microL de tampón acetato 0,1 M pH 4,5; filtrar y añadir 50 microL de peróxido de hidrógeno 30 %.
- ASA 80 mg/100 mL de agua destilada caliente; ajustar a pH 6,0 con 1 mM NaOH y añadir 10 % por volumen de 0,05 % peróxido de hidrógeno; parar con 25 microL de NaOH 1 M.
- AP (fosfatasa alcalina) PNPP 5 mg/5 mL de tampón dietanolamina-HCl 0,1 M pH 9,8 + 1 mM cloruro de magnesio.
- NAPFB (A) 4 mg de fosfato de naftol en 200 microL de dimetilformamida en un tubo de vidrio (B) 10 mg de sal Fast Blue BB/10 ml de tampón Tris 0,05 M pH 9,2 - 2 mM cloruro de magnesio. Mezclar A + B y filtrar.
- NAPR (A) 4 mg de fosfato de naftol en 200 microL de dimetilformamida en un tubo de vidrio (B) 10 mg de sal Red BB/ 10 ml de tampón Tris 0,05M pH 9,2 - 2 mM cloruro de magnesio. Mezclar A + B y filtrar.
- BCIP 1 mg/mL en solución AMP (2-amino-2-metil-propanol).
- beta-G ONPG 2,5 mg/ml en tampón fosfato sódico 0,1 M pH 7,0 + 1 mM cloruro de magnesio + 0,1 M beta-mercaptoetanol.
- ureasa BP 8 mg/1,48 ml de 0,01 M NaOH; llevarlo a 100 ml con agua desionizada; añadir 100 mg de urea y EDTA a 0,2 mM; ajustar el pH a 4,8 con 1 mM NaOH o HCl; almacenar a 4 °C.
- PG IS Añadir a cada placa de ELISA 25 microL de cada uno de los reactivos siguientes en secuencia: (A) 1 % (peso/vol) gelatina en 0,1 M tampón fosfato pH 7,0; (B) 1 % (peso/vol) almidón en agua destilada caliente; (C) 3,04 mg/mL de benzil-penicilina en 0,1 M tampón fosfato pH 7,0 (5000 U/mL); (D) 0,01 N ioduro en 0,1 M KI solución stock (en una botella oscura).
Prueba ELISPOT[editar]
Una variante de la prueba ELISA, llamada ELISPOT es capaz de detectar cuantitativamente el número de células en una población productora de anticuerpos específicos contra un antígeno determinado o un antígeno contra el que se dispone de un anticuerpo específico. Aquí, dichas placas se recubren con el antígeno reconocido por el anticuerpo de interés o con el anticuerpo específico para el antígeno cuya producción se valora. Seguidamente, se añade a las placas recubiertas una suspensión de la población celular que se investiga e incuba. Las células se disponen en la superficie de la placa, y las moléculas secretadas reactivas a las moléculas de captura son unidas en la cercanía de las células secretoras, produciéndose un anillo de complejos antígeno-anticuerpo alrededor de cada célula que sintetiza la molécula de interés. Después, la placa se lava y un anticuerpo unido a enzima específico para el antígeno secretado, o para la especie de anticuerpo secretado, se añade y deja que se unan. El posterior revelado del ensayo mediante adición de un sustrato cromógeno o emisor de luz adecuado indica la posición de cada célula productora de anticuerpo (o de antígeno) como un punto de color o luz.[6]
Referencias[editar]
- ↑ ELISA. Springer. ISBN 978-1-4939-2741-8. Consultado el 30 de marzo de 2016.
- ↑ Lin, AV (de de 2015). «Direct ELISA.». Methods in molecular biology (Clifton, N.J.) 1318: 61-7. PMID 26160564.
- ↑ Lin, AV (de de 2015). «Indirect ELISA.». Methods in molecular biology (Clifton, N.J.) 1318: 51-9. PMID 26160563.
- ↑ Paz Cruz, Osiris Y.; Bencomo Hernández, Antonio A.; Barranco Peregrino, Belkis; Fernández Franch, Neyda (2011-08). «Detección de autoanticuerpos antiplaquetarios por ELISA en pacientes con púrpura trombocitopénica autoinmune». Revista Archivo Médico de Camagüey 15 (4): 653-664. ISSN 1025-0255. Consultado el 7 de enero de 2020.
- ↑ «ELISA Applications». News-Medical.net (en inglés). 6 de diciembre de 2018. Consultado el 7 de enero de 2020.
- ↑
