Diferencia entre revisiones de «Ácido acetilsalicílico»
Sin resumen de edición |
Revertidos los cambios de 79.144.246.78 a la última edición de 187.144.80.60 usando monobook-suite |
||
| Línea 42: | Línea 42: | ||
| Vías_administración = Oral |
| Vías_administración = Oral |
||
}} |
}} |
||
El '''ácido acetilsalicílico''' |
El '''ácido acetilsalicílico''' o '''AAS''' (C<sub>9</sub>H<sub>8</sub>O<sub>4</sub>) es un fármaco de la familia de los [[salicilato]]s, usado frecuentemente como [[antiinflamatorio]], [[analgésico]], para el alivio del dolor leve y moderado, [[antipirético]] para reducir la [[fiebre]] y [[antiagregante plaquetario]] indicado para personas con alto riesgo de coagulación sanguínea,<ref>{{cita publicación| issn = 00284793| volumen= 309| número= 7| páginas= 396–403| apellido= Lewis| nombre= H D |
||
| coautores= J W Davis, D G Archibald, W E Steinke, T C Smitherman, J E Doherty, H W Schnaper, M M LeWinter, E Linares, J M Pouget, S C Sabharwal, E Chesler, H DeMots| título= Protective effects of aspirin against acute myocardial infarction and death in men with unstable angina. Results of a Veterans Administration Cooperative Study| revista= The New England journal of medicine| fecha= 18 de agosto de 1983}}</ref> principalmente individuos que ya han tenido un [[infarto agudo de miocardio]].<ref name="anticoag">{{cita publicación| apellido= Julian | nombre= D G | coautores= D A Chamberlain, S J Pocock | título= A comparison of aspirin and anticoagulation following thrombolysis for myocardial infarction (the AFTER study): a multicentre unblinded randomised clinical trial | revista= BMJ| volumen= 313 | número= 7070 | páginas= 1429–1431 | editorial= British Medical Journal | fecha= 24-09-1996| url = http://www.bmj.com/cgi/content/full/313/7070/1429 | fechaaceso= 4 octubre 2007 | pmid = 8973228}}</ref><ref>{{cita publicación| volumen= 92| número= 10| páginas= 2841–2847| apellido= Krumholz| nombre= Harlan M.| coautores= Martha J. Radford, Edward F. Ellerbeck, John Hennen, Thomas P. Meehan, Marcia Petrillo, Yun Wang, Timothy F. Kresowik, Stephen F. Jencks| título= Aspirin in the Treatment of Acute Myocardial Infarction in Elderly Medicare Beneficiaries : Patterns of Use and Outcomes| revista= Circulation| fechaaceso= 15 mayo 2008| fecha= 15-11-1995| url = http://circ.ahajournals.org/cgi/content/abstract/92/10/2841| pmid = 7586250}}</ref> |
| coautores= J W Davis, D G Archibald, W E Steinke, T C Smitherman, J E Doherty, H W Schnaper, M M LeWinter, E Linares, J M Pouget, S C Sabharwal, E Chesler, H DeMots| título= Protective effects of aspirin against acute myocardial infarction and death in men with unstable angina. Results of a Veterans Administration Cooperative Study| revista= The New England journal of medicine| fecha= 18 de agosto de 1983}}</ref> principalmente individuos que ya han tenido un [[infarto agudo de miocardio]].<ref name="anticoag">{{cita publicación| apellido= Julian | nombre= D G | coautores= D A Chamberlain, S J Pocock | título= A comparison of aspirin and anticoagulation following thrombolysis for myocardial infarction (the AFTER study): a multicentre unblinded randomised clinical trial | revista= BMJ| volumen= 313 | número= 7070 | páginas= 1429–1431 | editorial= British Medical Journal | fecha= 24-09-1996| url = http://www.bmj.com/cgi/content/full/313/7070/1429 | fechaaceso= 4 octubre 2007 | pmid = 8973228}}</ref><ref>{{cita publicación| volumen= 92| número= 10| páginas= 2841–2847| apellido= Krumholz| nombre= Harlan M.| coautores= Martha J. Radford, Edward F. Ellerbeck, John Hennen, Thomas P. Meehan, Marcia Petrillo, Yun Wang, Timothy F. Kresowik, Stephen F. Jencks| título= Aspirin in the Treatment of Acute Myocardial Infarction in Elderly Medicare Beneficiaries : Patterns of Use and Outcomes| revista= Circulation| fechaaceso= 15 mayo 2008| fecha= 15-11-1995| url = http://circ.ahajournals.org/cgi/content/abstract/92/10/2841| pmid = 7586250}}</ref> |
||
Revisión del 17:11 5 mar 2010
| Ácido acetilsalicílico | ||
|---|---|---|
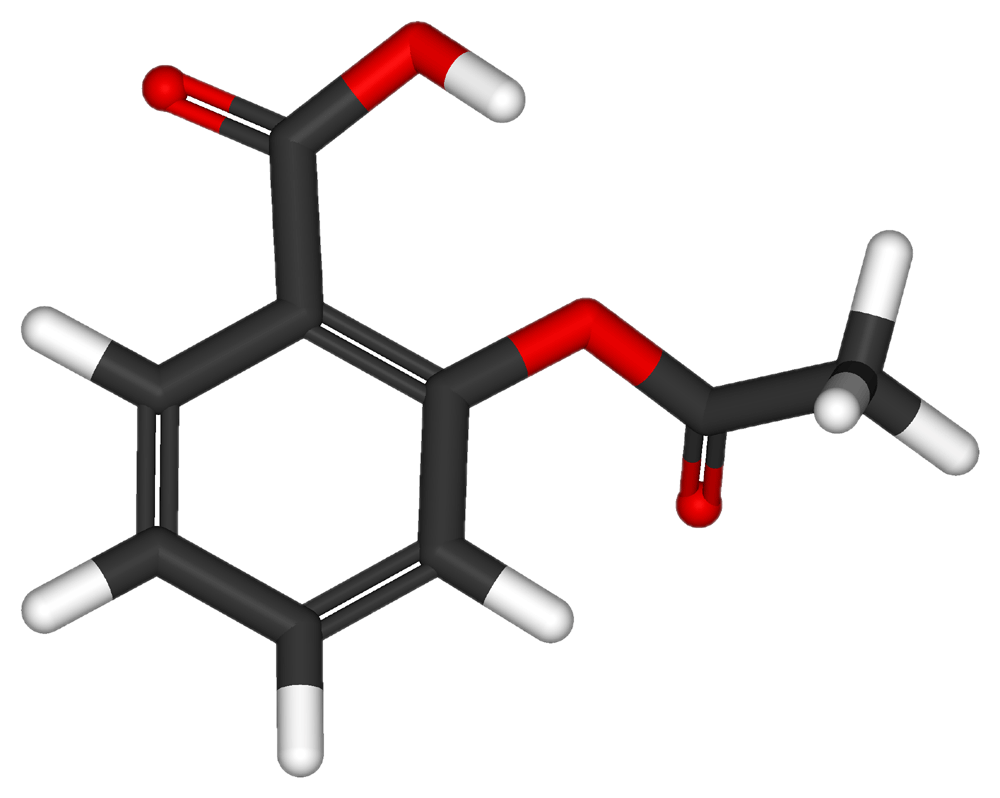 | ||
 | ||
| Nombre (IUPAC) sistemático | ||
| Ácido 2-(acetiloxi)-benzoico | ||
| Identificadores | ||
| Número CAS | 50-78-2 | |
| Código ATC | B01AC06 | |
| PubChem | 2244 | |
| DrugBank | APRD00264 | |
| ChEBI | 15365 | |
| Datos químicos | ||
| Fórmula | C6H4(OCOCH3)COOH | |
| Peso mol. | 180,16 uma | |
| Sinónimos | Ácido acetilsalicílico, Ácido o-acetilsalicílico, Acetilsalicilato, Ácido 2-acetoxibenzoico | |
| Datos físicos | ||
| Densidad | 1.40 g/cm³ | |
| P. de fusión | 138 °C (280 °F) | |
| P. de ebullición | 140 °C (284 °F) | |
| Solubilidad en agua | 1 mg/mL (20 °C) | |
| Farmacocinética | ||
| Biodisponibilidad | Rápida y completa | |
| Unión proteica | 99,6 % | |
| Metabolismo | hepático | |
| Vida media |
300-650mg: 3,1-3,2 horas; Dosis 1 g:5 horas; Dosis 2 g:9 horas | |
| Excreción | Renal | |
| Datos clínicos | ||
| Cat. embarazo | C (AU) No hay estudios en humanos. El fármaco solo debe utilizarse cuando los beneficios potenciales justifican los posibles riesgos para el feto. Queda a criterio del médico tratante. (EUA) | |
| Estado legal | Unscheduled (AU) GSL (UK) OTC (EUA) | |
| Vías de adm. | Oral | |
El ácido acetilsalicílico o AAS (C9H8O4) es un fármaco de la familia de los salicilatos, usado frecuentemente como antiinflamatorio, analgésico, para el alivio del dolor leve y moderado, antipirético para reducir la fiebre y antiagregante plaquetario indicado para personas con alto riesgo de coagulación sanguínea,[1] principalmente individuos que ya han tenido un infarto agudo de miocardio.[2][3]
Los efectos adversos de la aspirina son principalmente gastrointestinales, es decir, úlceras gástricas y sangrado estomacal. En pacientes menores de 14 años se ha dejado de usar la aspirina para el control de los síntomas de la gripe o de la varicela debido al elevado riesgo de contraer el síndrome de Reye.[4]
Historia

La corteza de sauce blanco (Salix alba; "Salix", que significa "sauce" en latín, es el nombre del género) ha sido usada desde tiempo inmemorial para el alivio de la fiebre y del dolor, incluso por Hipócrates en el siglo V a. C.,[5] los antiguos egipcios y los amerindios.[6] Los efectos medicinales del sauce blanco continuaron siendo mencionados por observadores del pasado, incluyendo al farmacéutico Plinio el Viejo, al naturista Dioscórides y al filósofo Galeno.
En 1763 Edward Stone, reverendo de la Iglesia de Inglaterra, presentó un informe a Lord Macclesfield, quien presidía la Real Sociedad de Ciencia Inglesa, referente a estas propiedades terapéuticas de la corteza de sauce blanco destacando su efecto antipirético.[7] Stone describió en su trabajo que había administrado el extracto en forma de té o cerveza a 50 pacientes febriles, aliviándoles el síntoma.[8][9] Investigaciones posteriores condujeron al principio activo de esta planta, que los científicos llamaron salicilina, un análogo del ácido salicílico y del ácido acetilsalicílico.[10]
El principio activo fue aislado en 1828 por Johann Buchner, profesor de farmacia en la Universidad de Múnich; se trataba de una sustancia amarga y amarillenta extraída de agujas cristalinas que llamó salicina.[5] Dos años antes, los italianos Brugnatelli y Fontana aislaron ese mismo extracto, pero en forma muy impura, y no lograron demostrar que la sustancia era la causante de los efectos farmacológicos del sauce blanco.[10] En 1829 un farmacéutico francés, Henri Leroux, improvisó un procedimiento de extracción del que obtuvo 30 gramos de salicilina a partir de 1.5 kg de corteza. En 1838 Raffaele Piria, un químico italiano, laborando en La Sorbona de París logró separar la salicina en azúcar y un componente aromático llamado salicilaldehído.[8] A este último compuesto lo convirtió, por hidrólisis y oxidación, en cristales incoloros a los que puso por nombre ácido salicílico.[5]

Fue sintetizado por primera vez por Charles Frédéric Gerhardt en 1853 y luego en forma de sal por Hermann Kolbe en 1859.[8] Hubo que esperar hasta 1897 para que el químico alemán Felix Hoffmann, de la casa Bayer, consiguiera sintetizar al ácido salicílico con gran pureza.[11] Sus propiedades terapéuticas como analgésico y antiinflamatorio fueron descritas en 1899 por el farmacólogo alemán Heinrich Dreser, lo que permitió su comercialización. Hasta ahí la historia que se relata en los libros, en realidad fue Arthur Eichengrün el que en 1894 esterifico el ácido salicílico convirtiéndolo en ácido acetil salicílico, lo que viene a ser la aspirina actual. Hoffman no fue más que un pupilo suyo y Heinrich Dresder no tuvo nada que ver en el descubrimiento, tan sólo era un supervisor. Cuando en 1941 se expuso en el museo de Múnich un cristal de aspirina con el rótulo "aspirina inventada por Dreser y Hoffman", Eichengrün se estaba pudriendo en el gueto de theresienstadt como judío que era, mientras los dos arios se llevaban las medallas. (British medical journal, 321,1.591 (2000) y The biochemist agosto de 2001).
Aspirina fue el nombre comercial acuñado por los laboratorios Bayer para el comprimido fabricado con esta sustancia,[12] convirtiéndose en el primer fármaco del grupo de los antiinflamatorios no esteroideos, AINE. Posteriormente, en 1971, el farmacólogo británico John Robert Vane, entonces empleado del Royal College of Surgeons ("Colegio Real de Cirujanos") de Londres, pudo demostrar que el AAS suprime la producción de prostaglandinas y tromboxanos,[13] lo que abrió la posibilidad de su uso en bajas dosis como antiagregante plaquetario, ampliando enormemente su campo comercial y compensando el hecho de que, en la actualidad, su uso como antiinflamatorio de elección haya sido desplazado por otros AINE más eficaces y seguros.[14]
Su trascendencia ha sido tanta que el nombre comercial terminó convirtiéndose en el nombre de uso cotidiano, de tal manera que en Estados Unidos aspirin pasó a ser el nombre genérico de la sustancia. Desde su comercialización se han consumido más de 350 billones de comprimidos y se estima que el consumo diario es de unos 100 millones de aspirinas.[15] Consecuentemente, es uno de los fármacos más usados en el mundo, con un consumo estimado de 40.000 toneladas métricas anuales.[16] En el año 2008, el 85% de la producción mundial de ácido acetilsalicílico se realiza en Langreo, España, en una planta química de la empresa multinacional Bayer.[17] Desde allí se envía a diferentes partes del mundo donde se preparan los comprimidos y diferentes formas farmacéuticas en las que se vende Aspirina.
Descripción
El ácido salicílico o salicilato, producto metabólico de la aspirina, es un ácido orgánico simple con un pKa de 3,0. La aspirina, por su parte, tiene un pKa de 3,5 a 25 °C.[18] Tanto la aspirina como el salicilato sódico son igualmente efectivos como antiinflamatorios, aunque la aspirina tiende a ser más eficaz como analgésico.[14]
En la producción del ácido acetilsalicílico, se protona el oxígeno para obtener un electrófilo más fuerte.

La reacción química de la síntesis de la aspirina se considera una esterificación. El ácido salicílico es tratado con anhídrido acético, un compuesto derivado de un ácido, lo que hace que el grupo alcohol del salicilato se convierta en un grupo acetilo (salicilato-OH → salicilato-OCOCH3). Este proceso produce aspirina y ácido acético, el cual se considera un subproducto de la reacción.[19] La producción de ácido acético es la razón por la que la aspirina con frecuencia huele como a vinagre.[20]
Como catalizador casi siempre se usan pequeñas cantidades de ácido sulfúrico y ocasionalmente ácido fosfórico. El método es una de las reacciones más usadas en los laboratorios de química en universidades de pregrado.[21]
Farmacocinética
Vías de administración (formas de uso)

El ácido acetilsalicílico se administra principalmente por vía oral, aunque también existe para uso rectal y como terapia intravenosa. Los comprimidos de aspirina para administración oral se hidrolizan con facilidad cuando se ven expuestos al agua o aire húmedo, de modo que deben permanecer almacenados en sus envoltorios hasta el momento de su administración. La aspirina que se hidrolizado así despide un olor a vinagre (en realidad es ácido acético) y no debe ingerirse. La aspirina también viene en preparados masticables para adultos. Los preparados efervescentes y saborizados son aptos para quienes prefieran la administración líquida del medicamento.[22] Es mayor la probabilidad de problemas severos del estómago con la aspirina que no tiene recubrimiento entérico.[23]
Absorción
La aspirina tiene muy escasa solubilidad en condiciones de pH bajo, como ocurre en el estómago, hecho que puede retardar la absorción de grandes dosis del medicamento unas 8-24 horas. Todos los salicilatos, incluyendo la aspirina, se absorben rápidamente por el tracto digestivo a la altura del duodeno y del intestino delgado, alcanzando la concentración máxima en el plasma sanguíneo al cabo de 1 a 2 horas.[24] Por ser un ácido débil, muy poco queda remanente en forma ionizada en el estómago después de la administración oral del ácido salicílico. Debido a su baja solubilidad, la aspirina se absorbe muy lentamente en casos de sobredosis, haciendo que las concentraciones plasmáticas aumenten de manera continua hasta 24 horas después de la ingesta.[25][26][27] La biodisponibilidad es muy elevada, aunque la absorción tiende a ser afectada por el contenido y el pH del estómago.
Distribución
La unión del salicilato a las proteínas plasmáticas es muy elevada, superior al 99%, y de dinámica lineal.[14] La saturación de los sitios de unión en las proteínas plasmáticas conduce a una mayor concentración de salicilatos libres, aumentando el riesgo de toxicidad. Presenta una amplia distribución tisular, atravesando las barreras hematoencefálica y placentaria. La vida media sérica es de aproximadamente 15 minutos. El volumen de distribución del ácido salicílico en el cuerpo es de 0,1–0,2 l/kg. Los estados de acidosis tienden a incrementar el volumen de distribución porque facilitan la penetración de los sacililatos a los tejidos.[27]
Metabolismo
La aspirina se hidroliza parcialmente a ácido salicílico durante el primer paso a través del hígado. Este metabolismo hepático está sujeto a mecanismos de saturación, por lo que al superarse el umbral, las concentraciones de la aspirina aumentan de manera desproporcionada en el organismo. También es hidrolizada a ácido acético y salicilato por esterasas en los tejidos y la sangre.
Excreción
La excreción se realiza a través de la orina y en mínimas cantidades por las heces. A medida que la cantidad de aspirina administrada aumenta, la vida media de eliminación de su metabolito, el ácido salicílico, se incrementa desde 3-5 horas (dosis de 600 mg cada día) hasta 12-16 horas (dosis mayores de 3,6 g cada día).[14]
La alcalinización de la orina aumenta la velocidad de excreción del ácido salicílico libre y sus conjugados hidrosolubles.
Farmacodinámica
Mecanismo de acción

Los mecanismos biológicos para la producción de la inflamación, dolor o fiebre son muy similares. En ellos intervienen una serie de sustancias que tienen un final común. En la zona de la lesión se generan unas sustancias conocidas con el nombre de prostaglandinas. Se las podría llamar también "mensajeros del dolor". Estas sustancias informan al sistema nervioso central de la agresión y se ponen en marcha los mecanismos biológicos de la inflamación, el dolor o la fiebre. En 1971 el farmacólogo británico John Robert Vane demostró que el ácido acetilsalicílico actúa interrumpiendo estos mecanismos de producción de las prostaglandinas y tromboxanos.[28][29] Así, gracias a la utilización de la aspirina, se restablece la temperatura normal del organismo y se alivia el dolor. La capacidad de la aspirina de suprimir la producción de prostaglandinas y tromboxanos se debe a la inactivación irreversible de la ciclooxigenasa (COX), enzima necesaria para la síntesis de esas moléculas proinflamatorias. La acción de la aspirina produce una acetilación (es decir, añade un grupo acetilo) en un residuo de serina del sitio activo de la COX.
Efectos
Efectos antiinflamatorios
La aspirina es un inhibidor no selectivo de ambas isoformas de la ciclooxigenasa, pero el salicilato, el producto metabólico normal de la aspirina en el cuerpo, es menos eficaz en la inhibición de ambas isoformas. Los salicilatos que no son acetilados pueden tener funciones en la eliminación de radicales del oxígeno. La aspirina inhibe irreversiblemente a la COX-1, modifica la actividad enzimática de la COX-2 e inhibe la agregación plaquetaria, no así las especies no acetiladas del salicilato.[14] Por lo general, la COX-2 produce los prostanoides, la mayoría de los cuales son proinflamatorios. Al ser modificada por la aspirina, la COX-2 produce en cambio lipoxinas, que tienden a ser antiinflamatorias. Los AINEs más recientes se han desarrollado para inhibir la COX-2 solamente y así reducir los efectos secundarios gastrointestinales de la inhibición de la COX-1.[16]
La aspirina también interfiere con los mediadores químicos del sistema calicreína-cinina, por lo que inhibe la adherencia de los granulocitos sobre la vasculatura que ha sido dañada, estabiliza los lisosomas evitando así la liberación de mediadores de la inflamación e inhibe la quimiotaxis de los leucocitos polimorfonucleares y macrófagos.[14]
Efectos analgésicos
La aspirina es más eficaz reduciendo el dolor leve o de moderada intensidad por medio de sus efectos sobre la inflamación y porque es probable que pueda inhibir los estímulos del dolor a nivel cerebral subcortical. Es un ácido orgánico débil que tiene al mismo tiempo una función de ácido carboxílico y de fenol ya que también se le considera el orto fenol del acido benzoico (su nombre es ortofenometiloico). Tiene características antiinflamatorias pero debido a que provoca irritaciones estomacales no se aplica como tal sino en forma de sus derivados, siendo los más conocidos el ácido acetilsalicílico ("Aspirina") y el salicilato de metilo (el éster con el alcohol metílico).
Efectos antipiréticos
La aspirina reduce la fiebre, mientras que su administración sólo afecta ligeramente a la temperatura normal del cuerpo. Los efectos antipiréticos de la aspirina probablemente están mediados tanto por la inhibición de la COX en el sistema nervioso central como por la inhibición de la interleucina-1,[14] liberada por los macrófagos durante los episodios de inflamación.
Se ha demostrado que la aspirina interrumpe la fosforilación oxidativa en las mitocondrias de los cartílagos y del hígado al difundir al espacio que está entre las dos membranas de la mitocondria y actuar como transportador de los protones requeridos en los procesos de la respiración celular.[30] Con la administración de dosis elevadas de aspirina se observa la aparición de fiebre debido al calor liberado por la cadena de transporte de electrones que se encuentra en la membrana interna de las mitocondrias, contrariamente a la acción antipirética de la aspirina a dosis terapéuticas. Además, la aspirina induce la formación de radicales de óxido nítrico (NO) en el cuerpo, lo cual reduce la adhesión de los leucocitos, uno de los pasos importantes en la respuesta inmune a infecciones, aunque aún no hay evidencias concluyentes de que la aspirina sea capaz de combatir una infección.[31] Datos publicados recientemente sugieren que el ácido salicílico y otros derivados de la aspirina modulan sus acciones de señalización celular por medio del NF-κB,[32] un complejo de factores de transcripción que juegan un papel importante en muchos procesos biológicos, incluida la inflamación.
Efectos antiplaquetarios
Las dosis bajas de aspirina, de 81 mg diarios, producen una leve prolongación en el tiempo de sangrado, que se duplica si la administración de la aspirina continúa durante una semana. El cambio se debe a la inhibición irreversible de la COX de las plaquetas, por lo que se mantiene durante toda la vida de las mismas (entre 8 y 10 días).[14] Esa propiedad anticoagulante hace que la aspirina sea útil en la reducción de la incidencia de infartos en algunos pacientes.[33] 40 mg de aspirina al día son suficientes para inhibir una proporción adecuada de tromboxano A2, sin que tenga efecto inhibitorio sobre la síntesis de prostaglandina I2, por lo que se requerirán mayores dosis para surtir efectos antiinflamatorios.[34]
En el año 2008 un ensayo demostró que la aspirina no reduce el riesgo de aparición de un primer ataque cardiaco o accidente cerebrovascular, sino que reduce el riesgo de un segundo evento para quienes ya han sufrido un ataque cardiaco o un accidente cerebrovascular. En mujeres que toman dosis bajas de aspirina cada dos días se disminuye el riesgo de un accidente cerebrovascular, pero no es un tratamiento que pueda alterar sustancialmente el riesgo de un infarto o muerte cardiovascular.[35] En general, para un paciente que no tiene enfermedad cardíaca, el riesgo de sangrado supera cualquier beneficio de la aspirina.[36]
Interacciones
| Fármaco | Resultados de la interacción. |
|---|---|
| • Antiinflamatorios no esteroideos (AINE) | Puede incrementar el riesgo de úlceras y de hemorragias gastrointestinales, debido a un efecto sinérgico. |
| • Corticoides | Puede incrementar el riesgo de úlceras y de hemorragias gastrointestinales, debido a un efecto sinérgico. |
| • Diuréticos | La administración conjunta puede ocasionar un fallo renal agudo, especialmente en pacientes deshidratados. En caso de que se administren de forma simultánea ácido acetilsalicílico y un diurético, es preciso asegurar una hidratación correcta del paciente y monitorizar la función renal al iniciar el tratamiento. |
| • Inhibidores selectivos de la recaptación de serotonina (ISRS) | Aumenta el riesgo de hemorragia en general y de hemorragia digestiva alta en particular. |
| • Anticoagulantes orales | Aumenta el riesgo de hemorragia, por lo que no se recomienda. Si resulta imposible evitar una asociación de este tipo, se requiere una monitorización cuidadosa del INR. |
| • Trombolíticos y antiagregantes plaquetarios | Aumenta el riesgo de hemorragia. |
|
Ejercen un efecto sinérgico en la reducción de la filtración glomerular, que puede ser exacerbado en caso de alteración de la función renal. La administración a pacientes ancianos o deshidratados, puede llevar a un fallo renal agudo por acción directa sobre la filtración glomerular. Además, pueden reducir el efecto antihipertensivo, debido a la inhibición de prostaglandinas con efecto vasodilatador. |
| • β-bloqueantes | Disminución del efecto antihipertensivo debido a una inhibición de las prostaglandinas con efecto vasodilatador. |
| • Insulina y sulfonilureas | Aumenta el efecto hipoglucemiante. |
| • Ciclosporina | Aumenta la nefrotoxicidad de la ciclosporina debido a efectos mediados por las prostaglandinas renales. |
| • Vancomicina | Aumenta el riesgo de ototoxicidad de la vancomicina. |
| • Interferón α | Disminuye la actividad del interferón-α. |
| • Alcohol | Aumenta el riesgo de hemorragia digestiva. |
Las interacciones farmacocinéticas van a cubrir prácticamente todo el espectro de posibilidades en cuanto al mecanismo de producción, aunque se muestran como más interesantes las de origen metabólico. En este sentido, parece ser independiente de la CYP3A4 y, al igual que otros AINE, estar ligada a la CYP2C9. No obstante, su abundante metabolismo al margen del hígado, hace que no sean fundamentales sus interacciones a nivel del citocromo P450. Las más interesantes se muestran en la siguiente tabla:
| Fármaco | Resultados de la interacción |
|---|---|
| • Metotrexato | Disminuyen la secreción tubular de metotrexato incrementando las concentraciones plasmáticas del mismo y por tanto su toxicidad. |
| • Litio | Disminuyen la excreción de litio, aumentando los niveles de litio en sangre, que pueden alcanzar valores tóxicos. |
| • Uricosúricos | Disminución del efecto uricosúrico y una disminución de la excreción del ácido acetilsalicilico alcanzándose niveles plasmáticos más altos. |
| • Antiácidos | Pueden aumentar la excreción renal de los salicilatos por alcalinización de la orina. |
| • Digoxina | Incremento de los niveles plasmáticos de digoxina que pueden alcanzar valores tóxicos. |
| • Barbitúricos | Aumenta las concentraciones plasmáticas de los barbitúricos. |
| • Zidovudina | Aumenta las concentraciones plasmáticas de zidovudina al inhibir de forma competitiva la glucuronidación o directamente inhibiendo el metabolismo microsomal hepático. |
| • Ácido valproico | Disminución de la unión a proteínas plasmáticas y una inhibición del metabolismo de ácido valproico. |
| • Fenitoína | Incremento de los niveles plasmáticos de fenitoína. |
Finalmente, la siguiente tabla muestra las interacciones no farmacológicas, manifestadas como alteraciones de los resultados de las pruebas de laboratorio:
| Resultados de la interacción. | Determinaciones analíticas afectadas. |
|---|---|
| Aumento biológico. |
•fosfatasa alcalina •transaminasas (ALT y AST). •amoníaco •bilirrubina •colesterol •creatinquinasa •creatinina •digoxina •tiroxina libre •lactato deshidrogenasa (LDH) •globulina de unión a la tiroxina •triglicéridos •ácido úrico •ácido valproico |
| Reducción biológica |
• Estriol (orina) •tiroxina libre •glucosa •fenitoína •TSH •TSH-RH •tiroxina •triglicéridos •triiodotironina •ácido úrico •aclaramiento de creatinina |
| Aumento analítico |
•glucosa •paracetamol •proteínas totales |
| Reducción analítica |
•transaminasas (ALT) •albúmina •fosfatasa alcalina •colesterol •creatina kinasa •lactato deshidrogenasa (LDH) •proteínas totales •ácido 5-hidroxiindolacético (orina) •ácido 4-hidroxi-3-metoxi-mandélico (orina) •estrógenos totales (orina) •glucosa (orina) |
| Nota: El aumento biológico consiste en un "verdadero aumento" del valor determinado, como consecuencia de la interacción con el organismo. El aumento analítico viene dado por una "falsa elevación" del valor determinado, como consecuencia de la interacción con los reactivos que forman parte de la técnica que determina los niveles de cada uno de ellos. De forma análoga ocurre con las reduccciones biológica y analítica. | |
En pacientes con cardiopatías establecidas, el ibuprofeno puede interferir con los efectos cardioprotectores de la aspirina cuando se administran ambos medicamentos al mismo tiempo.[38]
Uso clínico

- Dolor leve y moderado de origen variados, como el dolor de cabeza, períodos menstruales, resfríos, dolor en los dientes y dolores musculares.[22] Sin embargo, no es efectiva para el dolor visceral severo. La aspirina y otros antiinflamatorios no esteroideos (AINES) se han combinado con analgésicos opioides para el tratamiento del dolor causado por el cáncer, donde los efectos antiinflamatorios actúan sinergísticamente con los opioides para aumentar la analgesia. La combinación de aspirina con oxicodona —una clase de analgésicos narcóticos— se usa para aliviar desde el dolor moderado al moderadamente intenso.[39]
- Enfermedad de Kawasaki, especialmente a dosis elevadas durante la fase febril.[40]
- Fiebre reumática, sobre todo la artritis reumatoide.
- Enfermedades autoinmunes tipo lupus eritematoso.[22]
- Otros trastornos inflamatorios de las articulaciones.
Protección cardiovasscular
La aspirina disminuye la incidencia de ataques isquémicos, la angina inestable, trombosis de una arteria coronaria con infarto agudo de miocardio y la trombosis secundaria a un bypass coronario.[22]
Otros usos
Ciertos estudios epidemiológicos sugieren que el uso a largo plazo de la aspirina a bajas dosis se asocia con una reducción en la incidencia del cáncer colorrectal,[41][42][43][44] así como el cáncer de pulmón,[45][46] posiblemente por su asociación con efectos inhibitorios sobre la COX producida por adenocarcinomas,[47] efectos supresores de prostaglandinas[48] o incluso efectos directamente antimutagénicos.[49] También se ha estudiado el papel que juega la aspirina en reducir la incidencia de otras formas de cáncer. En varios estudios se demostró que la aspirina no reduce la aparición del cáncer de próstata.[50][51] Sus efectos en la prevención del cáncer de páncreas son mixtos, un estudio de 2004 encontró un aumento estadísticamente importante en el riesgo de contraer cáncer pancreático en mujeres que tomaban aspirina,[52] mientras que un metaanálisis de varios estudios publicado en 2006 no encontró evidencias concluyentes de que la aspirina u otros AINEs estuvieran asociados a un riesgo aumentado de esta forma de cáncer.[53] Es posible que la aspirina también tenga efectos positivos sobre el cáncer del tracto digestivo superior, pero las evidencias siguen aún siendo inconclusas.[54] [55]
Se ha hipotetizado que la aspirina es capaz de reducir la formación de cataratas en pacientes diabéticos, aunque en al menos un estudio se demostró que no es eficaz en esa acción.[56]
Dosificación
Las dosis óptimas para alcanzar los efectos analgésicos o antipiréticos de la aspirina son menores de 0,6 a 0,65 gramos por vía oral. Dosis más elevadas pueden prolongar el efecto. La dosis habitual suele ser repetida cada 4 horas. La dosis antiinflamatoria en niños es de 50–75 mg por cada kg de peso del niño cada día dividida en varias dosis durante el día. La dosis de entrada promedio para un adulto es de 45 mg/kg/día en dosis divididas.
Efectos adversos
A las dosis habituales, los efectos adversos más comunes de la aspirina son la irritación gástrica, náuseas, vómitos, úlcera gástrica o duodenal,[22] mientras que la hepatotoxicidad, asma, cambios en la piel y nefrotoxicidad son menos frecuentes. Se ha reportado que ocurre adaptación de la mucosa en pacientes con úlceras asociadas a la administración de aspirina de modo que se ha demostrado el mejoramiento espontáneo con el tiempo sin descontinuar la toma de la aspirina.[14]
Su ingesta abusiva produce nefritis, que son los procesos inflamatorios y/o disfuncionales del riñón y vasodilatación periférica por acción directa sobre el músculo liso. A dosis altas algunos pacientes han reportado vómitos, acúfenos, disminución de la audición, delirio, psicosis, estupor y vértigo los cuales son reversibles al reducir la dosis. A dosis aún mayores de salicilatos aparece una respiración profusa y coma resultado de un efecto directo sobre el bulbo raquídeo.[14] A niveles tóxicos de salicilatos se presenta alcalosis respiratoria seguida de acidosis metabólica por acumulación del salicilato, depresión respiratoria, cardiotoxicidad e intolerancia a la glucosa. Dos gramos o aún menos de aspirina al día pueden aumentar los niveles de ácido úrico en sangre, mientras que las dosis que sobrepasan los 4 gramos diarios disminuyen los uratos. Igual que el resto de los AINEs, la aspirina puede causar una elevación en las enzimas hepáticas, hepatitis, disfunción renal, sangrado y asma.
Sangrado
Algunas personas se ven menos afectadas que otras por el efecto antiplaquetario de la aspirina. Un estudio ha sugerido que las mujeres son más resistentes a los efectos plaquetarios de la aspirina que los hombres[57][58] y en otro estudio, cerca de un 30% de los pacientes evaluados eran así de resistentes a la acción secundaria de la aspirina.[59]
En ciertas ocasiones, puede aparecer un ligero sangrado gastrointestinal, por lo general causado por una gastritis erosiva que, con el tiempo, puede producir una deficiencia de hierro. En su forma comercial, no se debe administrar en niños menores de 12 años que padezcan gripe o varicela (por lo general se usa paracetamol en vez) y/o usar en conjunto con otros salicilatos, ya que puede conducir al Síndrome de Reye, enfermedad rara, pero muy grave.[4] La administración de aspirina durante un cuadro de dengue no se recomienda por razón de un aumento en el riesgo de hemorragias.[60]
La administración de aspirina en madres antes del parto puede causar trastornos hemostásicos en recién nacidos, incluyendo petequias, hematuria, cefalohematoma, hemorragia conjuntival y sangrado durante o después de una circuncisión. Por su parte, las madres pueden presentar con sangrado confinado al período intraparto o puerperio. Por ello, la administración de aspirina debe ser evitada durante el embarazo y si se sospecha que la madre ha tomado aspirina en los cinco días antes del parto, el recién nacido debe ser evaluado para descartar sangrados.[61]
Respecto a otras reacciones adversas (RAM), y a modo de resumen, se incluye una tabla siguiendo los criterios de la CIOSM.
| Sistema implicado | Grupo CIOSM. | Tipo de reacción |
| Aparato digestivo | Frecuentes | Úlcera gástrica, úlcera duodenal, hemorragia gastrointestinal (melenas, hematemesis), dolor abdominal, dispepsia, náuseas, vómitos. |
| Poco frecuentes | Hepatitis | |
| Aparato respiratorio | Frecuentes | Espasmo bronquial paroxístico, disnea grave, rinitis. |
| Piel y tejido subcutáneo | Frecuentes | Urticaria, erupciones cutáneas, angioedema. |
| Poco frecuentes | Sudoración | |
| Sangre y sistema linfático | Frecuentes | Hipoprotrombinemia |
| Sistema nervioso | Poco frecuentes | Mareos, confusión, tinnitus, sordera |
| Genitourinario | Raros | Insuficiencia renal y nefritis intersticial aguda |
| Otros | Poco frecuentes | Síndrome de Reye, cefalea. |
| Raros | Reacciones anafilácticas o anafilactoides | |
De forma global, puede afirmarse que entre el 5% y el 7% de los pacientes experimenta algún tipo de efecto adverso.[37]
Sobredosis
Tomar más de 150 mg/kg de aspirina puede provocar resultados graves e incluso mortales si no se recibe tratamiento. Para un adulto pequeño, eso equivale aproximadamente a tomar 20 tabletas que contienen 325 mg de aspirina. Los niños pueden resultar afectados con niveles mucho más bajos.[62]
Los pacientes con una sobredosis accidental o intencional de aspirina son sometidos a un lavado gástrico con carbón activado y se instala una producción abundante de orina alcalina. De presentar trastornos como hipertermia o desequilibrios en los electrolitos, deben ser restablecidos.[14] En las intoxicaciones severas, puede que sea necesaria la hemodiálisis o, rara vez, la ventilación asistida. A menudo se emplean infusiones de bicarbonato de sodio para alcalinizar la orina conllevando a un aumento en el salicilato excretado fuera del cuerpo.[62]
Contraindicaciones
La acción antiplaquetaria de la aspirina hace que esté contraindicada en pacientes con hemofilia.[63] Aunque en el pasado no se recomendaba el uso de la aspirina durante el embarazo, la aspirina puede tener utilidad en el tratamiento de la preeclampsia y aún en la eclampsia.[14]
La aspirina no debe administrarse en personas con antecedentes alérgicos al ibuprofeno o al naproxen,[64][65] o quienes sean de alguna forma intolerantes a los salicilatos[66][67] o a los AINEs y se debe ejercer moderación en la prescripción de aspirina a pacientes asmáticos o con broncoespasmo inducida por los AINEs. Por motivo de su acción sobre la mucosa estomacal, se recomienda que los pacientes con enfermedad renal, úlceras pépticas, diabetes, gota o gastritis consulten con un profesional de la salud antes de tomar aspirina.[64][63] Aún en la ausencia de estas enfermedades, siempre existe el riesgo de sangrado gastrointestinal cuando se combina la aspirina con el licor o la warfarina.[64][65]
Se ha demostrado que la aspirina puede causar anemia hemolítica en pacientes con deficiencia de glucosa-6-fosfato deshidrogenasa (G6PD), en especial a grandes dosis y dependiente de la severidad de la enfermedad.[68][69]
Presentaciones
Respecto a las dosis, habitualmente las más bajas (300 mg o menos) se suelen utilizar como antiagregante plaquetario, ya que su uso en niños se ha restringido mucho. Las más elevadas se utilizan buscando el efecto analgésico/antipirético o el antirreumático. Respecto a las presentaciones se puede decir que prácticamente se han estudiado todas las posibles formas galénicas para el uso clínico del ácido acetilsalicílico. Las que a continuación se describen son las más comúnmente utilizadas:
- Comprimidos de 25 mg, 100 mg, 125 mg, 250 mg, 300 mg, 500 mg, 650 mg
- Comprimidos masticables de 500 mg
- Comprimidos efervescentes de 500 mg
- Comprimidos recubiertos de 100 mg y 300 mg
- Granulado efervescente, sobres de 500 mg
- Cápsulas (asociado a otros fármacos) para presentación retard
- También podemos encontrarlo en dosificaciones inusuales, como la de 267 mg, asociado a otras sustancias.
Igualmente, existen multitud de presentaciones con otros fármacos asociados, habitualmente para el tratamiento de procesos catarrales. Es el caso de las asociaciones con fenilefrina, clorfenamina, cafeína, vitamina C (ácido ascórbico levógiro) o sustancias del complejo vitamínico B. Otras veces se asocia a otros fármacos para aumentar su efecto antiagregante (dipiridamol), o analgésico (paracetamol).
Respecto a los excipientes habituales se da una situación parecida. Tanto la forma galénica como las características organolépticas del fármaco obligan al uso de determinado tipos de excipientes. Sin embargo, el gran número de laboratorios que lo fabrican como fármaco genérico hace que los excipientes que podamos encontrarnos sean sumamente variables. No obstante a continuación se listan los que se suelen incluir en la forma comercial Aspirina (probablemente la más vendida en el mundo) y algunos de los más usuales en las formas genéricas:
- Colorantes:
- Conservantes y antioxidantes:
- ácido ascórbico (E-200),
- Citratos: ácido cítrico anhidro (E-330), citrato de sodio (E-331)
- Estabilizantes y emulgentes:
- Celulosa en polvo (E-460 II)
- Estearato de calcio, (E-470 A)
- Reguladores del pH y antiaglutinantes:
- Carbonatos: carbonato de sodio (E-500), Hidrogenocarbonato de sodio (E-500 I), carbonato de magnesio pesado (E-504)
- Otros:
- Edulcorantes, como el aspartamo (E-951), el manitol (E-421) o el almidón de maíz, (gelificante y espesante)
- Aromatizantes muy variables, entre ellos el aroma de zumo de mandarina, aroma de naranja o aroma seco especial,
- Carmelosa de sodio, celulosa microcristalina.
- Los comprimidos recubiertos suelen llevar en la capa externa copolímero de ácido metacrílico tipo C, dodecilsulfato de sodio (E-514), polisorbato 80, talco o citrato de trietilo (E-1505).
Notas y referencias
- ↑ Lewis, H D; J W Davis, D G Archibald, W E Steinke, T C Smitherman, J E Doherty, H W Schnaper, M M LeWinter, E Linares, J M Pouget, S C Sabharwal, E Chesler, H DeMots (18 de agosto de 1983). «Protective effects of aspirin against acute myocardial infarction and death in men with unstable angina. Results of a Veterans Administration Cooperative Study». The New England journal of medicine 309 (7): 396-403. ISSN 0028-4793.
- ↑ Julian, D G; D A Chamberlain, S J Pocock (24 de septiembre de 1996). «A comparison of aspirin and anticoagulation following thrombolysis for myocardial infarction (the AFTER study): a multicentre unblinded randomised clinical trial». BMJ (British Medical Journal) 313 (7070): 1429-1431. PMID 8973228. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda); - ↑ Krumholz, Harlan M.; Martha J. Radford, Edward F. Ellerbeck, John Hennen, Thomas P. Meehan, Marcia Petrillo, Yun Wang, Timothy F. Kresowik, Stephen F. Jencks (15 de noviembre de 1995). «Aspirin in the Treatment of Acute Myocardial Infarction in Elderly Medicare Beneficiaries : Patterns of Use and Outcomes». Circulation 92 (10): 2841-2847. PMID 7586250. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda); - ↑ a b Macdonald S (2002). «Aspirin use to be banned in under 16 year olds». BMJ 325 (7371): 988. PMC 1169585. PMID 12411346. doi:10.1136/bmj.325.7371.988/c.
- ↑ a b c Mary Bellis (1997). «History of Aspirin». About.com: Inventors (en inglés). Consultado el 21 de noviembre de 2008.
- ↑ O'Mathuna, Donal; Walt Larimore (2006). «Willow Bark». Alternative Medicine (en inglés). Zondervan. p. 470. ISBN 0310269997. Consultado el 21 de noviembre de 2008.
- ↑ An Account of the Success of the Bark of the Willow in the Cure of Agues. In a Letter to the Right Honourable George Earl of Macclesfield, President of R. S. from the Rev. Mr. Edmund Stone, of Chipping-Norton in Oxfordshire. Publicado en «Philosophical Transactions» Volumen 53 por el Royal Society de Londres, 1763
- ↑ a b c K. C. Nicolaou, Tamsyn Montagnon. Molecules That Changed the World (en inglés). Publicado por Wiley-VCH, 2008, pág. 13-14. ISBN 3-527-30983-7.
- ↑ Más de 100 años: La historia de aspirina (en español). Bayer Health Care. Último acceso 21 de noviembre 2008.
- ↑ a b Jeffreys, Diarmuid (2004). Aspirin: The Remarkable Story of a Wonder Drug (en inglés). Bloomsbury. ISBN 1582343861. Consultado el 21 de noviembre de 2008.
- ↑ LA HISTORIA DE LA ASPIRINA (en español). Bayer Health Care. Último acceso 21 de noviembre, 2008.
- ↑ Aspirina Diccionario de la lengua española de la Real Academia Española, edición 22. Último acceso 7 de noviembre, 2008.
- ↑ Inhibition of prostaglandin synthesis as a mechanism of action for aspirin-like drugs. John Robert Vane. Nature - New Biology. 1971(231.25:232-5)
- ↑ a b c d e f g h i j k l Katzung, Bertram G. (2007). «Chapter 36. Nonsteroidal Anti-Inflammatory Drugs, Disease-Modifying Antirheumatic Drugs, Nonopioid Analgesics, & Drugs Used in Gout». Basic & Clinical Pharmacology (9 edición). McGraw-Hill. ISBN 0071451536.
- ↑ [Revista Muy Interesante, especial Verano 2008 de preguntas y respuestas].
- ↑ a b Warner, T. D.; Warner TD, Mitchell JA. (15 de octubre de 2002). «Cyclooxygenase-3 (COX-3): filling in the gaps toward a COX continuum?». Proc Natl Acad Sci U S a 99 (21): 13371-3. PMID 12374850. doi:10.1073/pnas.222543099. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda); - ↑ El 85% de la fabricación de Aspirina se hace en Asturias.
- ↑ «Acetylsalicylic acid». Jinno Laboratory, School of Materials Science, Toyohashi University of Technology. March 1 1996. Consultado el 7 setiembre 2007.
- ↑ Carstensen, J.T.; F Attarchi and XP Hou (July de 1985). «Decomposition of aspirin in the solid state in the presence of limited amounts of moisture». Journal of Pharmaceutical Sciences 77 (4): 318-21. PMID 4032246. doi:10.1002/jps.2600770407.
- ↑ Barrans, Richard. «Aspirin Aging». Newton BBS. Consultado el 8 de mayo de 2008.
- ↑ Palleros, Daniel R. (2000). Experimental Organic Chemistry. New York: John Wiley & Sons. p. 494. ISBN 0-471-28250-2.
- ↑ a b c d e [MedlinePlus] Comprueba el valor del
|enlaceautor=(ayuda) (enero de 2007). «Aspirina». Enciclopedia médica en español. Consultado el 7 de novimebre, 2008. - ↑ Salud.com. «Aspirina (Oral)». Medicamentos. Consultado el 18 de noviembre de 2008. «Efectos más comunes (menos comunes con la aspirina con recubrimiento entérico o amortiguada) -- Retortijones, dolor o molestia del abdomen o estómago (de leve a Muy fuerte); ardor de estómago o indigestión; náuseas o vómitos.»
- ↑ Gerhard Levy. Clinical Pharmacokinetics of Aspirin (en inglés). PEDIATRICS Vol. 62 No. 5s November 1978, pp. 867-872. Último acceso 18 de noviembre, 2008.
- ↑ Ferguson, RK; Boutros, AR (17 de agosto de 1970). «Death following self-poisoning with aspirin». Journal of the American Medical Association. PMID 5468267.
- ↑ Kaufman, FL; Dubansky, AS (1970-04). «Darvon poisoning with delayed salicylism: a case report». Pediatrics 49 (4): 610-1. PMID 5013423.
- ↑ a b Levy, G; Tsuchiya, T (31-09-1972). «Salicylate accumulation kinetics in man». New England Journal of Medicine 287 (9): 430-2. PMID 5044917.
- ↑ John Robert Vane (1971). «Inhibition of prostaglandin synthesis as a mechanism of action for aspirin-like drugs». Nature - New Biology 231 (25): 232-5. PMID 5284360.
- ↑ Vane JR, Botting RM (June de 2003). «The mechanism of action of aspirin» (PDF). Thromb Res 110 (5-6): 255-8. PMID 14592543. doi:10.1016/S0049-3848(03)00379-7.
- ↑ Somasundaram, S. et al. (2000). «Uncoupling of intestinal mitochondrial oxidative phosphorylation and inhibition of cyclooxygenase are required for the development of NSAID-enteropathy in the rat». Aliment Pharmacol Ther 14: 639-650. doi:10.1046/j.1365-2036.2000.00723.x (inactivo 2008-06-24). Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda) - ↑ Mark J. Paul-Clark, Thong van Cao, Niloufar Moradi-Bidhendi, Dianne Cooper, and Derek W. Gilroy 15-epi-lipoxin A4–mediated Induction of Nitric Oxide Explains How Aspirin Inhibits Acute Inflammation J. Exp. Med. 200: 69-78; published online before print as 10.1084/jem.20040566
- ↑ McCarty, MF; KI Block (2006). «Preadministration of high-dose salicylates, suppressors of NF-kappaB activation, may increase the chemosensitivity of many cancers: an example of proapoptotic signal modulation therapy». Integr Cancer Ther. Vol 5 (3): 252-268. PMID 16880431. doi:10.1177/1534735406291499.
- ↑ «Aspirin in Heart Attack and Stroke Prevention». American Heart Association. Consultado el 8 de mayo de 2008.
- ↑ Tohgi, H; S Konno, K Tamura, B Kimura and K Kawano (1992). «Effects of low-to-high doses of aspirin on platelet aggregability and metabolites of thromboxane A2 and prostacyclin». Stroke. Vol 23: 1400-1403. PMID 1412574.
- ↑ Ridker, Paul M. y col. http://www.obgynsurvey.com/pt/re/obgynsurv/abstract.00006254-200508000-00018.htm;jsessionid=JVpp1KWVRCH2Qx6nSFFRQq6zPFlT1DMXFf1JyT1mGvzv4GhhyJrD!1600976923!181195628!8091!-1 A Randomized Trial of Low-Dose Aspirin in the Primary Prevention of Cardiovascular Disease in Women. Obstetrical & Gynecological Survey. 60(8):519-521.
- ↑ Artículo por HealthDay, citado por MedlinePlus (17 de octubre de 2008). «La aspirina no previene el primer ataque cardiaco ni el primer accidente cerebrovascular». Enciclopedia médica en español. Consultado el 7 de noviembre de 2008.
- ↑ a b c d e Agencia española de medicamentos y productos sanitarios. Información de fichas técnicas autorizadas. Enlace consultado el 4 de diciembre del 2008.
- ↑ MacDonald TM, Wei L. Effect of ibuprofen on cardioprotective effect of aspirin. 1: Lancet. 2003 Feb 15;361(9357):573-4. Citado 8 de noviembre, 2008. PMID: 12598144.
- ↑ [MedlinePlus] Comprueba el valor del
|enlaceautor=(ayuda) (enero de 2004). «Aspirina y Oxicodona». Enciclopedia médica en español. Consultado el 7 de noviembre de 2008. - ↑ Probable efficacy of high-dose salicylates in reducing coronary involvement in Kawasaki disease (en inglés). Koren, G., Rose, V., Lavi, S., Rowe, R. JAMA Vol. 254 No. 6, 9 de agosto, 1985.
- ↑ Thun MJ, Namboodiri MM, Heath CW (1991). «Aspirin use and reduced risk of fatal colon cancer». N Engl J Med 325 (23): 1593-6. PMID 1669840.
- ↑ Baron, et al. (2003). «A randomized trial of aspirin to prevent colorectal adenomas». N Engl J Med 348 (10): 891-9. PMID 12621133. doi:10.1056/NEJMoa021735.
- ↑ Chan, et al. (2004). «A Prospective Study of Aspirin Use and the Risk for Colorectal Adenoma». Ann Intern Med 140 (3): 157-66. PMID 14757613.
- ↑ Chan, et al. (2005). «Long-term Use of Aspirin and Nonsteroidal Anti-inflammatory Drugs and Risk of Colorectal Cancer». JAMA 294 (8): 914-23. PMID 16118381. doi:10.1001/jama.294.8.914.
- ↑ Akhmedkhanov, et al. (2002). «Aspirin and lung cancer in women». Br J cancer 87 (11): 1337-8. PMID 12085255. doi:10.1038/sj.bjc.6600370.
- ↑ Moysich KB, Menezes RJ, Ronsani A, et al (2002). «Regular aspirin use and lung cancer risk». BMC Cancer 2: 31. PMID 12453317. Free full text
- ↑ Wolff, et al. (1998). «Expression of cyclooxygenase-2 in human lung carcinoma». Cancer Research 58 (22): 4997-5001. PMID 9823297.
- ↑ Suppression of human colorectal mucosal prostaglandins: determining the lowest effective aspirin dose (artículo completo disponible en inglés). Ruffin, M.T., Krishnan, K., Rock, C.L., Normolle, D., Vaerten, M.A., Peters-Golden, M., Crowell, J., Kelloff, G., Boland, C.R., Brenner, D.E. J Natl Cancer Inst. agosto 1997 6;89 (15):1152-60.
- ↑ Lusânia Maria Greggi Antunes y cols. Acetylsalicylic acid exhibits anticlastogenic effects on cultured human lymphocytes exposed to doxorubicin (en inglés). Volume 626, Issues 1-2, 10 enero 2007, Pages 155-161. Último acceso 21 de noviembre, 2008.
- ↑ Bosetti, et al. (2006). «Aspirin and the risk of prostate cancer». Eur J Cancer Prev 15 (1): 43-5. PMID 16374228. doi:10.1097/01.cej.0000180665.04335.de.
- ↑ Menezes, et al. (2006). «Regular use of aspirin and prostate cancer risk (United States)». Cancer Causes & Control 17 (3): 251-6. PMID 16489532. doi:10.1007/s10552-005-0450-z.
- ↑ Schernhammer, et al. (2004). «A Prospective Study of Aspirin Use and the Risk of Pancreatic Cancer in Women». J Natl Cancer Inst 96 (1): 22-28. PMID 14709735. doi:10.1093/jnci/djh001.
- ↑ Larsson SC, Giovannucci E, Bergkvist L, Wolk A (December de 2006). «Aspirin and nonsteroidal anti-inflammatory drug use and risk of pancreatic cancer: a meta-analysis». Cancer Epidemiol. Biomarkers Prev. 15 (12): 2561-4. PMID 17164387. doi:10.1158/1055-9965.EPI-06-0574.
- ↑ Jayaprakash, Vijayvel; Jayaprakash V, Menezes RJ, Javle MM, McCann SE, Baker JA, Reid ME, Natarajan N, Moysich KB. (01-07-2006). «Regular aspirin use and esophageal cancer risk». Int J Cancer 119 (1): 202-7. PMID 16450404. doi:10.1002/ijc.21814.
- ↑ Bosetti, et al. (2003). «Aspirin use and cancers of the upper aerodigestive tract». Br J Cancer 88 (5): 672-74. PMID 12618872. doi:10.1038/sj.bjc.6600820.
- ↑ Chew EY, Williams GA, Burton TC, Barton FB, Remaley NA, Ferris FL (1992). «Aspirin effects on the development of cataracts in patients with diabetes mellitus. Early treatment diabetic retinopathy study report 16». Arch Ophthalmol 110 (3): 339-42. PMID 1543449.
- ↑ «Aspirin may be less effective heart treatment for women than men». University of Michigan. 26-04-2007. Consultado el 9 setiembre 2007.
- ↑ Dorsch MP, Lee JS, Lynch DR, Dunn SP, Rodgers JE, Schwartz T, Colby E, Montague D, Smyth SS (24 Apr de 2007). «Aspirin Resistance in Patients with Stable Coronary Artery Disease with and without a History of Myocardial Infarction». Ann Pharmacother 41 (May): 737. PMID 17456544. doi:10.1345/aph.1H621.
- ↑ Increased risk of heart attack or stroke for patients who are resistant to aspirin. 17 de enero de 2008. Consultado el 20 de enero de 2008.
- ↑ Dengue and Dengue Hemorrhagic Fever: Information for Health Care Practitioners, consultado el 28 de abril de 2008.
- ↑ Stuart MJ, Gross SJ, Elrad H, Graeber JE. Effects of acetylsalicylic-acid ingestion on maternal and neonatal hemostasis (en inglés). N Engl J Med. 1982 Oct 7;307(15):909-12. PMID: 7110272.
- ↑ a b [MedlinePlus] Comprueba el valor del
|enlaceautor=(ayuda) (febrero de 2007). «Sobredosis de aspirina». Enciclopedia médica en español. Consultado el 7 de novimebre, 2008. - ↑ a b PDR® Guide to Over the Counter (OTC) Drugs, consultado el 28 de abril de 2008..
- ↑ a b c «Aspirin information from Drugs.com». Drugs.com. Consultado el 8 de mayo de 2008.
- ↑ a b «Oral Aspirin information». First DataBank. Consultado el 8 de mayo de 2008.
- ↑ Raithel M, Baenkler HW, Naegel A, et al (septiembre de 2005). «Significance of salicylate intolerance in diseases of the lower gastrointestinal tract» (PDF). J. Physiol. Pharmacol. 56 Suppl 7: 89-102. PMID 16247191.
- ↑ Senna GE, Andri G, Dama AR, Mezzelani P, Andri L (1995). «Tolerability of imidazole salycilate in aspirin-sensitive patients». Allergy Proc 16 (5): 251-4. PMID 8566739.
- ↑ G6PD (Glucose-6-Phosphate Dehydrogenase) Deficiency, University of Virginia, consultado el 8 de mayo de 2008.
- ↑ G6PD (Glucose-6-Phosphate Dehydrogenase) Deficiency, University of Texas Medical Branch, consultado el 8 de mayo de 2008.
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Ácido acetilsalicílico.
Wikimedia Commons alberga una galería multimedia sobre Ácido acetilsalicílico.- Aspirina.com, de Bayer
- Documento FDA sobre Aspirina
- Aspirina como prevención primaria en diabéticos
