Archaea
| Arqueas | ||
|---|---|---|
| Rango temporal: 4280–0Ma [1] Hádico – Reciente | ||
 A la izquierda: Methanosarcina, Ignicoccus con Nanoarchaeum, ARMAN y Haloquadratum. A la derecha: Methanohalophilus, Pyrococcus, Prometheoarchaeum y Halobacterium. | ||
| Taxonomía | ||
| Dominio: |
Archaea Woese, Kandler y Wheelis, 1990[2] | |
| Supergrupos y filos[4] | ||
| Sinonimia | ||
| ||
Las arqueas (Archaea; et: del griego αρχαία [arjaía], «las antiguas»), a veces llamadas árqueas, son un gran grupo de microorganismos procariotas unicelulares que, al igual que las bacterias, no presentan núcleo (pero sí nucleolo) ni orgánulos membranosos internos, pero son fundamentalmente diferentes a estas, de tal manera que conforman su propio dominio o reino.
En el pasado se agruparon en el antiguo reino Monera, y cuando fueron identificadas como grupo en 1977, recibieron el nombre de arqueobacterias (reino Archaebacteria), pero esta clasificación ya no se utiliza.[5] En realidad, las arqueas tienen una historia evolutiva independiente y muestran muchas diferencias bioquímicas y genéticas con las otras formas de vida, por lo que se clasificaron en un dominio separado dentro del sistema de tres dominios: Archaea, Bacteria y Eukarya.
Las arqueas son un dominio (y también un reino)[6] que se divide en múltiples filos. Los grupos Crenarchaeota (Thermoproteia) y Euryarchaeota son los más estudiados. La clasificación de las arqueas todavía es difícil, porque la gran mayoría nunca se han estudiado en el laboratorio y solo se han detectado mediante análisis de sus ácidos nucleicos en muestras tomadas de diversos ambientes.
Las arqueas y bacterias son bastante similares en tamaño y forma, aunque algunas arqueas tienen formas muy inusuales, como las células aplanadas y cuadradas de Haloquadratum walsbyi.[7] A pesar de esta semejanza visual con las bacterias, las arqueas poseen genes y varias rutas metabólicas que son más cercanas a las de los eucariotas, en especial en las enzimas implicadas en la transcripción y la traducción. Otros aspectos de la bioquímica de las arqueas son únicos, como los éteres lipídicos de sus membranas celulares. Las arqueas explotan una variedad de recursos mucho mayores que los eucariotas, desde compuestos orgánicos comunes como los azúcares, hasta el uso de amoníaco,[8] iones de metales o incluso hidrógeno como nutrientes. Las arqueas tolerantes a la sal (las haloarqueas) utilizan la luz solar como fuente de energía, y otras especies de arqueas fijan carbono;[9] sin embargo, a diferencia de las plantas y las cianobacterias, no se conoce ninguna especie de arquea que sea capaz de ambas cosas. Las arqueas se reproducen asexualmente y se dividen por fisión binaria,[10] fragmentación o gemación; a diferencia de las bacterias y los eucariotas, no se conoce ninguna especie de arquea que forme esporas.[11]
Inicialmente, las arqueas eran consideradas todas metanógenas o extremófilas que vivían en ambientes hostiles tales como aguas termales y lagos salados, pero actualmente se sabe que están presentes en los más diversos hábitats, tales como el suelo, océanos, pantanos y en el colon humano. Las arqueas son especialmente numerosas en los océanos, y las que forman parte del plancton podrían ser uno de los grupos de organismos más abundantes del planeta. Actualmente se consideran una parte importante de la vida en la Tierra y podrían desempeñar un papel importante tanto en el ciclo del carbono como en el ciclo del nitrógeno. No se conocen ejemplos claros de arqueas patógenas o parásitas, pero suelen ser mutualistas o comensales. Son ejemplos las arqueas metanógenas que viven en el intestino de los humanos y los rumiantes, donde están presentes en grandes cantidades y contribuyen a digerir el alimento. Las arqueas tienen su importancia en la tecnología, hay metanógenos que son utilizados para producir biogás y como parte del proceso de depuración de aguas, y las enzimas de arqueas extremófilas son capaces de resistir temperaturas elevadas y disolventes orgánicos, siendo por ello utilizadas en biotecnología.
Historia
[editar]El grupo de arqueas que se ha estudiado desde más antiguo es el de las metanógenas. La metanogénesis fue descubierta en el lago Mayor de Italia en 1776, al observar en él el burbujeo de "aire combustible". En 1882 se observó que la producción de metano en el intestino de animales se debía a la presencia de microorganismos (Popoff, Tappeiner, y Hoppe-Seyler).[12]
En 1936, año que marcó el principio de la era moderna en el estudio de la metanogénesis, H.A Barker brindó las bases científicas para el estudio de su fisiología y logró desarrollar un medio de cultivo apropiado para el crecimiento de los metanógenos. En ese mismo año se identificaron los géneros Methanococcus y Methanosarcina.[13]
Las primeras arqueas extremófilas se encontraron en ambientes calientes. En 1970, Thomas D. Brock de la Universidad de Wisconsin descubrió a Thermoplasma, un arquea termoacidófila y en 1972 a Sulfolobus, una hipertermófila.[14] Brock se inició en 1969 en el campo de la biología de los hipertermófilos con el descubrimiento de la bacteria Thermus.
En 1977 se identifica a las arqueas como el grupo prokaryota más distante al descubrir que los metanógenos presentan una profunda divergencia con todas las bacterias estudiadas. Ese mismo año se propone la categoría de superreino para este grupo con el nombre de Archaebacteria. En 1978, el manual de Bergey le da la categoría de filo con el nombre de Mendosicutes y en 1984 divide al reino Procaryotae o Monera en 4 divisiones, agrupándolas en la división Mendosicutes.[15]
Las arqueas hipertermófilas se agruparon en 1984 bajo el nombre Eocyta, identificándolas como un grupo independiente de las entonces llamadas arqueobacterias (en referencia a los metanógenos) y las eubacterias, descubriéndose además que Eocyta era el grupo más cercano a las eucariotas.[16] La relación filogenética entre metanógenos e hipertermófilos hace que en 1990 se renombre a Eocyta como Crenarchaeota y a las metanógenas como Euryarchaeota, formando el nuevo grupo Archaea como parte del sistema de tres dominios.[17]
En febrero de 2023 se descubrió que un grupo de arqueas sí presentan nucléolo, rompiendo por completo el paradigma de la microbiología, esto gracias a una colaboración entre la Facultad de Ciencias de la Universidad Nacional Autónoma de México (FC-UNAM), el Instituto de Biología (IB-UNAM) y la King Abdullah University of Science & Technology (KAUST) de Arabia Saudita.[18]
Clasificación
[editar]Nuevo dominio
[editar]A principios del siglo XX, los prokaryotas se consideraban un único grupo de organismos y se clasificaban según su bioquímica, morfología y metabolismo. Por ejemplo, los microbiólogos intentaban clasificar los microorganismos según la estructura de su pared celular, su forma y las sustancias que consumían.[19] Sin embargo, en 1965 se propuso un nuevo sistema,[20] utilizando las secuencias genéticas de estos organismos para averiguar qué prokaryotas están realmente relacionadas entre sí. Este método, conocido como filogenia molecular, es el principal método utilizado desde entonces.

Las arqueas se clasificaron inicialmente en 1977 como un superreino separado de las bacterias, por Carl Woese y George E. Fox en árboles filogenéticos basados en las secuencias de genes de ARN ribosómico (ARNr).[21] Estos dos grupos se denominaron originalmente Eubacteria y Archaebacteria, lo que Woese y Fox denominaron "reinos originales". Woese argumentó que este grupo de prokaryotas es un tipo de vida fundamentalmente distinto. Para enfatizar esta diferencia, usaron el término dominio en 1990 y los rebautizaron Bacteria y Archaea.[17] El nombre científico Archaea proviene del griego antiguo ἀρχαῖα, que significa "los antiguos".[22] El término "arqueobacteria" proviene de la combinación de esta raíz y del término griego baktērion, que significa "pequeño bastón".
Originalmente, solo se clasificaron los metanógenos en este nuevo dominio, luego los considerados extremófilos que solo vivían en hábitats como aguas termales y lagos salados. A finales del siglo XX, los microbiólogos se dieron cuenta de que Archaea son un grupo grande y diverso de organismos ampliamente distribuidos en la naturaleza, y que son comunes en hábitats mucho menos extremos, como suelos y océanos.[23] Esta nueva toma de conciencia de la importancia y la omnipresencia de estos organismos vino del uso de la reacción en cadena de la polimerasa para detectar prokaryotas en muestras de agua o suelo a partir de, únicamente, sus ácidos nucleicos. Esto permite detectar e identificar organismos cuyo cultivo en el laboratorio es complejo.[24][25]
Clasificación actual
[editar]La clasificación de las arqueas, y de los procariotas en general, es un tema en constante fluctuación. Los sistemas actuales de clasificación intentan organizar las arqueas en grupos que comparten rasgos estructurales y antepasados comunes.[26] Estas clasificaciones se basan especialmente en el uso de secuencias de genes de ARN ribosómico para revelar las relaciones entre los organismos (análisis moleculares de ADN).[27] En (2016) figuraban cinco filos en LPSN (List of Prokaryotic names with Standing in Nomenclature, Lista de nombres de prokaryotas con pie en la nomenclatura). Estos eran: Euryarchaeota, Crenarchaeota, Korarchaeota, Nanoarchaeota y Thaumarchaeota. La mayoría de especies de arqueas cultivables y bien investigadas son miembros de dos grupos principales, Euryarchaeota y Crenarchaeota (Thermoproteia). A la peculiar especie Nanoarchaeum equitans, que fue descubierta en 2003, se le ha atribuido su propio filo, Nanoarchaeota.[28] El reciente candidato Korarchaeia contiene un número reducido de inusuales especies termófilas que comparten rasgos de los dos grupos principales, pero que son más cercanas a Thermoproteia (Crenarchaeota).[29][30]
Los análisis genómicos de las muestras tomadas del medio ambiente han revelado un gran número de especies nuevas de arqueas que tienen una relación distante con cualquiera de los grupos conocidos. Por ejemplo, los nanoorganismos arqueobacterianos acidófilos de la mina Richmond (ARMAN), que fueron descubiertos en 2006[31] y están entre los organismos conocidos más pequeños.[32] Así, el número de filos candidatos en 2018 es de catorce.[4][33] Los 19 taxones candidatos conocidos de arqueas se agrupan en cuatro supergrupos, usualmente con rango de filo o superfilo: DPANN, Euryarchaeota, Thermoproteota o TACK y Asgardarchaeota o Asgard.

Las características de los filos son:
- Euryarchaeota: Es el grupo más variado, cuatro clases son metanógenas, tres son termoacidófilas y dos hiperhalófilas. También abundan en ambientes marinos.
- Thermoproteota o TACK:
- Nitrososphaeria: Son quimiolitoautótrofos nitrificantes de ambientes marinos y terrestres.
- Korarchaeia: Son escasas y se encuentran en fuentes termales.
- Thermoproteia, Crenarchaeota o Eocyta: Tienen varias características comunes y generalmente son hipertermófilos, acidófilos, reductores y/u oxidantes del azufre y quimiolitoheterótrofos.
- Candidatos: Caldarchaeales (propuesto en 2011, de características intermedias entre mesófilos e hipertermófilos),[34] Bathyarchaeia y Gearchaeales.
- Asgardarchaeota o Asgard: Contiene las arqueas más próximas a los eucariotas.
- Candidatos: Lokiarchaeia, Odinarchaeia, Thorarchaeia y Heimdallarchaeia.
- Grupo DPANN:
- Nanoarchaeota: Hipertermófilos o acidófilos muy pequeños. Se considera que las nanoarqueas con 300 nm de diámetro, son las procariotas más pequeñas.
- Candidatos: Diapherotrites, Micrarchaeota (los dos anteriores, que contienen arqueas muy pequeñas, se conocían previamente como ARMAN), Aenigmarchaeota, Nanohaloarchaeota, Altiarchaeota, Huberarchaeota y Undinarchaeota.
Filogenia
[editar]Una filogenia algo consensuada en el GTDB database y el Annotree es la siguiente:[35][36]
| Archaea |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Otros análisis filogenéticos han sugerido que DPANN como clado puede no ser monofilético y sería causado por la atracción de ramas largas.[37] Análisis filogenéticos sugirieron que DPANN pertenece a Euryarchaeota, estando el filo Nanohaloarchaeota totalmente separado del resto. El clado de DPANN sin Nanohaloarchaeota se ha nombrado "Micrarchaea".[38] Por esta razón una filogenia alternativa para DPANN es la siguiente:[39][40]
| Archaea |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Especies
[editar]La clasificación de las arqueas en especies también es controvertida. En biología, una especie es un grupo de organismos relacionados. Una definición de especie muy extendida entre los animales es un conjunto de organismos que pueden reproducirse entre ellos y que están reproductivamente aislados de otros grupos de organismos (es decir, no pueden reproducirse con otras especies).[41] Sin embargo, los esfuerzos por clasificar los prokaryotas, como las arqueas, en especies se complican debido a que son asexuales y que presentan un alto nivel de transferencia horizontal de genes entre linajes. Este tema es controvertido; por ejemplo, algunos datos sugieren que en arqueas como Ferroplasma, se pueden agrupar células individuales en poblaciones de genoma muy similar y que raramente transfieren genes a grupos más divergentes de células.[42] Algunos argumentan que estos grupos de células son análogos a especies. Por otra parte, estudios de Halorubrum descubrieron un intercambio genético significativo entre estas poblaciones.[43] Estos resultados han llevado a pensar que clasificar estos grupos de organismos como especies tendría poco sentido práctico.[44]
El conocimiento actual sobre la diversidad de las arqueas es fragmentario, y no se puede estimar con ningún tipo de precisión el número total de especies existentes.[27] Incluso se desconoce el número total de filos arqueobacterianos, de los cuales actualmente hay propuestos 16 y solo ocho tienen representantes que se han cultivado y estudiado directamente. Muchos de estos grupos hipotéticos son conocidos únicamente a partir de una sola secuencia de ARNr, lo que indica que la diversidad de estos organismos permanece completamente desconocida.[45] El problema de cómo estudiar y clasificar microbios no cultivados también se da en las bacterias.[46] Recientemente, y aunque el proyecto plantea las dificultades mencionadas anteriormente, el consorcio público GEBA (acrónimo en inglés de Genomic Enciclopedy of Bacteria and Archaea, Enciclopedia genómica de Bacteria y Archaea) está llevando a cabo la tarea de completar y anotar la mayor cantidad de genomas de estos dos dominios con el fin, entre otros, de llevar a cabo una clasificación basada en el genoma.[47]
Origen y evolución
[editar]


Aunque se han encontrado probables fósiles de prokaryotas de casi 3770-4280 millones de años de antigüedad, la morfología de la mayoría de los prokaryotas y de sus fósiles no permite distinguir entre bacterias y arqueas.[51] En cambio, los "fósiles químicos" de lípidos característicos de las arqueas son más informativos, porque dichos compuestos no aparecen en otros organismos.[52] Algunas publicaciones sugieren que se encuentran lípidos característicos de arqueas o eucariotas, en sedimentos de hace 2700 millones de años;[53] pero estos datos fueron cuestionados.[54] Estos lípidos han sido detectados en rocas que datan del Precámbrico. Los restos más antiguos conocidos de lípidos de isopreno datan del cinturón de Isua, al oeste de Groenlandia, que incluyen sedimentos formados hace 3800 millones de años, siendo estos los más antiguos encontrados hasta la fecha.[55] El linaje de las arqueas podría ser el más antiguo de la Tierra.[56]
Woese consideraba que las bacterias, arqueas y eucariotas representan líneas separadas de descendencia que divergieron temprano en la evolución de colonias ancestrales de organismos.[57][58] Una posibilidad[58][59] es que esto ocurriera antes de la evolución de las células, cuando la falta de una membrana celular típica permitía una transferencia lateral de genes no restringida, y que el antepasado común de los tres dominios originó por fijación de un subconjunto específico de genes.[58][59] Es posible que el último antepasado común de las bacterias y arqueas fuera un termófilo, lo que presenta la posibilidad de que las temperaturas bajas sean "ambientes extremos" para las arqueas, y que los organismos que viven en ambientes más fríos aparecieran más tarde en la historia de la vida en la Tierra.[60] Como Archaea y Bacteria ya no están más relacionados entre sí que lo que son para los eucariotas, el término prokaryota solo tiene el significado de "no-eucariota", lo que limita su utilidad.[61]
Por su parte, Gupta propone que las arqueas evolucionaron a partir de bacterias grampositivas en respuesta a una presión selectiva ejercida por los antibióticos liberados por otras bacterias.[62][63][64] Esta idea está apoyada porque las arqueas son resistentes a una amplia variedad de antibióticos producidos principalmente por las grampositivas,[62][63] y estos antibióticos actúan principalmente sobre genes que distinguen las arqueas. Su propuesta es que la presión selectiva hacia la resistencia a los antibióticos generada por los antibióticos de las grampositivas fue finalmente suficiente para causar grandes cambios en muchos de los genes que eran el objetivo de los mismos, y que estas cepas de microorganismos representaban el ancestro común de las arqueas actuales.[64] La evolución de las arqueas en respuesta a la selección por antibióticos, o cualquier otra presión selectiva competitiva, también podría explicar su adaptación a ambientes extremos (tales como alta temperatura o acidez) como resultado de una búsqueda de nichos ecológicos desocupados para escapar de los organismos productores de antibióticos;[64][65] La propuesta de Gupta está apoyada también por otras investigaciones sobre la relación entre las proteínas estructurales[66] y por los estudios que sugieren que las bacterias grampositivas pueden constituir uno de los linajes que primero ramificaron en los prokaryotas.[67] Cavalier-Smith hizo una sugerencia similar, aunque considera que las bacterias gramnegativas son las más antiguas y que las grampositivas y las arqueas se originaron a partir de ellas por la pérdida de la membrana externa.[68] No obstante, hasta ahora no hay ningún análisis molecular que pueda respaldar estas teorías porque tanto las bacterias como arqueas forman grupos monofiléticos lo que indica que ambos son igualmente antiguos y evolucionaron del último antepasado común universal.
Se ha sugerido que el último antepasado común universal de bacterias y arqueas es un termófilo que vivió hace 4350 millones de años durante el eón Hádico.[49] La bifurcación entre arqueas y bacterias se produjo a mediados del Hádico, mientras que los eucariotas son más recientes y surgieron a finales del Paleoproterozoico. Las arqueas ultrapequeñas (DPANN) y el filo Euryarchaeota se separaron del resto de las arqueas a finales del Hádico y a comienzos del Arcaico. Proteoarchaeota que incluye los supergrupos Thermoproteota y Asgard se originaron a mediados del Arcaico.[69][49][50] La separación de Asgard y los eucariotas se calculó a finales del Arcaico (periodo Neoarcaico).[70]
Relaciones con otros procariotas
[editar]La relación entre los tres dominios es de gran importancia para comprender el origen de la vida. La mayoría de las vías metabólicas, que implican la mayoría de los genes de un organismo, son comunes entre arqueas y bacterias, y la mayoría de los genes implicados en la expresión del genoma son comunes entre Archaea y Eukarya.[71] En los prokaryotas la estructura de la celda de las arqueas es muy similar a las bacterias grampositivas, principalmente porque ambas tienen una bicapa lipídica[62] y generalmente contiene un grueso sáculo de composición química variada.[72] En los árboles filogenéticos basados en las secuencias de diferentes genes/proteínas de homólogos procarióticos, los homólogos de arqueas están más cerca de los de las bacterias grampositivas.[62] Las arqueas y las bacterias grampositivas también comparten indeles en varias proteínas importantes, como la Hsp70 y la glutamina sintetasa I.[62][63][73]
Relaciones con las eucariotas
[editar]La relación evolutiva entre las arqueas y los eucariotas es generalmente aceptada, aunque hay detalles que todavía se desconocen. Además de las similitudes en la estructura y las funciones celulares que serán discutidas más adelante, muchos árboles genéticos agrupan los dos linajes. La hipótesis principal es que el antepasado arqueano de las eucariotas divergió muy temprano[74][75] y que las eucariotas son el resultado de la fusión de esta arquea con una proteobacteria. Esto explicaría varias similitudes genéticas, pero resulta difícil explicar la estructura celular.[76] Un paso importante para la comprensión del origen arqueano de la primera célula eucariota fue el descubrimiento del clado TACK o filo Thermoproteota.[77] A continuación se descubrió la clase Lokiarchaeia, un linaje de arqueas que combina todas las características arqueanas compartidas con los eucariotas que previamente se encontraban distribuidas entre diferentes grupos de arqueas.[78] Finalmente se identificó un nuevo supergrupo o filo de arqueas relacionadas con Lokiarchaeia que se denominó Asgardarchaeota o Asgard.[33]
Cruzando estos datos se obtiene un árbol filogenético que agrupa a varios grupos de arqueas con Eukarya (hipótesis del eocito) combinado con la simbiogénesis pre-eucariota,[79][80][33] lo que se puede resumir del siguiente modo:
| Cytota |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Cuestionamiento del sistema de tres dominios
[editar]En las hipótesis anteriores como la de Woese, argumentaron que las bacterias, las arqueas y las eucariotas representaban tres linajes evolutivos distintos que divergieron muchos millones de años atrás de un grupo de ancestral de organismos.[81][82] Otros argumentaron que las arqueas y eucariotas surgieron de un grupo de bacterias.[83] Cavalier-Smith propuso el clado Neomura para representar esta teoría; Neomura significa "paredes nuevas" y hace referencia a la teoría de que las arqueas y los eucariotas hayan derivado de bacterias que (entre otras adaptaciones) sustituirían las paredes de peptidoglicano por otras glucoproteínas. Según Woese, como arqueas y bacterias no estarían relacionadas más estrechamente unas con otras que con los eucariotas, se propuso que el término "prokaryota" no tendría sentido evolutivo auténtico y habría que desecharlo por completo.[61] Sin embargo, muchos biólogos evolutivos creen que en el sistema de tres dominios se exagera la diferencia entre las arqueas y las bacterias, y sostienen que la transición más drástica se produjo entre Prokaryota y Eucariota (sistema de dos imperios), este último de origen más reciente por eucariogénesis y como resultado de la fusión endosimbiótica de por lo menos dos prokaryotas: una arquea y una bacteria.
Morfología
[editar]
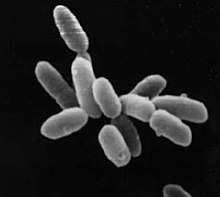
Las arqueas tienen medidas comprendidas entre 0,1 μm y más de 15 μm y se presentan en diversas formas, siendo comunes esferas, barras, espirales y placas.[10] El grupo Crenarchaeota incluye otras morfologías, como células lobuladas irregularmente en Sulfolobus, finos filamentos de menos de 0,5 μm de diámetro en Thermofilum y barras casi perfectamente rectangulares en Thermoproteus y Pyrobaculum.[84] Recientemente, se ha descubierto en piscinas hipersalinas una especie de forma cuadrada y plana (como un sello de correos) denominada Haloquadra walsbyi.[85] Estas formas inusuales probablemente se mantienen tanto por la pared celular como por un citoesqueleto procariótico, pero estas estructuras celulares, al contrario que en el caso de las bacterias, son poco conocidas.[86] En las células de las arqueas se han identificado proteínas relacionadas con los componentes del citoesqueleto,[87] así como filamentos.[88]
Algunas especies forman agregados o filamentos celulares de hasta 200 μm de longitud y pueden ser miembros importantes de las comunidades de microbios que conforman biopelículas.[10][89] Un ejemplo particularmente elaborado de colonias multicelulares lo constituyen las arqueas del género Pyrodictium. En este caso, las células se ordenan formando tubos largos, delgados y huecos, denominados cánulas, que se conectan y dan lugar a densas colonias ramificadas.[90] La función de estas cánulas se desconoce, pero pueden permitir que las células se comuniquen o intercambien nutrientes con sus vecinas.[91] También se pueden formar colonias por asociación entre especies diferentes. Por ejemplo, en una comunidad que fue descubierta en 2001 en un humedal alemán, había colonias blancas y redondas de una nueva especie de arquea del filo Euryarchaeota esparcidas a lo largo de filamentos delgados que pueden medir hasta 15 cm de largo; estos filamentos se componen de una especie particular de bacterias.[92]
Estructura y composición
[editar]Las arqueas son similares a las bacterias en su estructura celular general, pero la composición y organización de algunas de estas estructuras son muy diferentes. Como las bacterias, las arqueas carecen de membranas internas, de modo que sus células no contienen orgánulos.[61] También se parecen a las bacterias en que su membrana celular está habitualmente delimitada por una pared celular y en que nadan por medio de uno o más flagelos.[93] En su estructura general, las arqueas se parecen especialmente a las bacterias grampositivas, pues la mayoría tienen una única membrana plasmática y pared celular, y carecen de espacio periplasmático; la excepción de esta regla general es la arquea Ignicoccus, que tiene un espacio periplasmático particularmente grande que contiene vesículas limitadas por membranas, y que queda cerrado por una membrana exterior.[94]
La siguiente tabla describe algunas de las principales características que comparten las arqueas con otros dominios o que son únicas.[95] Muchas de estas características serán analizadas a continuación.
Membranas
[editar]
Las membranas arqueanas se componen de moléculas que difieren mucho de las que se encuentran en otras formas de vida, lo que es una prueba de que las arqueas solo tienen una relación distante con las bacterias y eucariotas.[97] En todos los organismos, las membranas celulares se componen de moléculas conocidas como fosfolípidos. Estas moléculas tienen una parte polar que se disuelve en el agua (la "cabeza" polar), y una parte "grasa" no polar que no se disuelve en el agua (la "cola" apolar). Estas partes diferentes quedan conectadas por glicerol. En el agua, los fosfolípidos se aglomeran, con las cabezas polares hacia el agua y las colas lipídicas no polares lejos de ella. Esto hace que se estructuren en capas. La estructura principal de la membrana celular es una doble capa de estos fosfolípidos, que recibe el nombre de bicapa lipídica.
Los fosfolípidos de las membranas arqueanas son inusuales en cuatro cosas. Primeramente, las bacterias tienen membranas compuestas principalmente de lípidos unidos con glicerol mediante enlaces éster, mientras que en las arqueas los lípidos se unen al glicerol mediante enlaces éter.[98] La diferencia entre estos dos tipos de fosfolípidos es el tipo de enlace que los une al glicerol. Los enlaces éter tienen una resistencia química superior a la de los enlaces éster, lo que podría contribuir a la capacidad de algunas arqueas de sobrevivir a temperaturas extremas o en ambientes muy ácidos o alcalinos.[99] Las bacterias y eucariotas también contienen algunos lípidos con enlaces éter, pero a diferencia de las arqueobacterias, estos lípidos no forman una parte importante de sus membranas.
En segundo lugar, los lípidos arqueanos son únicos porque la estereoquímica del grupo glicerol es la inversa de la que se observa en otros organismos. El grupo glicerol puede existir en dos formas que son la imagen especular la una de la otra, y que se pueden denominar formas "diestra" y "siniestra"; en lenguaje químico se les denomina enantiómeros. Del mismo modo que una mano derecha no entra fácilmente en un guante para la mano izquierda, una molécula de glicerol diestra generalmente no puede ser utilizada o creada por enzimas adaptados por la forma siniestra. Esto sugiere que las arqueas utilizan enzimas completamente diferentes para sintetizar sus fosfolípidos de los que utilizan las bacterias y eucariotas; como estas enzimas se desarrollaron muy al principio de la historia de la vida, esto sugiere a su vez que las arqueas se separaron muy pronto de los otros dos dominios.[97]
En tercer lugar, las colas lipídicas de los fosfolípidos de las arqueanos tienen una composición química diferente a las de otros organismos. Los lípidos arqueanos se basan en una cadena isoprenoide y son largas cadenas con múltiples ramas laterales y, a veces, incluso anillos de ciclopropano o ciclohexano.[100] Esto contrasta con los ácidos grasos que hay en las membranas de otros organismos, que tienen cadenas rectas sin ramificaciones ni anillos. Aunque los isoprenoides desempeñan un papel importante en la bioquímica de muchos organismos, solo las arqueas los utilizan para producir fosfolípidos. Estas cadenas ramificadas podrían ayudar a evitar que las membranas arqueobacterianas tengan fugas a altas temperaturas.[101]
Finalmente, en algunas arqueas la bicapa lipídica es sustituida por una única monocapa. De hecho, las arqueas fusionan las colas de dos moléculas fosfolipídicas independientes en una única molécula con dos cabezas polares, esta fusión podría hacer su membrana más rígida y más apta para resistir ambientes severos.[102] Por ejemplo, todos los lípidos de Ferroplasma son de este tipo, lo que se cree que ayuda a este organismo a sobrevivir en los medios extraordinariamente ácidos en que habita.
Pared celular y flagelos
[editar]La mayoría de las arqueas tienen una pared celular, las excepciones son Thermoplasma y Ferroplasma.[103] En la mayoría de arqueas, la pared se compone de proteínas de superficie, que forman una capa S.[104] Una capa S es una agrupación rígida de moléculas proteínicas que cubren el exterior de la célula como una cota de malla.[105] Esta capa ofrece una protección química y física, y puede servir de barrera, impidiendo que entren en contacto macromoléculas con la membrana celular.[106] A diferencia de las bacterias, la mayoría de arqueas carecen de peptidoglicano en la pared celular.[107] La excepción es el pseudopeptidoglicano, que se encuentra en las archaeas metanógenas, pero este polímero es diferente del peptidoglicano bacteriano, ya que carece de aminoácidos y ácido N-acetilmurámico.[106]
Las arqueas también tienen flagelos, que funcionan de una manera parecida a los flagelos bacterianos —son largas colas que se mueven por motores rotatorios situados en la base de los flagelos—. Estos motores son impulsados por el gradiente de protones de la membrana. Sin embargo, los flagelos arqueobacterianos son notablemente diferentes en su composición y su desarrollo.[93] Cada tipo de flagelo evolucionó de un antepasado diferente, el flagelo bacteriano evolucionó de un sistema de secreción de tipo III, mientras que los flagelos arqueanos parecen haber evolucionado de los pili bacterianos de tipo IV.[108] A diferencia del flagelo bacteriano, que es un tubo vacío y que está formado por subunidades que se mueven por la cavidad central y luego se añaden a la punta del flagelo, los flagelos arqueanos se sintetizan mediante la adición de subunidades en su base.[109]
Metabolismo
[editar]
Las arqueas presentan una gran variedad de reacciones químicas en su metabolismo; siendo idénticas a las de los otros dominios, y utilizan muchas fuentes de energía diferentes. Estas formas de metabolismo se clasifican en grupos nutricionales, según la fuente de la energía y del carbono. Algunas arqueas obtienen la energía de compuestos inorgánicos como el azufre o el amoníaco (son litótrofas). Estas arqueas incluyen nitrificantes, metanógenos y oxidantes anaeróbicos de metano.[111] En estas reacciones, un compuesto pasa electrones al otro (en una reacción redox), liberando energía que es utilizada para alimentar las actividades de las células. Un compuesto actúa como donante de electrones y el otro como aceptor. Una característica común de todas estas reacciones es que la energía liberada es utilizada para generar adenosín trifosfato (ATP) mediante la quimiosmosis, que es el mismo proceso básico que tiene lugar en las mitocondrias de las células animales.[112]
Otros grupos de arqueas utilizan la luz solar como fuente de energía (son fotótrofas), como las algas, protistas y bacterias. Sin embargo, ninguno de estos organismos presenta una fotosíntesis generadora de oxígeno (fotosíntesis oxigénica), como las cianobacterias.[112] Muchas de las rutas metabólicas básicas son compartidas por todas las formas de vida, por ejemplo, las arqueas utilizan una forma modificada de la glucólisis (la ruta de Entner-Doudoroff), y un ciclo de Krebs completo o parcial.[113] Estas semejanzas con el resto de organismos probablemente reflejan tanto la evolución temprana de estas partes del metabolismo en la historia de la vida, como su alto nivel de eficiencia.[114]
| Tipo nutricional | Fuente de energía | Fuente del carbono | Ejemplos |
|---|---|---|---|
| Fotótrofos | Luz solar | Compuestos orgánicos | Haloarchaea |
| Litótrofos | Compuestos inorgánicos | Compuestos inorgánicos o fijación del carbono | Ferroglobus, Methanobacteria o Pyrolobus |
| Organótrofos | Compuestos orgánicos | Compuestos orgánicos o fijación del carbono | Pyrococcus, Sulfolobus o Methanosarcinales |
Algunas Euryarchaeota son metanógenas y producen gas metano en ambientes anaeróbicos como pantanos. Este tipo de metabolismo evolucionó pronto, e incluso es posible que el primer organismo de vida libre fuera un metanógeno.[115] Una reacción típica de estos organismos implica el uso de dióxido de carbono como aceptor de electrones para oxidar hidrógeno. La metanogénesis implica una variedad de coenzimas que son únicos de estas arqueas, como la coenzima M o el metanofurano.[116] Otros compuestos orgánicos como alcoholes, ácido acético o ácido fórmico son utilizados como receptores de electrones por los metanógenos. Estas reacciones son habituales en las arqueas intestinales. El ácido acético también es descompuesto en metano y dióxido de carbono directamente, por arqueas acetótrofas. Estas acetótrofas pertenecen al orden Metanosarcinales, y son una parte importante de las comunidades de microorganismos productoras de biogás.[117]

Otras arqueas utilizan el CO2 de la atmósfera como fuente de carbono, en un proceso llamado fijación del carbono (son autótrofas). En las arqueas, este proceso implica o bien una forma muy modificada del ciclo de Calvin,[119] o una ruta metabólica recientemente descubierta conocida como ciclo del 3-hidroxipropionato/4-hidroxibutirato.[120] Las Crenarchaeota también utilizan el ciclo de Krebs inverso y las Euryarchaeota también utilizan la ruta reductora del acetil-CoA.[120] En estos organismos, la fijación del carbono es alimentada por fuentes inorgánicas de energía, en lugar de por la luz solar como en el caso en las plantas y cianobacterias. No se conocen arqueas que puedan llevar a cabo la fotosíntesis, que es cuando la luz es utilizada por los fotoautótrofos como fuente de energía, además de fuente de alimento para la fijación del dióxido de carbono.[121] Las fuentes de energía utilizadas por las arqueas para fijar el carbono son extremadamente diversas, y de la oxidación del amoníaco por parte de los Nitrosopumilales[122][123] hasta la oxidación de ácido sulfhídrico o azufre elemental por parte de Sulfolobus, utilizando oxígeno o iones metálicos como aceptor de electrones.[112]
Las arqueas fotótrofas utilizan luz para producir energía química en forma de ATP. En las haloarqueas hay bombas de iones que se activan por la luz, como la bacteriorodopsina y la halorodopsina, que generan gradientes de iones a través del bombeo de iones hacia el exterior de la célula a través de la membrana plasmática. La energía almacenada en estos gradientes electroquímicos es posteriormente convertida en ATP por la ATP sintasa.[10] Este proceso es una forma de fotofosforilación. La estructura y el funcionamiento de estas bombas activadas por la luz han sido estudiadas en gran detalle, lo que ha revelado que su capacidad de mover iones a través de las membranas depende en unos cambios producidos por la luz en la estructura de un cofactor de retinol en el centro de la proteína.[124]
Genética
[editar]Las arqueas, por lo general, tienen un único cromosoma circular al igual que las bacterias,[125] que varía en tamaño desde 5.751.492 pares de bases en Methanosarcina acetivorans,[126] el mayor genoma secuenciado hasta la fecha, hasta 490.885 pares de bases en Nanoarchaeum equitans, el genoma más pequeño conocido que puede contener solo 537 genes codificadores de proteínas. Las arqueas también pueden presentar plásmidos que se pueden propagar por contacto físico entre células, en un proceso que puede ser similar a la conjugación bacteriana.[127][128][129] Los plásmidos son cada vez más importantes como herramientas genéticas, pues permiten la realización de estudios genéticos en Archaea.[130]

Al igual que los bacteriófagos que infectan bacterias, existen virus que se replican en las arqueas. Esto incluye virus con formas ya conocidas en las bacterias y eucariotas y otros con una variedad de formas inusuales, como botellas, barras con un gancho o incluso lágrimas que no parecen tener relación evolutiva con otros virus, estos últimos han sido descritos en mayor detalle en los termófilos, en particular los órdenes Sulfolobales y Thermoproteales.[132][133] La defensa contra estos virus pueden implicar la interferencia de ARN por secuencias de ADN repetitivas en el genoma de las arqueas.[134][135]
Las arqueas son genéticamente distintas a otros organismos, con hasta un 15 % de proteínas exclusivas codificadas por el genoma de cualquiera arquea.[136] Los genes que son compartidos entre Archaea, Bacteria y Eukarya forman un núcleo de funciones de la célula, relacionados principalmente con la transcripción, traducción y metabolismo de nucleótidos.[137] La mayoría de los genes exclusivos de las arqueas no tienen una función conocida, pero de los que tienen una función identificada, la mayoría participan en la metanogénesis. Otros elementos característicos de los genomas de las arqueas son la organización de genes de función relacionada, tales como las enzimas que catalizan las etapas de la misma ruta metabólica, nuevos operones y grandes diferencias en genes ARNt y sus aminoacil ARNt sintetasas.[137]
La transcripción y traducción en Archaea son más similares a Eukarya que a Bacteria; por ejemplo, en las subunidades y secuencias de la ARN polimerasa II y en los ribosomas.[125] Las funciones e interacciones de la ARN polimerasa en la transcripción en Archaea también parece estar relacionada con la de Eukarya, con un similar ensamblado de proteínas (factores de transcripción generales) dirigiendo la unión de la ARN polimerasa a un promotor de gen. Sin embargo, muchos otros factores de transcripción en las arqueas son similares a los de bacterias.[138] Recientemente se descubrió la presencia del nucleolo, cuya función se resume en la transcripción del ARN ribosomal.
Ecología
[editar]Hábitats
[editar]Las arqueas existen en una gran variedad de hábitats, son una parte importante de los ecosistemas globales,[23] y podrían representar hasta un 20 % del total de biomasa de la Tierra.[139] Gran cantidad de arqueas son extremófilas, y este tipo de hábitat fue visto históricamente como su nicho ecológico.[111] De hecho, algunas arqueas sobreviven a altas temperaturas, como la cepa 121 de Geogemma barossii, a menudo por encima de 100 °C, como las que hay en los géiseres, chimeneas mineralizadas, y pozos de petróleo. Otros viven en hábitats muy fríos, y otros en aguas altamente salinas, ácidas o alcalinas. Sin embargo, otras arqueas son mesófilas, ya que viven en condiciones mucho más suaves y húmedas como las alcantarillas, los océanos y el suelo.[23]

Las arqueas extremófilas son miembros de cuatro grupos fisiológicos principales. Son los halófilos, termófilos, alcalófilos y acidófilos.[140] Estos grupos no son incluyentes ni tienen una relación con el filo al que pertenece una determinada arquea, ni son mutuamente exclusivos, ya que algunas arqueas pertenecen a varios de estos grupos. Sin embargo, son útiles como punto de partida para la clasificación de estos organismos.
Los halófilos, incluyendo el género Halobacterium, viven en ambientes extremadamente salinos, como lagos salados, y empiezan a superar a sus homólogos bacterianos a salinidades superiores al 20-25 %.[111] Los termófilos prosperan a temperaturas por encima de 45 °C, en lugares como aguas termales; las arqueas hipertermófilas son los que prosperan en temperaturas superiores a 80 °C.[141] La cepa 116 de Methanopyrus kandleri crece a 122 °C, que es la temperatura más alta registrada en la que puede vivir un organismo.[142] Otras arqueas existen en condiciones muy ácidas o alcalinas.[140] Por ejemplo, uno de los acidófilos arquobacterianos más extremos es Picrophilus torridus, que crece a un pH 0, lo que equivale a prosperar en ácido sulfúrico con una concentración molar de 1,2.[143]
Esta resistencia a ambientes extremos ha convertido a las arqueas en el centro de especulación sobre las posibles propiedades de la vida extraterrestre.[144] Esta hipótesis eleva las probabilidades de que exista vida microbial en Marte,[145] e incluso se ha llegado a sugerir que microbios viables podrían viajar entre planetas en meteoritos.[146] Recientemente, varios estudios han demostrado que las arqueas no existen únicamente en medios mesófilos y termófilos, sino que también están presentes, a veces en altas cantidades, a temperaturas bajas. Por ejemplo, las arqueas son comunes en ambientes oceánicos fríos como los mares polares.[147] Aún son más significativas las grandes cantidades de arqueobacterias que viven en todo el mundo en la comunidad planctónica (como parte del picoplancton).[148] Aunque estas arqueas pueden estar presentes en cantidades extremadamente grandes (hasta un 40 % de la biomasa microbial), casi ninguna de estas especies ha sido aislada y estudiada en un cultivo puro.[149] Por consiguiente, la comprensión actual del papel de las arqueas en la ecología de los océanos es rudimentaria, por lo que su influencia completa sobre los ciclos biogeoquímicos globales continúa siendo desconocida.[150] Asimismo, un estudio reciente ha demostrado que un grupo de Crenarchaeota marinos son capaces de llevar a cabo la nitrificación, sugiriendo que estos organismos podrían ser importantes en el ciclo del nitrógeno oceánico.[151] También se encuentran grandes cantidades de arqueas en los sedimentos que cubren el fondo marino, y estos organismos forman la mayoría de células vivientes a profundidades de más de un metro dentro de este sedimento.[152][153]
Papel en los ciclos químicos
[editar]Las arqueas reciclan elementos como carbono, nitrógeno y azufre de los diversos hábitats de cada ecosistema. Estas actividades son vitales para el funcionamiento normal de los ecosistemas, pero las arqueas pueden contribuir a incrementar los cambios causados por el hombre, e incluso pueden producir contaminación.
Las arqueas pueden llevar a cabo muchos de los pasos del ciclo del nitrógeno. Esto incluye tanto reacciones disimilatorias que eliminan nitrógeno de los ecosistemas (como la respiración basada en nitratos y desnitrificación), como procesos asimilatorios que introducen nitrógeno, como la asimilación de nitrato y la fijación de nitrógeno.[154] La implicación de las arqueas en las reacciones de oxidación de amoníaco se descubrió en 2007. Estas reacciones son particularmente importantes en los océanos.[122][155] Las arqueas son también importantes en la oxidación de amoníaco en el suelo. Producen nitritos, que son posteriormente otros microbios oxidadan en nitratos. Las plantas y otros organismos consumen este último.[156]
En el ciclo del azufre, las arqueas que crecen oxidando compuestos de azufre liberan este elemento de las rocas, haciendo que quede disponible para otros organismos. Sin embargo, las arqueas que hacen esto, como Sulfolobus producen ácido sulfúrico como producto residual, y el crecimiento de estos organismos en minas abandonadas puede contribuir a la formación de los líquidos del drenaje minero ácido.[8] y otros daños ambientales.[8]
En el ciclo del carbono, las arqueas metanógenas liberan hidrógeno y son importantes en la descomposición de la materia orgánica realizada por las poblaciones de microorganismos que actúan como descomponedores en los sistemas anaeróbicos, como depósitos de sedimentos, pantanos y en el tratamiento de aguas residuales.[157] Sin embargo, el metano es uno de los gases de efecto invernadero más abundantes en la atmósfera terrestre, y constituye el 18 % del total global.[158] Es 25 veces más potente como gas invernadero que el dióxido de carbono.[159] Los microorganismos metanógenos son la primera fuente de metano atmosférico, y son responsables de la mayoría de las emisiones de metano anuales mundiales.[160] Como consecuencia, estas arqueas contribuyen a las emisiones de gases invernadero globales y al calentamiento global.
Interacciones con otros organismos
[editar]
Las interacciones bien definidas entre arqueas y otros organismos son o bien mutualistas o comensalistas. En 2007, todavía no se conocía ningún ejemplo claro de patógeno o parásito arqueobacteriano.[161][162] Sin embargo, se ha sugerido una relación entre la presencia de algunas especies de metanógenos y las infecciones en la boca,[163] y Nanoarchaeum equitans podría ser parásito, pues solo sobrevive y se reproduce dentro de las células del Crenarchaeota Ignicoccus hospitalis,[164] y parece no ofrecer ningún beneficio a su hospedador.[165]
Mutualismo
[editar]Un ejemplo bien comprendido de mutualismo es la interacción entre los protozoos y arqueas metanógenas del sistema digestivo de animales que digieren celulosa, como los rumiantes y las termitas.[166] En estos ambientes anaeróbicos, los protozoos descomponen la celulosa del material vegetal para obtener energía. Este proceso libera hidrógeno como producto residual, pero los niveles altos de hidrógeno reducen la energía generada por esta reacción. Cuando los metanógenos convierten el hidrógeno en metano, los protozoos se benefician, ya que podrán obtener más energía de la descomposición de la celulosa.[167]
Estas asociaciones entre metanógenos y protozoos van un paso más allá en diversas especies de protozoos anaeróbicos, como Plagiopyla frontata, en cuyo caso, las arqueas viven en el protozoo y consumen el hidrógeno producido en sus hidrogenosomas.[168][169] Se están descubriendo asociaciones similares con organismos más grandes, con el descubrimiento de que la arquea marina Cenarchaeum symbiosum que vive dentro de la esponja Axinella mexicana.[170]
Comensalismo
[editar]Las arqueas también pueden ser comensales, beneficiándose de una asociación sin ayudar o dañar al otro organismo. Por ejemplo, el metanógeno Methanobrevibacter smithii es de largo la arquea más común de la flora humana, representando aproximadamente un 10 % de todos los prokaryotas del intestino humano.[171] Como en el caso de las termitas, es posible que estos metanógenos sean en realidad mutualistas en los humanos, interactuando con otros microbios del intestino para facilitar la digestión de los alimentos.[172] También hay comunidades arqueobacterianas asociadas con una variedad de otros organismos, como en la superficie de corales,[173] y en la parte del suelo que rodea las raíces de las plantas (la rizosfera).[174][175]
Reproducción
[editar]Las arqueas se reproducen asexualmente por fisión binaria o múltiple, fragmentación o gemación. No se produce meiosis, de manera que si una especie de arquea existe en más de una forma, todas tienen el mismo número de cromosomas (tienen el mismo cariotipo).[10] La división celular está controlada como parte de un complejo ciclo celular, donde el cromosoma se replica, las copias se separan y luego la célula se divide.[176] Los detalles del ciclo celular han sido investigados en el género Sulfolobus, siendo similares a los de bacterias y eucariotas: los cromosomas se replican desde múltiples puntos de partida (origen de replicación) usando ADN polimerasas que son similares a las enzimas equivalentes eucarióticas.[177] Sin embargo, las proteínas que dirigen la división celular, como la proteína FtsZ que forma un anillo contráctil alrededor de la célula, parecen estar más relacionadas con sus equivalentes bacterianos.[176]
No se forman endosporas en ninguna especie de arquea,[178] aunque algunas especies de haloarqueas pueden alternar entre fenotipos y crecer como diferentes tipos de células, incluidas estructuras de paredes gruesas que son resistentes al choque osmótico y que les permiten sobrevivir a bajas concentraciones de sal.[179] No se trata de estructuras reproductivas, pero es posible que ayuden a estas especies a dispersarse en nuevos hábitats.
Uso de las arqueas en tecnología e industria
[editar]Las arqueas extremófilas, en particular las resistentes a las altas temperaturas o a los extremos de acidez y alcalinidad, son una importante fuente de enzimas que puede funcionar bajo estas duras condiciones.[180][181] Estas enzimas tienen una amplia gama de usos. Por ejemplo, las ADN polimerasas termoestables, como la ADN polimerasa Pfu de Pyrococcus furiosus, han revolucionado la biología molecular, al permitir el uso de la reacción en cadena de la polimerasa como método simple y rápido para la clonación del ADN. En la industria, las amilasas, galactosidasas y pululanasas de otras especies de Pyrococcus realizan su función a más de 100 °C, lo que permite la elaboración de alimentos a altas temperaturas, tales como leche baja en lactosa y suero de leche.[182] Las enzimas de estas arqueas termófilas también tienden a ser muy estables en solventes orgánicos, por lo que pueden utilizarse en una amplia gama de procesos respetuosos con el medio ambiente para la síntesis de compuestos orgánicos.[181]
En contraste con la amplia gama de aplicaciones de las enzimas, la utilización en biotecnología de los organismos en sí mismos es más reducida. Sin embargo, las arqueas metanógeneas son una parte vital del tratamiento de aguas residuales, realizando la digestión anaeróbica de los residuos y produciendo biogás.[183] Las arqueas acidófilas son también prometedores en minería para la extracción de metales como oro, cobalto y cobre.[184]
Una nueva clase de antibióticos potencialmente útiles se derivan de este grupo de organismos. Ocho de esas sustancias ya han sido caracterizadas, pero podría haber muchas más, especialmente en las haloarqueas. Estos compuestos son importantes porque tienen una estructura diferente a la de los antibióticos bacterianos, de manera que pueden tener un modo de acción diferente. Además, podrían permitir la creación de nuevos marcadores seleccionables para utilizarlos en la biología molecular arqueobacteriana. El descubrimiento de nuevas sustancias depende de la recuperación de estos organismos del medio ambiente y de su cultivo.[185]
Notas
[editar]- ↑ Se ha sugerido que Euryarchaeota puede ser un superfilo en lugar de un filo.
Referencias
[editar]- ↑ Dodd, Matthew S.; Papineau, Dominic; Grenne, Tor; Slack, John F.; Rittner, Martin; Pirajno, Franco; O’Neil, Jonathan; Little, Crispin T. S. (2 de marzo de 2017). «Evidence for early life in Earth’s oldest hydrothermal vent precipitates». Nature (en inglés) 543 (7643): 60-64. ISSN 0028-0836. doi:10.1038/nature21377. Consultado el 13 de junio de 2017.
- ↑ Ruggiero, M. A.; Gordon, D. P.; Orrell, T. M.; Bailly, N.; Bourgoin, T. et al. (2015) «A Higher Level Classification of All Living Organisms». PLoS ONE, 10(6): e0130114. doi 10.1371/journal.pone.0119248
- ↑ a b Christian Rinke, Maria Chuvochina, Aaron J. Mussig, Pierre-Alain Chaumeil, David W. Waite, William B Whitman, Donovan H. Parks, Philip Hugenholtz (2020). A rank-normalized archaeal taxonomy based on genome phylogeny resolves widespread incomplete and uneven classifications. Biorxiv.
- ↑ a b Castelle, C. J. et al. (2015) «Genomic expansion of domain archaea highlights roles for organisms from new phyla in anaerobic carbon cycling». Current Biology, 25(6): 690-701.
- ↑ Pace, N. R. (Mayo de 2006). «Time for a change». Nature 441 (7091): 289. Bibcode:2006Natur.441..289P. PMID 16710401. doi:10.1038/441289a.
- ↑ Berg, L. R. (2008). Introductory Botany: Plants, People, and the Environment. Thompson Brooks/Cole. 622 pp. ISBN 978-0495384786
- ↑ No confundir con Haloarcula quadrata, que tiene forma similar y fue encontrada en las mismas lagunas salinas.
- ↑ a b c Baker, B. J.; Banfield, J. F. (2003). «Microbial communities in acid mine drainage». FEMS Microbiology Ecology 44 (2): 139-152. PMID 19719632. doi:10.1016/S0168-6496(03)00028-X. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Schimel, J. (Agosto de 2004). «Playing scales in the methane cycle: from microbial ecology to the globe». Proc. Natl. Acad. Sci. U.S.A. 101 (34): 12400-1. PMC 515073. PMID 15314221. doi:10.1073/pnas.0405075101. Archivado desde el original el 16 de octubre de 2019. Consultado el 26 de mayo de 2010.
- ↑ a b c d e Krieg, Noel (2005). Bergey’s Manual of Systematic Bacteriology. USA: Springer. pp. 21–6. ISBN 978-0-387-24143-2.
- ↑ Onyenwoke, R. U.; Brill, J. A.; Farahi, K. y Wiegel, J. (2004). «Sporulation genes in members of the low G+C Gram-type-positive phylogenetic branch ( Firmicutes)». Arch. Microbiol. 182 (2–3): 182-92. PMID 15340788. doi:10.1007/s00203-004-0696-y.
- ↑ Ferry, J. G. (ed.) (1993) Methanogenesis: Ecology, Physiology, Biochemistry & Genetics. Chapman & Hall Microbiology Series. ISBN 978-0-412-03531-9
- ↑ Kluyver and van Niel 1936
- ↑ Brock, T. D.; Brock, K. M.; Belly, R. T. y Weiss, R. L. (1972). «Sulfolobus: a new genus of sulfur-oxidizing bacteria living at low pH and high temperature». Arch. Mikrobiol., 84(1): 54–68. doi 10.1007/BF00408082. PMID 4559703.
- ↑ Bergey's Manual of Systematic Bacteriology. 1.ª edición. 4 vols. (1984)
- ↑ Lake, James A. et al. (1984). «Eocytes: A new ribosome structure indicates a kingdom with a close relationship to eukaryotes». PNAS, 81: 3786–3790.
- ↑ a b Woese, C. R.; Kandler, O. y Wheelis, M. L. (1990). «Towards a natural system of organisms: proposal for the domains Archaea, Bacteria, and Eucarya». Proc. Natl. Acad. Sci. U.S.A. 87 (12): 4576-9. PMID 2112744. doi:10.1073/pnas.87.12.4576. Archivado desde el original el 16 de octubre de 2019. Consultado el 12 de mayo de 2010.
- ↑ «Científicos de Facultad de Ciencias y Arabia Saudita cambian paradigma de la biología celular al descubrir el nucleolo en procariontes | Facultad de Ciencias». www.fciencias.unam.mx. Consultado el 16 de febrero de 2023.
- ↑ Staley JT (2006). «The bacterial species dilemma and the genomic-phylogenetic species concept». Philos. Trans. R. Soc. Lond., B, Biol. Sci. 361 (1475): 1899-909. PMID 17062409. doi:10.1098/rstb.2006.1914.
- ↑ Zuckerkandl E, Pauling L (1965). «Molecules as documents of evolutionary history». J. Theor. Biol. 8 (2): 357-66. PMID 5876245. doi:10.1016/0022-5193(65)90083-4.
- ↑ Woese C, Fox G (1977). «Phylogenetic structure of the prokaryotic domain: the primary kingdoms». Proc Natl Acad Sci USA 74 (11): 5088-90. PMID 270744. doi:10.1073/pnas.74.11.5088.
- ↑ Archaea. (2008). Al Merriam-Webster Online Dictionary. Consultado el 1 de julio del 2008, de [1]
- ↑ a b c DeLong EF (1998). «Everything in moderation: archaea as 'non-extremophiles'». Curr. Opin. Genet. Dev. 8 (6): 649-54. PMID 9914204. doi:10.1016/S0959-437X(98)80032-4.
- ↑ Theron J, Cloete TE (2000). «Molecular techniques for determining microbial diversity and community structure in natural environments». Crit. Rev. Microbiol. 26 (1): 37-57. PMID 10782339. doi:10.1080/10408410091154174.
- ↑ Schmidt TM (2006). «The maturing of microbial ecology». Int. Microbiol. 9 (3): 217-23. PMID 17061212. Archivado desde el original el 11 de septiembre de 2008. Consultado el 12 de mayo de 2010.
- ↑ Gevers, D.; Dawyndt, P.; Vandamme, P. et al. (2006). «Stepping stones towards a new prokaryotic taxonomy». Philos. Trans. R. Soc. Lond., B, Biol. Sci. 361 (1475): 1911-6. PMID 17062410. doi:10.1098/rstb.2006.1915.
- ↑ a b Robertson, C. E.; Harris, J. K.; Spear, J. R. y Pace, N. R. (2005). «Phylogenetic diversity and ecology of environmental Archaea». Curr. Opin. Microbiol. 8 (6): 638-42. PMID 16236543.
- ↑ Huber, H.; Hohn, M. J.; Rachel, R.; Fuchs, T.; Wimmer, V. C. y Stetter, K. O. (2002). «A new phylum of Archaea represented by a nanosized hyperthermophilic symbiont». Nature 417 (6884): 27-8. PMID 11986665. doi:10.1038/417063a.
- ↑ Barns, S. M.; Delwiche, C. F.; Palmer, J. D. y Pace, N. R. (1996). «Perspectives on archaeal diversity, thermophily and monophyly from environmental rRNA sequences». Proc. Natl. Acad. Sci. U.S.A. 93 (17): 9188-93. PMID 8799176. doi:10.1073/pnas.93.17.9188. Archivado desde el original el 8 de mayo de 2020. Consultado el 16 de mayo de 2010.
- ↑ Elkins JG, Podar M, Graham DE, et al. (Junio de 2008). «A korarchaeal genome reveals insights into the evolution of the Archaea». Proc. Natl. Acad. Sci. U.S.A. 105 (23): 8102-7. PMID 18535141. doi:10.1073/pnas.0801980105. Archivado desde el original el 27 de mayo de 2020. Consultado el 16 de mayo de 2010.
- ↑ Baker, B. J.; Tyson, G. W.; Webb, R. I.; Flanagan, J.; Hugenholtz, P. y Banfield, J. F. (2006). «Lineages of acidophilic Archaea revealed by community genomic analysis. Science». Science 314 (6884): 1933 - 1935. PMID 17185602. doi:10.1126/science.1132690.
- ↑ Baker, B. J.; Comolli, L. R.; Dick, G. J. et al. (Mayo de 2010). «Enigmatic, ultrasmall, uncultivated Archaea». Proc. Natl. Acad. Sci. U.S.A. 107 (19): 8806-11. Bibcode:2010PNAS..107.8806B. PMC 2889320. PMID 20421484. doi:10.1073/pnas.0914470107.
- ↑ a b c Zaremba-Niedzwiedzka, K., Caceres, E. F., Saw, J. H., Bäckström, D., Juzokaite, L., Vancaester, E., ... & Stott, M. B. (2017). Asgard archaea illuminate the origin of eukaryotic cellular complexity. Nature, 541(7637), 353.
- ↑ Takuro Nunoura et al 2011. Insights into the evolution of Archaea and eukaryotic protein modifier systems revealed by the genome of a novel archaeal group Nucleic Acids Res. 2011 April; 39(8): 3204–3223.
- ↑ Mendler, K; Chen, H; Parks, DH; Hug, LA; Doxey, AC (2019). «AnnoTree: visualization and exploration of a functionally annotated microbial tree of life». Nucleic Acids Research 47 (9): 4442-4448. PMC 6511854. PMID 31081040. doi:10.1093/nar/gkz246. Archivado desde el original el 23 de abril de 2021. Consultado el 21 de julio de 2021.
- ↑ «GTDB release 05-RS95». Genome Taxonomy Database.
- ↑ Nina Dombrowski, Jun-Hoe Lee, Tom A Williams, Pierre Offre, Anja Spang (2019). Genomic diversity, lifestyles and evolutionary origins of DPANN archaea. Nature.
- ↑ Thomas Cavalier-Smith & Ema E-Yung Chao (2020). Multidomain ribosomal protein trees and the planctobacterial origin of neomura (eukaryotes, archaebacteria). Linkspringer.
- ↑ Jordan T. Bird, Brett J. Baker, Alexander J. Probst, Mircea Podar, Karen G. Lloyd (2017). Culture Independent Genomic Comparisons Reveal Environmental Adaptations for Altiarchaeales. Frontiers.
- ↑ Monique Aouad, Najwa Taïb, Anne Oudart, Michel Lecocq, Manolo Gouy,Céline Brochier-Armanet (21 Apr 2018). «Extreme halophilic archaea derive from two distinct methanogen Class II lineages». Molecular Phylogenetics and Evolution (Elsevier) 2018 (27): 46-54. PMID 29684598. doi:10.1016/j.ympev.2018.04.011.
- ↑ de Queiroz, K. (2005). «Ernst Mayr and the modern concept of species». Proc. Natl. Acad. Sci. U.S.A. 102 Suppl 1: 6600-7. PMID 15851674. doi:10.1073/pnas.0502030102. Archivado desde el original el 16 de octubre de 2019. Consultado el 16 de mayo de 2010.
- ↑ Eppley, J. M.; Tyson, G. W.; Getz, W. M. y Banfield, J. F. (2007). «Genetic exchange across a species boundary in the archaeal genus ferroplasma». Genetics 177 (1): 407-16. PMID 17603112. doi:10.1534/genetics.107.072892.
- ↑ Papke, R.T.; Zhaxybayeva, O.; Feil, E. J.; Sommerfeld, K.; Muise, D. y Doolittle, W. F. (2007). «Searching for species in haloarchaea». Proc. Natl. Acad. Sci. U.S.A. 104 (35): 14092-7. PMID 17715057. doi:10.1073/pnas.0706358104.
- ↑ Kunin, V.; Goldovsky, L.; Darzentas, N. y Ouzounis, C. A. (2005). «The net of life: reconstructing the microbial phylogenetic network». Genome Res. 15 (7): 954-9. PMID 15965028. doi:10.1101/gr.3666505.
- ↑ Hugenholtz, P. (2002). «Exploring prokaryotic diversity in the genomic era». Genome Biol. 3 (2): REVIEWS0003. PMID 11864374. doi:10.1186/gb-2002-3-2-reviews0003. Archivado desde el original el 15 de marzo de 2020. Consultado el 17 de abril de 2008.
- ↑ Rappé, M. S. y Giovannoni, S. J. (2003). «The uncultured microbial majority». Annu. Rev. Microbiol. 57: 369-94. PMID 14527284. doi:10.1146/annurev.micro.57.030502.090759.
- ↑ «En route to a genome-based classification of Archaea and Bacteria?». Syst Appl Microbiol. 33 (4): 175-82. Junio de 2010. PMID 20409658.
- ↑ Ciccarelli, F. D.; Doerks, T.; von Mering, C.; Creevey, C. J.; Snel, B. y Bork, P. (2006). «Toward automatic reconstruction of a highly resolved tree of life». Science 311 (5765): 1283-7. PMID 16513982.
- ↑ a b c Battistuzzi F, Feijao A, Hedges S. A genomic timescale of prokaryote evolution: insights into the origin of methanogenesis, phototrophy, and the colonization of land. BMC.
- ↑ a b Fabia U. Battistuzzi & S. Blair Hedges 2008. A Major Clade of Prokaryotes with Ancient Adaptations to Life on Land. Oxford Academic.
- ↑ Schopf, J. (2006). «Fossil evidence of Archaean life» (PDF). Philos Trans R Soc Lond B Biol Sci 361 (1470): 869-85. PMC 1578735. PMID 16754604. doi:10.1098/rstb.2006.1834. Archivado desde el original el 23 de febrero de 2011.
- ↑ Chappe, B.; Albrecht, P. y Michaelis, W. (Julio de 1982). «Polar Lipids of Archaebacteria in Sediments and Petroleums». Science 217 (4554): 65-66. Bibcode:1982Sci...217...65C. PMID 17739984. doi:10.1126/science.217.4554.65.
- ↑ Brocks, J. J.; Logan, G. A.; Buick, R. y Summons, R. E. (1999). «Archean molecular fossils and the early rise of eukaryotes». Science 285 (5430): 1033-6. PMID 10446042. doi:10.1126/science.285.5430.1033.
- ↑ Rasmussen, B.; Fletcher, I. R.; Brocks, J. J. y Kilburn, M. R. (Octubre de 2008). «Reassessing the first appearance of eukaryotes and cyanobacteria». Nature 455 (7216): 1101-4. Bibcode:2008Natur.455.1101R. PMID 18948954. doi:10.1038/nature07381.
- ↑ Hahn, J.; Haug, P. (1986). «Traces of Archaebacteria in ancient sediments». System Applied Microbiology 7 (Archaebacteria '85 Proceedings): 178-83.
- ↑ Wang, M.; Yafremava, L. S.; Caetano-Anollés, D.; Mittenthal, J. E. y Caetano-Anollés, G. (2007). «Reductive evolution of architectural repertoires in proteomes and the birth of the tripartite world». Genome Res. 17 (11): 1572-85. PMID 17908824. doi:10.1101/gr.6454307.
- ↑ Woese, C. R. y Gupta, R. (1981). «Are archaebacteria merely derived 'prokaryotes'?». Nature 289 (5793): 95-6. Bibcode:1981Natur.289...95W. PMID 6161309. doi:10.1038/289095a0.
- ↑ a b c Woese, C. (1998). «The universal ancestor». Proc. Natl. Acad. Sci. U.S.A. 95 (12): 6854-9. Bibcode:1998PNAS...95.6854W. PMC 22660. PMID 9618502. doi:10.1073/pnas.95.12.6854.
- ↑ a b Kandler, O. (1998) «The early diversification of life and the origin of the three domains: A proposal». In: Wiegel, J. y Adams, W. W. (eds). Thermophiles: The keys to molecular evolution and the origin of life?. Londres: Taylor and Francis: 19-31. ISBN 9780748407477 doi 10.1110/ps.8.7.1564
- ↑ Gribaldo, S. y Brochier-Armanet, C. (2006). «The origin and evolution of Archaea: a state of the art». Philos. Trans. R. Soc. Lond., B, Biol. Sci. 361 (1470): 1007-22. PMID 16754611. doi:10.1098/rstb.2006.1841. Archivado desde el original el 4 de junio de 2012.
- ↑ a b c Woese, C. R. (marzo de 1994). «There must be a prokaryote somewhere: microbiology's search for itself». Microbiol. Rev. 58 (1): 1-9. PMC 372949. PMID 8177167.
- ↑ a b c d e Gupta R. S. (1998). «Protein phylogenies and signature sequences: A reappraisal of evolutionary relationships among archaebacteria, eubacteria, and eukaryotes». Microbiol. Mol. Biol. Rev 62: 1435-1491.
- ↑ a b c Gupta R.S. (1998). «What are archaebacteria: life's third domain or monoderm prokaryotes related to gram-positive bacteria? A new proposal for the classification of prokaryotic organisms». Mol. Microbiol 29: 695-708.
- ↑ a b c Gupta, R. S.(2000) The natural evolutionary relationships among prokaryotes. Crit. Rev. Microbiol. 26: 111-131.
- ↑ Gupta, RS (2005). Oxford University Press, ed. Molecular Sequences and the Early History of Life. En: Sapp J, editor. "Microbial Phylogeny and Evolution: Concepts and Controversies". Nueva York. pp. 160-183.
- ↑ Valas RE, Bourne PE (2011). «The origin of a derived superkingdom: how a Gram-positive bacterium crossed the desert to become an archaeon». Biol Direct (6): 16.
- ↑ Skophammer RG, Herbold CW, Rivera MC, Servin JA, Lake JA (2006). «Evidence that the root of the tree of life is not within the Archaea». Mol Biol Evol. (23(9)): 1648-1651.
- ↑ Cavalier-Smith T. (2002). «The neomuran origin of archaebacteria, the negibacterial root of the universal tree and bacterial megaclassification». Int J Syst Evol Microbiol (52(Pt 1)): 7-76.
- ↑ Qiyun Zhu, Uyen Mai, Rob Knight.(7012). Phylogenomics of 10,575 genomes reveals evolutionary proximity between domains Bacteria and Archaea. Nature.
- ↑ Emilie Neveu, Dany Khalifeh, Nicolas Salamin, Dirk Fasshauer, (2020). Prototypic SNARE Proteins Are Encoded in the Genomes of Heimdallarchaeota, Potentially Bridging the Gap between the Prokaryotes and Eukaryotes. Current Biology.
- ↑ Koonin EV, Mushegian AR, Galperin MY, Walker DR. (1997). «"Comparison of archaeal and bacterial genomes: computer analysis of protein sequences predicts novel functions and suggests a chimeric origin for the archaea".». Mol Microbiol (25): 619-637.
- ↑ Koch AL (2003). «Were Gram-positive rods the first bacteria?». Trends Microbiol (11(4)): 166-170.
- ↑ Brown JR, Masuchi Y, Robb FT, Doolittle WF. (1994). «Evolutionary relationships of bacterial and archaeal glutamine synthetase genes». J Mol Evol. (38(6)): 566-576.
- ↑ Gouy M, Li WH (Mayo de 1989). «Phylogenetic analysis based on rRNA sequences supports the archaebacterial rather than the eocyte tree». Nature 339 (6220): 145-7. Bibcode:1989Natur.339..145G. PMID 2497353. doi:10.1038/339145a0.
- ↑ Yutin N, Makarova KS, Mekhedov SL, Wolf YI, Koonin EV (Mayo de 2008). «The deep archaeal roots of eukaryotes». Mol. Biol. Evol. 25 (8): 1619-30. PMC 2464739. PMID 18463089. doi:10.1093/molbev/msn108. Archivado desde el original el 3 de mayo de 2009. Consultado el 16 de mayo de 2010.
- ↑ Lake JA. (1988). «Origin of the eukaryotic nucleus determined by rate-invariant analysis of rRNA sequences». Nature 331 (6152): 184-6. Bibcode:1988Natur.331..184L. PMID 3340165. doi:10.1038/331184a0.
- ↑ Tom A. Williams et al. (2012.). «A congruent phylogenomic signal places eukaryotes within the Archaea». Proc. R. Soc. (B rspb20121795).
- ↑ Dey, G., Thattai, M., & Baum, B. (2016). On the Archaeal Origins of Eukaryotes and the Challenges of Inferring Phenotype from Genotype. Trends in Cell Biology, 26(7), 476-485.
- ↑ L. Guy & T. Ettema 2011, The archaeal ‘TACK’ superphylum and the origin of eukaryotes Sciencedirect Volumen 19, Issue 12, Diciembre de 2011, Páginas 580–587
- ↑ Laura Eme, Daniel Tamarit, Eva F. Caceres, Courtney W. Stairs, Valerie De Anda, Max E. Schön, Kiley W. Seitz, Nina Dombrowski, William H. Lewis, Felix Homa, Jimmy H. Saw, Jonathan Lombard, Takuro Nunoura, Wen-Jun Li, Zheng-Shuang Hua, Lin-Xing Chen, Jillian F. Banfield, Emily St John, Anna-Louise Reysenbach, Matthew B. Stott, Andreas Schramm, Kasper U. Kjeldsen, Andreas P. Teske, Brett J. Baker & Thijs J. G. Ettema (2023). Inference and reconstruction of the heimdallarchaeial ancestry of eukaryotes. Nature.
- ↑ Woese C. R. & Gupta, R. (1981). «Are archaebacteria merely derived 'prokaryotes'?». Nature 289 (5793): 95-6. PMID 6161309. doi:10.1038/289095a0.
- ↑ Woese C (1998). «The universal ancestor». Proc. Natl. Acad. Sci. U.S.A. 95 (12): 6854-9. PMID 9618502. doi:10.1073/pnas.95.12.6854.
- ↑ Gupta RS (2000). «The natural evolutionary relationships among prokaryotes». Crit. Rev. Microbiol. 26 (2): 111-31. PMID 10890353. doi:10.1080/10408410091154219.
- ↑ Barns, Sue and Burggraf, Siegfried. (1997) Crenarchaeota. Version 1 de enero de 1997. in The Tree of Life Web Project
- ↑ Walsby AE (2005). «Archaea with square cells». Trends Microbiol. 13 (5): 193-5. PMID 15866034.
- ↑ Hixon WG, Searcy DG (1993). «Cytoskeleton in the archaebacterium Thermoplasma acidophilum? Viscosity increase in soluble extracts». BioSystems 29 (2-3): 151-60. PMID 8374067.
- ↑ Hara F, Yamashiro K, Nemoto N, et al (2007). «An actin homolog of the archaeon Thermoplasma acidophilum that retains the ancient characteristics of eukaryotic actin». J. Bacteriol. 189 (5): 2039-45. PMID 17189356. doi:10.1128/JB.01454-06. Archivado desde el original el 27 de mayo de 2020. Consultado el 16 de abril de 2008.
- ↑ Trent JD, Kagawa HK, Yaoi T, Olle E, Zaluzec NJ (1997). «Chaperonin filaments: the archaeal cytoskeleton?». Proc. Natl. Acad. Sci. U.S.A. 94 (10): 5383-8. PMID 9144246. Archivado desde el original el 27 de mayo de 2020. Consultado el 16 de abril de 2008.
- ↑ Hall-Stoodley L, Costerton JW, Stoodley P (2004). «Bacterial biofilms: from the natural environment to infectious diseases». Nat. Rev. Microbiol. 2 (2): 95-108. PMID 15040259.
- ↑ Nickell S, Hegerl R, Baumeister W, Rachel R (2003). «Pyrodictium cannulae enter the periplasmic space but do not enter the cytoplasm, as revealed by cryo-electron tomography». J. Struct. Biol. 141 (1): 34-42. PMID 12576018.
- ↑ Horn C, Paulmann B, Kerlen G, Junker N, Huber H (1999). «In vivo observation of cell division of anaerobic hyperthermophiles by using a high-intensity dark-field microscope». J. Bacteriol. 181 (16): 5114-8. PMID 10438790. doi:10.1073/pnas.241636498v1.
- ↑ Rudolph C, Wanner G, Huber R (Mayo de 2001). «Natural communities of novel archaea and bacteria growing in cold sulfurous springs with a string-of-pearls-like morphology». Appl. Environ. Microbiol. 67 (5): 2336-44. PMC 92875. PMID 11319120. doi:10.1128/AEM.67.5.2336-2344.2001.
- ↑ a b Thomas NA, Bardy SL, Jarrell KF (2001). «The archaeal flagellum: a different kind of prokaryotic motility structure». FEMS Microbiol. Rev. 25 (2): 147-74. PMID 11250034. doi:10.1111/j.1574-6976.2001.tb00575.x.
- ↑ Rachel R, Wyschkony I, Riehl S, Huber H (Marzo de 2002). «The ultrastructure of Ignicoccus: evidence for a novel outer membrane and for intracellular vesicle budding in an archaeon». Archaea 1 (1): 9-18. PMID 15803654. Archivado desde el original el 24 de febrero de 2009.
- ↑ A información procede de Willey, JM; Sherwood LM, Woolverton CJ (2008). «19». "Microbiology" (7ª edición). pp. 474-475. , excepto las partes que tienen notas.
- ↑ W. S. Vincent Yip, Nicholas G. Vincent and Susan J. Baserga, 2013. Ribonucleoproteins in Archaeal Pre-rRNA Processing and Modification. Archaea, 2013.
- ↑ a b Koga Y, Morii H (2007). «Biosynthesis of ether-type polar lipids in archaea and evolutionary considerations». Microbiol. Mol. Biol. Rev. 71 (1): 97-120. PMID 17347520. doi:10.1128/MMBR.00033-06.
- ↑ De Rosa M, Gambacorta A, Gliozzi A (1986). «Structure, biosynthesis, and physicochemical properties of archaebacterial lipids». Microbiol. Rev. 50 (1): 70-80. PMID 3083222.
- ↑ Albers SV, van de Vossenberg JL, Driessen AJ, Konings WN (Septiembre de 2000). «Adaptations of the archaeal cell membrane to heat stress». Front. Biosci. 5: D813-20. PMID 10966867. doi:10.2741/albers.
- ↑ Damsté JS, Schouten S, Hopmans EC, van Duin AC, Geenevasen JA (Octubre de 2002). «Crenarchaeol: the characteristic core glycerol dibiphytanyl glycerol tetraether membrane lipid of cosmopolitan pelagic crenarchaeota». J. Lipid Res. 43 (10): 1641-51. PMID 12364548. doi:10.1194/jlr.M200148-JLR200.
- ↑ Koga Y, Morii H (Noviembre de 2005). «Recent advances in structural research on ether lipids from archaea including comparative and physiological aspects». Biosci. Biotechnol. Biochem. 69 (11): 2019-34. PMID 16306681. doi:10.1271/bbb.69.2019. Archivado desde el original el 31 de diciembre de 2008.
- ↑ Hanford MJ, Peeples TL (Enero de 2002). «Archaeal tetraether lipids: unique structures and applications». Appl. Biochem. Biotechnol. 97 (1): 45-62. PMID 11900115. doi:10.1385/ABAB:97:1:45.
- ↑ Golyshina OV, Pivovarova TA, Karavaiko GI, et al (Mayo de 2000). «Ferroplasma acidiphilum gen. nov., sp. nov., an acidophilic, autotrophic, ferrous-iron-oxidizing, cell-wall-lacking, mesophilic member of the Ferroplasmaceae fam. nov., comprising a distinct lineage of the Archaea». Int. J. Syst. Evol. Microbiol. 50 Pt 3: 997-1006. PMID 10843038. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Sára M, Sleytr UB (2000). «S-Layer proteins». J. Bacteriol. 182 (4): 859-68. PMID 10648507. doi:10.1128/JB.182.4.859-868.2000.
- ↑ Engelhardt H, Peters J (1998). «Structural research on surface layers: a focus on stability, surface layer homology domains, and surface layer-cell wall interactions». J Struct Biol 124 (2–3): 276-302. PMID 10049812. doi:10.1006/jsbi.1998.4070.
- ↑ a b Kandler, O.; König, H. (1998). «Cell wall polymers in Archaea (Archaebacteria)». Cellular and Molecular Life Sciences (CMLS) 54 (4): 305-308. doi:10.1007/s000180050156.
- ↑ Howland, John L. (2000). The Surprising Archaea: Discovering Another Domain of Life. Oxford: Oxford University Press. pp. 32. ISBN 0-19-511183-4.
- ↑ Ng SY, Chaban B, Jarrell KF (2006). «Archaeal flagella, bacterial flagella and type IV pili: a comparison of genes and posttranslational modifications». J. Mol. Microbiol. Biotechnol. 11 (3–5): 167-91. PMID 16983194. doi:10.1159/000094053.
- ↑ Bardy SL, Ng SY, Jarrell KF (Febrero de 2003). «Prokaryotic motility structures». Microbiology (Reading, Engl.) 149 (Pt 2): 295-304. PMID 12624192. doi:10.1099/mic.0.25948-0.
- ↑ Aharon Oren 2001, Molecular ecology of extremely halophilic Archaea and Bacteria. FEMS Microbiology Ecology 39 (2002) 1-7
- ↑ a b c Valentine DL (2007). «Adaptations to energy stress dictate the ecology and evolution of the Archaea». Nat. Rev. Microbiol. 5 (4): 316-23. PMID 17334387. doi:10.1038/nrmicro1619.
- ↑ a b c Schäfer G, Engelhard M, Müller V (Septiembre de 1999). «Bioenergetics of the Archaea». Microbiol. Mol. Biol. Rev. 63 (3): 570-620. PMC 103747. PMID 10477309.
- ↑ Zillig W (1991). «Comparative biochemistry of Archaea and Bacteria». Curr. Opin. Gen. Dev. 1: 544-551.
- ↑ Romano A, Conway T (1996). «Evolution of carbohydrate metabolic pathways». Res Microbiol 147 (6–7): 448-55. PMID 9084754. doi:10.1016/0923-2508(96)83998-2.
- ↑ Koch A (1998). «How did bacteria come to be?». Adv Microb Physiol 40: 353-99. PMID 9889982. doi:10.1016/S0065-2911(08)60135-6.
- ↑ DiMarco AA, Bobik TA, Wolfe RS (1990). «Unusual coenzymes of methanogenesis». Annu. Rev. Biochem. 59: 355-94. PMID 2115763. doi:10.1146/annurev.bi.59.070190.002035.
- ↑ Klocke M, Nettmann E, Bergmann I, et al (Mayo de 2008). «Characterization of the methanogenic Archaea within two-phase biogas reactor systems operated with plant biomass». Syst. Appl. Microbiol. 31: 190. PMID 18501543. doi:10.1016/j.syapm.2008.02.003.
- ↑ Basado en PDB 1FBB. Información publicada en Subramaniam S, Henderson R (Agosto de 2000). «Molecular mechanism of vectorial proton translocation by bacteriorhodopsin». Nature 406 (6796): 653-7. PMID 10949309. doi:10.1038/35020614.
- ↑ Mueller-Cajar O, Badger MR (Agosto de 2007). «New roads lead to Rubisco in archaebacteria». Bioessays 29 (8): 722-4. PMID 17621634. doi:10.1002/bies.20616.
- ↑ a b Berg IA, Kockelkorn D, Buckel W, Fuchs G (Diciembre de 2007). «A 3-hydroxypropionate/4-hydroxybutyrate autotrophic carbon dioxide assimilation pathway in Archaea». Science (journal) 318 (5857): 1782-6. PMID 18079405. doi:10.1126/science.1149976.
- ↑ Bryant DA, Frigaard NU (Noviembre de 2006). «Prokaryotic photosynthesis and phototrophy illuminated». Trends Microbiol. 14 (11): 488-96. PMID 16997562. doi:10.1016/j.tim.2006.09.001.
- ↑ a b Francis CA, Beman JM, Kuypers MM (Mayo de 2007). «New processes and players in the nitrogen cycle: the microbial ecology of anaerobic and archaeal ammonia oxidation». ISME J 1 (1): 19-27. PMID 18043610. doi:10.1038/ismej.2007.8.
- ↑ Könneke M, Bernhard AE, de la Torre JR, Walker CB, Waterbury JB, Stahl DA (Septiembre de 2005). «Isolation of an autotrophic ammonia-oxidizing marine archaeon». Nature 437 (7058): 543-6. PMID 16177789. doi:10.1038/nature03911.
- ↑ Lanyi JK (2004). «Bacteriorhodopsin». Annu. Rev. Physiol. 66: 665-88. PMID 14977418. doi:10.1146/annurev.physiol.66.032102.150049.
- ↑ a b Allers T, Mevarech M (2005). «Archaeal genetics - the third way». Nat. Rev. Genet. 6 (1): 58-73. PMID 15630422.
- ↑ Baliga NS, Bonneau R, Facciotti MT, et al (2004). «Genome sequence of Haloarcula marismortui: a halophilic archaeon from the Dead Sea». Genome Res. 14 (11): 2221-34. PMID 15520287. doi:10.1101/gr.2700304.
- ↑ Waters E, Hohn MJ, Ahel I, et al (2003). «The genome of Nanoarchaeum equitans: insights into early archaeal evolution and derived parasitism». Proc. Natl. Acad. Sci. U.S.A. 100 (22): 12984-8. PMID 14566062. doi:10.1073/pnas.1735403100. Archivado desde el original el 16 de octubre de 2019. Consultado el 15 de abril de 2008.
- ↑ Schleper C, Holz I, Janekovic D, Murphy J, Zillig W (1995). «A multicopy plasmid of the extremely thermophilic archaeon Sulfolobus effects its transfer to recipients by mating». J. Bacteriol. 177 (15): 4417-26. PMID 7635827. Archivado desde el original el 29 de mayo de 2012. Consultado el 15 de abril de 2008.
- ↑ Sota M; Top EM (2008). «Horizontal Gene Transfer Mediated by Plasmids». Plasmids: Current Research and Future Trends. Caister Academic Press. ISBN 978-1-904455-35-6.
- ↑ Lipps G (2008). «Archaeal Plasmids». Plasmids: Current Research and Future Trends. Caister Academic Press. ISBN 978-1-904455-35-6.
- ↑ Xiang X, Chen L, Huang X, Luo Y, She Q, Huang L (2005). «Sulfolobus tengchongensis spindle-shaped virus STSV1: virus-host interactions and genomic features». J. Virol. 79 (14): 8677-86. PMID 15994761. doi:10.1128/JVI.79.14.8677-8686.2005.
- ↑ Prangishvili D, Forterre P, Garrett RA (2006). «Viruses of the Archaea: a unifying view». Nat. Rev. Microbiol. 4 (11): 837-48. PMID 17041631.
- ↑ Prangishvili D, Garrett RA (2004). «Exceptionally diverse morphotypes and genomes of crenarchaeal hyperthermophilic viruses». Biochem. Soc. Trans. 32 (Pt 2): 204-8. PMID 15046572.
- ↑ Mojica FJ, Díez-Villaseñor C, García-Martínez J, Soria E (2005). «Intervening sequences of regularly spaced prokaryotic repeats derive from foreign genetic elements». J. Mol. Evol. 60 (2): 174-82. PMID 15791728.
- ↑ Makarova KS, Grishin NV, Shabalina SA, Wolf YI, Koonin EV (2006). «A putative RNA-interference-based immune system in prokaryotes: computational analysis of the predicted enzymatic machinery, functional analogies with eukaryotic RNAi, and hypothetical mechanisms of action». Biol. Direct 1: 7. PMID 16545108.
- ↑ Graham DE, Overbeek R, Olsen GJ, Woese CR (2000). «An archaeal genomic signature». Proc. Natl. Acad. Sci. U.S.A. 97 (7): 3304-8. PMID 10716711. doi:10.1073/pnas.050564797.
- ↑ a b Gaasterland T (1999). «Archaeal genomics». Curr. Opin. Microbiol. 2 (5): 542-7. PMID 10508726.
- ↑ Aravind L, Koonin EV (1999). «DNA-binding proteins and evolution of transcription regulation in the archaea». Nucleic Acids Res. 27 (23): 4658-70. PMID 10556324.
- ↑ DeLong EF, Pace NR (2001). «Environmental diversity of bacteria and archaea». Syst. Biol. 50 (4): 470-8. PMID 12116647. doi:10.1080/106351501750435040.
- ↑ a b Pikuta EV, Hoover RB, Tang J (2007). «Microbial extremophiles at the limits of life». Crit. Rev. Microbiol. 33 (3): 183-209. PMID 17653987. doi:10.1080/10408410701451948.
- ↑ Madigan MT, Martino JM (2006). Brock Biology of Microorganisms (11th ed. edición). Pearson. p. 136. ISBN 0-13-196893-9.
- ↑ Takai K, Nakamura K, Toki T, Tsunogai U, Miyazaki M, Miyazaki J, Hirayama H, Nakagawa S, Nunoura T, Horikoshi K (2008). «Cell proliferation at 122 °C and isotopically heavy CH4 production by a hyperthermophilic methanogen under high-pressure cultivation». Proc Natl Acad Sci U S A 105: 10949-54. doi:10.1073/pnas.0712334105.
- ↑ Ciaramella M, Napoli A, Rossi M (Febrero de 2005). «Another extreme genome: how to live at pH 0». Trends Microbiol. 13 (2): 49-51. PMID 15680761. doi:10.1016/j.tim.2004.12.001.
- ↑ Javaux EJ (2006). «Extreme life on Earth—past, present and possibly beyond». Res. Microbiol. 157 (1): 37-48. PMID 16376523. doi:10.1016/j.resmic.2005.07.008.
- ↑ Nealson KH (Enero de 1999). «Post-Viking microbiology: new approaches, new data, new insights». Orig Life Evol Biosph 29 (1): 73-93. PMID 11536899. doi:10.1023/A:1006515817767.
- ↑ Davies PC (1996). «The transfer of viable microorganisms between planets». Ciba Found. Symp. 202: 304-14; discussion 314-7. PMID 9243022.
- ↑ López-García P, López-López A, Moreira D, Rodríguez-Valera F (Julio de 2001). «Diversity of free-living prokaryotes from a deep-sea site at the Antarctic Polar Front». FEMS Microbiol. Ecol. 36 (2–3): 193-202. PMID 11451524.
- ↑ Karner MB, DeLong EF, Karl DM (2001). «Archaeal dominance in the mesopelagic zone of the Pacific Ocean». Nature 409 (6819): 507-10. PMID 11206545. doi:10.1038/35054051.
- ↑ Giovannoni SJ, Stingl U. (2005). «Molecular diversity and ecology of microbial plankton». Nature 427 (7057): 343-8. PMID 16163344. doi:10.1038/nature04158.
- ↑ DeLong EF, Karl DM (Septiembre de 2005). «Genomic perspectives in microbial oceanography». Nature 437 (7057): 336-42. PMID 16163343. doi:10.1038/nature04157.
- ↑ Konneke M, Bernhard AE, de la Torre JR, Walker CB, Waterbury JB, Stahl DA. (2005). «Isolation of an autotrophic ammonia-oxidizing marine archaeon». Nature 437 (7057): 543-6. PMID 16177789. doi:10.1038/nature03911.
- ↑ Teske A, Sørensen KB (Enero de 2008). «Uncultured archaea in deep marine subsurface sediments: have we caught them all?». ISME J 2 (1): 3-18. PMID 18180743. doi:10.1038/ismej.2007.90.
- ↑ Lipp JS, Morono Y, Inagaki F, Hinrichs KU (Julio de 2008). «Significant contribution of Archaea to extant biomass in marine subsurface sediments». Nature. PMID 18641632. doi:10.1038/nature07174.
- ↑ Cabello P, Roldán MD, Moreno-Vivián C (Noviembre de 2004). «Nitrate reduction and the nitrogen cycle in archaea». Microbiology (Reading, Engl.) 150 (Pt 11): 3527-46. PMID 15528644. doi:10.1099/mic.0.27303-0.
- ↑ Coolen MJ, Abbas B, van Bleijswijk J, et al. (Abril de 2007). «Putative ammonia-oxidizing Crenarchaeota in suboxic waters of the Black Sea: a basin-wide ecological study using 16S ribosomal and functional genes and membrane lipids». Environ. Microbiol. 9 (4): 1001-16. PMID 17359272. doi:10.1111/j.1462-2920.2006.01227.x.
- ↑ Leininger S, Urich T, Schloter M, et al (Agosto de 2006). «Archaea predominate among ammonia-oxidizing prokaryotes in soils». Nature 442 (7104): 806-9. PMID 16915287. doi:10.1038/nature04983.
- ↑ Schimel J (agosto de 2004). «Playing scales in the methane cycle: from microbial ecology to the globe». Proc. Natl. Acad. Sci. U.S.A. 101 (34): 12400-1. Bibcode:2004PNAS..10112400S. PMC 515073. PMID 15314221. doi:10.1073/pnas.0405075101. Archivado desde el original el 16 de octubre de 2019. Consultado el 26 de mayo de 2010.
- ↑ «EDGAR 3.2 Fast Track 2000». Archivado desde el original el 21 de mayo de 2008. Consultado el 26 de junio de 2008.
- ↑ «Annual Greenhouse Gas Index (AGGI) Indicates Sharp Rise in Carbon Dioxide and Methane in 2007». 23 de abril de 2008. Archivado desde el original el 14 de mayo de 2008. Consultado el 26 de junio de 2008.
- ↑ United Nations Environment Programme (ed.). «Trace Gases: Current Observations, Trends, and Budgets». Climate Change 2001. Archivado desde el original el 5 de agosto de 2012. Consultado el 26 de mayo de 2010.
- ↑ Eckburg P, Lepp P, Relman D (2003). «Archaea and their potential role in human disease». Infect Immun 71 (2): 591-6. PMID 12540534. doi:10.1128/IAI.71.2.591-596.2003.
- ↑ Cavicchioli R, Curmi P, Saunders N, Thomas T (2003). «Pathogenic archaea: do they exist?». Bioessays 25 (11): 1119-28. PMID 14579252. doi:10.1002/bies.10354.
- ↑ Lepp P, Brinig M, Ouverney C, Palm K, Armitage G, Relman D (2004). «Methanogenic Archaea and human periodontal disease». Proc Natl Acad Sci U S a 101 (16): 6176-81. PMID 15067114. doi:10.1073/pnas.0308766101.
- ↑ Waters E, Hohn MJ, Ahel I, et al. (Octubre de 2003). «The genome of Nanoarchaeum equitans: insights into early archaeal evolution and derived parasitism». Proc. Natl. Acad. Sci. U.S.A. 100 (22): 12984-8. PMC 240731. PMID 14566062. doi:10.1073/pnas.1735403100. Archivado desde el original el 16 de octubre de 2019. Consultado el 15 de abril de 2008.
- ↑ Jahn U, Gallenberger M, Paper W, et al. (Marzo de 2008). «Nanoarchaeum equitans and Ignicoccus hospitalis: new insights into a unique, intimate association of two archaea». J. Bacteriol. 190 (5): 1743-50. PMID 18165302. doi:10.1128/JB.01731-07. Archivado desde el original el 27 de mayo de 2020. Consultado el 26 de mayo de 2010.
- ↑ Chaban B, Ng SY, Jarrell KF (Febrero de 2006). «Archaeal habitats—from the extreme to the ordinary». Can. J. Microbiol. 52 (2): 73-116. PMID 16541146. doi:10.1139/w05-147.
- ↑ Schink B (Junio de 1997). «Energetics of syntrophic cooperation in methanogenic degradation». Microbiol. Mol. Biol. Rev. 61 (2): 262-80. PMC 232610. PMID 9184013.
- ↑ Lange, M.; Westermann, P.; Ahring, B.K. (2005). «Archaea in protozoa and metazoa». Applied Microbiology and Biotechnology 66 (5): 465-474. doi:10.1007/s00253-004-1790-4.
- ↑ van Hoek AH, van Alen TA, Sprakel VS, et al. (Febrero de 2000). «Multiple acquisition of methanogenic archaeal symbionts by anaerobic ciliates». Mol. Biol. Evol. 17 (2): 251-8. PMID 10677847.
- ↑ Preston, C.M.; Wu, K.Y.; Molinski, T.F.; Delong, E.F. (1996). «A psychrophilic crenarchaeon inhabits a marine sponge: Cenarchaeum symbiosum gen. nov., sp. nov». Proc Natl Acad Sci USA 93 (13): 6241-6246. PMID 8692799. doi:10.1073/pnas.93.13.6241.
- ↑ Eckburg PB, Bik EM, Bernstein CN, et al (Junio de 2005). «Diversity of the human intestinal microbial flora». Science (journal) 308 (5728): 1635-8. PMC 1395357. PMID 15831718. doi:10.1126/science.1110591.
- ↑ Samuel BS, Gordon JI (Junio de 2006). «A humanized gnotobiotic mouse model of host-archaeal-bacterial mutualism». Proc. Natl. Acad. Sci. U.S.A. 103 (26): 10011-6. PMC 1479766. PMID 16782812. doi:10.1073/pnas.0602187103.
- ↑ Wegley, L.; Yu, Y.; Breitbart, M.; Casas, V.; Kline, D.I.; Rohwer, F. (2004). «Coral-associated Archaea» (PDF). Marine Ecology Progress Series 273: 89-96. doi:10.3354/meps273089. Archivado desde el original el 11 de septiembre de 2008.
- ↑ Chelius MK, Triplett EW (Abril de 2001). «The Diversity of Archaea and Bacteria in Association with the Roots of Zea mays L». Microb. Ecol. 41 (3): 252-63. PMID 11391463. doi:10.1007/s002480000087.
- ↑ Simon HM, Dodsworth JA, Goodman RM (Octubre de 2000). «Crenarchaeota colonize terrestrial plant roots». Environ. Microbiol. 2 (5): 495-505. PMID 11233158. doi:10.1046/j.1462-2920.2000.00131.x.
- ↑ a b Bernander R (1998). «Archaea and the cell cycle». Mol. Microbiol. 29 (4): 955-61. PMID 9767564.
- ↑ Kelman LM, Kelman Z (2004). «Multiple origins of replication in archaea». Trends Microbiol. 12 (9): 399-401. PMID 15337158.
- ↑ Onyenwoke RU, Brill JA, Farahi K, Wiegel J (2004). «Sporulation genes in members of the low G+C Gram-type-positive phylogenetic branch ( Firmicutes)». Arch. Microbiol. 182 (2-3): 182-92. PMID 15340788.
- ↑ Kostrikina NA, Zvyagintseva IS, Duda VI. (1991). «Cytological peculiarities of some extremely halophilic soil archaeobacteria». Arch. Microbiol. 156 (5): 344-49. doi:10.1007/BF00248708.
- ↑ Breithaupt H (2001). «The hunt for living gold. The search for organisms in extreme environments yields useful enzymes for industry». EMBO Rep. 2 (11): 968-71. PMID 11713183. doi:10.1093/embo-reports/kve238.
- ↑ a b Egorova K, Antranikian G (2005). «Industrial relevance of thermophilic Archaea». Curr. Opin. Microbiol. 8 (6): 649-55. PMID 16257257.
- ↑ Synowiecki J, Grzybowska B, Zdziebło A (2006). «Sources, properties and suitability of new thermostable enzymes in food processing». Crit Rev Food Sci Nutr 46 (3): 197-205. PMID 16527752.
- ↑ Schiraldi C, Giuliano M, De Rosa M (2002). «Perspectives on biotechnological applications of archaea». Archaea 1 (2): 75-86. PMID 15803645. Archivado desde el original el 26 de agosto de 2013.
- ↑ Norris PR, Burton NP, Foulis NA (2000). «Acidophiles in bioreactor mineral processing». Extremophiles 4 (2): 71-6. PMID 10805560.
- ↑ Shand RF; Leyva KJ (2008). «Archaeal Antimicrobials: An Undiscovered Country». Archaea: New Models for Prokaryotic Biology. Caister Academic Press. ISBN 978-1-904455-27-1.
Bibliografía
[editar]- Howland, John L. (2000). Oxford University Press, ed. The Surprising Archaea: Discovering Another Domain of Life. Oxford. ISBN 0-19-511183-4.
- Martinko, JM; Madigan MT (2005). Prentice Hall, ed. Brock Biology of Microorganisms (11ra edición). Englewood Cliffs, N.J. ISBN 0-13-144329-1.
- Garrett, RA; Klenk H (2005). WileyBlackwell, ed. Archaea: Evolution, Physiology and Molecular Biology. ISBN 1-4051-4404-1.
- Cavicchioli, R (2007). American Society for Microbiology, ed. Archaea: Molecular and Cellular Biology. ISBN 1-55581-391-7.
- Blum P (editor) (2008). Caister Academic Press, ed. Archaea: New Models for Prokaryotic Biology. ISBN 978-1-904455-27-1.
- Lipps, G (2008). «Archaeal Plasmids». En Caister Academic Press, ed. Plasmids: Current Research and Future Trends. ISBN 978-1-904455-35-6.
- Sapp, Jan (2009). Oxford University Press, ed. The New Foundations of Evolution. On the Tree of Life. Nueva York. ISBN 0-19-538850-X.
- Schaechter, M (2009). Elsevier Academic Press, ed. Archaea (Overview) in The Desk Encyclopedia of Microbiology (2da edición). San Diego y Londres. ISBN 978-0-12-374980-2.
Enlaces externos
[editar] Wikispecies tiene un artículo sobre Archaea.
Wikispecies tiene un artículo sobre Archaea. Wikimedia Commons alberga una categoría multimedia sobre Archaea.
Wikimedia Commons alberga una categoría multimedia sobre Archaea.- Introduction to the Archaea, ecology, systematics and morphology (en inglés)
- Página del NCBI sobre la taxonomía de las arqueas (en inglés)
- Géneros del dominio Archaea (en inglés)
- Ilustración Tree of Life que muestra la relación de las arqueas con otros seres vivos Archivado el 10 de febrero de 2015 en Wayback Machine. (en inglés)
- Shotgun sequencing finds nanoorganisms – descubrimiento del grupo ARMAN de arqueas (en inglés)
- Genomas completos de arqueas en UCSC (en inglés)
