Ruta del ácido shikímico
La ruta del ácido shikímico es un conjunto de reacciones metabólicas de gran relevancia en la biosíntesis de metabolitos secundarios. El ácido shikímico es precursor de diversos intermediarios metabólicos aromáticos, tales como los taninos, el cloranfenicol, el ácido 4-aminobenzoico, los fenilpropanoides, los lignanos, los aminoácidos aromáticos (tirosina, fenilalanina y triptófano), así como sus derivados: glucósidos cianogénicos aromáticos, aminas biógenas aromáticas, catecolaminas, betalaínas, melaninas, bisindoles, los flavonoides, las fenazinas y diversos alcaloides tales como los tetrahidroisoquinolínicos, los alcaloides del ergot y los morfinanos, entre otros. El intermediario principal es el ácido shikímico, un compuesto originalmente aislado de plantas del género Illicium. En compuestos aromáticos derivados del ácido shikímico, las posiciones oxigenadas son de tipo catecol (orto) o pirogalol (diorto), y en el caso de los fenoles monooxigenados son generalmente p-hidroxi-compuestos.[1][2][3]
Distribución
Esta ruta es empleada por bacterias, algas, plantas y algunos hongos pero no por animales y protozoarios. Sin embargo, los tres aminoácidos aromáticos son esenciales para la vida.[4]
Principales rutas
Ruta del 3-deshidroquinato
El ácido shikímico se biosintetiza originalmente del fosfoenol piruvato y la eritrosa 4-fosfato para formar el precursor denominado ácido 3-deshidroquínico. Éste ácido puede formar varios metabolitos, como el ácido gálico, el ácido protocatecuico, el ácido quínico y el ácido shikímico:[5]

- El ácido gálico es precursor de los denominados taninos hidrolizables (Galotaninos y Elagitaninos)[6][7]
- El ácido quínico es precursor de varios metabolitos secundarios, como el ácido clorogénico.
- El ácido protocatecuico es un antimicrobial presente en muchas plantas.
Ruta del corismato
El ácido shikímico puede producir por una vía enzimática de 3 pasos uno de los metabolitos intermedios más importantes de la ruta del ácido shikímico, el ácido corísmico:

En esta ruta se llevan a cabo 3 reacciones:
- Fosforilación del shikimato, en donde se forma el ácido 3-fosfoshikímico por acción de la shikimato quinasa y ATP;
- Conjugación con una molécula de fosfoenol piruvato por acción de la 3-fosfoshikimato 1-carboxiviniltransferasa, en donde se forma el ácido 5-enolpiruvilshikímico 3-P (EPSP)
- Eliminación del fosfato catalizada por la corismato sintasa.
El ácido corísmico puede producir metabolitos de gran diversidad química:

- El ácido 4-hidroxibenzoico es un compuesto encontrado en muchas plantas. Es precursor de las ubiquinonas.
- El ácido antranílico es precursor del triptófano, las quinolonas, las acridonas y algunos policétidos que utilizan al antranilato como unidad de iniciación.
- El ácido 4-aminobenzoico, el cual es requerido en la biosíntesis del ácido fólico.
- El ácido isocorísmico, precursor del ácido salicílico y el ácido 2,3-dihidroxibenzoico, componente de la enterobactina.
- El ácido prefénico, precursor de los aminoácidos fenilalanina y tirosina.
Ruta del prefenato: Biosíntesis de los aminoácidos aromáticos
Las rutas de los aminoácidos aromáticos L-fenilalanina y L-tirosina a partir del ácido prefénico pueden variar de acuerdo al organismo, y en muchos casos puede operar más de una ruta en una especie. En esencia, tres tipos de reacción están implicadas: Transaminación, aromatización descarboxilativa e hidroxilaciones, pero lo que cambia en los organismos es el orden en el que se llevan a cabo. Así, en algunos organismos se pueden producir tanto sustratos del ácido arogénico como del prefénico. Muchas bacterias y plantas tienden a sintetizar la fenilalanina y la tirosina por separado.

Los animales, en cambio, carecen de la ruta del ácido shikímico, por lo que la fenilalanina resulta esencial, no así la tirosina, la cual se puede obtener por la para-hidroxilación de la fenilalanina:

Ruta de los fenilpropanoides
La L-fenilalanina y la L-tirosina son bloques de contrucción para una amplia gama de metabolitos secundarios: los fenilpropanoides (Compuestos tipo C6C3). En plantas, el primer paso es la eliminación del nitrógeno de la fenilalanina en forma de amoniaco para generar el ácido trans-cinámico (En el caso de la tirosina se forma Ácido p-coumárico) Todas las plantas pueden desaminar fenilalanina por medio de la fenilalanina amoniaco liasa (PAL), pero la desaminación de tirosina parece ser más restringida a miembros de la familia Poaceae. La tirosina amoniaco liasa (TAL) ha sido encontrada en plantas y bacterias. Aquellos organismos que no pueden desaminar la tirosina obtienen el ácido p-coumárico por hidroxilación del ácido cinámico.

Rutas de los arilpiruvatos
Los productos de transaminación de aminoácidos aromáticos son el ácido fenilpirúvico y el ácido p-hidroxifenilpirúvico, los cuales pueden ser interconvertibles en algunos organismos via prefenato. El ácido fenilpirúvico puede reducirse para formar ácido 3-fenil láctico, el cual puede transformarse por transposición en ácido trópico, componente de la hiosciamina. El ácido fenilpirúvico puede dimerizarse por medio de una condensación aldólica doble para formar ácido polipórico, el cual es precursor de varios terfenilos, por ejemplo atromentina, volucrisporina, leucomelona, muscafurina, ácido telefórico y xileritrina. El ácido polipórico puede escindirse oxidativamente para formar ácido pulvínico y sus derivados.
El ácido 4-hidroxifenilpirúvico es precursor de la 4-hidroxifenilglicina, aminoácido componente de péptidos no ribosomales, como en el caso de la vancomicina.
El ácido homogentísico es un catabolito de la tirosina. También es precursor en la biosíntesis de las plastoquinonas.

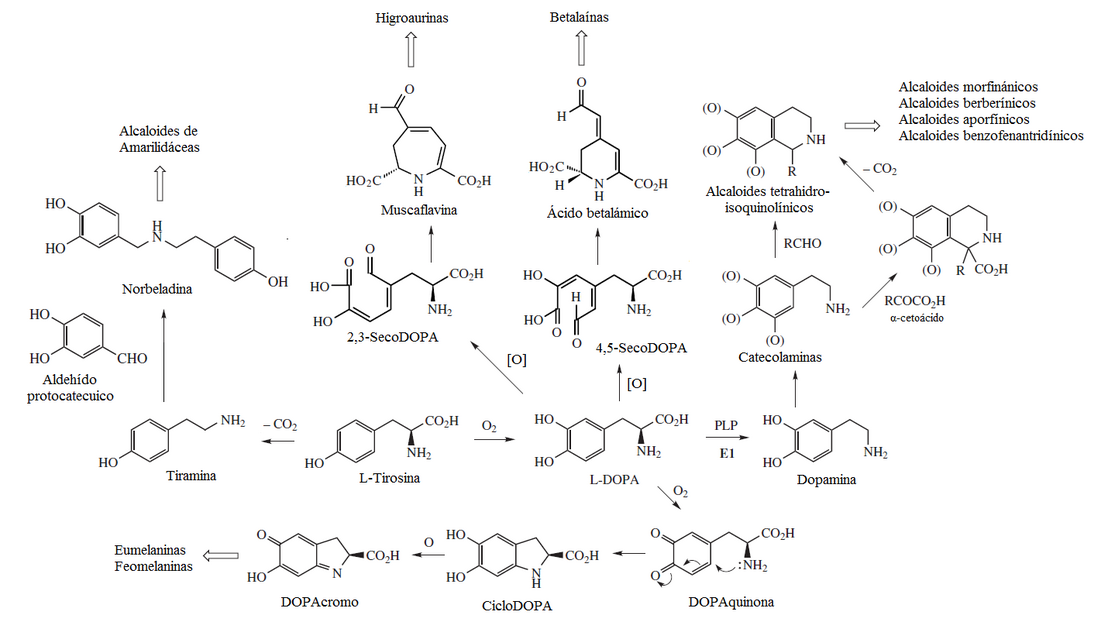
Rutas de la DOPA
La 3,4-dihidroxifenilalanina (DOPA) es un precursor relevante en el metabolismo de la tirosina y la fenilalanina. Se produce por la hidroxilación de la tirosina y produce varios metabolitos secundarios tales como las melaninas,[8] las catecolaminas,[9] las betalaínas,[10] las higroaurinas,[11] los alcaloides tetrahidroisoquinolínicos[12] y otros alcaloides.
Glucósidos cianogénicos y glucosinolatos de aminoácidos aromáticos
Los aminoácidos aromáticos pueden formar glucósidos cianogénicos y glucosinolatos. Ambos siguen las mismas rutas generales para ambos tipos de compuestos, en donde la formación de la aldoxima es el metabolito intermediario que puede formar el glucósido cianogénico o el glucosinolato, dependiendo de la especie. A continuación se ilustra como ejemplo la biosíntesis de los derivados de la tirosina, durrina y sinalbina. La mirosinasa hidroliza de manera general a todos los glucosinolatos cuando la planta presenta un daño físico.[13] [14]

Rutas del ácido antranílico
Acridinas y quinolinas
El ácido antranílico es precursor de varios metabolitos secundarios por condensación o conjugación con moléculas provenientes de otras rutas.
- Cuando el ácido antranílico se esterifica con una molécula de coenzima A, puede participar como unidad de iniciación en la formación de un policétido mixto con 2 unidades. Mediante los mismos mecanismos de los policétidos se pueden formar sistemas aromáticos policíclicos fusionados, tales como los alcaloides quinolónicoss. La prenilación con pirofosfato de dimetilalilo (DMAPP) puede generar alcaloides con esqueleto de furo[2,3-b]quinolina. La N-metilantraniloil-Coenzima A puede formar un tricétido, el cual es precursor de los alcaloides acridínicos, tales como la rutacridona, la acronicina y la melicopicina.
- La antraniloil coenzima A puede condensarse en una reacción tipo Mannich con el catión pirrolinio (derivado de la ornitina) para producir alcaloides del tipo 1,2,3,9-tetrahidropirrolo[2,1-b]quinazolina, por ejemplo la peganina. Se ha homologado esta ruta con otras quinazolinas, tales como la febrifuguina.

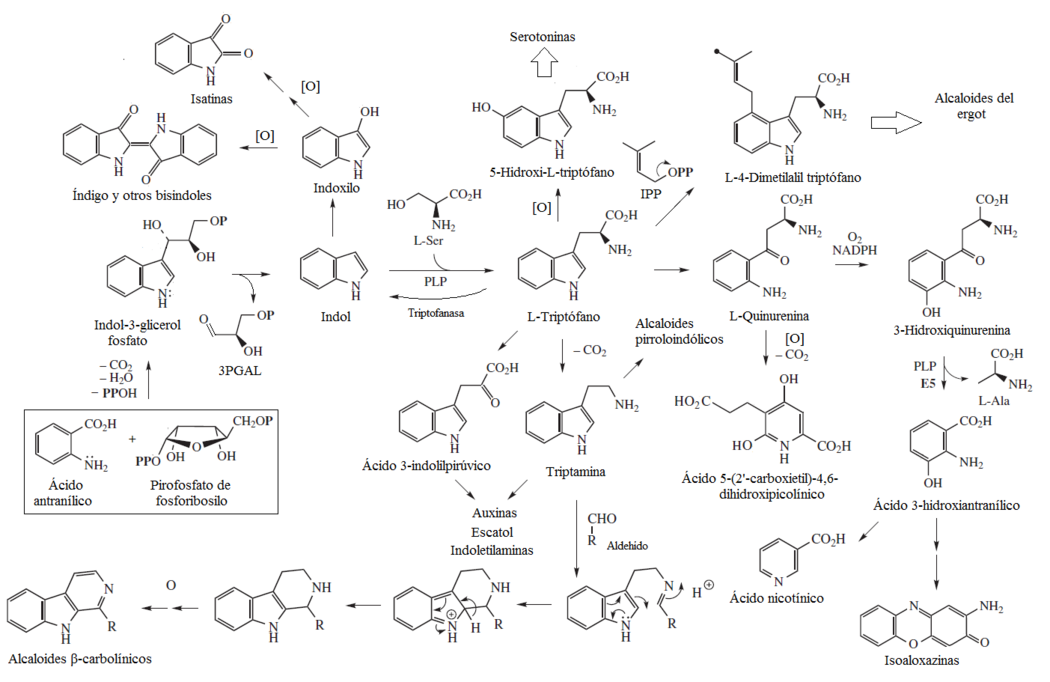
Indol y triptófano
El indol es biosintetizado a partir de ácido antranílico y pirofosfato de 5-fosfato-1-ribosilo. Se forma el fosfato de 3-indolilglicerol como intermediario, el cual elimina una molécula de alanina para formar indol ligado a la enzima (No se encuentra libre). Este indol realiza una SEA con una molécula de serina para formar el triptófano. Este aminoácido puede seguir las siguientes rutas:[15]
- Descarboxilación: El producto de descarboxilación del triptófano es la triptamina, la cual puede seguir varios caminos:
- - Alquilaciones: La triptamina puede alquilarse o hidroxilarse, formando así los alcaloides indoliletil amínicos o triptaminas. Un ejemplo clásico es la psilocibina aislada de los hongos alucinógenos Psilocybe.
- - Ciclización por radicales libres: Se forman alcaloides pirroloindolicos, tales como la fisostigmina.
- - Reacción de Mannich: La amina forma primero una imina con un carbonilo. La base de Schiff formada reacciona con el anillo aromático en una reacción tipo Mannich para dar una heterociclización que forma alcaloides β-carbolínicos. Los compuestos carbonílicos más comunes son el ácido pirúvico, el cual forma 1-metil β-carbolinas (como la harmina) o la secologanina (V. más adelante).
- - Transaminación: Esta ruta puede formar auxinas o escatol.
- Transaminación: El producto es el ácido 3-indolilpirúvico. Este intermediario es una alternativa para formar auxinas.
- Eliminación de piruvato: A partir de la triptofanasa, el triptófano elimina piruvato para producir indol libre. Este indol se puede hidroxilar para formar indoxilo. Este intermediario puede formar el glucósido indicano, pigmentos bisindólicos (como el colorante índigo o la púrpura de Tiro) o isatinas (Via N-acetil isatina.
- 5-Hidroxilación: Se forma el intermediario 5-hidroxitriptófano. Este compuesto es precursor de aminas biológicamente activas, tales como la serotonina y la melatonina.
- Prenilación: La SEA de una unidad de pirofosfato de dimetilalilo forma el intermediario L-4-Dimetilalil triptófano. Este es el precursor de los alcaloides del ergot.
- Escisión oxidativa: Por una ruptura oxidativa del anillo heterocíclico del indol, se forma la quinurenina, un intermediario catabólico que puede formar ácido 3-hidroxiantranílico, el cual puede formar isofenoxazinas y ácido nicotínico. Otro producto posible es el ácido 5-(2'carboxietil)-4,6-dihidroxipicolínico.
El triptófano también puede formar glucosinolatos, por ejemplo, la glucobrasicina (V.Biosíntesis de glucosinolatos)
Existen otros compuestos que proceden del triptófano o el ácido antranílico cuyas biosíntesis se revisarán en sus artículos correspondientes, tales como la camalexina, brassilexina, la estaurosporina, la piocianina, la violaceína, las benzoxazinas, las criptolepinas, la luciferina.
Catabolismo de los derivados del ácido shikímico[16]
Degradación de fenilalanina y tirosina
Se ha encontrado que los seres vivos pueden catabolizar la tirosina, la fenilalanina y los fenilpropanoides. La L-fenilalanina puede degradarse por descarboxilación (con catálisis de la Descarboxilasa de los aminoácidos aromáticos, EC 4.1.1.28) para producir feniletilamina, o por transaminación para dar el ácido fenilpirúvico.
La fenetilamina puede transaminarse para dar el fenilacetaldehído. Este compuesto se oxida a ácido fenilacético por acción de una aldehído deshidrogenasa (EC 1.2.1.5). Posteriormente una monooxigenasa hidroxila el anillo aromático en posición meta. Una vez más, se puede hidroxilar por la acción otra monooxigenasa en la posición 4. El producto intermediario es el ácido homoprotocatecuico. El ácido fenilacético se puede esterificar con la Coenzima A.
Por otro lado, el ácido fenilpirúvico sufre una descarboxilación oxidativa para formar fenilacetaldehído, el cual se puede incorporar a la ruta anteriormente descrita.
De modo análogo, la tirosina puede descarboxilarse o transaminarse, como se indicó en el inciso anterior. El producto de transaminación (Ácido p-hidroxifenilpirúvico) puede ser epoxidado en la posición 1,2 con transposición para dar el ácido homogentísico. Si el producto de transaminación se descarboxila con oxidación, se forma el 4-hidroxifenilacetaldehído. El producto de descarboxilación de la tirosina (la tiramina) al transaminarse forma también el 4-hidroxifenilacetaldehído. Este compuesto se oxida a su correspondiente ácido carboxílico, el cual se puede oxigenar por acción de la 4-hidroxifenilacetato 1-monooxigenasa (EC 1.14.13.18). El producto por acción de esta enzima produce también ácido homogentísico. Otra ruta que puede tomar el ácido 4-hidroxifenilacético es oxigenarse por acción de otra enzima, la 4-hidroxifenilacetato-3-monooxigenasa de cadena larga (EC 1.14.14.9). El producto de esta reacción es el ácido homoprotocatecuico.
La degradación de los aminoácidos tirosina y fenilalanina puede producir, dependiendo el organismo, 3 compuestos intermediarios:
- Ácido homogentísico
- Ácido homoprotocatecuico
- Fenilacetil Coenzima A
Cada uno de estos intermediarios tiene distintas formas de catabolizarse, lo cual deja ver la gran diversidad metabólica que existe en los seres vivos para el aprovechamiento energético de varios compuestos aromáticos.

La degradación del ácido homoprotocatecuico procede por los siguientes pasos:
- Escisión oxidativa del anillo aromático en presencia de oxígeno y NADPH por acción de la 3,4-dihidroxifenilacetato 2,3-dioxigenasa (EC 1.13.11.15). El producto es el semialdehído del ácido 2-hidroxi-5-carboximetilmucónico.
- Oxidación del semialdehído al ácido carboxílico por acción de la 5-carboximetil-2-hidroximucónico-semialdehído deshidrogenasa (EC 1.2.1.60). Una enzima diferente que realiza la misma reacción en organismos distintos es la 2-hidroxi-4-carboximuconato semialdehído hemiacetal deshidrogenasa (EC:1.1.1.312)
- Tautomería ceto con metátesis de doble ligadura, catalizada por la 5-carboximetil-2-hidroximuconato isomerasa (EC 5.3.3.10 ó HpaF).
- Descarboxilación catalizada por la 5-oxopent-3-eno-1,2,5-tricarboxylato decarboxilasa (EC 4.1.1.68). El producto es el ácido 2-hidroxihepta-2,4-dienodioico.
- Tautomería ceto con metátesis de doble ligadura, catalizada por la 2-hidroximuconato isomerasa (EC 4.1.1.68 ó HpaG).
- Hidratación del alqueno catalizada por una hidratasa (HpaH).
- Condensación aldólica inversa, para producir ácido pirúvico y semialdehído succínico. Esta reacción es catalizada por una aldolasa (HpaI)

La fenilacetil-Coenzima A puede degradarse por dos vías:
- 1- Vía benzoato: la fenilacetil-Coenzima A se oxida en posición bencílica para formar fenilglioxil-Coenzima A (Con participación de la fenilacetil-CoA deshidrogenasa, EC 1.17.5.1 y una quinona). El éster de la coenzima A se hidroliza (La enzima es la fenilacetil-CoA hidrolasa, EC 3.1.2.25) y se descarboxila con oxidación por acción de la fenilglioxilato deshidrogenasa (EC 1.2.1.58).
- 2- Via 3-oxoadipil-CoA: Ocurren 7 reacciones, todas catalizadas por enzimas: epoxidación del anillo aromático en la posición 1,2 (1,2-fenilacetil-CoA epoxidasa de anillo, subunidad PaaA); expansión de anillo por una reacción electrocíclica inversa (2-(1,2-epoxi-1,2-dihidrofenil)acetil-CoA isomerasa; EC 5.3.3.18); hidrólisis de la oxepina (Sistema oxepina-CoA hidrolasa / 3-oxo-5,6-deshidrosuberil-CoA semialdehído deshidrogenasa;EC:3.7.1.16 y EC 1.17.1.7); condensación de Claisen inversa (acetil-CoA acetiltransferasa); hidratación del alqueno (enoil-CoA hidratasa EC:4.2.1.17) y oxidación del alcohol (3-hidroxibutiril-CoA deshidrogenasa EC 1.1.1.157). Los catabolitos formados son acetil coenzima A y 3-oxoadipil-Coenzima A (Este intermediario puede formar acetil couenzima A y butiril-Coenzima A).

La degradación del ácido homogentísico tiene dos posibles rutas:
- Vía a) Por descarboxilación del ácido homogentísico. Se produce primero gentisaldehído, el cual se oxida a su ácido correspondiente, el ácido gentísico (Enzima: aril-aldehído deshidrogenasa, EC 1.2.1.29). El ácido m-salicílico (el cual se forma durante la degradación del benzoato) puede hidroxilarse para formar ácido gentísico. El ácido gentísico puede descarboxilarse (Gentisato descarboxilasa EC 4.1.1.62) para formar dihidroquinona (El cual se degrada de acuerdo a lo mostrado más adelante en la degradación del ácido benzoico) o puede sufrir escisión oxidativa del anillo aromático (Gentisato 1,2-dioxigenasa, EC 1.13.11.4) para formar el ácido 3-maleilpirúvico. Éste se isomeriza a su forma trans (Maleilpiruvato isomerasa, EC 5.2.1.4), el ácido 3-fumarilpirúvico. Por medio de una condensación de Claisen inversa (acilpiruvato hidrolasa EC 3.7.1.5) se obtienen ácido fumárico y ácido pirúvico.
- Vía b) El ácido homogentísico sufre directamente la escisión oxidativa (Enzima: homogentisato 1,2-dioxigenasa EC 1.13.11.5) para formar ácido 4-maleilacetoacético, se isomeriza a la forma trans (maleilacetoacetato isomerasa EC 5.2.1.2) y sufre una condensación de Claisen inversa para formar ácido acetoacético y ácido fumárico (fumarilacetoacetasa EC 3.7.1.2).

Degradación del ácido benzoico
El ácido benzoico es un metabolito de degradación de compuestos aromáticos en plantas y bacterias[17] . Este compuesto es un xenobiótico que puede resultar tóxico para animales y hongos, por lo que los seres vivos han desarrollado distintas rutas complejas para la degradación del ácido benzoico o sus sales. El esquema general es la hidroxilación del ácido benzoico (la cual se puede efectuar en distintas posiciones) para dar intermediarios que pueden escindirse oxidativamente para dar derivados del ácido mucónico. Estos compuestos pueden seguirse oxidando para producir moléculas que pueden incorporarse en el ciclo de ácido cítrico:[18]

Muchos mamíferos herbívoros eliminan el ácido benzoico por la formación del ácido hipúrico. La benzoil Coenzima A puede funcionar como unidad de iniciación en la ruta de los policétidos.

Degradación de fenilpropanoides

Referencias
- ↑ Vered Tzin and Gad Galili. "New Insights into the Shikimate and Aromatic Amino Acids Biosynthesis Pathways in Plants." Molecular Plant (2010); 3(6):956–972
- ↑ Knaggs AR "The biosynthesis of shikimate metabolites." Nat. Prod. Rep. (2003); 20:p. 119–136.
- ↑ B. Buchanan, W. Gruissem, R. Jones, "Biochemistry & Molecular Biology of Plants,". (2000), Edit. American Society of Plant Physiologists. pp. 1281-1292
- ↑ Romeo, Ibrahim,Varin, DeLuca. "Evolution of Pathways." Vol 34. Edit. Pergamon (2000)
- ↑ Joel E. Ream, Hans C. Steinrücken, Clark A. Porter, and James A. Sikorski. "Purification and Properties of 5-Enolpyruvylshikimate-3-Phosphate Synthase from Dark-Grown Seedlings of Sorghum bicolor". Plant Physiol. (1988); 87(1):p. 232–238.
- ↑ Feldman KS Recent progress in ellagitannin chemistry. Phytochemistry (2005) 66:p. 1984–2000.
- ↑ Haslam E Vegetable tannins – lessons of a phytochemical lifetime. Phytochemistry (2007) 68: 2713–2721.
- ↑ Zecca L., Tampellini D., Gerlach M., Riederer P.,Fariello R.G., Sulzer D. "Substantia nigra neuromelanin: structure, synthesis, and molecular behaviour." Molecular Pathology (2001) 54:p. 414–418.
- ↑ Blashko. "Catecholamine biosynthesis". Br. Med. Bull. (1973) 29(2):p. 105-109
- ↑ Strack D., Vogt T., Schliemann W. "Recent advances in betalain research". Phytochemistry (2003) 62:p.247–269.
- ↑ Mueller L.K., Hinz U., Zryd J.-P. "The formation of betalamic acid and muscaflavin by recombinant DOPA-dioxygenase from Amanita." Phytochemistry (1997) 44:p. 567–569.
- ↑ Khanna, M. Takido, H. Rosenberg And A. G. Paul. "Biosynthesis of phenolic tetrahydroisoquinoline alkaloids of peyote". Phytochemistry, (1970) 9: pp. 1811-1815.
- ↑ Poulton. "Cyanogenesis in Plants" Plant Physiol. (1990) 94: p.401-405.
- ↑ Dewick, P.M. (2009). Medicinal Natural Products. A biosynthetic approach. UK: John Wiley and Sons. p. 539. ISBN 978-0-470-74168-9.
- ↑ Kegg Pathway: Tryptophan metabolism http://www.genome.jp/kegg/pathway/map/map00380.html
- ↑ Albert L. Lehninger, David Lee Nelson, Michael M. Cox (2005). Principles of biochemistry, Vol. 1 4th ed. W.H. Freeman,. ISBN 9780716743392.
- ↑ Abd El-Mawla AMA, Beerhues L "Benzoic acid biosynthesis in cell cultures of Hypericum androsaemum." Planta (2002) 214:p. 727-733
- ↑ Kegg Pathways: Benzoate degradation http://www.genome.jp/kegg/pathway/map/map00362.html