Ciclo de Krebs

El ciclo de Krebs (ciclo del ácido cítrico o ciclo de los ácidos tricarboxílicos)[1][2] es una ruta metabólica, es decir, una sucesión de reacciones químicas, que forma parte de la respiración celular en todas las células aerobias, donde es liberada energía almacenada a través de la oxidación del acetilcoenzima A (acetil-CoA) derivado de glúcidos, lípidos y proteínas en dióxido de carbono y energía química en forma de adenosín trifosfato (ATP). En la célula eucariota, el ciclo de Krebs se realiza en la matriz mitocondrial.
Además, el ciclo proporciona precursores de ciertos aminoácidos, así como el agente reductor nicotinamida adenina (NADH) que se utiliza en numerosas reacciones bioquímicas. Su importancia central para muchas vías bioquímicas sugiere que es uno de los primeros componentes establecidos del metabolismo celular y señala un origen abiogénico.[3][4]
En organismos aeróbicos, el ciclo de Krebs es parte de la vía catabólica que realiza la oxidación de glúcidos, ácidos grasos y aminoácidos hasta producir dióxido de carbono (CO2), liberando energía en forma utilizable: poder reductor y guanosina trifosfato (GTP), que algunos microorganismos se producen ATP.
El metabolismo oxidativo de glúcidos, lípidos y proteínas frecuentemente se divide en tres etapas, de las cuales el ciclo de Krebs supone la segunda. En la primera etapa, los carbonos de estas macromoléculas dan lugar a acetil-CoA, e incluye las vías catabólicas de aminoácidos (p. ej. desaminación oxidativa), la beta oxidación de ácidos grasos y la glucólisis. La tercera etapa es la fosforilación oxidativa, en la cual el poder reductor (NADH y flavín adenín -FADH2-) generado se emplea para la síntesis de ATP según la teoría del acoplamiento quimiosmótico.
El ciclo de Krebs también proporciona precursores para muchas biomoléculas, como ciertos aminoácidos. Por ello se considera una vía anfibólica, es decir, catabólica y anabólica al mismo tiempo.
El nombre de esta vía metabólica se deriva del ácido cítrico (un tipo de ácido tricarboxílico) que se consume y luego se regenera por esta secuencia de reacciones para completar el ciclo, o también conocido como ciclo de Krebs ya que fue descubierto por el alemán Hans Adolf Krebs, quien obtuvo el Premio Nobel de Fisiología o Medicina en 1953, junto con Fritz Lipmann.
Muchos de los componentes y reacciones del ciclo del ácido cítrico fueron establecidos en la década de 1930 por la investigación de Albert Szent-Györgyi, por la que recibió el Premio Nobel de Medicina o Fisiología en 1937, específicamente por sus descubrimientos relacionados con el ácido fumárico, un componente clave de esta ruta metabólica.[5] El ciclo del ácido cítrico fue finalmente identificado en 1937 por Hans Adolf Krebs, en la universidad de Sheffield, por lo que recibió el Premio Nobel de Medicina o Fisiología en 1953.[6]
Evolución[editar]
Los componentes del ciclo se derivaron de bacterias anaerobias, y el mismo ciclo posiblemente ha evolucionado más de una vez.[7] Teóricamente, hay varias alternativas al ciclo del ácido cítrico, sin embargo, este ciclo parece ser el más eficiente. Si varias alternativas del ciclo de Krebs habían evolucionado independientemente, todas parecen haber convergido en esta ruta.[8][9]
Visión general[editar]
El ciclo del ácido cítrico es una vía metabólica clave que unifica el metabolismo de los glúcidos, las grasas y las proteínas. Las reacciones del ciclo son llevadas a cabo por 8 enzimas que oxidan completamente el acetilo, en forma de acetil-CoA, y se liberan dos moléculas por cada una, de dióxido de carbono y agua. A través del catabolismo de azúcares, grasas y proteínas, se produce un acetilo de producto orgánico de dos carbonos en forma de acetil-CoA que entra en el ciclo de ácido cítrico. Las reacciones del ciclo también convierten tres equivalentes de nicotinamida adenina dinucleótido (NAD+) en tres de NAD+ reducido (NADH), un equivalente de flavina adenina dinucleótido (FAD) en una de FADH2, y un equivalente de guanosina difosfato (GDP) y fosfato inorgánico (Pi) en una de trifosfato de guanosina (GTP). El NADH y el FADH2 generados por el ciclo del ácido cítrico son a su vez utilizados por la vía de la fosforilación oxidativa para generar trifosfato de adenosina rico en energía (ATP).
Una de las fuentes primarias de acetil-CoA es la descomposición de azúcares por glucólisis que producen ácido pirúvico que a su vez es descarboxilado por la enzima piruvato deshidrogenasa que genera acetil-CoA.

El producto de esta reacción, acetil-CoA, es el punto de partida para el ciclo del ácido cítrico.
El ciclo del ácido cítrico comienza con la transferencia de un grupo acetilo de dos carbonos de acetil-CoA al compuesto aceptor de cuatro carbonos (ácido oxaloacético/oxalacetato) para formar un compuesto de seis carbonos (citrato).
El citrato pasa entonces por una serie de transformaciones químicas, perdiendo dos grupos carboxilo como CO2. Los carbonos perdidos como CO2 se originan de lo que fue oxaloacetato, no directamente de acetil-CoA. Los carbonos donados por acetil-CoA se convierten en parte de la columna vertebral de oxaloacetato de carbono después de la primera vuelta del ciclo de ácido cítrico. La pérdida de los carbonos donados con acetil-CoA como CO2 requiere varias vueltas del ciclo del ácido cítrico. Sin embargo, debido al papel del ciclo del ácido cítrico en el anabolismo, pueden no perderse, ya que muchos intermedios del ciclo TCA también se utilizan como precursores de la biosíntesis de otras moléculas.[10]
La mayor parte de la energía disponible por los pasos oxidativos del ciclo se transfiere como electrones ricos en energía a NAD+, formando NADH. Para cada grupo acetilo que entra en el ciclo del ácido cítrico, se producen tres moléculas de NADH.
Los electrones también son transferidos al aceptor de electrones coenzima Q, formando QH2.
Al final de cada ciclo, el oxaloacetato de cuatro carbonos ha sido regenerado, y el ciclo continúa.
Reacciones del ciclo de Krebs[editar]
El ciclo de Krebs tiene lugar en la matriz mitocondrial en la célula eucariota.
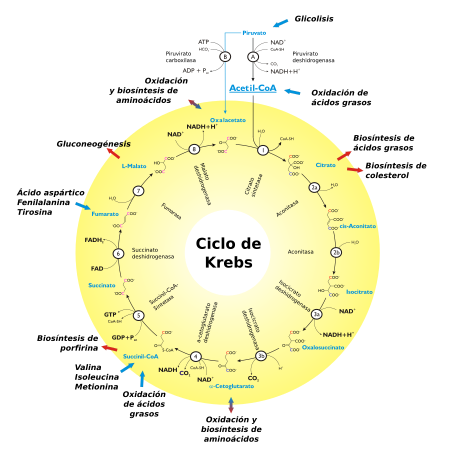
El acetil-CoA es el principal precursor del ciclo. El ácido cítrico (6 carbonos) o citrato se obtiene en cada ciclo por condensación de un acetil-CoA (2 carbonos) con una molécula de oxaloacetato (4 carbonos). El citrato produce en cada ciclo una molécula de oxaloacetato y dos CO2, por lo que el balance neto del ciclo es:
Los dos carbonos del acetil-CoA son oxidados a CO2, y la energía que tenía acumulada es liberada en forma de energía química: GTP y poder reductor (electrones de alto potencial): NADH y FADH2. NADH y FADH2 son coenzimas (moléculas que se unen a enzimas) capaces de acumular la energía en forma de poder reductor para su conversión en energía química en la fosforilación oxidativa.
El FADH2 de la succinato deshidrogenasa (complejo II de la cadena transportadora de electrones), al no poder desprenderse de la enzima, debe oxidarse nuevamente in situ. El FADH2 cede sus dos hidrógenos a la ubiquinona (coenzima Q), que se reduce a ubiquinol (QH2) y abandona la enzima.
Las reacciones son:
| Molécula Sustrato | Co-Sustrato | Enzima | Tipo de reacción | Productos | Comentarios |
|---|---|---|---|---|---|
| I. Citrato | - | 1. Aconitasa | Deshidratación | cis-Aconitato+
H2O |
Reacción reversible isomerización |
| II. cis-Aconitato [Nota 1] | H2O | 2. Aconitasa | Hidratación | Isocitrato | Reacción reversible isomerización |
| III. Isocitrato | NAD | 3. Isocitrato deshidrogenasa | Oxidación
(por transferencia de protones) |
NADH + Oxalosuccinato +H+ | Síntesis de NADH |
| IV. Oxalosuccinato | - | 4. Isocitrato deshidrogenasa | Descarboxilación | α-cetoglutarato+
CO2 |
Reacción irreversible, es dependiente de la velocidad, sintetiza moléculas de 5 carbonos |
| V. α-cetoglutarato | NAD + CoA-SH | 5. α-cetoglutarato deshidrogenasa |
Descarboxilación oxidativa (descarboxilacion y deshidrogenacion) |
NADH + H+ + CO2 + Succinil-CoA |
Reacción irreversible, sintetiza NADH y moléculas de 4 carbonos |
| VI. Succinil-CoA | GDP + Pi | 6. Succinil CoA sintetasa | Hidrólisis | GTP + CoA-SH + Succinato |
La reacción de condensación del GDP + Pi y la hidrólisis de Succinyl-CoA implican el H2O necesario para equilibrar la ecuación. |
| VII. Succinato | FAD | 7. Succinato deshidrogenasa | Oxidación
(por transferencia de protones) |
FADH2 + Fumarato | Utiliza FAD como un grupo prostético en la enzima y sintetiza ATP. |
| VIII. Fumarato | H2O | 8. Fumarato Hidratasa | Hidratación | L-Malato | |
| IX. L-Malato | NAD | 9. Malato deshidrogenasa | Oxidación
(por transferencia de protones) |
NADH + H+ + Oxalacetato | Reacción reversible |
| X. Oxalacetato | Acetil-CoA | 10. Citrato sintasa | Condensación | Citrato + Co-A | Reacción irreversible |
Visión simplificada y rendimiento del proceso[editar]
- El paso final es la oxidación del ciclo de Krebs, produciendo un oxaloacetato y dos CO2.
- El acetil-CoA (2 carbonos) reacciona con una molécula de oxaloacetato (4 carbonos) para formar citrato (6 carbonos), mediante una reacción de condensación.
- A través de una serie de reacciones, el citrato se convierte de nuevo en oxaloacetato.
- Durante estas reacciones, se substraen 2 átomos de carbono del citrato (6C) para dar oxalacetato (4C); dichos átomos de carbono se liberan en forma de CO2
- El ciclo consume netamente 1 acetil-coA y produce 2 CO2. También consume 3 NAD+ y 1 FAD, produciendo 3 NADH + 3 H+ y 1 FADH2.
- El rendimiento de un ciclo es (por cada molécula de piruvato): 1 GTP, 3 NADH +3H+, 1 FADH2, 2CO2.
- Cada NADH, cuando se oxide en la cadena respiratoria, originará 3 moléculas de ATP (3 x 3 = 9), mientras que el FADH2 dará lugar a 2 ATP. Por tanto, 11 ATP + 1 GTP = 12 Nucleótidos energéticos por cada acetil-CoA que ingresa en el ciclo de Krebs.
- Cada molécula de glucosa produce (vía glucólisis) dos moléculas de piruvato, que a su vez producen dos acetil-COA, por lo que por cada molécula de glucosa en el ciclo de Krebs se produce: 4CO2, 2 GTP, 22 ATP (por los 6 NADH + 6H +, 2 FADH2); total 24 Nucleótidos energéticos.
Regulación[editar]
Muchas de las enzimas del ciclo de Krebs son reguladas por retroalimentación negativa (feedback), por unión alostérica del ATP, que es un producto de la vía y un indicador del nivel energético de la célula. Entre estas enzimas, se incluye el complejo de la piruvato deshidrogenasa que sintetiza el acetil-CoA necesario para la primera reacción del ciclo a partir de piruvato (mediante una reacción irreversible), procedente de la glucólisis o del catabolismo de aminoácidos gluncogénicos (es decir, los 20 aminoácidos estándar exceptuando lisina y leucina). Esta enzima es regulada por inhibición, producto del NADH y acetil-CoA, y modificación covalente de la enzima por fosforilación.[11] También las enzimas citrato sintasa, isocitrato deshidrogenasa y α-cetoglutarato deshidrogenasa, que catalizan las tres primeras reacciones del ciclo de Krebs, son inhibidas por altas concentraciones de ATP. Esta regulación frena este ciclo degradativo cuando el nivel energético de la célula es bueno.
Algunas enzimas son también reguladas negativamente cuando el nivel de poder reductor de la célula es elevado. El mecanismo que se realiza es una inhibición competitiva por producto (por NADH) de las enzimas que emplean NAD+ como sustrato. Así se regulan, entre otros, los complejos piruvato deshidrogenasa y citrato sintasa.
Eficiencia[editar]
El rendimiento teórico máximo de ATP a través la oxidación de una molécula de glucosa en la glucólisis, ciclo del ácido cítrico, y la fosforilación oxidativa es treinta y ocho (suponiendo tres equivalentes molares de ATP por NADH equivalente y dos ATP por FADH2). En eucariotas, se generan dos equivalentes de NADH en la glucólisis, que se produce en el citoplasma. El transporte de estos dos equivalentes en la mitocondria consume dos equivalentes de ATP, reduciendo de este modo la producción neta de ATP a treinta y seis. Además, las ineficiencias en la fosforilación oxidativa debido a la fuga de protones a través de la membrana mitocondrial y el deslizamiento de la ATP sintasa/bomba de protones normalmente reduce la producción de ATP a partir de NADH y FADH2 por debajo del rendimiento máximo teórico.[12] Los rendimientos observados son, por lo tanto, más cercanos a ~ 2,5 ATP por NADH y ~ 1,5 ATP por FADH2, reduciendo aún más la producción total neta de ATP a aproximadamente treinta.[13] La evaluación del rendimiento total de ATP con recientemente revisado relaciones de protones a ATP proporciona una estimación de 29,85 ATP por molécula de glucosa.[14]
Principales vías que convergen en el ciclo de Krebs[editar]
El ciclo de Krebs es una vía metabólica central en la que convergen otras, tanto anabólicas como catabólicas. Ingresan al ciclo por diferentes metabolitos:
- Acetil-CoA:
- Malato:
- Gluconeogénesis (por acción de la enzima málica o malato deshidrogenasa dependiente de NADP+; esta enzima convierte el piruvato en malato empleando NADPH, CO2 y H2O).
- Oxalacetato:
- Oxidación y biosíntesis de aminoácidos
- Fumarato:
- Degradación de aspartato, fenilalanina y tirosina
- Succinil-CoA
- Biosíntesis de porfirina
- Degradación de valina isoleucina y metionina
- Oxidación de ácidos grasos
- Alfa-cetoglutarato
- Oxidación y biosíntesis de aminoácidos
- Citrato
- Biosíntesis de ácidos grasos y colesterol
- NADH y FADH
- Fosforilación oxidativa y cadena de transporte electrónico
Véase también[editar]
- Descarboxilación oxidativa
- Ácido cítrico
- Glucólisis
- Fosforilación oxidativa
- Ciclo de Krebs inverso (reductor)
Notas[editar]
- ↑ El cis-aconitato es un intermedio de reacción muy inestable que rápidamente se transforma en citrato, antes de comenzar la tercera reacción.
Referencias[editar]
- ↑ Lowenstein JM (1969). Methods in Enzymology, Volume 13: Citric Acid Cycle. Boston: Academic Press. ISBN 0-12-181870-5.
- ↑ Krebs HA, Weitzman PDJ (1987). Krebs' citric acid cycle: half a century and still turning. Londres: Biochemical Society. ISBN 0-904498-22-0.
- ↑ Wagner, Andreas (2014). Arrival of the fittest (first ed.). New York: Penguin group. p 100. ISBN 9781591846468
- ↑ Lane, Nick (2009). Life Ascending: The Ten Great Inventions of Evolution. New York: W.W. Norton & Co. ISBN 0-393-06596-0.
- ↑ "The Nobel Prize in Physiology or Medicine 1937". The Nobel Foundation. Retrieved 2011-10-26.
- ↑ "The Nobel Prize in Physiology or Medicine 1953". The Nobel Foundation. Retrieved 2011-10-26
- ↑ Gest H (1987). "Evolutionary roots of the citric acid cycle in prokaryotes". Biochem. Soc. Symp. 54: 3–16. PMID 3332996
- ↑ Meléndez-Hevia E, Waddell TG, Cascante M (September 1996). "The puzzle of the Krebs citric acid cycle: assembling the pieces of chemically feasible reactions, and opportunism in the design of metabolic pathways during evolution". J. Mol. Evol. 43 (3): 293–303. doi:10.1007/BF02338838. PMID 8703096
- ↑ Ebenhöh O, Heinrich R (January 2001). "Evolutionary optimization of metabolic pathways. Theoretical reconstruction of the stoichiometry of ATP and NADH producing systems". Bull. Math. Biol. 63 (1): 21–55. doi:10.1006/bulm.2000.0197. PMID 11146883
- ↑ Wolfe RR, Jahoor F (February 1990). "Recovery of labeled CO2 during the infusion of C-1- vs C-2-labeled acetate: implications for tracer studies of substrate oxidation". Am. J. Clin. Nutr. 51 (2): 248–52. PMID 2106256
- ↑ «ENZIMAS». La vida con ciencia. Consultado el 6 de febrero de 2021.
- ↑ Porter RK, Brand MD (septiembre de 1995). «Mitochondrial proton conductance and H+/O ratio are independent of electron transport rate in isolated hepatocytes». Biochem. J. (en inglés). 310 (Pt 2): 379-82. PMC 1135905. PMID 7654171.
- ↑ Stryer L, Berg JM, Tymoczko JL (2002). «Section 18.6: The Regulation of Cellular Respiration Is Governed Primarily by the Need for ATP». Biochemistry (en inglés). San Francisco: W.H. Freeman. ISBN 0-7167-4684-0.
- ↑ Rich PR (diciembre de 2003). «The molecular machinery of Keilin's respiratory chain». Biochem. Soc. Trans. (en inglés) 31 (Pt 6): 1095-105. PMID 14641005. doi:10.1042/BST0311095.
Enlaces externos[editar]
- Rap del ciclo de krebs (en español)
- Ciclo de Krebs explicacion paso a paso (Articulo para estudiantes)
- Animación sobre el ciclo de Krebs (castellano)
- CiclodeKrebs.com Información sobre el ciclo de Krebs
- «Ciclo de krebs en el deporte».
- An animation of the citric acid cycle (inglés)
- A more detailed tutorial animation Archivado el 25 de junio de 2005 en Wayback Machine. (inglés)
- A citric-acid cycle self quiz flash applet Archivado el 6 de julio de 2008 en Wayback Machine. (inglés)
- The chemical logic behind the citric acid cycle (inglés)
