Diferencia entre revisiones de «Progesterona»
| Línea 187: | Línea 187: | ||
La tendencia de la progesterona a tener un efecto regulador, la presencia de [[receptor de progesterona|receptores de progesterona]] en muchos tipos de tejidos del cuerpo, y el patrón de deterioro (o formación de [[tumor]]es) de muchos de estos con el pasar de los años cuando los niveles de progesterona han caído, está impulsando una amplia investigación en el valor potencial del mantenimiento de los niveles de progesterona, tanto en hombres como en mujeres. |
La tendencia de la progesterona a tener un efecto regulador, la presencia de [[receptor de progesterona|receptores de progesterona]] en muchos tipos de tejidos del cuerpo, y el patrón de deterioro (o formación de [[tumor]]es) de muchos de estos con el pasar de los años cuando los niveles de progesterona han caído, está impulsando una amplia investigación en el valor potencial del mantenimiento de los niveles de progesterona, tanto en hombres como en mujeres. |
||
=== Daño cerebral === |
|||
Estudios anteriores han demostrado que la progesterona apoya el desarrollo normal de las neuronas en el cerebro, y que la hormona tiene un efecto protector sobre el tejido cerebral dañado. Se ha observado en modelos de animales que las mujeres tienen una menor susceptibilidad a lesiones cerebrales traumáticas y este efecto protector ha planteado la hipótesis de que es causada por el aumento de los niveles circulantes de estrógeno y progesterona en las mujeres.<ref name="pmid10833057">{{cite journal | author = Roof RL, Hall ED | title = Gender differences in acute CNS trauma and stroke: neuroprotective effects of estrogen and progesterone | journal = J. Neurotrauma | volume = 17 | issue = 5 | pages = 367–88 | year = 2000 | month = May | pmid = 10833057 | doi = 10.1089/neu.2000.17.367| url = }}</ref> Una serie de estudios adicionales en animales han confirmado que la progesterona tiene un efecto neuroprotector cuando se administra poco después de una lesión cerebral traumática.<ref name="pmid17715141">{{cite journal | author = Gibson CL, Gray LJ, Bath PM, Murphy SP | title = Progesterone for the treatment of experimental brain injury; a systematic review | journal = Brain | volume = 131 | issue = Pt 2 | pages = 318–28 | year = 2008 | month = February | pmid = 17715141 | doi = 10.1093/brain/awm183 | url = }}</ref> Se han reportado resultados alentadores en ensayos clínicos con humanos.<ref name="pmid17011666">{{cite journal | author = Wright DW, Kellermann AL, Hertzberg VS, Clark PL, Frankel M, Goldstein FC, Salomone JP, Dent LL, Harris OA, Ander DS, Lowery DW, Patel MM, Denson DD, Gordon AB, Wald MM, Gupta S, Hoffman SW, Stein DG | title = ProTECT: a randomized clinical trial of progesterone for acute traumatic brain injury | journal = Ann Emerg Med | volume = 49 | issue = 4 | pages = 391–402, 402.e1–2 | year = 2007 | month = April | pmid = 17011666 | doi = 10.1016/j.annemergmed.2006.07.932 | url = }}</ref><ref name="pmid18447940">{{cite journal | author = Xiao G, Wei J, Yan W, Wang W, Lu Z | title = Improved outcomes from the administration of progesterone for patients with acute severe traumatic brain injury: a randomized controlled trial | journal = Crit Care | volume = 12 | issue = 2 | pages = R61 | year = 2008 | month = April | pmid = 18447940 | doi = 10.1186/cc6887 | url = | pmc = 2447617 }}</ref> |
|||
El mecanismo de los efectos protectores de la progesterona puede ser la reducción de la inflamación que le sigue a un trauma cerebral.<ref name="pmid18188998">{{cite journal | author = Pan DS, Liu WG, Yang XF, Cao F | title = Inhibitory effect of progesterone on inflammatory factors after experimental traumatic brain injury | journal = Biomed. Environ. Sci. | volume = 20 | issue = 5 | pages = 432–8 | year = 2007 | month = October | pmid = 18188998 | doi = | url = | issn = }}</ref> |
|||
== Véase también == |
== Véase también == |
||
Revisión del 22:39 12 sep 2011
| Progesterona | ||
|---|---|---|
 | ||
 | ||
| Nombre (IUPAC) sistemático | ||
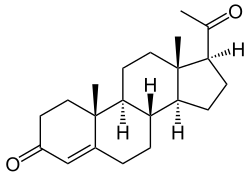
| pregn-4-ene-3,20-dione | ||
| Identificadores | ||
| Número CAS | 57-83-0 | |
| Código ATC | G03DA04 | |
| PubChem | 5994 | |
| DrugBank | DB00396 | |
| ChEBI | 17026 | |
| Datos químicos | ||
| Fórmula | C21H30O2 | |
| Peso mol. | 314.46 | |
| Datos físicos | ||
| P. de fusión | 126 °C (259 °F) | |
| Rot. esp. | [α]D | |
| Farmacocinética | ||
| Biodisponibilidad | absorción prolongada, vida media de aproximadamente 25 a 50 horas | |
| Unión proteica | 96%-99% | |
| Metabolismo | hepático a pregnanedioles y pregnanolonas | |
| Vida media | 34.8-55.13 horas | |
| Excreción | renal | |
| Datos clínicos | ||
| Cat. embarazo | Los estudios en animales no han demostrado efectos adversos sobre el feto, pero no hay estudios clínicos adecuados y bien controlados hechos en embarazadas. Puede emplearse con vigilancia médica. (EUA) | |
| Vías de adm. | oral, implantes | |
La progesterona también conocida como P4 (pregn-4-ene-3,20-dione) es una hormona esteroide C-21 involucrada en el ciclo menstrual femenino, embarazo (promueve la gestación) y embriogénesis de los humanos y otras especies. La progesterona pertenece a una clase de hormonas llamados progestágenos, y es el principal progestágeno humano de origen natural. Su fuente principal es el ovario (cuerpo lúteo) y la placenta, la progesterona también puede sintetizarse en las glándulas adrenales y en el hígado.
La progesterona es una de las hormonas sexuales que se desarrollan en la pubertad y en la adolescencia en el sexo femenino, actúa principalmente durante la segunda parte del ciclo menstrual, parando los cambios endometriales que inducen los estrógenos y estimulando los cambios madurativos, preparando así al endometrio para la implantación del embrión. Estos efectos también ocurren en la mama. La progesterona también se encarga de engrosar y mantener sujeto al endometrio en el útero: al bajar sus niveles, el endometrio se cae, produciendo la menstruación. Es la hormona responsable del desarrollo de caracteres sexuales secundarios en una mujer, y sirve para mantener el embarazo.
Química
La progesterona fue descubierta independientemente por cuatro grupos de investigación.[1][2][3][4]
Willard Myron Allen co-descubrió la progesterona con su profesor de anatomía George Washington Corner en la Escuela de Medicina de la Universidad de Rochester en 1933. Allen determinó primero su punto de fusión, peso molecular, y estructura molecular parcial. Él también le dio el nombre Progesterone derivado de Progestational Steroidal ketone.[5]
Como otros esteroides, la progesterona consiste en cuatro hidrocarburos cíclicos interconectados. La progesterona contiene grupos funcionales de cetona y oxigenados, como también dos ramas de metil. Tal como todas las hormonas esteroides, la progesterona es hidrofóbica.
Síntesis
Biosíntesis

Abajo: La progesterona es importante para la síntesis de aldosterona (mineralocorticoide), como la 17-Hidroxiprogesterona es para el cortisol (glucocorticoide), y la androstenediona para los esteroides sexuales.
En los mamíferos, la progesterona (6), tal como todas las hormonas esteroides, es sintetizada a partir de la pregnenolona (3), que a su vez se deriva del colesterol (1) (véase la parte superior de la figura a la derecha).
El colesterol (1) sufre una oxidación doble para producir 20,22-hidroxicolesterol (2). Este diol vecinal es luego oxidado con la pérdida de la cadena lateral empezando en la posición C-22 para producir la pregnenolona (3). Esta reacción es catalizada por el citocromo P450scc. La conversión de pregnenolona a progesterona tiene lugar en dos pasos. Primero, el grupo 3-hidroxilo es oxidado a un grupo de cetona (4) y segundo, el doble enlace es movido a C-4, desde C-5 a través de una reacción de tautomerización cetona/enol.[6] Esta reacción es catalizada por la 3 beta-hidroxisteroide dehidrogenizado.
La progesterona (véase la mitad inferior de la figura a la derecha) es a su vez el precursor del mineralocorticoide aldosterona, y después de su conversión a 17-hidroxiprogesterona (otro progestágeno natural) del cortisol y la androstenediona. La Androstenediona puede ser convertida en testosterona y estrona.
La pregnenolona y progesterona también pueden ser sintetizadas por la levadura.[7]
Niveles
En las mujeres, los niveles de progesterona son relativamente bajos durante la fase preovulatoria del ciclo menstrual, suben después de la ovulación, y se mantienen elevados durante la fase lútea, como es mostrado en el diagrama. Los niveles de progesterona tienden a ser < 2 ng/ml antes de la ovulación, y > 5 ng/ml después de la ovulación. Si ocurre un embarazo, los niveles de progesterona son inicialmente mantenidos a niveles lúteos. Con el inicio del cambio lúteo-placentario en el apoyo de la progesterona en el embarazo, los niveles empiezan a subir y pueden alcanzar los 100-200 ng/ml al término del embarazo. Se ha argumentado que una disminución en los niveles de progesterona es fundamental para la iniciación del parto y puede que sea específico de la especie. Después del parto y durante la lactancia, los niveles de progesterona son muy bajos.
Los niveles de progesterona son relativamente bajos en niños y mujeres posmenopáusicas.[8] Los varones adultos tienen niveles similares a los de las mujeres durante la fase folicular del ciclo menstrual.

- Los rangos denotados By biological stage (por etapas biológicas) pueden ser ocupados en ciclos menstruales en estrecho seguimiento en lo que respecta a otros indicadores de su progreso biológico, con la escala de tiempo siendo comprimida o estirada a que tan más rápido o lento, respectivamente, es el progreso del ciclo comparado con un ciclo promedio.
- Los rangos denotados Inter-cycle variability (variabilidad inter-ciclo) son más apropiados de usar en ciclos no-monitoreados donde sólo el comienzo del ciclo se conoce, y la mujer sabe la duración promedio de su ciclo y tiempo de ovulación, y que son relativamente regulares, con la escala de tiempo siendo comprimida o estirada a que tan más corto o largo, respectivamente, es el ciclo comparado con el promedio de la población.
- Los rangos denotados Inter-woman variability (variabilidad inter-mujer) son más apropiados de usar cuando la duración y tiempo de ovulación son desconocidos, donde sólo el comienzo del ciclo se conoce.
| Person type | Rangos de referencia para exámenes de sangre | ||
|---|---|---|---|
| Limite inferior | Límite superior | Unidad | |
| Mujer - ciclo menstrual | (véase el diagrama) | ||
| Mujer - posmenopáusica | <0.2[10] | 1[10] | ng/mL |
| <0,6[11] | 3[11] | nmol/L | |
| Mujer con anticonceptivos orales | 0.34[10] | 0.92[10] | ng/mL |
| 1.1[11] | 2.9[11] | nmol/L | |
| Varones ≥16 years | 0.27[10] | 0.9[10] | ng/mL |
| 0.86[11] | 2.9[11] | nmol/L | |
| Mujer o varon 1-9 años | 0.1[10] | 4.1[10] or 4.5[10] | ng/mL |
| 0.3[11] | 13[11] | nmol/L | |
Efectos

La progesterona ejerce su acción principal a través del receptor de progesterona intracelular, aunque se ha postulado sobre un receptor de progesterona unido a la membrana.[12][13] Además, la progesterona es un antagonista muy potente del receptor de mineralcorticoides (el receptor de la aldosterona y otros mineralocorticoides). La progesterona previene la activación de los receptores de mineralcorticoides al unirse a estos receptores con una afinidad que supera incluso los de la aldosterona y otros corticosteroides, como el cortisol y la corticosterona.[14]
La progesterona tiene una serie de efectos fisiológicos que son amplificados en la presencia de estrógenos. Los estrógenos a través de los receptores de estrógenos regulan al alza la expresión génica de los receptores de progesterona.[15] También, niveles elevados de progesterona reducen fuertemente la actividad de la aldosterona de retener sodio, resultando en natriuresis y una reducción en el volumen del líquido extracelular. Por otra parte, la abstinencia de progesterona es asociado con un aumento temporal en la retención de sodio (natriuresis reducido, con un incremento en el volumen del líquido extracelular) debido al incremento compensatorio en la producción de aldosterona, que lucha contra el bloqueo de los receptores de mineralocorticoides por los niveles previamente elevados de progesterona.[16]
Sistema reproductivo
La progesterona tiene efectos claves vía una señalización no genómica en la esperma humana a medida que migran a través del tracto femenino antes de que la fertilización ocurra, aunque los receptores aún no han sido identificados.[17] Caracterización detallada de los acontecimientos que ocurren en el esperma, en respuesta a la progesterona ha elucidado ciertos eventos incluyendo transeúntes de calcio intracelular y cambios mantenidos,[18] oscilaciones lentas de calcio,[19] ahora se piensa que posiblemente regulan la motilidad.[20] Interesantemente la progesterona también ha demostrado demostrar efectos en los espermatozoides del pulpo.[21]
La progesterona modula la actividad de los canales de cationes de los espermatozoides (CatSper) Ca2+. Dado que los óvulos liberan progesterona, el espermatozoide podría usar la progesterona como señal de recalada para nadar hacia el óvulo (quimiotaxis). Por lo tanto, las sustancias que bloquean el sitio de unión de la progesterona en los canales CatSper podrían ser utilizado en la anticoncepción masculina.[22][23]
La progesterona es a veces llamada la "hormona del embarazo",[24] y tiene muchas funciones relacionadas con el desarrollo del feto:
- La progesterona convierte el endometrio a su fase de secreción para preparar el útero para su implantación. Al mismo tiempo la progesterona afecta al epitelio vaginal y el moco cervical, haciendolo espeso e impenetrable para el espermatozoide. Si no ocurre un embarazo, los niveles de progesterona disminuyen, dando lugar, en el humano, a la menstruación. El sangrado menstrual normal es debido a la abstinencia de progesterona. Si no ocurre una ovulación y el cuerpo lúteo no se desarrolla, los niveles de progesterona podrían ser bajos, llevando a una sangrado uterino disfuncional anovulatorio.
- Durante la implantación y gestación, la progesterona parece reducir la respuesta inmune maternal para permitir la aceptación del embarazo.
- La progesterona disminuye la contractilidad del músculo liso uterino.[24]
- La progesterona inhibe la lactancia durante el embarazo. La caída en los niveles de progesterona después del parto es uno de los desencadenantes de la producción de leche.
- Una caída en los niveles de progesterona es, posiblemente, un paso que facilita el inicio del parto.
El feto metaboliza la progesterona placentaria en la producción de esteroides adrenales.
Sistema nervioso
La progesterona, como la pregnenolona y dehidroepiandrosterona, pertenece al grupo de neuroesteroides. Puede ser sintetizado dentro del sistema nervioso central y también sirve como un precursor de otro importante neuroesteroide, la alopregnanolona.
Los neuroesteroides afectan el funcionamiento de las sinapsis, son neuroprotectores, y afectan la mielinización.[25] Son investigados por su potencial de mejorar la memoria y habilidad cognitiva. La progesterona afecta la regulación de los genes apoptóticos.
Sus efectos como neuroesteroide funcionan predominantemente a través de la vía beta GSK-3, como un inhibidor. (Otros inhibidores beta GSK-3 incluyen estabilizadores del ánimo bipolares, litio y ácido valproico.)
Otros síndromes
- Eleva los niveles del factor de crecimiento epidérmico, un factor que a menudo es utilizado para inducir la proliferación, y se utiliza para sostener las culturas de células madre.
- Incrementa la temperatura central (función termogénica) durante la ovulación.[26]
- Reduce espasmos y relaja los músculos lisos. Los bronquios se amplían y la mucosa es regulada. (Los receptores de progesterona están ampliamente presentes en el tejido submucoso.)
- Actúa como agente antiinflamatorio y regula la respuesta inmune.
- Reduce la actividad de la vesícula biliar.[27]
- Puede que afecte la salud de las encías, aumentando el riesgo de gingivitis y caries dentales.
- Parece evitar el cáncer de endometrio al regular los efectos del estrógeno.
Efectos adversos
La progesterona en forma de píldoras (en realidad una versión sintética, como un progestágeno) tomada a 400 mg como es citado por la patente puede causar una mayor retención de líquidos, que puede resultar en epilepsia, migraña, asma, disfunción renal o cardiaca. Puede desarrollarse coágulos sanguíneos que pueden ocasionar accidentes cerebrovasculares y ataques al corazón, lo que puede conducir a la muerte o discapacidad a largo plazo; embolia pulmonar o cáncer de mama también pueden desarrollarse como resultado del tratamiento con progesterona. La progesterona se asocia con un riesgo incrementado de enfermedades trombóticas, tales como tromboflebitis, enfermedades cerebrovasculares, embolia pulmonar y trombosis retinal.[28]
Los efectos adversos comunes incluyen calambres, dolor abdominal, dolor óseo, dolor perineal, dolor de cabeza, artralgia, estreñimiento, dispareunia, nocturia, diarrea, náuseas, vómitos, ampliación de mama, dolor en las articulaciones, flatulencia, sofocos, disminución de la libido, sed, aumento del apetito, nerviosismo, somnolencia, micción excesiva durante la noche. Los efectos psiquiátricos incluyen depresión, cambios de humor, inestabilidad emocional, agresión, llanto anormal, insomnio, falta de memoria, trastornos del sueño.[28]
Los efectos adversos menos frecuentes que pueden presentarse incluyen alergias, anemia, hinchazón, fatiga, temblores, urticaria, dolor, conjuntivitis, mareos, vómitos, mialgias, dolor de espalda, dolor en los senos, prurito genital, infección por hongos genitales, infección del tracto respiratorio superior, cistitis, disuria, astenia, xeroftalmia, síncope, dismenorrea, tensión premenstrual, gastritis, infección del tracto urinario, flujo vaginal, faringitis, sudoración, hiperventilación, sequedad vaginal, disnea, fiebre, edema, síntomas de gripe, sequedad de boca, rinitis, dolor de piernas, decoloración de la piel, trastornos de la piel, seborrea, sinusitis, acné.
Investigaciones actuales sugieren que la progesterona juega un papel importante en la señalización de la liberación de insulina y la función pancreática, y podría afectar la susceptibilidad a la diabetes.[29] Se ha demostrado que las mujeres con altos niveles de progesterona durante el embarazo tienen más probabilidades de desarrollar anormalidades en la glucosa.[30]
Aplicaciones médicas
El uso de la progesterona y sus análogos tienen muchas aplicaciones médicas, tanto para hacer frente a situaciones críticas como para hacer frente a la disminución a largo plazo de los niveles de progesterona natural. Debido a la baja biodisponibilidad de la progesterona por vía oral, muchos progestágenos sintéticos han sido diseñados con una biodisponibilidad oral mejorada.[31] La progesterona fue aprobada por la FDA de los Estados Unidos como un gel vaginal el 31 de julio de 1997, [32] en cápsula oral el 14 de mayo de 1998[33] en inyección el 25 de abril de 2001[34] y como un inserto vaginal el 21 de junio de 2007.[35] En Italia y España, la progesterona se vende bajo la marca Progeffik.
Biodisponibilidad
La vía de administración afecta el efecto de la droga. Por vía oral, la progesterona tiene una amplia gama en la variabilidad en la absorción y biodisponibilidad de persona a persona, mientras que los progestágenos sintéticos se absorben rápidamente, con una vida media más larga que la progesterona y mantienen niveles estables en la sangre.[36]
La progesterona no se disuelve en agua y no se absorbe bien por vía oral a menos que sea micronizada en aceite. Los productos de progesterona a menudo se venden como cápsulas conteniendo progesterona micronizada en aceite. La progesterona también puede ser administrada a través de supositorios o pesarios vaginales o rectales, transdérmicamente a través de geles o cremas,[37] o vía inyección (aunque este último tiene una corta vida media requiriendo una administración diaria).
Los productos de "progesterona natural" derivados del ñame no requieren receta médica, pero no existe evidencia que el cuerpo humano pueda convertir su ingrediente activo (la diosgenina, el esteroide de la planta que es químicamente convertido para producir la progesterona industrialmente[38]) en progesterona.[39][40]
Usos específicos
- La progesterona se utiliza para mantener el embarazo en ciclos de la Tecnología de Reproducción Asistida (TRA) tal como la Fertilización In-vitro (FIV). Mientras que las inyecciones diarias intramusculares de progesterona en aceite (PIO) han sido la ruta de la administración estándar, las inyecciones de PIO no están aprobadas por la FDA para su uso en el embarazo. Un reciente meta-análisis mostró que la vía intravaginal con una dosis y frecuencia de la dosis adecuada es equivalente a inyecciones intramusculares diarias.[41] Además, un estudio reciente de casos de concordancia comparando la progesterona vaginal con inyecciones de PIO mostró que las tasas de nacimientos vivos fueron casi idénticos con ambos métodos.[42]
- La progesterona es usada para controlar el sangrado anovulatorio persistente. También es usada para preparar el revestimiento del útero en terapias de esterilidad y para mantener el embarazo temprano. Las pacientes con pérdida recurrente de embarazo debido a una producción inadecuada de progesterona podrían recibir progesterona.
- La progesterona también se utiliza en mujeres no embarazadas con un retraso en la menstruación de una o más semanas, a fin de que el endometrio engrosado se desprenda. Este proceso se llama una hemorragia por deprivación de progesterona. La progesterona es tomada por vía oral durante un corto período de tiempo (generalmente una semana), después la progesterona se suspende y el sangrado debería ocurrir.
- La progesterona está siendo investigada como potencialmente beneficiosa en el tratamiento de la esclerosis múltiple, puesto que el deterioro característico de la mielina de los nervios se detiene durante el embarazo, cuando los niveles de progesterona se elevan; el deterioro comienza de nuevo cuando los niveles bajan.
- La progesterona por vía vaginal está siendo investigada como potencialmente beneficiosa en la prevención de nacimientos prematuros en mujeres con riesgo de parto prematuro. El estudio inicial realizado por Fonseca sugirió que la progesterona vaginal podría prevenir el parto prematuro en mujeres con antecedentes de parto prematuro.[43] Según un estudio reciente, las mujeres con un cuello uterino corto que recibieron tratamiento hormonal con un gel de progesterona tuvieron una reducción en el riesgo de dar a luz antes de tiempo. El tratamiento hormonal fue administrado por vía vaginal todos los días durante la segunda mitad del embarazo.[44]
Un estudio posterior y más grande mostró que la progesterona vaginal no era mejor que el placebo en la prevención del parto prematuro recurrente en mujeres con antecedentes de un parto prematuro previo,[45] pero un análisis planificado secundario de los datos de este ensayo mostró que las mujeres con un cuello uterino corto al inicio del estudio en el ensayo tenían ventaja de dos maneras: una reducción en los partos de menos de 32 semanas y una reducción en la frecuencia y el tiempo que sus bebés estuvieron en cuidados intensivos.[46] En otro ensayo, la progesterona vaginal demostró ser mejor que el placebo en la prevención del parto prematuro antes de las 34 semanas en mujeres con un cuello extremadamente corto en la línea base.[47] Un editorial de Roberto Romero analiza el papel de la longitud cervical ecográfica en la identificación de los pacientes que podrían beneficiarse del tratamiento con progesterona.[48]
- La progesterona también tiene un papel en la elasticidad de la piel y la resistencia ósea, en la respiración celular, en el tejido nervioso y en la sexualidad femenina, y la presencia de receptores de progesterona en ciertos tejidos musculares y grasos podría dar una pista sobre la función de estos en el dimorfismo sexual.[49]
- Los antagonistas de receptores de progesterona, o moduladores selectivos de los receptores de progesterona (SPRM)s, tal como el RU-486 (Mifepristona), se pueden utilizar para prevenir la concepción o inducir un aborto médico.
Nótese que los métodos de anticoncepción hormonal no contienen progesterona, pero una progestina.
La progesterona podría afectar el comportamiento masculino.[50]
La progesterona está comenzando a ser utilizada en el tratamiento de la enfermedad de la piel hidradenitis supurativa.
Envejecimiento
Como la mayoría de la progesterona en los hombres se crea durante la producción testicular de la testosterona, y en las mujeres por los ovarios, el apagón (ya sea por medios naturales o químicos), o el retiro, de estos provoca inevitablemente una reducción considerable en los niveles de progesterona. Concentración previa en la función de los progestágenos (progesterona y moléculas con efectos similares) en la reproducción femenina, cuando la progesterona se consideraba simplemente una "hormona femenina", oculta la importancia de la progesterona en otras partes de ambos sexos.
La tendencia de la progesterona a tener un efecto regulador, la presencia de receptores de progesterona en muchos tipos de tejidos del cuerpo, y el patrón de deterioro (o formación de tumores) de muchos de estos con el pasar de los años cuando los niveles de progesterona han caído, está impulsando una amplia investigación en el valor potencial del mantenimiento de los niveles de progesterona, tanto en hombres como en mujeres.
Daño cerebral
Estudios anteriores han demostrado que la progesterona apoya el desarrollo normal de las neuronas en el cerebro, y que la hormona tiene un efecto protector sobre el tejido cerebral dañado. Se ha observado en modelos de animales que las mujeres tienen una menor susceptibilidad a lesiones cerebrales traumáticas y este efecto protector ha planteado la hipótesis de que es causada por el aumento de los niveles circulantes de estrógeno y progesterona en las mujeres.[51] Una serie de estudios adicionales en animales han confirmado que la progesterona tiene un efecto neuroprotector cuando se administra poco después de una lesión cerebral traumática.[52] Se han reportado resultados alentadores en ensayos clínicos con humanos.[53][54]
El mecanismo de los efectos protectores de la progesterona puede ser la reducción de la inflamación que le sigue a un trauma cerebral.[55]
Véase también
Referencias
- ↑ Allen WM (1935). «The isolation of crystalline progestin». Science 82 (2118): 89-93. PMID 17747122. doi:10.1126/science.82.2118.89.
- ↑ Butenandt A, Westphal U (1934). «Zur Isolierung und Charakterisierung des Corpusluteum-Hormons». Berichte Deutsche chemische Gesellschaft 67: 1440-1442. doi:10.1002/cber.19340670831.
- ↑ Hartmann M, Wettstein A (1934). «Ein krystallisiertes Hormon aus Corpus luteum». Helvetica Chimica Acta 17: 878-882. doi:10.1002/hlca.193401701111.
- ↑ Slotta KH, Ruschig H, Fels E (1934). «Reindarstellung der Hormone aus dem Corpusluteum». Berichte Deutsche chemische Gesellschaft 67: 1270-1273. doi:10.1002/cber.19340670729.
- ↑ Allen WM (1970). «Progesterone: how did the name originate?». South. Med. J. 63 (10): 1151-5. PMID 4922128.
- ↑ Dewick, Paul M. (2002). Medicinal natural products: a biosynthetic approach. New York: Wiley. p. 244. ISBN 0-471-49641-3.
- ↑ Duport C, Spagnoli R, Degryse E, Pompon D (February de 1998). «Self-sufficient biosynthesis of pregnenolone and progesterone in engineered yeast». Nat. Biotechnol. 16 (2): 186-9. PMID 9487528. doi:10.1038/nbt0298-186.
- ↑ NIH Clinical Center (16 de agosto de 2004). «Progesterone Historical Reference Ranges». United States National Institutes of Health. Consultado el 12-03-2008.
- ↑ References and further description of values are given in image page in Wikimedia Commons at Commons:File:Estradiol during menstrual cycle.png
- ↑ a b c d e f g h i Progesterone Reference Ranges, Performed at the Clinical Center at the National Institutes of Health, Bethesda MD, 03Feb09
- ↑ a b c d e f g h Converted from mass values using molar mass of 314.46 g/mol
- ↑ Luconi M, Bonaccorsi L, Maggi M, Pecchioli P, Krausz C, Forti G, Baldi E (1998). «Identification and characterization of functional nongenomic progesterone receptors on human sperm membrane». J. Clin. Endocrinol. Metab. 83 (3): 877-85. PMID 9506743. doi:10.1210/jc.83.3.877.
- ↑ Jang S, Yi LS (2005). «Identification of a 71 kDa protein as a putative non-genomic membrane progesterone receptor in boar spermatozoa». J. Endocrinol. 184 (2): 417-25. PMID 15684349. doi:10.1677/joe.1.05607.
- ↑ Rupprecht R, Reul JM, van Steensel B, Spengler D, Söder M, Berning B, Holsboer F, Damm K (1993). «Pharmacological and functional characterization of human mineralocorticoid and glucocorticoid receptor ligands». Eur J Pharmacol 247 (2): 145-54. PMID 8282004. doi:10.1016/0922-4106(93)90072-H.
- ↑ Kastner P, Krust A, Turcotte B, Stropp U, Tora L, Gronemeyer H, Chambon P (1990). «Two distinct estrogen-regulated promoters generate transcripts encoding the two functionally different human progesterone receptor forms A and B». EMBO J. 9 (5): 1603-14. PMC 551856. PMID 2328727.
- ↑ Landau RL, Bergenstal DM, Lugibihl K, Kascht ME. (1955). «The metabolic effects of progesterone in man». J Clin Endocrinol Metab 15 (10): 1194-215. PMID 13263410. doi:10.1210/jcem-15-10-1194.
- ↑ Correia JN, Conner SJ, Kirkman-Brown JC (May de 2007). «Non-genomic steroid actions in human spermatozoa. "Persistent tickling from a laden environment"». Semin. Reprod. Med. 25 (3): 208-19. PMID 17447210. doi:10.1055/s-2007-973433.
- ↑ Kirkman-Brown JC, Bray C, Stewart PM, Barratt CL, Publicover SJ (June de 2000). «Biphasic elevation of [Ca(2+)](i) in individual human spermatozoa exposed to progesterone». Developmental Biology 222 (2): 326-35. ISSN 0012-1606. PMID 10837122. doi:10.1006/dbio.2000.9729.
- ↑ Kirkman-Brown JC, Barratt CL, Publicover SJ (March de 2004). «Slow calcium oscillations in human spermatozoa». The Biochemical Journal 378 (Pt 3): 827-32. PMC 1223996. PMID 14606954. doi:10.1042/BJ20031368.
- ↑ Harper CV, Barratt CL, Publicover SJ (October de 2004). «Stimulation of human spermatozoa with progesterone gradients to simulate approach to the oocyte. Induction of [Ca(2+)](i) oscillations and cyclical transitions in flagellar beating». The Journal of Biological Chemistry 279 (44): 46315-25. PMID 15322137. doi:10.1074/jbc.M401194200.
- ↑ Tosti E, Di Cosmo A, Cuomo A, Di Cristo C, Gragnaniello G (May de 2001). «Progesterone induces activation in Octopus vulgaris spermatozoa». Mol. Reprod. Dev. 59 (1): 97-105. PMID 11335951. doi:10.1002/mrd.1011.
- ↑ Strünker T, Goodwin N, Brenker C, Kashikar ND, Weyand I, Seifert R, Kaupp UB (March de 2011). «The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm». Nature 471 (7338): 382-6. PMID 21412338. doi:10.1038/nature09769. Resumen divulgativo – Nature News.
- ↑ Lishko PV, Botchkina IL, Kirichok Y (March de 2011). «Progesterone activates the principal Ca2+ channel of human sperm». Nature 471 (7338): 387-91. PMID 21412339. doi:10.1038/nature09767.
- ↑ a b Bowen R (06-08-2000). «Placental Hormones». Consultado el 12-03-2008.
- ↑ Schumacher M, Guennoun R, Robert F, et al. (2004). «Local synthesis and dual actions of progesterone in the nervous system: neuroprotection and myelination». Growth Horm. IGF Res. 14 Suppl A: S18-33. PMID 15135772. doi:10.1016/j.ghir.2004.03.007.
- ↑ Physiology: 5/5ch9/s5ch9_13 - Essentials of Human Physiology
- ↑ Hould FS, Fried GM, Fazekas AG, Tremblay S, Mersereau WA (1988). «Progesterone receptors regulate gallbladder motility». J. Surg. Res. 45 (6): 505-12. PMID 3184927. doi:10.1016/0022-4804(88)90137-0.
- ↑ a b Columbia Laboratories, Inc. (November de 2004). «Prometrium(progesterone)» (PDF).
- ↑ Picard F, Wanatabe M, Schoonjans K, Lydon J, O'Malley BW, Auwerx J (November de 2002). «Progesterone receptor knockout mice have an improved glucose homeostasis secondary to beta -cell proliferation» (PDF).
- ↑ Brănişteanu DD, Mathieu C (March de 2003). «Progesterone in gestational diabetes mellitus: guilty or not guilty?».
- ↑ Schindler AE, Campagnoli C, Druckmann R, Huber J, Pasqualini JR, Schweppe KW, Thijssen JH (2008). «Classification and pharmacology of progestins». Maturitas 61 (1-2): 171-80. PMID 19434889. doi:10.1016/j.maturitas.2003.09.014.
- ↑ «Orange Book: Approved Drug Products with Therapeutic Equivalence Evaluations: 020701». Food and Drug Administration. 02-07-2010. Consultado el 07-07-2010.
- ↑ «Orange Book: Approved Drug Products with Therapeutic Equivalence Evaluations: 019781». Food and Drug Administration. 02-07-2010. Consultado el 07-07-2010.
- ↑ «Orange Book: Approved Drug Products with Therapeutic Equivalence Evaluations: 075906». Food and Drug Administration. 02-07-2010. Consultado el 07-07-2010.
- ↑ «Orange Book: Approved Drug Products with Therapeutic Equivalence Evaluations: 022057». Food and Drug Administration. 02-07-2010. Consultado el 07-07-2010.
- ↑ Por favor, pon la referencia que aparece aquí.
- ↑ Lark, Susan (1999). Making the Estrogen Decision. McGraw-Hill Professional. p. 22. ISBN 9780879836962.
- ↑ Marker RE, Krueger J (1940). «Sterols. CXII. Sapogenins. XLI. The Preparation of Trillin and its Conversion to Progesterone». J. Am. Chem. Soc. 62 (12): 3349-3350. doi:10.1021/ja01869a023.
- ↑ Zava DT, Dollbaum CM, Blen M (1998). «Estrogen and progestin bioactivity of foods, herbs, and spices». Proc. Soc. Exp. Biol. Med. 217 (3): 369-78. PMID 9492350.
- ↑ Komesaroff PA, Black CV, Cable V, Sudhir K (2001). «Effects of wild yam extract on menopausal symptoms, lipids and sex hormones in healthy menopausal women». Climacteric 4 (2): 144-50. PMID 11428178. doi:10.1080/713605087.
- ↑ Zarutskiea PW, Phillips JA (2007). «Re-analysis of vaginal progesterone as luteal phase support (LPS) in assisted reproduction (ART) cycles». Fertility and Sterility 88 (supplement 1): S113. doi:10.1016/j.fertnstert.2007.07.365.
- ↑ Khan N, Richter KS, Blake EJ, et al. Case-matched comparison of intramuscular versus vaginal progesterone for luteal phase support after in vitro fertilization and embryo transfer. Presented at: 55th Annual Meeting of the Pacific Coast Reproductive Society; April 18–22, 2007; Rancho Mirage, CA.
- ↑ da Fonseca EB, Bittar RE, Carvalho MH, Zugaib M (2003). «Prophylactic administration of progesterone by vaginal suppository to reduce the incidence of spontaneous preterm birth in women at increased risk: a randomized placebo-controlled double-blind study». Am. J. Obstet. Gynecol. 188 (2): 419-24. PMID 12592250. doi:10.1067/mob.2003.41.
- ↑ Harris, Gardiner. «Hormone Is Said to Cut Risk of Premature Birth». New York Times. Consultado el 5 de mayo de 2011.
- ↑ O'Brien JM, Adair CD, Lewis DF, Hall DR, Defranco EA, Fusey S, Soma-Pillay P, Porter K, How H, Schackis R, Eller D, Trivedi Y, Vanburen G, Khandelwal M, Trofatter K, Vidyadhari D, Vijayaraghavan J, Weeks J, Dattel B, Newton E, Chazotte C, Valenzuela G, Calda P, Bsharat M, Creasy GW (2007). «Progesterone vaginal gel for the reduction of recurrent preterm birth: primary results from a randomized, double-blind, placebo-controlled trial». Ultrasound Obstet Gynecol 30 (5): 687-96. PMID 17899572. doi:10.1002/uog.5158.
- ↑ DeFranco EA, O'Brien JM, Adair CD, Lewis DF, Hall DR, Fusey S, Soma-Pillay P, Porter K, How H, Schakis R, Eller D, Trivedi Y, Vanburen G, Khandelwal M, Trofatter K, Vidyadhari D, Vijayaraghavan J, Weeks J, Dattel B, Newton E, Chazotte C, Valenzuela G, Calda P, Bsharat M, Creasy GW (2007). «Vaginal progesterone is associated with a decrease in risk for early preterm birth and improved neonatal outcome in women with a short cervix: a secondary analysis from a randomized, double-blind, placebo-controlled trial». Ultrasound Obstet Gynecol 30 (5): 697-705. PMID 17899571. doi:10.1002/uog.5159.
- ↑ Fonseca EB, Celik E, Parra M, Singh M, Nicolaides KH (2007). «Progesterone and the risk of preterm birth among women with a short cervix». N. Engl. J. Med. 357 (5): 462-9. PMID 17671254. doi:10.1056/NEJMoa067815.
- ↑ Romero R (2007). «Prevention of spontaneous preterm birth: the role of sonographic cervical length in identifying patients who may benefit from progesterone treatment». Ultrasound Obstet Gynecol 30 (5): 675-86. PMID 17899585. doi:10.1002/uog.5174.
- ↑ Sriram, D (2007). Medicinal Chemistry. New Delhi: Dorling Kindersley India Pvt. Ltd. p. 432. ISBN 81-317-0031-3.
- ↑ Schneider JS, Stone MK, Wynne-Edwards KE, Horton TH, Lydon J, O'Malley B, Levine JE (2003). «Progesterone receptors mediate male aggression toward infants». Proc. Natl. Acad. Sci. U.S.A. 100 (5): 2951-6. PMC 151447. PMID 12601162. doi:10.1073/pnas.0130100100.
- ↑ Roof RL, Hall ED (May de 2000). «Gender differences in acute CNS trauma and stroke: neuroprotective effects of estrogen and progesterone». J. Neurotrauma 17 (5): 367-88. PMID 10833057. doi:10.1089/neu.2000.17.367.
- ↑ Gibson CL, Gray LJ, Bath PM, Murphy SP (February de 2008). «Progesterone for the treatment of experimental brain injury; a systematic review». Brain 131 (Pt 2): 318-28. PMID 17715141. doi:10.1093/brain/awm183.
- ↑ Wright DW, Kellermann AL, Hertzberg VS, Clark PL, Frankel M, Goldstein FC, Salomone JP, Dent LL, Harris OA, Ander DS, Lowery DW, Patel MM, Denson DD, Gordon AB, Wald MM, Gupta S, Hoffman SW, Stein DG (April de 2007). «ProTECT: a randomized clinical trial of progesterone for acute traumatic brain injury». Ann Emerg Med 49 (4): 391-402, 402.e1-2. PMID 17011666. doi:10.1016/j.annemergmed.2006.07.932.
- ↑ Xiao G, Wei J, Yan W, Wang W, Lu Z (April de 2008). «Improved outcomes from the administration of progesterone for patients with acute severe traumatic brain injury: a randomized controlled trial». Crit Care 12 (2): R61. PMC 2447617. PMID 18447940. doi:10.1186/cc6887.
- ↑ Pan DS, Liu WG, Yang XF, Cao F (October de 2007). «Inhibitory effect of progesterone on inflammatory factors after experimental traumatic brain injury». Biomed. Environ. Sci. 20 (5): 432-8. PMID 18188998.
