Metilfenidato
| Metilfenidato | ||
|---|---|---|
 | ||
 | ||
| Nombre (IUPAC) sistemático | ||
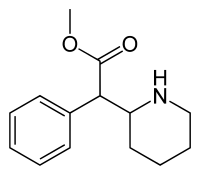
| 2-fenil-2-(piperidin-2-il)etanoato de metilo | ||
| Identificadores | ||
| Número CAS | 113-45-1 | |
| Código ATC | N06BA04 | |
| PubChem | 4158 | |
| DrugBank | DB00422 | |
| ChemSpider | 4015 | |
| UNII | 207ZZ9QZ49 | |
| KEGG | D04999 | |
| ChEBI | 6887 | |
| Datos químicos | ||
| Fórmula | C14H19NO2 | |
| Peso mol. | 233,31 g/mol | |
|
O=C(OC)C(c1ccccc1)C2NCCCC2
| ||
|
InChI=1S/C14H19NO2/c1-17-14(16)13(11-7-3-2-4-8-11)12-9-5-6-10-15-12/h2-4,7-8,12-13,15H,5-6,9-10H2,1H3
Key: DUGOZIWVEXMGBE-UHFFFAOYSA-N | ||
| Datos físicos | ||
| P. de fusión | 214 °C (417 °F) | |
| Farmacocinética | ||
| Biodisponibilidad | 11-52 % | |
| Unión proteica | 30 % | |
| Metabolismo | Hepático (80 %) | |
| Vida media | 2-4 horas | |
| Excreción | Orina | |
| Datos clínicos | ||
| Nombre comercial | Concerta, Aradix, Methylin, Ritalin, Ritalina, Ritrocel, Rubifen, Equasym, Medicebran, Medikinet, Tradea | |
| Inf. de Licencia | FDA:enlace | |
| Cat. embarazo | No hay estudios en humanos. El fármaco solo debe utilizarse cuando los beneficios potenciales justifican los posibles riesgos para el feto. Queda a criterio del médico tratante. (EUA) | |
| Estado legal | S8 (AU) Lista III (CA) Grupo II (MEX) POM (UK) Lista II (EUA) | |
| Vías de adm. | Vía oral y transdérmica | |
El metilfenidato (MFD) es un medicamento estimulante del sistema nervioso central (es decir, un psicoestimulante) aprobado para el tratamiento del trastorno por déficit de atención con hiperactividad (TDAH), la narcolepsia y el síndrome de taquicardia ortostática postural. También puede ser prescrito fuera de etiqueta para casos de síndrome de fatiga crónica y depresión resistentes a otros tratamientos.
El metilfenidato es un derivado de la piperidina,[1][2][3][4] que incrementa los niveles de dopamina y noradrenalina en el cerebro por la inhibición de la recaptación de los respectivos transportadores de monoaminas. No presenta el efecto adicional de activación de dichos receptores y la consecuente segregación de ambas catecolaminas presente en las anfetaminas.
Historia
[editar]El uso de estimulantes para el tratamiento sintomático de la narcolepsia se remonta a los años 1930, cuando comenzaron a indicarse efedrina y anfetamina.[5] En 1937 se llevó a cabo el primer estudio clínico del que se tiene registro que avaló la eficacia de un estimulante para el tratamiento del síndrome hiperactivo. Por entonces, Charles Bradley dirigió en Providence (Rhode Island) un ensayo en que se administró anfetamina (benzedrina) a un grupo de niños hiperactivos.[6] Las conclusiones del estudio revelaron que se habían observado progresos significativos.[7]
En 1944 se sintetizó por primera vez el metilfenidato, ya en los últimos meses de la Segunda Guerra Mundial. Durante la contienda se había experimentado con innumerables variantes químicas de la anfetamina. Se trataba de buscar moléculas con propiedades análogas, pero con efectos adversos menos severos.
En 1954 se patentó el nuevo compuesto.[8] La acción del metilfenidato sobre el organismo humano reveló, respecto a los fármacos de su clase conocidos en el momento, menos efectos colaterales neurovegetativos, sobre todo vasopresores y broncodilatadores. Mostraron reacciones adversas menos frecuentes o mejor toleradas, como la supresión del apetito y el insomnio.
El MFD existe desde la década de 1950. Sin embargo, cobró especial notoriedad a partir de los años 90. Esto se debió a la difusión del diagnóstico de trastorno por déficit de atención con hiperactividad (TDAH[9]) en niños y adultos, fenómeno unido a la prescripción del MFD, fármaco de elección para este tratamiento. En 2013 se consumieron unos 2400 millones de dosis en todo el mundo[10] y la Junta Internacional de Fiscalización de Estupefacientes estima que Estados Unidos es responsable del 80% del consumo global.[10]
Tanto el diagnóstico como el fármaco han sido objetados desde diferentes perspectivas. La amplia documentación sobre sus efectos negativos a nivel físico y psicológico, como el desarrollo de comportamientos obsesivo-compulsivo, depresión y perdida de sociabilidad, han sido estudiados por científicos críticos de la medicalización con estimulantes. [cita requerida]
Sin embargo, quienes aprueban el uso terapéutico del MFD atribuyen tal rechazo a un pánico moral[11] del público no especializado ante el concepto de tratamiento medicamentoso en la infancia, o bien a creencias, muchas veces infundadas, sobre sus consecuencias.[12] La temática ocupó los medios de comunicación de masas, con la intervención de figuras del psicoanálisis y la antipsiquiatría.[13][14]
Las críticas al TDAH y al metilfenidato proceden, a menudo, de un rechazo al concepto general de disfunción neurobiológica y a los supuestos neuroquímicos que subyacen a las prácticas de la psiquiatría contemporánea. En 1998, un panel de expertos designado por los National Institutes of Health (NIH) de los Estados Unidos redactó un consenso para procurar legitimar la entidad clínica de este trastorno y la necesidad de ser tratado.[15] Algunos hallazgos recientes en neurociencia, como los provistos por neuroimágenes, parecen ratificar el arraigo orgánico del síndrome, al ser identificados patrones específicos de expresión fisiológica. Por último, ciertos estudios sobre herencia biológica han revelado una fuerte asociación de este con determinados genes.[16]
Indicaciones originales
[editar]La compañía farmacéutica CIBA (precursora de Novartis) lanzó el producto en 1955 como Ritalin. Desde sus comienzos, fue utilizado para distintas indicaciones. No tardarían en llegar los primeros reportes acerca de su utilidad en el tratamiento de la narcolepsia.[17] El Physician's Desk Reference de 1957 afirmaba, además, que estaba «indicado en fatiga crónica y estados letárgicos y depresivos, incluyendo aquellos asociados con agentes tranquilizantes y otras drogas, conducta senil perturbada, psiconeurosis y psicosis asociadas con depresión».[18]
A comienzos de los años 1960 se popularizó el MFD para tratar el TDAH en la infancia, síndrome conocido en ese momento como «hiperactividad» o «disfunción cerebral mínima» (DCM). Por esos años, la Ritalina también lograba creciente renombre debido a menciones periodísticas sobre su uso corriente entre celebridades de la política[19] y de la ciencia, como el astronauta Buzz Aldrin y el matemático Paul Erdős.[20]
Control internacional
[editar]En 1971, la Convención Internacional de Sustancias Psicotrópicas incluyó al MFD en la Lista II.[21] Los Estados monitorizan la ruta de este medicamento, que se expende con receta oficial. Con posterioridad al Convenio mencionado, hubo casos aislados de países en que se prohibió la circulación de MFD: Belice (1989); Nigeria (1986); Senegal (1980); Tailandia (1991); Togo (1993); Turquía (1981); Yemen (1980). En otros, se lo retiró temporalmente del mercado, como sucedió en Italia, donde se reintrodujo en 2003. Sin embargo, en ningún caso esas regulaciones se ampararon en cuestionamientos sobre la eficacia o la seguridad del fármaco.
Situación actual
[editar]El MFD es la medicación más comúnmente prescrita para tratar el TDAH en todo el mundo. De acuerdo a estimaciones, más del 75 % de las recetas de MFD son extendidas a niños, siendo aquel trastorno unas cuatro veces más frecuente entre los varones que entre las niñas. La producción y prescripción del MFD creció significativamente en los años noventa, especialmente en los Estados Unidos, en la medida en que el diagnóstico de TDAH pasó a ser mejor comprendido y aceptado más generalizadamente dentro de las comunidades médica y de salud mental.
Críticas
[editar]Algunos de los detractores más conocidos son Peter Breggin, Thomas Armstrong, Fred Baughman y el periodista Thom Hartmann, famoso por su controvertida teoría del granjero y el cazador para caracterizar el TDAH. Estos sostienen que las características neurobiológicas observadas no son necesariamente de origen patológico, y manifiestan preocupación por los cambios en el comportamiento, asociados al uso de estimulantes.
En 2005 se había reintroducido el tema en algunos medios de difusión por causa de un estudio en pequeña escala, que sugería una asociación del MFD con alteraciones cromosómicas, las cuales han sido asociadas a efectos genotóxicos.[22] No obstante, se trataba de un estudio preliminar, cuyos resultados se vieron contrariados por evidencia diversa[23] [24] [25] y que, actualmente, se considera refutado.[26] [27]
En 1998 el Instituto Nacional de Salud de Estados Unidos organizó una Conferencia de Consenso sobre el diagnóstico y tratamiento del TDAH y el uso de metilfenidato y otros estimulantes para su tratamiento. La conferencia, en que participaron relevantes especialistas en el tema, se llevó a cabo entre los días 16 y 18 de noviembre en el Natcher Conference Center, en Bethesda, Maryland. La conclusión de la Conferencia fue que no se logró consenso sobre los beneficios terapéuticos del uso de estimulantes para el TDAH, no se logró consenso sobre sus eventuales beneficios sobre la concentración y el rendimiento académico: «Los tratamientos estimulantes no "normalizan" toda la gama de problemas de conducta, y los niños en tratamiento aún manifiestan un mayor nivel de problemas de comportamiento que los niños normales. De particular interés son los hallazgos consistentes que muestran que, a pesar de la mejoría en los síntomas centrales, hay poca mejora en el rendimiento académico o las habilidades sociales». El panorama es aún más desolador en cuanto al estatus de la enfermedad, sobre la cual se concluye que «no hay información que nos permita concluir que el TDAH corresponde a un mal funcionamiento cerebral (...) Finalmente, después de años de experiencia e investigación clínica sobre el TDAH, nuestro conocimiento sobre las causas del TDAH permanecen en la especulación».
Una revisión sistemática Cochrane de 2018 concluye que el metilfenidato puede estar relacionado con un número de efectos adversos graves, y producir una gran cantidad de efectos adversos no graves; sin embargo, la certeza de la evidencia no permite estimar exactamente el nivel de riesgo de estos efectos.[28]
Industria farmacéutica
[editar]Se estima que el valor bruto de la producción anual de MFD en 2005 habría multiplicado al menos por diecisiete el correspondiente a 1990, de acuerdo a las cifras previstas para ese año en curso en EE. UU., pasando en ese periodo de menos de dos toneladas[29] a más de 30.[30] El MFD es en la actualidad el psicotrópico bajo fiscalización internacional con mayor distribución en el circuito legal. Se ha convertido en una de las manufacturas más rentables para el complejo industrial farmacéutico. Los ingresos derivados del mercado de drogas para el TDAH, incluyendo al MFD y sus competidoras, alcanzan solo en EE. UU. valores superiores a los 3100 millones de dólares.[31] Nótese que el producto interior bruto (PIB) anual de unos 50 países estaría por debajo de esas cifras.[32]
Esta tendencia se está expandiendo a muchos otros países, siendo Argentina uno de los casos salientes de América Latina. No obstante, datos estadísticos sugieren que este síndrome se halla subdiagnosticado en todos los países hispanoparlantes.
Propiedades clínicas
[editar]El MFD se administra generalmente por vía oral en forma de comprimidos. Los efectos clínicos de la fórmula de liberación inmediata se manifiestan unos 30 a 45 minutos después de ingeridos, y se extienden por un máximo de 4 horas. Se comercializa bajo las marcas Ritalina, Rubifen, Methylin y Focalin (la última contiene solo d-treo-metilfenidato o dexmetilfenidato, en lugar de la usual mezcla racémica de d,l-treo-metilfenidato de las otras presentaciones).
El MFD se encuentra disponible también en fórmulas de acción extendida (liberación prolongada, LP), que prescinden de la necesidad de repetir las dosis, pudiendo alcanzar una cobertura de ocho horas (Ritalina LA) a doce horas (Concerta). Se trata de la misma droga, pero con un recubrimiento especial que la libera de manera controlada en el sistema, atenuando, además, picos y valles en los niveles plasmáticos de sustancia.
Indicaciones
[editar]El MFD está indicado para el tratamiento en niños, mayores de seis años, y también en adultos de:
Otros usos médicos
[editar]| Síntomas blancos o target | Acción terapéutica | Indicación | Categoría evidencia |
|---|---|---|---|
| Depresión secundaria | Psicoanaléptico | Pacientes enfermos de edad avanzada,[33] incluidos los casos de ACV.[34] | A[35] |
| Sedación y dolor |
Psicoestimulante | En el cáncer, para reducir el sopor inducido por opioides y potenciar la analgesia.[36][37][38] | B |
| Astenia | Antiasténico | Cuando la fatiga se asocia con cáncer,[36] VIH, síndrome de fatiga crónica o fibromialgia.[39] | B |
| Depresión refractaria | Psicoanaléptico | En pacientes que no responden al antidepresivo solo (polifarmacia).[40] | C |
| Depresión atípica | Psicoanaléptico | Cuando hay historial de respuesta a psicoestimulantes. | C |
| Obesidad | Anorexígeno | En pacientes con intolerancia a otras aminas simpaticomiméticas.[41] | C |
| Dislexia | Nootrópico | Niños mayores de 6 años y adultos. | C |
| Traumatismo cerebral | Nootrópico | Alivio de las secuelas neurológicas[42] | C |
| Disfunción sexual | Psicoestimulante | Cuando es causada por el uso de antidepresivos inhibidores de la recaptación de serotonina | C |
| Terror nocturno | Psicoestimulante | Niños mayores de 6 años y adultos[43] | C |
| Síncope vasovagal | Estimulante del SNC; vasoconstrictor periférico |
En pacientes que no responden o presentan intolerancia a los tratamientos de primera línea.[44] | C |
Mecanismo de acción
[editar]
El MFD es un potente inhibidor de la recaptación de dopamina (DA) y noradrenalina (NA). Bloquea la captura de estas catecolaminas por las terminales de las células nerviosas; impide que sean eliminadas del espacio sináptico. De este modo, la DA y la NA extracelulares permanecen activas por más tiempo, aumentando significativamente la densidad de estos neurotransmisores en las sinapsis neuronales.
El MFD posee potentes efectos agonistas sobre receptores alfa y beta adrenérgicos.
- A nivel presináptico produce liberación de NA y DA (agonista indirecto)
- A nivel postsináptico actúa como agonista directo.[45]
El MFD eleva el nivel de alerta (arousal) del sistema nervioso central, lo que es mensurable electrofisiológicamente (ondas de bajo voltaje). Incrementa los mecanismos excitatorios del cerebro, a la vez que aumenta aquellos mecanismos responsables de la inhibición. Esto genera una mejor concentración, coordinación motora y control de los impulsos.
Acción neuromoduladora
[editar]Los efectos del MFD en el TDAH se atribuyen a una mejora en la capacidad inhibitoria de circuitos frontosubcorticales mediados por el neurotransmisor dopamina. En particular, el MFD incrementa la acción reguladora de la corteza frontal y estructuras inferiores a nivel del cerebro anterior basal, como el núcleo estriado. Hacia la porción ventral de este último, localizado en los ganglios basales de las áreas prefrontales del cerebro, se encuentra el núcleo accumbens. La dopamina actúa en el núcleo accumbens limitando la información que debe ser procesada, permitiendo focalizar la atención. En el TDAH, la corteza prefrontal no modularía adecuadamente al locus coeruleus por un déficit de dopamina y noradrenalina. Esta falta de inhibición se manifiesta en un ingreso excesivo de información. Así, surgen dificultades para seleccionar estímulos pertinentes, y aumenta la distracción.[45] La serotonina también podría estar implicada, pues se relaciona con el control de los impulsos.

Este mecanismo pudo verificarse en estudios realizados con PET (tomografía por emisión de positrones). En adultos con TDAH, se encontró una disminución del 8,1 % en el metabolismo cerebral de la glucosa en relación con los controles, sobre todo a nivel de la corteza prefrontal y áreas premotoras.[46] Estudios recientes del flujo cerebral muestran que, durante el tratamiento con MFD, se incrementan tanto la actividad en el estriado como las conexiones entre la región órbito-frontal y límbica.
La tomografía por emisión de positrones demostró un aumento del metabolismo en las áreas órbito-frontales bilaterales y en las sensoriomotoras parietales izquierdas, después de una dosis única de MFD.
Efectos conductuales
[editar]El MFD es la droga más utilizada para tratar el TDAH, y la más estudiada en los últimos cuarenta años. Se ha comprobado que produce un efecto estabilizador en personas con este trastorno. La noradrenalina incidiría sobre los sistemas atencionales posteriores, que permiten cambiar la focalización de un estímulo a otro. La noradrenalina y la dopamina, sobre los sistemas atencionales anteriores, relacionados con funciones ejecutivas, análisis de datos y preparación o planificación de la respuesta.
En los niños con trastornos por déficit de la atención, disminuye las conductas impulsivas y la inquietud motora, y aumenta la actividad cognitiva (atención, memoria), mejorando su capacidad de concentrarse en tareas repetitivas, que demandan esfuerzo mental sostenido y no se asocian a una satisfacción inmediata. En los adultos con TDAH, el MFD favorece las funciones ejecutivas, relacionadas con el control cognitivo.[47] Estas incluyen un conjunto de funciones cerebrales que involucra: autorregulación, secuencia y organización del comportamiento, flexibilidad, inhibición de respuestas y planificación.
En la vida cotidiana de estos adultos, suelen manifestarse avances significativos en la capacidad de focalizarse en el trabajo y administrar el tiempo (organización), disponer de sus recursos con metas a medio y largo plazo (planificación), lograr continuidad en sus proyectos (secuencia), e interaccionar más adaptadamente con el entorno (flexibilidad). Estos cambios en el desempeño, afectan contextos vitales para el sujeto, como son las áreas familiar, académica y laboral.
Perfil farmacológico
[editar]Química
[editar]| Química molecular[48] | |
|---|---|
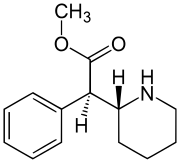 Dexmetilfenidato: enantiómero más activo.
| |
| pKa (grupo amino) | 8,5[49] |
| Número de enlaces rotables | 4 |
| Número de centros quirales | 2 |
| Número de aceptores de enlaces de hidrógeno | 3 |
| Número de dadores de enlaces de hidrógeno | 1 |
| Suma de cargas parciales | 0,00 |
| Suma de cargas formales | 0,00 |
| Densidad molecular | 1,21 |
| Área de superficie | 232,40 |
| Polarizabilidad | 9.221,02 |
| Momento dipolar | 1,43 |
| Dipolo X | -0,69 |
| Dipolo Y | -1,03 |
| Dipolo Z | 0,71 |
| Radio de giro | 3,43 |
El metilfenidato es un polvo cristalino fino, blanco, inodoro preparado por síntesis química. La molécula de metilfenidato posee dos centros de quiralidad; por lo tanto, existe un total de cuatro diastereoisómeros de esta droga. Las primeras formulaciones de MFD que se comercializaron contenían los cuatro enantiómeros. Estudios subsecuentes revelaron, sin embargo, que los isómeros eritro estaban desprovistos de efectos estimulantes significativos sobre el sistema nervioso central.[50] A causa de esto, las formulaciones actualmente disponibles contienen una mezcla racémica de solo d,l-treo-metilfenidato. Como se verá más adelante, la actividad farmacológica se atribuye principalmente al isómero d-treo.[51]
El MFD es una amina simpaticomimética cuya fórmula molecular es C14H19NO2. Pertenece al grupo de las fenetilaminas y, en particular, es un análogo ciclizado de la anfetamina. Estructuralmente, el MFD añade al modelo un anillo piperidínico, que incluye al nitrógeno y al carbono beta.
El clorhidrato de MFD (sal utilizada en la forma farmacéutica) es el clorhidrato de metil-α-fenil-2-piperidinacetato y contiene aproximadamente un 87 % de MFD base. El peso molecular de aquel es 269,77. (Nótese diferencia con dato indicado en tabla: se debe a que allí se refiere el peso molecular del MFD, y aquí el de su sal.)
Las soluciones de clorhidrato de MFD son ácidas al tornasol. Aquel es libremente soluble en agua y en metanol, soluble en alcohol y ligeramente soluble en cloroformo y acetona. Su punto de fusión es de 224-226 grados Celsius. Se trata de un compuesto estable, combustible, y químicamente incompatible con agentes fuertemente oxidantes, álcalis, barbitúricos. [1]
Farmacocinética
[editar]El MFD es una mezcla racémica (50/50) de enantiómeros d-treo y l-treo. El dexmetilfenidato (enantiómero dextrógiro) es el responsable del efecto terapéutico del MFD. La mezcla racémica, después de ser administrada por vía oral, pasa por un proceso de clearance estéreo-selectivo.
El MFD es rápidamente absorbido en el tracto gastrointestinal (Tmáx = 1 a 2 horas), y de forma casi completa. Debido al efecto de primer paso, la biodisponibilidad sistémica es de alrededor de un 30 %. La presencia de alimentos en el estómago acelera la velocidad de absorción, pero no la cantidad total absorbida. La rapidez con que se absorbe la sustancia desempeña un papel importante en la efectividad, lo que haría a la preparación regular la más conveniente.
La unión a las proteínas es baja. Por ser una sustancia alcalina, se une a glucoproteínas alfa y lipoproteínas y poco a la albúmina (15 %). Un 85 % de la concentración de la droga cruza la barrera hematoencefálica.
Las concentraciones plasmáticas máximas son alcanzadas alrededor de dos horas después de la administración oral. El área bajo la curva de concentración en plasma (AUC) y el pico de concentración (Cmáx) son proporcionales a la dosis.
La semivida de la sustancia es de tres horas, y los efectos clínicos se prolongan entre dos y cuatro horas. Esto demanda múltiples dosificaciones a lo largo del día. La razón del metabolismo rápido se debe a la débil ligadura a proteínas sanguíneas del MFD, que impide su distribución en los depósitos de grasa.
Se excreta principalmente como metabolito en la orina, apareciendo pequeñas cantidades en las heces. El mayor metabolito es el ácido ritalínico, el cual es farmacológicamente inactivo. Menos de un 1 % de la droga es eliminada por la orina de forma inalterada.
Farmacoterapia
[editar]| Nivel de evidencia para la eficacia de estimulantes en niños[52][53] | ||||
|---|---|---|---|---|
| Indicación | Eficacia a corto plazo | Eficacia a largo plazo | Seguridad a corto plazo | Seguridad a largo plazo |
| TDAH | A | B | A | A |
El metilfenidato tiene una tasa de respuesta del 80 %, al igual que la dextroanfetamina.[54] La respuesta en los adultos está relacionada con la dosis. La mayoría de los textos recomendaba tradicionalmente una dosis diaria de hasta 60 mg, admitiendo que algunos individuos podían necesitar dosis mayores. Este límite de 60 mg/día parece ser arbitrario y no está basado en ensayos clínicos. Actualmente, estudios en adultos con TDAH sugieren 1 mg/kg/día como dosis usual, con dosis más bajas se produce menor respuesta.
Estudios en niños han determinado que dosis entre 0,3 y 2,0 mg/kg/día mejoran tanto el desempeño académico-cognitivo como el conductual. El rango de dosis terapéutica es muy amplio, considerando que la dosis activa mínima del MFD en un adulto por vía oral es de 0,1 mg/kg en una toma. La proporción que hay entre la dosis activa mínima y la dosis letal media (margen de seguridad) para el MFD es, comparativamente, la mayor entre los psicoestimulantes conocidos, con una dosis letal media (LD50) de 367 mg/kg (vía oral) contra los 55 mg/kg de la anfetamina. Se han registrado experiencias clínicas satisfactorias con dosis de MFD de hasta 240 mg diarios.[55][56]
| Régimen de dosificación para el metilfenidato[57] | |||
|---|---|---|---|
| Grupo etario | Indicación | Dosis inicial típica | Dosis diaria máxima usual |
(≥ 6 años) |
Trastorno por déficit de atención con hiperactividad | Liberación inmediata: 5 mg dos veces al día, durante o después de desayuno y almuerzo | 60 mg |
| Liberación prolongada: 20 mg una vez al día | |||
| Trastorno por déficit de atención con hiperactividad, narcolepsia | Liberación inmediata: 5 a 20 mg dos a tres veces al día, durante o después de las comidas | 90 mg | |
| Liberación prolongada: 20 mg una a tres veces al día, a intervalos de 8 h. | |||
| Depresión secundaria a enfermedad médica | Liberación inmediata: 5 a 10 mg dos a tres veces al día | 30 mg | |
Una estrategia de uso creciente para el tratamiento simultáneo del TDAH y trastornos depresivos comórbidos, consiste en la asociación de MFD con fluoxetina.[45] Este antidepresivo actuaría en sinergismo con el MFD ya que, a diferencia de otros agentes de su familia, no produce deterioro cognitivo. Estudios recientes demuestran que la fluoxetina incrementa los niveles extracelulares de dopamina y noradrenalina en la corteza prefrontal, lo que se asocia normalmente con efectos neurotónicos.[58] Se postula una potenciación mutua de esta acción sobre el sistema nervioso central.
| Farmacología clínica | |
|---|---|
| Efectos secundarios más frecuentes | |
| |
| Otros efectos secundarios habituales | |
| |
| Contraindicaciones | |
| |
| Interacciones medicamentosas | |
| |
| Otras interacciones menos significativas | |
| |
| Precauciones y advertencias | |
| |
| Signos de sobredosis | |
| |
| Epifenómenos sociales | |
| El MFD en los noventa (EUA)[60] | |
| |

De acuerdo con la mayoría de los protocolos clínicos, un comprimido de 10 mg de MFD (monodosis generalmente prescrita al iniciar el tratamiento) produce efectos terapéuticos comparables a 10 mg de anfetamina, 5 mg de dextroanfetamina (Dexedrine, Dextrostat), y 7,5 mg de Adderall (un preparado a base de sales mixtas de anfetamina y dextroanfetamina). El Adderall es en la actualidad, tratamiento de primera línea, junto al MFD, tanto para el TDAH como para la narcolepsia, en niños y adultos. El MFD es más activo sobre las funciones intelectuales que sobre las motoras, mientras que las anfetaminas producen una estimulación más generalizada, lo que se traduce en una mayor intensidad de efectos secundarios como insomnio, supresión del apetito y activación cardiorrespiratoria. Sin embargo, estos efectos distintivos en algunos casos resultan funcionales a la terapéutica. La palabra «anfetamina» se asocia culturalmente con mayor riesgo de abuso, por lo que en muchos países se instituyeron esquemas farmacológicos que la excluyen deliberadamente, sustituyéndola por el MFD.
Efectos secundarios
[editar]El MFD es en general bien tolerado. Los efectos adversos se observan normalmente al inicio del tratamiento, y suelen ser transitorios (ver recuadros). Los más frecuentes pueden controlarse reduciendo la dosis u omitiendo la misma en la tarde o noche de ser necesario (por ejemplo, después de las 18:00). En caso de dolor abdominal, puede aliviarse tomando los comprimidos junto con los alimentos. Si el efecto de la droga desaparece al anochecer, se suele suministrar una dosis nocturna pequeña para resolver síntomas recurrentes tales como conductas alteradas o incapacidad para dormir. Se han encontrado cambios menores en la presión sanguínea y ritmo cardiaco en pacientes bajo tratamiento, aunque raramente tienen relevancia clínica.[63][64] Estudios contra placebo indican que los efectos secundarios son escasos y leves.[65]
Otros efectos menos frecuentes pero más graves son insuficiencia cardíaca, coma hepático, ictus, muerte súbita. En 2018 una revisión de Cochrane concluyó con que la relación entre riesgo y beneficio podría ser demasiado pobre y que se requerían de más estudios. Fue en 2020 que la OMS argumentó con base en esta evaluación que el metilfenidato ya no estaría en su lista de fármacos esenciales.
Tradicionalmente, se ha creído que el MFD puede inducir tics nerviosos; en la actualidad se considera que ese riesgo es mínimo.[66] El MFD puede asociarse con una ligera desaceleración del crecimiento. Sin embargo, la evidencia indica que una altura normal se recupera en la adolescencia. Recientemente se ha desestimado el vínculo de la sustancia con una acción supresora sobre la secreción de hormona de crecimiento y de prolactina, tal como había sido postulado.
Los efectos de la sustancia a largo plazo (24 meses) han sido evaluados en humanos (estudios abiertos con metodología idónea)[67] sin reportes de efectos adversos imprevistos o alteraciones clínicamente significativas en signos vitales y pruebas de laboratorio. Asimismo, se han realizado estudios de seguimiento a largo plazo y se han examinado datos epidemiológicos asociados al uso crónico de MFD desde la niñez hasta la edad adulta.[68]
Cuestiones sociales implicadas
[editar]Desvío del medicamento
[editar]La acción del MFD sobre el sistema nervioso central resulta particularmente eficaz en la terapia del TDAH, en la medida en que hace blanco en déficits neuroquímicos comunes a las personas con este trastorno. Sin embargo, individuos que no tienen TDAH pueden obtener de la droga efectos reforzadores, vinculados con alteraciones del humor, la percepción, el pensamiento y sensaciones de tipo euforizante. En estos casos, en que hay desvío de la droga, el MFD se puede asociar a conductas adictivas.
Ya en los años setenta se había establecido que, con frecuencia, abusadores de droga experimentados no podían distinguir los efectos de la cocaína y del metilfenidato.[69] Recientemente, se realizó un estudio comparando los mecanismos de acción de ambos compuestos. Los dos ejercen sus efectos inhibiendo la recaptación de la dopamina. El incremento en los niveles extracelulares de este neurotransmisor, en el eje mesolímbico-cortical del cerebro, activa una vía neuronal vinculada con la recompensa. A dosis terapéuticas, el MFD bloqueó el 78,5 % de las moléculas transportadoras de dopamina, por encima de la tasa registrada para la cocaína. Se concluyó: "La evidencia claramente muestra que la noción de que la Ritalina es un estimulante poco potente es completamente incorrecta".[70] Sin embargo, ese mismo estudio reveló que el potencial de abuso de la cocaína se explica mejor por el hecho de que esta droga, al ser inhalada, se liga a los receptores con gran rapidez, actuando en apenas segundos, lo que se asocia a una inducción drástica y súbita de los efectos psicotrópicos. El MFD, en cambio, se une a esos mismos receptores con mayor potencia, pero de manera gradual y progresiva, produciendo cambios paulatinos. Por otra parte, la cocaína abandona el sistema unas seis a ocho veces más rápidamente que el MFD, lo que se vincula con síndromes carenciales.
Los efectos reforzadores en los casos de abuso de estimulantes, se asocian con mejoría del ánimo, sensación de aumento de la energía física, de la capacidad mental y del estado de alerta, supresión del apetito, la fatiga y el sueño, aumento de atención/enfoque, locuacidad y euforia. Los adictos pulverizan los comprimidos para poder inhalar el contenido. Algunos los disuelven en agua, inyectándose la mezcla por vía intravenosa, lo que puede ocasionar complicaciones adicionales debido a que algunos excipientes insolubles presentes en los comprimidos podrían obstruir los vasos sanguíneos más estrechos.
La adicción a los estimulantes parece ocurrir cuando se producen aumentos considerables y bruscos de los niveles de dopamina extracelular en el cerebro, y estos se vinculan con las vías de administración intravenosa e intranasal. En estos casos, cuando hay abuso, el MFD sería también más potente que la anfetamina.[71] El efecto terapéutico, por el contrario, se logra con incrementos graduales y progresivos de dopamina, similares a la producción natural del cerebro, como los que produce el MFD si se administra por vía oral. De esta manera, el riesgo de adicción es relativamente bajo.[72]
TDAH y adicciones
[editar]La prevalencia de abuso de sustancias en el TDAH es significativamente más alta que en la población general. Sin embargo, hasta la fecha no se ha comprobado drogodependencia en niños ni adolescentes que recibieron anfetaminas o metilfenidato, como forma de tratamiento.[cita requerida]
Actualmente se ha establecido que el tratamiento del TDAH con estimulantes ejerce un efecto protector contra las adicciones.[73][74] En un estudio donde se comparan los índices de abuso de droga en tres grupos: adolescentes con TDAH no medicados, pacientes con TDAH medicados y un grupo control, puede observarse que los que nunca recibieron medicación tienen un 30 % de incidencia de abuso de sustancias, mientras que la incidencia en los TDAH medicados es prácticamente igual que la del grupo control.[75]
También se evaluó la eficacia del MFD en pacientes adultos con TDAH que ya presentaban dependencia y abuso de drogas. En estos casos, además de una mejora sintomática del TDAH, se reportaron progresos en el tratamiento del trastorno adictivo comórbido.[76][77]
Consideraciones farmacoeconómicas
[editar]Impacto social del TDAH
[editar]Tradicionalmente, la prevalencia del TDAH se estimaba entre un 3 % y un 5 % de la población general, aunque en la actualidad se considera que puede oscilar entre un 7 % y un 9 %. Se trata de una patología, reconocida por la Organización Mundial de la Salud[78] como un: 1) trastorno funcional (neuroconductual); 2) que requiere tratamiento prolongado en el tiempo (crónico); y 3) que presenta una alta tasa de frecuencia en la población general (prevalente). Por lo general, las patologías con tales características suelen ser objeto de políticas públicas activas: los Estados facilitan los medios para que el tratamiento farmacológico pueda cumplirse, reduciendo a largo plazo los gastos de los sistemas de salud. Agrupaciones civiles en varios países afirman que lo mismo debería ocurrir respecto al metilfenidato en los casos de TDAH, cuando la farmacoterapia está indicada.
Acceso al tratamiento farmacológico
[editar]El tratamiento del TDAH no es exclusivamente farmacológico, y alcanza sus mejores resultados cuando se implementan esquemas multidisciplinarios con participación de psicólogos, pedagogos, docentes, etc. Sin embargo, se ha establecido que la medicación cumple un rol esencial en la mayoría de los casos. De acuerdo con la evidencia disponible, el éxito terapéutico en el TDAH tiene relación directa con la farmacoterapia.
El tratamiento farmacológico trae consecuencias palpables, no solo a corto plazo para la calidad de vida de los afectados, sino además a largo plazo, porque se estima que un acceso generalizado al mismo, por parte del conjunto de la población con este diagnóstico, se vincularía con un ahorro significativo en las erogaciones del sistema de salud pública. [4] Archivado el 28 de abril de 2006 en Wayback Machine. Los costos que sobre este imputa con los años un paciente con TDAH, sin acceso a su medicación, se deben a: 1) la alta tasa de comorbilidad de este trastorno, que deriva en otras psicopatologías inhabilitantes (depresión mayor, trastornos de ansiedad); 2) tendencia a comportamientos antisociales y conducta criminal:[79][80] la mitad de los varones tienen problemas con la ley y muchos terminan presos cuando alcanzan la adolescencia tardía; 3) mayor probabilidad de accidentes automovilísticos: en estudios de seguimiento, los sujetos con TDAH no tratados tuvieron el triple de multas por exceso de velocidad y el doble de accidentes de tráfico;[81] 4) alto riesgo de conductas adictivas y, en particular, abuso de sustancias: tasa cinco veces mayor que la población general.
Varios especialistas en la materia (Timothy Willens, Jefferson Prince, Joseph Biederman, Thomas E. Brown, Rusell A. Barkley: ver bibliografía y enlaces externos) destacan, basándose en estos datos, la importancia farmacoeconómica de que los Estados faciliten el acceso a la medicación, y promuevan así la continuidad en los tratamientos, en particular en las familias de menos recursos. Sin embargo, no hay pleno consenso al respecto en la arena política, y tales iniciativas aún son objeto de controversia.
Evidencia de eficacia y seguridad
[editar]El mercado para el metilfenidato ha crecido vertiginosamente, sobre todo a partir de la década de los noventa. Este hecho, sumado a la cobertura sensacionalista de medios de comunicación masivos, ha asociado al MFD una cantidad de mitos. Uno de ellos consiste en la idea de que el TDAH es un desorden sobrediagnosticado. Los datos revelan que, mientras la prevalencia del TDAH en la población general se estima en un cinco por ciento, el número de niños en EE. UU. tomando Ritalina oscila entre un uno y un dos por ciento.
La proliferación del MFD puede relacionarse con un mayor conocimiento del TDAH, que ha permitido a muchas personas con este trastorno ser correctamente diagnosticadas y tratadas. Para estos individuos, el abordaje farmacológico suele traer cambios apreciables. Sin embargo, este fenómeno puso en evidencia una vulnerabilidad en el sistema de farmacovigilancia: el desvío del medicamento no pudo ser contenido. Socialmente se percibieron conductas de abuso y adicción por parte de personas que llegaron al MFD con motivaciones diferentes a las terapéuticas. Por fuera de esa problemática, la evidencia disponible avala la eficacia y seguridad del uso terapéutico del MFD.
Nuevas formulaciones
[editar]Mientras tanto, como resultado de proyectos de investigación (básica y aplicada) se desarrollaron nuevas formulaciones. En noviembre del 2001, Novartis anunció la aprobación, por parte de la Food and Drug Administration (FDA), de una forma farmacéutica a base de uno de los enantiómeros de MFD. Se trata del dexmetilfenidato, isómero óptico dextrógiro (farmacológicamente el más activo) del treo-metilfenidato. Aquel es aislado mediante técnicas de difracción de rayos X aplicadas a estereoisomería óptica. El dexmetilfenidato es dos veces más potente que la Ritalina en términos de dosis terapéuticamente activas; se le dio el nombre de Focalin. Otras características del Focalin son una semivida algo más larga, y una incidencia de efectos secundarios igual o levemente menor que el MFD racémico. Más recientemente, en junio de 2005, se aprobó la primera fórmula de dexmetilfenidato de liberación prolongada (Focalin XR) para el tratamiento del TDAH en niños, adolescentes y adultos.[82]
Por otra parte, concluyó la fase III de ensayos clínicos para el primer parche transdérmico de MFD. En abril de 2006, la FDA anunció la aprobación Daytrana (marca comercial del dispositivo) para el tratamiento del TDAH. Este sistema libera la droga directamente al torrente sanguíneo, y apunta a conseguir una mayor biodisponibilidad con concentraciones plasmáticas más estables. Se administra una sola vez al día, y se presenta en dosis de 10, 15, 20 o 30 mg.[83]
En la cultura popular
[editar]Cine y televisión
[editar]- En South Park (temporada 4, episodio 3) (2000) y en Lie to Me (temporada 1, episodio 3) (2009) tratan este tema.
- Otro episodio de South Park lo aborda como tema principal (temporada 8, episodio 11) (2004).
- Bart Simpson consume esta sustancia (con el nombre de Focusine) en el episodio 2 de la temporada 11 (1999) de la serie Los Simpson.
- En la serie Weeds, Andy la utiliza para crear un nuevo fármaco en forma de bebida (temporada 6, episodio 10) (2010).
- En el episodio 9 de la temporada 4 deThe Big Bang Theory, uno de los protagonistas, Sheldon Cooper, se compara con un «flamenco en ritalin» cuando le tiemblan los brazos, uno de los posibles efectos secundarios de este medicamento.
- En el episodio de la serie británica Doc Martin emitido el 21 de enero de 2012 en TF1, el MPH está en el centro de la trama.
- En la serie Dr. House (temporada 2, episodio 11), el paciente que protagoniza la trama lo consume.
- En la serie Desperate Housewives, Lynette lo consume durante varios episodios y desarrolla una adicción. Poco después de estos episodios, la actriz Eva Longoria, quien interpreta a Gabrielle en la serie, admitió en una entrevista que toma este medicamento diariamente para su hiperactividad (TDAH)[84]
- En la serie Urgencias (temporada 5, episodio 21), Lucy Knight (Kellie Martin) reconoce haberla consumido desde quinto grado, haber dejado de hacerlo en la preparatoria y haberla retomado.
- En la serie Silicon Valley, un joven apodado «el descuartizador» la consume.
- En la película alemana Who Am I, de 2014, dirigida por Baran bo Odar, el joven Benjamin la consume como sustancia adictiva común entre los hackers.
- En la serie Big Mouth, Jay es diagnosticado con TDAH y comienza a vender sus pastillas a otros estudiantes de su escuela.
- En El exorcista, película de 1973 dirigida por William Friedkin, el ritalin es el medicamento principal del tratamiento inicial de Regan (Linda Blair).
Véase también
[editar]Referencias
[editar]- ↑ «“Ritalin (metilfenidato) es una anfetamina. Es muy buen medicamento cuando se maneja bien” | Actualidad 1040AM». actualidadradio.com. Consultado el 10 de agosto de 2018.
- ↑ Murcia, Consejería de Salud de la Región de. «http://www.murciasalud.es/preevid.php?op=mostrar_pregunta&id=10716&idsec=453». Consultado el 10 de agosto de 2018.
- ↑ Abuse, National Institute on Drug. «Estimulantes de prescripción médica» (en inglés estadounidense). Consultado el 10 de agosto de 2018.
- ↑ «6ºAnfetaminas, metanfetaminas, metilfenidato y A. Clínicas - E-portafolio VELA FLORES». sites.google.com. Consultado el 10 de agosto de 2018.
- ↑ Doyle, J. B., Daniels, L. E. «Symptomatic treatment for narcolepsy.» JAMA. 1931;96:1370-72.
- ↑ Véase «Charles Bradley, M.D., 1902–1979.» Am J Psychiatry 155:968, julio de 1998.
- ↑ Bradley, C,: «Behavior of children receiving Benzedrine.» Am J Psychiatry. Nov 1937;94:577-85. Resumen (en inglés)
- ↑ Morton, W. A., Stockton, G.: «Methylphenidate abuse and psychiatric side effects.» Prim Care Companion J Clin Psychiatry. Oct 2000;2(5):159-64. PMID 15014637 | Texto completo (PDF).
- ↑ En este artículo se adopta la sigla en español, TDAH, aunque es común su equivalente en inglés, "ADHD" (Attention-Deficit Hyperactivity Disorder), habitual en varios países de habla hispana.
- ↑ a b «Narcotics monitoring board reports 66% increase in global consumption of methylphenidate». Pharmaceutical Journal. 6 de marzo de 2015. Archivado desde el original el 3 de julio de 2020. Consultado el 8 de mayo de 2015.
- ↑ Miller, T., Leger, M. C. «A very childish moral panic: Ritalin.» Journal of Medical Humanities. 2003 jun;24(1-2):9-33 Texto completo (PDF).
- ↑ Imhof V: Disponible en línea. Consultado en agosto de 2007. | Navas, L.: «Reviven cruzada contra ritalina.» El Nuevo Diario, 22 de septiembre de 2003. Disponible en línea. Consultado en agosto de 2007.
- ↑ Tauber, W.: «Ritalin: ¿una droga de control social?». Ekintza Zuzena (26), 2000.
- ↑ Breggin, P.: «Vital information about Ritalin, attention deficit-hyperactivity disorder and the politics behind the ADHD/Ritalin movement». The Antipsychiatry Coalition, 1998. Consultado en agosto de 2007.
- ↑ "Diagnosis and treatment of attention deficit hyperactivity disorder". NIH Consens Statement. 16-18 nov 1998;16(2):1-37. PMID 10868163 | Texto completo (PDF).
- ↑ McKusick. V. A., et al.: «Attention deficit-hyperactivity disorder; ADHD.» OMIM - Online Mendelian Inheritance in Man, 26 de septiembre de 2006. Véase: OMIM 143465.
- ↑ Daly, D. D., Yoss, R. E.: «The treatment of narcolepsy with methylphenylpiperidylacetate: a preliminary report.» Mayo Clinic Proc. 1956;31:620-26.
- ↑ «Ritalin (methylphenidate).» Physician´s Desk Reference, 11.a ed., Oradell, NJ; Medical Economics; 1956: 441-42.
- ↑ Véanse, en este sentido, las alusiones de la prensa a John F. Kennedy.
- ↑ Hoffman, Paul. El hombre que solo amaba los números. México: Granica, 2000. 296 páginas. ISBN 84-7577-831-3. Reseña (en inglés).
- ↑ Green List: Annex to the annual statistical report on psychotropic substances (form P). 23.a edición, agosto de 2003. International Narcotics Board, Vienna International Centre. Texto completo (PDF)
- ↑ El-Zein, RA; Abdel-Rahman, SZ; Hay, MJ; Lopez, MS; Bondy, ML; Morris, DL; Legator, MS (18 de diciembre de 2005). «Cytogenetic effects in children treated with methylphenidate.». Cancer letters 230 (2): 284-91. PMID 16297714.
- ↑ Teo, S. K., et al.: «D-Methylphenidate is non-genotoxic in in vitro and in vivo assays.» Mutat Res. 9 may 2003;537(1):67-79. PMID 12742508
- ↑ Price, P. J., et al.: «Ritalin, Benzedrine and Dexedrine do not transform F 1706 rat cells.» Cancer Lett. Dic 1978;5(6):345-9. PMID 728890
- ↑ Dunnick, J. K., Hailey, J. R.: «Experimental studies on the long-term effects of methylphenidate hydrochloride.» Toxicology. 30 nov 1995;103(2):77-84. PMID 8545847
- ↑ Suter, W., et al.: «Methylphenidate is not clastogenic in cultured human lymphocytes and in the mouse bone-marrow micronucleus test.» Mutat Res. 5 sep 2006;607(2):153-9. PMID 16829163
- ↑ Walitza, S., et al.: «Does methylphenidate cause a cytogenetic effect in children with attention deficit hyperactivity disorder?» Environ Health Perspect. Jun 2007;115(6):936-40. PMID 17589603 | Texto completo (PDF).
- ↑ Storebø OJ, Pedersen N, Ramstad E, Kielsholm ML, Nielsen SS, Krogh HB, Moreira-Maia CR, Magnusson FL, Holmskov M, Gerner T, Skoog M, Rosendal S, Groth C, Gillies D, Buch Rasmussen K, Gauci D, Zwi M, Kirubakaran R, Håkonsen SJ, Aagaard L, Simonsen E, Gluud C (9 de mayo de 2018). «Methylphenidate for attention deficit hyperactivity disorder (ADHD) in children and adolescents - assessment of adverse events in non-randomised studies». Cochrane Database Syst Rev (Revisión Sistemática). PMID 29744873. doi:10.1002/14651858.CD012069.pub2.
- ↑ a b «Medicating kids: statistics on stimulant use» PBS Frontline, 2001. Disponible en línea. Consultado en agosto de 2007.
- ↑ «Aggregate production quota history». Office of Diversion Control, Drug Enforcement Administration, 12 dic 2005. Disponible en línea. Consultado en agosto de 2007.
- ↑ Trenton, N. J.: «Adult use of ADHD drugs up. Study: rate of use doubles among group of adults.» HealthWatch, CBS News, 15 sept 2005. Disponible en línea. Consultado en agosto de 2007.
- ↑ PBI nominal, Banco Mundial y OCDE, 2002.
- ↑ Wallace, A. E., et al.: «Double-blind, placebo-controlled trial of methylphenidate in older, depressed, medically ill patients.» Am J Psychiatry. Jun 1995;152(6):929-31. PMID 7755127
- ↑ Grade, C., et al.: «Methylphenidate in early poststroke recovery: a double-blind, placebo-controlled study.» Arch Phys Med Rehabil. 1998 sep;79(9):1047-50. PMID 9749682
- ↑ Al menos un ensayo controlado aleatorio. Véase: Grado de recomendación
- ↑ a b Department of Medicine, Mayo Clinic: Sood, A., et al.: «Use of methylphenidate in patients with cancer.» Am J Hosp Palliat Care. En-feb 2006;23(1):35-40. PMID 16450661
- ↑ Dalal, S., Melzack, R.: «Psychostimulant drugs potentiate morphine analgesia in the formalin test.» J Pain Symptom Manage. Oct 1998;16(4):230-9. PMID 9803050
- ↑ Yee, J. D., Berde, C. B.: «Dextroamphetamine or methylphenidate as adjuvants to opioid analgesia for adolescents with cancer.» J Pain Symptom Manage. 1994;9:122-25.
- ↑ Hanna, A., et al.: «A phase II study of methylphenidate for the treatment of fatigue.» Support Care Cancer. Mar 2006;14(3):210-5. PMID 16096772
- ↑ Stoll, A. L., et al.: «Methylphenidate augmentation of serotonin selective reuptake inhibitors: a case series.» J Clin Psychiatry. Feb 1996;57(2):72-6. PMID 8591972
- ↑ Leddy, J. J., et al.: «Influence of methylphenidate on eating in obese men.» Obes Res. Feb 2004;12(2):224-32. PMID 14981214 | Texto completo. Archivado el 19 de febrero de 2008 en Wayback Machine.
- ↑ Siddall, O. M.: «Use of methylphenidate in traumatic brain injury.» Ann Pharmacother. Jul-ag 2005;39(7-8):1309-13. PMID 15914519
- ↑ Etchepareborda, M. C.: «Abordaje neurocognitivo y farmacológico de los trastornos específicos del aprendizaje.» Rev Neurol. Feb 1999;28 supl 2:S81-93. PMID 10778495
- ↑ Grubb, B. P., et al.: «The use of methylphenidate in the treatment of refractory neurocardiogenic syncope.» Ann Pharmacother. Jul-ag 2005;39(7-8):1309-13. PMID 8734752
- ↑ a b c Moizeszowicz, Julio: Psicofarmacología psicodinámica IV: estrategias terapéuticas y psiconeurobiológicas. Buenos Aires: Paidós, 2000. ISBN 950-12-3180-1
- ↑ a b Zametkin, A. J., et al.: «Cerebral glucose metabolism in adults with hyperactivity of childhood onset.» N Engl J Med. 15 nov 1990;323(20):1361-6. PMID 2233902
- ↑ Wilens, T. E., Spencer, T. J.: «The stimulants revisited.» Child Adolesc Psychiatr Clin N Am. Jul 2000;9(3):573-603, VIII. PMID 10944658
- ↑ Goede, A., et al.: «SuperDrug: a conformational drug database.» Bioinformatics. 1 de mayo de 2005;21(9):1751-3. Epub 2 feb 2005. PMID 10944658
- ↑ Dollery, Colin (coordinador): Therapeutic drugs. Edimburgo: Churchill Livingstone, 1999. Segunda edición (2 volúmenes). ISBN 0-443-05148-8
- ↑ Szporny, L., Görög, P.: «Investigations into the correlations between monoamine oxidase inhibition and other effects due to methylphenydate and its stereoisomers.» Biochem Pharmacol. 1961;8:263-68.
- ↑ Ding, Y. S., et al.: «Chiral drugs: comparison of the pharmacokinetics of [11C]d-threo and L-threo-methylphenidate in the human and baboon brain.» Psychopharmacology (Berl). May 1997;131(1):71-8. PMID 9181638
- ↑ Jensen, P. S., et al.: «Psychoactive medication prescribing practices for U.S. children: gaps between research and clinical practice.» J Am Acad Child Adolesc Psychiatry. May 1999;38(5):557-65. PMID 10230187
- ↑ Medication treatment for child and adolescent psychiatric disorders: What is the evidence? Extracto de ADHD research update - Vol. 21, julio de 1999. Por David Rabiner.
- ↑ Willens, T., Spencer, T.: Massachusetts General Hospital's child and adolescent psychopharmacology meeting. Marzo 10-12, 2000. Boston.
- ↑ Mitler, M. M., et al.: «Narcolepsy and its treatment with stimulants. ASDA standards of practice.» Sleep. Jun 1994;17(4):352-71. PMID 7973321
- ↑ Littner, M., et al.: "Practice parameters for the treatment of narcolepsy: an update for 2000". Sleep. 15 jun 2001;24(4):451-66. PMID 11403530 | Texto completo (PDF) En 1956, Daly y Yoss introdujeron el MFD como tratamiento para narcolepsia. Más tarde, reportaron sus efectos en 25 y 36 pacientes tratados por 1-6 meses con dosis diarias de MFD de 40 a 240 mg. En opinión de Yoss: «La dosis total diaria de MFD debería ser tan baja como 30 mg para la narcolepsia leve y superior a los 100 mg en narcolepsia severa; ocasionalmente cantidades tan altas como 200 mg son necesarias». Poco después, en un estudio de serie de casos reportado en 1959, Yoss llegó a utilizar dosis de 300 mg en un sujeto, sin efectos adversos destacables.
- ↑ Thomas, D., et al.: «Methylphenidate: its pharmacology and uses.» Mayo Clin Proc. 2000;75:711-21.
- ↑ Bymaster, F. P., et al.: «Fluoxetine, but not other selective serotonin uptake inhibitors, increases norepinephrine and dopamine extracellular levels in prefrontal cortex.» Psychopharmacology (Berl). Abr 2002;160(4):353-61. PMID 11919662
- ↑ Markowitz, J. S., et al.: «Ethylphenidate formation in human subjects after the administration of a single dose of methylphenidate and ethanol.» Drug Metab Dispos. Jun 2000;28(6):620-4. PMID 10820132 | Texto completo (PDF)
- ↑ "Methylphenidate", en DEA, News Releases, 20 oct 1995. Disponible en línea Archivado el 30 de agosto de 2005 en Wayback Machine.
- ↑ "DEA Congressional Testimony, 16/05/00", en DEA, News Releases, 16 may 2000. Disponible en línea
- ↑ United Nations Drug Control Programme (UNDCP): Amphetamine-type stimulants: a global review. Viena: Commission on Narcotic Drugs, 1996. Texto completo (PDF) | Publicado bajo dominio público.
- ↑ Wilens, T. E., et al.: «Effects of once-daily osmotic-release methylphenidate on blood pressure and heart rate in children with attention-deficit/hyperactivity disorder: results from a one-year follow-up study.» J Clin Psychopharmacol. Feb 2004;24(1):36-41. PMID 14709945
- ↑ Wilens, T. E., et al.: «Blood pressure changes associated with medication treatment of adults with attention-deficit/hyperactivity disorder.» J Clin Psychiatry. 2005;66(2):253-9. PMID 15705013
- ↑ Kooij, J. J., et al.: «Efficacy and safety of methylphenidate in 45 adults with attention-deficit/hyperactivity disorder. A randomized placebo-controlled double-blind cross-over trial.» Psychol Med. Ag 2004;34(6):973-82. PMID 15554568
- ↑ Palumbo, D., et al.: «Emergence of tics in children with ADHD: impact of once-daily OROS methylphenidate therapy.» J Child Adolesc Psychopharmacol. 2004;14(2):185-94. PMID 15319016
- ↑ Wilens, T., et al.: «ADHD treatment with once-daily OROS methylphenidate: final results from a long-term open-label study.» J Am Acad Child Adolesc Psychiatry. Oct 2005;44(10):1015-23. PMID 16175106
- ↑ Barbaresi, W. J., et al.: «Long-term stimulant medication treatment of attention-deficit/hyperactivity disorder: results from a population-based study.» J Dev Behav Pediatr. Feb 2006;27(1):1-10. PMID 16511362 |
A modo de ejemplo, hallazgos aislados en ratas habían sugerido posibles cambios plásticos en la personalidad y funcionamiento cerebral. Sin embargo, sucesivos estudios han podido establecer lo contrario, refutando aquella hipótesis:
- Grund, T., et al.: «Influence of methylphenidate on brain development — an update of recent animal experiments.» Behav Brain Funct. 10 en 2006;2:2. PMID 16403217 | Texto completo (PDF)
- Ludolph A. G., et al.: "Methylphenidate exerts no neurotoxic, but neuroprotective effects in vitro". J Neural Transm. Dic 2006;113(12):1927-34. PMID 16736241
- Mannuzza, S., et al.: "Does stimulant treatment place children at risk for adult substance abuse? A controlled, prospective follow-up study". J Child Adolesc Psychopharmacol. 2003;13(3):273-82. PMID 14642015
- Feron, F. J., et al.: "Dopamine transporter in attention-deficit hyperactivity disorder normalizes after cessation of methylphenidate". Pediatr Neurol. Sep 2005;33(3):179-83. PMID 16139732
- Wang, R., et al.: "Clinical and sleep EEG monitoring characteristics and long-term follow-up study on narcolepsy". Zhonghua Er Ke Za Zhi. En 2003;41(1):11-3. PMID 14761316
- Hechtman, L., Greenfield, B.: «Long-term use of stimulants in children with attention deficit hyperactivity disorder: safety, efficacy, and long-term outcome.» Paediatr Drugs. 2003;5(12):787-94. PMID 14658920
- Jensen, P.: «Longer term effects of stimulant treatments for Attention-Deficit/Hyperactivity Disorder.» J Atten Disord. 2002;6 supl 1:S45-56. PMID 12685518
- Charach, A., et al.: «Stimulant treatment over five years: adherence, effectiveness, and adverse effects.» J Am Acad Child Adolesc Psychiatry. May 2004;43(5):559-67. PMID 15100562
- Gadow, K. D., et al.: «Long-term methylphenidate therapy in children with comorbid attention-deficit hyperactivity disorder and chronic multiple tic disorder.» Arch Gen Psychiatry. Abr 1999;56(4):330-6. PMID 10197827
- Brown, R. T., et al.: "«Treatment of attention-deficit/hyperactivity disorder: overview of the evidence.» Pediatrics. Jun 2005;115(6):e749-57. PMID 15930203
- ↑ Fischman, M. W., et al.: «Cardiovascular and subjective effects of intravenous cocaine administration in humans.» Arch Gen Psychiatry. 1976 ag;33(8):983-9. PMID 949232
- ↑ Volkow, N. D., et al.: «Is methylphenidate like cocaine? Studies on their pharmacokinetics and distribution in the human brain.» Arch Gen Psychiatry. Jun 1995;52(6):456-63. PMID 7771915
- ↑ Segal, D. S., Janowsky, D. S.: "«Psychostimulant-induced behavioral effects: possible models of schizophrenia.» En Lipton, Morris A.; DiMascio, Alberto; Killam, Keith F. (coordinadores): Psychopharmacology: a generation of progress. Nueva York: Raven Press, 1978, pp. 1113-24. ISBN 0-89004-191-1
- ↑ Volkow, N. D., Swanson, J. M.: «Variables that affect the clinical use and abuse of methylphenidate in the treatment of ADHD.» Am J Psychiatry. Nov 2003;160(11):1909-18. PMID 14594733 | Texto completo (PDF).
- ↑ Mannuzza, S., et al.: «Does stimulant treatment place children at risk for adult substance abuse? A controlled, prospective follow-up study.» J Child Adolesc Psychopharmacol. Otoño 2003;13(3):273-82). PMID 14642015
- ↑ «El metilfenidato (Ritalín).» NIDA InfoFacts, agosto de 2006. Disponible en línea (PDF)
- ↑ Ramos-Quiroga, J. A., et al.: «TDAH y drogodependencias.» Programa Integral del Déficit d’Atenció a l’Adult, Hospital Universitari Vall d’Hebron. Texto completo (PDF).
- ↑ Schubiner, H., et al.: «Double-blind placebo-controlled trial of methylphenidate in the treatment of adult ADHD patients with comorbid cocaine dependence.» Exp Clin Psychopharmacol. Ag 2002;10(3):286-94. PMID 12233989. (Estudio publicado con metodología idónea: doble ciego, aleatorizado, controlado frente a placebo.)
- ↑ Levin, F. R., et al.: «Methylphenidate treatment for cocaine abusers with attention-deficit attention-deficit hyperactivity disorder: a pilot study.» J Clin Psychiatry. Jun 1998;59(6):300-5. PMID 9671342. (Estudios abiertos, usando MFD de liberación prolongada.)
- ↑ El TDAH como entidad clínica se encuentra recogido en la Clasificación internacional de enfermedades, décima revisión (CIE-10), la cual representa un marco etiológico. En cambio, el funcionamiento y la discapacidad asociados con aquel trastorno se tratan en la Clasificación internacional del funcionamento, de la discapacidad y de la salud (en inglés: International classification of functioning, disability and health), esta última, auspiciada y publicada también por la OMS, y adoptada a nivel mundial.
- ↑ Centers for Disease Control and Prevention, Department of Health and Human Services: "Attention deficit hyperactivity disorder (ADHD)". Disponible en línea. Consultado en agosto de 2007.
- ↑ National Institute of Mental Health, National Institutes of Health: Attention deficit hyperactivity disorder. Publicación NIH n.o 3572. Disponible en línea. Consultado en junio de 2007.
- ↑ Michanie, Claudio: "Diferencias del Trastorno por Déficit de Atención en el niño y el adulto: consideraciones diagnósticas y terapéuticas". En Moizeszowicz, Julio (coordinador): Psicofarmacología Psicodinámica IV - Actualizaciones 2004. Buenos Aires: el autor, 2004. ISBN 987-43-8089-6 | Texto completo (PDF) Archivado el 11 de noviembre de 2004 en Wayback Machine.
- ↑ Novartis Pharmaceuticals: «Focalin XR(TM) approved for treatment of ADHD in adults, adolescents and children.» Medical News Today, 13 de junio de 2005. Disponible en línea Archivado el 30 de junio de 2007 en Wayback Machine. Consultado en octubre de 2007.
- ↑ Peck, P.: «FDA approves Daytrana transdermal patch for ADHD.» MedPage today, 7 de abril de 2006. Disponible en línea Consultado en agosto de 2007.
- ↑ . julio de 2011 http://adhdclinicjeeva.com/jeeves-desk/9%20can%20we%20have%20your%20attention%20pls/attention-plese.pdf. Parámetro desconocido
|langue=ignorado (se sugiere|idioma=) (ayuda); Parámetro desconocido|périodique=ignorado (se sugiere|publicación=) (ayuda); Parámetro desconocido|auteur=ignorado (se sugiere|autor=) (ayuda); Parámetro desconocido|titre=ignorado (se sugiere|título=) (ayuda); Falta el|título=(ayuda).
Bibliografía
[editar]Referencias generales
[editar]- Aust-Claus, Elisabeth y Hammer, Petra-Marina: Das A. D. S.- Buch. Aufmerksamkeits- Defizit- Syndrom. Neue Konzentrations-Hilfen für Zappelphilippe und Träumer. Ratingen: Oberstebrink, 1999. ISBN 3-9804493-6-X
- Barkley, R. A.: «International consensus statement on ADHD. January 2002.» Clin Child Fam Psychol Rev. Jun 2002;5(2):89-111. PMID 12093014 | Texto completo (PDF).
- Barkley, Russell A. Attention deficit hyperactivity disorders: A handbook for diagnosis and treatment. Nueva York: Guilford Press, 1998.
- Barkley, Russell A.: Taking charge of ADHD: the complete, authoritative guide for parents. Nueva York: Guilford Press, 2000. ISBN 1-57230-560-6
- Biederman, J., et al.: «Pharmacotherapy of ADHD reduces risk for substance use disorder.» Pediatrics. Ag 1999;104(2):e20. PMID 10429138 | Texto completo (PDF)
- Brown, Thomas E.: Attention-deficit disorders and comorbidities in children, adolescents, and adults. Washington, D.C.: American Psychiatric Press, 2000.
- Diller, Lawrence H.: Running on Ritalin: a physician reflects on children, society, and performance in a pill. Nueva York: Bantam, 1999. 400 páginas. ISBN 0-553-37906-2
- Icon Health Publications (coordinador): Concerta: a medical dictionary, bibliography, and annotated research guide to Internet references. San Diego, CA: Icon Group International, 2004. ISBN 0-597-84382-1
- Icon Health Publications (coordinador): Methylphenidate: a medical dictionary, bibliography, and annotated research guide to Internet references. San Diego, CA: Icon Group International, 2004. ISBN 0-497-00725-8
- Krause, Johanne y Krause, Klaus-Henning: ADHS im Erwachsenenalter. Stuttgart: Schattauer, 2004. ISBN 3-7945-2371-7
- Lattal, Kennon A. y Perone, Michael (coordinadores): Handbook of research methods in human operant behavior (applied clinical psychology). Springer, 1998. 684 páginas. ISBN 0-306-45668-0
- Scandar, Ruben O.: El niño que no podía dejar de portarse mal. Distal (2000). ISBN 987-502-052-4
- Schulte-Markwort, Michael y Warnke, Andreas: Methylphenidat. Stuttgart: Thieme, 2004. ISBN 3-13-133441-X
- Wender, Paul H.: Attention-deficit hyperactivity disorder in adults. Oxford: Oxford University Press, 1998. ISBN 0-19-511922-3
- Willens, Timothy E.: Straight talk about psychiatric medications for kids. Nueva York: The Guilford Press, 2004. Edición revisada. ISBN 1-57230-945-8
Notas
[editar]Lecturas adicionales
[editar]- Goldman, L. S., et al.: "Diagnosis and treatment of attention-deficit/hyperactivity disorder in children and adolescents". Council on Scientific Affairs, American Medical Association. JAMA. 8 abr 1998;279(14):1100-7. PMID 9546570
- Greenhill, Laurence L. y Osman, Betty B. (eds.): Ritalin: theory and practice. Mary Ann Liebert: Nueva Rochelle, 2000. Segunda edición. 443 páginas. ISBN 0-913113-82-4
- Kandel, Eric; Jessell, Thomas; Schwartz, James. Neurociencia y conducta. Madrid: Pearson Alhambra, 1996. ISBN 978-84-89660-05-2
- Kupfer, David; First, Michael; Regier, Darrel: Agenda de investigación para el DSM-V. Barcelona: Masson, 2004. ISBN 84-458-1295-5
- MTA Cooperative Group: "National Institute of Mental Health Multimodal Treatment Study of ADHD follow-up: 24-month outcomes of treatment strategies for attention-deficit/hyperactivity disorder". Pediatrics. Abr 2004;113(4):754-61. PMID 15060224 | Texto completo (PDF)
- Organización Mundial de la Salud; Secretaría General de Asuntos Sociales de España; Organización Panamericana de la Salud (eds.): Clasificación internacional del funcionamiento, de la discapacidad y de la salud (CIF). Ginebra: Organización Mundial de la Salud, 2001. ISBN 92-4-354542-6 | OCLC 49036441
- U.S. Department of Health and Human Services: "Children and mental health". En Mental Health: A Report of the Surgeon General—Executive Summary. Rockville, MD: U.S. Department of Health and Human Services, Substance Abuse and Mental Health Services Administration, Center for Mental Health Services, National Institutes of Health, National Institute of Mental Health, 1999. Texto completo (PDF) | Publicado bajo dominio público.
- Eymj.org Efectos del MFD en el EEG de varones con TDAH en pruebas de rendimiento continuo.
- Pediatrics.aappublications.org Comparación entre Ritalin y Adderall: eficacia y progreso en el tiempo en niños.
- Jabfp.org MFD de liberación controlada mejora atención en adolescentes cuando conducen en ruta.
- MFD en pacientes pediátricos
- MFD de acción prolongada para el tratamiento del TDAH en adultos drogodependientes
- Efectos del MFD sobre el rendimiento en un simulador de manejo vehicular
- Documento PDF Focalin XR (dexmetilfenidato): NDA n.o 021802.
Enlaces externos
[editar] Wikimedia Commons alberga una galería multimedia sobre metilfenidato.
Wikimedia Commons alberga una galería multimedia sobre metilfenidato.
- Divulgación científica
- En MedlinePlus hay más información sobre metilfenidato
- En Medline hay más información sobre metilfenidato (en inglés)
- TDAH: a largo plazo medicinas no son más efectivas que la psicoterapia y pueden atrofiar el crecimiento, dice un estudio
- TDAH en adultos sin farmacoterapia y costos por ingresos no percibidos
- MFD y medicina apoyada en la evidencia: niños y adultos con TDAH
- El MFD ayuda a adolescentes con TDAH a conducir de manera segura
- Guía para padres: hablando claro sobre el MFD
- MFD como tratamiento para adultos con TDAH
- EurekAlert! Archivado el 27 de septiembre de 2007 en Wayback Machine. Resultados preliminares del sistema transdérmico de metilfenidato.
- ClinicalTrials.gov Ensayos clínicos involucrando esta sustancia que se encuentran actualmente en desarrollo. (En inglés.)
- Documento.pdf Una crítica en perspectiva de Running from Ritalin. Por Malcolm Gladdwell. (En inglés.)
- Material gráfico
- Antiguo aviso publicitario (1958) Ritalin parenteral tras la anestesia con barbitúricos.
- Antiguo aviso publicitario (1962) Ritalin en la Disfunción Cerebral Mínima.

