Tos ferina
| Tos ferina | ||
|---|---|---|
 Niño con tos ferina, durante una crisis de tos. | ||
| Especialidad | infectología | |
| Sinónimos | ||
| ||
La tos ferina o tosferina,[1] también denominada pertussis, coqueluche[nota 1][nota 2] o tos convulsa,[4][5] es una enfermedad infecciosa aguda sumamente contagiosa de las vías respiratorias altas causada por la bacteria gramnegativa Bordetella pertussis. Se caracteriza por inflamación traqueobronquial y accesos típicos de tos violenta y espasmódica con sensación de asfixia que terminan con un ruido estridente durante la inspiración (estridor inspiratorio).[6] B. parapertussis y otros microorganismos causan una enfermedad similar pero más leve a la que se denomina síndrome coqueluchoide.[7] Este término se prefiere cuando el diagnóstico es exclusivamente clínico y la enfermedad puede deberse a otros agentes virales o bacterianos.
Las complicaciones pueden incluir compromiso del sistema nervioso y el miocardio. La aparición de la tos ferina es posible a cualquier edad pero los más afectados son los niños menores de cinco años. La infección se difunde durante la primavera y el verano. Si bien en los países desarrollados la incidencia de esta enfermedad es muy baja gracias a la vacunación, en todo el mundo hay entre 30 y 50 millones de casos de tos ferina y más de 300 000 muertes anuales. En general, a pesar de la alta cobertura con las vacunas DPT y DTaP, la tos ferina es una de las principales causas de muerte prevenible por vacunación en todo el mundo. La mayor parte de las muertes ocurren entre los niños pequeños no vacunados o con una vacunación incompleta: la protección completa contra la tos ferina requiere tres dosis de la vacuna. La tos ferina se considera endémica, con ciclos de tres a cinco años de incremento de la enfermedad.[8] [9] El noventa por ciento de todos los casos se producen en los países en vías de desarrollo. Canadá es el único país desarrollado en el que la tos ferina es endémica.
Historia[editar]


La primera descripción clínica de la tos ferina tuvo lugar en 1578, con el nombre de tussis quinta. Posteriormente, Thomas Sydenham en 1679 y Thomas Willis en 1682 categorizaron la enfermedad de la que se describieron muchas epidemias en Europa durante los siglos XVIII y XIX. B. pertussis se aisló en cultivo puro en 1906; los responsables del aislamiento de este microorganismo fueron Jules Bordet (de allí el nombre de la bacteria) y Octave Gengou, que usaron un medio de cultivo con extractos de patatas. Al principio B. pertussis se incluyó en el género Haemophilus pero como su crecimiento no requería los factores X y V se creó el género Bordetella. Los esfuerzos para desarrollar una vacuna inactivada de células enteras contra la tos ferina comenzaron poco después del primer aislamiento de B. pertussis en cultivo puro en 1906. En la década de 1920, el médico pediatra Louis W. Sauer desarrolló una vacuna contra la tos ferina en el Hospital Evanston (Evanston, Illinois). En 1925 otro médico, el danés Thorvald Madsen, probó por primera vez en gran escala una vacuna de células enteras contra la tos ferina[9] y en 2002 se estableció la secuencia del genoma de la bacteria. La vacuna ha ayudado a reducir la gravedad de la enfermedad y la mortalidad, pero lamentablemente solo en los países industrializados.
Madsen utilizó la vacuna para controlar los brotes de la enfermedad en las Islas Feroe, en el Mar del Norte. En 1942 la científica estadounidense Pearl Kendrick[10] combinó la vacuna de células enteras contra la tos ferina con toxoides antidiftérico y antitetánico para generar la primera vacuna combinada: DTP. Con el propósito de reducir al mínimo los efectos colaterales frecuentes generados por el componente pertussis de la vacuna, el científico japonés Yuji Sato desarrolló una vacuna acelular contra la tos ferina consistente en hemaglutininas (HA) purificadas a partir de la HA filamentosa promotora de faringitis estreptocócica y la HA del factor promotor de leucocitosis (LPF) que secreta B. pertussis en el medio de cultivo.[11] La vacuna acelular contra la tos ferina de Sato se utiliza en Japón desde 1981.[12] Las versiones posteriores de la vacuna acelular usadas en otros países consistían en componentes adicionales definidos de B. pertussis y a menudo formaban parte de la vacuna combinada DTaP. En 2004 se estableció la secuencia completa del genoma de B. pertussis, que tiene 4 086 186 pares de bases.[13]
Epidemiología[editar]

A nivel mundial la tos ferina afecta a 48,5 millones de personas por año.[14] En 2010 la enfermedad causó cerca de 81 000 muertes, en comparación con 167 000 en 1990.[15] Estas muertes se produjeron a pesar de la alta cobertura general con las vacunas DTP y DTaP. La tos ferina es una de las principales causas de muerte prevenible por vacunación en todo el mundo[16] y el 90 por ciento de los casos ocurren en países en desarrollo.[16]
En los Estados Unidos, antes de que se desarrollaran las vacunas contra la tos ferina se registraba un promedio anual de 157 casos cada 100 000 habitantes, con picos cada dos a cinco años; más del 93 por ciento de esos casos correspondían a niños menores de 10 años. Es probable que la incidencia real fuera mucho mayor. En 1970 (treinta años después de la introducción de la vacuna en ese país) la incidencia se redujo drásticamente a menos de 1 caso cada 100 000. Lamentablemente, a partir de 1980 las tasas de incidencia se incrementaron y en 2012 alcanzaron un máximo de 48 277 personas, lo que representa la cifra más alta desde 1955, año en el que el número llegó a 62 786.[17] La tos ferina es la única enfermedad prevenible por vacunación que en los Estados Unidos se asocia con un aumento de las muertes. El número de decesos se incrementó de cuatro en 1996 a 17 en 2001 y casi todos los casos correspondieron a lactantes menores de un año.[18] En Canadá el número de infecciones por B. pertussis ha variado entre 2000 y 10 000 casos informados cada año durante los últimos diez años.[19]
En Australia se informa un promedio de 10 000 casos anuales, pero en los últimos años el número de casos ha aumentado.[20] En los Estados Unidos desde alrededor de 2004 se observa un incremento significativo de los casos de tos ferina en adultos.[21]
Brotes en los Estados Unidos[editar]
Brote de 2010[editar]
En 2010 en California murieron diez recién nacidos y las autoridades sanitarias declararon una epidemia con 9120 casos.[22] [23] La investigación de las diez muertes infantiles reveló que los médicos habían equivocado el diagnóstico de la enfermedad de los recién nacidos a pesar de haberlos visto en múltiples consultas.[24] El análisis estadístico identificó una superposición significativa en las comunidades entre la agregación[nota 3] de exenciones no médicas para los niños y los casos de tos ferina. En el estudio se encontró que el número de exenciones variaba mucho entre las comunidades, pero con tendencia a una fuerte agregación; en algunas escuelas más de las tres cuartas partes de los padres habían presentado certificados de exención para no vacunar a sus hijos. Los datos sugieren que el rechazo de la vacuna sobre la base de una razón no médica y creencias personales podría haber sido uno de los factores que determinaron el brote; además, el efecto menos duradero de la vacuna actual y el hecho de que la mayoría de los adultos y los niños mayores vacunados no hubieran recibido una dosis de refuerzo contribuyeron al brote de 2010 en California.[25][26]
Brote de 2012[editar]
En abril y mayo de 2012 la tos ferina fue declarada en niveles de epidemia en el estado de Washington, con 3308 casos en el mes de diciembre.[27][28][29] También en diciembre de 2012 el estado de Vermont declaró una epidemia de tos ferina, con 522 casos.[30] En realidad, la mayor tasa de incidencia corresponde al estado de Wisconsin con 3877 casos de tos ferina, pero ese estado no dio a conocer una declaración oficial de epidemia.[29]
La tos ferina se transmite principalmente por contacto directo con secreciones de la nariz y la garganta de las personas infectadas. Los hermanos mayores pueden ser portadores nasales y faríngeos de la bacteria y, por lo tanto, llevar la enfermedad al hogar e infectar al lactante de la familia. En general, el contagio confiere inmunidad prolongada, pero no de por vida.
Etiología[editar]

El agente causal de la tos ferina, Bordetella pertussis, es una bacteria gramnegativa pequeña (mide alrededor de 0,3-0,5 μm de ancho y entre 1,0 y 1,5 μm de largo), aerobia, no móvil y encapsulada. Su patogenicidad se debe a la producción de muchas proteínas, algunas de ellas toxinas, y moléculas de adhesión, sobre todo al epitelio ciliado, las que en parte también son responsables de su capacidad de causar enfermedad. Sus antígenos de superficie, vinculados con las fimbrias, son aglutinógenos incorporados en las vacunas acelulares. La pertactina, una proteína externa de la membrana de la bacteria, es inmunógena y sirve para la adhesión celular, también usada en algunas vacunas acelulares. Otra probable molécula de adhesión es el factor de colonización traqueal.
B. pertussis también produce toxinas. La evasión de la respuesta inmunitaria es un factor importante en su virulencia, mediada por la toxina adenilciclasa.[31] La toxina está ubicada en la superficie bacteriana y aumenta la concentración de AMP cíclico, lo que inhibe la función fagocitaria. Por su parte, la citotoxina traqueal derivada del peptidoglucano produce parálisis de los cilios respiratorios y aunque no es inmunógena, da comienzo a la sintomatología del cuadro clínico.
Toxina pertussis[editar]

La toxina pertussis es un complejo proteico de seis componentes o subunidades organizadas en una estructura A-B. Un componente (A) es enzimáticamente activo y está formado por la subunidad S1 mientras que el componente B es la parte vinculante del receptor y está constituido por las subunidades S2-S5.[32] La bacteria libera la toxina de forma inactiva. Cuando la subunidad B se une al receptor de membrana de la célula, se activa la subunidad A, probablemente a través de la acción del ATP y el glutatión.[7]
Síndrome coqueluchoide[editar]
Cuando los signos y los síntomas son indistinguibles de la tos ferina pero no se puede demostrar la presencia de Bordetella pertussis se emplea el término síndrome coqueluchoide o pertusoide.[33] La infección por Bordetella parapertussis causa menos de una quinta parte de los casos con cuadro clínico de tos ferina; en el cuarenta por ciento de esos casos los pacientes permanecen asintomáticos y en otro cuarenta por ciento se trata de una simple bronquitis aguda. Otros microorganismos que pueden causar síndrome coqueluchoide son Bordetella bronchiseptica, Mycoplasma pneumoniae, Chlamydia trachomatis y virus como el adenovirus y el virus sincicial respiratorio.
Se debe sospechar la posibilidad de incrustación de un cuerpo extraño, como por ejemplo tumores o adenopatías. La inhalación de ciertos gases tóxicos y las sustancias ácidas pueden producir síntomas muy similares.
Patogenia[editar]
La bacteria B. pertussis (microorganismo cuyo único huésped es el humano) posee un marcado tropismo por los cilios del tracto respiratorio y se multiplica en la mucosa. Por lo general entra en el huésped a través de la vía aérea, es atrapada por el moco y posteriormente las células ciliadas eliminan los fragmentos de mucina que contienen bacterias. La colonización epitelial respiratoria persiste durante varias semanas y se asocia con ciliostasis (detención del movimiento de los cilios) y daño localizado del epitelio y el tejido mesenquimatoso subyacente. B. pertussis se une preferentemente a las células ciliadas y se multiplica en su superficie, con lo que al final les provoca la muerte a causa de la producción de sus compuestos tóxicos. Los efectos sistémicos se deben a las toxinas liberadas por la bacteria cuando se multiplica en el tracto respiratorio. Como B. pertussis se localiza exclusivamente en los cilios del epitelio respiratorio y sus efectos sistémicos se producen en tejidos distantes, aun después de la desaparición del microorganismo, se ha propuesto que la tos ferina es una enfermedad mediada por toxinas, entre las cuales la más importante es la toxina pertussis.[34] La unión de la toxina pertussis (solo B. pertussis expresa esa toxina, la proteína más virulenta) a los neutrófilos polimorfonucleares (PMN) aumenta la cantidad de CR3 (receptor de complemento de tipo 3) en la superficie de esas células y la presencia de toxina pertussis y hemaglutininas filamentosas estimula la fagocitosis de B. pertussis.[35]

Entre los factores que se ha descrito que intervienen en la patogenia de la enfermedad figuran la sustancia capsular (que le brinda protección efectiva al microorganismo), las vellosidades o pili (que intervienen en la adherencia), la pertactina (una proteína de la membrana externa), la hemaglutinina filamentosa (proteína antigénica que por su carácter de fimbria actúa como adhesina bacteriana), la toxina pertussis (que favorece la adherencia a las células epiteliales y la linfocitosis y tiene actividad de ribosilación del ADP de manera análoga a la toxina del cólera), la toxina citotóxica traqueal (que inhibe la síntesis de ADN de las células ciliadas y causa ciliostasis y finalmente la muerte de las células epiteliales con lesiones locales en la mucosa que provocan el inicio de la tos), la endotoxina (un componente de la pared celular de las bacterias gramnegativas) y otras toxinas (adenilciclasa, toxina dermonecrótica y hemolisina).
En síntesis, Bordetella pertussis llega al tracto respiratorio y se adhiere a la superficie epitelial (cilios) de la tráquea y los bronquios. Esa unión está mediada fundamentalmente por la hemaglutinina, aunque también intervienen la pertactina, las fimbrias y la toxina pertussis. Una vez que llega a esa zona, el microorganismo se multiplica con rapidez e interfiere sobre la acción ciliar pero sin invadir la sangre. B. pertussis produce toxinas y sustancias que irritan las células superficiales (toxina dermonecrótica, citotoxina traqueal) y así provocan tos y linfocitosis. La citotoxina traqueal también produce ciliostasis, lo que altera la defensa mucociliar. Aparecen zonas de necrosis en el epitelio e infiltración polimorfonuclear, inflamación peribronquial y neumonía intersticial. Los bronquios más pequeños se obstruyen a causa del moco y producen atelectasia y disminución de la oxigenación, lo que determina la aparición de convulsiones. Por último, la toxina pertussis y la adenilciclasa pueden determinar la inhibición de las células fagocíticas. En algunos casos se desarrolla encefalitis como complicación tardía.
Anatomía patológica[editar]
Los bacilos se adhieren a los cilios y la actividad ciliar se deteriora, lo que finalmente determina la descamación de las células ciliadas de la superficie mucosa. El cuadro anatomopatológico básico consiste en un proceso inflamatorio de la mucosa del tracto respiratorio con congestión e infiltración de linfocitos y polimorfonucleares en la pared bronquial, en la que después es posible el desarrollo de un proceso de necrosis de algunas capas de la mucosa. También es posible que en la luz bronquial se acumulen restos celulares que, junto con las secreciones mucosas, obstruyan los bronquios y causen atelectasias.
Las toxinas bacterianas son las que ocasionan las manifestaciones clínicas de la enfermedad. Entre las complicaciones graves que pueden ser causas directas de la muerte de los pacientes afectados figuran bronconeumonía, edema cerebral, empiema pleural y úlceras gástricas sangrantes. Otras complicaciones de importancia que en ocasiones se asocian con la tos ferina en las dos últimas fases son de tipo neurológico y consisten en convulsiones o encefalopatía, tanto por hipoxemia como por los efectos de la toxina pertussis. Además, el esfuerzo provocado por la tos puede desencadenar hemorragias subconjuntivales, petequias en la parte superior del tórax, hematomas subdurales, hernias inguinales o umbilicales, prolapso rectal, enfisema subcutáneo, fracturas costales y neumotórax.
Cuadro clínico[editar]
Desde la exposición al microorganismo hasta el desarrollo de los síntomas (período de incubación) transcurren en promedio de siete a diez días[36] pero pueden pasar entre cuatro y veintiuno[36] y, en raras ocasiones, ese lapso llega a prolongarse hasta cuarenta y dos días.[37] Después de ese período en general hay síntomas respiratorios poco importantes, como tos leve, estornudos o secreción nasal. Esa fase inicial se conoce como la etapa catarral y el cuadro clínico se asemeja al de un resfriado común. Se observan estornudos, enrojecimiento de los ojos y fiebre leve. Después de una o dos semanas de evolución de la tos, clásicamente aparecen accesos incontrolables, cada uno con cinco a diez crisis de tos violenta, espasmódica y sin interrupción, que suelen terminar con una inspiración también violenta y prolongada, acompañada de un silbido o estridor inspiratorio característico, un sonido similar a un jadeo producido por el cierre parcial de la glotis en los niños más pequeños o un sonido jadeante en niños mayores, dado que el paciente lucha por respirar (etapa paroxística). Los portadores pueden transmitir la tos ferina desde la aparición de los síntomas hasta tres semanas después del inicio de los episodios de tos. El período de contagio se reduce a cinco días después del comienzo de la terapia con antibióticos.[36]
La aparición de la tos característica revela el inicio de la segunda etapa (paroxística). Las crisis, que se suceden a intervalos regulares, a veces se repiten rápidamente y otras veces son separadas por intervalos de varias horas. Por lo general, se produce un vómito inmediatamente después de la crisis. La última etapa, la de convalecencia, dura de uno a tres meses y se caracteriza por una resolución gradual de los episodios de tos.
Los síntomas clásicos de la tos ferina son tos (paroxística), estridor inspiratorio y síncope o vómitos después de toser.[38] Se ha documentado que la tos causada por B. pertussis provoca hemorragia subconjuntival, fracturas costales, incontinencia urinaria, hernias, síncope después de un acceso y la disección de la arteria vertebral.[38] La tos violenta puede causar la ruptura de la pleura con el consiguiente neumotórax. Si después de un acceso de tos hay vómitos o estridor inspiratorio, la probabilidad de que la enfermedad sea tos ferina es casi del doble. Por otro lado, la ausencia de tos paroxística o de emesis posterior a la crisis de tos reduce las probabilidades casi a la mitad.[38]
Las crisis de tos, que pueden ocurrir solas o ser provocadas por un bostezo, un estiramiento o los actos de reír, comer o gritar, por lo general se presentan en grupos, con múltiples episodios cada hora durante todo el día. Esta etapa suele durar de dos a ocho semanas, o a veces más. A continuación se produce una transición gradual a la fase de convalecencia, que por lo común dura de una a dos semanas. Lo característico de esta etapa es que disminuyan los paroxismos de tos, tanto en frecuencia como en gravedad, y desaparezcan los vómitos. La tendencia al estridor inspiratorio después de toser puede seguir presente por un período considerable una vez curada la enfermedad.
Diagnóstico[editar]
Los métodos utilizados en el diagnóstico de laboratorio incluyen el cultivo de hisopados nasofaríngeos en medio de Bordet-Gengou, la reacción en cadena de la polimerasa (PCR), la inmunofluorescencia directa (IFD) y los métodos serológicos. Como las bacterias solo pueden ser aisladas de los pacientes durante las tres primeras semanas de la enfermedad, el cultivo y la IFD no resultan útiles después de ese período; en cambio, la PCR puede tener cierta utilidad (limitada) durante un lapso adicional de tres semanas.
En la mayoría de los adultos y los adolescentes, que a menudo no buscan atención médica hasta varias semanas después de la instalación de la enfermedad, la serología puede usarse para determinar si hay un alto nivel sanguíneo de anticuerpos contra la toxina pertussis u otro componente de B. pertussis. Durante esta etapa ha habido posibilidad de transmisión por algunas semanas y es posible que la infección se haya diseminado a muchas personas. Por ese motivo, aunque los adultos no corren gran riesgo de contagio, cada vez se los alienta más a vacunarse.
B. parapertussis causa una enfermedad similar, pero más leve.[7]
Según los Centros para Control y Prevención de Enfermedades (CDC) de Atlanta, Estados Unidos, el diagnóstico se basa en los criterios siguientes:[39]
- Diagnóstico clínico
- Tos de más de dos semanas de duración, más uno de los siguientes hallazgos:
- Tos paroxística.
- Estridor inspiratorio.
- Vómitos tras los accesos de tos sin otra causa evidente.
- Tos de más de dos semanas de duración, más uno de los siguientes hallazgos:
- Diagnóstico bacteriológico
- Aislamiento de Bordetella pertussis de una muestra de origen nasofaríngeo.
- PCR positiva.
- Clasificación de los casos
- Caso probable. Caso que satisface los criterios del diagnóstico clínico, pero sin que se haya podido demostrar la enfermedad con pruebas bacteriológicas ni se haya podido establecer su relación epidemiológica con un caso definitivo.
- Caso confirmado. Cualquier cuadro respiratorio con cultivo positivo para Bordetella pertussis. Cualquier cuadro que satisfaga los criterios del diagnóstico clínico, con PCR positiva para Bordetella pertussis o asociación epidemiológica con un caso que posea diagnóstico bacteriológico.[39]
Diagnóstico diferencial[editar]
Para establecer el diagnóstico diferencial se utilizan datos específicos que permitan diferenciar la enfermedad en estudio (en este caso la tos ferina) de otros procesos con un cuadro clínico similar. El diagnóstico de la tos ferina no siempre es fácil de realizar porque hay varias afecciones que pueden desencadenar cuadros de tos semejantes; el principal diagnóstico diferencial de esta enfermedad corresponde al síndrome coqueluchoide, que como ya se ha dicho se asocia con un cuadro clínico parecido, pero sin compromiso sistémico y además es secundario a la infección por microorganismos distintos de B. pertussis como adenovirus, virus sincicial respiratorio, Chlamydia trachomatis y Mycoplasma pneumoniae, entre otros. Por ese motivo, en un paciente con manifestaciones clínicas compatibles no será posible establecer un diagnóstico de certeza en el momento de la consulta, sino que para ello habrá que esperar hasta que se demuestre el agente etiológico.
En síntesis, en el diagnóstico diferencial de la tos ferina deben tenerse en cuenta todas las causas del síndrome coqueluchoide. Además, debe considerarse que los lactantes menores de seis meses que presenten tos paroxística y manifestaciones clínicas respiratorias bajas, sobre todo obstrucción bronquial difusa, pueden ser portadores de la neumonía afebril del lactante producida por Chlamydia trachomatis, virus, micoplasmas, Ureaplasma urealyticum y otros agentes patógenos.[40]
Tratamiento[editar]
El tratamiento farmacológico consiste en la administración de antibióticos macrólidos como la eritromicina o la claritromicina en una fase lo bastante temprana de la etapa catarral.[41] Lamentablemente, en la mayoría de los pacientes el diagnóstico se establece en el estadio avanzado de la enfermedad, cuando los antibióticos pueden ser poco efectivos, pero de todos modos es posible que eliminen la bacteria de las secreciones y así reduzcan rápidamente el riesgo de que el paciente transmita la enfermedad a otras personas.[41] En la mayor parte de los casos con manifestaciones clínicas sospechosas la administración del antibiótico se inicia sin esperar la confirmación del laboratorio. También se recomienda un tratamiento preventivo con antibióticos para las personas con riesgo de tos ferina. Lo mismo es cierto para todas las personas del entorno inmediato del paciente, independientemente de su edad y de su estado de vacunación.
La eritromicina suele administrarse en una dosis de 50 mg/kg/día, fraccionada en dos tomas, o en una dosis máxima de 2 g/día. El tratamiento debe durar 15 días.[42] En los niños la azitromicina se administra en una dosis diaria única de 10 mg/kg el día 1 y luego en una dosis diaria también única de 5 mg/kg los días 2 a 5 mientras que en los adultos se suele prescribir una dosis de 500 mg el primer día y de 250 mg los días 2 a 5.[31] El cotrimoxazol también puede utilizarse en adultos en dosis de 800 mg cada 12 horas, durante 15 días. La eritromicina ha sido vinculada con la aparición de estenosis pilórica en recién nacidos sensibles.[41] En los niños de más de dos meses también se considera como alternativa el antibiótico trimetoprima (TMP)-sulfametoxazol (SXT),[43] que se administra en dosis de 8 mg/kg de TMP y 40 mg/kg/día de SXT en dos tomas.[31]
Los lactantes de menos de 18 meses requieren supervisión constante porque la respiración puede detenerse temporalmente durante los accesos de tos. Cuando la tos ferina es grave, conviene hospitalizar a los niños menores de seis meses para permitir la creación de un mecanismo de vigilancia cardiorrespiratoria estrecha y la atención de personal de enfermería especializado durante la fase aguda. El uso de óxido nítrico inhalado no ha sido satisfactorio en el tratamiento de esta enfermedad.[31]
También se pueden administrar líquidos por vía intravenosa para garantizar el correcto estado de hidratación y la nutrición si los accesos de tos son tan graves que impiden que el paciente tolere la vía oral. Los jarabes para la tos, los expectorantes y los antitusígenos por lo general no están indicados y no se los debe utilizar en pacientes con tos ferina.
Pronóstico[editar]
Las complicaciones más comunes de la enfermedad incluyen neumonía, otitis media debida a sobreinfección secundaria por Haemophilus influenzae o neumococos, anorexia, deshidratación, encefalopatía, episodios de apnea, neumotórax y muerte. En alrededor del 2 al 4 por ciento de los casos también se observan convulsiones, una complicación inusual que ocurre especialmente en el 0,5 por ciento de los pacientes con daño cerebral por encefalopatías y que a menudo constituye un daño permanente. La causa exacta todavía no está clara. La mayor parte de las hospitalizaciones y prácticamente todas las muertes se producen en niños menores de un año.[41]
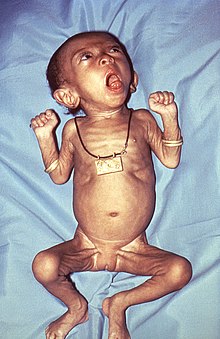
Casi todos los niños y los adultos mayores sanos se recuperan por completo de la tos ferina; en cambio, en las personas con procesos mórbidos asociados puede haber mayor riesgo de morbilidad y mortalidad.
En los recién nacidos la infección es particularmente grave. La tos ferina es mortal en alrededor del 1,6 por ciento de los niños menores de un año hospitalizados.[44] Los niños de menos de un año también son más propensos a desarrollar complicaciones como neumonía (20 %), encefalopatía (0,3 %), convulsiones (1 %), retraso del crecimiento y la muerte (1 %),[44] tal vez debido a la capacidad de la bacteria para suprimir la respuesta inmunitaria dirigida contra ella.[45] La tos ferina puede causar hipoxia cerebral grave inducida por paroxismo y el 50 por ciento de los lactantes internados en el hospital sufrirán apnea.[44] Las muertes por tos ferina informadas en recién nacidos han aumentado sustancialmente en los últimos veinte años.[46]
Prevención[editar]
El método primario para prevenir la tos ferina es la vacunación. No existen pruebas suficientes para determinar la eficacia de los antibióticos en los pacientes que han estado expuestos a la infección pero se encuentran asintomáticos.[47] Aun así, los antibióticos profilácticos siguen utilizándose con frecuencia en los pacientes expuestos y con alto riesgo de enfermedad grave (como los lactantes).[48]
La medida de control más eficaz es mantener el nivel más alto posible de inmunización en la comunidad (inmunización de grupo). El tratamiento con determinados antibióticos, como la eritromicina, puede acortar el período de contagio. Las personas infectadas o con probabilidad de estarlo deben mantenerse alejadas de los niños pequeños y los recién nacidos hasta recibir el tratamiento correcto. El tratamiento de las personas en contacto cercano con casos de tos ferina también es una parte importante de la prevención.
Vacunación[editar]
Las vacunas contra la tos ferina son eficaces.[49] La Organización Mundial de la Salud (OMS) recomienda su aplicación,[50] lo mismo que los Centros para el Control y Prevención de Enfermedades (en inglés Centers for Disease Control and Prevention, CDC),[51] y se estima que en 2002 salvaron más de medio millón de vidas.[50] Por ejemplo, la vacuna acelular de múltiples componentes contra la tos ferina tiene una eficacia del 71 al 85 por ciento y su efectividad es mayor contra la enfermedad más grave.[49] Sin embargo, a pesar del amplio uso de la vacuna, la tos ferina persiste en las poblaciones vacunadas y constituye “una de las enfermedades prevenibles por vacunación de mayor prevalencia en los países occidentales”.[52] El reciente resurgimiento de las infecciones por B. pertussis se atribuye a una combinación de disminución de la inmunidad y desarrollo en la bacteria de mutaciones nuevas que las vacunas existentes no pueden controlar de manera eficaz.[52][53] La vacuna contra la tos ferina, que como ya se dijo se desarrolló en la década de 1940, en general se administra en combinación con la vacuna contra la difteria y el tétanos. Las autoridades sanitarias recomiendan que la vacuna DTaP (vacuna acelular contra la difteria, el tétanos y la tos ferina) se administre a los dos, a los cuatro y a los seis meses, entre los 15 y los 18 meses y, posteriormente, entre los cuatro y los seis años. Mantener una buena cobertura de vacunación ha reducido drásticamente la morbilidad y la mortalidad asociadas con la tos ferina. Lamentablemente la vacunación no confiere inmunidad de por vida. Un estudio realizado por los CDC en 2011 indicó que la protección que brinda dura solo de tres a seis años; sin embargo, ese lapso cubre la infancia, el período de mayor exposición y de mayor riesgo de muerte por esta enfermedad.[54] Hay dos tipos principales de vacuna contra la tos ferina, a saber, la vacuna de células enteras y la vacuna acelular. La primera contiene células de Bordetella pertussis, la bacteria responsable de la enfermedad, inactivadas por calor o con procedimientos químicos. La segunda, o acelular, desarrollada en Japón en la década de 1970, contiene de dos a cinco antígenos purificados de B. pertussis. La vacuna de células enteras tiene una eficacia del 95 por ciento después de la administración de tres dosis y la protección que brinda dura aproximadamente ocho años. Sin embargo, puede provocar reacciones adversas. La vacuna acelular en general es mucho más cara que la vacuna de células enteras y no es fácil de conseguir para los países en desarrollo. Las vacunas acelulares son 5 a 10 por ciento menos eficaces que las vacunas de células enteras pero son mejor toleradas y tienen menos efectos secundarios.
Eventos adversos[editar]
La vacuna DTPa puede causar efectos colaterales leves, los que por lo general duran solo unos pocos días e incluyen:[55]
- Fiebre.
- Enrojecimiento de la piel y dolor en el lugar de la inyección.
- Vómitos y disminución del apetito.
Las reacciones moderadas o graves son muy raras y pueden abarcar:[55]
- Síndrome de llanto persistente durante 3 horas o más, fiebre superior a 40,5 °C ocurren con menos frecuencia.
- Convulsiones, disminución de la conciencia o el daño cerebral permanente son extremadamente raras.
Contraindicaciones[editar]
La vacuna contra la tos ferina no debe ser administrada sola ni en combinación con otras vacunas en pacientes con antecedentes de alergia a sus componentes.
Controversias acerca de la vacunación[editar]
Muchas de las controversias existentes sobre la vacuna DPT en las décadas de 1970 y 1980 se relacionaban con la cuestión de si en casos raros el componente pertussis de las células enteras causaría una lesión cerebral permanente, la encefalopatía posvacunación contra la tos ferina. A pesar de esa posibilidad, los médicos recomendaban la vacuna debido al enorme beneficio que significaba para la salud pública y a que la tasa informada era muy baja (un caso cada 310 mil vacunas o alrededor de 50 casos de los 15 millones de vacunas aplicadas anualmente en los Estados Unidos) y el riesgo de muerte por la enfermedad era alto (antes de la introducción de la vacuna la tos ferina causaba la muerte de miles de estadounidenses cada año).[56]
Ningún estudio demostró una relación causal y los trabajos posteriores no hallaron asociación alguna entre la administración de la vacuna DPT y la lesión cerebral permanente. Se comprobó que el presunto daño cerebral inducido por la vacuna se asociaba con una enfermedad no relacionada, la epilepsia infantil.[57]
Con el tiempo las evidencias que contradecían la hipótesis del desarrollo de la encefalopatía posvacuna contra la tos ferina aumentaron hasta tal punto que la Revista de la Asociación Médica estadounidense (JAMA) calificó esa hipótesis de “mito” y de “disparate”.[58]
Sin embargo, antes de ese momento (en la década de 1970) las críticas de los estudios que no habían demostrado la conexión y algunos informes anecdóticos bien publicitados de discapacidad permanente atribuida a la vacuna DPT habían dado lugar a movimientos anti-DPT.[59] La publicidad negativa y el alarmismo determinaron que la tasa de inmunización disminuyera en varios países, entre ellos el Reino Unido, Suecia y Japón. En muchos casos el resultado fue un aumento espectacular de la incidencia de tos ferina.[60] Las afirmaciones no científicas sobre la vacuna expulsaron del mercado a los que la proveían.[56] En los Estados Unidos, los bajos márgenes de ganancia y un aumento de las demandas relacionadas con la vacunación determinaron que en la década de 1980 muchos fabricantes dejaran de producir la vacuna DPT.[56]
En 1982 el documental televisivo DPT: Vacuna Roulette (DPT: la ruleta de la vacunación) describió la vida de los niños con discapacidades graves atribuidas erróneamente a la vacuna DPT por la reportera Lea Thompson.[61] La publicidad negativa generada por el documental llevó a un aumento enorme del número de demandas presentadas contra los fabricantes de vacunas,[62] los que en 1985 tuvieron dificultades para obtener un seguro de responsabilidad civil. El precio de la vacuna DPT se disparó, lo que condujo a su escasez en todo el país. Hacia fines de 1985 en los Estados Unidos quedaba un solo fabricante de vacuna DPT. Para evitar una crisis, en 1986 el Congreso aprobó la Ley Nacional de Lesiones Infantiles por Vacunas (NCVIA), que estableció un sistema federal de responsabilidad objetiva para compensar a las víctimas de lesiones causadas por las vacunas obligatorias.[63] La mayoría de las reclamaciones que se han presentado a través de la NCVIA se han relacionado con lesiones presuntamente causadas por la vacuna DPT de células enteras.
Las preocupaciones sobre los efectos adversos de la vacunación condujeron a que Yuji Sato introdujera una versión acelular aún más segura de la vacuna contra la tos ferina en Japón en 1981. La vacuna acelular contra la tos ferina fue aprobada en los Estados Unidos en 1992 para ser utilizada en la vacuna combinada DTaP. La investigación ha demostrado que la tasa de efectos adversos de la vacuna acelular es similar a la de una vacuna Td (vacuna contra el tétanos y la difteria que no contiene vacuna contra la tos ferina).[64]
Véase también[editar]
Notas[editar]
- ↑ Esta palabra de origen francés fue incluida en algunas ediciones del Diccionario de la Real Academia (1927, 1950, 1983, 1989) —siempre con el rótulo de galicismo— como sinónimo de tos ferina. El vocablo francés se formó a partir del bajo latín cuculuccia, derivado del latín cucullus (capucha). En Francia en otros tiempos las personas enfermas de tos ferina estaban obligadas a cubrirse la cabeza con una capucha o caperuza, lo que dio lugar al nombre francés de la enfermedad, coqueluche, adoptado más tarde por el español. Además, se cree que la palabra francesa recibió la influencia del vocablo coq (gallo) porque la tos ferina se conocía también como chant du coq (canto del gallo).[2]
- ↑ Según una “Nota histórica” publicada en Chile en 2004 “la coqueluche, la única de las pestes de la infancia que sobrevive inmutable al avance de la ciencia médica”, se conocía desde mucho antes de que surgiera la preocupación por su agente causal. Después de describir los orígenes del nombre desde el siglo XVI, este autor señala las dudas y discusiones sin sentido que siempre ha suscitado la denominación de la enfermedad. Al llegar al término coqueluche describe las dos teorías que considera más importantes sobre su origen. La más citada, que llama onomatopéyica, sostiene que proviene del vocablo francés coq, el "gallito" que culmina las crisis de tos. Explica además que en el Larousse coq es el mâle de la poule (gallo), en tanto que coquelicot c'est une fleur, la amapola, que menciona porque también se ha dicho que el empleo de la tintura del opio extraída de esa flor para detener las crisis de tos sugiere que sería coquelicot el origen del nombre coqueluche. La otra teoría aceptada sostiene que coqueluche deriva de coqueluchon (del latín cucullio), término que se habría utilizado para designar una caperuza aislante que se les ponía a los niños que tosían o que quizás usaran los primitivos infectólogos. La opinión personal de este autor es que “coqueluche proviene de coquette, es decir, la coqueta Bordetella, que se muestra en la inmunofluorescencia, pero no se deja capturar en el cultivo, nos elude y se burla de los microbiólogos”.[3]
- ↑ Agregación: proceso de agrupamiento de personas o de actividades en un mismo lugar o en un área de dimensión restringida. Los nodos de población se forman por agregación de migrantes, las ciudades por agregación de casas, etc. Los procesos de agregación suponen la existencia de similitudes o de comunidades de interés entre las personas o los objetos aproximados, que se refuerzan por las interacciones que permite la proximidad.
Referencias[editar]
- ↑ Hernández Perera J.C., "¿Tos ferina o tosferina?", Archivado el 25 de febrero de 2017 en Wayback Machine. El idioma y la medicina 2012, Infomed 1999-2015, Centro Nacional de Información de Ciencias Médicas, Ministerio de Salud Pública de Cuba. Consultado el 11 de octubre de 2015.
- ↑ La página del idioma español, “Coqueluche. Consultado el 4 de febrero de 2016.
- ↑ Ledermann D. W., “Breve historia de la Bordetella pertussis, una elusiva damisela”, Rev Chil Infect 2004, 21 (3): 241-246. Consultado el 4 de febrero de 2016.
- ↑ Spock B. y Rothenberg M.B., El cuidado de su hijo del Dr. Spock, 1a ed. en español, Nueva York, Simon & Schuster, 1997, p. 687. ISBN: 0-671-56881-7. Consultado el 11 de octubre de 2015.
- ↑ Acevedo G.E., Martínez G.A. y Estario J.C., Manual de Salud Pública, 1a ed., Ediciones Encuentro-Centro de Investigación y Formación en Salud Ambiental, Facultad de Ciencias Médicas, Universidad Nacional de Córdoba, 2007, p. 45. ISBN: 978-987-1432-07-3. Consultado el 11 de octubre de 2015.
- ↑ MedlinePlus, Enciclopedia médica en español, "Tos ferina". Consultado el 12 de marzo de 2009.
- ↑ a b c Finger H., von Koenig C.H.W., “Bordetella–Clinical Manifestations”, en Baron S. (ed.) et al., Baron's Medical Microbiology, 4ª ed., Univ of Texas Medical Branch, Galveston, 1996. ISBN 0-9631172-1-1. Disponible en [1].
- ↑ Baker C. (DRT), "Tos ferina", cap. 109 en Red Book. Atlas de enfermedades infecciosas en pediatría, Buenos Aires, Editorial Médica Panamericana, 2007, p. 308. ISBN 978-95006-1449-8. Vista previa disponible en [2].
- ↑ a b Baker J.P. y Katz S.L., “Childhood vaccine development: an overview”, Pediatr. Res. 2004, 55 (2):347-356. PMID 14630981/doi: 10.1203/01.PDR.0000106317.36875.6A. Disponible en [3]. Consultado el 13 de mayo de 2015.
- ↑ Shapiro-Shapin C.G., “Pearl Kendrick, Grace Eldering, and the pertussis vaccine”, Emerg Infect Dis [serial on the Internet], agosto de 2010, 16 (8). ISSN: 10.3201/EID: 1608.100288/DOI: 10.3201/eid:1608.100288. Disponible en [4]. Consultado el 7 de mayo de 2014.
- ↑ Sato Y., Arai H., Suzuki K., “Leukocytosis-Promoting Factor of Bordetella pertussis III. Its Identity with Protective Antigen” (pdf), Infect Immun, mayo de 1974, 9(5):801-810, disponible en [5]. Consultado el 4 de abril de 2014.
- ↑ Sato Y., Kimura M., Fukumi H., “Development of a pertussis component vaccine in Japan”, Lancet, enero de 1984, 323(8369):122-126. DOI: 10.1016/S0140-6736(84)90061-8. Disponible en [6]. Consultado el 7 de mayo de 2014.
- ↑ Parkhill J., Sebaihia M., Preston A., Murphy L.D., Thomson N., Harris D.E. et al., “Comparative analysis of the genome sequences of Bordetella pertussis, Bordetella parapertussis and Bordetella bronchiseptica” (Internet), Nat Genet, 10 de agosto de 2003, 35 (1): 32-40. DOI: 10.1038/ng1227. Disponible en [7]. Consultado el 9 de mayo de 2014.
- ↑ Bettiol S., Wang K., Thompson M.J., Roberts N.W., Perera R., Heneghan C.J. et al., “Symptomatic treatment of the cough in whooping cough”, Cochrane Database Syst Rev 2012 (Internet), 5:CD003257. DOI: 10.1002/14651858.CD003257.pub4. PMID: 22592689. Disponible en [8]. Consultado el 9 de mayo de 2014.
- ↑ Lozano R., Naghavi M., Foreman K., Lim S., Shibuya K., Aboyans V. et al., “Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010”, Lancet, 15 de diciembre de 2012, 380 (9859): 2095-2128. DOI: 10.1016/S0140-6736(12)61728-0/PMID: 23245604. Disponible en [9]. Consultado el 10 de mayo de 2014.
- ↑ a b Centers for Disease Control and Prevention (CDC), “Pertussis in Other Countries” (Internet), disponible en [10]. Consultado el 14 de abril de 2014.
- ↑ Centers for Disease Control and Prevention (CDC), “Pertussis Cases by Year (1922-2013)”. Página actualizada el 17 de enero de 2014. Disponible en [11]. Consultada el 10 de mayo de 2014.
- ↑ Gregory D.S., “Pertussis: a disease affecting all ages”, Am Fam Physician 2006, 74 (3):420-426. PMID: 16913160. Disponible en [12] Archivado el 16 de mayo de 2008 en Wayback Machine..
- ↑ «Whooping Cough - Causes, Symptoms, Treatment, Diagnosis - - C-Health». Archivado desde el original el 7 de julio de 2012. Consultado el 19 de abril de 2014.
- ↑ Lavelle P., “A bad year for whooping cough”, Australian Broadcasting Corporation, 20 de enero de 2009. Disponible en [13].
- ↑ Murphy K., “Enduring and Painful, Pertussis Leaps Back”, The New York Times, Section: Health, 22 de febrero de 2005. Disponible en [14]. Consultado el 8 de mayo de 2014.
- ↑ Falco M., “Ten infants dead in California whooping cough outbreak”, CNN, 20 de octubre de 2010. Disponible en [15]. “Whooping cough, also known as pertussis, has claimed the 10th victim in California, in what health officials are calling the worst outbreak in 60 years" (En California la tos ferina, también conocida como pertussis, se ha cobrado la décima víctima del que los funcionarios de salud llaman el peor brote en 60 años). Consultado el 10 de mayo de 2014.
- ↑ Centers for Disease Control and Prevention (CDC), “Pertussis (Whooping Cough) Brotes” (en español), 11 de enero de 2011. Disponible en [16]. Consultado el 9 de mayo de 2014.
- ↑ Rong-Gong Lin II, “Diagnoses lagged in baby deaths”, Los Angeles Times, 7 de septiembre de 2010. Disponible en [17]. Consultado el 10 de mayo de 2014.
- ↑ Shute N., “Vaccine Refusals Fueled California’s Whooping Cough Epidemic”, NPR, 30 de septiembre de 2013. Disponible en [18]. Consultado el 10 de mayo de 2014.
- ↑ Atwell J.E., van Otterloo J., Zipprich J., Winter K., Harriman K., Salmon D.A. et al., “Nonmedical Vaccine Exemptions and Pertussis in California, 2010”, Pediatrics (Official Journal of American Academy of Pediatrics) (edición en línea del 30 de septiembre de 2013), 132 (4):624-630. DOI=10.1542/peds.2013-0878. Disponible en [19]. Consultado el 10 de mayo de 2014.
- ↑ Gordon Blankinship D., “Whooping cough epidemic declared in Wash. State”, Associated Press, The Seattle Times, 10 de mayo de 2012. Disponible en [20]. Consultado el 11 de mayo de 2014.
- ↑ Washington State Department of Health (abril de 2012). «Whooping cough cases reach epidemic levels in much of Washington». Washington State Department of Health. Archivado desde el original el 20 de enero de 2015. Consultado el 14 de mayo de 2012.
- ↑ a b Herzog K., “Wisconsin has highest rate of whooping cough”, The Journal Sentinel, 17 de agosto de 2012. Disponible en [21]. Consultado el 12 de mayo de 2014.
- ↑ Johnson T., “Whooping cough epidemic declared in Vermont”, Burlington Free Press, 13 de diciembre de 2012. Disponible en [22]. Consultado el 11 de mayo de 2014.
- ↑ a b c d Donoso A., Díaz F., "Coqueluche grave: Puesta al día", Neumología Pediátrica. ISSN: 0718-3321. Disponible en[23] Archivado el 4 de marzo de 2016 en Wayback Machine.. Consultado nuevamente el 15 de mayo de 2015.
- ↑ Locht C., Antoine R., “A proposed mechanism of ADP-ribosylation catalyzed by the pertussis toxin S1 subunit”, Biochimie 1995, 77 (5): 333-340. DOI:10.1016/0300-9084(96)88143-0. PMID 8527486. Disponible en [24]. Última consulta el 15 de mayo de 2015.
- ↑ Dotres Martínez C., Vega Mendoza D., Toraño Peraza G, Álvarez Carmenate M., Broche Morera A., “Síndrome coqueluchoide y tos ferina”, Instituto Pedro Kourí (IPK), La Habana, Cuba, 25 de septiembre de 2012. Disponible en [25] Archivado el 19 de abril de 2014 en Wayback Machine.. Consultado el 14 de abril de 2014.
- ↑ Llop Hernández A., “Cocobacilos gramnegativos pequeños, Bordetella”, en Microbiología y parasitología médicas, t. 1, sección III: BACTERIAS. Ecimed, Departamento de Publicaciones Electrónicas, La Habana, Cuba, 2001. Disponible en [26]. Consultado el 11 de abril de 2014.
- ↑ Molina López J., Tosferina Archivado el 3 de enero de 2016 en Wayback Machine., Departamento de Microbiología y Parasitología, Facultad de Medicina, Universidad Autónoma de México (UNAM), 1 de junio de 2015. Consultado el 9 de noviembre de 2015.
- ↑ a b c Hamborsky J., Kroger A. y Wolfe Ch. (eds.), “Pertussis”, Epidemiology and Prevention of Vaccine-Preventable Diseases, 13a ed., Washington D.C., Centers for Disease Control and Prevention, U.S.Department of Health and Human Services, 2015, p. 261. Consultado el 11 de octubre de 2015.
- ↑ New York State Department of Health, "Pertussis (whooping cough)", actualizado en enero de 2012, consultado el 8 de junio de 2013. Última consulta el 16 de mayo de 2015.
- ↑ a b c Cornia P.B., Hersh A.L, Lipsky B.A., Newman T.B., Gonzales R., “Does this coughing adolescent or adult patient have pertussis?”, JAMA, agosto de 2010, 304 (8): 890-896. PMID:20736473, DOI:10.1001/jama.2010.1181. Resumen disponible en [27]. Última consulta el 16 de mayo de 2015.
- ↑ a b Tiwari T., Murphy T.V. y Moran J., “Recommended antimicrobial agents for the treatment and postexposure prophylaxis of pertussis: 2005 CDC guidelines”, MMWR, 9 de diciembre de 2005, 54 (RR-14): 1-16. Disponible en [28].
- ↑ Dotres Martínez C. et al., “Síndrome coqueluchoide y tos ferina”, Rev Cubana Med Gen Integr, octubre-diciembre de 2012, 28, 4, La Habana, Cuba. Disponible en [29]. Consultado el 15 de abril de 2014.
- ↑ a b c d Oliva Rodríguez-Pastor S., García Martín F.J. y Milano Manso, "Eritromicina y estenosis hipertrófica del píloro", An Esp Pediatr 2001, 54: 318. Disponible en formato PDF en Anales de pediatría. Consultado el 16 de mayo de 2015.
- ↑ Bazán M.C., Batisttini M.G. y Patiño Martínez G., "Tratamiento de la tos ferina con Eritromicina", Rev. chil. pediatr. (versión en línea), 1953, 24 (8): 280-284 [consultado el 16 de mayo de 2015]. Disponible en: [30]
- ↑ Urgencias pediátricas. Parte II en Van Wie D., Clínicas pediátricas de Norteamérica 2006, vol. 53, N° 2, Elsevier España; p. 230. ISBN 84-458-1685-3.
- ↑ a b c Centers for Disease Control and Prevention, “Pertussis: Complications”. Disponible en [31]. Consultado el 11 de abril de 2014.
- ↑ Carbonetti N.H., “Pertussis toxin and adenylate cyclase toxin: key virulence factors of Bordetella pertussis and cell biology tools”, Future Microbiol, marzo de 2010, 5:455-469. PMC: 2851156. Disponible en [32] Consultado el 15 de mayo de 2015.
- ↑ Guinto-Ocampo H, McNeil BK, Aronoff SC, “Pertussis: Follow-up”, Emedicine, WebMD, 27 de abril de 2010.
- ↑ Altunaiji S.M., Kukuruzovic R.H., Curtis N.C., Massie J., “Antibiotics for whooping cough (pertussis)”, Cochrane database of systematic reviews (en línea) 2007. Editorial Group: Cochrane Acute Respiratory Infections Group. DOI: 10.1002/14651858.CD004404.pub3. Resumen disponible en [33].
- ↑ Heininger U., “Update on pertussis in children”, Expert Rev Anti Infect Ther, febrero de 2010, 8 (2): 163-173. DOI:10.1586/eri.09.124. Resumen disponible en [34] Consultado nuevamente en mayo de 2015.
- ↑ a b Zhang L., Prietsch S.O.M., Axelsson I., Halperin S.A., “Acellular vaccines for preventing whooping cough in children”, Grupo Editorial: Cochrane Acute Respiratory Infections Group , publicado en línea en marzo de 2012 y actualizado en enero del mismo año. DOI:10.1002/14651858.CD001478.pub5. Resumen disponible en [35].Consultado en mayo de 2015.
- ↑ a b World Health Organization, “Recommendations for whole-cell pertussis vaccine”, Annex 6 whole cell pertussis, WHO Technical Report Series Nº 941, 2007. Disponible en [36]. Consultado el 5 de junio de 2011.
- ↑ Center for Disease Control and Prevention, "Pertussis: Summary of Vaccine Recommendation", 5 de junio de 2011. Disponible en [37].
- ↑ a b Mooi F.R., van der Maas N.A.T. y de Melker H.E., “Pertussis resurgence: waning immunity and pathogen adaptation - two sides of the same coi”, Epidemiol Infect, abril de 2014, 142 (4):685-694. Publicado por primera vez en línea en febrero de 2013. DOI. Resumen disponible en [38].
- ↑ van der Ark A., Hozbor D.F., Boog C.J.P., Metz B., van den Dobbelsteen G.P.J.M. y van Els C.A.C.M., “Resurgence of pertussis calls for re-evaluation of pertussis animal models”, Expert Revs, septiembre de 2012, 11 (9):1121-1137. Disponible en [39]. Consultado en mayo de 2015.
- ↑ Versteegh F.G.A., Schellekens J.F.P., Fleer A., Roord J.J., “Pertussis: a concise historical review including diagnosis, incidence, clinical manifestations and the role of treatment and vaccination in management”, Rev Med Microbiol 2005, 16 (3):79-89. Resumen disponible en [40].
- ↑ a b MedlinePlus, “Vacuna contra DTaP (difteria, tétanos y tos ferina) - lo que usted necesita saber”, Enciclopedia médica en español, junio de 2008 (actualizado en junio de 2013). Disponible en [41]. Consultado el 16 de mayo de 2015.
- ↑ a b c Huber P., “Junk Science in the Courtroom”, Forbes, 8 de julio de 1991, p. 68, disponible en [42].
- ↑ Cherry, J.D., “Historical Perspective on Pertussis and Use of Vaccines to Prevent It: 100 years of pertussis (the cough of 100 days)”, Microbe Magazine, marzo de 2007. Disponible en [43]. Consultado en mayo de 2015.
- ↑ Cherry J.D.,"Pertussis Vaccine Encephalopathy': It Is Time to Recognize It as the Myth That It Is", JAMA 1990, 263(12):1679-1680. DOI:10.1001/jama.1990.03440120101046. Resumen disponible en [44]. Consultado en mayo de 2015.
- ↑ Geier D., Geier M., “The true story of pertussis vaccination: a sordid legacy?”, J Hist Med Allied Sci 2002, 57 (3):249-284. DOI:10.1093/jhmas/57.3.249. PMID 12211972. Disponible previo registro en [45].
- ↑ Gangarosa E.J., Galazka A.M., Wolfe C.R., Phillips L.M., Gangarosa R.E., Miller E. et al., “Impact of anti-vaccine movements on pertussis control: the untold story”, Lancet 1998, 351:356-361. PMID:9652634. DOI:10.1016/S0140-6736(97)04334-1. Disponible en [46] Archivado el 18 de abril de 2013 en Wayback Machine.. Consultado en mayo de 2015.
- ↑ Offit P.A., At last: Ignorance inoculation. How the Anti-Vaccine Movement Threatens Us All, revisado por Sobel R.K. en Philadelphia Inquirer el 22 de mayo de 2011. Disponible en [47]. Consultado en mayo de 2015.
- ↑ Evans G., “Update on vaccine liability in the United States: presentation at the National Vaccine Program Office Workshop on strengthening the supply of routinely recommended vaccines in the United States, 12 de febrero de 2002”, Clin. Infect. Dis. 2006, 42 (Suppl 3):S130-137. PMID:16447135. DOI:10.1086/499592. Resumen disponible en [48]. Artículo completo (en línea ISSN 1537-6591 - Impreso ISSN 1058-4838) disponible en [49] Archivado el 6 de agosto de 2014 en Wayback Machine.. Consultado en mayo de 2015.
- ↑ Smith M.H., “National Childhood Vaccine Injury Compensation Act”, Pediatrics 1988, 82 (2):264-269.
- ↑ Pichichero M.E., Rennels M.B., Edwards K.M., Blatter M.M., Marshall G.S., Bologa M. et al., "Combined tetanus, diphtheria, and 5-component pertussis vaccine for use in adolescents and adults”, JAMA, junio de 2005, 293 (24):3003-3011. Resumen disponible en [50].
Bibliografía[editar]
- Russell Martin. "Out of Silence", an autistic boy's journey into language and communication. Penguin Books; 1995. ISBN 0-14-024701-7
Enlaces externos[editar]
 Wikimedia Commons alberga una categoría multimedia sobre Tos ferina.
Wikimedia Commons alberga una categoría multimedia sobre Tos ferina.- Pertussis: new insights in diagnosis, incidence and clinical manifestations, F.G.A. Versteegh, Thesis, 2005
- PKIDS (Padres de niños con enfermedades infecciosas) y la Red Nacional de Salud Latina (NLHN) dirigen una Campaña educativa para informar a la comunidad hispana (o latina) acerca de los peligros de la tos ferina y la necesidad de inmunización de los adultos y los adolescentes para evitar la transmisión a los niños.
- Una tragedia que se puede evitar: una historia verdadera. CDC, American Academy of Family Physicians y American Academy of Pediatrics.
- Acalla los sonidos de la tos ferina. PKIDS.
