Euphausiacea
| Kril | ||
|---|---|---|
 | ||
| Taxonomía | ||
| Reino: | Animalia | |
| Filo: | Arthropoda | |
| Subfilo: | Crustacea | |
| Clase: | Malacostraca | |
| Superorden: | Eucarida | |
| Orden: |
Euphausiacea Dana, 1852 | |
| Familias y géneros | ||
| ||
Los eufausiáceos[n 1] (Euphausiacea) son un orden de crustáceos malacostráceos conocidos genéricamente como kril. Pueden encontrarse en todos los océanos del mundo, se alimentan sobre todo de fitoplancton y son un elemento fundamental de la cadena trófica de los ecosistemas oceánicos. En el océano Antártico, una especie, el kril antártico (Euphausia superba), constituye una biomasa estimada de alrededor de 379 000 000 de toneladas,[1] lo que la convierte en una de las especies con mayor biomasa del planeta, de la cual más de la mitad es consumida por ballenas barbadas, focas, pingüinos, calamares y peces cada año. La mayoría de las especies de eufausiáceos realizan grandes migraciones verticales diarias, lo que proporciona alimento a los depredadores cerca de la superficie por la noche y en aguas más profundas durante el día.
De comportamiento gregario, se agrupan en enormes cardúmenes que se extienden a lo largo de kilómetros con miles de individuos concentrados en un solo metro cúbico de agua, lo que los hace una especie idónea para su explotación comercial.[2] Se pesca comercialmente en el océano Antártico y en las aguas en torno a Japón. La captura total asciende a entre 150 000 y 200 000 toneladas anuales, la mayor parte de la cual proveniente del mar del Scotia. La mayoría se utiliza en la acuicultura, para la confección de alimento para acuarios, como cebo en la pesca deportiva o en la industria farmacéutica. En Japón, Filipinas y Rusia también se usa para el consumo humano.
Su nombre común en español proviene del inglés krill y este a su vez del noruego krill (alevín, pez pequeño).[3][4]
Taxonomía
[editar]Los eufausiáceos (Euphausiacea) son un orden de artrópodos incluidos dentro del gran subfilo Crustacea. El grupo con más familias y más numeroso de crustáceos, la clase Malacostraca, incluye el superorden Eucarida que comprende tres órdenes: Euphausiacea (kril), Decapoda (camarones, cangrejos, langostas) y Amphionidacea.
El orden se divide en dos familias. La más abundante es Euphausiidae, que contiene 10 géneros con un total de 86 especies;[5][6] de estos, el género Euphausia es el mayor, con 31 especies.[7][8] La familia menos conocida, Bentheuphausiidae, tiene una sola especie, Bentheuphausia amblyops, un kril batipelágico que vive en aguas por debajo de los 1000 m de profundidad y se considera la especie de kril más primitiva que existe.[9]
Las especies más conocidas, sobre todo por ser objeto de pesca comercial, son el kril antártico (Euphausia superba), el kril del Pacífico (Euphausia pacifica) y el kril del norte (Meganyctiphanes norvegica).[10]
Filogenia
[editar]| Propuesta de filogenia de Euphausiacea[11] | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
|
El taxón marcado (♣) posiblemente parafilético debido a Nematobrachion. Los marcados (♦) difieren de Casanova (1984),[12] donde Pseudoeuphausia es hermano de Nyctiphanes, Euphausia es hermano de Thysanopoda y Nematobrachion es hermano de Stylocheiron. |
Se cree que el orden Euphausiacea es monofilético debido a que conserva varias características morfológicas únicas (autoapomorfia), como branquias filamentosas desnudas y toracópodos delgados,[13] y por estudios moleculares.[14][15][16]
Ha habido muchas propuestas sobre la ubicación del orden Euphausiacea. Desde la primera descripción de Thysanopode tricuspide realizada por Henri Milne-Edwards en 1830, la similitud de sus toracópodos birrámeos había llevado a los zoólogos a agrupar a los eufausiáceos y misidáceos (Mysidacea) en el orden Schizopoda, que fue dividido por Boas en 1883 en dos órdenes separados.[17] En 1904 William Thomas Calman clasificó los misidáceos en el superorden Peracarida y los eufausiáceos en el superorden Eucarida, aunque hasta la década de 1930 se abogó por el orden Schizopoda.[13] Posteriormente también se propuso que el orden Euphausiacea debería agruparse con Penaeidae (familia de langostinos) en Decapoda con base en sus similitudes de desarrollo, tal como lo consideraron Robert Gurney e Isabella Gordon.[18][19] La razón de este debate es que el kril comparte algunas características morfológicas de los decápodos y otras de los misidáceos.[13]
Los estudios moleculares no hay permitido su agrupación de manera inequívoca, posiblemente debido a la escasez de especies clave escasas como Bentheuphausia amblyops en Euphausiacea y Amphionides reynaudii en Eucarida. Un estudio apoya la monofilia de Eucarida (con el orden Mysida basal),[20] otros agrupan Euphausiacea con Mysida (Schizopoda),[15] mientras que otros agrupan Euphausiacea con Hoplocarida.[21]
Ningún fósil existente puede asignarse inequívocamente a Euphausiacea. Se ha considerado que algunos taxones eumalacostráceos extintos podrían ser eufausiáceos, como Anthracophausia, Crangopsis —actualmente asignado a Aeschronectida (Hoplocarida)—[11] o Palaeomysis.[22] Todas las fechas de los procesos de especiación se estimaron mediante la técnica de reloj molecular, que ubicaron al último ancestro común de la familia de krils Euphausiidae (orden Euphausiacea menos Bentheuphausia amblyops) como que vivió en el Cretácico inferior hace unos 130 millones de años.[15]
Distribución
[editar]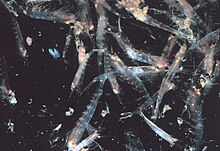
El kril se encuentra en todos los océanos del mundo, aunque muchas especies individuales tienen una distribución endémica o nerítica. Bentheuphausia amblyops, una especie batipelágica, tiene una distribución cosmopolita dentro de su hábitat en aguas profundas.[23]
Las especies del género Thysanoessa se encuentran en los océanos Atlántico y Pacífico.[24] Meganyctiphanes norvegica se distribuye por el Atlántico, desde una zona aproximadamente a la altura del Mediterráneo hacia el norte. Euphausia pacifica se distribuye por el océano Pácífico.
Entre las especies con distribuciones neríticas están las cuatro del género Nyctiphanes;[25] son muy abundantes a lo largo de las regiones de surgencia de las corrientes marinas de California, Humboldt, Benguela y Canarias.[26][27][28] Otra especie que solo tiene distribución nerítica es Euphausia crystallorophias, endémica de la costa antártica.[29]
Entre las especies con distribuciones endémicas están Nyctiphanes capensis, que se encuentra solo en la corriente de Benguela,[25] Euphausia mucronata en la corriente de Humboldt,[30] y las seis especies de Euphausia, nativas del océano Antártico.
En la Antártida se conocen siete especies,[31] una en el género Thysanoessa (T. macrura) y seis en Euphausia. El kril antártico (Euphausia superba) vive generalmente a profundidades que alcanzan los 100 m,[32] mientras que Euphausia crystallorophias puede alcanzar una profundidad de 4000 m, aunque por lo general viven a profundidades de 300-600 m como máximo.[33] Ambos se encuentran en latitudes de 55°S, con E. crystallorophias preferentemente al sur de 74°S[34] y en regiones de hielo a la deriva. Otras especies conocidas en el océano Antártico son E. frigida, E. longirostris, E. triacantha y E. vallentini.[35]
Anatomía y morfología
[editar]
Como crustáceos, los eufausiáceos tiene un exoesqueleto quitinoso compuesto por tres tagmas: el céfalon (cabeza), el pereion (fusionado al cefalón para formar un cefalotórax) y el pleon; esta capa exterior es transparente en la mayoría de las especies. Como todos los eucáridos, tienen el cuerpo dividido en cinco segmentos cefálicos, ocho torácicos y seis abdominales.[6] Disponen de complejos ojos compuestos. Excepto en el caso del género Thysanoessa que cuenta con especies con diversos tipos de ojos, todas las demás especies de un mismo género tienen los ojos o bien redondos o bien bilobulados; la forma y tamaño de los ojos puede ser un factor importante para definir una especie.[6] Cuentan con dos pares de antenas: el par de antenas superiores, las anténulas, están formadas por un pedúnculo antenular de tres segmentos y un par de flagelos antenulares compuestos por múltiples segmentos; las antenas en posición inferior consisten en un segmento basal con una escama y un pedúnculo antenal formado por dos segmentos y terminado en un largo flagelo.[6] Tienen varios pares de patas torácicas en la parte ventral denominadas pereiopodos o toracópodos, por estar unidos al tórax; su número varía entre los distintos géneros y especies. Estas patas torácicas incluyen patas de alimentación y patas de aseo. Todas las especies cuentan con seis segmentos articulados: un telsón con urópodos en el extremo posterior y cinco pares de patas de natación ventrales llamadas pleópodos, muy similares a los de una langosta o los cangrejos de río. La mayoría de las especies tienen una longitud aproximada de 1-2 cm en su etapa adulta, aunque algunos alcanzan tamaños de 6-15 cm. La especie de mayor tamaño es la batipelágica Thylopoda spinicauda.[36] El kril se puede distinguir fácilmente de otros crustáceos similares, como las gambas y otros decápodos, por sus branquias externas visibles en el margen exterior de la coxa.[37][6]

A excepción de Bentheuphausia amblyops y Thysanopoda minyops todas las especies de kril son bioluminiscentes gracias a unos órganos de gran tamaño denominados fotóforos que pueden emitir luz.[6] La luz se genera mediante una reacción de quimioluminiscencia catalizada por enzimas, que activa una luciferina (un tipo de pigmento) mediante una enzima luciferasa. Algunos estudios indican que la luciferina de muchas especies es un tetrapirrol fluorescente similar, aunque no idéntica a la de los dinoflagelados[38] y que el kril probablemente no produzca esta sustancia por sí mismo, sino que la adquiere porque estos organismos forman parte de su dieta.[39] Los fotóforos del kril son órganos complejos con lentes y capacidad de enfoque y que pueden rotarse con los músculos.[40] La función precisa de estos órganos se desconoce, aunque se cree que pueden estar relacionados con el apareamiento, interacción u orientación social y como una forma de camuflaje de contrailuminación para compensar su sombra contra la luz ambiente proveniente de la superficie.[6][41][42]
Ecología
[editar]La mayoría de las especies de kril se alimentan por filtración;[27] sus apéndices anteriores, los toracópodos o patas torácicas, cuentan con unos pelillos muy finos con los que pueden filtrar su comida del agua. Estos filtros pueden ser muy efectivos en aquellas especies (como Euphausia spp.) que se alimentan principalmente de fitoplancton, en particular en diatomeas (algas unicelulares) y dinoflagelados. La mayoría omnívoros, aunque algunas especies son herbívoras y otras carnívoras y se alimentan de huevos y larvas de peces, copépodos y otro zooplancton y también detrito.[43][44][6] Algunos estudios indican que no tienen un único tipo de alimentación, sino que se acomodan de forma natural a la comida que les es accesible en cada momento, pudiendo cambiar en periodos de tiempo corto de una dieta estrictamente herbívora a una omnívora o carnívora.[6]
Su pequeño tamaño y su alimentación hacen del kril un elemento fundamental de la cadena trófica de los ecosistemas oceánicos, pues convierte la producción primaria que constituye su dieta en una forma adecuada para el consumo de animales más grandes que no pueden alimentarse directamente del plancton.[44][6] Muchos animales se alimentan de estos pequeños crustáceos, desde animales más pequeños como peces o pingüinos, hasta animales más grandes como focas y ballenas barbadas.[45] Las formas larvarias de kril se consideran generalmente parte del zooplancton.[46][6]
Las alteraciones de un ecosistema que provoquen una disminución en la población de kril pueden tener efectos de gran alcance. Por ejemplo, durante una proliferación de cocolitóforos en el mar de Bering en 1998,[47] la concentración de diatomeas disminuyó en el área afectada. Como el kril no puede alimentarse de cocolitóforos, su población (principalmente E. pacifica) en esa región disminuyó drásticamente, lo que afectó a otras especies como las pardelas que tuvo un gran descenso de población. Se cree también que el incidente fue uno de los motivos por los que el salmón no se reprodujo esa temporada.[48]
El cambio climático supone otra amenaza para las poblaciones de kril.[49][50][51] Varios ciliados endoparásitos unicelulares del género Collinia pueden infectar especies de kril y devastar las poblaciones afectadas. Existen informes de estas enfermedades en Thysanoessa inermis en el mar de Bering y también para E. pacifica, Thysanoessa spinifera y T. gregaria frente a la costa del Pacífico de América del Norte.[52] Algunos ectoparásitos de la familia Dajidae (isópodos epicarideanos) afectan al kril (y también a gambas y mísidos); uno de estos parásitos es Oculophryxus bicaulis, que se encontró en el kril Stylocheiron affine y S. longicorne. Este parásito se adhiere al pedúnculo de los ojos del animal y absorbe la sangre de su cabeza; aparentemente inhibe la reproducción del huésped, ya que ninguno de los animales afectados alcanzó la madurez.[53]
La especie está amenazada por la pesca indiscriminada. Según estudios publicados en la Convención para la Conservación de Recursos Vivos Marinos Antárticos (CCRVA), las captura de kril pasaron de 104 728 toneladas en 2007 a 415 508 en 2022.[54]
Ciclo vital y comportamiento
[editar]
El ciclo de vida del kril está relativamente bien estudiado, a pesar de pequeñas variaciones en los detalles de una especie a otra.[18][27] Después de la eclosión, experimentan varios estadios larvales: nauplio, pseudometanauplio, metanauplio, calyptopis y furcilia, cada uno de los cuales se divide en subetapas. La etapa pseudometanauplio es exclusiva de las especies que ponen sus huevos dentro de un saco ovígero (ovisaco o saco de cría). Las larvas crecen y mudan a medida que se desarrollan, reemplazando su rígido exoesqueleto cuando se vuelve demasiado pequeño. Las reservas de yema dentro de su cuerpo nutren a las larvas a través de la etapa metanauplio. Durante la calyptopis el proceso de diferenciación celular ya ha progresado lo suficiente como para desarrollar la boca y un tracto digestivo y comienzan a comer fitoplancton; en ese momento sus reservas de yema ya se han agotado y las larvas deben haber alcanzado la zona fótica, las capas superiores del océano donde penetra el sol y florecen las algas. Las etapas del estadio furcilia, donde ya son parecidos a adultos de pequeño tamaño, se caracterizan por la adición de segmentos y la emergencia y desarrollo de pleópodos abdominales, comenzando en los segmentos delanteros. Posteriormente desarrolla gónadas y madura sexualmente.[6][55][56][57]
Los sexos están diferenciados y el apareamiento probablemente se realiza mediante la transferencia de uno o dos espermatóforos por parte del macho introduciendo su petasma (órgano de transferencia, modificación de los endopoditos del primer par de pleópodos) en el télico (apertura genital, modificación de la parte ventral del cefalotórax a la altura del 3.º, 4.º y 5.º par de pereiópodos) de la hembra. No hay constancia de observaciones de la cópula del kril, pero probablemente se produce durante la noche y se completa en unos segundos.[6] Las hembras pueden llevar varios miles de huevos, que con el tiempo pueden alcanzar hasta un tercio de la masa corporal del animal.[58] Pueden tener múltiples crías en una sola temporada, con intervalos entre cruces que duran del orden de días.[28][59]

Utilizan dos tipos de mecanismo de desove.[28] Las 57 especies de los géneros Bentheuphausia, Euphausia, Meganyctiphanes, Thysanoessa y Thysanopoda son «reproductores por difusión»: la hembra libera los huevos fertilizados en el agua, donde generalmente se hunden, se dispersan y son abandonados. Estas especies liberan de 40 a 500 huevos por puesta, dependiendo de la especie y el tamaño de la hembra, y generalmente eclosionan en la etapa de nauplio 1, pero recientemente se ha descubierto que eclosionan a veces como metanauplio o incluso como etapas de calyptopis;[60][6] Las 29 especies restantes de los otros géneros son «reproductores de saco», donde la hembra lleva los huevos con ella, unidos a los pares posteriores de los toracópodos hasta que eclosionan como metanauplio, aunque algunas especies como Nematoscelis difficilis pueden hacerlo como nauplio o pseudometanauplio.[61]
Los juveniles, que crecen más rápido, mudan más a menudo que los mayores y lo de mayor tamaño. El número de mudas varía entre especies, o incluso dentro de la misma especie dependiendo de la zona, la época y las condiciones ambientales;[6] está sujeta a muchos factores externos, como la latitud, la temperatura del agua y la disponibilidad de alimentos, por lo que la tasa de muda varía estacionalmente.[62] La especie subtropical Nyctiphanes simplex, por ejemplo, tiene un período entre mudas de dos a siete días: las larvas mudan cada cuatro días por término medio, mientras que los juveniles y los adultos lo hacen, de media, cada seis días. Para E. superba en el mar antártico, se han observado períodos entre mudas que van de 9 a 28 días, dependiendo de temperaturas entre –1 y 4 °C, y para Meganyctiphanes norvegica en el mar del Norte los periodos intermuda también varían entre 9 y 28 días, pero a temperaturas entre 2,5 y 15 °C.[63] E. superba puede reducir su tamaño corporal cuando no hay suficiente comida disponible, mudando también cuando su exoesqueleto se vuelve demasiado grande.[64] También se ha observado una reducción similar en E. pacifica, una especie que se encuentra en el océano Pacífico desde zonas polares a templadas, como una adaptación a temperaturas anormalmente altas del agua. La reducción de tamaño también se ha comprobado en otras especies de kril de zonas templadas.[65]
El ciclo de muda consta de procesos de formación de la cutícula y su resorción, estos mecanismos se encuentran regulados por diferentes genes, entre los que se han determinado familias génicas pertenecientes a dominios de unión a ATP, en particular, genes de miosina por lo que participan en contracciones musculares asociadas a la reducción del tamaño corporal en invierno.[62]
Esperanza de vida
[editar]Algunas especies de kril de latitudes elevadas, como Euphausia superba, pueden vivir más de seis años;[66][67] otras, como la especie de latitud media Euphausia pacifica, viven solo durante dos años.[68][10] La longevidad de las especies subtropicales o tropicales es todavía más corta; por ejemplo, Nyctiphanes simplex generalmente vive solo de seis a ocho meses.[69]
Gregarismo
[editar]La mayoría de las especies de kril son gregarias; el tamaño y densidad de los cardúmenes varía según la especie y la región. En el caso de Euphausia superba, alcanzan un tamaño de 10 000 a 60 000 individuos por metro cúbico.[70][71] El agrupamiento es un mecanismo de defensa, que le ayuda a confundir a pequeños depredadores que busquen presas individuales. En 2012 se presentó lo que parece ser un algoritmo estocástico exitoso para modelar el comportamiento de los enjambres de kril. El algoritmo se basa en tres factores principales: «(i) movimiento inducido por la presencia de otros individuos (ii) actividad de alimentación, y (iii) difusión aleatoria».[72]
Migración vertical
[editar]Fundamentalmente para alimentarse, la mayor parte de especies de kril sigue un patrón de migración vertical diaria; pasan el día a mayor profundidad y suben durante la noche hacia la superficie, a menudo desplazándose más de 200 m.[6] Cuanto más profundo van, más reducen su actividad, aparentemente para reducir los encuentros con depredadores y conservar energía.[73] Su actividad natatoria varía en función de la cantidad de alimento ingerido; los individuos saciados que se habían alimentado en la superficie nadan menos activamente y se hunden hasta la zona mixta.[74] A medida que se hunden producen heces, desempeñando así un papel en el ciclo del carbono antártico. Los individuos con el estómago vacío nadan más activamente y se dirigen hacia la superficie. La migración vertical puede producirse 2 a 3 veces al día. Algunas especies, como Euphausia superba, E. pacifica, E. hanseni, Pseudeuphausia latifrons y Thysanoessa spinifera, forman cardúmenes de superficie durante el día con fines alimenticios y reproductivos, aunque este comportamiento los hace extremadamente vulnerables a los depredadores.[75] Los densos cardúmenes que forman pueden provocar un frenesí de alimentación entre peces, aves y mamíferos depredadores, especialmente cerca de la superficie. Cuando se lo molesta, el cardumen se dispersa e incluso se ha observado que algunos individuos mudan espontáneamente, dejando atrás la exuvia como señuelo.[76]

Normalmente nadan a un ritmo de 5-10 cm/s (2-3 veces su tamaño corporal por segundo),[77] usando sus Pleópodos natatorios para la propulsión. Sus grandes migraciones están sujetas a las corrientes oceánicas. Cuando se sienten en peligro, reaccionan con un comportamiento de huida, sacudiendo sus estructuras caudales, el telson y los urópodos, moviéndose hacia atrás a través del agua con relativa rapidez, alcanzando velocidades de 10 a 27 veces la longitud corporal por segundo, que un kril grande como E. superba significa alrededor de 0,8 m/s.[78] Su rendimiento natatorio ha llevado a muchos investigadores a clasificar el kril adulto como formas de vida micro-nectónicas, es decir, pequeños animales capaces de movimiento individual contra corrientes (débiles).[46]
Como recurso económico
[editar]
El kril se ha criado artificialmente como una fuente de alimento para humanos y animales domésticos desde al menos el siglo XIX, y posiblemente antes en Japón, donde se lo conocía como okiami. Su pesca a gran escala se desarrolló a fines de la década de 1960 y principios de la de 1970, y actualmente solo en aguas antárticas y en los mares en torno a Japón. Históricamente, las naciones con mayor volumen de captura de kril fueron Japón y la Unión Soviética o, tras su disolución, Rusia y Ucrania.[79] La pesca alcanzó su punto máximo, que en 1983 era de aproximadamente 528 000 toneladas solo en el océano Antártico (de la cual la Unión Soviética suponía el 93 %), actualmente se gestiona con precaución para evitar la sobrepesca.[80]
En 1993, dos hechos provocaron una disminución de la pesca de kril: Rusia abandonó la industria y la Convención para la Conservación de Recursos Vivos Marinos Antárticos (CCRVMA) estableció unos cupos máximos de captura para una explotación sostenible del kril antártico. Tras una revisión de octubre de 2011, la Convención decidió no modificar la cuota.[81]
La captura anual en la zona antártica se estabilizó en torno a las 200 000 toneladas, muy por debajo de la cuota de captura establecida por la CCRVMA de 5,6 millones de toneladas.[80] El principal factor limitante fue probablemente los altos costos junto con cuestiones políticas y legales.[82] En 2014 Japón y Rusia ya no se dedicaban a la pesca del kril, y los países con mayores capturas fueron Noruega, con 165 899 t (58 % del total); Corea del Sur, con 55 414 t (19 %); y China, con 54 303 t (10 %).[83]
Aunque la biomasa total del kril antártico puede alcanzar los 400 millones de toneladas, el impacto humano en esta especie clave está creciendo, con un aumento del 39 % en su captura, que pasó de 212 000 a 294 000 toneladas durante el período 2010-2014.[83]
Se encuentra en todos los océanos del mundo, pero se prefiere su pesca en los océanos meridionales porque es más abundante y fácil de capturar en estas regiones. Dado que los mares antárticos se consideran prístinos, el kril está considerado un «producto limpio».[79]
Consumo humano
[editar]El kril es una fuente rica en proteínas y ácidos grasos omega-3 es también rico en el antioxidante llamado astaxantina, por lo que a principios del siglo XXI está incrementándose su explotación para el consumo humano, como suplementos dietéticos como cápsulas de aceite, alimento para el ganado y alimento para mascotas.[79][81][84] Tiene un sabor salado, similar al pescado, algo más fuerte que el camarón. Para su consumo masivo como productos preparados comercialmente, deben pelarse para eliminar su exoesqueleto no comestible.[84]
En 2011 la Administración de Alimentos y Medicamentos de los Estados Unidos publicó un informe de no objeción para que un producto manufacturado de aceite de kril fuera reconocido como generalmente seguro para el consumo humano.[85]
Notas y referencias
[editar]- Notas
- ↑ Respecto al nombre común del orden Euphausiacea, varía según los autores, utilizándose «eufausiáceos», «eufáusidos» o «eufásidos».
- Referencias
- ↑ Atkinson, A.; Siegel, V.; Pakhomov, E. A.; Jessopp, M. J.; Loeb, V. (2009). «A re-appraisal of the total biomass and annual production of Antarctic krill». Deep-Sea Research I 56: 727-740. doi:10.1016/j.dsr.2008.12.007.
- ↑ Werner, R. (2015). «Pingüinos y kril: la vida en un océano cambiante». Journal de Asuntos Antárticos 1: 37-48. Archivado desde el original el 17 de enero de 2016. Consultado el 13 de marzo de 2016.
- ↑ Real Academia Española. «kril». Diccionario de la lengua española (23.ª edición).
- ↑ «Krill». Online Etymology Dictionary. Consultado el 31 de octubre de 2017.
- ↑ «Euphausiidae (TSN 95500)». Sistema Integrado de Información Taxonómica (en inglés).
- ↑ a b c d e f g h i j k l m n ñ o Guglielmo, Letterio; Granata, Antonia; Guglielmo, Rosanna (2015). «Orden Euphausiacea». Ibero Diversidad Entomológica (Sociedad Entomológica Aragonesa) (86A): 1-20. ISSN 2386-7183.
- ↑ «Euphausia (TSN 95501)». Sistema Integrado de Información Taxonómica (en inglés).
- ↑ Siegel, Volker (2017). «Euphausiidae Dana, 1852». World Euphausiacea database. Registro Mundial de Especies Marinas. Consultado el 1 de noviembre de 2017.
- ↑ Brinton, Edward (1962). «The distribution of Pacific euphausiids». Bulletin of the Scripps Institution of Oceanography 8 (2): 51-270.
- ↑ a b Nicol, S.; Endo, Y. (1999). «Krill fisheries: Development, management and ecosystem implications». Aquatic Living Resources 12 (2): 105-120. doi:10.1016/S0990-7440(99)80020-5.
- ↑ a b Maas, Andreas; Waloszek, Dieter (2001). «Larval development of Euphausia superba Dana, 1852 and a phylogenetic analysis of the Euphausiacea». Hydrobiologia 448: 143-169. doi:10.1023/A:1017549321961. Archivado desde el original el 18 de julio de 2011.
- ↑ Casanova, Bernadette (1984). «Phylogénie des Euphausiacés (Crustacés Eucarides)» [Phylogeny of the Euphausiacea (Crustacea: Eucarida)]. Bulletin du Muséum National d'Histoire Naturelle (en francés) 4: 1077-1089.
- ↑ a b c Casanova, Bernadette (2003). «Ordre des Euphausiacea Dana, 1852». Crustaceana 76 (9): 1083-1121. JSTOR 20105650. doi:10.1163/156854003322753439.
- ↑ D'Amato, M. Eugenia; Harkins, Gordon W.; de Oliveira, Tulio; Teske, Peter R.; Gibbons, Mark J. (2008). «Molecular dating and biogeography of the neritic krill Nyctiphanes». Marine Biology 155 (2): 243-247. doi:10.1007/s00227-008-1005-0. Archivado desde el original el 17 de marzo de 2012. Consultado el 1 de noviembre de 2017.
- ↑ a b c Jarman, Simon N. (2001). «The evolutionary history of krill inferred from nuclear large subunit rDNA sequence analysis». Biological Journal of the Linnean Society 73 (2): 199-212. doi:10.1111/j.1095-8312.2001.tb01357.x.
- ↑ Shen, Xin; Wang, Haiqing; Wang, Minxiao; Liu, Bin (2011). «The complete mitochondrial genome sequence of Euphausia pacifica (Malacostraca: Euphausiacea) reveals a novel gene order and unusual tandem repeats». Genome 54 (11): 911-922. PMID 22017501. doi:10.1139/g11-053.
- ↑ Boas, Johan Erik Vesti (1883). «Studien über die Verwandtschaftsbeziehungen der Malakostraken». Morphologisches Jahrbuch (en alemán) 8: 485-579.
- ↑ a b Gurney, Robert (1942). Larvae of Decapod Crustacea. Ray Society.
- ↑ Gordon, Isabella (1955). «Systematic position of the Euphausiacea». Nature 176 (4489): 934. Bibcode:1955Natur.176..934G. doi:10.1038/176934a0.
- ↑ Spears, Trisha; DeBry, Ronald W.; Abele, Lawrence G.; Chodyl, Katarzyna (2005). «Peracarid monophyly and interordinal phylogeny inferred from nuclear small-subunit ribosomal DNA sequences (Crustacea: Malacostraca: Peracarida)». Proceedings of the Biological Society of Washington 118 (1): 117-157. doi:10.2988/0006-324X(2005)118[117:PMAIPI]2.0.CO;2.
- ↑ Meland, K.; Willassen, E. (2007). «The disunity of “Mysidacea” (Crustacea)». Molecular Phylogenetics and Evolution 44 (3): 1083-1104. PMID 17398121. doi:10.1016/j.ympev.2007.02.009.
- ↑ Schram, Frederick R. (1986). Crustacea. Oxford University Press. ISBN 0-19-503742-1.
- ↑ Torres, J. J.; Childress, J. J. (1985). «Respiration and chemical composition of the bathypelagic euphausiid Bentheuphausia amblyops». Marine Biology 87 (3): 267-272. doi:10.1007/BF00397804.
- ↑ Siegel, Volker (2017). «Thysanoessa Brandt, 1851». World Euphausiacea database. Registro Mundial de Especies Marinas. Consultado el 1 de noviembre de 2017.
- ↑ a b D'Amato, M. Eugenia; Harkins, G. W.; de Oliveira, Tulio; Teske, Peter R.; Gibbons, Mark J. (2008). «Molecular dating and biogeography of the neritic krill Nyctiphanes». Marine Biology 155 (2): 243-247. doi:10.1007/s00227-008-1005-0. Archivado desde el original el 17 de marzo de 2012. Consultado el 1 de noviembre de 2017.
- ↑ Siegel, Volker (2010). «Nyctiphanes Sars, 1883». World Euphausiacea database. Registro Mundial de Especies Marinas. Consultado el 1 de noviembre de 2017.
- ↑ a b c Mauchline, J.; Fisher, L. R. (1969). The Biology of Euphausiids. Advances in Marine Biology 7. Academic Press. ISBN 978-7-7708-3615-2.
- ↑ a b c Gómez-Gutiérrez, Jaime; Robinson, Carlos J. (2005). «Embryonic, early larval development time, hatching mechanism and interbrood period of the sac-spawning euphausiid Nyctiphanes simplex Hansen». Journal of Plankton Research 27 (3): 279-295. doi:10.1093/plankt/fbi003.
- ↑ Jarman, S. N.; Elliott, N. G.; Nicol, S.; McMinn, A. (2002). «Genetic differentiation in the Antarctic coastal krill Euphausia crystallorophias». Heredity 88 (4): 280-287. PMID 11920136. doi:10.1038/sj.hdy.6800041.
- ↑ Escribano, R.; Marin, V.; Irribarren, C. (2000). «Distribution of Euphausia mucronata at the upwelling area of Peninsula Mejillones, northern Chile: the influence of the oxygen minimum layer». Scientia Marina 64 (1): 69-77. doi:10.3989/scimar.2000.64n169.
- ↑ Brueggeman, Peter (1998). Ice krillEuphausia crystallorophias. «Arthropoda - Other: copepods, krill, ostracods, mysids, tanaids, barnacles, shrimp, etc.». Underwater Field Guide to Ross Island & McMurdo Sound, Antarctica (University of California, San Diego). Archivado desde el original el 14 de marzo de 2017. Consultado el 1 de noviembre de 2017.
- ↑ «Krill, Euphausia superba». MarineBio. Consultado el 1 de noviembre de 2017.
- ↑ Kirkwood, J. A. (1984). «A Guide to the Euphausiacea of the Southern Ocean». ANARE Research Notes 1: 1-45.
- ↑ Sala, A.; Azzali, M.; Russo, A. (2002). «Krill of the Ross Sea: distribution, abundance and demography of Euphausia superba and Euphausia crystallorophias during the Italian Antarctic Expedition (January-February 2000)». Scientia Marina 66 (2): 123-133. doi:10.3989/scimar.2002.66n2123.
- ↑ Hosie, G. W.; Fukuchi, M.; Kawaguchi, S. (2003). «Development of the Southern Ocean Continuous Plankton Recorder survey». Progress in Oceanography 58 (2-4): 263-283. doi:10.1016/j.pocean.2003.08.007.
- ↑ Brinton, E. (1953). «Thysanopoda spinicauda, a new bathypelagic giant euphausiid crustacean, with comparative notes on T. cornuta and T. egregia». Journal of the Washington Academy of Sciences 43: 408-412.
- ↑ «Euphausiacea». Institute for Marine and Antarctic Studies. University of Tasmania. Consultado el 2 de noviembre de 2017.
- ↑ Shimomura, O. (1995). «The roles of the two highly unstable components F and P involved in the bioluminescence of euphausiid shrimps». Journal of Bioluminescence and Chemiluminescence 10 (2): 91-101. PMID 7676855. doi:10.1002/bio.1170100205.
- ↑ Dunlap, J. C.; Hastings, J. W.; Shimomura, O. (1980). «Crossreactivity between the light-emitting systems of distantly related organisms: novel type of light-emitting compound». Proceedings of the National Academy of Sciences 77 (3): 1394-1397. JSTOR 8463. PMC 348501. PMID 16592787. doi:10.1073/pnas.77.3.1394.
- ↑ Herring, P. J.; Widder, E. A. (2001). «Bioluminescence in Plankton and Nekton». En Steele, J. H.; Thorpe, S. A.; Turekian, K. K., eds. Encyclopedia of Ocean Science 1. San Diego: Academic Press. pp. 308-317. ISBN 0-12-227430-X.
- ↑ Lindsay, S. M.; Latz, M. I. (1999). Experimental evidence for luminescent countershading by some euphausiid crustaceans. American Society of Limnology and Oceanography (ASLO) Aquatic Sciences Meeting. Santa Fe.
- ↑ Johnsen, Sönke (2005). «The Red and the Black: bioluminescence and the color of animals in the deep sea». Integrative and Comparative Biology 4 (2): 234-246. doi:10.1093/icb/45.2.234.
- ↑ Cripps, G. C.; Atkinson, A. (2000). «Fatty acid composition as an indicator of carnivory in Antarctic krill, Euphausia superba». Canadian Journal of Fisheries and Aquatic Sciences 57 (S3): 31-37. doi:10.1139/f00-167.
- ↑ a b Saether, Olav; Ellingsen, Trond Erling; Mohr, Viggo (1986). «Lipids of North Atlantic krill». Journal of Lipid Research 27 (3): 274-285. PMID 3734626.
- ↑ Schramm, Mary Jane (31 de julio de 2017). «Tiny Krill: Giants in Marine Food Chain». National Marine Sanctuaries. National Oceanic & Atmospheric Administration. Consultado el 4 de noviembre de 2017.
- ↑ a b Nicol, S.; Endo, Y. (1997). «Krill Fisheries of the World». FAO Fisheries Technical Paper 367.
- ↑ Weier, J. (30 de marzo de 1999). «Changing currents color the Bering Sea a new shade of blue». Earth Observatory. National Oceanic and Atmospheric Administration. Consultado el 4 de noviembre de 2017.
- ↑ Brodeur, R. D. et al. (1998). Draft Report of the FOCI International Workshop on Recent Conditions in the Bering Sea. National Oceanic and Atmospheric Administration. pp. 22-26.
- ↑ Piñones, A.; Fedorov, A. V. (2016). «Projected changes of Antarctic krill habitat by the end of the 21st century». Geophysical Research Letters 43 (16): 8580-8589. doi:10.1002/2016GL069656.
- ↑ «La disminución de krill en el océano, a causa del cambio climático, amenaza a poblaciones de animales como pingüinos y focas». Consejo Superior de Investigaciones Científicas. 19 de julio de 2013. Consultado el 4 de noviembre de 2017.
- ↑ Dornin, Rusty (6 de julio de 1997). «Antarctic krill populations decreasing». CNN. Consultado el 4 de noviembre de 2017.
- ↑ Gómez-Gutiérrez, J.; Peterson; de Robertis, A.; Brodeur, R. D. (2003). «Mass mortality of krill caused by parasitoid ciliates». Science 301 (5631): 339. PMID 12869754. doi:10.1126/science.1085164. Resumen divulgativo – National Geographic (17 de julio de 2003).
- ↑ Shields, J. D.; Gómez-Gutiérrez, J. (1996). «Oculophryxus bicaulis, a new genus and species of dajid isopod parasitic on the euphausiid Stylocheiron affine Hansen». International Journal for Parasitology 26 (3): 261-268. doi:10.1016/0020-7519(95)00126-3.
- ↑ «Pesca de krill: animales pequeños, grandes preocupaciones». El País América. 12 de noviembre de 2023. Consultado el 14 de noviembre de 2023.
- ↑ Knight, M. D. (1984). «Variation in larval morphogenesis within the Southern California Bight population of Euphausia pacifica from Winter through Summer, 1977-1978». CalCOFI Report XXV. Archivado desde el original el 3 de agosto de 2019. Consultado el 5 de noviembre de 2017.
- ↑ «Euphausia superba». Species factsheet. Food and Agriculture Organization. Consultado el 5 de noviembre de 2017.
- ↑ Ros Pérez, M. M.; Lozano Soldevilla, F. (1986). «Contribución al conocimiento de los eufausiaceos (euphausiacea: Euphausiidae) de la Isla de Tenerife. Estudio de las fases larvarias calyptopis y furcilia». Vieraea: Folia scientarum biologicarum canariensium (16): 27-34. ISSN 0210-945X.
- ↑ Ross, R. M.; Quetin, L. B. (1986). «How productive are Antarctic krill?». BioScience 36 (4): 264-269. JSTOR 1310217. doi:10.2307/1310217.
- ↑ Cuzin-Roudy, Janine (2000). «Seasonal reproduction, multiple spawning, and fecundity in northern krill, Meganyctiphanes norvegica, and Antarctic krill, Euphausia superba». Canadian Journal of Fisheries and Aquatic Sciences 57 (S3): 6-15. doi:10.1139/f00-165.
- ↑ Gómez-Gutiérrez, J. (2002). «Hatching mechanism and delayed hatching of the eggs of three broadcast spawning euphausiid species under laboratory conditions». Journal of Plankton Research 24 (12): 1265-1276. doi:10.1093/plankt/24.12.1265.
- ↑ Brinton, E.; Ohman, M. D.; Townsend, A. W.; Knight, M. D.; Bridgeman, A. L. (2000). Euphausiids of the World Ocean. World Biodiversity Database CD-ROM Series, Springer Verlag. ISBN 3-540-14673-3.
- ↑ a b Shao, Changwei; Sun, Shuai; Liu, Kaiqiang; Wang, Jiahao; Li, Shuo; Liu, Qun; Deagle, Bruce E.; Seim, Inge et al. (2023). «The enormous repetitive Antarctic krill genome reveals environmental adaptations and population insights». Cell (en inglés) 186 (6): 1279-1294.e19. doi:10.1016/j.cell.2023.02.005. Consultado el 23 de diciembre de 2023.
- ↑ Buchholz, F. (2003). «Experiments on the physiology of Southern and Northern krill, Euphausia superba and Meganyctiphanes norvegica, with emphasis on moult and growth - a review». Marine and Freshwater Behaviour and Physiology 36 (4): 229-247. doi:10.1080/10236240310001623376.
- ↑ H.-C. Shin; S. Nicol (2002). «Using the relationship between eye diameter and body length to detect the effects of long-term starvation on Antarctic krill Euphausia superba». Marine Ecology Progress Series 239: 157-167. doi:10.3354/meps239157.
- ↑ Marinovic, B.; Mangel, M. (1999). «Krill can shrink as an ecological adaptation to temporarily unfavourable environments». Ecology Letters 2: 338-343.
- ↑ Ikeda, T.; Thomas, P.C. (1987). «Longevity of the Antarctic krill (Euphausia superba Dana) based on a laboratory experiment». Proceedings of the NIPR Symposium on Polar Biology 1: 56-62.
- ↑ «Euphausia superba Antarctic krill». Animal Diversity Web. Museum of Zoology, University of Michigan. Consultado el 8 de noviembre de 2017.
- ↑ Iguchi, Naoki; Ikeda, Tsutomu (1999). «Production, metabolism and P:B ratio of Euphausia pacifica (Crustacea: Euphausiacea) in Toyama Bay, southern Japan Sea». Plankton Biol. Ecol. 46 (1): 68-74.
- ↑ Gómez, J. G. (1995). «Distribution patterns, abundance and population dynamics of the euphausiidsNyctiphanes simplex and Euphausia eximia off the west coast of Baja California, Mexico». Marine Ecology Progress Series 119: 63-76. doi:10.3354/meps119063.
- ↑ Kils, U.; Marshall, P. (1995). «Der Krill, wie er schwimmt und frisst - neue Einsichten mit neuen Methoden ("The Antarctic krill - how it swims and feeds - new insights with new methods")». En Hempel, I.; Hempel, G., eds. Biologie der Polarmeere: Erlebnisse und Ergebnisse. Fischer Verlag. pp. 201-210. ISBN 3-334-60950-2.
- ↑ Piper, R. (2007). Extraordinary Animals: An Encyclopedia of Curious and Unusual Animals. Greenwood Press. ISBN 0-313-33922-8.
- ↑ Gandomi, A. H.; Alavi, A. H. (2012). «Krill Herd Algorithm: A New Bio-Inspired Optimization Algorithm». Communications in Nonlinear Science and Numerical Simulation 17 (12): 4831-4845. doi:10.1016/j.cnsns.2012.05.010.
- ↑ Jaffe, J. S.; Ohmann, M. D.; de Robertis, A. (1999). «Sonar estimates of daytime activity levels of Euphausia pacifica in Saanich Inlet». Canadian Journal of Fisheries and Aquatic Sciences 56 (11): 2000-2010. doi:10.1139/cjfas-56-11-2000.
- ↑ Tarling, Geraint A.; Johnson, Magnus L. (2006). «Satiation gives krill that sinking feeling». Current Biology 16 (3): R83-R84. PMID 16461267. doi:10.1016/j.cub.2006.01.044.
- ↑ Howard, Dan (2001). «Krill». Beyond the Golden Gate - Oceanography, Geology, Biology, and Environmental Issues in the Gulf of the Farallones. United States Geological Survey. pp. 133-140. Circular 1198.
- ↑ Howard, D. «Krill in Cordell Bank National Marine Sanctuary». National Oceanic and Atmospheric Administration. Consultado el 11 de noviembre de 2017.
- ↑ Demer, David A.; Conti, Stéphane G. (2005). «New target-strength model indicates more krill in the Southern Ocean». ICES Journal of Marine Science 62 (1): 25-32. doi:10.1016/j.icesjms.2004.07.027.
- ↑ Kils, U. (1982). «Swimming behavior, swimming performance and energy balance of Antarctic krill Euphausia superba». BIOMASS Scientific Series 3: 1-122. Archivado desde el original el 2 de junio de 2020. Consultado el 31 de marzo de 2021.
- ↑ a b c Grossman, Elizabeth (14 de julio de 2015). «Scientists consider whether krill need to be protected from human over-hunting». Public Radio International (PRI). Consultado el 12 de noviembre de 2017.
- ↑ a b «Krill fisheries and sustainability: Antarctic krill (Euphausia superba)». Commission for the Conservation of Antarctic Marine Living Resources. 12 de octubre de 2017. Consultado el 12 de noviembre de 2017.
- ↑ a b Schiermeier, Quirin (2010). «Ecologists fear Antarctic krill crisis». Nature 467 (7311): 15. PMID 20811427. doi:10.1038/467015a.
- ↑ Wright, Minturn J. (1987). «The Ownership of Antarctica, its Living and Mineral Resources». Journal of Law and the Environment 4 (2): 49-78.
- ↑ a b «Krill - biology, ecology and fishing». Commission for the Conservation of Antarctic Marine Living Resources. 28 de abril de 2015. Consultado el 14 de noviembre de 2017.
- ↑ a b «Why krill?». Southwest Fisheries Science Center. US National Oceanic and Atmospheric Administration. 22 de noviembre de 2016. Consultado el 14 de noviembre de 2017.
- ↑ «Krill oil: Agency Response Letter GRAS Notice No. GRN 000371». US FDA. 23 de diciembre de 2014. Consultado el 14 de noviembre de 2017.
Bibliografía adicional
[editar]- Boden, Brian P.; Johnson, Martin W. Johnson; Brinton, Edward (1955). «Euphausiacea (Crustacea) of the North Pacific». Bulletin of the Scripps Institution of Oceanography of the University of California 6 (8): 287-399.
- Brinton, Edward (1962). «The distribution of Pacific euphausiids». Bulletin of the Scripps Institution of Oceanography of the University of California 8 (2): 21-270.
- Brinton, Edward (1975). «Euphausiids of Southeast Asian waters». Bulletin of the Scripps Institution of Oceanography of the University of California 4.
- Conway, D. V. P.; White, R. G.; Hugues-Dit-Ciles, J.; Galienne, C. P.; Robins, D. B. (2003). Order Euphausiacea. «Guide to the coastal and surface zooplankton of the South-Western Indian Ocean». Occasional Publication of the Marine Biological Association of the United Kingdom (Plymouth, Reino Unido) (15). Archivado desde el original el 8 de mayo de 2016. Consultado el 31 de octubre de 2017.
- Everson, I., ed. (2000). Krill: biology, ecology and fisheries. Oxford: Blackwell Science. ISBN 0-632-05565-0.
- Gallotti, D., ed. (2014). Krill. Especie clave del ecosistema antártico. Publicia. ISBN 978-3-639-55918-7.
- Hamner, William M. (1984). «Krill - Untapped Bounty From the Sea?». National Geographic 165 (5): 626-642. ISSN 0027-9358. OCLC 643483454.
- Marr, J. W. S. (1962). «The Natural History and Geography of the Antarctic Krill (Euphausia superba Dana)». Discovery Reports (32): 33-464. doi:10.1002/iroh.19630480411.
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre Euphausiacea.
Wikimedia Commons alberga una categoría multimedia sobre Euphausiacea. Wikispecies tiene un artículo sobre Euphausiacea.
Wikispecies tiene un artículo sobre Euphausiacea.- Euphausia superba en Animal Diversity Web
- «Microscopio virtual» de krill antártico Archivado el 18 de diciembre de 2002 en Wayback Machine., Department of Marine and Coastal Sciences, Rutgers University
