Diferencia entre revisiones de «Helio»
m Revertidos los cambios de 190.68.24.39 a la última edición de Diegusjaimes |
|||
| Línea 52: | Línea 52: | ||
== Características principales == |
== Características principales == |
||
las caracteristicas del helio es que es un elemento con 2 de valencia |
|||
=== El átomo de helio === |
=== El átomo de helio === |
||
El helio es un elemento y el átomo más simple de resolver siguiente después del átomo de hidrógeno. El helio se compone de dos electrones en órbita alrededor de un núcleo que contiene dos protones, junto con uno o dos neutrones, dependiendo del isótopo. El átomo de hidrógeno se utiliza ampliamente para ayudar a resolver el átomo de helio. El [[modelo atómico de Bohr]] dio una explicación muy precisa de todo el espectro de hidrógeno, pero cuando se trataba de helio se derrumbó. [[Werner Heisenberg]] desarrolló una modificación del análisis de Bohr, sino que se trataba de un medio integral de los valores de los [[números cuánticos]]. La [[teoría del funcional de la densidad]], se utiliza para obtener el terreno los niveles de estado de energía del átomo de helio, junto con el [[método de Hartree-Fock]]. |
El helio es un elemento y el átomo más simple de resolver siguiente después del átomo de hidrógeno. El helio se compone de dos electrones en órbita alrededor de un núcleo que contiene dos protones, junto con uno o dos neutrones, dependiendo del isótopo. El átomo de hidrógeno se utiliza ampliamente para ayudar a resolver el átomo de helio. El [[modelo atómico de Bohr]] dio una explicación muy precisa de todo el espectro de hidrógeno, pero cuando se trataba de helio se derrumbó. [[Werner Heisenberg]] desarrolló una modificación del análisis de Bohr, sino que se trataba de un medio integral de los valores de los [[números cuánticos]]. La [[teoría del funcional de la densidad]], se utiliza para obtener el terreno los niveles de estado de energía del átomo de helio, junto con el [[método de Hartree-Fock]]. |
||
Revisión del 19:30 9 mar 2010
El helio es un elemento químico de número atómico 2, símbolo He y una masa atómica de 4,0026. A pesar de que su configuración electrónica es 1s2, el helio no figura en el grupo 2 de la tabla periódica de los elementos, junto al hidrógeno en el bloque s, sino que se coloca en el grupo 18 del bloque p, ya que al tener el nivel de energía completo, presenta las propiedades de un gas noble, es decir, es inerte (no reacciona) y al igual que éstos, es un gas monoatómico incoloro e inodoro. El helio tiene el menor punto de evaporación de todos los elementos químicos, y sólo puede ser solidificado bajo presiones muy grandes. Es además, el segundo elemento químico en abundancia en el universo, tras el hidrógeno, encontrándose en la atmósfera trazas debidas a la desintegración de algunos elementos. En algunos depósitos naturales de gas se encuentra en cantidad suficiente para la explotación, empleándose para el llenado de globos y dirigibles, como líquido refrigerante de materiales superconductores criogénicos y como gas envasado en el buceo a gran profundidad.
Características principales
El átomo de helio
El helio es un elemento y el átomo más simple de resolver siguiente después del átomo de hidrógeno. El helio se compone de dos electrones en órbita alrededor de un núcleo que contiene dos protones, junto con uno o dos neutrones, dependiendo del isótopo. El átomo de hidrógeno se utiliza ampliamente para ayudar a resolver el átomo de helio. El modelo atómico de Bohr dio una explicación muy precisa de todo el espectro de hidrógeno, pero cuando se trataba de helio se derrumbó. Werner Heisenberg desarrolló una modificación del análisis de Bohr, sino que se trataba de un medio integral de los valores de los números cuánticos. La teoría del funcional de la densidad, se utiliza para obtener el terreno los niveles de estado de energía del átomo de helio, junto con el método de Hartree-Fock.
En condiciones normales de presión y temperatura el helio es un gas monoatómico no inflamable, pudiéndose licuar sólo en condiciones extremas (de alta presión y baja temperatura).
Tiene el punto de solidificación más bajo de todos los elementos químicos, siendo el único líquido que no puede solidificarse bajando la temperatura, ya que permanece en estado líquido en el cero absoluto a presión normal. De hecho, su temperatura crítica es de tan sólo 5,19K o -267.96 grados centígrados. Los sólidos 3He y 4He son los únicos en los que es posible, incrementando la presión, reducir el volumen más del 30%. El calor específico del gas helio es muy elevado y el helio vapor muy denso, expandiéndose rápidamente cuando se calienta a temperatura ambiente.
El helio sólido sólo existe a presiones del orden de 100 MPa a 15 K (-248,15 °C). Aproximadamente a esa temperatura, el helio sufre una transformación cristalina, de estructura cúbica a estructura hexagonal compacta; en condiciones más extremas, se produce un nuevo cambio, empaquetándose los átomos en una estructura cúbica centrada en el cuerpo. Todos estos empaquetamientos tienen energías y densidades similares, debiéndose los cambios a la forma en la que los átomos interactúan.
El helio en la mecánica cuántica
El helio es el átomo más simple para resolver utilizando las reglas de la mecánica cuántica, después del átomo de hidrógeno. El helio se compone de dos electrones en órbita alrededor de un núcleo que contiene dos protones, junto con algunos neutrones. Sin embargo, como en la mecánica newtoniana, que ningún sistema que consiste de más de dos partículas se pueden resolver con un enfoque de análisis matemático exacto (véase problema de los tres cuerpos) y el helio no es la excepción. Así, los métodos matemáticos son necesarios, incluso para resolver el sistema de un núcleo y dos electrones. Sin embargo, tales métodos de la química computacional se han utilizado para crear una imagen mecánica cuántica de los electrones de helio vinculante que tiene una precisión del 2% del valor correcto, en unos pocos pasos de cálculo. En estos modelos se encuentra que cada electrón en las pantallas de helio en parte el núcleo de la otra, es de aproximadamente 1,69 unidades, no los 2 cargos de un clásico "núcleo desnudo" de helio.
Fases de gas y de plasma
El helio es el gas noble menos reactivo después del neón y por tanto, el segundo elemento menos reactivo, es inerte y monoatómico en todas las condiciones estándar. El helio es bajo en masa atómica, en la fase gaseosa, su conductividad térmica, calor específico, y el sonido de velocidad son mayores que cualquier otro gas, excepto el hidrógeno. Por razones similares, y también debido al pequeño tamaño de los átomos de helio, la tasa de difusión del helio a través de los sólidos es tres veces mayor que la del aire y alrededor del 65% del hidrógeno.[1]
El helio es menos soluble en agua que cualquier otro gas conocido, y el índice de refracción es más cercano a la unidad que la de cualquier otro gas.[2][3] El helio tiene un efecto Joule-Thomson negativo a la temperatura ambiente normal, lo que significa que se calienta cuando se les permite expandir libremente. Sólo por debajo de su temperatura de inversión del efecto Joule-Thomson (de 32 a 50 K a 1 atmósfera) hace que se enfríe en la expansión libre.[1] Una vez preenfriado debajo de esta temperatura, el helio puede licuarse mediante el enfriamiento de expansión.
La mayor parte del helio extraterrestre se encuentra en un estado de plasma, con propiedades muy diferentes de los del helio atómico. En el plasma, los electrones del helio no están obligados a estar en su núcleo, lo que hace que su conductividad eléctrica sea muy alta, aun cuando el gas es sólo parcialmente ionizado. Las partículas cargadas son altamente influenciadas por los campos magnéticos y eléctricos. Por ejemplo, en el viento solar, junto con el hidrógeno ionizado, las partículas deben interactuar con la magnetósfera de la Tierra, dando lugar a la corriente de Birkeland y a la aurora.[4]
Fases líquida y sólida
A diferencia de cualquier otro elemento, el helio líquido se mantendrá hasta el cero absoluto a presiones normales. Este es un efecto directo de la mecánica cuántica: en concreto, la energía de punto cero del sistema es demasiado alta para permitir la congelación. El helio sólido requiere una temperatura de 1 a 1.5 ºK (alrededor de -272 °C o -457 °F) y alrededor de 25 bar (2,5 MPa) de presión.[5] A menudo es difícil distinguir sólidos del helio líquido ya que el índice de refracción de las dos fases son casi los mismos. El sólido tiene un punto de fusión agudo y tiene una estructura cristalina, pero es muy compresible, aplicar presión en un laboratorio puede reducir su volumen en más del 30%.[6] Con un módulo de volumen del orden de 50 MPa que es 50 veces más compresible que el agua. El helio sólido tiene una densidad de 0,214 ± 0,006 g/ml a 1,15 ºK y 66 atm, la densidad proyectada a 0 ºK y 25 bar (2,5 MPa) es 0,187 ± 0,009 g/ml.[7]
Helio I
Por debajo de su punto de ebullición de 4,22 ºK, y por encima del punto lambda de 2,1768 ºK, el isótopo del helio-4 existe en un estado normal de líquido incoloro, llamado helio I.[1] Al igual que otros líquidos criogénicos, el helio se reduce cuando se calienta y los aumenta cuando se baja su temperatura. Por debajo del punto lambda, sin embargo, el helio no se reduce, y se expande a medida que la temperatura desciende aún más.
El helio tiene un índice de refracción de 1,026 lo que hace que su superficie sea tan difícil de ver que los flotadores de espuma de poliestireno se utilizan a menudo para mostrar la superficie.[1] Este líquido incoloro, tiene una muy baja viscosidad y una densidad de 0,145 g/mL, que es sólo una cuarta parte del valor esperado de la física clásica.[1] La mecánica cuántica es necesaria para explicar esta propiedad y, por tanto ambos tipos de helio líquido se llaman fluidos cuánticos, lo que significa que muestran las propiedades atómicas a escala macroscópica. Esto puede ser un efecto de su punto de ebullición por estar tan cerca del cero absoluto, impidiendo el movimiento molecular aleatorio de enmascarar las propiedades atómicas (energía térmica).[1]
Helio II
El helio líquido por debajo de su punto lambda comienza a mostrar características muy inusuales, en un estado llamado helio II. La ebullición del helio II no es posible debido a su alta conductividad térmica; la entrada de calor causa la evaporación del líquido. El isótopo de helio-3 también tiene una fase de superfluido, pero sólo a temperaturas mucho más bajas, como resultado, se sabe menos sobre las propiedades de este tipo en el isótopo de helio-3.[1]
El helio II es un superfluido, un estado cuántico de la materia con propiedades extrañas. Por ejemplo, cuando fluye a través de capilares tan delgados como 10-7 a 10-8 M no tiene viscosidad mensurable. Sin embargo, cuando las mediciones se realizaron entre dos discos en movimiento, una viscosidad comparable a la de helio gaseoso se observó. La teoría actual explica esta utilizando el modelo de dos fluidos para el helio II. En este modelo, el helio líquido por debajo del punto lambda se considera que contienen una proporción de átomos de helio en un estado fundamental, que son superfluido y el flujo de viscosidad exactamente igual a cero, y una proporción de átomos de helio en un estado excitado, que se comportan más como un fluido ordinario.[8]
En el efecto fuente, se construye una cámara que está conectada a un depósito de helio II por un disco sinterizado a través del cual las fugas de helio superfluido fácilmente pero a los que no son superfluidos, no puede pasar. Si se calienta el interior del contenedor, el helio pasa a no ser superfluido. A fin de mantener el equilibrio de la fracción de helio superfluido, a través de fugas de helio superfluido y aumenta la presión, haciendo que el líquido salga del recipiente.[9]
La conductividad térmica del helio II es mayor que la de cualquier otra sustancia conocida, un millón de veces mayor que la del helio y varios cientos de veces la del cobre.[1] Esto se debe a la conducción de calor se produce por un mecanismo cuántico excepcional. La mayoría de los materiales que conducen calor y tienen una banda de electrones de valencia libres que sirven para transferir el calor. El helio II no tiene banda de valencia, pero conduce bien el calor. El flujo de calor se rige por las ecuaciones que son similares a la ecuación de onda utilizadas para caracterizar la propagación del sonido en el aire. Cuando se introduce calor, se mueve a 20 metros por segundo a 1,8 ºK a través de helio II como ondas en un fenómeno conocido como segundo sonido.[1]
El helio II también presenta un efecto de reptiles. Cuando una superficie se extiende más allá del nivel de helio II, el helio II se mueve a lo largo de la superficie, contra la fuerza de gravedad. Se mueve en 30 nm de espesor de película, independientemente del material de superficie. Esta película se llama película Rollin y lleva el nombre del hombre que primero se caracteriza este rasgo, Bernard V. Rollin.[1][10][11] Las ondas que se propagan a través de una película de Rollin se rigen por la misma ecuación de ondas de gravedad en aguas poco profundas, pero en lugar de la gravedad, la fuerza de restauración es la fuerza de van der Waals.[12] Estas ondas son conocidas como tercer sonido.[13]
Aplicaciones
El helio es más ligero que el aire y a diferencia del hidrógeno no es inflamable, siendo además su poder ascensional un 8% menor que la de éste, por lo que se emplea como gas de relleno en globos y zepelines publicitarios, de investigación atmosférica e incluso para realizar reconocimientos militares.
Aún siendo la anterior la principal el helio tiene más aplicaciones:
- Las atmósferas helio-oxígeno se emplean en la inmersión a gran profundidad, ya que el helio es inerte, menos soluble en la sangre que el nitrógeno y se difunde 2,5 veces más deprisa que él, todo lo cual reduce el tiempo requerido para la descompresión, aunque ésta debe comenzar a mayor profundidad, y elimina el riesgo de narcosis por nitrógeno (borrachera de las profundidades).
- Por su bajo punto de licuefacción y evaporación puede utilizarse como refrigerante en aplicaciones a temperatura extremadamente baja como en imanes superconductores e investigación criogénica a temperaturas próximas al cero absoluto.
- En cromatografía de gases se usa como gas portador inerte.
- La atmósfera inerte de helio se emplea en la soldadura por arco y en la fabricación de cistales de silicio y germanio, así como para presurizar combustibles líquidos de cohetes.
- En túneles de viento supersónicos.
- Como agente refrigerante en reactores nucleares.
- El helio líquido encuentra cada vez mayor uso en las aplicaciones médicas de la imagen por resonancia magnética (RMI).
- Se utiliza en equipos láser como uno de los gases, el más común es el Helio-Neón.
En 2008 la producción total mundial de helio era de 32 millones de kg de helio por año, el mayor uso (alrededor del 22% del total en 2008) es en aplicaciones criogénicas, la mayoría de los cuales comprende el enfriamiento de los imanes superconductores de medicina (véase imagen por resonancia magnética). Otros usos importantes (por un total de cerca de 78% de uso en 1996) fueron en los sistemas de presurización y purga, el mantenimiento de atmósferas controladas, y la soldadura.
El helio se utiliza para muchos propósitos que requieren algunas de sus propiedades únicas, tales como su bajo punto de ebullición, baja densidad, baja solubilidad, alta conductividad térmica, o su inercia. El helio está disponible comercialmente en forma líquida o gaseosa. Como un líquido, puede ser suministrada en recipientes pequeños llamados Dewars que permiten llevar hasta 1.000 litros de helio, o en los contenedores ISO de gran tamaño que tienen una capacidad nominal tan grande como 42 m3. En forma gaseosa, pequeñas cantidades de helio se suministran en cilindros de alta presión que puede recibir hasta 8 m3 (300 pies cúbicos), mientras que grandes cantidades de gas de alta presión son ofrecidos en remolques que tienen una capacidad de hasta 4.860 m3.
Historia
Descubrimiento científico
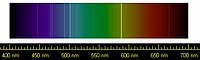
La primera evidencia de helio se observó el 18 de agosto 1868 como una línea de color amarillo brillante con una longitud de 587,49 nanómetros en la cromosfera del sol. La línea fue detectada por el astrónomo francés Pierre Janssen durante un eclipse solar total en Guntur, India[14]. Esta línea se supone que es un principio de sodio. El 20 de octubre del mismo año, astrónomo Inglés Joseph Norman Lockyer observó una línea amarilla en el espectro solar, que llamó la línea D3 Fraunhofer porque estaba cerca de la conocidas líneas de sodio D1 y D2[1]. Llegó a la conclusión de que era causada por un elemento desconocido en el Sol. Eduard Frankland confirmó los resultados de Janssen y propuso el nombre helium para el nuevo elemento, en honor al dios griego del sol (Helios) al que se añadió el sufijo -ium ya que se esperaba que el nuevo elemento fuera metálico.[15][16][17]
En 1882, el físico italiano Luigi Palmieri detectó helio en la Tierra por primera vez, a través de su línea espectral D3, al analizar la lava del Monte Vesubio[18].
En 1895 Sir William Ramsay aisló el helio descubriendo que no era metálico, a pesar de lo cual el nombre original se conservó. Los químicos suecos Nils Langlet y Per Theodor Cleve consiguieron también, por la misma época, aislar el elemento.[1][19][20][21]
En 1907 Ernest Rutherford y Thomas Royds mostraron que las partículas alfa son núcleos de helio. En 1908 el físico alemán Heike Kamerlingh Onnes produjo helio líquido enfriando el gas hasta 0,9 K, lo que le hizo merecedor del premio Nobel. En 1926 su discípulo Willem Hendrik Keesom logró por vez primera solidificar el helio.
En 1938, el físico ruso Pyotr Leonidovich Kapitsa descubrió que el helio IV casi no tiene viscosidad a temperaturas cercanas al cero absoluto, un fenómeno que ahora se llama superfluidez. Este fenómeno está relacionado con la condensación de Bose-Einstein. En 1972, el mismo fenómeno se observó en el helio-3, pero a temperaturas mucho más cerca del cero absoluto, por los físicos estadounidenses Douglas D. Osheroff, David M. Lee y Robert C. Richardson. El fenómeno en el helio IV se cree que en relación con la vinculación de helio-3 para que los fermiones creen bosones, en analogía a los pares de Cooper que producen la superconductividad.
Extracción y uso

Después de una operación de perforación de petróleo en 1903 en Dexter, Kansas producido un géiser de gas que no se quema, el geólogo del estado de Kansas Erasmus Haworth recogió muestras de los gases de escape y se las llevó a la Universidad de Kansas en Lawrence, donde, con la ayuda de químicos Hamilton Cady y David McFarland, descubrió que el gas consistía, en volumen, 72% de nitrógeno, 15% de metano (un porcentaje único combustible con el oxígeno suficiente), 1% de hidrógeno, y 12%, un gas no identificado. Con más análisis, Cady y McFarland descubrió que el 1,84% de la muestra de gas es helio. Esto demostró que a pesar de su rareza global de la Tierra, el helio se concentró en grandes cantidades en virtud de las Grandes Planicies de América, disponible para la extracción como un subproducto del gas natural. La mayor reserva de helio se encontraban en el Hugoton y campos de gas en las inmediaciones en el suroeste de Kansas y mangos de Texas y Oklahoma.
Esto permitió a los Estados Unidos convertirse en el principal proveedor mundial de helio. Tras una sugerencia de Sir Richard Threlfall, la Marina de los Estados Unidos patrocinó tres pequeñas plantas experimentales de producción de helio durante la Primera Guerra Mundial. El objetivo era proporcionar globos de barrera con el gas más ligero no inflamable. Un total de 5.700 m3 (200.000 pies cúbicos) de 92% de helio se produce en el programa a pesar de que menos de un metro cúbico de gas habían sido adquiridos. Parte de este gas de helio se utilizó en la primera aeronave, de la Marina de EE.UU., que hizo su primer viaje de Hampton Roads, Virginia, a Bolling Field en Washington, DC, el 1 de diciembre de 1921.
Aunque el proceso de extracción, el uso de licuefacción de gas de baja temperatura, no se desarrolló a tiempo para ser significativas durante la Primera Guerra Mundial, la producción continuó. El helio se utiliza principalmente como un gas de elevación más ligeros que el de aeronaves. La demanda fue mayor durante la Segunda Guerra Mundial, así como las demandas de soldadura por arco. El espectrómetro de masas de helio también fue vital en la bomba atómica del Proyecto Manhattan.
El gobierno de los Estados Unidos creó la Reserva Nacional de helio en 1925 en Amarillo, Texas, con el objetivo de suministrar helio a aeronaves militares en tiempo de guerra y aeronaves comerciales en tiempos de paz. Debido a un embargo militar de EE.UU. contra Alemania que el suministro de helio era restringido, el LZ-129 Hindenburg se vio obligado a utilizar el hidrógeno como gas elevador. El uso de helio tras la Segunda Guerra Mundial estaba deprimido, pero la reserva se amplió en la década de 1950 para garantizar el suministro de helio líquido como refrigerante para crear oxígeno y combustible para los cohetes de hidrógeno (entre otros usos) durante la carrera espacial y la Guerra Fría. El uso de helio en los Estados Unidos en 1965 fue de más de ocho veces el consumo máximo de tiempo de guerra.
la Oficina de Minas de EE.UU. dispuso de cinco plantas privadas para recuperar de helio a partir de gas natural. Para este programa de conservación de helio, la Oficina construyó 684 km de tuberías en Bushton, Kansas para conectar las plantas con el campo de gas, cerca de Amarillo, Texas. Esta mezcla de helio y nitrógeno fue inyectada y almacenada en el campo de gas de Cliffside hasta que se necesite, cuando luego se purifica.
En 1995, mil millones de metros cúbicos de gas se ha recaudado y la deuda era de 1.4 billones de dólares, lo que llevó al Congreso de los Estados Unidos para eliminar la reserva en 1996. El helio producido entre 1930 y 1945 fue aproximadamente 98,3% de pureza (nitrógeno 2%), el cual fue suficiente para llenar los dirigibles. En 1945, se usó una pequeña cantidad de 99,9% de helio, para uso de soldadura.
Durante muchos años, Estados Unidos produce más del 90% de helio para que puedan utilizarse comercialmente en el mundo, mientras que las plantas de extracción, en Canadá, Polonia, Rusia y otros países producen el resto. A mediados de la década de 1990, una nueva planta en Arzew, Argelia entró en funcionamiento y produjo 17 millones de metros cúbicos de helio, con una producción suficiente para cubrir toda la demanda de Europa. Mientras tanto, en el año 2000, el consumo de helio dentro de los EE.UU. había aumentado a más de 15 millones de kg. En 2004-2006, dos plantas adicionales, una en Ras laffen, Qatar y la otra en Skikda, Argelia fueron construidas, pero a principios de 2007, Ras laffen está funcionando al 50%, y Skikda aún no ha sido puesta en marcha. Argelia se convirtió rápidamente en el segundo principal productor de helio. A través de este tiempo, tanto el consumo de helio, como los costos de producción de helio aumentaron. Entre 2002 y 2007 el precio del helio se duplicó, y en 2008 sólo los principales proveedores aumentaron sus precios en un 50%.
Abundancia y obtención
El helio es el segundo elemento más abundante del universo tras el hidrógeno y constituye alrededor del 20% de la materia de las estrellas, en cuyo proceso de fusión nuclear desempeña un importante papel. La abundancia de helio no puede ser explicada por la generada en las estrellas, aunque es consistente con el modelo del Big bang, creyéndose que la mayor parte del helio existente se formó en los tres primeros minutos del universo.
En la atmósfera terrestre hay del orden de 5 ppm y se encuentra también como producto de desintegración en diversos minerales radioactivos de uranio y torio. Además está presente en algunas aguas minerales, en gases volcánicos y en ciertos yacimientos de gas natural de los Estados Unidos, de los que proviene la mayoría del helio comercial.
El helio puede sintetizarse bombardeando núcleos de litio o boro con protones a alta velocidad.
Compuestos
Dado que el helio es un gas noble, en la práctica no participa en las reacciones químicas, aunque bajo la influencia de descargas eléctricas o bombardeado con electrones forma compuestos con el wolframio, yodo, flúor y fósforo.
El helio tiene una valencia de cero y es químicamente reactivo en todas las condiciones normales. Se trata de un aislante eléctrico a menos ionizado. Al igual que con los demás gases nobles el helio tiene niveles de energía metaestable que le permiten seguir siendo ionizado una descarga eléctrica con un voltaje por debajo de su potencial de ionización. El helio puede formar compuestos inestables, cuando se somete a una descarga luminiscente eléctrica, a un bombardeo de electrones, o bien es un plasma por otra razón. Los compuestos moleculares HeNe, HgHe10 y WHe2, y los iones moleculares se han creado de esta manera. Esta técnica también ha permitido la producción de la molécula neutra He2, que tiene un gran número de sistemas de banda, y HgHe, que aparentemente sólo se mantienen unidos por fuerzas de la polarización. En teoría, otros compuestos de verdad también puede ser posible, como el helio fluorohídrico (HHeF), que sería análogo al argón fluorhídrico, descubierto en 2000. Los cálculos indican que dos nuevos compuestos que contiene una mezcla de helio-oxígeno podría ser estable. Dos nuevas especies moleculares, CsFHeO y N(CH3)4FHeO, son los derivados de un metaestable [HEO-F], anión teorizado en 2005 por un grupo de Taiwán. Si es confirmado por la experiencia, estos compuestos terminarán la inercia química del helio, y el único elemento inerte será el neón.
Isótopos

El isótopo más común del helio es el 4He, cuyo núcleo está constituido por dos protones y dos neutrones. Su excepcional estabilidad nuclear se debe a que tiene un número másico de nucleones, es decir, una cantidad que se distribuye en niveles completos (de modo análogo a como se distribuyen los electrones en los orbitales). Numerosos núcleos pesados se desintegran emitiendo un núcleo de 4He; éste proceso, que se denomina desintegración alfa y por el que al núcleo emitido se le llama partícula alfa, es el origen de la mayoría del helio terrestre.
El helio tiene un segundo isótopo, el 3He, así como otros más pesados que son radiactivos. El helio-3 es prácticamente inexistente en la tierra, dado que la desintegración alfa produce exclusivamente núcleos de helio-4 y tanto éstos como el helio atmosférico escapan al espacio en periodos geológicos relativamente cortos.
Ambos isótopos se produjeron en el Big bang y cantidades significativas se siguen produciendo mediante la fusión del hidrógeno en las estrellas siguiendo la cadena protón-protón.
Formas

El helio líquido (helio-4) se encuentra en dos formas distintas: helio-4 I y helio-4 II, entre los que se produce una brusca transición a 2,1768 K (punto lambda) a la presión de vapor. El He-I, por encima de esa temperatura es un líquido normal, pero el He-II, por debajo de ella, no se parece a ninguna otra sustancia convirtiéndose en un superfluido cuyas inusuales características se deben a efectos cuánticos, uno de los primeros casos en los que se han observado a escala macroscópica.
El helio-II tiene una viscosidad nula por lo que fluye con facilidad a través de finísimos capilares a través de los que el helio-I no puede fluir, y tiene además una conductividad térmica mucho mayor que cualquier otra sustancia. Exhibe un efecto fuente, de modo que si se sumerge parcialmente un tubo con un extremo capilar en helio-II y se calienta el tubo para superar el punto lambda, el helio-I se verterá por el extremo libre del tubo a modo de fuente, produciéndose un flujo constante de helio-II a través del capilar hacia el tubo calentado. Inversamente, cuando se fuerza el paso de helio-II a través de un capilar, el líquido se enfría. Los pulsos de calor se propagan a través del líquido de forma análoga a como lo hace el sonido, un fenómeno al que se denomina, por ello, segundo sonido. Además, el helio-II tiene la capacidad de reptar, de modo que cualquier sólido en contacto con él se cubre con un capa de entre 50 y 100 átomos de espesor a través de la cual el líquido puede fluir a una velocidad que depende de la temperatura, de hecho si se sumerge parcialmente una vasija con el fondo estanco en un lecho de helio-II, éste reptará por las paredes exteriores de la vasija llenándola hasta que los niveles en ambos se igualen, esta propiedad dificulta por razones obvias la construcción de recipientes de helio-II.
Precauciones
Un efecto producido al inhalar helio es hacer la voz humana más aguda. Esto se debe a que el helio es menos denso que el aire, por lo que las cuerdas vocales pueden vibrar a mayor frecuencia, pues tienen menor resistencia que superar (Helium FAQ). Aunque este efecto pueda resultar curioso, es peligroso realizarlo excesivamente, ya que el helio puede provocar asfixia. Un gas que produce el efecto contrario es el Hexafluoruro de azufre, es decir, hace la voz humana más grave al inhalarlo.
Los depósitos de helio gas de 5 a 10 K deben almacenarse como si contuvieran líquido debido al gran incremento de presión que se produce al calentar el gas a temperatura ambiente.
Efectos biológicos
La velocidad del sonido en el helio es casi tres veces la velocidad del sonido en el aire. Debido a la frecuencia fundamental de una cavidad llena de gas es proporcional a la velocidad del sonido en el gas, cuando es inhalado helio se produce un aumento correspondiente en las alturas de las frecuencias de resonancia del tracto vocal. (El efecto contrario, la reducción de frecuencias, se puede obtener por la inhalación de un gas denso como el hexafluoruro de azufre).
La inhalación de helio puede ser peligroso si se hace en exceso, ya que el helio es un gas asfixiante y desplaza al oxígeno necesario para la respiración normal. La respiración de helio puro continua, causa la muerte por asfixia en pocos minutos. La inhalación de helio directamente de cilindros a presión es extremadamente peligrosa, ya que la alta velocidad de flujo puede resultar en el barotrauma, fatalmente, la ruptura de los tejidos pulmonares. Sin embargo, la muerte causada por el helio es muy rara, con sólo dos muertos registrados entre 2000 y 2004 en los Estados Unidos.
A altas presiones (más de 20 atm o dos MPa), una mezcla de helio y oxígeno (heliox) puede conducir al síndrome de alta presión nerviosa, una especie de revertir el efecto anestésico, añadiendo una pequeña cantidad de nitrógeno a la mezcla puede aliviar el problema.
Véase también
- Efecto Leidenfrost
- Gas noble
- Origen inorgánico del petróleo
- Superfluidez
- Tabla periódica de los elementos
- Viscosidad
Referencias
- ↑ a b c d e f g h i j k l Clifford A. Hampel (1968). The Encyclopedia of the Chemical Elements. New York: Van Nostrand Reinhold. pp. 256-268. ISBN 0442155980.
- ↑ Weiss, Ray F. (1971). «Solubility of helium and neon in water and seawater». J. Chem. Eng. Data 16 (2): 235-241. doi:10.1021/je60049a019.
- ↑ Stone, Jack A.; Stejskal, Alois (2004). «Using helium as a standard of refractive». Metrologia 41: 189-197. doi:10.1088/0026-1394/41/3/012.
- ↑ Buhler, F.; Axford, W. I.; Chivers, H. J. A.; Martin, K. (1976). «Helium isotopes in an aurora». J. Geophys. Res. 81 (1): 111-115. doi:10.1029/JA081i001p00111.
- ↑ «Solid Helium». Department of Physics University of Alberta. 5 de octubre de 2005. Consultado el 20 de julio de 2008.
- ↑ Malinowska-Adamska, C.; Soma, P.; Tomaszewski, J. (2003). «Dynamic and thermodynamic properties of solid helium in the reduced all-neighbours approximation of the self-consistent phonon theory». Physica status solidi (b) 240 (1): 55-67. doi:10.1002/pssb.200301871.
- ↑ Henshaw, D. B. (1958). «Structure of Solid Helium by Neutron Diffraction». Physical Review Letters 109 (2): 328-330. doi:10.1103/PhysRev.109.328.
- ↑ Hohenberg, P. C.; Martin, P. C. (2000). «Microscopic Theory of Superfluid Helium». Annals of Physics 281 (1–2): 636-705 12091211. doi:10.1006/aphy.2000.6019.
- ↑ Warner, Brent. «Introduction to Liquid Helium». NASA. Archivado desde el original el 1 de septiembre de 2005. Consultado el 5 de enero de 2007.
- ↑ Fairbank, H. A.; Lane, C. T. (1949). «Rollin Film Rates in Liquid Helium». Physical Review 76 (8): 1209-1211. doi:10.1103/PhysRev.76.1209.
- ↑ Rollin, B. V.; Simon, F. (1939). «On the "film" phenomenon of liquid helium II». Physica 6 (2): 219-230. doi:10.1016/S0031-8914(39)80013-1.
- ↑ Ellis, Fred M. (2005). «Third sound». Wesleyan Quantum Fluids Laboratory. Consultado el 23 de julio de 2008.
- ↑ Bergman, D. (1949). «Hydrodynamics and Third Sound in Thin He II Films». Physical Review 188 (1): 370-384. doi:10.1103/PhysRev.188.370.
- ↑ Kochhar, R. K. «French astronomers in India during the 17th - 19th centuries» (en inglés). Consultado el 8 de marzo de 2010.
- ↑ Sir Norman Lockyer - descubrimiento del helio (en inglés)".
- ↑ «Helium». Oxford English Dictionary. 2008. Consultado el 20 de julio de 2008.
- ↑ Thomson, W. (1872). Frankland and Lockyer find the yellow prominences to give a very decided bright line not far from D, but hitherto not identified with any terrestrial flame. It seems to indicate a new substance, which they propose to call Helium. Rep. Brit. Assoc. xcix.
- ↑ Stewart, Alfred Walter (2008). Recent Advances in Physical and Inorganic Chemistry. BiblioBazaar, LLC. p. 201. ISBN 0554805138.
- ↑ Ramsay, William (1895). «On a Gas Showing the Spectrum of Helium, the Reputed Cause of D3 , One of the Lines in the Coronal Spectrum. Preliminary Note». Proceedings of the Royal Society of London 58: 65-67. doi:10.1098/rspl.1895.0006.
- ↑ Ramsay, William (1895). «Helium, a Gaseous Constituent of Certain Minerals. Part I». Proceedings of the Royal Society of London 58: 80-89. doi:10.1098/rspl.1895.0010.
- ↑ Ramsay, William (1895). «Helium, a Gaseous Constituent of Certain Minerals. Part II--». Proceedings of the Royal Society of London 59: 325-330. doi:10.1098/rspl.1895.0097.
Referencias externas
- WebElements.com (inglés)
- EnvironmentalChemistry.com (inglés)
- Es Elemental (inglés)
- Elementos Químicos: Helio (español)
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del helio. (español)
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Helio.
Wikimedia Commons alberga una galería multimedia sobre Helio.


