Teneso
| Livermorio ← Teneso → Oganesón | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Teneso, Ts, 117 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Halógenos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 17, 7, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 294 (isótopo más estable) u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Rn] 5f14 6d10 7s2 7p5 (predicción)[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel |
2, 8, 18, 32, 32, 18, 7 (predicción) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Desconocida | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 165 (estimado)[2] pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | −1, +1, +3, +5 (predicción)[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 742,9 (predicción)[3] kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido (predicción) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 573 K (300 °C) a 773 K (500 °C) (predicción)[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 823 K (550 °C) (predicción)[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del teneso | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El teneso[4] es un elemento sintético muy pesado de la tabla periódica de los elementos cuyo símbolo es Ts y número atómico 117. También conocido como eka-astato o simplemente elemento 117, es el segundo elemento más pesado creado hasta ahora y el penúltimo del séptimo período en la tabla periódica.
Su descubrimiento se anunció en 2010 y fue fruto de una colaboración entre científicos rusos y estadounidenses en el Instituto Central de Investigaciones Nucleares de Dubná, Rusia.[5] En un experimento en 2011, se creó directamente uno de sus productos de desintegración, confirmando parcialmente los resultados del experimento inicial; el experimento, además, fue repetido con éxito en 2012. En 2014, el Centro GSI Helmholtz para la Investigación de Iones Pesados de Alemania también afirmó haber reproducido el experimento original.[6] El grupo formado por la IUPAC y la IUPAP —IUPAC/IUPAP Joint Working Party—, que se encarga de examinar las reivindicaciones de descubrimientos de elementos superpesados, confirmó el descubrimiento en diciembre de 2015.[7] En junio de 2016, sus descubridores propusieron nombrarlo tennessine (según Tennessee, sede del Laboratorio Nacional Oak Ridge), traducido inicialmente como tenesino[nota 1] o téneso.[10] Finalmente, el 28 de noviembre de 2016, la IUPAC aprobó el nombre propuesto (en inglés),[11] habiendo divergencias en la traducción del nombre al español,[12] hasta que finalmente la Real Academia de Ciencias, la Real Sociedad Española de Química, la RAE y la Fundéu acordaron promover la forma llana teneso.
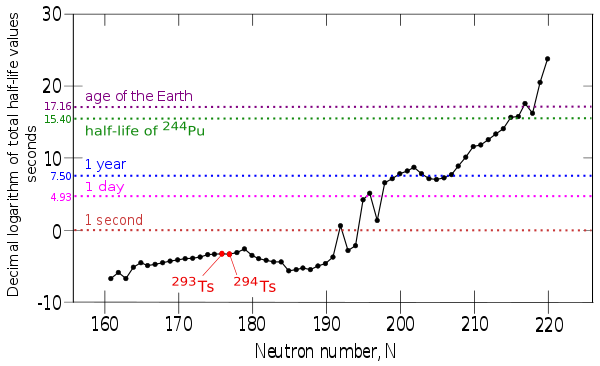
En la tabla periódica, el teneso está ubicado en el grupo 17,[nota 2] cuyos miembros de número atómico menor son halógenos. Sin embargo, es probable que el teneso tenga propiedades significativamente diferentes de las del resto de elementos del grupo, aunque se prevé que el punto de fusión, el punto de ebullición y la primera energía de ionización sigan las tendencias periódicas. Los isótopos sintetizados hasta ahora son el teneso-293, con una vida media de aproximadamente 14 milisegundos, y teneso-294, con una vida media de alrededor de 78 milisegundos; esto parece confirmar la existencia de la isla de estabilidad. Asimismo, las predicciones teóricas prevén que los isótopos de teneso-309 y superiores sean aún más estables.
Historia[editar]
Antes del descubrimiento[editar]
En 2004, el equipo del Instituto Central de Investigaciones Nucleares en Dubná (en el óblast de Moscú, Rusia), propuso un experimento para sintetizar el elemento 117 —llamado así por los 117 protones en su núcleo atómico— mediante la fusión nuclear de un blanco de berkelio (elemento 97) con un haz de iones de calcio (elemento 20). El equipo del Laboratorio Nacional Oak Ridge de los Estados Unidos, el único productor de berkelio en el mundo en aquellos días, decidió iniciar la síntesis del material para el blanco en conjunción con la producción de californio para fines comerciales, tan pronto como esta fuera puesta en marcha.[13] Mientras tanto, los planes para sintetizar el elemento 117 fueron dejados de lado temporalmente en favor de la síntesis del elemento 118, producido mediante el bombardeo de un blanco de californio con iones de calcio.[14]
El equipo ruso deseaba usar el isótopo de calcio-48 debido a que tiene veinte protones y veintiocho neutrones; este es el núcleo más ligero con tal exceso de neutrones que es estable o casi estable. La inusual estabilidad de este isótopo de calcio radica en que es «doblemente mágico» debido a que cuenta con «números mágicos» tanto de neutrones como de protones, veintiocho y veinte respectivamente. El siguiente núcleo de semejantes características, zinc-68, es ya mucho más pesado.[15] El haz de iones de calcio fue preparado en Rusia separando químicamente[16] las pequeñas cantidades de calcio-48 presentes en el calcio natural de la tierra.[17] Los núcleos resultantes de la fusión de isótopos ricos en neutrones son más pesados y se encuentran más cerca de la buscada isla de estabilidad.[18]
Descubrimiento[editar]


En 2008, el equipo americano inició la producción del blanco de berkelio en el laboratorio de Oak Ridge para el experimento. Tras irradiar curio-244 con partículas alfa durante un total de 250 días, se obtuvieron 22 mg de berkelio, con etapas posteriores de enfriamiento y purificación que sumaron seis meses.[20][13] El período de semidesintegración del isótopo de berkelio usado (berkelio-249) es de únicamente trescientos treinta días, transcurridos los cuales la mitad de este se transforma en otros elementos, por lo que el equipo determinó un plazo de seis meses a partir de la purificación del blanco para iniciar el experimento, pues más tarde podría no quedar la suficiente cantidad de elemento para llevar a cabo la síntesis del teneso.[13] En el verano boreal de 2009, el berkelio se transportó en un vuelo comercial desde Nueva York a Moscú empaquetado dentro de cinco recipientes de plomo.[13]
La llegada del berkelio a Dubna se retrasó varios días, debido a documentación faltante o incompleta, lo que condujo a que la aduana rusa no permitiera la entrada del material al país y lo devolviera a los Estados Unidos dos veces, hasta que finalmente pudo ingresar a Rusia.[13] Una vez permitida la entrada del «blanco», este se transfirió a Dimitrovgrad, en el óblast de Ulyanovsk, para ser fijado en una película delgada de titanio y luego ser llevada a Dubná, donde fue instalado en el acelerador de partículas del Instituto Central de Investigaciones Nucleares —el más potente del mundo— para la síntesis de elementos superpesados.[20]
El experimento comenzó en junio del 2009 y en enero del 2010 científicos del Laboratorio Flerov de Reacciones Nucleares anunciaron que habían detectado con éxito la desintegración de un nuevo elemento con número atómico 117 a través de dos cadenas de isótopos impar-impar mediante seis desintegraciones alfa antes de una fisión espontánea, y de otro par-impar,[nota 3] con tres desintegraciones alfa antes de la fisión.[21] Según el informe oficial publicado el 9 de abril de 2010 en la revista Physical Review Letters, dichos isótopos eran el teneso-294 y el teneso-293 respectivamente, formados como sigue a continuación:[19]
(un evento)
(cinco eventos)
Antes de la síntesis del teneso, no se conocía ninguno de sus isótopos productos de desintegración;[19] por lo tanto, no había una base para una reclamación del descubrimiento ante el comité de la IUPAC y mucho menos para su reconocimiento. El moscovio-289 —uno de los productos de desintegración del teneso— fue sintetizado de forma directa en 2011 —en lugar de haberse obtenido a partir de la desintegración del teneso—; a pesar de la distinta vía de obtención las propiedades de desintegración medidas en este experimento coincidieron con las del descubrimiento del teneso.[22] Sin embargo, los descubridores no reivindicaron el descubrimiento del teneso cuando el comité encargado estaba revisando los reclamos de descubrimientos de elementos más allá del copernicio.[23] El grupo de Dubna repitió exitosamente el experimento original en 2012, confirmando así la síntesis del teneso. Los científicos presentaron una solicitud para registrar de forma oficial el elemento,[24] y los presidentes de IUPAC y IUPAP formaron un nuevo comité conjunto de trabajo para asignar el derecho de descubrimiento.[25] El 2 de mayo de 2014, científicos del Centro GSI Helmholtz para la Investigación de Iones Pesados, en Darmstadt, aseguraron haber confirmado el descubrimiento del teneso[26][27][6] y de un nuevo isótopo: lawrencio-266, obtenido de la desintegración alfa del dubnio-270; este modo de desintegración no fue observado en los experimentos de Dubna, donde el dubnio-270 experimentó una fisión espontánea.[28][29]
Denominación[editar]
Utilizando la nomenclatura de Mendeléyev para los elementos no identificados y sin descubrir, el teneso debería ser conocido como «eka-astato» o «dvi-iodo». En 1979, la IUPAC publicó una serie de recomendaciones para la nomenclatura de elementos de número atómico mayor que 100, que resultaron en el nombre ununseptio y el correspondiente símbolo de Uus,[30] de acuerdo a la denominación sistemática de elementos, como una manera de referirse al elemento de manera temporal, hasta la asignación de un nombre permanente.[31] Conforme a este sistema, el nombre temporal literalmente significa 117 (uno-uno-siete).[30] Las recomendaciones fueron mayoritariamente ignoradas entre los científicos, quienes lo llaman «elemento 117», con el símbolo de «(117)» o incluso simplemente «117».[3]
También llegó a ser llamado o Efelio con cuyo símbolo es Ef.[32]
El descubrimiento del elemento fue confirmado en diciembre de 2015, junto a los elementos 115 y 118, sintetizados por el mismo equipo ruso-estadounidense, y el elemento 113, descubierto por investigadores japoneses.[7] En junio de 2016, sus descubridores propusieron nombrarlo tennessine, con símbolo Ts, que devino la denominación oficial en noviembre de 2016.[33][34]
Propiedades previstas[editar]
Estabilidad nuclear e isótopos[editar]

Ningún elemento con un número atómico por encima de 82 —correspondiente al plomo— cuenta con isótopos estables. La estabilidad de los núcleos disminuye rápidamente para los elementos con un número atómico mayor que el del plutonio, el elemento primordial más pesado, y ningún isótopo con más de 101 protones sintetizado hasta la fecha tiene una vida media superior a un día, con la excepción del dubnio-268.[36] Sin embargo, debido a razones aún no muy bien comprendidas, la estabilidad nuclear aumenta ligeramente alrededor de los números atómicos 110-114, lo que se conoce en física nuclear como la «isla de estabilidad». Este concepto, propuesto por el profesor Glenn Seaborg de la Universidad de California, explica por qué algunos elementos superpesados duran más de lo previsto.[37] El teneso es el segundo elemento más pesado de todos los creados hasta la fecha, y la vida media de su isótopo más estable es de 78 milisegundos, valor sin embargo superior al previsto antes del descubrimiento.[19] El grupo de Dubná cree que la síntesis del elemento es una prueba experimental directa de la existencia de la isla.[35]
La vida media del teneso-295 se ha calculado en (18 ± 7) milisegundos y se considera posible obtener este isótopo a partir de colisiones de berkelio y calcio, como el teneso-294 y el teneso-293, aunque según los cálculos, la probabilidad de producir teneso-295 de esta forma es siete veces menor que la de formar teneso-294.[38][39][40] Un cálculo del período de semidesintegración alfa de varios isótopos del unuseptio con menos de 304 nucleones predice un valor máximo de 40 milisegundos para el teneso-296, basándose en un modelo de túnel cuántico.[41] Otro estudio del Centro Brasileiro de Pesquisas Físicas, basado en el modelo de la gota líquida, también predice que el teneso-296 es el isótopo más estable en esa región;[nota 4] sin embargo, en dicho estudio se examinaron los isótopos hasta el teneso-337 y se halló una tendencia al aumento general de la estabilidad para isótopos más pesados que el teneso-301. Según estos cálculos, el teneso-309 y los isótopos más pesados serán más estables que los dos isótopos sintetizados a la fecha; el teneso-326 podría tener una vida media de más de trescientos años y el isótopo más pesado para el cual existen predicciones, teneso-337, alrededor de 1016 años,[42] un tiempo superior a la edad del Universo.
Propiedades atómicas y físicas[editar]

El teneso es un miembro del grupo 17 en la tabla periódica, que comprende los cinco halógenos (flúor, cloro, bromo, iodo y astato). Cada elemento del grupo 17 tiene siete electrones en su capa de valencia, formando una configuración de electrones de valencia de ns2np5. En el caso del teneso, se prevé que la configuración de electrones de valencia siga la norma y sea 7s27p5;[3] por lo tanto, es de esperar que el teneso se comporte de forma similar a los halógenos en muchos aspectos.
Sin embargo, también es probable que surjan algunas diferencias notables, a las que contribuirá en gran parte la interacción espín-órbita entre el movimiento de los electrones y su espín. Esta interacción es especialmente fuerte para los elementos superpesados, porque sus electrones se mueven mucho más rápidamente que los electrones en elementos más livianos, a velocidades comparables a la velocidad de la luz.[43] A consecuencia de ello, disminuyen los niveles de energía de los niveles 7s y 7p —estabilizando los correspondientes electrones—, pero dos de los niveles de energía 7p están más estabilizados que los otros cuatro.[44] La estabilización de los electrones de 7p se conoce como el efecto del par inerte, y al efecto de dividir la subcapa 7p en dos partes con distinta estabilidad se le llama división de subcapa. En química computacional se describe esta división como un cambio del número cuántico azimutal ℓ de 1 a 1/2 y 3/2 para las partes más y menos estabilizadas de la subcapa 7p, respectivamente.[45][nota 5] Para reflejar la división de la subcapa 7p para propósitos teóricos, la configuración del electrón de valencia se representa como 7s2
7p2
1/27p5
3/2.[3]
También existen diferencias en otros niveles de electrones. Por ejemplo, los niveles 6d también se dividen en subcapas, con cuatro electrones 6d3/2 y seis electrones 6d5/2. Ambos tienen una energía cercana a la del nivel 7s,[44] aunque no se prevé que los electrones 6d participen en enlaces químicos. La diferencia entre los niveles 7p1/2 y 7p3/2 es anormalmente alta, de 9.8 eV.[44] Como comparación, la división de la subcapa 6p del astato solo es de 3.8 eV,[44] y esa diferencia ya entraña una participación limitada de los electrones 6p1/2 en enlaces químicos.[46] Tomados en conjunto, todos esos efectos causan diferencias química entre el teneso y los otros elementos del grupo, detalladas más abajo.

Se calcula que la primera energía de ionización —la energía requerida para remover un electrón de un átomo— sea 7.7 eV, más baja que la de los halógenos de menor número atómico, siguiendo la tendencia en el grupo.[3] Similarmente, se espera que tenga la menor afinidad electrónica —energía emitida cuando un electrón es agregado a un átomo— del grupo, de 2.6 o incluso 1.8 eV.[3] En el átomo hidrogenoide teneso-116+, donde el signo + denota que el átomo está oxidado, el único electrón se movería a tanta velocidad que su masa podría ser unas 1.9 veces mayor que la de un electrón en reposo, característica que proviene de los efectos relativistas mencionados anteriormente. Como comparación, el factor es de 1.27 para el astato hidrogenoide y de 1.08 para el iodo hidrogenoide.[47] De acuerdo a simples extrapolaciones de las leyes de la relatividad, esto conlleva la contracción del radio atómico.[47] Mientras que ciertos cálculos avanzados muestran que el radio de un átomo de teneso que ha formado un enlace covalente mediría 165 pm, mayor que los 147 pm del astato,[48] con los siete electrones más externos eliminados, el teneso es de menor tamaño: 57 pm[3] frente a los 61 pm[49] del astato.
Los puntos de fusión y ebullición del teneso no son conocidos con exactitud. Se han predicho valores alrededor de 350-500 °C y 550 °C respectivamente,[3] o incluso 350-550 °C y 610 °C respectivamente.[50] Esos valores exceden los del astato y de todos los elementos precedentes en el grupo, siguiendo las tendencias periódicas. Un estudio posterior, no obstante, predice un punto de ebullición para el teneso de 345 °C,[51] similar al del astato, estimado en 309 °C,[52] 337 °C,[53] o 370 °C,[54] aunque se han observado valores experimentales de 503 °C[55] y 411 °C.[49]
Propiedades químicas[editar]
Los miembros anteriores del grupo 17 comúnmente aceptan otro electrón para lograr la configuración electrónica estable de un gas noble, con ocho electrones en su capa de valencia (regla del octeto).[56] La propensión a captar un electrón disminuye a medida que aumenta el número atómico dentro del grupo, de tal forma que en el hidruro de astato este cede un electrón al hidrógeno en vez de al contrario; el teneso mostraría una predisposición aún mayor a adquirir un estado de oxidación positivo en compuestos, y el estado −1 sería el menos común.[3]
El teneso también puede completar el octeto mediante la formación de un enlace covalente. Por consiguiente, cuando dos átomos de ununseptium se reúnen, se espera que formen una molécula diatómica, como ocurre con los halógenos. Según los cálculos, en la molécula de At2 el enlace sigma formaría un marcado orbital de antienlace, debido al acoplamiento espín-órbita, que causa que los electrones del orbital molecular se alejen de los núcleos de los átomos enlazados y sen concentren en los extremos de la molécula; es probable que el teneso siga la tendencia a adoptar un enlace covalente débil en la molécula diatómicaTs2 y que está presente un fuerte carácter pi.[3][57] Para la molécula TsCl, se predice un enlace pi simple.[57]
Aparte del mencionado estado de oxidación −1 inestable, el teneso podría presentar otros tres estados de oxidación: +5, +3 y +1, de los que el último sería el más estable; esto se debe a la estabilidad del orbital 7p1/2, que conlleva a su vez la desestabilización de los tres electrones más externos en el orbital 7p3/2,[3] como ya se ha observado en el astato.[58] La contracción de los niveles ns y np1/2, muy marcada al igual que ocurre en el oro, conduce a pensar que el estado +3 del teneso puede parecerse al Au3+ en compuestos haluros;[3] la desestabilización de los electrones 7p3/2, en comparación con los electrones 7p1/2, sugiere que este estado de oxidación también debería ser importante. En cambio, por la misma razón, el estado +5 será poco común[3] y, según los cálculos teoréticos, el estado +7 ni siquiera existirá: dada la estabilidad de los electrones 7s y la diferencia en energía entre estos y los electrones 7p1/2, se ha planteado la hipótesis de que el núcleo de valencia del elemento contenga solo cinco electrones.[59]
El compuesto de teneso más simple posible es el monohidruro TsH. En este enlace participan un electrón 7p3/2 del teneso y el electrón 1s del hidrógeno, sin participación de los electrones 7p1/2. A causa de la ya mencionada desestabilidad energética de los electrones nivel 7p3/2, este nivel se extiende hacia la periferia del núcleo de tal modo que se calcula que la longitud de la molécula TsH aumentaría en 17 picómetros debido a este efecto.[60][61] Como los enlaces de electrones p son dos tercios sigma, el enlace es un tercio más débil que en la ausencia la de interacción espín-órbita.[61] Esto es consistente con las propiedades de los hidruros de halógenos, cuya longitud de enlace aumenta con el número atómico a la vez que energía de disociación disminuye. Para las moléculas TlTs y NhTs se pueden realizar consideraciones análogas, aunque en estos casos también debe tomarse en cuenta que los electrones p1/2 de los metales Tl y Nh son estables, lo que conduce al efecto opuesto: el momento dipolar para el TlTs es relativamente pequeño, solo 1.67 D ——el valor positivo indica que la carga negativa está en el átomo de teneso—; y para el NhTs, de 1.80 D, con la transferencia de un electrón desde el átomo de teneso hacia el átomo de nihonio.[62] En vista de los datos del TsH, es interesante que la interacción espín-órbita aumente la energía de disociación para la molécula de TsF. Esto se debe a que reduce la electronegatividad del teneso, causando que el enlace con el flúor (extremadamente electronegativo) tenga un carácter más iónico.[61] De hecho, el monofluoruro de teneso debería presentar el enlace más fuerte de todos los monofluoruros del grupo 17.[61]
La teoría de repulsión de pares de electrones de valencia (TREPEV) predice que los trifluoruros del grupo 17 tengan una geometría molecular en forma de T, lo que se cumple para todos los trifluoruros de halógeno conocidos que tienen una estructura AX3E2 —un átomo central, indicado como A, rodeado por tres ligandos, X, y dos pares de electrones no compartidos, E—. En la ausencia de efectos relativistas, TsF3 también debería adoptar esta geometría molecular en forma de T, pero debido a la contracción de la capa 7s del teneso, que impide la plena participación de estos electrones en reacciones químicas, la teoría TREPEV predice en este caso una geometría molecular piramidal trigonal (AX3E1). Algunos cálculos más sofisticados muestran, no obstante, que esta geometría molecular no sería energéticamente favorable para TsF3, y predicen en su lugar una geometría molecular trigonal plana (AX3E0), lo que sugiere que la teoría TREPEV no es totalmente válida para los elementos superpesados.[59] También en este caso las interacciones espín-órbita contribuyen a la estabilidad de la molécula, posiblemente gracias a la gran diferencia de electronegatividad entre el teneso y el flúor y el consiguiente carácter iónico del enlace.[59]
Véase también[editar]
- Tabla periódica de los elementos
- Elementos transuránicos
- Berkelio
- Periodo de semidesintegración
- Isla de estabilidad
- Denominación sistemática de elementos
- Instituto Central de Investigaciones Nucleares de Dubná
Notas[editar]
- ↑ Traducción de tennessine difundida originalmente por la agencia SINC,[8] aunque posteriormente rectificó para dar téneso.[9]
- ↑ El término «grupo 17» se refiere al grupo, o columna vertical en la tabla periódica, que comienza con el flúor. No es equivalente al término «halógenos», que se refiere exclusivamente a los elementos flúor, cloro, bromo, iodo y astato.[cita requerida]
- ↑ La denominación «par-impar» e «impar-impar» se refiere al número de protones y de neutrones respectivamente de los isótopos.
- ↑ Estos cálculos obtienen las vidas medias totales, no solo para la desintegración alfa.
- ↑ El número cuántico corresponde a la letra en el nombre del orbital del electrón: 0 para s, 1 para p, 2 para d, etc. Véase número cuántico azimutal para más información
Referencias[editar]
- ↑ Hoffman, D; Lee, D; Pershina, V (2006). «Transactinides and the future elements». En Morss; Edelstein, N; Fuger, J, eds. The Chemistry of the Actinide and Transactinide Elements (en inglés) (Tercera edición). Dordrecht: Springer Science+Business Media. ISBN 978-1-4020-3555-5. OCLC 1113045368.
- ↑ «Tennessine - Element information, properties and uses». Periodic Table (en inglés). Royal Chemical Society.
- ↑ a b c d e f g h i j k l m n ñ o Haire, Richard G. (2006). «Transactinides and the future elements». En Morss; Edelstein, Norman M.; Fuger, Jean, eds. The Chemistry of the Actinide and Transactinide Elements (en inglés) (3ª edición). Dordrecht, Países Bajos: Springer Science+Business Media. pp. 1724. ISBN 1-4020-3555-1.
- ↑ «Nombres y símbolos en español de los elementos aceptados por la IUPAC el 28 de noviembre de 2016 acordados por la RAC, la RAE, la RSEQ y la Fundéu»
- ↑ «Conferencia: Nacionalismos y localismos en la tabla periódica de los elementos químicos». Facultad de Ciencia y Tecnología, Universidad del País Vasco. 9 de noviembre de 2011. Consultado el 19 de abril de 2013. «... el 5 de abril de 2010, un equipo de 33 científicos liderado por el ruso Yu. Ts. Oganesian, publicaba en la prestigiosa revista Physical Review Letters la síntesis de un nuevo elemento con número atómico Z = 117 (teneso). De este modo, se completaba el periodo 7 y, en la actualidad, se conocen 118 elementos.»
- ↑ a b «El Ununseptio, confirmado como nuevo elemento de la tabla periódica». ABC. 5 de mayo de 2014. Consultado el 8 de julio de 2014.
- ↑ a b Rogers, Nala (4 de enero de 2016). «Four new elements complete the seventh row of the periodic table». Science.
- ↑ «Nihonio, moscovio, tenesino y oganesón, nuevos nombres en la tabla periódica». SINC.
- ↑ «Nihonio, moscovio, téneso y oganesón, nuevos nombres en la tabla periódica». SINC.
- ↑
- ↑ «IUPAC announces the names of the elements 113, 115, 117, and 118» (en inglés). IUPAC. 30 de noviembre de 2016.
- ↑ «Fundéu BBVA: "téneso" y "oganesón", mejor que "tenesino" y "oganesson".» La Vanguardia. Consultado el 7 de diciembre de 2016.
- ↑ a b c d e «Element 117: How scientists found the atom at the end of the material» (en inglés). Fox News. 2010. Consultado el 8 de noviembre de 2012.
- ↑ Oganessian, Yu. Ts.; Utyonkov, V. K.; Lobanov, Yu. V.;, Abdullin, F. Sh.; Polyakov, A. N.; Shirokovsky, I. V.; Tsyganov, Yu. S.; Mezentsev, A. N. et al. (2002). «Results from the first 249Cf+48Ca experiment». JINR Communication (en inglés).
- ↑ Audi., G; Wapstra, A. H.;, Thibault, C.; Blachot, J.; Bersillon, O. (2003). «The NUBASE evaluation of nuclear and decay properties». Nuclear Physics A (en inglés) 729 (1): 37-44, 119-120. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- ↑ Jepson, B. E.; Shockley, G. C. (1984). «Calcium hydroxide isotope effect in calcium isotope enrichment by ion exchange». Separation Science and Technology (en inglés) 19 (2-3): 173-181.
- ↑ «Ununseptium – The 117th element» (en inglés). RIA Novosti. 2009. Consultado el 7 de julio de 2012.
- ↑ «Universal nuclide chart». Nucleonica (en inglés). Institute for Transuranium Elements. 2007-2012. Consultado el 3 de julio de 2012. (requiere suscripción).
- ↑ a b c d Oganessian, Yu. Ts. et al. (2010). «Synthesis of a new element with atomic number Z=117». Phys. Rev. Lett. (en inglés) 104 (14): 1-4. doi:10.1103/PhysRevLett.104.142502. (requiere suscripción).
- ↑ a b «International team discovers element 117» (en inglés). Oak Ridge National Laboratory. 2010. Archivado desde el original el 14 de julio de 2014. Consultado el 29 de noviembre de 2012.
- ↑ Greiner, Walter (2010). Recommendations: 31st meeting, PAC for nuclear physics (en inglés). PAC for Nuclear Physics. p. 6. Archivado desde el original el 14 de abril de 2010.
- ↑ «В лабораториях ОИЯИ. Возвращение к дубнию» [In JINR labs. Returning to dubnium] (en ruso). JINR. 2011. Consultado el 9 de noviembre de 2011.
- ↑ Barber, Robert C.; Karol, Paul J.; Nakahara, Hiromichi; Vardaci, Emanuele; Vogt, Erich W. (2011). «Discovery of the elements with atomic numbers greater than or equal to 113 (IUPAC Technical Report)». Pure and Applied Chemistry (en inglés) 83 (7): 1485-1498. doi:10.1351/PAC-REP-10-05-01.
- ↑ «Russian scientists confirm 117th element». RIA Novosti (en inglés). 2012. Consultado el 5 de julio de 2012.
- ↑ «Element 114 is named flerovium and element 116 is named livermorium» (en inglés). JINR. 2012. Consultado el 9 de noviembre de 2012.
- ↑ «New Super-Heavy Element 117 Confirmed by Scientists» (en inglés). LiveScience. Consultado el 2 de mayo de 2014.
- ↑ Cooper, Dani (2 de mayo de 2014). «Physicists add another element to table › News in Science (ABC Science)» (en inglés). Abc.net.au. Consultado el 2 de mayo de 2014.
- ↑ «48Ca + 249Bk Fusion Reaction Leading to Element Z=117: Long-Lived α-Decaying 270Db and Discovery of 266Lr». Physical Review Letters (en inglés) (American Physical Society) 112 (17): 172501. mayo de 2014. doi:10.1103/PhysRevLett.112.172501. Consultado el 8 de mayo de 2014.
- ↑ Stark, Anne M. (1 de mayo de 2014). «Element 117, discovered by Laboratory, one step closer to being named» (en inglés). Laboratorio Nacional Lawrence Livermore. Archivado desde el original el 8 de mayo de 2014. Consultado el 8 de mayo de 2014.
- ↑ a b Chatt, J. (1979). «Recommendations for the naming of elements of atomic numbers greater than 100». Pure and Applied Chemistry (en inglés) 51 (2): 381-384. doi:10.1351/pac197951020381.
- ↑ Martínez Peniche, Jorge Rafael. «Nomenclatura para los Elementos con Número Atómico Mayor a 100». Universidad Nacional Autónoma de México. Archivado desde el original el 6 de marzo de 2016. Consultado el 19 de abril de 2013.
- ↑ Error en la cita: Etiqueta
<ref>no válida; no se ha definido el contenido de las referencias llamadas:0 - ↑ Gramling, Carolyn (8 de junio de 2016). «Four new element names are on the table». Science.
- ↑ «IUPAC is naming the four new elements nihonium, moscovium, tennessine, and oganesson». 8 de junio de 2016. Archivado desde el original el 8 de junio de 2016.
- ↑ a b «Синтез нового 117-го элемента» [Synthesis of the new 117th element] (en ruso). JINR. 2010. Consultado el 9 de noviembre de 2012.
- ↑ Marcillac, Pierre de; Coron, Noël; Dambier, Gérard; Leblanc, Jacques; Moalic, Jean-Pierre (2003). «Experimental detection of α-particles from the radioactive decay of natural bismuth». Nature (en inglés) 422 (6934): 876-878. Bibcode:2003Natur.422..876D. PMID 12712201. doi:10.1038/nature01541.
- ↑ Kulik, Glenn D. (2002). Van Nostrand's scientific encyclopedia (en inglés) (9 edición). Wiley-Interscience. ISBN 978-0-471-33230-5. OCLC 223349096.
- ↑ Zagrebaev, Valeriy; Karpov, Alexander; Greiner, Walter (2013 título=Future of superheavy element research: Which nuclei could be synthesized within the next few years?). Journal of Physics: Conference Series (en inglés) (IOP Science) 420: 1-15 http://iopscience.iop.org/1742-6596/420/1/012001/pdf/1742-6596_420_1_012001.pdf
|url=sin título (ayuda). - ↑ Zhao-Qing, Feng; Gen-Ming, Jin; Ming-Hui, Huang; Zai-Guo, Gan; Nan, Wang; Jun-Qing, Li (2007). «Possible Way to Synthesize Superheavy Element Z = 117». Chinese Physics Letters (en inglés) 24 (9): 2551. Bibcode:2007ChPhL..24.2551F. doi:10.1088/0256-307X/24/9/024.
- ↑ Feng, Z.; Jin, G.; Li, J.; Scheid, W. (2009). «Production of heavy and superheavy nuclei in massive fusion reactions». Nuclear Physics A (en inglés) 816: 33. Bibcode:2009NuPhA.816...33F. doi:10.1016/j.nuclphysa.2008.11.003.
- ↑ Chowdhury, Roy P.; Samanta, C.; Basu, D. N. (2008). «Search for long lived heaviest nuclei beyond the valley of stability». Physical Reviews C (en inglés) 77 (4): 044603. Bibcode:2008PhRvC..77d4603C. arXiv:0802.3837. doi:10.1103/PhysRevC.77.044603.
- ↑ a b Duarte, S. B.; et al. (2004). Half-life prediction for decay modes for superheavy nuclei (en inglés). Centro Brasiliero de Pesquisas Físicas. ISSN 0029-3865.
- ↑ Thayer, 2010, pp. 63-64.
- ↑ a b c d Fægri, K.; Saue, T. (2001). «Diatomic molecules between very heavy elements of group 13 and group 17: A study of relativistic effects on bonding». The Journal of Chemical Physics (en inglés) 115 (6): 2456. doi:10.1063/1.1385366.
- ↑ Thayer, 2010, pp. 63-67.
- ↑ Thayer, 2010, p. 79.
- ↑ a b Thayer, 2010, p. 64.
- ↑ Pyykkö, P.; Atsumi, M. «Molecular Single-Bond Covalent Radii for Elements 1-118». Chemistry - A European Journal (en inglés) 15: 186. doi:10.1002/chem.200800987.
- ↑ a b Sharma, B. K. (2001). Nuclear and radiation chemistry (en inglés) (7th edición). Krishna Prakashan Media. p. 147. ISBN 978-81-85842-63-9. Consultado el 9 de noviembre de 2012.
- ↑ Seaborg, G. T. (1994). Modern alchemy (en inglés). World Scientific. p. 172. ISBN 981-02-1440-5.
- ↑ Takahashi, N. (2002). «Boiling points of the superheavy elements 117 and 118». Journal of Radioanalytical and Nuclear Chemistry (en inglés) 251 (2): 299-301. doi:10.1023/A:1014880730282.
- ↑ Luig, Heribert; Keller, Comelius; Wolf, Walter; Shani, Jashovam; Miska, Horst; Zyball, Alfred; Gervé, Andreas; Balaban, Alexandru T.; Kellerer, Albrecht M.; Griebel, Jüfgen (2005). «Radionuclides». En Ullmann, Franz, ed. Encyclopedia of industrial chemistry (en inglés). Wiley-VCH. p. 23. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a22_499.
- ↑ Punter, Jacqui; Johnson, Robert; Langfield, Steve (2006). The essentials of GCSE OCR Additional science for specification B (en inglés). Letts and Lonsdale. p. 36. ISBN 978-1-905129-73-7.
- ↑ Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Inorganic chemistry (en inglés). Academic Press. p. 423. ISBN 978-0-12-352651-9.
- ↑ Otozai, K.; Takahashi, N. (1982). «Estimation chemical form boiling point elementary astatine by radio gas chromatography». Radiochimica Acta (en inglés) 31 (3‒4): 201‒203.
- ↑ Bader, Richard F. W. «An introduction to the electronic structure of atoms and molecules» (en inglés). McMaster University. Consultado el 18 de enero de 2008.
- ↑ a b Pershina, 2010, p. 504.
- ↑ Thayer, 2010, p. 84.
- ↑ a b c Bae, C.; Han, Y. K.; Lee, Y. S. (2003). «Spin−Orbit and Relativistic Effects on Structures and Stabilities of Group 17 Fluorides EF3 (E = I, At, and Element 117): Relativity Induced Stability for the D3h Structure of (117)F3». The Journal of Physical Chemistry A (en inglés) 107 (6): 852. doi:10.1021/jp026531m.
- ↑ Stysziński, 2010, pp. 144-146.
- ↑ a b c d Han, Y. K.; Bae, C.; Son, S. K.; Lee, Y. S. (2000). «Spin-orbit effects on the transactinide p-block element monohydrides MH (M=element 113-118)». Journal of Chemical Physics (en inglés) 112 (6): 2684-2691. Bibcode:2000JChPh.112.2684H. doi:10.1063/1.480842.
- ↑ Stysziński, 2010, pp. 139-146.
Bibliografía[editar]
- Barysz, M.; Ishikawa, Y., ed. (2010). Relativistic methods for chemists. Springer Science+Business Media. ISBN 978-1-4020-9974-8.
- Pershina, V. (2010). Electronic structure and chemistry of the heaviest elements. doi:10.1007/978-1-4020-9975-5_11.
- Stysziński, Jacek (2010). Why do we need relativistic computational methods?. doi:10.1007/978-1-4020-9975-5_3.
- Thayer, John S. (2010). Chemistry of heavier main group elements. doi:10.1007/978-1-4020-9975-5_2.
Enlaces externos[editar]
 Wikimedia Commons alberga una galería multimedia sobre Teneso.
Wikimedia Commons alberga una galería multimedia sobre Teneso. Wikcionario tiene definiciones y otra información sobre teneso.
Wikcionario tiene definiciones y otra información sobre teneso.- WebElements.com - Ts.
- El ununseptium rellena una casilla en blanco en la tabla periódica. Noticia aparecida en El País (7 de abril de 2010).
- Comunicado de prensa del Laboratorio Flerov Archivado el 13 de octubre de 2014 en Wayback Machine. anunciando la síntesis del elemento.
- Esta obra contiene una traducción parcial derivada de «Tennessine» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.




