Diferencia entre revisiones de «Infección por estreptococo del grupo B»
m Bot: ajustando referencias al Manual de estilo. Retirando espacio antes de las referencias. |
REVISION AND UPDATE |
||
| Línea 1: | Línea 1: | ||
La [[infección]] por [[estreptococo]] del grupo B es la [[infección]] causada por la [[bacteria]] ''[[Streptococcus agalactiae]]'' (''S. agalactiae''), también conocida como Estreptococo Grupo B, EGB (Group B Streptococcus, en inglés, GBS). La infección causada por EGB puede dar lugar a una [[enfermedad]] grave e incluso mortal, especialmente en recién nacidos (RN), ancianos y personas con [[Inmunidad (medicina)|inmunidad]] disminuida. El EGB fue reconocido inicialmente como patógeno en el ganado bovino por [[Edmond Nocard]] (1850-1903, veterinario y microbiólogo francés) al final de la década de 1880, pero su importancia como [[Agente biológico patógeno|patógeno]] humano no fue descubierta hasta 1938 cuando Fry<ref name="Fry 1938">{{cita publicación|apellidos1=Fry RM|título=Fatal infections by haemolytic streptococcus group|publicación=Lancet|fecha=1938|volumen=1|páginas=199-201}}</ref> describió tres casos de [[Infección puerperal]] causados por EGB. Al principio de la década de 1960 el EGB fue también reconocido como una importante causa de infección grave en el recién RN.<ref name="Eickhoff 1963">{{cita publicación|apellidos1=Eickhoff TC, Klein JO, Kathleen Daly A, David Ingall, Finland M.|título=Neonatal Sepsis and Other Infections Due to Group B Beta-Hemolytic Streptococci|publicación=New Enland J Med|fecha=1963|número=271|páginas=1221-1228|doi=10.1056/NEJM196412102712401}}</ref> |
La [[infección]] por [[estreptococo]] del grupo B es la [[infección]] causada por la [[bacteria]] ''[[Streptococcus agalactiae]]'' (''S. agalactiae''), también conocida como Estreptococo Grupo B, EGB (Group B Streptococcus, en inglés, GBS). La infección causada por EGB puede dar lugar a una [[enfermedad]] grave e incluso mortal, especialmente en recién nacidos (RN), ancianos y personas con [[Inmunidad (medicina)|inmunidad]] disminuida. El EGB fue reconocido inicialmente como patógeno en el ganado bovino por [[Edmond Nocard]] (1850-1903, veterinario y microbiólogo francés) al final de la década de 1880, pero su importancia como [[Agente biológico patógeno|patógeno]] humano no fue descubierta hasta 1938 cuando Fry<ref name="Fry 1938">{{cita publicación|apellidos1=Fry RM|título=Fatal infections by haemolytic streptococcus group|publicación=Lancet|fecha=1938|volumen=1|páginas=199-201}}</ref> describió tres casos de [[Infección puerperal]] causados por EGB. Al principio de la década de 1960 el EGB fue también reconocido como una importante causa de infección grave en el recién RN.<ref name="Eickhoff 1963">{{cita publicación|apellidos1=Eickhoff TC, Klein JO, Kathleen Daly A, David Ingall, Finland M.|título=Neonatal Sepsis and Other Infections Due to Group B Beta-Hemolytic Streptococci|publicación=New Enland J Med|fecha=1963|número=271|páginas=1221-1228|doi=10.1056/NEJM196412102712401}}</ref> |
||
En general, EGB es una [[bacteria]] inofensiva que forma parte de la [[Microbiota normal|microbiota]] normal (flora normal) humana y que coloniza (se establece y multiplica en la piel o mucosas del [[Huésped (biología)|huésped]] sin causar infección) el tracto gastrointestinal y el tracto genital de hasta un 30% de los adultos humanos sanos (portador asintomático).<ref name= |
En general, EGB es una [[bacteria]] inofensiva que forma parte de la [[Microbiota normal|microbiota]] normal (flora normal) humana y que coloniza (se establece y multiplica en la piel o mucosas del [[Huésped (biología)|huésped]] sin causar infección) el tracto gastrointestinal y el tracto genital de hasta un 30% de los adultos humanos sanos (portador asintomático).<ref name=Familydoctor>{{cita web|título=Infección por estreptococo del grupo B|url=https://es.familydoctor.org/condicion/infeccion-por-estreptococo-del-grupo-b-es/?adfree=true|editorial=Academia Americana de Médicos de Familia.|idioma=Español|fechaacceso=30 de octubre de 2023}}</ref> |
||
<ref name="CDC - EGB">{{cita web|apellidos1=CDC-Centro para el Control y la Prevencion de Enfermedades|título=Información acerca del estreptococo del grupo B|url=https://www.cdc.gov/groupbstrep/about/index-sp.html|idioma=Español|fecha=18 de octubre del 2022|fechaacceso=30 de octubre de 2023}}</ref><ref name=Mandel>{{cita libro|apellidos1=Edwards MS, Baker CJ|título=Streptococcus agalactiae (group B streptococcus). "In" Mandell GL, Bennett JE, Dolin R (eds). Principles and practice of infectious diseases. Vol 2. Capitulo 202|fecha=2010|editorial=Elsevier|isbn=978-0-443-06839-3|edición=7th}}</ref><ref name="Edwards MS, Nizet V.">{{cita libro|apellidos1=Edwards MS, Nizet V.|título=Group B streptococcal infections. "in" Infectious Diseases of the Fetus and Newborn Infant.|fecha=2011|editorial=Elsevier|isbn=978-0-443-06839-3|páginas=419-469|edición=7th 2011}}</ref><ref name=":Perez Trallero">{{Cita libro|apellidos = Perez Trallero E, Cueto Lopez M, Muñoz Garcia P.|nombre = Capitulo 11. Cocos grampositivos y gramnegativos- Streptococcus agalactiae. p 124.|enlaceautor = |título = "En" Microbiología en Ciencias de la Salud. 3ª Ed. 2011. Rosa-Fraile M, Prieto J, Navarro JM. (editores)|año = 2011|url =https://archive.org/details/microbiologaenci0000unse|fechaacceso = |editorial = Elsevier|isbn = 978-84-8086-692-7|editor = |ubicación = |página = |idioma = español|capítulo = }}</ref> |
|||
EGB es también un patógeno veterinario que causa [[Mastitis (animales domésticos)|mastitis]] (inflamación de las ubres) en el ganado bovino, el nombre "agalactiae" significa sin leche.<ref name=":Keefe">{{Cita publicación|url=http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1576741/pdf/canvetj00092-0031.pdf|título=Streptococcus agalactiae mastitis: a review.|apellidos=Keefe GP|nombre=|fecha=|publicación=Can Vet J. 1997; 38:199-204|fechaacceso=10 de noviembre de 2019|doi=|pmid=}}</ref><ref name=":Milk Quality">{{Cita web|url=http://milkquality.wisc.edu/wp-content/uploads/2011/09/streptococcus-agalactiae_spanish.pdf|título=Milk Quality Factsheet. Streptococcus agalactiae. EN ESPAÑOL.|fechaacceso=10 de noviembre de 2019|autor=University of Wisconsin-Madison, Dept of Dairy Science|enlaceautor=|fecha=|sitioweb=|editorial=|idioma=Español|urlarchivo=https://web.archive.org/web/20160223001042/http://milkquality.wisc.edu/wp-content/uploads/2011/09/streptococcus-agalactiae_spanish.pdf|fechaarchivo=23 de febrero de 2016}}</ref> |
EGB es también un patógeno veterinario que causa [[Mastitis (animales domésticos)|mastitis]] (inflamación de las ubres) en el ganado bovino, el nombre "agalactiae" significa sin leche.<ref name=":Keefe">{{Cita publicación|url=http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1576741/pdf/canvetj00092-0031.pdf|título=Streptococcus agalactiae mastitis: a review.|apellidos=Keefe GP|nombre=|fecha=|publicación=Can Vet J. 1997; 38:199-204|fechaacceso=10 de noviembre de 2019|doi=|pmid=}}</ref><ref name=":Milk Quality">{{Cita web|url=http://milkquality.wisc.edu/wp-content/uploads/2011/09/streptococcus-agalactiae_spanish.pdf|título=Milk Quality Factsheet. Streptococcus agalactiae. EN ESPAÑOL.|fechaacceso=10 de noviembre de 2019|autor=University of Wisconsin-Madison, Dept of Dairy Science|enlaceautor=|fecha=|sitioweb=|editorial=|idioma=Español|urlarchivo=https://web.archive.org/web/20160223001042/http://milkquality.wisc.edu/wp-content/uploads/2011/09/streptococcus-agalactiae_spanish.pdf|fechaarchivo=23 de febrero de 2016}}</ref><ref name=Kabelitz>{{cita publicación|apellidos1=Kabelitz T, Aubry E, van Vorst K, Amon T, Fulde M|título=The Role of Streptococcus spp. in Bovine Mastitis.|publicación=Microorganisms|fecha=2021|volumen=9|páginas=1497|doi=10.3390/microorganisms9071497|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8305581/pdf/microorganisms-09-01497.pdf |fechaacceso=30 de octubre de 2023}}</ref> |
||
EGB es un coco (bacteria esférica) [[Bacteria grampositiva|gram]] positivo con tendencia a formar cadenas ([[estreptococo]]). EGB es beta-[[Agar sangre|hemolítico]] en [[Agar sangre|agar]] sangre, [[catalasa]] negativo y [[Organismo aerobio|aerobio]] facultativo.<ref name=":Bergey`s 2009">{{Cita libro|apellidos = Whiley RA, Hardie JM.|nombre = |enlaceautor = |título = Genus I. Streptococcus Rosenbach 1884. Pag. 655-657. "In" Bergey's Manual of Systematic Bacteriology: Vol 3: The Firmicutes. (2nd. ed.). 2009.|url = |fechaacceso = |año = |editorial = Springer|isbn = 978-0-387-95041-9|editor = |ubicación = |página = |idioma = Inglés|capítulo = }}</ref><ref name=":Sherris 2004">{{Cita libro|apellidos = |nombre = |enlaceautor = |título = Ryan KJ. Streptococci and Enterococci. "In" Sherris Medical Microbiology. Ryan KJ, Ray CG, eds. 2004. Chapter 17. Pag.286-288.|url = |año = |editorial = McGraw Hill.|isbn = 0-8385-8529-9|editor = |ubicación = |página = |idioma = Inglés|capítulo = }}</ref><ref name=":Bailey & Scott's 2014">{{Cita libro|apellidos = Tille P. (2014).|nombre = |enlaceautor = |título = Bailey & Scott's Diagnostic Microbiology (13th. ed.).|año = 2014|url =https://archive.org/details/baileyscottsdiag0000till_edi13th|fechaacceso = |editorial = Elsevier|isbn = 978-0-323-08330-0|editor = |ubicación = |página = |idioma = Inglés|capítulo = }}</ref> |
EGB es un coco (bacteria esférica) [[Bacteria grampositiva|gram]] positivo con tendencia a formar cadenas ([[estreptococo]]). EGB es beta-[[Agar sangre|hemolítico]] en [[Agar sangre|agar]] sangre, [[catalasa]] negativo y [[Organismo aerobio|aerobio]] facultativo.<ref name=":Bergey`s 2009">{{Cita libro|apellidos = Whiley RA, Hardie JM.|nombre = |enlaceautor = |título = Genus I. Streptococcus Rosenbach 1884. Pag. 655-657. "In" Bergey's Manual of Systematic Bacteriology: Vol 3: The Firmicutes. (2nd. ed.). 2009.|url = |fechaacceso = |año = |editorial = Springer|isbn = 978-0-387-95041-9|editor = |ubicación = |página = |idioma = Inglés|capítulo = }}</ref><ref name=":Sherris 2004">{{Cita libro|apellidos = |nombre = |enlaceautor = |título = Ryan KJ. Streptococci and Enterococci. "In" Sherris Medical Microbiology. Ryan KJ, Ray CG, eds. 2004. Chapter 17. Pag.286-288.|url = |año = |editorial = McGraw Hill.|isbn = 0-8385-8529-9|editor = |ubicación = |página = |idioma = Inglés|capítulo = }}</ref><ref name=":Bailey & Scott's 2014">{{Cita libro|apellidos = Tille P. (2014).|nombre = |enlaceautor = |título = Bailey & Scott's Diagnostic Microbiology (13th. ed.).|año = 2014|url =https://archive.org/details/baileyscottsdiag0000till_edi13th|fechaacceso = |editorial = Elsevier|isbn = 978-0-323-08330-0|editor = |ubicación = |página = |idioma = Inglés|capítulo = }}</ref> |
||
| Línea 10: | Línea 12: | ||
''S. agalactiae'' es el nombre de la [[especie]] de los estreptococos pertenecientes al grupo B de la clasificación de Lancefield ([[Sistema de Lancefield|sistema]] de Lancefield). EGB está rodeado por una [[Cápsula (microbiología)|cápsula]] compuesta de [[polisacáridos]] (exopolisacáridos) determinados por los productos de genes del operon cps<ref name="Toniolo 2015">{{cita publicación|apellidos1=Toniolo C, Balducci E, Romano MR, Proietti D, Ferlenghi I, Grandi G, Berti F, Ros IM, Janulczyk R.|título=Streptococcus agalactiae capsule polymer length and attachment is determined by the proteins CpsABCD|publicación=J Biol Chem.|fecha=2015|volumen=290|páginas=9521-9532.|doi=10.1074/jbc.M114.631499|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4392257/pdf/zbc9521.pdf|fechaacceso=7 de febrero de 2021}}</ref> y según el polisacárido de su [[Cápsula (microbiología)|cápsula]] se clasifica en 10 [[Serotipo|serotipos]] (Ia, Ib, II-IX).<ref name="Edwards MS, Nizet V." /><ref name=":Bergey`s 2009" /><ref name= ": Slotved 2007">{{Cita publicación|url=http://jcm.asm.org/content/45/9/2929.full.pdf|título=Serotype IX, a proposed new Streptococcus agalactiae serotype.|apellidos=Slotved HC, Kong F, Lambertsen L, Sauer S, Gilbert GL.|nombre=|fecha=2007|publicación=J Clin Microbiol. 2007; 45:2929-2936.|volumen=|fechaacceso=10 de noviembre de 2019|página=|doi=10.1128/JCM.00117-07|pmid=|año=|fechaarchivo=22 de julio de 2018|urlarchivo=https://web.archive.org/web/20180722004421/http://jcm.asm.org/content/45/9/2929.full.pdf|deadurl=yes}}</ref> |
''S. agalactiae'' es el nombre de la [[especie]] de los estreptococos pertenecientes al grupo B de la clasificación de Lancefield ([[Sistema de Lancefield|sistema]] de Lancefield). EGB está rodeado por una [[Cápsula (microbiología)|cápsula]] compuesta de [[polisacáridos]] (exopolisacáridos) determinados por los productos de genes del operon cps<ref name="Toniolo 2015">{{cita publicación|apellidos1=Toniolo C, Balducci E, Romano MR, Proietti D, Ferlenghi I, Grandi G, Berti F, Ros IM, Janulczyk R.|título=Streptococcus agalactiae capsule polymer length and attachment is determined by the proteins CpsABCD|publicación=J Biol Chem.|fecha=2015|volumen=290|páginas=9521-9532.|doi=10.1074/jbc.M114.631499|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4392257/pdf/zbc9521.pdf|fechaacceso=7 de febrero de 2021}}</ref> y según el polisacárido de su [[Cápsula (microbiología)|cápsula]] se clasifica en 10 [[Serotipo|serotipos]] (Ia, Ib, II-IX).<ref name="Edwards MS, Nizet V." /><ref name=":Bergey`s 2009" /><ref name= ": Slotved 2007">{{Cita publicación|url=http://jcm.asm.org/content/45/9/2929.full.pdf|título=Serotype IX, a proposed new Streptococcus agalactiae serotype.|apellidos=Slotved HC, Kong F, Lambertsen L, Sauer S, Gilbert GL.|nombre=|fecha=2007|publicación=J Clin Microbiol. 2007; 45:2929-2936.|volumen=|fechaacceso=10 de noviembre de 2019|página=|doi=10.1128/JCM.00117-07|pmid=|año=|fechaarchivo=22 de julio de 2018|urlarchivo=https://web.archive.org/web/20180722004421/http://jcm.asm.org/content/45/9/2929.full.pdf|deadurl=yes}}</ref> |
||
Como otras bacterias patógenas EGB posee varios factores de [[virulencia]],<ref name=":Maisey, Doran 2009">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2676346/pdf/nihms-110577.pdf|título = Recent advances in understanding the molecular basis of group B Streptococcus virulence.|apellidos = Maisey HC, Doran KS, Nizet V.|nombre = |fecha = |publicación = Expert Rev Mol Med. 2009;10: e27.|fechaacceso = |doi = 10.1017/S1462399408000811|pmid = |volumen = |idioma = Ingles.}}</ref><ref name="Armistead-Oler 2019" /> de ellos los más importante parecen ser el polisacárido capsular (rico en ácido [[Ácido siálico|sialico]]) y la beta-[[hemolisina]], que se comporta como una [[toxina]] productora de poros en las células [[Células eucariotas|eucariotas]].<ref name="Armistead-Oler 2019">{{cita publicación|apellidos1=Armistead B, Oler E, Adams Waldorf K, Rajagopal L.|título=The double life of Group B Streptococcus: Asymptomatic colonizer and potent pathogen|publicación=J Mol Biol|fecha=2019|volumen=431|páginas=2914-2931|doi=10.1016/j.jmb.2019.01.035|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6646060/pdf/nihms-1521909.pdf|fechaacceso=25 de enero de 2021}}</ref><ref name=": Rajagopal 2009">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2691590/pdf/nihms114724.pdf|título = Understanding the regulation of Group B Streptococcal virulence factors.|apellidos = Rajagopal L.|nombre = |fecha = |publicación = Future Microbiol. 2009; 4: 201-221.|fechaacceso = |doi = 10.2217/17460913.4.2.201|pmid = |volumen = |páginas = |idioma = Inglés}}</ref><ref name=" Leclercq 2016">{{Cita publicación|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4935997/|título=Pathogenesis of Streptococcus urinary tract infection depends on bacterial strain and β-hemolysin/cytolysin that mediates cytotoxicity, cytokine synthesis, inflammation and virulence.|apellidos=Leclercq SY, Sullivan MJ, Ipe DS, Smith JP, Cripps AW, Ulett GC.| |
Como otras bacterias patógenas EGB posee varios factores de [[virulencia]],<ref name=":Maisey, Doran 2009">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2676346/pdf/nihms-110577.pdf|título = Recent advances in understanding the molecular basis of group B Streptococcus virulence.|apellidos = Maisey HC, Doran KS, Nizet V.|nombre = |fecha = |publicación = Expert Rev Mol Med. 2009;10: e27.|fechaacceso = |doi = 10.1017/S1462399408000811|pmid = |volumen = |idioma = Ingles.}}</ref><ref name="Armistead-Oler 2019" /> de ellos los más importante parecen ser el polisacárido capsular (rico en ácido [[Ácido siálico|sialico]]) y la beta-[[hemolisina]], que se comporta como una [[toxina]] productora de poros en las células [[Células eucariotas|eucariotas]].<ref name="Armistead-Oler 2019">{{cita publicación|apellidos1=Armistead B, Oler E, Adams Waldorf K, Rajagopal L.|título=The double life of Group B Streptococcus: Asymptomatic colonizer and potent pathogen|publicación=J Mol Biol|fecha=2019|volumen=431|páginas=2914-2931|doi=10.1016/j.jmb.2019.01.035|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6646060/pdf/nihms-1521909.pdf|fechaacceso=25 de enero de 2021}}</ref><ref name=": Rajagopal 2009">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2691590/pdf/nihms114724.pdf|título = Understanding the regulation of Group B Streptococcal virulence factors.|apellidos = Rajagopal L.|nombre = |fecha = |publicación = Future Microbiol. 2009; 4: 201-221.|fechaacceso = |doi = 10.2217/17460913.4.2.201|pmid = |volumen = |páginas = |idioma = Inglés}}</ref><ref name=" Leclercq 2016">{{Cita publicación|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4935997/|título=Pathogenesis of Streptococcus urinary tract infection depends on bacterial strain and β-hemolysin/cytolysin that mediates cytotoxicity, cytokine synthesis, inflammation and virulence.|apellidos=Leclercq SY, Sullivan MJ, Ipe DS, Smith JP, Cripps AW, Ulett GC.|url=https://www.nature.com/articles/srep29000|publicación=Sci Rep. 2016 Jul 7;6:29000|fechaacceso= 30 de octubre de 2023|doi=10.1038/srep2900}}</ref> |
||
Respecto a la hemolisina de EGB actualmente se considera que es idéntica al pigmento de EGB ([[granadaeno]]) o bien este constituye una parte de la molécula de hemolisina.<ref name="Whidbey 2013">{{Cita publicación|url = http://jem.rupress.org/content/210/6/1265.full.pdf+html|título = A hemolytic pigment of Group B Streptococcus allows bacterial penetration of human placenta.|apellidos = Whidbey C, Harrell MI, Burnside K, Ngo L, Becraft AK, Iyer LM, Aravind L, Hitti J, Waldorf KM, Rajagopal L.|nombre = |fecha = |
Respecto a la hemolisina de EGB actualmente se considera que es idéntica al pigmento de EGB ([[granadaeno]]) o bien este constituye una parte de la molécula de hemolisina.<ref name="Whidbey 2013">{{Cita publicación|url = http://jem.rupress.org/content/210/6/1265.full.pdf+html|título = A hemolytic pigment of Group B Streptococcus allows bacterial penetration of human placenta.|apellidos = Whidbey C, Harrell MI, Burnside K, Ngo L, Becraft AK, Iyer LM, Aravind L, Hitti J, Waldorf KM, Rajagopal L.|nombre = |fecha =|url=https://rupress.org/jem/article-pdf/210/6/1265/1747806/jem_20122753.pdf|publicación = J Exp Med. 2013; 210: 1265-1281.|fechaacceso = |doi = |pmid = }}</ref><ref name= "Rosa 2014">{{Cita publicación|url = http://femsre.oxfordjournals.org/content/femsre/38/5/932.full.pdf|título = Group B streptococcal haemolysin and pigment, a tale of twins.|apellidos = Rosa-Fraile M, Dramsi S, Spellerberg B.|nombre = |fecha = 2014|publicación = FEMS Microbiol Rev. 38.: 932-946.|fechaacceso = |doi = |pmid = }}</ref><ref name= "Widbey 2015">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4403049/pdf/emmm0007-0488.pdf|título = A streptococcal lipid toxin induces membrane permeabilization and pyroptosis leading to fetal injury.|apellidos = Whidbey C, Vornhagen J, Gendrin C, Boldenow E, Samson JM, Doering K, Ngo L, Ezekwe EA Jr, Gundlach JH, Elovitz MA, Liggitt D, Duncan JA, Adams Waldorf KM, Rajagopal L.|nombre = |fecha = 2015.|publicación = EMBO Mol Med. 2015; 7: 488-505.|fechaacceso = |doi = 10.15252/emmm.201404883|pmid = }}</ref><ref name= "Widbey Univ Washington">{{Cita web|url=https://digital.lib.washington.edu/researchworks/bitstream/handle/1773/33228/Whidbey_washington_0250E_14193.pdf|título=Characterization of the Group B Streptococcus Hemolysin and its Role in Intrauterine Infection.|fechaacceso=5 de noviembre de 2019|autor=Christopher-Mychael Whidbey|enlaceautor=|fecha=2015|sitioweb=University of Washington.|editorial=|idioma=Inglés}}</ref> |
||
[[Archivo:Streptococcus agalactiae on blood agar.JPG|thumb|Colonias beta-hemolíticas de ''Streptococcus agalactiae'' en agar sangre.]] |
[[Archivo:Streptococcus agalactiae on blood agar.JPG|thumb|Colonias beta-hemolíticas de ''Streptococcus agalactiae'' en agar sangre.]] |
||
La cápsula de |
La cápsula de EGB es probablemente el factor de virulencia más importante pues le permite al EGB evitar la acción de los mecanismos de defensa del huésped interfiriendo con la capacidad de [[Fagocitosis|fagocitar]] y destruir la bacteria de los [[Fagocito|fagocitos]] humanos.<ref name="Edwards MS, Nizet V." /><ref name="Armistead-Oler 2019" /><ref name=": Rajagopal 2009" /> |
||
[[Archivo:Granadaene.png|thumb|Granadaeno- Ornitinramnododecaeno producido por ''Streptococcus agalactiae''|292x292px]] |
[[Archivo:Granadaene.png|thumb|Granadaeno- Ornitinramnododecaeno producido por ''Streptococcus agalactiae''|292x292px]] |
||
| Línea 23: | Línea 25: | ||
Como se ha indicado, EGB es un coco gram positivo con tendencia a formar cadenas, beta hemolítico, [[catalasa]] negativo y [[Organismo aerobio|aerobio]] [[Bacteria facultativa|facultativo]]. El EGB crece fácilmente en agar sangre como colonias rodeadas por un halo pequeño de β-hemólisis. |
Como se ha indicado, EGB es un coco gram positivo con tendencia a formar cadenas, beta hemolítico, [[catalasa]] negativo y [[Organismo aerobio|aerobio]] [[Bacteria facultativa|facultativo]]. El EGB crece fácilmente en agar sangre como colonias rodeadas por un halo pequeño de β-hemólisis. |
||
EL EGB se caracteriza por poseer en su pared celular el [[antígeno]] B de la clasificación de [[Rebeca Lancefield]], que puede ser detectado directamente en la bacteria utilizando pruebas de aglutinación con látex, lo que permite identificarlo fácilmente. Hay que tener en cuenta que en la identificación de EGB por detección del antígeno B pueden darse reacciones falsamente positivas con algunos otros estreptocococos como ''S. pseudoporcinus'' and ''S.thalichoeri''.<ref name=":Bailey & Scott's 2014" /><ref name="Rosa-Fraile 2017">{{cita publicación|apellidos1=Rosa-Fraile M, Spellerberg B.|título=Reliable Detection of Group B Streptococcus in the Clinical Laboratory.|publicación=Journal of Clinical Microbiology|fecha=2017|volumen=55|número=9|páginas=2590-2598.|doi=10.1128/JCM.00582-17|pmid=28659318|fechaacceso= |
EL EGB se caracteriza por poseer en su pared celular el [[antígeno]] B de la clasificación de [[Rebeca Lancefield]], que puede ser detectado directamente en la bacteria utilizando pruebas de aglutinación con látex, lo que permite identificarlo fácilmente. Hay que tener en cuenta que en la identificación de EGB por detección del antígeno B pueden darse reacciones falsamente positivas con algunos otros estreptocococos como ''S. pseudoporcinus'' and ''S.thalichoeri''.<ref name=":Bailey & Scott's 2014" /><ref name="Rosa-Fraile 2017">{{cita publicación|apellidos1=Rosa-Fraile M, Spellerberg B.|título=Reliable Detection of Group B Streptococcus in the Clinical Laboratory.|publicación=Journal of Clinical Microbiology|fecha=2017|volumen=55|número=9|páginas=2590-2598. | url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5648696/pdf/zjm2590.pdf|doi=10.1128/JCM.00582-17|pmid=28659318|fechaacceso=30 de octubre de 2023}}</ref><ref name="ASM 3020">{{cita web|apellidos1=Filkins L, Hauser J, Robinson-Dunn B, Tibbetts R, Boyanton B, Revell P.|título=10 March 2020. Guidelines for the Detection and Identification of Group B Streptococcus|url=https://asm.org/ASM/media/Policy-and-Advocacy/images/ASM-GBS-guideline-031020.pdf?ext=.pdfeditorial=American Society for Microbiology.|url=https://web.archive.org/web/20210627062706/https://asm.org/ASM/media/Policy-and-Advocacy/images/ASM-GBS-guideline-031020.pdf?ext=.pdf |idioma=Inglés|fechaacceso=30 de octubre de 2023}}</ref> |
||
EGB también puede ser identificado en el laboratorio usando el test de CAMP basado en la demostración en el EGB del factor CAMP, capaz de actuar conjuntamente con la beta-hemolisina de los [[estafilococos]] y producir una incremento de la hemólisis en hematíes bovinos o de cordero.<ref name=":Bailey & Scott's 2014" /><ref name="Identif Bact SEIMC 2010">{{cita libro|apellidos1=Ana Fernández Olmos, Celia García de la Fuente, Juan Antonio Saéz Nieto, Sylvia Valdezate Ramos|título=Metodos de identificación bacteriana en el laboratorio de microbiología|fecha=2010|editorial=Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica|isbn=978-84-614-7932-0|url=https://www.seimc.org/contenidos/documentoscientificos/procedimientosmicrobiologia/seimc-procedimientomicrobiologia37.pdf|fechaacceso= |
EGB también puede ser identificado en el laboratorio usando el test de CAMP basado en la demostración en el EGB del factor CAMP, capaz de actuar conjuntamente con la beta-hemolisina de los [[estafilococos]] y producir una incremento de la hemólisis en hematíes bovinos o de cordero.<ref name=":Bailey & Scott's 2014" /><ref name="Identif Bact SEIMC 2010">{{cita libro|apellidos1=Ana Fernández Olmos, Celia García de la Fuente, Juan Antonio Saéz Nieto, Sylvia Valdezate Ramos|título=Metodos de identificación bacteriana en el laboratorio de microbiología|fecha=2010|editorial=Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica|isbn=978-84-614-7932-0|url=https://www.seimc.org/contenidos/documentoscientificos/procedimientosmicrobiologia/seimc-procedimientomicrobiologia37.pdf|fechaacceso=30 de octubre de 2023}}</ref> |
||
[[Archivo:Positive CAMP test.jpg|thumb|Prueba CAMP positiva. Formación de una zona de hemólisis en forma de flecha donde confluye en crecimiento de EGB y ''Staphylococcus aureus''.]] |
[[Archivo:Positive CAMP test.jpg|thumb|Prueba CAMP positiva. Formación de una zona de hemólisis en forma de flecha donde confluye en crecimiento de EGB y ''Staphylococcus aureus''.]] |
||
EGB es capaz de hidrolizar el [[Ácido hipúrico|hipurato]] lo que también puede ser usado para su identificación en el laboratorio.<ref name="Identif Bact SEIMC 2010" /><ref>{{Cita web|url=http://paratecnicosdelaboratorio.blogspot.com.es/2012/12/hidrolisis-del-hipurato.html|título=hidrólisis del hipurato|fechaacceso= |
EGB es capaz de hidrolizar el [[Ácido hipúrico|hipurato]] lo que también puede ser usado para su identificación en el laboratorio.<ref name="Identif Bact SEIMC 2010" /><ref>{{Cita web|url=http://paratecnicosdelaboratorio.blogspot.com.es/2012/12/hidrolisis-del-hipurato.html|título=hidrólisis del hipurato|fechaacceso=30 de octubre de 2023|autor=|enlaceautor=|fecha=|sitioweb=|editorial=|idioma=}}</ref> |
||
[[Archivo:Streptococcus agalactiae on Granada medium.jpg|thumb|Colonias de ''Streptococcus agalactiae'' medio Granada. Incubación anaerobiosis]] |
[[Archivo:Streptococcus agalactiae on Granada medium.jpg|thumb|Colonias de ''Streptococcus agalactiae'' medio Granada. Incubación anaerobiosis]] |
||
| ⚫ | |||
La forma más fácil de identificar el EGB es la producción de colonias rojas en [[Agar granada]], pues las cepas hemolíticas de EGB producen un pigmento rojo específico del EGB, el [[granadaeno]] cuya observación permite su identificación inmediata.<ref name="Rosa-Fraile 2017" /> |
|||
El granadaeno es un polieno (sustancia orgánica que contiene una cadena de dobles enlaces alternando con enlaces simples), no [[isoprenoide]] (ornitin ramnododeacaeno).<ref name="Rosa-Fraile 2006">{{Cita publicación|url = http://aem.asm.org/content/72/9/6367.full.pdf|título = Granadaene: proposed structure of the group B Streptococcus polyenic pigment.|apellidos = Rosa-Fraile M, Rodríguez-Granger J, Haidour-Benamin A, Cuerva JM, Sampedro A.|nombre = |fecha = |publicación = Appl Env Microbiol. 2006; 72: 6367-6370.|fechaacceso = |doi = 10.1128/AEM.00756-06|pmid = |fechaarchivo = 19 de julio de 2018|urlarchivo = https://web.archive.org/web/20180719230905/http://aem.asm.org/content/72/9/6367.full.pdf|deadurl = yes}}</ref> |
|||
| ⚫ | <ref name=":Rosa-Fraile 1999">{{Cita publicación|url = http://jcm.asm.org/content/37/8/2674.full.pdf|título = Use of Granada medium to detect group B streptococcal colonization in pregnant women|apellidos = Rosa-Fraile M, Rodriguez-Granger J, Cueto-Lopez M, Sampedro A, Biel Gaye E, Haro M , Andreu A.|nombre = |fecha = 1999|publicación = J Clin Microbiol. 37: 2674-2677.|fechaacceso = |doi = |pmid = }}</ref> |
||
La identificación del EGB también puede llevarse a cabo usando otras técnicas como nucleic acid amplification techniques ([[NAAT]]s) o [[MALDI-TOF]] (Matrix-Assisted Laser Desorption Ionization--Time of Flight Mass Spectrometry).<ref name="Rosa-Fraile 2017" /><ref name="ASM 3020" /><ref>{{Cita publicación|url = http://www.ijidonline.com/article/S1201-9712(14)01586-0/pdf|título = Use of MALDI-TOF mass spectrometry for rapid identification of group B Streptococcus on chromID Strepto B agar.|apellidos = Binghuai L, Yanli S, Shuchen Z, Fengxia Z, Dong L, YanchaoC|nombre = |fecha = |publicación = International Journal of Infectious Diseases (IJID) 2014, 27: 44-48.|fechaacceso = |doi = 10.1016/j.ijid.2014.06.023|pmid = }}</ref><ref name="Ka-Ning">{{cita publicación|apellidos1=Ka-Ning To, Emma Cornwell, Roger Daniel,3 Sweenie Goonesekera, Elita Jauneikaite, Victoria Chalker, Kirsty Le Doare|título=Evaluation of matrix-assisted laser desorption ionisation time-of-flight mass spectrometry (MALDI-TOF MS) for the Identification of Group B Streptococcus|publicación=BMC Res Note|fecha=2019|volumen=12|doi=10.1186/s13104-019-4119-1}}</ref> |
El granadaeno es un polieno (sustancia orgánica que contiene una cadena de dobles enlaces alternando con enlaces simples), no [[isoprenoide]] (ornitin ramnododeacaeno).<ref name="Rosa-Fraile 2006">{{cita publicación|apellidos1=Rosa-Fraile M, Rodríguez-Granger J, Haidour-Benamin A, Cuerva JM, Sampedro A.|título=Granadaene: proposed structure of the group B Streptococcus polyenic pigment|publicación=Appl Environ Microbiol .|fecha=2006|volumen=72|páginas=6367-6370|doi=10.1128/AEM.00756-06|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1563658/pdf/0756-06.pdf|fechaacceso=31 de octubre de 2023}}</ref> |
||
La identificación del EGB también puede llevarse a cabo usando otras técnicas como nucleic acid amplification techniques ([[NAAT]]s) o [[MALDI-TOF]] (Matrix-Assisted Laser Desorption Ionization--Time of Flight Mass Spectrometry).<ref name="Rosa-Fraile 2017" /><ref name="ASM 3020" /><ref>{{Cita publicación|url = http://www.ijidonline.com/article/S1201-9712(14)01586-0/pdf|título = Use of MALDI-TOF mass spectrometry for rapid identification of group B Streptococcus on chromID Strepto B agar.|apellidos = Binghuai L, Yanli S, Shuchen Z, Fengxia Z, Dong L, YanchaoC|nombre = |fecha = |publicación = International Journal of Infectious Diseases (IJID) 2014, 27: 44-48.|fechaacceso =31 de octubre de 2023 |doi = 10.1016/j.ijid.2014.06.023|pmid = }}</ref><ref name="Ka-Ning">{{cita publicación|apellidos1=Ka-Ning To, Emma Cornwell, Roger Daniel,3 Sweenie Goonesekera, Elita Jauneikaite, Victoria Chalker, Kirsty Le Doare|título=Evaluation of matrix-assisted laser desorption ionisation time-of-flight mass spectrometry (MALDI-TOF MS) for the Identification of Group B Streptococcus|publicación=BMC Res Note|fecha=2019|volumen=12|doi=10.1186/s13104-019-4119-1}}</ref> |
|||
== Colonización e infección por EGB == |
== Colonización e infección por EGB == |
||
Generalmente EGB es una bacteria que coloniza (formando parte de la [[microbiota normal]]) sin producir infección el tubo digestivo y el tracto genitourinario del hombre y la mujer. Diferentes estudios indican tasas de colonización por EGB entre el 4 y el 36%, pero la mayoría señalan más de un 20%.<ref name="Russell 2017" /> |
Generalmente EGB es una bacteria que coloniza (formando parte de la [[microbiota normal]]) sin producir infección el tubo digestivo y el tracto genitourinario del hombre y la mujer. Diferentes estudios indican tasas de colonización por EGB entre el 4 y el 36%, pero la mayoría señalan más de un 20%.<ref name=":Russell-Seale 2017">{{cita publicación|apellidos1=Russell NJ, Seale AC, O'Driscoll M, O'Sullivan C, et al.|título=Maternal Colonization With Group B Streptococcus and Serotype Distribution Worldwide: Systematic Review and Meta-analyses|publicación=Clin Infect Dis|fecha=2017|volumen=65, Suppl 2|páginas=S100|doi=10.1093/cid/cix658|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5848259/pdf/cix658.pdf}}</ref> |
||
| ⚫ | |||
La colonización por EGB puede ser intermitente, transitoria o persistente. Estas variaciones pueden deberse a diferentes métodos de detección o a diferencias entre las poblaciones estudiadas.<ref name=":Barcaite 2008">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/18307064|título = Prevalence of maternal group B streptococcal colonisation in European countries".|apellidos = Barcaite E, Bartusevicius A, Tameliene R, Kliucinskas M, Maleckiene L, Nadisauskiene R.|fecha = |publicación = Acta Obstet Gynecol Scand. 2008, 87: 260-271.|url=https://obgyn.onlinelibrary.wiley.com/doi/epdf/10.1080/00016340801908759 |
|||
| ⚫ | Aunque, como se ha indicado, el EGB coloniza sin producir infección hasta un 30% de adultos sanos incluyendo la mujer gestante,<ref name="Edwards MS, Nizet V. |
||
| ⚫ | |fechaacceso = 31 de octubre de 2023|doi = 10.1080/00016340801908759|pmid = }}</ref><ref name=":Rodriguez-Granger 2012">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/?term=Rodriguez-Granger+J%2C+Alvargonzalez+JC%2C+Berardi+A%2C|título = Prevention of group B streptococcal neonatal disease revisited. The DEVANI European project.|apellidos = Rodriguez-Granger J, Alvargonzalez JC, Berardi A, Berner R, Kunze M, Hufnagel M, Melin P, Decheva A, Orefici G, Poyart C, Telford J, Efstratiou A, Killian M, Krizova P, Baldassarri L, Spellerberg B, Puertas A, Rosa-Fraile M.|nombre = |fecha = |publicación = Eur J Clin Microbiol Infect Dis. 2012, 31: 2097-2114.|fechaacceso = |doi = |pmid = }}</ref><ref name=":Recomend CDC 2010">{{Cita publicación|url = http://www.cdc.gov/mmwr/pdf/rr/rr5910.pdf|título = Prevention of perinatal group B streptococcal disease: revised guidelines from CDC. En ingles|apellidos = Verani JR, McGee L, Schrag SJ.|nombre = |fecha = |publicación = MMWR Recomm Rep. 2010, 59(RR-10).|fechaacceso = |doi = |pmid = }}</ref><ref name=":Recomendaciones Españolas 2012">{{Cita publicación|url=https://seq.es/seq/0214-3429/25/1/alos.pdf|título=Prevención de la infección perinatal por estreptococo del grupo B. Recomendaciones españolas. Actualización 2012. Documento de consenso SEIMC/SEGO/SEN/SEQ/SEMFYC.|apellidos=Alós Cortés JI, Andreu Domingo A, Arribas Mir L, Cabero Roura L, de Cueto López M, López Sastre J, Melchor Marcos JC, Puertas Prieto A, de la Rosa Fraile M, Salcedo Abizanda S, Sánchez Luna M, Sanchez Pérez MJ, Torrejón Cardoso R.|nombre=|fecha=2012|publicación=Rev Esp Quimioter 2012;25:79-88 EN ESPAÑOL|fechaacceso=10 de noviembre de 2019|doi=10.1016/j.eimc.2012.03.013|pmid=}}</ref> |
||
| ⚫ | |||
<ref name=":Barcaite 2008" /> |
|||
esta bacteria, en general inofensiva, puede en algunas circunstancias causar infecciones muy graves tanto en el recién nacido como en adultos.<ref name=Mandel /> |
|||
<ref name="ACOG 2020" /> |
|||
== EGB y embarazo == |
== EGB y embarazo == |
||
Aunque la colonización por EGB no causa síntomas en la embarazada en ocasiones puede dar lugar a infecciones muy graves de la madre y del feto durante el embarazo y en el RN. En la madre el EGB puede causar [[corioamnionitis]] (infección de las membranas amnióticas), infecciones después del parto y ha sido relacionada con muerte fetal y parto prematuro.<ref name="Muller 2016">{{Cita publicación|url=https://obgyn.onlinelibrary.wiley.com/doi/full/10.1080/00016340600780508|título=Morbidity related to maternal group B streptococcal infections.|apellidos=Muller AE, Oostvogel PM, Steegers EA, Dörr PJ.|nombre=|fecha=2016|publicación=Acta Obstet Gynecol Scand. 85(9):1027-37| |
Aunque la colonización por EGB no causa síntomas en la embarazada en ocasiones puede dar lugar a infecciones muy graves de la madre y del feto durante el embarazo y en el RN. En la madre el EGB puede causar [[corioamnionitis]] (infección de las membranas amnióticas), infecciones después del parto y ha sido relacionada con muerte fetal y parto prematuro.<ref name="Muller 2016">{{Cita publicación|url=https://obgyn.onlinelibrary.wiley.com/doi/full/10.1080/00016340600780508|título=Morbidity related to maternal group B streptococcal infections.|apellidos=Muller AE, Oostvogel PM, Steegers EA, Dörr PJ.|nombre=|fecha=2016|publicación=Acta Obstet Gynecol Scand. 85(9):1027-37|url= https://obgyn.onlinelibrary.wiley.com/doi/epdf/10.1080/00016340600780508 |
||
|fechaacceso=31 de octubre de 2023 |doi=10.1080/00016340600780508|pmid=|número-autores=}}</ref> |
|||
| ⚫ | Si durante el embarazo se detecta la presencia de EGB en la orina en cualquier cantidad (menor de 100.000 colonias/ml) esta embarazada debe considerarse portadora de EGB y aplicarse PAI (profilaxis antibiótica intraparto) no siendo necesario tratamiento antibiótico. Sin embargo la bacteriuria por EGB durante el embarazo debe tratarse si causa síntomas o se detectan más de 100.000 colonias de EGB por ml de orina, pero aunque esta bacteriuria sea tratada debe aplicarse PAI.<ref name="ACOG 2020">{{cita publicación|apellidos1=American College of Obstetricians and Gynecologists.Committee Opinion, Number 797|título=Prevention of Group B Streptococcal Early-Onset Disease in Newborns|publicación=Obstetrics & Gynecology:|fecha=2020|volumen=135|páginas=p e51-e72|doi=10.1097/AOG.0000000000003668|url=https://journals.lww.com/greenjournal/Fulltext/2020/02000/Prevention_of_Group_B_Streptococcal_Early_Onset.43.aspx|fechaacceso= |
||
| ⚫ | Si durante el embarazo se detecta la presencia de EGB en la orina en cualquier cantidad (menor de 100.000 colonias/ml) esta embarazada debe considerarse portadora de EGB y aplicarse PAI (profilaxis antibiótica intraparto) no siendo necesario tratamiento antibiótico. Sin embargo la bacteriuria por EGB durante el embarazo debe tratarse si causa síntomas o se detectan más de 100.000 colonias de EGB por ml de orina, pero aunque esta bacteriuria sea tratada debe aplicarse PAI.<ref name="ACOG 2020">{{cita publicación|apellidos1=American College of Obstetricians and Gynecologists.Committee Opinion, Number 797|título=Prevention of Group B Streptococcal Early-Onset Disease in Newborns|publicación=Obstetrics & Gynecology:|fecha=2020|volumen=135|páginas=p e51-e72|doi=10.1097/AOG.0000000000003668|url=https://journals.lww.com/greenjournal/Fulltext/2020/02000/Prevention_of_Group_B_Streptococcal_Early_Onset.43.aspx|fechaacceso=31 de octubre de 2023}}</ref> |
||
La [[Infección urinaria|infección]] urinaria (ITU) por EGB durante el embarazo (por EGB u otra bacteria) puede desencadenar un parto prematuro.<ref name="Edwards MS, Nizet V." /><ref name="Puopolo AAP 2019" /> |
La [[Infección urinaria|infección]] urinaria (ITU) por EGB durante el embarazo (por EGB u otra bacteria) puede desencadenar un parto prematuro.<ref name="Edwards MS, Nizet V." /><ref name="Puopolo AAP 2019" /> |
||
| Línea 50: | Línea 64: | ||
El RN adquiere (se coloniza) EGB a su paso por el canal del parto de una madre colonizada, pudiendo a veces adquirir el EGB intraútero tras la rotura de membranas o, más raramente por vía ascendente, aun antes de la rotura de membranas. Aproximadamente el EGB es adquirido por un 50% de los RN de madres portadoras de EGB y en ausencia de medidas de protección (profilaxis antibiótica intraparto) 1-2% de estos recién nacidos se infectaran por EGB y desarrollarán una sepsis neonatal precoz.<ref name=":Recomendaciones Españolas 2012" /><ref name="ACOG 2020" /> |
El RN adquiere (se coloniza) EGB a su paso por el canal del parto de una madre colonizada, pudiendo a veces adquirir el EGB intraútero tras la rotura de membranas o, más raramente por vía ascendente, aun antes de la rotura de membranas. Aproximadamente el EGB es adquirido por un 50% de los RN de madres portadoras de EGB y en ausencia de medidas de protección (profilaxis antibiótica intraparto) 1-2% de estos recién nacidos se infectaran por EGB y desarrollarán una sepsis neonatal precoz.<ref name=":Recomendaciones Españolas 2012" /><ref name="ACOG 2020" /> |
||
La colonización de la madre con EGB durante el parto es el principal factor de riesgo para el desarrollo de la infección precoz por EGB. La infección precoz es adquirida por el RN por [[Transmisión vertical|transmisión]] vertical en el útero, aun con membranas intactas por exposición del feto al EGB que coloniza la vagina (a causa de una infección ascendente). Después de la rotura de membranas el feto puede infectarse en el útero o a su paso por la vagina. Sin embargo los RN que adquieren el EGB durante el parto (a su paso por la vagina) normalmente solo quedan colonizados y no desarrollan infección.<ref name="Russell 2017">{{cita publicación|apellidos1=Russell NJ, Seale AC, O'Driscoll M, O'Sullivan C, Bianchi-Jassir F, Gonzalez-Guarin J, Lawn JE, Baker CJ, Bartlett L, Cutland C, Gravett MG, Heath PT, Le Doare K, Madhi SA, Rubens CE, Schrag S, Sobanjo-Ter Meulen A, Vekemans J, Saha SK, Ip M|título=Risk of early-onset neonatal group B streptococcal disease with maternal colonization worldwide: systematic review and meta-analyses.|publicación=Clin Infect Dis|fecha=2017|volumen=;65(suppl_2):S152–S159|páginas=S152-159|doi=10.1093/cid/cix658|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5848259/pdf/cix658.pdf|fechaacceso=11 de febrero de 2021}}</ref><ref name=": Boyer 1985">{{Cita publicación|url = |título = Strategies for chemoprophylaxis of GBS early-onset infections.|apellidos = Boyer KM, Gotoff SP.|nombre = |fecha = |publicación = Antibiot Chemother. 1985; 35: 267-280.|fechaacceso = |doi = |
La colonización de la madre con EGB durante el parto es el principal factor de riesgo para el desarrollo de la infección precoz por EGB. La infección precoz es adquirida por el RN por [[Transmisión vertical|transmisión]] vertical en el útero, aun con membranas intactas por exposición del feto al EGB que coloniza la vagina (a causa de una infección ascendente). Después de la rotura de membranas el feto puede infectarse en el útero o a su paso por la vagina. Sin embargo los RN que adquieren el EGB durante el parto (a su paso por la vagina) normalmente solo quedan colonizados y no desarrollan infección.<ref name=":Russell 2017">{{cita publicación|apellidos1=Russell NJ, Seale AC, O'Driscoll M, O'Sullivan C, Bianchi-Jassir F, Gonzalez-Guarin J, Lawn JE, Baker CJ, Bartlett L, Cutland C, Gravett MG, Heath PT, Le Doare K, Madhi SA, Rubens CE, Schrag S, Sobanjo-Ter Meulen A, Vekemans J, Saha SK, Ip M|título=Risk of early-onset neonatal group B streptococcal disease with maternal colonization worldwide: systematic review and meta-analyses.|publicación=Clin Infect Dis|fecha=2017|volumen=;65(suppl_2):S152–S159|páginas=S152-159|doi=10.1093/cid/cix658|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5848259/pdf/cix658.pdf|fechaacceso=11 de febrero de 2021}}</ref><ref name=": Boyer 1985">{{Cita publicación|url = |título = Strategies for chemoprophylaxis of GBS early-onset infections.|apellidos = Boyer KM, Gotoff SP.|nombre = |fecha = |publicación = Antibiot Chemother. 1985; 35: 267-280.|fechaacceso = |doi =10.1159/000410380|pmid = }}</ref> |
||
En los países desarrollados el EGB (en ausencia de medidas de prevención) es la principal bacteria causante de infecciones en el RN, tales como [[Sepsis|septicemia]], [[neumonía]] y [[meningitis]] que pueden provocar la muerte o dejar [[Secuela (medicina)|secuelas]] permanentes.<ref name="Edwards MS, Nizet V." /><ref name=":Libster 2012">{{Cita publicación|url = http://pediatrics.aappublications.org/content/pediatrics/130/1/e8.full.pdf|título = Long-term outcomes of group B streptococcal meningitis.|apellidos = Libster R, Edwards KM, Levent F, Edwards MS, Rench MA, Castagnini LA, Cooper T, Sparks RC, Baker CJ, Shah PE.|nombre = |fecha = |publicación = Pediatrics 2012, 130: e8-15.|fechaacceso = |doi = 10.1542/peds.2011-3453|pmid = }}</ref> |
En los países desarrollados el EGB (en ausencia de medidas de prevención) es la principal bacteria causante de infecciones en el RN, tales como [[Sepsis|septicemia]], [[neumonía]] y [[meningitis]] que pueden provocar la muerte o dejar [[Secuela (medicina)|secuelas]] permanentes.<ref name="Edwards MS, Nizet V." /><ref name=":Libster 2012">{{Cita publicación|url = http://pediatrics.aappublications.org/content/pediatrics/130/1/e8.full.pdf|título = Long-term outcomes of group B streptococcal meningitis.|apellidos = Libster R, Edwards KM, Levent F, Edwards MS, Rench MA, Castagnini LA, Cooper T, Sparks RC, Baker CJ, Shah PE.|nombre = |fecha = |publicación = Pediatrics 2012, 130: e8-15.|fechaacceso = |doi = 10.1542/peds.2011-3453|pmid = }}</ref> |
||
El EGB en el RN y en el bebé causa dos tipos de infección: |
El EGB en el RN y en el bebé causa dos tipos de infección: |
||
--Infección neonatal precoz (en inglés early-onset disease). |
--Infección neonatal precoz (en inglés early-onset disease). |
||
--Infección neonatal tardía (en inglés late onset disease). |
--Infección neonatal tardía (en inglés late onset disease). |
||
| Línea 66: | Línea 78: | ||
En el pasado, la incidencia de la infección precoz por EGB oscilaba entre 0.7 y 3.7 por mil RN vivos en US A<ref name="Edwards MS, Nizet V." /> y desde el 0.2 al 3.25 por mil en Europa.<ref name=":Rodriguez-Granger 2012" /> |
En el pasado, la incidencia de la infección precoz por EGB oscilaba entre 0.7 y 3.7 por mil RN vivos en US A<ref name="Edwards MS, Nizet V." /> y desde el 0.2 al 3.25 por mil en Europa.<ref name=":Rodriguez-Granger 2012" /> |
||
| ⚫ | El uso general de la [[Profilaxis antibiótica|profilaxis]] antibiótica intraparto (PAI) ha resultado en un descenso en la incidencia de la infección neonatal precoz por EGB en USA de mas del 85%, desde un 1.8 por mil recién nacidos vivos en los años 90 hasta un 0,23 por mil en 2015. <ref name="ACOG 2020" /><ref name=":Nanduri 2019">{{Cita publicación|url=|título=Epidemiology of Invasive Early-Onset and Late-Onset Group B Streptococcal Disease in the United States, 2006 to 2015: Multistate Laboratory and Population-Based Surveillance.|apellidos=Nanduri SA, Petit S, Smelser C, Apostol M, Alden NB, Harrison LH, Lynfield R, Vagnone PS, Burzlaff K, Spina NL, Dufort EM, Schaffner W, Thomas AR, Farley MM, Jain JH, Pondo T, McGee L, Beall BW, Schrag SJ.|nombre=|fecha=2019|publicación=JAMA Pediatr. 173(3):224-233|fechaacceso=|doi=10.1001/jamapediatrics.2018.4826|pmid=}}</ref> |
||
En 2008 después del uso general de la [[Profilaxis antibiótica|profilaxis]] antibiótica intraparto (PAI) los [[Centros para el Control y Prevención de Enfermedades|Centros]] de Control y Prevención de Enfermedades de Estados Unidos ([[Centers for Disease Control and Prevention]] of United States, CDC) han comunicado una incidencia de 0.28 casos por mil RN vivos en USA.<ref name=":37">{{Cita web|url=http://www.cdc.gov/groupbstrep/clinicians/clinical-overview.html|título=Group B Strep (GBS)-Clinical Overview|fechaacceso=11 de noviembre de 2019|autor=CDC|enlaceautor=|fecha=|sitioweb=|editorial=|idioma=}}</ref> |
|||
Con una estimación global de 0.49/1000 RN vivos pero con importantes diferencias entre países desarrollados y países en vía de desarrollo. |
|||
| ⚫ | |||
<ref name=DEVANI>{{cita publicación|apellidos1=Lohrmann, Hufnagel et al.for the DEVANI Study Group|título=Neonatal invasive disease caused by Streptococcus agalactiae in Europe: the DEVANI multi‐center study|publicación=Infection|fecha=2023|volumen=51|páginas=981-991|doi=10.1007/s15010-022-01965-x|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9773664/pdf/15010_2022_Article_1965.pdf|fechaacceso=1 de noviembre de 2023}}</ref> |
|||
Aunque la colonización maternal por EGB es el factor clave para que el RN desarrolle una infección por EGB otros factores también aumentan el riesgo.<ref name="Edwards MS, Nizet V." /><ref name=":Recomend CDC 2010" /><ref name="ACOG 2020" /> |
Aunque la colonización maternal por EGB es el factor clave para que el RN desarrolle una infección por EGB otros factores también aumentan el riesgo.<ref name="Edwards MS, Nizet V." /><ref name=":Recomend CDC 2010" /><ref name="ACOG 2020" /> |
||
| Línea 90: | Línea 103: | ||
Los RN de madres en que está presente algún factor de riesgo pero que no están colonizadas tienen un riesgo mucho más bajo de desarrollar infección comparados con aquellos RN de madres que están colonizadas aunque no presenten ningún factor de riesgo.<ref name=": Boyer 1985" /> |
Los RN de madres en que está presente algún factor de riesgo pero que no están colonizadas tienen un riesgo mucho más bajo de desarrollar infección comparados con aquellos RN de madres que están colonizadas aunque no presenten ningún factor de riesgo.<ref name=": Boyer 1985" /> |
||
La presencia en la madre de bajos niveles de anticuerpos frente a los polisacáridos de la cápsula de EGB es también un importante factor para el desarrollo de la infección en el RN.<ref name=":Baker,Kasper 1976">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/768760|título = Correlation of maternal antibody deficiency with susceptibility to neonatal infection with group B Streptococcus. En ingles|apellidos = Baker CJ, Kasper DL.|nombre = |fecha = |publicación = N Eng J Med. 1976; 294: 753-756.|fechaacceso = |doi = |pmid = }}</ref><ref name="Baker-Edwards 1981">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/7033911|título = Role of antibody to native type III polysaccharide of group B Streptococcus in infant infection.|apellidos = Baker CJ, Edwards MS, Kasper DL.|nombre = |fecha = |publicación = Pediatrics 1981; 68: 544-549.|fechaacceso = |doi = |pmid = |idioma = Inglés}}</ref> Debido a esto, la existencia de un hermano anterior que haya sufrido infección por EGB es un importante factor de riesgo para que los siguientes hermanos desarrollen la infección, pues indica la presencia de bajos niveles de anticuerpos protectores en la madre.<ref name=":Recomend CDC 2010" /><ref name="ACOG 2020" /> |
La presencia en la madre de bajos niveles de anticuerpos frente a los polisacáridos de la cápsula de EGB es también un importante factor para el desarrollo de la infección en el RN.<ref name=":Baker,Kasper 1976">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/768760|título = Correlation of maternal antibody deficiency with susceptibility to neonatal infection with group B Streptococcus. En ingles|apellidos = Baker CJ, Kasper DL.|nombre = |fecha = |publicación = N Eng J Med. 1976; 294: 753-756.|fechaacceso = |doi = |pmid = }}</ref><ref name="Baker-Edwards 1981">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/7033911|título = Role of antibody to native type III polysaccharide of group B Streptococcus in infant infection.|apellidos = Baker CJ, Edwards MS, Kasper DL.|nombre = |fecha = |publicación = Pediatrics 1981; 68: 544-549.|fechaacceso = |doi = |pmid = |idioma = Inglés}}</ref> Debido a esto, la existencia de un hermano anterior que haya sufrido infección por EGB es un importante factor de riesgo para que los siguientes hermanos desarrollen la infección, pues indica la presencia de bajos niveles de anticuerpos protectores en la madre.<ref name=":Recomend CDC 2010" /><ref name="ACOG 2020" /><ref name=DEVANI /> |
||
En general la mortalidad por infección por EGB ha descendido desde un 50% en los años 1970 hasta el 10% actualmente. Esta disminución se ha debido a los progresos en el manejo y tratamiento de estos RN. La mortalidad es más alta entre los RN prematuros. La mortalidad causada por infección precoz por EGB fundamentalmente ocurre en recién nacidos prematuros. Actualmente en US se estima un 2.1% de mortalidad entre recién nacidos a término y un 19.2 en recién nacidos prematuros.<ref name="Edwards MS, Nizet V." /><ref name=":Recomend CDC 2010" /><ref name="Puopolo AAP 2019" /><ref name=":Edmond 2012">{{Cita publicación|url = http://www.thelancet.com/pdfs/journals/lancet/PIIS0140-6736(11)61651-6.pdf|título = Group B streptococcal disease in infants aged younger than 3 months: systematic review and meta-analysis.|apellidos = Edmond KM, Kortsalioudaki C, Scott S, Schrag SJ, Zaidi AK, Cousens S, Heath PT.|nombre = |fecha = |publicación = Lancet. 2012; 279: 547-556.|fechaacceso = |doi = |pmid = }}</ref> |
En general la mortalidad por infección por EGB ha descendido desde un 50% en los años 1970 hasta el 10% actualmente. Esta disminución se ha debido a los progresos en el manejo y tratamiento de estos RN. La mortalidad es más alta entre los RN prematuros. La mortalidad causada por infección precoz por EGB fundamentalmente ocurre en recién nacidos prematuros. Actualmente en US se estima un 2.1% de mortalidad entre recién nacidos a término y un 19.2 en recién nacidos prematuros.<ref name="Edwards MS, Nizet V." /><ref name=":Recomend CDC 2010" /><ref name="Puopolo AAP 2019" /><ref name=":Edmond 2012">{{Cita publicación|url = http://www.thelancet.com/pdfs/journals/lancet/PIIS0140-6736(11)61651-6.pdf|título = Group B streptococcal disease in infants aged younger than 3 months: systematic review and meta-analysis.|apellidos = Edmond KM, Kortsalioudaki C, Scott S, Schrag SJ, Zaidi AK, Cousens S, Heath PT.|nombre = |fecha = |publicación = Lancet. 2012; 279: 547-556.|fechaacceso = |doi = |pmid = }}</ref> |
||
La infección tardía por EGB afecta a bebés entre los 7 días y los tres meses después del nacimiento y presenta mortalidad más baja (1-6%) que la infección precoz. La presentación clínica de la infección tardía es bacteremia sin un foco definido (65%), meningitis (25%), [[Celulitis (inflamación)|celulitis]], [[Osteoartrítis|osteoartritis]] y neumonía.<ref name= ":Prieto Tato 2008">{{Cita publicación|url = |
La infección tardía por EGB afecta a bebés entre los 7 días y los tres meses después del nacimiento y presenta mortalidad más baja (1-6%) que la infección precoz. La presentación clínica de la infección tardía es bacteremia sin un foco definido (65%), meningitis (25%), [[Celulitis (inflamación)|celulitis]], [[Osteoartrítis|osteoartritis]] y neumonía.<ref name= ":Prieto Tato 2008">{{Cita publicación|url =https://www.analesdepediatria.org/es-pdf-S169540330870064X|título = Infección tardía por estreptococo del grupo B: experiencia en un hospital de tercer nivel (2000-2006)|apellidos = Prieto Tato LM, Gimeno Díaz de Atauri A, Aracil Santos J, Omeñaca Teres F, del Castillo Martín F, de José Gómez MI.|nombre = |fecha = |publicación = An Pediatr (Barc). 2008 68:239-243.|fechaacceso = |doi = |pmid = }}</ref> |
||
Para el desarrollo de la infección tardía la [[Prematuro|prematuridad]] es el principal factor de riesgo. De tal manera que cada semana que se adelanta el parto multiplica el riesgo de desarrollo de infección tardía en un factor de 1.34.<ref name ="Lin 2003">{{Cita publicación|url = http://jid.oxfordjournals.org/content/188/2/267.full.pdf|título = Prematurity Is the Major Risk Factor for Late-Onset Group B Streptococcus Disease. En Ingles.|apellidos = Lin FYC, Weisman LE ,Troendle J, Adams K.|nombre = |fecha = |publicación = The Journal of Infectious Diseases. 2003; 188: 267-271.|fechaacceso = |doi = |pmid = }}</ref> |
Para el desarrollo de la infección tardía la [[Prematuro|prematuridad]] es el principal factor de riesgo. De tal manera que cada semana que se adelanta el parto multiplica el riesgo de desarrollo de infección tardía en un factor de 1.34.<ref name ="Lin 2003">{{Cita publicación|url = http://jid.oxfordjournals.org/content/188/2/267.full.pdf|título = Prematurity Is the Major Risk Factor for Late-Onset Group B Streptococcus Disease. En Ingles.|apellidos = Lin FYC, Weisman LE ,Troendle J, Adams K.|nombre = |fecha = |publicación = The Journal of Infectious Diseases. 2003; 188: 267-271.|fechaacceso = |doi = |pmid = }}</ref> |
||
La infección tardía por EGB (comienzo entre 7 y 90 días después del nacimiento) no es adquirida por el RN o bebé durante o antes del nacimiento, sino que es adquirida a partir de la madre por la leche materna o a partir de fuentes de EGB ambientales o de otras personas. La infección tardía no suele presentar signos específicos y el diagnóstico debe realizarse mediante [[hemocultivo]] en los RN que presentan fiebre. Defectos en la audición y retraso mental pueden ser consecuencias futuras de la meningitis causada por EGB.<ref name="Edwards MS, Nizet V." /><ref name=":Libster 2012" /> |
La infección tardía por EGB (comienzo entre 7 y 90 días después del nacimiento) no es adquirida por el RN o bebé durante o antes del nacimiento, sino que es adquirida a partir de la madre por la leche materna o a partir de fuentes de EGB ambientales o de otras personas. La infección tardía no suele presentar signos específicos y el diagnóstico debe realizarse mediante [[hemocultivo]] en los RN que presentan fiebre. Defectos en la audición y retraso mental pueden ser consecuencias futuras de la meningitis causada por EGB.<ref name="Edwards MS, Nizet V." /><ref name=":Libster 2012" /> |
||
| Línea 109: | Línea 123: | ||
En caso de que la cepa de EGB que coloniza a la madre sea resistente a clindamicina debe usarse vancomicina a la dosificación indicada.<ref name="ACOG 2020" /> |
En caso de que la cepa de EGB que coloniza a la madre sea resistente a clindamicina debe usarse vancomicina a la dosificación indicada.<ref name="ACOG 2020" /> |
||
La [[eritromicina]] no se recomienda actualmente para la PAI en ninguna circunstancia.<ref name=":Recomend CDC 2010" /><ref name="ACOG 2020" /> |
La [[eritromicina]] no se recomienda actualmente para la PAI en ninguna circunstancia.<ref name=":Recomend CDC 2010" /><ref name="ACOG 2020" /> |
||
La realización de pruebas de sensibilidad antibiótica ([[antibiograma]]) es fundamental para decidir el antibiótico a usar en aquellas madres alérgicas a la penicilina, porque la resistencia a clindamicina ha aumentado de manera importante en las cepas de EGB.<ref>{{Cita publicación|url = http://seq.es/seq/0214-3429/25/1/artiles.pdf|título = Fenotipos y mecanismos de resistencia a macrólidos y lincosamidas en aislados de Streptococcus agalactiae con significación clínica en un período de ocho años (2002-2010)|apellidos = Campelo FA1, Pedrosa AC, Antúnez IÁ, Capuz BL|nombre = |fecha = |publicación = Rev Esp Quimioter. 2012; 25:42-46. EN ESPAÑOL|fechaacceso = |doi = |pmid = }}</ref><ref>{{Cita publicación|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1140544/|título=Multicenter study of the mechanisms of resistance and clonal relationships of Streptococcus agalactiae isolates resistant to macrolides, lincosamides, and ketolides in Spain.|apellidos=Gonzalez JJ1, Andreu A; Spanish Group for the Study of Perinatal Infection from the Spanish Society for Clinical Microbiology and Infectious Diseases.|nombre=|fecha=2005|publicación=Antimicrob Agents Chemother. 2005 49:2525-7.|fechaacceso=|doi=10.1128/AAC.49.6.2525-2527.2005|pmid=}}</ref> |
La realización de pruebas de sensibilidad antibiótica ([[antibiograma]]) es fundamental para decidir el antibiótico a usar en aquellas madres alérgicas a la penicilina, porque la resistencia a clindamicina ha aumentado de manera importante en las cepas de EGB.<ref>{{Cita publicación|url = http://seq.es/seq/0214-3429/25/1/artiles.pdf|título = Fenotipos y mecanismos de resistencia a macrólidos y lincosamidas en aislados de Streptococcus agalactiae con significación clínica en un período de ocho años (2002-2010)|apellidos = Campelo FA1, Pedrosa AC, Antúnez IÁ, Capuz BL|nombre = |fecha = |publicación = Rev Esp Quimioter. 2012; 25:42-46. EN ESPAÑOL|fechaacceso = |doi = |pmid = }}</ref><ref>{{Cita publicación|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1140544/pdf/1391-04.pdf|título=Multicenter study of the mechanisms of resistance and clonal relationships of Streptococcus agalactiae isolates resistant to macrolides, lincosamides, and ketolides in Spain.|apellidos=Gonzalez JJ1, Andreu A; Spanish Group for the Study of Perinatal Infection from the Spanish Society for Clinical Microbiology and Infectious Diseases.|nombre=|fecha=2005|publicación=Antimicrob Agents Chemother. 2005 49:2525-7.|fechaacceso=|doi=10.1128/AAC.49.6.2525-2527.2005|pmid=}}</ref> |
||
La utilización de una correcta técnica en la realización del [[antibiograma]] es muy importante (incluyendo pruebas de resistencia inducible a clindamicina), dado que la resistencia a clindamicina puede no ser detectada por algunas técnicas de laboratorio.<ref name="ASM 3020" /><ref name=":Recomend CDC 2010" /><ref name=":Recomendaciones Españolas 2012" /><ref name="ACOG 2020" /> |
La utilización de una correcta técnica en la realización del [[antibiograma]] es muy importante (incluyendo pruebas de resistencia inducible a clindamicina), dado que la resistencia a clindamicina puede no ser detectada por algunas técnicas de laboratorio.<ref name="ASM 3020" /><ref name=":Recomend CDC 2010" /><ref name=":Recomendaciones Españolas 2012" /><ref name="ACOG 2020" /> |
||
| Línea 115: | Línea 129: | ||
En mujeres con riesgo de alergia a penicilina, en la petición al laboratorio para investigar el estado de portadora de EGB este hecho (posibilidad de alergia) debe consignarse en la petición al laboratorio para que se realicen pruebas sensibilidad a clindamicina. |
En mujeres con riesgo de alergia a penicilina, en la petición al laboratorio para investigar el estado de portadora de EGB este hecho (posibilidad de alergia) debe consignarse en la petición al laboratorio para que se realicen pruebas sensibilidad a clindamicina. |
||
Existen datos que indican que la PAI efectuada con un antibiótico adecuado, comenzando al menos dos horas antes del parto (en vez del tiempo adecuado que es comenzar al menos 4 horas antes) es también capaz de reducir el riesgo de infección en el RN, aunque no es tan eficaz como la PAI correctamente administrada.<ref>{{Cita publicación|url = http://www.ajog.org/article/S0002-9378(01)99003-9/abstract|título = The effectiveness of risk-based intrapartum chemoprophylaxis for the prevention of early-onset neonatal group B streptococcal disease. En ingles|apellidos = Lin FY, Brenner RA, Johnson YR, Azimi PH, Philips JB 3rd, Regan JA, Clark P, Weisman LE, Rhoads GG, Kong F, Clemens JD.|nombre = |fecha = |publicación = American Journal of Obstetrics and Gynecology 2001; 184: 1204-1210.|fechaacceso = |doi = 10.1067/mob.2001.113875|pmid = }}</ref><ref>{{Cita publicación|url = |
Existen datos que indican que la PAI efectuada con un antibiótico adecuado, comenzando al menos dos horas antes del parto (en vez del tiempo adecuado que es comenzar al menos 4 horas antes) es también capaz de reducir el riesgo de infección en el RN, aunque no es tan eficaz como la PAI correctamente administrada.<ref>{{Cita publicación|url = http://www.ajog.org/article/S0002-9378(01)99003-9/abstract|título = The effectiveness of risk-based intrapartum chemoprophylaxis for the prevention of early-onset neonatal group B streptococcal disease. En ingles|apellidos = Lin FY, Brenner RA, Johnson YR, Azimi PH, Philips JB 3rd, Regan JA, Clark P, Weisman LE, Rhoads GG, Kong F, Clemens JD.|nombre = |fecha = |publicación = American Journal of Obstetrics and Gynecology 2001; 184: 1204-1210.|fechaacceso = |doi = 10.1067/mob.2001.113875|pmid = }}</ref><ref>{{Cita publicación|url = |título = Timing of Intrapartum Ampicillin and Prevention of Vertical Transmission of Group B Streptococcus". Obstetrics & Gynecology. En ingles.|apellidos = De Cueto, M, Sanchez, MJ, Sampedro, A, Miranda, JA, Herruzo, AJ, Rosa-Fraile, M.|nombre = |fecha = |publicación = Obstetrics & Gynecology 1988; 91:112-114.|fechaacceso = |pmid = 9464732}}</ref><ref name=":Berardi 2011">{{Cita publicación|url=http://www.ncbi.nlm.nih.gov/pubmed/?term=Berardi+A%2C+Rossi+C%2C+Biasini+A%2C+Minniti+S%2C|título=Berardi A, Rossi C, Biasini A, Minniti S, Venturelli C, Ferrari F, Facchinetti F.|apellidos=Efficacy of intrapartum chemoprophylaxis less than 4 hours duration. En ingles|nombre=|fecha=|publicación=J Matern Fetal Neonatal Med. 2011; 24: 619-625.|fechaacceso=|doi=|pmid=}}</ref> |
||
Se ha indicado que en los casos en que la cantidad de antibiótico administrado en la PAI es insuficiente, puede administrarse al RN inmediatamente tras el nacimiento una dosis de un antibiótico efectivo frente al EGB. De todas las formas la evidencia sobre la eficacia de esta práctica no es completa.<ref name=":Recomend CDC 2010" /><ref name=":Recomendaciones Españolas 2012" /><ref name=":Siegel JD 1996">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/8677068|título = Prevention of early-onset group B streptococcal disease: another look at single-dose penicillin at birth.|apellidos = Siegel JD, Cushion NB.|nombre = |fecha = |publicación = Obstet Gynecol. 1996; 87: 692-698.|fechaacceso = |doi = |pmid = }}</ref><ref name=" :Velaphi 2003">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/?term=Velaphi+S%2C+Siegel+JD%2C+Wendel+GD|título = Early-onset group B streptococcal infection after a combined maternal and neonatal group B streptococcal chemoprophylaxis strategy.|apellidos = Velaphi S, Siegel JD, Wendel GD Jr, Cushion N, Eid WM, Sanchez PJ.|nombre = |fecha = |publicación = Pediatrics 2003; 111: 541-547.|fechaacceso = |doi = |pmid = }}</ref><ref name= |
Se ha indicado que en los casos en que la cantidad de antibiótico administrado en la PAI es insuficiente, puede administrarse al RN inmediatamente tras el nacimiento una dosis de un antibiótico efectivo frente al EGB. De todas las formas la evidencia sobre la eficacia de esta práctica no es completa.<ref name=":Recomend CDC 2010" /><ref name=":Recomendaciones Españolas 2012" /><ref name=":Siegel JD 1996">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/8677068|título = Prevention of early-onset group B streptococcal disease: another look at single-dose penicillin at birth.|apellidos = Siegel JD, Cushion NB.|nombre = |fecha = |publicación = Obstet Gynecol. 1996; 87: 692-698.|fechaacceso = |doi = |pmid = }}</ref><ref name=" :Velaphi 2003">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/?term=Velaphi+S%2C+Siegel+JD%2C+Wendel+GD|título = Early-onset group B streptococcal infection after a combined maternal and neonatal group B streptococcal chemoprophylaxis strategy.|apellidos = Velaphi S, Siegel JD, Wendel GD Jr, Cushion N, Eid WM, Sanchez PJ.|nombre = |fecha = |publicación = Pediatrics 2003; 111: 541-547.|fechaacceso = |doi = |pmid = }}</ref><ref name=COCHRANE>{{cita web|apellidos1=Woodgate PG, Flenady V, Steer PA, Cochrane Library| título=Intramuscular penicillin for the prevention of early onset group Bstreptococcal infection in newborn infants (Review)|url=https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD003667.pub2/epdf/full|idioma=Ingles|fecha=2012|fechaacceso=1 de noviembre de 2023}}</ref> |
||
La alergia verdadera a penicilina es rara, con una frecuencia estimada de [[anafilaxia]] de 1 a 5 casos por 10,000 casos de tratamiento.<ref name= "Bhattacharya 2010">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3255391/|título = The facts about Penicillin Allergy: A Review. En ingles.|apellidos = Bhattacharya S.|nombre = |fecha = |publicación = J Adv Pharm Technol Res.2010; 1: 11-17.|fechaacceso = |doi = |pmid = }}</ref> |
La alergia verdadera a penicilina es rara, con una frecuencia estimada de [[anafilaxia]] de 1 a 5 casos por 10,000 casos de tratamiento.<ref name= "Bhattacharya 2010">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3255391/|título = The facts about Penicillin Allergy: A Review. En ingles.|apellidos = Bhattacharya S.|nombre = |fecha = |publicación = J Adv Pharm Technol Res.2010; 1: 11-17.|fechaacceso =2 de noviembre de 2023 |url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3255391/pdf/JAPTR-1-11.pdf|doi = |pmid = }}</ref> |
||
La administración de penicilina a una mujer sin una historia previa de alergia conlleva un riesgo de anafilaxia de 4/10,000 a 4/100,000. Anafilaxia asociada con la administración de PAI puede ocurrir, pero los riesgos son mucho menores que los beneficios de prevenir la infección neonatal por EGB.<ref name=":Recomend CDC 2010" /> |
|||
La supuesta alergia a penicilina en las embarazadas se asocia con un mayor utilización de otros antibióticos (clindamicina y vancomicina) por ello se recomienda que en estas mujeres se realicen pruebas de laboratorio para detectar si existe una verdadera alergia a penicilina.<ref name="ACOG 2020" /><ref name="Desai 2017">{{cita publicación|apellidos1=Shilpa H Desai, Michael S Kaplan, Qiaoling Chen, Eric M Macy,|título=Morbidity in Pregnant Women Associated with Unverified Penicillin Allergies, Antibiotic Use, and Group B Streptococcus Infections|publicación=Perm J|fecha=2017|volumen=21|páginas=16-080|doi=10.7812/TPP/16-080|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5363897/pdf/16-080.pdf|fechaacceso=13 de febrero de 2021}}</ref> |
La supuesta alergia a penicilina en las embarazadas se asocia con un mayor utilización de otros antibióticos (clindamicina y vancomicina) por ello se recomienda que en estas mujeres se realicen pruebas de laboratorio para detectar si existe una verdadera alergia a penicilina.<ref name="ACOG 2020" /><ref name="Desai 2017">{{cita publicación|apellidos1=Shilpa H Desai, Michael S Kaplan, Qiaoling Chen, Eric M Macy,|título=Morbidity in Pregnant Women Associated with Unverified Penicillin Allergies, Antibiotic Use, and Group B Streptococcus Infections|publicación=Perm J|fecha=2017|volumen=21|páginas=16-080|doi=10.7812/TPP/16-080|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5363897/pdf/16-080.pdf|fechaacceso=13 de febrero de 2021}}</ref> |
||
La utilización de la PAI ha sido asociada con la emergencia de bacterias resistentes a los antibióticos utilizados y con un incremento de infecciones neonatales causadas por otras bacterias, fundamentalmente bacilos [[Bacteria gramnegativa|Gram]] negativos como ''[[Escherichia coli|Escherichia]] coli.'' Sin embargo la mayoría de estudios no encuentran relación entre las infecciones neonatales causadas por otros microorganismos y el uso generalizado de la PAI.<ref name=":Recomend CDC 2010" /><ref name="Andreu 2001">{{Cita publicación|título = Evolución de la sepsis perinatal por Escherichia coli en la era de la profilaxis del estreptococo del grupo B|apellidos = Andreu A, Ortega E, Planes AM, Salcedo S|nombre =|url = |fecha = |publicación = Med Clin (Barc). 2001; 117:521-524.|fechaacceso = |doi =10.1016/s0025-7753(01)72166-5|pmid = |}}</ref><ref name="Baltimore 2001">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/?term=Baltimore+RS%2C+Huie+SM%2C+Meek+JI%2C|título = Early-onset neonatal sepsis in the era of group B streptococcal prevention.|apellidos = Baltimore RS, Huie SM, Meek JI, Schuchat A, O'Brien KL.|nombre = |fecha = |publicación = Pediatrics. 2001; 108: 1094-1098.|fechaacceso = |doi = |pmid = }}</ref><ref>{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/?term=Sutkin+G%2C+Krohn+MA%2C+Heine+RP|título = Antibiotic prophylaxis and non-group B streptococcal neonatal sepsis. En ingles|apellidos = Sutkin G, Krohn MA, Heine RP, Sweet RL.|nombre = |fecha = |publicación = Obstet Gynecol. 2005; 105: 581-586.|fechaacceso = |doi = |pmid = }}</ref> |
La utilización de la PAI ha sido asociada con la emergencia de bacterias resistentes a los antibióticos utilizados y con un incremento de infecciones neonatales causadas por otras bacterias, fundamentalmente bacilos [[Bacteria gramnegativa|Gram]] negativos como ''[[Escherichia coli|Escherichia]] coli.'' Sin embargo la mayoría de estudios no encuentran relación entre las infecciones neonatales causadas por otros microorganismos y el uso generalizado de la PAI.<ref name=":Recomend CDC 2010" /><ref name="Andreu 2001">{{Cita publicación|título = Evolución de la sepsis perinatal por Escherichia coli en la era de la profilaxis del estreptococo del grupo B|apellidos = Andreu A, Ortega E, Planes AM, Salcedo S|nombre =|url = |fecha = |publicación = Med Clin (Barc). 2001; 117:521-524.|fechaacceso = |doi =10.1016/s0025-7753(01)72166-5|pmid = |}}</ref><ref name="Baltimore 2001">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/?term=Baltimore+RS%2C+Huie+SM%2C+Meek+JI%2C|título = Early-onset neonatal sepsis in the era of group B streptococcal prevention.|apellidos = Baltimore RS, Huie SM, Meek JI, Schuchat A, O'Brien KL.|nombre = |fecha = |publicación = Pediatrics. 2001; 108: 1094-1098.|fechaacceso = |doi = |pmid = }}</ref><ref>{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/?term=Sutkin+G%2C+Krohn+MA%2C+Heine+RP|título = Antibiotic prophylaxis and non-group B streptococcal neonatal sepsis. En ingles|apellidos = Sutkin G, Krohn MA, Heine RP, Sweet RL.|nombre = |fecha = |publicación = Obstet Gynecol. 2005; 105: 581-586.|fechaacceso = |doi = |pmid = }}</ref> |
||
Otras estrategias para prevenir la infección neonatal precoz por EGB han sido estudiadas. Entre ellas la utilización de lavados vaginales intraparto con [[clorhexidina]], sin embargo no hay evidencia de su utilidad real.<ref name=":Recomend CDC 2010" /><ref name="ACOG 2020" /><ref name= "Cutland 2009">{{Cita publicación|url = http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(09)61339-8/abstract|título = Chlorhexidine maternal-vaginal and neonate body wipes in sepsis and vertical transmission of pathogenic bacteria in South Africa: A randomised, controlled trial. En Ingles|apellidos = Cutland CL, Madhi SA, Zell ER, Kuwanda L, Laque M, Groome M, Gorwitz R, Thigpen MC, Patel R, Velaphi SC, Adrian P, Klugman K, Schuchat A, Schrag SJ; PoPS Trial Team.|nombre = |fecha = |publicación = The Lancet 2009; 374 (9705): 1909-1916.|fechaacceso = |doi = 10.1016/S0140-6736(09)61339-8|pmid = }}</ref><ref name= " Cochrane">{{Cita web|url= |
Otras estrategias para prevenir la infección neonatal precoz por EGB han sido estudiadas. Entre ellas la utilización de lavados vaginales intraparto con [[clorhexidina]], sin embargo no hay evidencia de su utilidad real.<ref name=":Recomend CDC 2010" /><ref name="ACOG 2020" /><ref name= "Cutland 2009">{{Cita publicación|url = http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(09)61339-8/abstract|título = Chlorhexidine maternal-vaginal and neonate body wipes in sepsis and vertical transmission of pathogenic bacteria in South Africa: A randomised, controlled trial. En Ingles|apellidos = Cutland CL, Madhi SA, Zell ER, Kuwanda L, Laque M, Groome M, Gorwitz R, Thigpen MC, Patel R, Velaphi SC, Adrian P, Klugman K, Schuchat A, Schrag SJ; PoPS Trial Team.|nombre = |fecha = |publicación = The Lancet 2009; 374 (9705): 1909-1916.|fechaacceso = |doi = 10.1016/S0140-6736(09)61339-8|pmid = }}</ref><ref name= " Cochrane">{{Cita web|url=https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD003520.pub3/epdf/full|título=Vaginal chlorhexidine during labour to prevent early-onset neonatal group B streptococcal infection. The Cochrane database of systematic reviews.|fechaacceso=2 Noviembre 2023.|autor=Ohlsson, A; Shah, VS; Stade, BC|enlaceautor=|fecha=2014|sitioweb=|editorial=|idioma=Inglés}}</ref> |
||
=== Parto en casa y parto en el agua === |
=== Parto en casa y parto en el agua === |
||
El dar a luz en el propio domicilio ([[Parto en casa|parto]] en casa) es actualmente popular en el Reino Unido<ref name=" |
El dar a luz en el propio domicilio ([[Parto en casa|parto]] en casa) es actualmente popular en el Reino Unido<ref name="GBS support FAQ">{{cita web|apellidos1=Group B Strep Support|título=FAQs (Frequently Asked Questions) Carrying GBS and water birth, and home birth|url= }}</ref> |
||
y en otros países. Las recomendaciones para prevenir la infección por EGB son las mismas que en el hospital. Hay que tener en cuenta que aproximadamente un 25 % de las embarazadas son portadoras de EGB y puede ser difícil seguir en el propio domicilio las indicaciones correctas de la PAI y manejar adecuadamente un posible caso de alergia a los antibióticos.<ref name="GBS support FAQ" /> |
|||
Respecto al parto en el agua<ref name=" |
Respecto al parto en el agua<ref name="Iriondo 2015">{{cita publicación|apellidos1=M Iriondo Sanza, M.Sánchez Lunab, F.Botet Mussonsc, T.Martínez-Astorquizad,J.M.LaillaVicensey J.Figueras Aloy|título=Atención del parto en el agua.Consenso de la Sociedad Española de Neonatología y de la Sección de Medicina Perinatal de la Sociedad Española de Obstetricia y Ginecología|publicación=Anales de Pediatria|fecha=2015|volumen=82|página=108|doi=10.1016/j.anpedi.2014.06.013|pmid=25074709|url=https://www.analesdepediatria.org/es-pdf-S1695403314003282|fechaacceso=3 de noviembre de 2023}}</ref><ref name="Neiman 2020">{{cita publicación|apellidos1=Emily Neiman , Elizabeth Austin, Alai Tan , Cindy M Anderson, Esther Chipps|título=Outcomes of Waterbirth in a US Hospital-Based Midwifery Practice: A Retrospective Cohort Study of Water Immersion During Labor and Birth|publicación=J Midwifery Womens Health .|fecha=2029|volumen=65|páginas=216-23|doi=10.1111/jmwh.13033}}</ref> las recomendaciones para prevenir la infección por EGB son las mismas que para el parto tradicional.<ref name="ACOG 2020" /><ref name="GBS support FAQ" /> |
||
=== Identificación de las madres candidatas a recibir profilaxis antibiótica intraparto === |
=== Identificación de las madres candidatas a recibir profilaxis antibiótica intraparto === |
||
| Línea 147: | Línea 164: | ||
La administración de PAI se recomienda también cuando se seleccionan las candidatas usando el cribado prenatal si en el momento del parto no se conoce si la madre es o no es portadora de EGB y está presente algún factor de riesgo, en mujeres que han tenido infección urinaria por EGB o presencia de EGB en un urocultivo durante el embarazo y en mujeres con un hijo anterior que ha tenido una infección neonatal por EGB.<ref name=":Recomend CDC 2010" /><ref name=":Recomendaciones Españolas 2012" /><ref name="ACOG 2020" /> |
La administración de PAI se recomienda también cuando se seleccionan las candidatas usando el cribado prenatal si en el momento del parto no se conoce si la madre es o no es portadora de EGB y está presente algún factor de riesgo, en mujeres que han tenido infección urinaria por EGB o presencia de EGB en un urocultivo durante el embarazo y en mujeres con un hijo anterior que ha tenido una infección neonatal por EGB.<ref name=":Recomend CDC 2010" /><ref name=":Recomendaciones Españolas 2012" /><ref name="ACOG 2020" /> |
||
La estrategia basada en factores de riesgo es en general menos eficaz que la estrategia basada en la detección de portadoras, porque en la mayoría de los casos la infección neonatal aparece en RN cuyas madres no presentaban ningún factor de riesgo.<ref name=":Recomend CDC 2010" /><ref name=" Gimenez 2015">{{Cita publicación|url=|título="Evolución de la sepsis neonatal precoz por Streptococcus agalactiae en el área de Barcelona (2004-2010). Análisis de los fallos del cumplimiento del protocolo de prevención.|apellidos=Giménez M, Sanfeliu I, Sierra M, Dopico E, Juncosa T, Andreu A, Lite J, Guardià C, Sánchez F, Bosch J.|nombre=|fecha=|publicación=Enf Infect Microbiol Clin. 2015; 33: 446-450.|fechaacceso=|doi=|pmid=}}</ref> |
La estrategia basada en factores de riesgo es en general menos eficaz que la estrategia basada en la detección de portadoras, porque en la mayoría de los casos la infección neonatal aparece en RN cuyas madres no presentaban ningún factor de riesgo.<ref name=":Recomend CDC 2010" /><ref name=" Gimenez 2015">{{Cita publicación|url=|título="Evolución de la sepsis neonatal precoz por Streptococcus agalactiae en el área de Barcelona (2004-2010). Análisis de los fallos del cumplimiento del protocolo de prevención.|apellidos=Giménez M, Sanfeliu I, Sierra M, Dopico E, Juncosa T, Andreu A, Lite J, Guardià C, Sánchez F, Bosch J.|nombre=|fecha=|publicación=Enf Infect Microbiol Clin. 2015; 33: 446-450.|fechaacceso=|doi=10.1016/j.eimc.2014.10.015|pmid=}}</ref> |
||
La aplicación de PAI no se recomienda en aquellas mujeres (sean o no portadoras de EGB) en que se realiza una [[cesárea]] programada si el trabajo del parto no se ha iniciado aún y las membranas amnióticas están intactas, pues el RN no estará colonizado.<ref name=":Recomend CDC 2010" /><ref name=":Recomendaciones Españolas 2012" /><ref name="ACOG 2020" /><ref name=": Boyer 1985" /><ref name= "Schrag 2002">{{Cita publicación|url = http://www.nejm.org/doi/pdf/10.1056/NEJMoa020205|título = A population-based comparison of strategies to prevent early-onset group B streptococcal disease in neonates.|apellidos = Schrag SJ, Zell ER, Lynfield R, Roome A, Arnold KE, Craig AS, Harrison LH, Reingold A, Stefonek K, Smith G, Gamble M, Schuchat A; Active Bacterial Core Surveillance Team.|nombre = |fecha = |publicación = N Eng J Med. 2002, 347: 233-239.|fechaacceso = |doi = |pmid = }}</ref><ref name= "Hakanson 2008" >{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/18158627|título = Group B streptococcal carriage in Sweden: a national study on risk factors for mother and infant colonisation. En ingles|apellidos = Håkansson S, Axemo P, Bremme K, Bryngelsson AL, Wallin MC, Ekström CM, Granlund M, Jacobsson B, Källén K, Spetz E, Tessin I; Swedish Working Group For The Prevention of Perinatal Group B Streptococcal Infections.|nombre =|url = https://obgyn.onlinelibrary.wiley.com/doi/epdf/10.1080/00016340701802888|fecha = |publicación = Acta Obstet Gynecol Scand. 2008;87:50-58.|fechaacceso = |doi = 10.1080/00016340701802888|pmid = }}</ref> |
La aplicación de PAI no se recomienda en aquellas mujeres (sean o no portadoras de EGB) en que se realiza una [[cesárea]] programada si el trabajo del parto no se ha iniciado aún y las membranas amnióticas están intactas, pues el RN no estará colonizado.<ref name=":Recomend CDC 2010" /><ref name=":Recomendaciones Españolas 2012" /><ref name="ACOG 2020" /><ref name=": Boyer 1985" /><ref name= "Schrag 2002">{{Cita publicación|url = http://www.nejm.org/doi/pdf/10.1056/NEJMoa020205|título = A population-based comparison of strategies to prevent early-onset group B streptococcal disease in neonates.|apellidos = Schrag SJ, Zell ER, Lynfield R, Roome A, Arnold KE, Craig AS, Harrison LH, Reingold A, Stefonek K, Smith G, Gamble M, Schuchat A; Active Bacterial Core Surveillance Team.|nombre = |fecha = |publicación = N Eng J Med. 2002, 347: 233-239.|fechaacceso = |doi = |pmid = }}</ref><ref name= "Hakanson 2008" >{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/18158627|título = Group B streptococcal carriage in Sweden: a national study on risk factors for mother and infant colonisation. En ingles|apellidos = Håkansson S, Axemo P, Bremme K, Bryngelsson AL, Wallin MC, Ekström CM, Granlund M, Jacobsson B, Källén K, Spetz E, Tessin I; Swedish Working Group For The Prevention of Perinatal Group B Streptococcal Infections.|nombre =|url = https://obgyn.onlinelibrary.wiley.com/doi/epdf/10.1080/00016340701802888|fecha = |publicación = Acta Obstet Gynecol Scand. 2008;87:50-58.|fechaacceso = |doi = 10.1080/00016340701802888|pmid = }}</ref> |
||
La estrategia de cribado universal se recomienda en la mayoría de países desarrollados, e.g. Estados Unidos, Francia, España, Bélgica, Canadá y Australia. Los datos publicados de incidencia de infección precoz por EGB muestran un marcado descenso de su frecuencia después de la introducción de la PAI y la estrategia de selección basada en el cribado universal.<ref name=":Rodriguez-Granger 2012" /><ref name=":Nanduri 2019" /><ref name="Gimenez 2015" /><ref name=":Phares 2008">{{Cita publicación|url = http://jama.jamanetwork.com/article.aspx?articleid=181853|título = Epidemiology of Invasive Group B Streptococcal Disease in the United States, 1999-2005. En ingles|apellidos = Phares CR, Lynfield R, Farley MM, Mohle-Boetani J, Harrison LH, Petit S, Craig AS, Schaffner W, Zansky SM, Gershman K, Stefonek KR, Albanese BA, Zell ER, Schuchat A, Schrag SJ; Active Bacterial Core surveillance/Emerging Infections Program Network.|nombre = |fecha = |publicación = JAMA 2008; 299: 2056-2065.|fechaacceso = |doi = |pmid = }}</ref> |
La estrategia de cribado universal se recomienda en la mayoría de países desarrollados, e.g. Estados Unidos, Francia, España, Bélgica, Canadá y Australia. Los datos publicados de incidencia de infección precoz por EGB muestran un marcado descenso de su frecuencia después de la introducción de la PAI y la estrategia de selección basada en el cribado universal.<ref name=":Rodriguez-Granger 2012" /><ref name=":Nanduri 2019" /><ref name="Gimenez 2015" /><ref name=":Phares 2008">{{Cita publicación|url = http://jama.jamanetwork.com/article.aspx?articleid=181853|título = Epidemiology of Invasive Group B Streptococcal Disease in the United States, 1999-2005. En ingles|apellidos = Phares CR, Lynfield R, Farley MM, Mohle-Boetani J, Harrison LH, Petit S, Craig AS, Schaffner W, Zansky SM, Gershman K, Stefonek KR, Albanese BA, Zell ER, Schuchat A, Schrag SJ; Active Bacterial Core surveillance/Emerging Infections Program Network.|nombre = |fecha = |publicación = JAMA 2008; 299: 2056-2065.|fechaacceso = |doi = |pmid = }}</ref><ref name=Rosa-Alos>{{cita publicación|apellidos1=Rosa-Fraile M, Alos JI|título=Group B Streptococcus neonatal infections, the ongoing history|publicación=Enferm Infecc Microbiol Clin|fecha=2022|volumen=40|páginas=349-352|doi=10.1016/j.eimce.2022.01.002|fechaacceso=3 de noviembre de 2023}}</ref> |
||
La estrategia de selección basada en factores de riesgo se recomienda entre otros países en el Reino Unido, Holanda, Nueva Zelanda y Argentina.<ref name=":Rodriguez-Granger 2012" /> |
La estrategia de selección basada en factores de riesgo se recomienda entre otros países en el Reino Unido, Holanda, Nueva Zelanda y Argentina.<ref name=":Rodriguez-Granger 2012" /> |
||
| Línea 172: | Línea 189: | ||
Las muestras tomadas del cuello uterino, del [[periné]] o de la zona perianal no son adecuadas.<ref name=":Recomend CDC 2010" /><ref name=":Recomendaciones Españolas 2012" /><ref name="ACOG 2020" /> |
Las muestras tomadas del cuello uterino, del [[periné]] o de la zona perianal no son adecuadas.<ref name=":Recomend CDC 2010" /><ref name=":Recomendaciones Españolas 2012" /><ref name="ACOG 2020" /> |
||
Las muestras pueden ser tomadas por profesionales de la salud o por la misma embarazada tras adecuada información.<ref name=":Recomend CDC 2010" /><ref name=":Recomendaciones Españolas 2012" /><ref name= "Price 2006">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/17169231|título = Self-sampling for group B Streptococcus in women 35 to 37 weeks pregnant is accurate and acceptable: a randomized cross-over trial. En ingles.|apellidos = Price D, Shaw E, Howard M, Zazulak J, Waters H, Kaczorowski J.|nombre = |fecha = |publicación = J Obstet Gynaecol Can. 2006. 28: 1983-1088.|fechaacceso = |doi = |pmid = }}</ref><ref name= "Hicks 2009" >{{Cita publicación|url = http://www.jabfm.org/content/22/2/136.full.pdf|título = Patient self-collection of group B streptococcal specimens during pregnancy. En ingles|apellidos = Hicks P, Diaz-Perez MJ.|nombre = |fecha = |publicación = J Am Board Fam Med. 2009; 22: 136-140.|fecha acceso = |doi = |pmid = }}</ref><ref name = "Arya 2008" >{{Cita publicación|url = http://www.ejog.org/article/S0301-2115(07)00518-0/abstract|título = Self-collected versus health professional-collected genital swabs to identify the prevalence of group B streptococcus: A comparison of patient preference and efficacy.|apellidos = Arya A, Cryan B, O’Sullivan K, Greene RA, Higgins JR.|nombre = |fecha = |publicación = The European Journal of Obstetrics & Gynecology and Reproductive Biology 2008; 139: 32-45.|fecha acceso = |doi = 10.1016/j.ejogrb.2007.12.005|pmid = }}</ref> |
Las muestras pueden ser tomadas por profesionales de la salud o por la misma embarazada tras adecuada información.<ref name=":Recomend CDC 2010" /><ref name=":Recomendaciones Españolas 2012" /><ref name= "Price 2006">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/17169231|título = Self-sampling for group B Streptococcus in women 35 to 37 weeks pregnant is accurate and acceptable: a randomized cross-over trial. En ingles.|apellidos = Price D, Shaw E, Howard M, Zazulak J, Waters H, Kaczorowski J.|nombre = |fecha = |publicación = J Obstet Gynaecol Can. 2006. 28: 1983-1088.|fechaacceso = |doi = |pmid = }}</ref><ref name= "Hicks 2009" >{{Cita publicación|url = http://www.jabfm.org/content/22/2/136.full.pdf|título = Patient self-collection of group B streptococcal specimens during pregnancy. En ingles|apellidos = Hicks P, Diaz-Perez MJ.|nombre = |fecha = |publicación = J Am Board Fam Med. 2009; 22: 136-140.|fecha acceso = |doi = |pmid = }}</ref><ref name = "Arya 2008" >{{Cita publicación|url = http://www.ejog.org/article/S0301-2115(07)00518-0/abstract|título = Self-collected versus health professional-collected genital swabs to identify the prevalence of group B streptococcus: A comparison of patient preference and efficacy.|apellidos = Arya A, Cryan B, O’Sullivan K, Greene RA, Higgins JR.|nombre = |fecha = |publicación = The European Journal of Obstetrics & Gynecology and Reproductive Biology 2008; 139: 32-45.|fecha acceso = |doi = 10.1016/j.ejogrb.2007.12.005|pmid = }}</ref><ref name=Nebreda-Martin>{{cita publicación|apellidos1=Nebreda-Martín L, Albisu-Del Campo A, Valle-Ruiz de Larrea L, González-Rodríguez G, Arana-Arri E, Paz-Pascual C|título=Efectividad de la autotoma del exudado vaginorrectal para el cribado prenatal de la infección por Streptococcus agalactiae. Estudio GALL|publicación=Atención Primaria|fecha=2022|volumen=54|páginas=102366|doi=10.1016/j.aprim.2022.102366|url=|fechaacceso=4 de noviembre de 2023}}</ref> |
||
La toma del exudado vagino-rectal se realizará antes de cualquier manipulación vaginal, sin haber usado productos de higiene íntima femenina y sin tratamiento antibacteriano.<ref name="Padilla Ortega 2015">{{Cita publicación|url = |
La toma del exudado vagino-rectal se realizará antes de cualquier manipulación vaginal, sin haber usado productos de higiene íntima femenina y sin tratamiento antibacteriano.<ref name=":Recomendaciones Españolas 2012" /><ref name="Padilla Ortega 2015">{{Cita publicación|url = |título = Diagnóstico microbiológico de la infección bacteriana asociada al parto y puerperio.|apellidos = Padilla-Ortega B, Delgado-Palacio S, García-Garrote F, Rodríguez-Gómez JM, Romero-Hernández B.|nombre = |fecha = |publicación = Enferm Infecc Microbiol Clin. 2015 Dec 16. EN ESPAÑOL.|fechaacceso = |doi = 10.1016/j.eimc.2015.10.017|pmid = }}</ref> |
||
[[Archivo:Streptococcus agalactiae EGB Instruciones Toma Muestras.tif|thumb|Instrucciones para toma escobillón vagino-rectal para diagnóstico de portadoras de EGB en el embarazo- |
[[Archivo:Streptococcus agalactiae EGB Instruciones Toma Muestras.tif|thumb|Instrucciones para toma escobillón vagino-rectal para diagnóstico de portadoras de EGB en el embarazo- |
||
CDC- MMWR]] |
CDC- MMWR]] |
||
las muestras deben ser colocadas en un medio de transporte adecuado y si es posible deben conservase refrigeradas hasta su envío al laboratorio al que deben enviarse lo antes posible (en menos de 24 horas).<ref name="ASM 3020" /><ref name=":Recomend CDC 2010" /><ref name=":Recomendaciones Españolas 2012" /> En un medio de transporte adecuados el EGB continua viable por varios días a temperatura ambiente. Sin embargo la recuperación del EG disminuye con el tiempo de conservación de la muestra lo que puede dar lugar a resultados falsamente negativos.<ref name=":Recomend CDC 2010" /><ref name=":Recomendaciones Españolas 2012" /><ref name= "Rosa-Fraile 2005">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pmc/articles/PMC548104/pdf/1486-04.pdf|título = Specimen storage in transport medium and detection of group B streptococci by culture. En Ingles|apellidos = Rosa-Fraile M, Camacho-Muñoz E, Rodríguez-Granger J, Liébana-Martos C.|nombre = |fecha = |publicación = J Clin Microbiol. 2005; 43: 928-930.|fechaacceso = |doi = |pmid = }}</ref> |
las muestras deben ser colocadas en un medio de transporte adecuado y si es posible deben conservase refrigeradas hasta su envío al laboratorio al que deben enviarse lo antes posible (en menos de 24 horas).<ref name="ASM 3020" /><ref name=":Recomend CDC 2010" /><ref name=":Recomendaciones Españolas 2012" /> En un medio de transporte adecuados el EGB continua viable por varios días a temperatura ambiente. Sin embargo la recuperación del EG disminuye con el tiempo de conservación de la muestra lo que puede dar lugar a resultados falsamente negativos.<ref name=":Recomend CDC 2010" /><ref name=":Recomendaciones Españolas 2012" /><ref name= "Rosa-Fraile 2005">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pmc/articles/PMC548104/pdf/1486-04.pdf|título = Specimen storage in transport medium and detection of group B streptococci by culture. En Ingles|apellidos = Rosa-Fraile M, Camacho-Muñoz E, Rodríguez-Granger J, Liébana-Martos C.|nombre = |fecha = |publicación = J Clin Microbiol. 2005; 43: 928-930.|fechaacceso = |doi = |pmid = }}</ref> |
||
==== Métodos de cultivo para detectar colonización por EGB en la embarazada ==== |
==== Métodos de cultivo para detectar colonización por EGB en la embarazada ==== |
||
Las muestras (escobillones vaginales, rectales o vagino-rectales) deben ser inoculadas en un caldo de cultivo de enriquecimiento selectivo para EGB (caldo [[Todd Hewitt]] con antibióticos). Esto se efectúa para favorecer el desarrollo del EGB, impidiendo al mismo tiempo el crecimiento otras bacterias presentes en la muestra y que pueden interferir con la detección del EGB. Después de la incubación del caldo de enriquecimiento (18-24h, 35-37 °C) este es subcultivado a placas de [[Agar sangre|agar]] sangre y las colonias con aspecto de EGB son identificadas con el test CAMP, usando una técnica de aglutinación con látex o MALDI-TOF.<ref name="ASM 3020" /><ref name=":Recomend CDC 2010" /><ref name=":Recomendaciones Españolas 2012" /><ref name=":29">{{Cita publicación|url=|título=Reliable Detection of Group B Streptococcus in the Clinical Laboratory.|apellidos=Rosa-Fraile M, Spellerberg B|nombre=|fecha=Septiembre de 2017|publicación=Journal of Clinical Microbiology|volumen=55|número=9|páginas=2590-2598.|fechaacceso=|idioma=Inglés|doi=10.1128/JCM.00582-17|pmid=28659318|año=2017}}</ref> |
Las muestras (escobillones vaginales, rectales o vagino-rectales) deben ser inoculadas en un caldo de cultivo de enriquecimiento selectivo para EGB (caldo [[Todd Hewitt]] con antibióticos). Esto se efectúa para favorecer el desarrollo del EGB, impidiendo al mismo tiempo el crecimiento otras bacterias presentes en la muestra y que pueden interferir con la detección del EGB. Después de la incubación del caldo de enriquecimiento (18-24h, 35-37 °C) este es subcultivado a placas de [[Agar sangre|agar]] sangre y las colonias con aspecto de EGB son identificadas con el test CAMP, usando una técnica de aglutinación con látex o MALDI-TOF.<ref name="ASM 3020" /><ref name=":Recomend CDC 2010" /><ref name=":Recomendaciones Españolas 2012" /><ref name=":29">{{Cita publicación|url=|título=Reliable Detection of Group B Streptococcus in the Clinical Laboratory.|apellidos=Rosa-Fraile M, Spellerberg B|nombre=|fecha=Septiembre de 2017|publicación=Journal of Clinical Microbiology|volumen=55|número=9|páginas=2590-2598. |url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5648696/pdf/zjm2590.pdf|fechaacceso=|idioma=Inglés|doi=10.1128/JCM.00582-17|pmid=28659318|año=2017}}</ref> |
||
Después de la incubación el caldo de enriquecimiento puede ser subcultivado a una placa de agar [[Agar granada|granada]] donde el EGB crece como colonias rojo naranjas 100% específicas de EGB<ref name=" |
Después de la incubación el caldo de enriquecimiento puede ser subcultivado a una placa de agar [[Agar granada|granada]] donde el EGB crece como colonias rojo naranjas 100% específicas de EGB<ref name="Rosa-Fraile 2017" /><ref name=":Rosa-Fraile 1999" /><ref name=":Recomend CDC 2010" /><ref name=":Recomendaciones Españolas 2012" /><ref name = "Gil 1999">{{Cita publicación|url = http://jcm.asm.org/content/37/8/2648.full.pdf|título = Evaluation of the Granada agar plate for detection of vaginal and rectal group B streptococci in pregnant women|apellidos = Gil, EG; Rodríguez, MC; Bartolomé, R; Berjano, B; Cabero, L; Andreu, A.|nombre = |fecha = |publicación = Journal of Clinical Microbiology. 1999; 37: 2648-2651.|fechaacceso = |doi = |pmid = }}</ref><ref name= " Claeys 2001">{{Cita publicación|url = http://www.clinicalmicrobiologyandinfection.com/article/S1198-743X(14)63728-9/pdf|título = Modified Granada Agar Medium for the detection of group B streptococcus carriage in pregnant women.En ingles|apellidos = Claeys, G.; Verschraegen, G.; Temmerman, M.|nombre = |fecha = |publicación = Clinical Microbiology and Infection 2001; 7: 22-24.|fechaacceso = |doi = |pmid = }}</ref><ref name=":El Aila 2010">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2956727/|título = Comparison of different sampling techniques and of different culture methods for detection of group B streptococcus carriage in pregnant women. En ingles|apellidos = El Aila NA, Tency I, Claeys G, Saerens B, Cools P, Verstraelen H, Temmerman M, Verhelst R, Vaneechoutte M.|nombre = |fecha = |publicación = BMC Infect Dis. 2010; 10:285.|fechaacceso = |doi = 10.1186/1471-2334-10-285|pmid = }}</ref><ref name= ":Bou 2005">{{Cita publicación|url = http://www.clinicalmicrobiologyandinfection.com/article/S1198-743X(14)62425-3/pdf|título = Evaluation of Group B Streptococcus Differential Agar for detection and isolation of Streptococcus agalactiae.|apellidos = Bou G, Figueira M, Canle D, Cartelle M, Eiros JM, Villanueva R|nombre = |fecha = |publicación = Clinical Microbiology and Infection 2005; 11:676-678.|fechaacceso = |doi = |pmid = }}</ref> |
||
o una placa de medio cromogénico donde EGB crece como colonias coloreadas con diferentes aspectos dependiendo del medio utilizado.<ref name="Rosa-Fraile 2017" /><ref name="ASM 3020" /><ref name=":Recomend CDC 2010" /><ref name=":El Aila 2010" /><ref name=":Bou 2005" /> |
o una placa de medio cromogénico donde EGB crece como colonias coloreadas con diferentes aspectos dependiendo del medio utilizado.<ref name="Rosa-Fraile 2017" /><ref name="ASM 3020" /><ref name=":Recomend CDC 2010" /><ref name=":El Aila 2010" /><ref name=":Bou 2005" /> |
||
Si para la detección de EGB se utilizan medios de cultivo cromogénicos debe confirmarse que las colonias sospechosas (con aspecto de EGB) son realmente EGB utilizando un procedimiento adecuado de confirmación e.g. aglutinación con látex o el test CAMP.<ref name="Rosa-Fraile 2017" /><ref name="ASM 3020" /> |
Si para la detección de EGB se utilizan medios de cultivo cromogénicos debe confirmarse que las colonias sospechosas (con aspecto de EGB) son realmente EGB utilizando un procedimiento adecuado de confirmación e.g. aglutinación con látex o el test CAMP.<ref name="Rosa-Fraile 2017" /><ref name="ASM 3020" /> |
||
Es también posible inocular directamente los escobillones con la muestras vaginales, rectales o vagino-rectales en una placa de un medio de cultivo adecuado para EGB (agar sangre, medio granada o medio cromogénico), Sin embargo este método (omitiendo la etapa de enriquecimiento selectivo) puede dar lugar a algún resultado falsamente negativo y se aconseja usar este método (sin caldo de enriquecimiento) adicionalmente a la inoculación en caldo de enriquecimiento selectivo.<ref name=":Recomend CDC 2010" /> |
Es también posible inocular directamente los escobillones con la muestras vaginales, rectales o vagino-rectales en una placa de un medio de cultivo adecuado para EGB (agar sangre, medio granada o medio cromogénico), Sin embargo este método (omitiendo la etapa de enriquecimiento selectivo) puede dar lugar a algún resultado falsamente negativo y se aconseja usar este método (sin caldo de enriquecimiento) adicionalmente a la inoculación en caldo de enriquecimiento selectivo. |
||
<ref name=":Recomend CDC 2010" /> |
|||
[[Archivo:S agalactiae vagino-rectal culture GRANADA.png|alt=|thumb|Colonias de EGB en medio granada- Escobillón vagino-rectal. 18h. 36 °C.]] |
[[Archivo:S agalactiae vagino-rectal culture GRANADA.png|alt=|thumb|Colonias de EGB en medio granada- Escobillón vagino-rectal. 18h. 36 °C.]] |
||
==== Técnicas rápidas de detección del EGB. Pruebas "point-of-care testing (POCT)". Detección intraparto del EGB. PCR ==== |
==== Técnicas rápidas de detección del EGB. [[Pruebas de laboratorio en el lugar de asistencia]] "point-of-care testing (POCT)". Detección intraparto del EGB. PCR ==== |
||
Las técnicas de detección de EGB basadas en cultivar e identificar la bacteria no son lo suficientemente rápidas para detectar el EGB una vez que el parto ha comenzado. La siembra de los escobillones y el desarrollo del EGB en el cultivo requiere aguardar a que la bacteria se desarrolle, necesitando al menos varias horas. Por ello esta técnica no es utilizable como técnica de diagnóstico rápido que permita seleccionar las embarazadas candidatas a recibir PAI una vez ha comenzado el parto. |
Las técnicas de detección de EGB basadas en cultivar e identificar la bacteria no son lo suficientemente rápidas para detectar el EGB una vez que el parto ha comenzado. La siembra de los escobillones y el desarrollo del EGB en el cultivo requiere aguardar a que la bacteria se desarrolle, necesitando al menos varias horas. Por ello esta técnica no es utilizable como técnica de diagnóstico rápido que permita seleccionar las embarazadas candidatas a recibir PAI una vez ha comenzado el parto. |
||
| Línea 201: | Línea 218: | ||
Sin embargo las pruebas rápidas de detección de EGB directamente sobre las muestras carecen de sensibilidad suficiente para detectar en todos los casos la colonización por EGB por lo que su uso no se recomienda directamente en muestras clínicas y solo deben usarse tras una etapa de enriquecimiento en caldo selectivo.<ref name="ASM 3020" /><ref name="ACOG 2020" /> |
Sin embargo las pruebas rápidas de detección de EGB directamente sobre las muestras carecen de sensibilidad suficiente para detectar en todos los casos la colonización por EGB por lo que su uso no se recomienda directamente en muestras clínicas y solo deben usarse tras una etapa de enriquecimiento en caldo selectivo.<ref name="ASM 3020" /><ref name="ACOG 2020" /> |
||
Las pruebas rápidas pueden ser en el futuro efectivas para ser usadas como substituto del cultivo para detectar las madres portadoras de EGB. Pero estas pruebas deben ser aún mejoradas y simplificadas para su uso como |
Las pruebas rápidas pueden ser en el futuro efectivas para ser usadas como substituto del cultivo para detectar las madres portadoras de EGB. Pero estas pruebas deben ser aún mejoradas y simplificadas para su uso como [[Pruebas de laboratorio en el lugar de asistencia]] "Point of care testing, POCT" que pueda ser realizado en la sala de partos y reemplazar a la detección del EGB por cultivo.<ref name=":Recomend CDC 2010" /><ref name="Padilla Ortega 2015" /><ref name= "Daniels 2009">{{Cita publicación|url =http://www.journalslibrary.nihr.ac.uk/__data/assets/pdf_file/0020/64640/FullReport-hta13420.pdf|título =Rapid testing for group B streptococcus during labour: a test accuracy study with evaluation of acceptability and cost-effectiveness. En ingles.|apellidos =Daniels J, Gray J, Pattison H, Roberts T, Edwards E, Milner P, Spicer L, King E, Hills RK, Gray R, Buckley L, Magill L, Elliman N, Kaambwa B, Bryan S, Howard R, Thompson P, Khan KS.|nombre =|fecha =|publicación =Health Technol Assess. 2009; 13; No.42.|fechaacceso =|doi =|pmid =|fechaarchivo =23 de febrero de 2016|urlarchivo =https://web.archive.org/web/20160223064039/http://www.journalslibrary.nihr.ac.uk/__data/assets/pdf_file/0020/64640/FullReport-hta13420.pdf|deadurl =}}</ref> |
||
Un inconveniente de estas técnicas es que actualmente no permiten conocer la sensibilidad a los antibióticos de la cepa de EGB,<ref name="Padilla Ortega 2015" /> lo que es un problema serio si existe alergia a la penicilina. Las pruebas de diagnóstico rápido (POCT) pueden ser usadas en aquellas mujeres que ingresan de parto sin factores de riesgo y cuyo estado de portadoras de EGB no se conoce.<ref name="ASM 3020" /><ref name="ACOG 2020" /> |
Un inconveniente de estas técnicas es que actualmente no permiten conocer la sensibilidad a los antibióticos de la cepa de EGB,<ref name="Padilla Ortega 2015" /> lo que es un problema serio si existe alergia a la penicilina. Las pruebas de diagnóstico rápido (POCT) pueden ser usadas en aquellas mujeres que ingresan de parto sin factores de riesgo y cuyo estado de portadoras de EGB no se conoce.<ref name="ASM 3020" /><ref name="ACOG 2020" /> |
||
| Línea 225: | Línea 242: | ||
=== Epidemiología === |
=== Epidemiología === |
||
La incidencia publicada de infección neonatal por EGB in the UK fue 0.72 por 1,000 nacidos vivos en el periodo 2000-2001.<ref name = "Heath 2004" >{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/?term=Heath+PT%2C+Balfour+G%2C+Weisner+AM%2C|título = Group B streptococcal disease in UK and Irish infants younger than 90 days.|apellidos = Heath PT, Balfour G, Weisner AM, Efstratiou A, Lamagni TL, Tighe H, O'Connell LA, Cafferkey M, Verlander NQ, Nicoll A, McCartney AC; PHLS Group B Streptococcus Working Group.|nombre = |fecha = |publicación = Lancet. 2004; 363: 292-294.|fechaacceso = |doi = |pmid = |idioma = Inglés}}</ref><ref name=" Doare 2013">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/23973349|título = An overview of global GBS epidemiology.|apellidos = Doare K, Heath PT.|nombre = |fecha = |publicación = Vaccine.2013; 31 Suppl 4: D7-12.|fechaacceso = |doi = 10.1016/j.vaccine.2013.01.009|pmid = |idioma = Inglés}}</ref> y de 0.57 por 1000 en 2015.<ref name=":Hughes RCOG 2017" /> |
La incidencia publicada de infección neonatal por EGB in the UK fue 0.72 por 1,000 nacidos vivos en el periodo 2000-2001.<ref name = "Heath 2004" >{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/?term=Heath+PT%2C+Balfour+G%2C+Weisner+AM%2C|título = Group B streptococcal disease in UK and Irish infants younger than 90 days.|apellidos = Heath PT, Balfour G, Weisner AM, Efstratiou A, Lamagni TL, Tighe H, O'Connell LA, Cafferkey M, Verlander NQ, Nicoll A, McCartney AC; PHLS Group B Streptococcus Working Group.|nombre = |fecha = |publicación = Lancet. 2004; 363: 292-294.|fechaacceso = |doi = |pmid = |idioma = Inglés}}</ref> |
||
<ref name=" Doare 2013">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/23973349|título = An overview of global GBS epidemiology.|apellidos = Doare K, Heath PT.|nombre = |fecha = |publicación = Vaccine.2013; 31 Suppl 4: D7-12.|fechaacceso = |doi = 10.1016/j.vaccine.2013.01.009|pmid = |idioma = Inglés}}</ref> y de 0.57 por 1000 en 2015.<ref name=":Hughes RCOG 2017" /> |
|||
Sin embargo, se ha indicado que esta cifra puede estar muy infravalorada, pues un considerable número de RN con una probable infección pueden tener cultivos negativos como consecuencia de un tratamiento previo de la madre con antibióticos, que puede inhibir el crecimiento del EGB en los cultivos de sangre (hemocultivo) y [[Líquido cefalorraquídeo|líquido]] cefalorraquídeo del RN sin enmascarar los síntomas clínicos.<ref name = "Brigtsen 2015">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/26182960|título = Maternal colonization with Group B Streptococcus Is associated with an increased rate of infants transferred to the neonatal intensive care unit.|apellidos = Brigtsen A.K. Jacobsen A.F. Dedi L. Melby K.K. Fugelseth D. Whitelaw A.|nombre = |fecha = |publicación = Neonatology. 2015; 108: 157-163.|fechaacceso = |doi = 10.1159/000434716|pmid = |idioma = Inglés}}</ref><ref name = " Carbonell-Estrany 2008">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/17704105|título = Probable early-onset group B streptococcal neonatal sepsis: a serious clinical condition related to intrauterine infection.|apellidos = Carbonell-Estrany X, Figueras-Aloy J, Salcedo-Abizanda S, de la Rosa-Fraile M, Castrillo Study Group.|nombre = |fecha = |publicación = Archives of Disease in Childhood. Fetal Neonatal Edition. 2008; 93: F85-89.|fechaacceso = |doi = |pmid = }}</ref> |
Sin embargo, se ha indicado que esta cifra puede estar muy infravalorada, pues un considerable número de RN con una probable infección pueden tener cultivos negativos como consecuencia de un tratamiento previo de la madre con antibióticos, que puede inhibir el crecimiento del EGB en los cultivos de sangre (hemocultivo) y [[Líquido cefalorraquídeo|líquido]] cefalorraquídeo del RN sin enmascarar los síntomas clínicos.<ref name = "Brigtsen 2015">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/26182960|título = Maternal colonization with Group B Streptococcus Is associated with an increased rate of infants transferred to the neonatal intensive care unit.|apellidos = Brigtsen A.K. Jacobsen A.F. Dedi L. Melby K.K. Fugelseth D. Whitelaw A.|nombre = |fecha = |publicación = Neonatology. 2015; 108: 157-163.|fechaacceso = |doi = 10.1159/000434716|pmid = |idioma = Inglés}}</ref><ref name = " Carbonell-Estrany 2008">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/17704105|título = Probable early-onset group B streptococcal neonatal sepsis: a serious clinical condition related to intrauterine infection.|apellidos = Carbonell-Estrany X, Figueras-Aloy J, Salcedo-Abizanda S, de la Rosa-Fraile M, Castrillo Study Group.|nombre = |fecha = |publicación = Archives of Disease in Childhood. Fetal Neonatal Edition. 2008; 93: F85-89.|fechaacceso = |doi = |pmid = }}</ref> |
||
En USA se ha publicado una incidencia de infección neonatal precoz por EGB del 0.47 por 1000 RN vivos en 1999-2011, que decreció al 0.34 por 1000 en 2003-2005<ref name=":Phares 2008" /> y a 0.23 por mil en 2015.<ref name=":Nanduri 2019" /> |
En USA se ha publicado una incidencia de infección neonatal precoz por EGB del 0.47 por 1000 RN vivos en 1999-2011, que decreció al 0.34 por 1000 en 2003-2005<ref name=":Phares 2008" /> y a 0.23 por mil en 2015. |
||
<ref name=":Nanduri 2019" /> |
|||
Los CDC han comunicado una incidencia de infección neonatal precoz por EGB del 0.25 por 1,000 RN vivos en 2010. Mientras que la incidencia de infección neonatal tardía permaneció inalterada en un 0.31 por 1,000.<ref name=":Nanduri 2019" /><ref name= "Baker 2013" >{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/?term=The+spectrum+of+perinatal+group+B+streptococcal+disease|título = The spectrum of perinatal group B streptococcal disease.|apellidos = Baker CJ.|nombre = |fecha = |publicación = Vaccine 2013; 31s: D3-6.|fechaacceso = |doi = 10.1016/j.vaccine.2013.02.030|pmid = |idioma = Inglés}}</ref> |
|||
[[Archivo:Incidence GBS-EOD in Spain-Castrillo group.tif|alt=Disminución de la incidencia de infección precoz por EGB en España. Grupo Castrillo de hospitales.|thumb]] |
[[Archivo:Incidence GBS-EOD in Spain-Castrillo group.tif|alt=Disminución de la incidencia de infección precoz por EGB en España. Grupo Castrillo de hospitales.|thumb]] |
||
En España la incidencia de la infección neonatal por EGB descendió desde 1.25 por mil en 1996 a 0.33 por 1000 en 2008.<ref name= " Lopez Sastre 2009" >{{Cita publicación|url = http://www.earlyhumandevelopment.com/article/S0378-3782(09)00177-7/abstract|título = An epidemiological study from the "Grupo de Hospitales Castrillo.|apellidos = Lopez Sastre J, Fernandez Colomer B, Coto Cotallo Gil D, Members of “Grupo de Hospitales Castrillo".|nombre = |fecha = |publicación = Early Human Development 2009; 85: S100.|fechaacceso = |doi = 10.1016/j.earlhumdev.2009.08.049|pmid = |idioma = Inglés}}</ref> |
En España la incidencia de la infección neonatal por EGB descendió desde 1.25 por mil en 1996 a 0.33 por 1000 en 2008.<ref name= " Lopez Sastre 2009" >{{Cita publicación|url = http://www.earlyhumandevelopment.com/article/S0378-3782(09)00177-7/abstract|título = An epidemiological study from the "Grupo de Hospitales Castrillo.|apellidos = Lopez Sastre J, Fernandez Colomer B, Coto Cotallo Gil D, Members of “Grupo de Hospitales Castrillo".|nombre = |fecha = |publicación = Early Human Development 2009; 85: S100.|fechaacceso = |doi = 10.1016/j.earlhumdev.2009.08.049|pmid = |idioma = Inglés}}</ref> |
||
El Grupo de Hospitales Fundación Castrillo ha comunicado en 2018 en España una incidencia de infección neonatal precoz por EGB del 0.17 por mil RN vivos y del 0,05 por mil de infección neonatal tardía por EGB.<ref name=Rosa-Alos /> |
|||
En el área de Barcelona entre 2004 y 2010 la incidencia de infección precoz por EGB fue de 0.29 por 1000 RN vivos sin cambios significativos entre los distintos años. La mortalidad fue del 8.16%.<ref name="Gimenez 2015" /><ref name="Andreu 2003" >{{Cita publicación|url=https://www.elsevier.es/es-revista-enfermedades-infecciosas-microbiologia-clinica-28-pdf-S0213005X03729139|título=Declive de la incidencia de la sepsis perinatal por estreptococo del grupo B (Barcelona 1994-2001). Relación con las políticas profilácticas.|apellidos=Andreu A, Sanfeliu I, Viñas L, Barranco M, Bosch J, Dopico E, Guardia C, Juncosa T, Lite J, Matas L, Sánchez F, Sierr M; Grupo de Microbiólogos pare el Estudio de las Infecciones de Transmissión Vertical, Societat Catalana de Malalties Infeccioses i Microbiologia Clínica,|nombre=|fecha=|publicación=Enferm Infecc Microbiol Clin. 2003;21:174-179. EN ESPAÑOL|fechaacceso=|idioma=Español|doi=10.1016/S0213-005X(03)72913-9|pmid=}}</ref> |
En el área de Barcelona entre 2004 y 2010 la incidencia de infección precoz por EGB fue de 0.29 por 1000 RN vivos sin cambios significativos entre los distintos años. La mortalidad fue del 8.16%.<ref name="Gimenez 2015" /><ref name="Andreu 2003" >{{Cita publicación|url=https://www.elsevier.es/es-revista-enfermedades-infecciosas-microbiologia-clinica-28-pdf-S0213005X03729139|título=Declive de la incidencia de la sepsis perinatal por estreptococo del grupo B (Barcelona 1994-2001). Relación con las políticas profilácticas.|apellidos=Andreu A, Sanfeliu I, Viñas L, Barranco M, Bosch J, Dopico E, Guardia C, Juncosa T, Lite J, Matas L, Sánchez F, Sierr M; Grupo de Microbiólogos pare el Estudio de las Infecciones de Transmissión Vertical, Societat Catalana de Malalties Infeccioses i Microbiologia Clínica,|nombre=|fecha=|publicación=Enferm Infecc Microbiol Clin. 2003;21:174-179. EN ESPAÑOL|fechaacceso=|idioma=Español|doi=10.1016/S0213-005X(03)72913-9|pmid=}}</ref> |
||
En Francia desde 2001 ha sido publicada una disminución rápida de la incidencia de la infección neonatal por EGB desde el uso generalizado de la PAI |
En Francia desde 2001 ha sido publicada una disminución rápida de la incidencia de la infección neonatal por EGB desde el uso generalizado de la PAI.<ref name="Sikias 2022">{{cita publicación|apellidos1=Sikias P, Biran V, Foix-L'Hélias L, Plainvert C, Boileau P, Bonacorsi S; EOS study group.|título=Early-onset neonatal sepsis in the Paris area: a population-based surveillance study from 2019 to 2021|publicación=Arch Dis Child Fetal Neonatal Ed .|fecha=2023|volumen=108|página=114-120|doi=10.1136/archdischild-2022-324080|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9985718/pdf/fetalneonatal-2022-324080.pdf|fechaacceso=7 de noviembre de 2023}}</ref> |
||
La incidencia de la infección neonatal por EGB en 2012 se ha estimado en 0.53 por 1,000 RN en Europa, en 0,67 en América y en un 0.15 en Australia. En los países donde no está establecido el uso PAI la incidencia fue 2.2 veces más alta que en aquellos donde está establecido el uso de PAI.<ref name=":Edmond 2012" /><ref name="Doare 2013" /> |
La incidencia de la infección neonatal por EGB en 2012 se ha estimado en 0.53 por 1,000 RN en Europa, en 0,67 en América y en un 0.15 en Australia. En los países donde no está establecido el uso PAI la incidencia fue 2.2 veces más alta que en aquellos donde está establecido el uso de PAI.<ref name=":Edmond 2012" /><ref name="Doare 2013" /> |
||
A nivel mundial en 2015 se ha estimado una incidencia anual de unos 205.000 casos de infección neonatal precoz por EGB y de unos 114.000 casos de infección neonatal tardía.<ref name =" Seale 2017">{{Cita publicación|url=|título=Estimates of the Burden of Group B Streptococcal Disease Worldwide for Pregnant Women, Stillbirths, and Children.|apellidos=Seale AC, Bianchi-Jassir F, Russell NJ, |
A nivel mundial en 2015 se ha estimado una incidencia anual de unos 205.000 casos de infección neonatal precoz por EGB y de unos 114.000 casos de infección neonatal tardía.<ref name =" Seale 2017">{{Cita publicación|url=|título=Estimates of the Burden of Group B Streptococcal Disease Worldwide for Pregnant Women, Stillbirths, and Children.|apellidos=Seale AC, Bianchi-Jassir F, Russell NJ, et al.|nombre=|fecha=2017|publicación=Clin Infect Dis. 65(suppl_2):S200-S219. 10.1093/cid/cix664|fechaacceso=|doi=10.1093/cid/cix664|pmid=}}</ref> |
||
Estimaciones mas recientes cifran, a nivel mundial en 2020, que 400.000 recién nacidos han sufrido infección neonatal por EGB y 90.000 han muerto como consecuencia de ello, principalmente en paises en vias de desarrollo. <ref name=Proma-Goncalvez>{{cita publicación|apellidos1=Proma P., Goncalvez B.P., Le Doare k., Lawn E.|título=20 million pregnant women with group B streptococcus carriage: consequences, challenges, and opportunities for prevention|publicación=Curr Opin Pediatr 2023;35:223-30.|fecha=2023|volumen=35|páginas=223-230|doi=10.1097/MOP.0000000000001223|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9994794/pdf/coped-35-223.pdf|fechaacceso=9 de noviembre de 2023}}</ref> |
|||
La frecuencia estimada de infección neonatal precoz por EGB varia entre diferentes países con incidencias de 0.09 en Japón, 0,58 en Panamá, 0.76 en Hong Kong y 2.35 en República Dominicana siendo en general inferior en Asia y más alta en África.<ref name="Raabe 2019">{{cita publicación|apellidos1=Raabe VN, Shane AL|título=Group B Streptococcus (Streptococcus agalactiae)|publicación=Microbiol Spectr|fecha=2019|volumen=7|página=GPP3-0007-2018.|doi=10.1128/microbiolspec.GPP3-0007-2018|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6432937/pdf/nihms-998887.pdf|fechaacceso=16 de febrero de 2021}}</ref> |
La frecuencia estimada de infección neonatal precoz por EGB varia entre diferentes países con incidencias de 0.09 en Japón, 0,58 en Panamá, 0.76 en Hong Kong y 2.35 en República Dominicana siendo en general inferior en Asia y más alta en África.<ref name="Raabe 2019">{{cita publicación|apellidos1=Raabe VN, Shane AL|título=Group B Streptococcus (Streptococcus agalactiae)|publicación=Microbiol Spectr|fecha=2019|volumen=7|página=GPP3-0007-2018.|doi=10.1128/microbiolspec.GPP3-0007-2018|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6432937/pdf/nihms-998887.pdf|fechaacceso=16 de febrero de 2021}}</ref> |
||
Con la aplicación generalizada en muchos países de medidas de prevención de la infección neonatal por EGB la incidencia de estas infecciones ha disminuido a una estimación global del 0.49 por 1000 recién nacidos vivos. Aunque existen grandes diferencias entre diversos países.<ref name=DEVANI/> |
|||
=== Recomendaciones nacionales para prevención de la infección neonatal por EGB === |
=== Recomendaciones nacionales para prevención de la infección neonatal por EGB === |
||
La política de prevención de la infección neonatal precoz por EGB basada en la detección del estado de portadoras de la gestante u administración de profilaxis antibiótica intraparto ha sido adoptada por mas de 35 países.<ref name=Proma-Goncalvez /> |
|||
==== USA. Guidelines from the Centers for Disease Control and Prevention, CDC. Opinión del Comité ACOG ==== |
==== USA. Guidelines from the Centers for Disease Control and Prevention, CDC. Opinión del Comité ACOG ==== |
||
| Línea 267: | Línea 297: | ||
--Modificaciones en el algoritmo para reducir evaluaciones innecesarias en RN que aparecen sanos y tienen bajo riesgo de desarrollar infección neonatal precoz por EGB. |
--Modificaciones en el algoritmo para reducir evaluaciones innecesarias en RN que aparecen sanos y tienen bajo riesgo de desarrollar infección neonatal precoz por EGB. |
||
En USA el costo asociado a las infecciones neonatales por EGB antes de la instauración de la prevención se ha estimado en 294 millones de dólares anuales.<ref name=":37" /> |
|||
En el año 2018 los CDC transfirieron la responsabilidad de actualización de sus recomendaciones para a prevención de la infección neonatal por EGB al colegio americano de obstetras y ginecólogos (American College of Obstetricians and Gynecologists, ACOG), a la Academia Americana de Pediatría (AAP) y a la Sociedad Americana de Microbiología (ASM) que han publicado nuevos documento de recomendaciones.<ref name="ASM 3020" /><ref name="ACOG 2020" /><ref name="Puopolo AAP 2019" /> |
En el año 2018 los CDC transfirieron la responsabilidad de actualización de sus recomendaciones para a prevención de la infección neonatal por EGB al colegio americano de obstetras y ginecólogos (American College of Obstetricians and Gynecologists, ACOG), a la Academia Americana de Pediatría (AAP) y a la Sociedad Americana de Microbiología (ASM) que han publicado nuevos documento de recomendaciones.<ref name="ASM 3020" /><ref name="ACOG 2020" /><ref name="Puopolo AAP 2019" /> |
||
| Línea 322: | Línea 350: | ||
El costo para el sistema de salud en el Reino Unido (NHS) de las indemnizaciones satisfechas por responsabilidad en el desarrollo de infecciones neonatales por EGB ha sido estimado entre 2006 y 2018 en 50 millones de libras.<ref>{{Cita web|url=https://gbss.org.uk/wp-content/uploads/2018/10/2018_09-The-cost-of-group-B-Strep-infection-FINAL-WEB.pdf|título=The cost of group B Strep infection|autor=UK GROUP B STREP SUPPORT|año=2018}}</ref> |
El costo para el sistema de salud en el Reino Unido (NHS) de las indemnizaciones satisfechas por responsabilidad en el desarrollo de infecciones neonatales por EGB ha sido estimado entre 2006 y 2018 en 50 millones de libras.<ref>{{Cita web|url=https://gbss.org.uk/wp-content/uploads/2018/10/2018_09-The-cost-of-group-B-Strep-infection-FINAL-WEB.pdf|título=The cost of group B Strep infection|autor=UK GROUP B STREP SUPPORT|año=2018}}</ref> |
||
==== Recomendaciones argentinas ==== |
==== Recomendaciones argentinas y colombianas ==== |
||
En la República Argentina desde 1996 se recomendó la estrategia de prevención basada en factores de riesgo, señalando la obligación de "Realizar en todas las instituciones, la estrategia de profilaxis intraparto a mujeres con factores de riesgo de portar EGB", señalando que la misma "disminuirá la infección neonatal precoz con EGB en no menos de un 70%". Y, se indica que "en aquellas instituciones en que existen posibilidades para realizar un cuidadoso protocolo de investigación, se podrá realizar el cultivo entre las 35 a 37 semanas de EGB.<ref name=":23">{{Cita web|url=http://www.ms.gba.gov.ar/sitios/tocoginecologia/files/2014/09/Consenso-Estreptococo-B-Hemol%C3%ADtico.pdf|título=Recomendaciones para la prevención, diagnóstico y tratamiento de la infección neonatal precoz por Estreptococo β Hemolítico del Grupo B (EGB).|fechaacceso=14 noviembre 2019.|autor=Ministerio de Salud de la Nación. Dirección Nacional de Salud Materno Infantil. Argentina,|enlaceautor=|fecha=|sitioweb=|editorial=|idioma=}}</ref> |
En la República Argentina desde 1996 se recomendó la estrategia de prevención basada en factores de riesgo, señalando la obligación de "Realizar en todas las instituciones, la estrategia de profilaxis intraparto a mujeres con factores de riesgo de portar EGB", señalando que la misma "disminuirá la infección neonatal precoz con EGB en no menos de un 70%". Y, se indica que "en aquellas instituciones en que existen posibilidades para realizar un cuidadoso protocolo de investigación, se podrá realizar el cultivo entre las 35 a 37 semanas de EGB.<ref name=":23">{{Cita web|url=http://www.ms.gba.gov.ar/sitios/tocoginecologia/files/2014/09/Consenso-Estreptococo-B-Hemol%C3%ADtico.pdf|título=Recomendaciones para la prevención, diagnóstico y tratamiento de la infección neonatal precoz por Estreptococo β Hemolítico del Grupo B (EGB).|fechaacceso=14 noviembre 2019.|autor=Ministerio de Salud de la Nación. Dirección Nacional de Salud Materno Infantil. Argentina,|enlaceautor=|fecha=|sitioweb=|editorial=|idioma=}}</ref> |
||
Con posterioridad en 2008 se publicó la Ley de SALUD PUBLICA 26.369 que incorpora con carácter obligatorio de control y prevención, la realización del examen de detección del estreptococo Grupo B Agalactiae, a todas las embarazadas con edad gestacional entre las semanas 35 y 37, presenten o no condiciones de riesgo.<ref name="Aergentina Ley 26369">{{cita web|apellidos1=Ley 26.369|título=Realización del examen de detección del estreptococo Grupo B Agalactiae, a todas las embarazadas con edad gestacional entre las semanas 35 y 37,|url= |
Con posterioridad en 2008 se publicó la Ley de SALUD PUBLICA 26.369 que incorpora con carácter obligatorio de control y prevención, la realización del examen de detección del estreptococo Grupo B Agalactiae, a todas las embarazadas con edad gestacional entre las semanas 35 y 37, presenten o no condiciones de riesgo.<ref name="Aergentina Ley 26369">{{cita web|apellidos1=Ley 26.369|título=Realización del examen de detección del estreptococo Grupo B Agalactiae, a todas las embarazadas con edad gestacional entre las semanas 35 y 37,|url= https://e-legis-ar.msal.gov.ar/htdocs/legisalud/migration/html/7539.html#:~:text=LEY%2026369,rutinaria%20de%20control%20y%20prevenci%C3%B3n. |
||
|idioma=Español|fecha=2008|fechaacceso=7 de noviembre de 2023}}</ref> |
|||
Sin embargo esta ley no se encuentra aún reglamentada y ha generado controversia sobre la posibilidad de su efectivo cumplimiento al significar una modificación sustancial a la estrategia difundida por el Ministerio de Salud desde 1996 la cual se basaba en la identificación de los factores de riesgo en el momento del parto.<ref name=":23" /> |
Sin embargo esta ley no se encuentra aún reglamentada y ha generado controversia sobre la posibilidad de su efectivo cumplimiento al significar una modificación sustancial a la estrategia difundida por el Ministerio de Salud desde 1996 la cual se basaba en la identificación de los factores de riesgo en el momento del parto.<ref name=":23" /> |
||
En Colombia por Resolución del Ministerio de Salud y Protección Social también se ha declarado la obligatoriedad de efectuar la detección del estado de portadora de EGB en la gestante por cultivo vaginal y rectal. |
|||
<ref name=Colombia>{{cita web|apellidos1=República de Colombia. Ministerio de Salud y Proteccion Social.|título=Resolucion 3280|url=https://www.minsalud.gov.co/Normatividad_Nuevo/Resoluci%C3%B3n%20No.%203280%20de%2020183280.pdf|idioma=Español|fecha=2018|fechaacceso=7 de noviembre de 2023}}</ref> |
|||
==== Otras recomendaciones ==== |
==== Otras recomendaciones ==== |
||
Recomendaciones para la prevención de la infección neonatal por EGB se han publicado en muchos países. En la mayoría de países desarrollados recomiendan el uso del cribado universal para detectar EGB al final del embarazo y la administración de PAI a las madres colonizadas. e.g. Canadá,<ref>{{Cita publicación|url=https://www.jogc.com/article/S1701-2163(18)30495-X/fulltext|título=The Prevention of Early-Onset Neonatal Group B Streptococcal Disease.|apellidos=Money D, Allen VM.|nombre=|fecha=2018|publicación=J Obstet Gynaecol Can. 2018 :e665-e674. 10.1016/j.jogc.2018.05.032.|fechaacceso= |
Recomendaciones para la prevención de la infección neonatal por EGB se han publicado en muchos países. En la mayoría de países desarrollados recomiendan el uso del cribado universal para detectar EGB al final del embarazo y la administración de PAI a las madres colonizadas. e.g. Canadá,<ref>{{Cita publicación|url=https://www.jogc.com/article/S1701-2163(18)30495-X/fulltext|título=The Prevention of Early-Onset Neonatal Group B Streptococcal Disease.|apellidos=Money D, Allen VM.|nombre=|fecha=2018|publicación=J Obstet Gynaecol Can. 2018 :e665-e674. 10.1016/j.jogc.2018.05.032.|fechaacceso=7 de noviembre de 2023|idioma=Inglés|doi=10.1016/j.jogc.2018.05.032|pmid=}}</ref><ref>{{Cita web|url=https://www.pregnancyinfo.ca/your-pregnancy/routine-tests/group-b-streptococcus-screening/|título=Group B Streptococcus screening|fechaacceso=7 de noviembre de 2023|autor=The Society of Obstetricians and Gynaecologists of Canada (SOGC)}}</ref>Suiza,<ref>{{Cita publicación|url = http://www.karger.com/Article/Pdf/100342|título = Prophylaxe der frühen Neugeborenensepsis durch Streptokokken der Gruppe B-Prevention of early neonatal sepsis by GBS.|apellidos = Surbek D.Kommission für Qualitätssicherung der SGGG/gynécologie suisse.|nombre = |fecha = |publicación = Gynäkol Geburtshilfliche Rundsch. 2007; 47: 103-104.|fechaacceso = |doi = |pmid = |idioma = Aleman.}}</ref>Alemania,<ref>{{Cita web|url=https://www.awmf.org/uploads/tx_szleitlinien/024-020l_S2k_Prophylaxe_Neugeborenensepsis_Streptokokken_2016-04.pdf|título=Prophylaxe der Neugeborenensepsis - frühe Form - durch Streptokokken der Gruppe B|fechaacceso=21 de febrero 2021|autor=Leitlinien der Gesellschaft für Neonatologie und Pädiatrische Intensivmedizin (GNPI) Deutschen Gesellschaft für Gynäkologie und Geburtshilfe, Deutschen Gesellschaft für Pädiatrische Infektiologie (DGPI), und Deutsche Gesellschaft für Perinatale Medizin (DGPM).|enlaceautor=|fecha=|sitioweb=|editorial=|idioma=Alemán|fechaarchivo=6 de julio de 2016|urlarchivo=https://web.archive.org/web/20160706060407/http://www.awmf.org/uploads/tx_szleitlinien/024-020l_S2k_Prophylaxe_Neugeborenensepsis_Streptokokken_2016-04.pdf|deadurl=yes}}</ref>Polonia,<ref>{{Cita publicación|url =https://www.ptgin.pl/sites/scm/files/2021-09/02.2008%20-%20W%20TRAKCIE%20AKTUALIZACJI%20-%20Wykrywanie%20nosicielstwa%20GBS%20u%20kobiet%20w%20ci%C4%85%C5%BCy%20i%20zapobiegania%20zaka%C5%BCeniom%20u%20noworodk%C3%B3w.pdf|título = Rekomendacje polskiego towarzystwa ginekologicznego dotyczące wykrywania nosicielstwa paciorkowców grupy B (GBS) u kobiet w ciąży i zapobiegania zakażeniom u noworodków--Recommendations Polish Gynecological Society for the detection of carriers of GBS in pregnant women and prevent infections in newborns..|apellidos = Kotarski J, Heczko PB, Lauterbach R, Niemiec T, Leszczyńska- Gorzelak B.|nombre = |fecha = |publicación = Ginekol Pol 2008; 79: 221-223.|fechaacceso = |doi = |pmid = |idioma = Polaco}}</ref>República Checa,<ref>{{Cita publicación|url =https://www.porodniasistentky.info/wp-content/uploads/2016/08/p-2013-diagnostika-a-lecba-streptokoku-skupiny-b-v-tehotenstvi.pdf| título = Diagnostika a léčba streptokoků skupiny B v těhotenství a za porodu - doporučený postup---Diagnosis and treatment of GBS in pregnancy and during birth - Recommendations.|apellidos = A. Měchurová, V. Unzeitig, J. Mašata, P. Švihovec|nombre = |fecha = |publicación = Klin Mikrobiol Infekc Lek. 2013; 12: 11-14.|fechaacceso = 7 de noviembre de 2023|doi = |pmid = |idioma = Checo.}}</ref> Francia,<ref>{{Cita web|url = http://www.has-sante.fr/portail/upload/docs/application/pdf/prevention_antenatale_du_risque_infectieux_bacterien_-_rec.pdf|título = Prévention anténatale du risque infectieux bactérien néonatal précoce. 2001.|autor = Agence Nationale d’Accreditation et d’Evaluation en Santé.|enlaceautor = |fecha = |idioma = Frances.|editorial = |fechaacceso = 7 de noviembre de 2023|sitioweb = }}</ref> y Bélgica.<ref>{{cita web|apellidos1=Belgian Health Council|título=PREVENTION OF PERINATAL GROUP B STREPTOCOCCAL INFECTIONS Guidelines|url=https://web.archive.org/web/20160304104930/https://orbi.ulg.ac.be/bitstream/2268/8652/1/GBS_CSH%20english%202003.pdf|idioma=Ingles|fecha=2003|fechaacceso=7 de noviembre de 2023}}</ref> |
||
Polonia,<ref>{{Cita publicación|url = |título = Rekomendacje polskiego towarzystwa ginekologicznego dotyczące wykrywania nosicielstwa paciorkowców grupy B (GBS) u kobiet w ciąży i zapobiegania zakażeniom u noworodków--Recommendations Polish Gynecological Society for the detection of carriers of GBS in pregnant women and prevent infections in newborns..|apellidos = Kotarski J, Heczko PB, Lauterbach R, Niemiec T, Leszczyńska- Gorzelak B.|nombre = |fecha = |publicación = Ginekol Pol 2008; 79: 221-223.|fechaacceso = |doi = |pmid = |idioma = Polaco}}</ref> República Checa,<ref>{{Cita publicación|url = http://www.gynultrazvuk.cz/data/clanky/6/dokumenty/p-2013-diagnostika-a-lecba-streptokoku-skupiny-b-v-tehotenstvi.pdf|título = Diagnostika a léčba streptokoků skupiny B v těhotenství a za porodu - doporučený postup---Diagnosis and treatment of GBS in pregnancy and during birth - Recommendations.|apellidos = A. Měchurová, V. Unzeitig, J. Mašata, P. Švihovec|nombre = |fecha = |publicación = Klin Mikrobiol Infekc Lek. 2013; 12: 11-14.|fechaacceso = |doi = |pmid = |idioma = Checo.}}</ref> Francia,<ref>{{Cita web|url = http://www.has-sante.fr/portail/upload/docs/application/pdf/prevention_antenatale_du_risque_infectieux_bacterien_-_rec.pdf|título = Prévention anténatale du risque infectieux bactérien néonatal précoce. 2001.|autor = Agence Nationale d’Accreditation et d’Evaluation en Santé.|enlaceautor = |fecha = |idioma = Frances.|editorial = |fechaacceso = 10 de febrero de 2016|sitioweb = }}</ref> y Bélgica.<ref>{{Cita web|url=https://orbi.ulg.ac.be/bitstream/2268/8652/1/GBS_CSH%20english%202003.pdf|título=PREVENTION OF PERINATAL GROUP B STREPTOCOCCAL INFECTIONS. |
|||
Guidelines from the Belgian Health Council, 2003|fechaacceso=10 Noviembre 2019.|autor=Belgian Health Council.|enlaceautor=|fecha=|sitioweb=|editorial=|idioma=Ingles.|fechaarchivo=4 de marzo de 2016|urlarchivo=https://web.archive.org/web/20160304104930/https://orbi.ulg.ac.be/bitstream/2268/8652/1/GBS_CSH%20english%202003.pdf|deadurl=yes}}</ref> |
|||
Recomendaciones basadas en el criterio de factores de riesgo para recomendar PAI han sido publicadas en Holanda,<ref>{{Cita web|url=http://www.med-info.nl/Richtlijnen/Gynecologie/Perinatologie/Preventie%20van%20neonatale%20groep-B-streptokokkenziekte%20(GBS-ziekte).pdf|título=Preventie van neonatale groep-B-streptokokkenziekte (GBS- Ziekte). 2008.|fechaacceso=14 de noviembre de 2019|autor=Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)|enlaceautor=|fecha=|sitioweb=|editorial=|idioma=Holandés}}</ref> |
Recomendaciones basadas en el criterio de factores de riesgo para recomendar PAI han sido publicadas en Holanda,<ref>{{Cita web|url=http://www.med-info.nl/Richtlijnen/Gynecologie/Perinatologie/Preventie%20van%20neonatale%20groep-B-streptokokkenziekte%20(GBS-ziekte).pdf|título=Preventie van neonatale groep-B-streptokokkenziekte (GBS- Ziekte). 2008.|fechaacceso=14 de noviembre de 2019|autor=Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)|enlaceautor=|fecha=|sitioweb=|editorial=|idioma=Holandés}}</ref> |
||
El Real Colegio Australiano y Neozelandés de Obstetras y Ginecólogos (Royal Australian and New Zealand College of Obstetricians and Gynaecologists, RANZCOG) no recomienda claramente una u otra estrategia, sino que indica que los médicos encargados de la atención a la embarazada deben escoger de acuerdo con las recomendaciones en su área.<ref>{{Cita web|url=https://ranzcog.edu.au/ |
El Real Colegio Australiano y Neozelandés de Obstetras y Ginecólogos (Royal Australian and New Zealand College of Obstetricians and Gynaecologists, RANZCOG) no recomienda claramente una u otra estrategia, sino que indica que los médicos encargados de la atención a la embarazada deben escoger de acuerdo con las recomendaciones en su área.<ref>{{Cita web|url= |
||
https://ranzcog.edu.au/wp-content/uploads/2022/05/Maternal-Group-B-Streptococcus-in-Pregnancy-Screening-and-Management.pdf |
|||
|título=Maternal Group B Streptococcus (GBS) in Pregnancy: Screening and Management. July 2019.|fechaacceso=7 de noviembre de 2023|autor=Royal Australian and New Zealand College of Obstetricians and Gynaecologists. RANZCOG.|enlaceautor=|fecha=|sitioweb=|editorial=|idioma=Ingles.}}</ref> |
|||
== Infección por EGB en adultos == |
== Infección por EGB en adultos == |
||
El EGB es también capaz de causar infecciones graves en adultos, fundamentalmente en personas con condiciones predisponentes como obesidad, diabetes, [[cirrosis]], edad avanzada y cáncer.<ref name=Mandel /><ref name= "Peirotti 2002">{{Cita publicación|url = |título = Infecciones por estreptococos grupo B en adultos excluyendo infecciones genitales.|apellidos = Peirotti MG; Gonzalez SE; Littvik AM; Vacaflor L; Kassar MA; Moreno S; Bottiglieri MT.|nombre = |fecha = |publicación = Rev Argent Microbiol; 2002; 34: 226-229. EN ESPAÑOL|fechaacceso = |doi = |pmid =12600008}}</ref><ref name= " Farley 2001">{{Cita publicación|url = http://cid.oxfordjournals.org/content/33/4/556.full.pdf|título = Group B Streptococcal Disease in Nonpregnant Adults.|apellidos = Farley MM.|nombre = |fecha = |publicación = Clinical Infectious Diseases. 2001; 33: 556-561.|fechaacceso = |doi = |pmid = |idioma = INGLES}}</ref><ref name =" Edwards Baker 2005" >{{Cita publicación|url = http://cid.oxfordjournals.org/content/41/6/839.full.pdf|título = Group B streptococcal infections in elderly adults.|apellidos = Edwards MS,. Baker CJ. .|nombre = |fecha = |publicación = Clin Infect Dis. 2005; 41: 839-847.|fechaacceso = |doi = |pmid = |idioma = Ingles.}}</ref><ref name = "Skoff 2009">{{Cita publicación|url = http://cid.oxfordjournals.org/content/49/1/85.full.pdf|título = Increasing Burden of Invasive Group B Streptococcal Disease in Nonpregnant Adults, 1990-2007.|apellidos = Skoff TH, Farley MM, Petit S, Craig AS, Schaffner W, Gershman K, Harrison LH, Lynfield R, Mohle-Boetani J, Zansky S, Albanese BA, Stefonek K, Zell ER, Jackson D, Thompson T, Schrag SJ.|nombre = |fecha = |publicación = Clin Infect Dis. 2009; 49: 85-92.|fechaacceso = |doi = 10.1086/599369|pmid = |idioma = Inglés}}</ref><ref name=" Edwards Rench 2016">{{Cita publicación|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5088039/|título=Immune Response to Invasive Group B Streptococcus Disease in Adults|apellidos=Edwards MS, Rench MA, Rinaudo CD, Fabbrini M, Tuscano G, Buffi G, Bartolini E, Bonacci S, Baker CJ, Margarit I.|nombre=|fecha=2016|publicación=Emerg Infect Dis.|volumen=22|número=11|páginas=1877-1883|fechaacceso= |
El EGB es también capaz de causar infecciones graves en adultos, fundamentalmente en personas con condiciones predisponentes como obesidad, diabetes, [[cirrosis]], edad avanzada y cáncer.<ref name=Mandel /><ref name= "Peirotti 2002">{{Cita publicación|url = |título = Infecciones por estreptococos grupo B en adultos excluyendo infecciones genitales.|apellidos = Peirotti MG; Gonzalez SE; Littvik AM; Vacaflor L; Kassar MA; Moreno S; Bottiglieri MT.|nombre = |fecha = |publicación = Rev Argent Microbiol; 2002; 34: 226-229. EN ESPAÑOL|fechaacceso = |doi = |pmid =12600008}}</ref><ref name= " Farley 2001">{{Cita publicación|url = http://cid.oxfordjournals.org/content/33/4/556.full.pdf|título = Group B Streptococcal Disease in Nonpregnant Adults.|apellidos = Farley MM.|nombre = |fecha = |publicación = Clinical Infectious Diseases. 2001; 33: 556-561.|fechaacceso = |doi = |pmid = |idioma = INGLES}}</ref><ref name =" Edwards Baker 2005" >{{Cita publicación|url = http://cid.oxfordjournals.org/content/41/6/839.full.pdf|título = Group B streptococcal infections in elderly adults.|apellidos = Edwards MS,. Baker CJ. .|nombre = |fecha = |publicación = Clin Infect Dis. 2005; 41: 839-847.|fechaacceso = |doi = |pmid = |idioma = Ingles.}}</ref><ref name = "Skoff 2009">{{Cita publicación|url = http://cid.oxfordjournals.org/content/49/1/85.full.pdf|título = Increasing Burden of Invasive Group B Streptococcal Disease in Nonpregnant Adults, 1990-2007.|apellidos = Skoff TH, Farley MM, Petit S, Craig AS, Schaffner W, Gershman K, Harrison LH, Lynfield R, Mohle-Boetani J, Zansky S, Albanese BA, Stefonek K, Zell ER, Jackson D, Thompson T, Schrag SJ.|nombre = |fecha = |publicación = Clin Infect Dis. 2009; 49: 85-92.|fechaacceso = |doi = 10.1086/599369|pmid = |idioma = Inglés}}</ref><ref name=" Edwards Rench 2016">{{Cita publicación|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5088039/pdf/16-0914.pdf|título=Immune Response to Invasive Group B Streptococcus Disease in Adults|apellidos=Edwards MS, Rench MA, Rinaudo CD, Fabbrini M, Tuscano G, Buffi G, Bartolini E, Bonacci S, Baker CJ, Margarit I.|nombre=|fecha=2016|publicación=Emerg Infect Dis.|volumen=22|número=11|páginas=1877-1883|fechaacceso=7 de noviembre de 2023|doi=10.3201/eid2211.160914|pmid=}}</ref><ref name= " Raabe Shane 2019" >{{Cita publicación|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6432937/pdf/nihms-998887.pdf|título=Group B Streptococcus (Streptococcus agalactiae).|apellidos=Raabe VN, Shane AL.|nombre=|fecha=2019|publicación=Microbiol Spectr. 2019;7(2).|fechaacceso=7 de noviembre de 2023|doi=10.1128/microbiolspec.GPP3-0007-2018|pmid=}}</ref> |
||
Las infecciones por EGB en el adulto incluyen<ref name=Mandel /> infección urinaria, infección de tejidos blandos ([[Celulitis (inflamación)|celulitis]]), bacteremia, osteomielits y endocarditis. |
|||
| ⚫ | <ref name = "Ribas 2009" >{{Cita publicación|url=|título=Endocarditis tricuspídea por Streptococcus agalactiae. Descripción de un caso y revisión de la literatura.|apellidos=Ribas N , Arribas C, Murillas J.|nombre=|fecha=|publicación=Enf Infecc Microbiol Clin 2009; 27:191-194.|fechaacceso=21febrero 2021 |doi=10.1016/j.eimc.2008.04.007|pmid=}}</ref> |
||
| ⚫ | |||
Estas infecciones pueden ser muy graves y la mortalidad es más alta en adultos que en RN. La infección por EGB en adultos se estima responsable del 90% de las muertes causadas cada año por EGB en USA.<ref name="Edwards Rench 2016" /> |
Estas infecciones pueden ser muy graves y la mortalidad es más alta en adultos que en RN. La infección por EGB en adultos se estima responsable del 90% de las muertes causadas cada año por EGB en USA.<ref name="Edwards Rench 2016" /> |
||
EGB también es causante frecuente de infección de la herida tras el parto por cesárea.<ref name="Collin-Shetty 2019">{{cita publicación|apellidos1=Collin SM, Shetty N, Guy R, Nyaga VN, Bull A, Richards MJ, van der Kooi TII, Koek MBG, De Almeida M, Roberts SA, Lamagni T.|título=Group B Streptococcus in surgical site and non-invasive bacterial infections worldwide: A systematic review and meta-analysis|publicación=Int J Infect Dis.|fecha=2019|volumen=83|página=116-129|doi=10.1016/j.ijid.2019.04.017|url=https://www.ijidonline.com/action/showPdf?pii=S1201-9712%2819%2930187-0|fechaacceso=7 de noviembre de 2023}}</ref> |
|||
En general la penicilina es el antibiótico de elección para el tratamiento.<ref name="Raabe Shane 2019" /> Eritromicina y Clindamicina no deben usarse en pacientes alérgicos a penicilina sin efectuar pruebas de sensibilidad para comprobar que la cepa de EGB causante no presenta resistencia a estos antibióticos. La gentamicina asociada a penicilina (para conseguir sinergia, [[Efecto sinérgico|efecto]] sinérgico) puede usarse en el tratamiento de infecciones graves. |
En general la penicilina es el antibiótico de elección para el tratamiento.<ref name="Raabe Shane 2019" /> Eritromicina y Clindamicina no deben usarse en pacientes alérgicos a penicilina sin efectuar pruebas de sensibilidad para comprobar que la cepa de EGB causante no presenta resistencia a estos antibióticos. La gentamicina asociada a penicilina (para conseguir sinergia, [[Efecto sinérgico|efecto]] sinérgico) puede usarse en el tratamiento de infecciones graves. |
||
La frecuencia de infección por EGB en adultos parece estar incrementandose en los últimos años y su alta morbilidad y mortalidad hacen aún más necesario el desarrollo de una vacuna para prevenir estas infecciones.<ref name="Graux 2020">{{cita publicación|apellidos1=Graux E, Hites M, Martiny D, Maillar E, Delforge M, Melin P, Dauby N|título=Invasive group B Streptococcus among non-pregnant adults in Brussels-Capital Region, 2005–2019|publicación=Eur J Clin Microbiol Infect Dis|fecha=2020|páginas=Sep 17;1-9|doi=10.1007/s10096-020-04041-0|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7498195/pdf/10096_2020_Article_4041.pdf|fechaacceso=17 de febrero de 2021}}</ref><ref name="Colin 2020">{{cita publicación|apellidos1=Collin SM, Shetty N, Lamagni T| |
La frecuencia de infección por EGB en adultos parece estar incrementandose en los últimos años y su alta morbilidad y mortalidad hacen aún más necesario el desarrollo de una vacuna para prevenir estas infecciones.<ref name="Graux 2020">{{cita publicación|apellidos1=Graux E, Hites M, Martiny D, Maillar E, Delforge M, Melin P, Dauby N|título=Invasive group B Streptococcus among non-pregnant adults in Brussels-Capital Region, 2005–2019|publicación=Eur J Clin Microbiol Infect Dis|fecha=2020|páginas=Sep 17;1-9|doi=10.1007/s10096-020-04041-0|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7498195/pdf/10096_2020_Article_4041.pdf|fechaacceso=17 de febrero de 2021}}</ref> |
||
<ref name="Colin 2020">{{cita publicación|apellidos1=Collin SM, Shetty N, Lamagni T|publicación= |
|||
Emerging Infectious Diseases |
|||
|título=Invasive Group B Streptococcus Infections in Adults, England, 2015-2016.|fecha=2020|volumen=26|páginas=1174-1181|doi=10.3201/eid2606.191141|url= |
|||
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7258460/pdf/19-1141.pdf |
|||
|fechaacceso=7 de noviembre de 2023}}</ref> |
|||
== Vacunas frente al EGB == |
== Vacunas frente al EGB == |
||
Aunque la difusión del uso de la PAI ha disminuido de manera muy notable la frecuencia de la infección neonatal precoz por EGB este enfoque no es efectivo para reducir la infección neonatal de comienzo tardío y la infección en adultos.<ref>{{Cita publicación|url=|título=La infección neonatal tardía por Streptococcus agalactiae en el área de Barcelona (1996-2010).|apellidos=Juncosa-Morros T, Guardià-Llobet C, Bosch-Mestres J, Dopico-Ponte E, Sanfeliu-Sala I, Sierra-Soler M, Sánchez-Reus F, Giménez-Pérez M, Lite-Lite J, Andreu-Domingo A.|nombre=|fecha=|publicación=Enferm Infecc Microbiol Clin. 2014; 32:574-378. EN ESPAÑOL|fechaacceso=|doi=10.1016/j.eimc.2013.09.012|pmid=}}</ref><ref name=" Jordan Farley 2008">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/?term=Jordan+HT%2C+Farley+MM%2C+Craig+A%2C+Mohle-Boetani+J|título = Revisiting the need for vaccine prevention of late-onset neonatal group B streptococcal disease: a multistate, population-based analysis.|apellidos = Jordan HT, Farley MM, Craig A, Mohle-Boetani J, Harrison LH, Petit S, Lynfield R, Thomas A, Zansky S, Gershman K, Albanese BA, Schaffner W, Schrag SJ; Active Bacterial Core Surveillance (ABCs)/Emerging Infections Program Network, CDC .|nombre = |fecha = |publicación = Pediatr Infect Dis J. 2008; 27: 1057-1064.|fechaacceso = |doi = 10.1097/INF.0b013e318180b3b9|pmid = |idioma = Ingles.}}</ref> Sin embargo con una vacuna efectiva podrían controlarse las infecciones precoces y tardías en RN, bebes y adultos |
Aunque la difusión del uso de la PAI ha disminuido de manera muy notable la frecuencia de la infección neonatal precoz por EGB este enfoque no es efectivo para reducir la infección neonatal de comienzo tardío y la infección en adultos.<ref>{{Cita publicación|url=|título=La infección neonatal tardía por Streptococcus agalactiae en el área de Barcelona (1996-2010).|apellidos=Juncosa-Morros T, Guardià-Llobet C, Bosch-Mestres J, Dopico-Ponte E, Sanfeliu-Sala I, Sierra-Soler M, Sánchez-Reus F, Giménez-Pérez M, Lite-Lite J, Andreu-Domingo A.|nombre=|fecha=|publicación=Enferm Infecc Microbiol Clin. 2014; 32:574-378. EN ESPAÑOL|fechaacceso=|doi=10.1016/j.eimc.2013.09.012|pmid=}}</ref><ref name=" Jordan Farley 2008">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/?term=Jordan+HT%2C+Farley+MM%2C+Craig+A%2C+Mohle-Boetani+J|título = Revisiting the need for vaccine prevention of late-onset neonatal group B streptococcal disease: a multistate, population-based analysis.|apellidos = Jordan HT, Farley MM, Craig A, Mohle-Boetani J, Harrison LH, Petit S, Lynfield R, Thomas A, Zansky S, Gershman K, Albanese BA, Schaffner W, Schrag SJ; Active Bacterial Core Surveillance (ABCs)/Emerging Infections Program Network, CDC .|nombre = |fecha = |publicación = Pediatr Infect Dis J. 2008; 27: 1057-1064.|fechaacceso = |doi = 10.1097/INF.0b013e318180b3b9|pmid = |idioma = Ingles.}}</ref> Sin embargo con una vacuna efectiva podrían controlarse las infecciones precoces y tardías en RN, bebes y adultos. <ref name="Baker 2023">{{cita publicación|apellidos1=Baker CJ|título=Group B Streptococcal Vaccine — Sisyphus Reconciled|publicación=The New England Journal of Medicine|fecha=2023|volumen=389|páginas=275-277|doi=10.1056/NEJMe2306234|fechaacceso=9 de noviembre de 2023}}</ref> |
||
Ya en 1976 se demostró que la presencia de bajos niveles de anticuerpos frente al polisacárido de la cápsula de EGB en el suero de las madres se relacionaba con la susceptibilidad del RN a padecer una infección precoz o tardía por EGB.<ref name=":Baker,Kasper 1976" /> El polisacárido de la cápsula del EGB, que como se indicó, es un factor de virulencia importante, es un excelente candidato para el desarrollo de una vacuna efectiva. Pues los anticuerpos específicos transferidos de la madre al feto son capaces de proteger al RN de una infección por EGB.<ref name="Jordan Farley 2008" /> |
Ya en 1976 se demostró que la presencia de bajos niveles de anticuerpos frente al polisacárido de la cápsula de EGB en el suero de las madres se relacionaba con la susceptibilidad del RN a padecer una infección precoz o tardía por EGB.<ref name=":Baker,Kasper 1976" /> El polisacárido de la cápsula del EGB, que como se indicó, es un factor de virulencia importante, es un excelente candidato para el desarrollo de una vacuna efectiva. Pues los anticuerpos específicos transferidos de la madre al feto son capaces de proteger al RN de una infección por EGB.<ref name="Jordan Farley 2008" /> |
||
Actualmente en adición a las vacunas frente EGB basadas en el polisacárido capsular se están desarrollando vacunas basadas en proteínas de superficie. La ventaja de las vacunas basadas en proteínas es que pueden proteger de la infección por todos los serotipos de EGB en contraste con las vacunas de polisacéridos capsulares que solo protegen frente a los serotipos incluidos.<ref name="Carreras-Abad 2020">{{cita publicación|apellidos1=Carreras-Abad C, Ramkhelawon L, Heath PT, Le Doare K|título=A Vaccine Against Group B Streptococcus: Recent Advances.|publicación=Infect Drug Resist.|fecha=2020|volumen=29|páginas=1263-1272|doi=10.2147/IDR.S203454|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7196769/pdf/idr-13-1263.pdf|fechaacceso=18 de febrero de 2021}}</ref><ref name= "Song 2018" >{{Cita publicación|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6314413/|título=Progress toward a group B streptococcal vaccine.|apellidos=Song JY, Lim JH, Lim S, Yong Z, Seo HS.|nombre=|fecha=2018|publicación=Hum Vaccin Immunother. 2018;14:2669-2681.|fechaacceso= |
Actualmente en adición a las vacunas frente EGB basadas en el polisacárido capsular se están desarrollando vacunas basadas en proteínas de superficie. La ventaja de las vacunas basadas en proteínas es que pueden proteger de la infección por todos los serotipos de EGB en contraste con las vacunas de polisacéridos capsulares que solo protegen frente a los serotipos incluidos.<ref name="Carreras-Abad 2020">{{cita publicación|apellidos1=Carreras-Abad C, Ramkhelawon L, Heath PT, Le Doare K|título=A Vaccine Against Group B Streptococcus: Recent Advances.|publicación=Infect Drug Resist.|fecha=2020|volumen=29|páginas=1263-1272|doi=10.2147/IDR.S203454|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7196769/pdf/idr-13-1263.pdf|fechaacceso=18 de febrero de 2021}}</ref><ref name= "Song 2018" >{{Cita publicación|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6314413/|título=Progress toward a group B streptococcal vaccine.|apellidos=Song JY, Lim JH, Lim S, Yong Z, Seo HS. |url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6314413/pdf/khvi-14-11-1493326.pdf |nombre=|fecha=2018|publicación=Hum Vaccin Immunother. 2018;14:2669-2681.|fechaacceso=8 de noviembre de 2023|doi=10.1080/21645515.2018.1493326|pmid=}}</ref> |
||
La vacunación se considera hoy la solución ideal, pues sería capaz no solo de prevenir la infección neonatal precoz y tardía sino que también protegería a los adultos susceptibles. Sin embargo, aunque la investigación y ensayos clínicos sobre estas vacunas se están realizando,<ref name = "Puertas 2017" >{{Cita publicación|url=http://seq.es/wp-content/uploads/2017/10/puertas25sep2017.pdf|título=Streptococcus agalactiae: prevention and vaccine development.|apellidos=Puertas-Prieto A, Lara-Oya A, Liébana Martos C, Rodríguez-Granger J, Cobo F, Sampedro A, Padilla A, Gutiérrez-Fernández J, Manzanares-Galán S, Cueto-López M, Rosa-Fraile M, Navarro-Mari JM.|nombre=|fecha=|publicación=Rev Esp Quimioter.|volumen=30|número=5|páginas=312-318|fechaacceso=1 de noviembre de 2019|doi=|pmid=28945063|año=2017}}</ref><ref name = "Seale Baker 2019" >{{Cita publicación|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6677922/pdf/main.pdf|título=Vaccines for maternal immunization against Group B Streptococcus disease: WHO perspectives on case ascertainment and case definitions|apellidos=Seale AC, Baker CJ, Berkley JA, Madhi SA, Ordi J, Saha SK6, Schrag SJ, Sobanjo-Ter Meulen A, Vekemans J.|nombre=|fecha=2019|publicación=Vaccine. 2019 ;37:4877-4885.|fechaacceso=12 de noviembre de 2019|doi=10.1016/j.vaccine.2019.07.012|pmid=}}</ref> no existe aún una vacuna comercialmente disponible en 2020.<ref name="Davies 2019">{{Cita publicación|url=|título=Group B Streptococcus: Trials and Tribulations.|apellidos=Davies HG, Carreras-Abad C, Le Doare K, Heath PT.|nombre=|fecha=2019|publicación=Pediatr Infect Dis J. 2019 38(6S Suppl 1):S72-S76.|fechaacceso=|doi=10.1097/INF.0000000000002328|pmid=}}</ref>.Actualmente la autorización de estas vacunas es difícil por las dificultades de realizar ensayos clínicos adecuados dada la baja incidencia de |
La vacunación se considera hoy la solución ideal, pues sería capaz no solo de prevenir la infección neonatal precoz y tardía sino que también protegería a los adultos susceptibles. Sin embargo, aunque la investigación y ensayos clínicos sobre estas vacunas se están realizando,<ref name = "Puertas 2017" >{{Cita publicación|url=http://seq.es/wp-content/uploads/2017/10/puertas25sep2017.pdf|título=Streptococcus agalactiae: prevention and vaccine development.|apellidos=Puertas-Prieto A, Lara-Oya A, Liébana Martos C, Rodríguez-Granger J, Cobo F, Sampedro A, Padilla A, Gutiérrez-Fernández J, Manzanares-Galán S, Cueto-López M, Rosa-Fraile M, Navarro-Mari JM.|nombre=|fecha=|publicación=Rev Esp Quimioter.|volumen=30|número=5|páginas=312-318|fechaacceso=1 de noviembre de 2019|doi=|pmid=28945063|año=2017}}</ref><ref name = "Seale Baker 2019" >{{Cita publicación|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6677922/pdf/main.pdf|título=Vaccines for maternal immunization against Group B Streptococcus disease: WHO perspectives on case ascertainment and case definitions|apellidos=Seale AC, Baker CJ, Berkley JA, Madhi SA, Ordi J, Saha SK6, Schrag SJ, Sobanjo-Ter Meulen A, Vekemans J.|nombre=|fecha=2019|publicación=Vaccine. 2019 ;37:4877-4885.|fechaacceso=12 de noviembre de 2019|doi=10.1016/j.vaccine.2019.07.012|pmid=}}</ref> no existe aún una vacuna comercialmente disponible en 2020.<ref name="Davies 2019">{{Cita publicación|url=|título=Group B Streptococcus: Trials and Tribulations.|apellidos=Davies HG, Carreras-Abad C, Le Doare K, Heath PT.|nombre=|fecha=2019|publicación=Pediatr Infect Dis J. 2019 38(6S Suppl 1):S72-S76.|fechaacceso=|doi=10.1097/INF.0000000000002328|pmid=}}</ref>.Actualmente la autorización de estas vacunas es difícil por las dificultades de realizar ensayos clínicos adecuados dada la baja incidencia de infección neonatal por EGB.<ref name=":Rodriguez-Granger 2012" /><ref name="Davies 2019" /><ref name =" Edwards Gonik 2013">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pubmed/?term=Preventing+the+broad+spectrum+of+perinatal+morbidity+and+mortality+through+group+B+streptococcal+vaccination|título = Preventing the broad spectrum of perinatal morbidity and mortality through group B streptococcal vaccination.|apellidos = Edwards MS, Gonik B.|nombre = |fecha = |publicación = Vaccine 2013; 31S: D66-71.|fechaacceso = |doi = 10.1016/j.vaccine.2012.11.046|pmid = |idioma = Ingles.}}</ref> |
||
== Infección por EGB en animales == |
== Infección por EGB en animales == |
||
El EGB se ha encontrado en mamíferos como elefantes, camellos, perros, gatos, focas, delfines y en otros animales como cocodrilos.<ref name= "Delannoy 2013">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3585737/pdf/1471-2180-13-41.pdf|título = Human Streptococcus agalactiae strains in aquatic mammal and fish.|apellidos = Delannoy CMJ, Crumlish M, Fontaine MC, Pollock J, Foster G, Dagleish MP, Turnbull JF, Zadoks RN.|nombre = |fecha = |publicación = BMC Microbiology 2013; 13: 41.|fechaacceso = |doi = 10.1186/1471-2180-13-41|pmid = |idioma = Ingles.}}</ref> |
El EGB se ha encontrado en mamíferos como elefantes, camellos, perros, gatos, focas, delfines y en otros animales como cocodrilos.<ref name= "Delannoy 2013">{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3585737/pdf/1471-2180-13-41.pdf|título = Human Streptococcus agalactiae strains in aquatic mammal and fish.|apellidos = Delannoy CMJ, Crumlish M, Fontaine MC, Pollock J, Foster G, Dagleish MP, Turnbull JF, Zadoks RN.|nombre = |fecha = |publicación = BMC Microbiology 2013; 13: 41.|fechaacceso = |doi = 10.1186/1471-2180-13-41|pmid = |idioma = Ingles.}}</ref> |
||
=== Ganado vacuno === |
=== Ganado vacuno === |
||
En el ganado vacuno el EGB puede causar [[Mastitis (animales domésticos)|mastitis]] (infección de las ubres). La mastitis causada por EGB puede presentarse como una enfermedad febril aguda o como una infección crónica, provocando en ambos casos una disminución de la producción de leche (de ahí procede el nombre de agalactiae que significa sin leche). La mastitis provocada por EGB puede tener un importante efecto sobre la cantidad y calidad de la leche producida y está asociada con contajes elevados de células y bacterias en la leche.<ref name=:Keefe /><ref name=":Milk Quality" /><ref name= "Ruegg 2017">{{Cita publicación|url=https://www.journalofdairyscience.org/article/S0022-0302(17)31032-9/fulltext|título=A 100-Year Review: Mastitis detection, management, and prevention.|apellidos=Ruegg PL|nombre=|fecha=2017|publicación=J Dairy Sci. 2017;100:10381-10397.|fechaacceso=10 de noviembre de 2019|doi=10.3168/jds.2017-13023|pmid=}}</ref> |
En el ganado vacuno el EGB puede causar [[Mastitis (animales domésticos)|mastitis]] (infección de las ubres). La mastitis causada por EGB puede presentarse como una enfermedad febril aguda o como una infección crónica, provocando en ambos casos una disminución de la producción de leche (de ahí procede el nombre de agalactiae que significa sin leche). La mastitis provocada por EGB puede tener un importante efecto sobre la cantidad y calidad de la leche producida y está asociada con contajes elevados de células y bacterias en la leche.<ref name=:Keefe /><ref name=":Milk Quality" /><ref name= "Ruegg 2017">{{Cita publicación|url=https://www.journalofdairyscience.org/article/S0022-0302(17)31032-9/fulltext|título=A 100-Year Review: Mastitis detection, management, and prevention.|apellidos=Ruegg PL|nombre=|fecha=2017|publicación=J Dairy Sci. 2017;100:10381-10397.|fechaacceso=10 de noviembre de 2019|doi=10.3168/jds.2017-13023|pmid=}}</ref><ref name="Kabelitz 2021">{{cita publicación|apellidos1=Kabelitz T, Aubry E, van Vorst K, Amon T, Fulde M.|título=The Role of Streptococcus spp. in Bovine Mastitis.|publicación=Microorganisms|fecha=2021|volumen=9|páginas=1497|doi=10.3390/microorganisms9071497|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8305581/pdf/microorganisms-09-01497.pdf|fechaacceso=9 de noviembre de 2023}}</ref> |
||
| ⚫ | Los brotes de mastitis causadas por EGB en los rebaños son habituales y pueden tener un fuerte impacto en la producción industrial de leche. Por ello en muchos países se han desarrollado programas para reducir su impacto en el ganado vacuno.<ref>{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1576741/pdf/canvetj00092-0031.pdf|título = Streptococcus agalactiae mastitis: A review.|apellidos = Keefe, GP.|nombre = |fecha = |publicación = The Canadian veterinary journal 1997; 38: 429-37.|fechaacceso = |doi = |pmid = |idioma = Inglés}}</ref> |
||
| ⚫ | Los brotes de mastitis causadas por EGB en los rebaños son habituales y pueden tener un fuerte impacto en la producción industrial de leche. Por ello en muchos países se han desarrollado programas para reducir su impacto en el ganado vacuno.<ref>{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1576741/pdf/canvetj00092-0031.pdf|título = Streptococcus agalactiae mastitis: A review.|apellidos = Keefe, GP.|nombre = |fecha = |publicación = The Canadian veterinary journal 1997; 38: 429-37.|fechaacceso = |doi = |pmid = |idioma = Inglés}}</ref> |
||
=== Peces === |
=== Peces === |
||
Se han descrito infecciones por EGB en diversas especies de peces, tanto en estadio libre como en piscifactorías ([[piscicultura]]), causando septicemia y hemorragias internas y externas y dando lugar lugar a importantes perdidas económicas.<ref>{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2687030/pdf/08-0222_finalD.pdf|título = Human Streptococcus agalactiae isolate in Nile tilapia (Oreochromis niloticus).|apellidos = Evans JJ, Klesius PH, Pasnik DJ, Bohnsack JF.|nombre = |fecha = |publicación = Emerg Infect Dis. 2009; 15: 774-776.|fechaacceso = |doi = 10.3201/eid1505.080222|pmid = |idioma = Ingles.}}</ref><ref>{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3831827/pdf/1471-2164-14-775.pdf|título = Comparative genomics analysis of Streptococcus.|apellidos = Liu G, Zhang W, Lu C. .|nombre = |fecha = |publicación = BMC Genomics. 2013; 14: 775.|fechaacceso = |doi = |pmid = |idioma = Ingles.}}</ref> |
Se han descrito infecciones por EGB en diversas especies de peces, tanto en estadio libre como en piscifactorías ([[piscicultura]]), causando septicemia y hemorragias internas y externas y dando lugar lugar a importantes perdidas económicas.<ref>{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2687030/pdf/08-0222_finalD.pdf|título = Human Streptococcus agalactiae isolate in Nile tilapia (Oreochromis niloticus).|apellidos = Evans JJ, Klesius PH, Pasnik DJ, Bohnsack JF.|nombre = |fecha = |publicación = Emerg Infect Dis. 2009; 15: 774-776.|fechaacceso = |doi = 10.3201/eid1505.080222|pmid = |idioma = Ingles.}}</ref><ref>{{Cita publicación|url = http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3831827/pdf/1471-2164-14-775.pdf|título = Comparative genomics analysis of Streptococcus.|apellidos = Liu G, Zhang W, Lu C. .|nombre = |fecha = |publicación = BMC Genomics. 2013; 14: 775.|fechaacceso = |doi = |pmid = |idioma = Ingles.}}</ref> |
||
Asi mismo el consumo de peces infectados por EGB en piscifactorias ha causado brotes de infección humana por EGB. <ref name=FAO>{{cita web|apellidos1=Food and Agriculture Organization of the United Nations|título=RISK PROFILE Group B Streptococcus (GBS) Streptococcus agalactiae sequence type (ST) 283 in freshwater fish|url=https://www.fao.org/3/cb5067en/cb5067en.pdf|idioma=Ingles|fecha=2021|fechaacceso=9 de noviembre de 2023}}</ref> |
|||
| ⚫ | Para prevenir estas infecciones en peces causadas por EGB se está intentando el desarrollo de vacunas.<ref>{{Cita publicación|url = http://www.sciencedirect.com/science/article/pii/S1050464815300425|título = Development of live attenuated Streptococcus agalactiae vaccine for tilapia via continuous passage in vitro.|apellidos = Li LP, Wang R, Liang WW1, Huang T1, Huang Y2, Luo FG, Lei AY, Chen M, Gan X.|nombre = |fecha = |publicación = Fish Shellfish Immunol. 2015; 45: 955-963.|fechaacceso = |doi = 10.1016/j.fsi.2015.06.014|pmid = |idioma = Ingles.}}</ref><ref>{{Cita publicación|url=http://www.int-res.com/articles/dao_oa/d122p163.pdf|título=Development of Streptococcus agalactiae vaccines for tilapia.|apellidos=Liu G, Zhu J, Chen K, Gao T, Yao H, Liu Y, Zhang W, Lu C.|nombre=|fecha=|publicación=Dis Aquat Organ.|volumen=122|número=2|páginas=163-170.|fechaacceso=|idioma=Inglés|doi=10.3354/dao03084|pmid=|año=2016}}</ref> |
||
| ⚫ | Para prevenir estas infecciones en peces causadas por EGB se está intentando el desarrollo de vacunas.<ref>{{Cita publicación|url = http://www.sciencedirect.com/science/article/pii/S1050464815300425|título = Development of live attenuated Streptococcus agalactiae vaccine for tilapia via continuous passage in vitro.|apellidos = Li LP, Wang R, Liang WW1, Huang T1, Huang Y2, Luo FG, Lei AY, Chen M, Gan X.|nombre = |fecha = |publicación = Fish Shellfish Immunol. 2015; 45: 955-963.|fechaacceso = |doi = 10.1016/j.fsi.2015.06.014|pmid = |idioma = Ingles.}}</ref><ref>{{Cita publicación|url=http://www.int-res.com/articles/dao_oa/d122p163.pdf|título=Development of Streptococcus agalactiae vaccines for tilapia.|apellidos=Liu G, Zhu J, Chen K, Gao T, Yao H, Liu Y, Zhang W, Lu C.|nombre=|fecha=|publicación=Dis Aquat Organ.|volumen=122|número=2|páginas=163-170.|fechaacceso=|idioma=Inglés|doi=10.3354/dao03084|pmid=|año=2016}}</ref><ref name="Bashir 2023">{{cita publicación|apellidos1=Bashir S, Phuoc NN, Herath T, Basit A, Zadoks RN, Murdan S|título=An oral pH-responsive Streptococcus agalactiae vaccine formulation provides protective immunity to pathogen challenge in tilapia: A proof-of-concept study|publicación=PLoS ONE|fecha=2023|volumen=18|páginas=e0278277|url=https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0278277|fechaacceso=9 de noviembre de 2023}}</ref> |
||
== Enlaces externos == |
== Enlaces externos == |
||
http://www.groupbstrep.org/ USA |
|||
http://www.groupbstrepinternational.org/ |
http://www.groupbstrepinternational.org/ |
||
Revisión del 19:40 9 nov 2023
La infección por estreptococo del grupo B es la infección causada por la bacteria Streptococcus agalactiae (S. agalactiae), también conocida como Estreptococo Grupo B, EGB (Group B Streptococcus, en inglés, GBS). La infección causada por EGB puede dar lugar a una enfermedad grave e incluso mortal, especialmente en recién nacidos (RN), ancianos y personas con inmunidad disminuida. El EGB fue reconocido inicialmente como patógeno en el ganado bovino por Edmond Nocard (1850-1903, veterinario y microbiólogo francés) al final de la década de 1880, pero su importancia como patógeno humano no fue descubierta hasta 1938 cuando Fry[1] describió tres casos de Infección puerperal causados por EGB. Al principio de la década de 1960 el EGB fue también reconocido como una importante causa de infección grave en el recién RN.[2]
En general, EGB es una bacteria inofensiva que forma parte de la microbiota normal (flora normal) humana y que coloniza (se establece y multiplica en la piel o mucosas del huésped sin causar infección) el tracto gastrointestinal y el tracto genital de hasta un 30% de los adultos humanos sanos (portador asintomático).[3] [4][5][6][7]
EGB es también un patógeno veterinario que causa mastitis (inflamación de las ubres) en el ganado bovino, el nombre "agalactiae" significa sin leche.[8][9][10]
EGB es un coco (bacteria esférica) gram positivo con tendencia a formar cadenas (estreptococo). EGB es beta-hemolítico en agar sangre, catalasa negativo y aerobio facultativo.[11][12][13]

S. agalactiae es el nombre de la especie de los estreptococos pertenecientes al grupo B de la clasificación de Lancefield (sistema de Lancefield). EGB está rodeado por una cápsula compuesta de polisacáridos (exopolisacáridos) determinados por los productos de genes del operon cps[14] y según el polisacárido de su cápsula se clasifica en 10 serotipos (Ia, Ib, II-IX).[6][11][15]
Como otras bacterias patógenas EGB posee varios factores de virulencia,[16][17] de ellos los más importante parecen ser el polisacárido capsular (rico en ácido sialico) y la beta-hemolisina, que se comporta como una toxina productora de poros en las células eucariotas.[17][18][19]
Respecto a la hemolisina de EGB actualmente se considera que es idéntica al pigmento de EGB (granadaeno) o bien este constituye una parte de la molécula de hemolisina.[20][21][22][23]
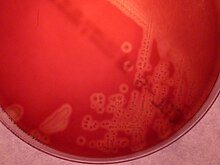
La cápsula de EGB es probablemente el factor de virulencia más importante pues le permite al EGB evitar la acción de los mecanismos de defensa del huésped interfiriendo con la capacidad de fagocitar y destruir la bacteria de los fagocitos humanos.[6][17][18]

Identificación del EGB en el laboratorio
Como se ha indicado, EGB es un coco gram positivo con tendencia a formar cadenas, beta hemolítico, catalasa negativo y aerobio facultativo. El EGB crece fácilmente en agar sangre como colonias rodeadas por un halo pequeño de β-hemólisis.
EL EGB se caracteriza por poseer en su pared celular el antígeno B de la clasificación de Rebeca Lancefield, que puede ser detectado directamente en la bacteria utilizando pruebas de aglutinación con látex, lo que permite identificarlo fácilmente. Hay que tener en cuenta que en la identificación de EGB por detección del antígeno B pueden darse reacciones falsamente positivas con algunos otros estreptocococos como S. pseudoporcinus and S.thalichoeri.[13][24][25]
EGB también puede ser identificado en el laboratorio usando el test de CAMP basado en la demostración en el EGB del factor CAMP, capaz de actuar conjuntamente con la beta-hemolisina de los estafilococos y producir una incremento de la hemólisis en hematíes bovinos o de cordero.[13][26]

EGB es capaz de hidrolizar el hipurato lo que también puede ser usado para su identificación en el laboratorio.[26][27]
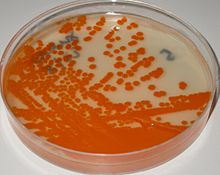
La forma más fácil de identificar el EGB es la producción de colonias rojas en Agar granada, pues las cepas hemolíticas de EGB producen un pigmento rojo específico del EGB, el granadaeno cuya observación permite su identificación inmediata.[24] [28]
El granadaeno es un polieno (sustancia orgánica que contiene una cadena de dobles enlaces alternando con enlaces simples), no isoprenoide (ornitin ramnododeacaeno).[29]
La identificación del EGB también puede llevarse a cabo usando otras técnicas como nucleic acid amplification techniques (NAATs) o MALDI-TOF (Matrix-Assisted Laser Desorption Ionization--Time of Flight Mass Spectrometry).[24][25][30][31]
Colonización e infección por EGB
Generalmente EGB es una bacteria que coloniza (formando parte de la microbiota normal) sin producir infección el tubo digestivo y el tracto genitourinario del hombre y la mujer. Diferentes estudios indican tasas de colonización por EGB entre el 4 y el 36%, pero la mayoría señalan más de un 20%.[32]
La colonización por EGB puede ser intermitente, transitoria o persistente. Estas variaciones pueden deberse a diferentes métodos de detección o a diferencias entre las poblaciones estudiadas.[33][34][35][36]
Aunque, como se ha indicado, el EGB coloniza sin producir infección hasta un 30% de adultos sanos incluyendo la mujer gestante,[6]
[33] esta bacteria, en general inofensiva, puede en algunas circunstancias causar infecciones muy graves tanto en el recién nacido como en adultos.[5] [37]
EGB y embarazo
Aunque la colonización por EGB no causa síntomas en la embarazada en ocasiones puede dar lugar a infecciones muy graves de la madre y del feto durante el embarazo y en el RN. En la madre el EGB puede causar corioamnionitis (infección de las membranas amnióticas), infecciones después del parto y ha sido relacionada con muerte fetal y parto prematuro.[38]
Si durante el embarazo se detecta la presencia de EGB en la orina en cualquier cantidad (menor de 100.000 colonias/ml) esta embarazada debe considerarse portadora de EGB y aplicarse PAI (profilaxis antibiótica intraparto) no siendo necesario tratamiento antibiótico. Sin embargo la bacteriuria por EGB durante el embarazo debe tratarse si causa síntomas o se detectan más de 100.000 colonias de EGB por ml de orina, pero aunque esta bacteriuria sea tratada debe aplicarse PAI.[37] La infección urinaria (ITU) por EGB durante el embarazo (por EGB u otra bacteria) puede desencadenar un parto prematuro.[6][39]
Infección en el recién nacido
El RN adquiere (se coloniza) EGB a su paso por el canal del parto de una madre colonizada, pudiendo a veces adquirir el EGB intraútero tras la rotura de membranas o, más raramente por vía ascendente, aun antes de la rotura de membranas. Aproximadamente el EGB es adquirido por un 50% de los RN de madres portadoras de EGB y en ausencia de medidas de protección (profilaxis antibiótica intraparto) 1-2% de estos recién nacidos se infectaran por EGB y desarrollarán una sepsis neonatal precoz.[36][37]
La colonización de la madre con EGB durante el parto es el principal factor de riesgo para el desarrollo de la infección precoz por EGB. La infección precoz es adquirida por el RN por transmisión vertical en el útero, aun con membranas intactas por exposición del feto al EGB que coloniza la vagina (a causa de una infección ascendente). Después de la rotura de membranas el feto puede infectarse en el útero o a su paso por la vagina. Sin embargo los RN que adquieren el EGB durante el parto (a su paso por la vagina) normalmente solo quedan colonizados y no desarrollan infección.[40][41]
En los países desarrollados el EGB (en ausencia de medidas de prevención) es la principal bacteria causante de infecciones en el RN, tales como septicemia, neumonía y meningitis que pueden provocar la muerte o dejar secuelas permanentes.[6][42]
El EGB en el RN y en el bebé causa dos tipos de infección: --Infección neonatal precoz (en inglés early-onset disease). --Infección neonatal tardía (en inglés late onset disease).
La infección neonatal precoz se manifiesta en la primera semana de vida, aunque la mayoría de los casos aparecen en las primeras 12-24 horas de vida. La infección neonatal tardía comienza entre los 7 y 90 días después del parto.[6][35][37][39]
Las manifestaciones clínicas más frecuentes de la infección precoz son septicemia (bacteremia) sin un foco definido de infección, neumonía y menos frecuentemente meningitis. Bacteremia sin foco ocurre en 80-85% de los casos, neumonía en un 10-15% y meningitis en un 5% a 10%. Los síntomas iniciales son alteraciones respiratorias en más del 80% de casos. Los RN con meningitis inician la enfermedad de manera análoga a los que no tienen meningitis, por ello un examen del líquido cefalorraquídeo (punción lumbar) es frecuentemente necesario para descartar meningitis.[6][43][44]
En el pasado, la incidencia de la infección precoz por EGB oscilaba entre 0.7 y 3.7 por mil RN vivos en US A[6] y desde el 0.2 al 3.25 por mil en Europa.[34]
El uso general de la profilaxis antibiótica intraparto (PAI) ha resultado en un descenso en la incidencia de la infección neonatal precoz por EGB en USA de mas del 85%, desde un 1.8 por mil recién nacidos vivos en los años 90 hasta un 0,23 por mil en 2015. [37][45]
Con una estimación global de 0.49/1000 RN vivos pero con importantes diferencias entre países desarrollados y países en vía de desarrollo. [46]
Aunque la colonización maternal por EGB es el factor clave para que el RN desarrolle una infección por EGB otros factores también aumentan el riesgo.[6][35][37]
-Comienzo del parto antes de las 37 semanas de gestación.
-Rotura prolongada de membranas antes del parto (más de 18 horas).
-Fiebre durante el parto (más de 38 °C).
-Infección urinaria (bacteriuria) por EGB durante el embarazo.
-Infección amniótica (corioamnionitis).
-Baja edad de la madre.
Sin embargo la mayoría de los RN que desarrollan infección nacen de madres que están colonizadas por EGB sin que este presente ninguno de los factores de riesgo indicados.[35]
Una alta colonización de la madre con EGB está asociada con mayor riesgo para el RN de desarrollar infección. La presencia de EGB en la orina de una embarazada en cualquier momento de la gestación se considera indicativa de una alta colonización de la madre.[37]
Los RN de madres en que está presente algún factor de riesgo pero que no están colonizadas tienen un riesgo mucho más bajo de desarrollar infección comparados con aquellos RN de madres que están colonizadas aunque no presenten ningún factor de riesgo.[41]
La presencia en la madre de bajos niveles de anticuerpos frente a los polisacáridos de la cápsula de EGB es también un importante factor para el desarrollo de la infección en el RN.[47][48] Debido a esto, la existencia de un hermano anterior que haya sufrido infección por EGB es un importante factor de riesgo para que los siguientes hermanos desarrollen la infección, pues indica la presencia de bajos niveles de anticuerpos protectores en la madre.[35][37][46]
En general la mortalidad por infección por EGB ha descendido desde un 50% en los años 1970 hasta el 10% actualmente. Esta disminución se ha debido a los progresos en el manejo y tratamiento de estos RN. La mortalidad es más alta entre los RN prematuros. La mortalidad causada por infección precoz por EGB fundamentalmente ocurre en recién nacidos prematuros. Actualmente en US se estima un 2.1% de mortalidad entre recién nacidos a término y un 19.2 en recién nacidos prematuros.[6][35][39][49]
La infección tardía por EGB afecta a bebés entre los 7 días y los tres meses después del nacimiento y presenta mortalidad más baja (1-6%) que la infección precoz. La presentación clínica de la infección tardía es bacteremia sin un foco definido (65%), meningitis (25%), celulitis, osteoartritis y neumonía.[50]
Para el desarrollo de la infección tardía la prematuridad es el principal factor de riesgo. De tal manera que cada semana que se adelanta el parto multiplica el riesgo de desarrollo de infección tardía en un factor de 1.34.[51] La infección tardía por EGB (comienzo entre 7 y 90 días después del nacimiento) no es adquirida por el RN o bebé durante o antes del nacimiento, sino que es adquirida a partir de la madre por la leche materna o a partir de fuentes de EGB ambientales o de otras personas. La infección tardía no suele presentar signos específicos y el diagnóstico debe realizarse mediante hemocultivo en los RN que presentan fiebre. Defectos en la audición y retraso mental pueden ser consecuencias futuras de la meningitis causada por EGB.[6][42] En contra del descenso de la incidencia de la infección precoz la incidencia de la infección neonatal tardía no ha variado en USA desde 2006 a 2015 (0.31 por mill RN vivos).[45]
Prevención de la infección neonatal por EGB. Profilaxis antibiótica intraparto (PAI)
Actualmente el único procedimiento eficaz para prevenir la infección precoz por EGB es administrar a la madre profilaxis antibiótica durante el parto (PAI) por vía intravenosa.[35][36][37] Es decir administrar antibióticos a la madre durante el parto. Se ha comprobado que la administración intravenosa (IV) de penicilina G o ampicilina a la madre colonizada por EGB al comienzo del parte, continuando su administración cada cuatro horas hasta la finalización del parto es una medida muy efectiva para prevenir la transmisión vertical de EGB de la madre al RN, previniendo el desarrollo de la infección neonatal precoz. Penicilina G, 5 millones de unidades IV como dosis inicial y posteriormente 2-3 millones de unidades cada 4 horas hasta el final del parto o ampicilina, 2 g IV como dosis inicial y luego 1 g IV cada 4 horas hasta el final del parto.[6][35][37]
La administración de antibióticos por vía oral o por inyección intramuscular a la embarazada no es en general efectiva para prevenir la infección neonatal por EGB.[37]
Se ha indicado que en mujeres alérgicas a penicilina pero sin historia de anafilaxia, (angioedema, síndrome de dificultad respiratoria aguda, Distres Respiratorio Agudo) o de urticaria después de la administración de una penicilina o una cefalosporina (bajo riesgo de anafilaxia) puede usarse cefazolina como antibiótico para la PAI (dosis inicial de 2 g IV seguidos de 1 g IV cada 8 horas hasta el final del parto) en vez de penicilina o ampicilina.[35][37] Clindamicina (900 mg IV cada 8 horas hasta el final del parto) o vancomicina (20 mg/Kg IV cada 8 horas, con una máxima dosis unitaria de 2g) pueden emplearse en mujeres alérgicas a penicilina.[37] En caso de que la cepa de EGB que coloniza a la madre sea resistente a clindamicina debe usarse vancomicina a la dosificación indicada.[37] La eritromicina no se recomienda actualmente para la PAI en ninguna circunstancia.[35][37] La realización de pruebas de sensibilidad antibiótica (antibiograma) es fundamental para decidir el antibiótico a usar en aquellas madres alérgicas a la penicilina, porque la resistencia a clindamicina ha aumentado de manera importante en las cepas de EGB.[52][53]
La utilización de una correcta técnica en la realización del antibiograma es muy importante (incluyendo pruebas de resistencia inducible a clindamicina), dado que la resistencia a clindamicina puede no ser detectada por algunas técnicas de laboratorio.[25][35][36][37]
En mujeres con riesgo de alergia a penicilina, en la petición al laboratorio para investigar el estado de portadora de EGB este hecho (posibilidad de alergia) debe consignarse en la petición al laboratorio para que se realicen pruebas sensibilidad a clindamicina.
Existen datos que indican que la PAI efectuada con un antibiótico adecuado, comenzando al menos dos horas antes del parto (en vez del tiempo adecuado que es comenzar al menos 4 horas antes) es también capaz de reducir el riesgo de infección en el RN, aunque no es tan eficaz como la PAI correctamente administrada.[54][55][56]
Se ha indicado que en los casos en que la cantidad de antibiótico administrado en la PAI es insuficiente, puede administrarse al RN inmediatamente tras el nacimiento una dosis de un antibiótico efectivo frente al EGB. De todas las formas la evidencia sobre la eficacia de esta práctica no es completa.[35][36][57][58][59]
La alergia verdadera a penicilina es rara, con una frecuencia estimada de anafilaxia de 1 a 5 casos por 10,000 casos de tratamiento.[60]
La administración de penicilina a una mujer sin una historia previa de alergia conlleva un riesgo de anafilaxia de 4/10,000 a 4/100,000. Anafilaxia asociada con la administración de PAI puede ocurrir, pero los riesgos son mucho menores que los beneficios de prevenir la infección neonatal por EGB.[35] La supuesta alergia a penicilina en las embarazadas se asocia con un mayor utilización de otros antibióticos (clindamicina y vancomicina) por ello se recomienda que en estas mujeres se realicen pruebas de laboratorio para detectar si existe una verdadera alergia a penicilina.[37][61]
La utilización de la PAI ha sido asociada con la emergencia de bacterias resistentes a los antibióticos utilizados y con un incremento de infecciones neonatales causadas por otras bacterias, fundamentalmente bacilos Gram negativos como Escherichia coli. Sin embargo la mayoría de estudios no encuentran relación entre las infecciones neonatales causadas por otros microorganismos y el uso generalizado de la PAI.[35][62][63][64]
Otras estrategias para prevenir la infección neonatal precoz por EGB han sido estudiadas. Entre ellas la utilización de lavados vaginales intraparto con clorhexidina, sin embargo no hay evidencia de su utilidad real.[35][37][65][66]
Parto en casa y parto en el agua
El dar a luz en el propio domicilio (parto en casa) es actualmente popular en el Reino Unido[67] y en otros países. Las recomendaciones para prevenir la infección por EGB son las mismas que en el hospital. Hay que tener en cuenta que aproximadamente un 25 % de las embarazadas son portadoras de EGB y puede ser difícil seguir en el propio domicilio las indicaciones correctas de la PAI y manejar adecuadamente un posible caso de alergia a los antibióticos.[67]
Respecto al parto en el agua[68][69] las recomendaciones para prevenir la infección por EGB son las mismas que para el parto tradicional.[37][67]
Identificación de las madres candidatas a recibir profilaxis antibiótica intraparto
Existen dos procedimientos para seleccionar las madres candidatas a recibir PAI:[70]
1.. Selección basada en el criterio de colonización maternal por EGB anteparto (cribado prenatal)(pesquisa prenatal)(screening).
2.. Selección basada en la existencia de factores de riesgo en la madre (prematuridad, rotura prolongada de membranas, fiebre intraparto).
La selección basada en el cribado prenatal identifica a las candidatas a recibir PAI usando cultivos vaginales y rectales entre las semanas 35 y 37 (actualmente se recomienda entre las semanas 36-37[37]) de gestación y PAI es administrada a todas las madres colonizadas por EGB.
Actualmente, considerando que la "validez" del cultivo vagino-rectal para detectar EGB es de solo 5 semanas[71][72] las nuevas recomendaciones de la ACOG recomiendan efectuar la detección de EGB en la embarazada desde el principio de la semana 36 de gestación hasta el final de la semana 37.Esta recomendación tiene por objeto hacer válida la detección de EGB hasta cubrir los partos en la semana 41.[37]
La estrategia basada en factores de riesgo identifica a las madres candidatas a recibir PAI por la presencia de alguno de los factores de riesgo que incrementan la probabilidad de que el RN desarrolle infección neonatal por EGB, sin considerar si la madre es o no es portadora de EGB.[6][35][36][73]
La administración de PAI se recomienda también cuando se seleccionan las candidatas usando el cribado prenatal si en el momento del parto no se conoce si la madre es o no es portadora de EGB y está presente algún factor de riesgo, en mujeres que han tenido infección urinaria por EGB o presencia de EGB en un urocultivo durante el embarazo y en mujeres con un hijo anterior que ha tenido una infección neonatal por EGB.[35][36][37]
La estrategia basada en factores de riesgo es en general menos eficaz que la estrategia basada en la detección de portadoras, porque en la mayoría de los casos la infección neonatal aparece en RN cuyas madres no presentaban ningún factor de riesgo.[35][74]
La aplicación de PAI no se recomienda en aquellas mujeres (sean o no portadoras de EGB) en que se realiza una cesárea programada si el trabajo del parto no se ha iniciado aún y las membranas amnióticas están intactas, pues el RN no estará colonizado.[35][36][37][41][75][76]
La estrategia de cribado universal se recomienda en la mayoría de países desarrollados, e.g. Estados Unidos, Francia, España, Bélgica, Canadá y Australia. Los datos publicados de incidencia de infección precoz por EGB muestran un marcado descenso de su frecuencia después de la introducción de la PAI y la estrategia de selección basada en el cribado universal.[34][45][74][77][78]
La estrategia de selección basada en factores de riesgo se recomienda entre otros países en el Reino Unido, Holanda, Nueva Zelanda y Argentina.[34] Aunque en Argentina la ley 26.369 (6 de mayo de 2008) de Salud Pública, incorpora con carácter obligatorio el control y prevención de la infección neonatal por EGB y la realización del examen de detección del EGB en todas las embarazadas con edad gestacional entre las semanas 35 y 37, presenten o no condiciones de riesgo.[79]
En otros países como Chile, aunque no existen recomendaciones oficiales, las sociedades científicas recomiendan adoptar el enfoque de detección de las madres portadoras de EGB estableciendo la pesquisa universal.[80]
En el Reino Unido el Royal College of Obstetricians and Gynaecologists (RCOG) no recomienda actualmente (2021) el cribado de las embarazadas para detectar el estado de portadoras de EGB, en lugar de ello recomienda tratar a las embarazadas según los factores de riesgo en el momento del parto.[81] Sin embargo estas recomendaciones (guideline) si recomiendan ofrecer profilaxis antibiótica intraparto si se conoce que la embarazada es portadora de EGB.[81]

Cribado (pesquisa) para detectar la colonización por EGB durante el embarazo
Aproximadamente 10%-30% de mujeres están colonizadas por EGB durante el embarazo en la vagina y/o ano y recto. Sin embargo esta colonización puede ser temporal, intermitente o continua.[35][37]
Dado que la colonización por EGB puede cambiar durante el curso del embarazo, únicamente los cultivos efectuados en las últimas cinco semanas de embarazo son capaces de predecir con seguridad el estado de portadora en el momento del parto. Por otro lado, si el cultivo es realizado con una antelación de más de cinco semanas no es capaz de predecir con seguridad el estado de portadora de EGB en el momento del parto. Y por ello los cultivos para detectar si una madre será o no portadora de EGB en el momento del parto han de efectuarse en las semanas 35-37 de embarazo.[35][82] Aunque las últimas recomendaciones de la ACOG recomiendan efectuar el cultivo para detección de EGB entre las semanas 36 y 37.[37]
Las muestras clínicas recomendadas para el cultivo de EGB son escobillones tomados del tercio externo de la vagina (sin utilizar espéculo) y de la zona anorectal introduciendo el escobillón en el esfínter externo del ano. Para la toma de muestras puede usarse un único escobillón tomando primero la muestra vaginal y después la rectal.[35][37][83] Para la toma de muestras es preferible el uso de "floked" escobillones que permiten una mejor liberación de la muestra al medio de cultivo.[25]
Las muestras tomadas del cuello uterino, del periné o de la zona perianal no son adecuadas.[35][36][37] Las muestras pueden ser tomadas por profesionales de la salud o por la misma embarazada tras adecuada información.[35][36][84][85][86][87]
La toma del exudado vagino-rectal se realizará antes de cualquier manipulación vaginal, sin haber usado productos de higiene íntima femenina y sin tratamiento antibacteriano.[36][88]

las muestras deben ser colocadas en un medio de transporte adecuado y si es posible deben conservase refrigeradas hasta su envío al laboratorio al que deben enviarse lo antes posible (en menos de 24 horas).[25][35][36] En un medio de transporte adecuados el EGB continua viable por varios días a temperatura ambiente. Sin embargo la recuperación del EG disminuye con el tiempo de conservación de la muestra lo que puede dar lugar a resultados falsamente negativos.[35][36][89]
Métodos de cultivo para detectar colonización por EGB en la embarazada
Las muestras (escobillones vaginales, rectales o vagino-rectales) deben ser inoculadas en un caldo de cultivo de enriquecimiento selectivo para EGB (caldo Todd Hewitt con antibióticos). Esto se efectúa para favorecer el desarrollo del EGB, impidiendo al mismo tiempo el crecimiento otras bacterias presentes en la muestra y que pueden interferir con la detección del EGB. Después de la incubación del caldo de enriquecimiento (18-24h, 35-37 °C) este es subcultivado a placas de agar sangre y las colonias con aspecto de EGB son identificadas con el test CAMP, usando una técnica de aglutinación con látex o MALDI-TOF.[25][35][36][90]
Después de la incubación el caldo de enriquecimiento puede ser subcultivado a una placa de agar granada donde el EGB crece como colonias rojo naranjas 100% específicas de EGB[24][28][35][36][91][92][93][94] o una placa de medio cromogénico donde EGB crece como colonias coloreadas con diferentes aspectos dependiendo del medio utilizado.[24][25][35][93][94] Si para la detección de EGB se utilizan medios de cultivo cromogénicos debe confirmarse que las colonias sospechosas (con aspecto de EGB) son realmente EGB utilizando un procedimiento adecuado de confirmación e.g. aglutinación con látex o el test CAMP.[24][25]
Es también posible inocular directamente los escobillones con la muestras vaginales, rectales o vagino-rectales en una placa de un medio de cultivo adecuado para EGB (agar sangre, medio granada o medio cromogénico), Sin embargo este método (omitiendo la etapa de enriquecimiento selectivo) puede dar lugar a algún resultado falsamente negativo y se aconseja usar este método (sin caldo de enriquecimiento) adicionalmente a la inoculación en caldo de enriquecimiento selectivo. [35]

Técnicas rápidas de detección del EGB. Pruebas de laboratorio en el lugar de asistencia "point-of-care testing (POCT)". Detección intraparto del EGB. PCR
Las técnicas de detección de EGB basadas en cultivar e identificar la bacteria no son lo suficientemente rápidas para detectar el EGB una vez que el parto ha comenzado. La siembra de los escobillones y el desarrollo del EGB en el cultivo requiere aguardar a que la bacteria se desarrolle, necesitando al menos varias horas. Por ello esta técnica no es utilizable como técnica de diagnóstico rápido que permita seleccionar las embarazadas candidatas a recibir PAI una vez ha comenzado el parto.
Métodos rápidos para detectar EGB en muestras clínicas han sido desarrollados, como los basados en amplificación de ácidos nucleicos (NAAT, Nucleic acid amplification tests), la reacción en cadena de la polimerasa (PCR, Polymerase chain reaction) y sondas de hibridación de DNA. Estos tests pueden ser usados directamente sobre la muestra o usando como muestra el caldo de enriquecimiento una vez incubado, evitando subcultivar la muestra a una placa de medio de identificación de EGB y acelerando la obtención del resultado.[35][83][88][95]
La detección del EGB usando muestras vaginales o rectales cultivándolas en un caldo de enriquecimiento no proporciona un resultado tan inmediato como puede hacerlo una prueba de PCR efectuada directamente sobre la muestra tomada con un escobillón inmediatamente antes del parto lo que detectaría si la embarazada está colonizada y permitiría la administración de PAI a las madres en que no se conoce sin son portadoras en el momento del parto.[35]
Sin embargo las pruebas rápidas de detección de EGB directamente sobre las muestras carecen de sensibilidad suficiente para detectar en todos los casos la colonización por EGB por lo que su uso no se recomienda directamente en muestras clínicas y solo deben usarse tras una etapa de enriquecimiento en caldo selectivo.[25][37]
Las pruebas rápidas pueden ser en el futuro efectivas para ser usadas como substituto del cultivo para detectar las madres portadoras de EGB. Pero estas pruebas deben ser aún mejoradas y simplificadas para su uso como Pruebas de laboratorio en el lugar de asistencia "Point of care testing, POCT" que pueda ser realizado en la sala de partos y reemplazar a la detección del EGB por cultivo.[35][88][96]
Un inconveniente de estas técnicas es que actualmente no permiten conocer la sensibilidad a los antibióticos de la cepa de EGB,[88] lo que es un problema serio si existe alergia a la penicilina. Las pruebas de diagnóstico rápido (POCT) pueden ser usadas en aquellas mujeres que ingresan de parto sin factores de riesgo y cuyo estado de portadoras de EGB no se conoce.[25][37]
Oportunidades perdidas para la prevención de la infección neonatal por EGB.
Los factores importantes para la prevención adecuada de la infección neonatal precoz usando el enfoque del cribado universal y aplicación de IAP a todas las madres portadoras de EGB son:
1-Efectuar la detección del estado de portadora de EGB en todas las embarazadas
2-Toma de muestras para detectar EGB adecuada
3-Métodos de cultivo de detección de EGB correctos
4-Administración adecuada de PAI a todas las madres colonizadas
Varios estudios han encontrado que en la mayoría de casos la infección neonatal precoz ocurre en RN a término cuyas madres tenían un resultado negativo en el estudio de colonización por EGB y en RN prematuros a cuyas madres no se les había efectuado el estudio de colonización.
Aunque algunos resultados falsamente negativos en la detección de EGB pueden ser debidos a las limitaciones de la técnica o la colonización por EGB después de la toma de muestra, los datos muestran que es aún necesario en algunas unidades una mejora de los métodos de detección de EGB, incluyendo toma de muestras y técnicas de diagnóstico.
Los resultados falsamente negativos en la detección de EGB, la no administración de PAI a mujeres que presentan parto prematuro y que no se conoce si están colonizadas y el uso de antibióticos no adecuados para erradicar el EGB en mujeres alérgicas a penicilina causan la mayoría de oportunidades perdidas de prevención de infección neonatal por EGB.
La infección neonatal en RN de madres que han sido estudiadas para ver si eran portadoras de EGB pero en que las pruebas de laboratorio han sido negativas, son particularmente preocupantes y pueden ser causados por una incorrecta toma de muestras, excesivo tiempo de conservación de la muestra antes de estudiarla, por uso de una técnica incorrecta en el laboratorio, por uso reciente de antibióticos o por colonización de la madre después de que las muestras fueron tomadas.[45][74][97][98][99][100]
Epidemiología
La incidencia publicada de infección neonatal por EGB in the UK fue 0.72 por 1,000 nacidos vivos en el periodo 2000-2001.[101] [102] y de 0.57 por 1000 en 2015.[81] Sin embargo, se ha indicado que esta cifra puede estar muy infravalorada, pues un considerable número de RN con una probable infección pueden tener cultivos negativos como consecuencia de un tratamiento previo de la madre con antibióticos, que puede inhibir el crecimiento del EGB en los cultivos de sangre (hemocultivo) y líquido cefalorraquídeo del RN sin enmascarar los síntomas clínicos.[103][104]
En USA se ha publicado una incidencia de infección neonatal precoz por EGB del 0.47 por 1000 RN vivos en 1999-2011, que decreció al 0.34 por 1000 en 2003-2005[77] y a 0.23 por mil en 2015. [45] Los CDC han comunicado una incidencia de infección neonatal precoz por EGB del 0.25 por 1,000 RN vivos en 2010. Mientras que la incidencia de infección neonatal tardía permaneció inalterada en un 0.31 por 1,000.[45][105]

En España la incidencia de la infección neonatal por EGB descendió desde 1.25 por mil en 1996 a 0.33 por 1000 en 2008.[106]
El Grupo de Hospitales Fundación Castrillo ha comunicado en 2018 en España una incidencia de infección neonatal precoz por EGB del 0.17 por mil RN vivos y del 0,05 por mil de infección neonatal tardía por EGB.[78]
En el área de Barcelona entre 2004 y 2010 la incidencia de infección precoz por EGB fue de 0.29 por 1000 RN vivos sin cambios significativos entre los distintos años. La mortalidad fue del 8.16%.[74][107]
En Francia desde 2001 ha sido publicada una disminución rápida de la incidencia de la infección neonatal por EGB desde el uso generalizado de la PAI.[108]
La incidencia de la infección neonatal por EGB en 2012 se ha estimado en 0.53 por 1,000 RN en Europa, en 0,67 en América y en un 0.15 en Australia. En los países donde no está establecido el uso PAI la incidencia fue 2.2 veces más alta que en aquellos donde está establecido el uso de PAI.[49][102]
A nivel mundial en 2015 se ha estimado una incidencia anual de unos 205.000 casos de infección neonatal precoz por EGB y de unos 114.000 casos de infección neonatal tardía.[109]
Estimaciones mas recientes cifran, a nivel mundial en 2020, que 400.000 recién nacidos han sufrido infección neonatal por EGB y 90.000 han muerto como consecuencia de ello, principalmente en paises en vias de desarrollo. [110]
La frecuencia estimada de infección neonatal precoz por EGB varia entre diferentes países con incidencias de 0.09 en Japón, 0,58 en Panamá, 0.76 en Hong Kong y 2.35 en República Dominicana siendo en general inferior en Asia y más alta en África.[111]
Con la aplicación generalizada en muchos países de medidas de prevención de la infección neonatal por EGB la incidencia de estas infecciones ha disminuido a una estimación global del 0.49 por 1000 recién nacidos vivos. Aunque existen grandes diferencias entre diversos países.[46]
Recomendaciones nacionales para prevención de la infección neonatal por EGB
La política de prevención de la infección neonatal precoz por EGB basada en la detección del estado de portadoras de la gestante u administración de profilaxis antibiótica intraparto ha sido adoptada por mas de 35 países.[110]
USA. Guidelines from the Centers for Disease Control and Prevention, CDC. Opinión del Comité ACOG
Los CDC publicaron en 1996 sus primeras recomendaciones para prevención de la infección neonatal por EGB usando PAI. En estas recomendaciones se recomendó el uso de cualquiera de las dos alternativas para seleccionar las madres candidatas a recibir PAI, bien la selección basada en factores de riesgo, o bien la alternativa de cribado de todas las embarazadas para detectar las portadoras de EGB.[70] Como consecuencia de la puesta en práctica de estas recomendaciones se observó una importante disminución de la incidencia de la infección neonatal precoz por EGB en USA.[112]
Los CDC actualizaron estas recomendaciones en 2002 y en ellas se recomendó el uso del cribado universal para detectar las portadoras de EGB y la aplicación de PAI a todas las madres portadoras, recomendando también el uso de PAI en aquellas madres en que en el momento del parto no se conoce si son portadoras de EGB pero que presentan factores de riesgo.[113] La implementación de estas recomendaciones provocó una nueva disminución de la incidencia de la infección precoz por EGB.[114] Los CDC actualizaron sus recomendaciones de nuevo en 2010, sin embargo las recomendaciones fundamentales no sufrieron cambios.[35]
Los siguientes son las adiciones más importantes en las recomendaciones de 2010 sobre las de 2002.
--Nuevas opciones para la detección de EGB en el laboratorio incluyendo el uso de medios cromogénicos, medio granada y tests PCR.
--Revisión del límite de colonias necesarias para informar la presencia de EGB en la orina de embarazadas.
--Algoritmos revisados para cribado de EGB y uso de PAI en mujeres con amenaza de parto prematuro, incluyendo algoritmos para el manejo del parto prematuro y para la rotura prematura pretérmino de membranas.
--Presentación de las recomendaciones para el uso de PAI en forma de algoritmo para promover el uso del antibiótico más apropiado en mujeres alérgicas a la penicilina.
--Un pequeño cambio en la dosificación de la penicilina para facilitar su uso considerando las diversas presentaciones farmacéuticas.
--Ampliación de los algoritmos de manejo del neonato.
--Recomendaciones para el manejo del RN en función de su aspecto clínico y otros factores de riesgo como corioamnionitis materna, aplicación correcta de la PAI a la madre, edad gestacional y duración de la ruptura de membranas.
--Modificaciones en el algoritmo para reducir evaluaciones innecesarias en RN que aparecen sanos y tienen bajo riesgo de desarrollar infección neonatal precoz por EGB.
En el año 2018 los CDC transfirieron la responsabilidad de actualización de sus recomendaciones para a prevención de la infección neonatal por EGB al colegio americano de obstetras y ginecólogos (American College of Obstetricians and Gynecologists, ACOG), a la Academia Americana de Pediatría (AAP) y a la Sociedad Americana de Microbiología (ASM) que han publicado nuevos documento de recomendaciones.[25][37][39]
El documento de la ACOG no introduce novedades importantes sobre las recomendaciones de los CDC de 2010. La principal novedad es la recomendación de efectuar la detección de EGB en la embarazada en la semana 36-37 en vez de 35-37. Asimismo es revisada la dosificación de la vancomicina cuando se administra a embarazadas alérgicas a penicilina. También se incluyen recomendaciones sobre la conveniencia de efectuar pruebas de laboratorio para comprobar la existencia de verdadera alergia a penicilina en aquellas embarazadas que informan de posible alergia a penicilina.
El documento de la AAP fundamentalmente indica pautas de manejo clínico de los recién nacidos infectados por EGB estableciendo diferencia entre recién nacidos prematuros y a término.
El documento de la ASM revisa las indicaciones y utilidad de las pruebas de amplificación de ácidos nucleicos para el diagnóstico de embarazadas portadoras de EGB y aconseja la utilización de escobillones "floked" para la toma de muestras vagino-rectales en las embarazadas.
Recomendaciones españolas
En 1998 se publicó el Documento de Consenso de las Sociedades Españolas de Obstetricia y Ginecología y de Neonatología, avalado por la Sociedades Españolas de Enfermedades Infecciosas y Microbiología Clínica y de Quimioterapia: "Recomendaciones para la prevención de la infección perinatal por estreptococo del grupo B".[115] En este documento las sociedades participantes recomendaron el cribado universal de las gestantes para determinar su estado de portadoras de EGB y la aplicación de PAI a todas las madres colonizadas. Con posterioridad, en 2003 las recomendaciones fueron actualizadas por las Sociedades Españolas de Obstetricia y Ginecología (SEGO), de Neonatología (SEN), de Enfermedades Infecciosas y Microbiología Clínica (SEIMC), de Quimioterapia (SEQ) y de Medicina Familiar y Comunitaria.siguiendo las recomendaciones del CDC de 2002.[116]
Nuevamente las recomendaciones españolas fueron actualizadas en 2012 de acuerdo con las nuevas recomendaciones de los CDC,[36] con pequeñas variaciones sobre los procedimientos de detección de la colonización por EGB. Específicamente no se recomendó la aglutinación directa con látex sobre el caldo de enriquecimiento por posibles resultados falsos positivos y negativos.
A continuación se indican los procedimientos para toma y procesamiento de muestras para detección de portadoras EGB
-¿A quién?. Todas las embarazadas.
-¿Cuándo?. Entre la 35 a la 37 semanas de gestación. Modificado en las nuevas recomendaciones ACOG (2020) a las semanas 36-37.[37]
-¿Dónde?. Tercio externo de la vagina y el recto.
-¿Con qué?. Uno o dos escobillones que, después de la toma, se introducirán en el medio de transporte.
-Transporte. Enviar al laboratorio el mismo día de la obtención y, si no es posible, al día siguiente. Si la muestra no puede ser enviada al laboratorio el día de su obtención, debe conservarse en frigorífico hasta su envío.
-Conservación de la muestra en el laboratorio hasta el procesamiento. 24 h en frigorífico. Un tiempo de conservación mayor puede dar lugar a resultados falsos negativos.
-Petición. Indicar claramente «Cribado de EGB» e indicar posible alergia a penicilina.
Procesamiento de las muestras:
--Opción 1. Inocular la muestra en medio líquido de enriquecimiento selectivo para EGB (Todd Hewitt con colistina y ácido nalidíxico o con gentamicina y ácido nalidíxico) y tras 18-24 h de incubación subcultivar a una placa de medio granada, a una placa de agar sangre, a una placa de agar sangre selectivo (p. ej., colistina-nalidíxico) o a una placa de medio cromogénico.
--Opción 2. Inocular la muestra en caldo granada e incubar en aerobiosis 18 h. Observar la presencia de colonias rojas tras 24 h de incubación. Los cultivos negativos (ausencia de colonias rojas o naranjas) se reincubarán 24 h más antes de descartarlos como negativos.
--Opción 3. Inocular un medio líquido de enriquecimiento selectivo y después sembrar una placa de agar granada. Si la placa de granada es negativa a las 18 h, subcultivar el caldo de enriquecimiento a un medio de cultivo adecuado, como en la opción 1.
--Opción 4. Sembrar en medio granada en placa e incubar en anaerobiosis durante 48 h antes de considerarla negativa. Esta opción requiere un riguroso control de calidad para comprobar su sensibilidad.

Con posterioridad a estas recomendaciones en 2015 la Sociedad Española de Enfermedades infecciosas y Microbiología Clínica publicó su procedimiento nº54 Diagnóstico microbiológico de la infección bacteriana asociada al parto y al puerperio donde se recogen las técnicas microbiológicas relacionadas con el diagnóstico de EGB durante la gestación.[117]
UK. Royal College of Obstetricians & Gynaecologists, RCOG
En 2003 el Real colegio de Obstetras y Ginecólogos (Royal College of Obstetricians & Gynaecologists, RCOG) publicó su Guideline No.26 sobre Prevención de la infección neonatal precoz por EGB (Prevention of early onset neonatal Group B streptococcal disease).
En estas recomendaciones no se recomienda el cribado general para detectar el estado de portadora de EGB en las embarazadas. Sin embargo se indica que se debe ofrecer el uso de PAI si EGB es detectado en un cultivo vaginal durante el embarazo. En septiembre de 2017 se ha publicado una nueva revisión de las recomendaciones del RCOG para prevención de la infección neonetal precoz por EGB (Guideline No.26).[81] En estas recomendaciones sigue sin aconsejarse el cribado general para detectar EGB en todas las embarazadas aunque indica que si se conoce que la madre es portadora de EGB se le debe ofrecer la administración de PAI. Así mismo se indica que a todas las madres se les debe suministrar un folleto explicando los problemas asociados con el EGB y el embarazo (publicado en diciembre de 2017).[118]
El costo para el sistema de salud en el Reino Unido (NHS) de las indemnizaciones satisfechas por responsabilidad en el desarrollo de infecciones neonatales por EGB ha sido estimado entre 2006 y 2018 en 50 millones de libras.[119]
Recomendaciones argentinas y colombianas
En la República Argentina desde 1996 se recomendó la estrategia de prevención basada en factores de riesgo, señalando la obligación de "Realizar en todas las instituciones, la estrategia de profilaxis intraparto a mujeres con factores de riesgo de portar EGB", señalando que la misma "disminuirá la infección neonatal precoz con EGB en no menos de un 70%". Y, se indica que "en aquellas instituciones en que existen posibilidades para realizar un cuidadoso protocolo de investigación, se podrá realizar el cultivo entre las 35 a 37 semanas de EGB.[120] Con posterioridad en 2008 se publicó la Ley de SALUD PUBLICA 26.369 que incorpora con carácter obligatorio de control y prevención, la realización del examen de detección del estreptococo Grupo B Agalactiae, a todas las embarazadas con edad gestacional entre las semanas 35 y 37, presenten o no condiciones de riesgo.[121]
Sin embargo esta ley no se encuentra aún reglamentada y ha generado controversia sobre la posibilidad de su efectivo cumplimiento al significar una modificación sustancial a la estrategia difundida por el Ministerio de Salud desde 1996 la cual se basaba en la identificación de los factores de riesgo en el momento del parto.[120]
En Colombia por Resolución del Ministerio de Salud y Protección Social también se ha declarado la obligatoriedad de efectuar la detección del estado de portadora de EGB en la gestante por cultivo vaginal y rectal. [122]
Otras recomendaciones
Recomendaciones para la prevención de la infección neonatal por EGB se han publicado en muchos países. En la mayoría de países desarrollados recomiendan el uso del cribado universal para detectar EGB al final del embarazo y la administración de PAI a las madres colonizadas. e.g. Canadá,[123][124]Suiza,[125]Alemania,[126]Polonia,[127]República Checa,[128] Francia,[129] y Bélgica.[130]
Recomendaciones basadas en el criterio de factores de riesgo para recomendar PAI han sido publicadas en Holanda,[131]
El Real Colegio Australiano y Neozelandés de Obstetras y Ginecólogos (Royal Australian and New Zealand College of Obstetricians and Gynaecologists, RANZCOG) no recomienda claramente una u otra estrategia, sino que indica que los médicos encargados de la atención a la embarazada deben escoger de acuerdo con las recomendaciones en su área.[132]
Infección por EGB en adultos
El EGB es también capaz de causar infecciones graves en adultos, fundamentalmente en personas con condiciones predisponentes como obesidad, diabetes, cirrosis, edad avanzada y cáncer.[5][133][134][135][136][137][138]
Las infecciones por EGB en el adulto incluyen[5] infección urinaria, infección de tejidos blandos (celulitis), bacteremia, osteomielits y endocarditis. [139]
Estas infecciones pueden ser muy graves y la mortalidad es más alta en adultos que en RN. La infección por EGB en adultos se estima responsable del 90% de las muertes causadas cada año por EGB en USA.[137]
EGB también es causante frecuente de infección de la herida tras el parto por cesárea.[140]
En general la penicilina es el antibiótico de elección para el tratamiento.[138] Eritromicina y Clindamicina no deben usarse en pacientes alérgicos a penicilina sin efectuar pruebas de sensibilidad para comprobar que la cepa de EGB causante no presenta resistencia a estos antibióticos. La gentamicina asociada a penicilina (para conseguir sinergia, efecto sinérgico) puede usarse en el tratamiento de infecciones graves. La frecuencia de infección por EGB en adultos parece estar incrementandose en los últimos años y su alta morbilidad y mortalidad hacen aún más necesario el desarrollo de una vacuna para prevenir estas infecciones.[141] [142]
Vacunas frente al EGB
Aunque la difusión del uso de la PAI ha disminuido de manera muy notable la frecuencia de la infección neonatal precoz por EGB este enfoque no es efectivo para reducir la infección neonatal de comienzo tardío y la infección en adultos.[143][144] Sin embargo con una vacuna efectiva podrían controlarse las infecciones precoces y tardías en RN, bebes y adultos. [145]
Ya en 1976 se demostró que la presencia de bajos niveles de anticuerpos frente al polisacárido de la cápsula de EGB en el suero de las madres se relacionaba con la susceptibilidad del RN a padecer una infección precoz o tardía por EGB.[47] El polisacárido de la cápsula del EGB, que como se indicó, es un factor de virulencia importante, es un excelente candidato para el desarrollo de una vacuna efectiva. Pues los anticuerpos específicos transferidos de la madre al feto son capaces de proteger al RN de una infección por EGB.[144] Actualmente en adición a las vacunas frente EGB basadas en el polisacárido capsular se están desarrollando vacunas basadas en proteínas de superficie. La ventaja de las vacunas basadas en proteínas es que pueden proteger de la infección por todos los serotipos de EGB en contraste con las vacunas de polisacéridos capsulares que solo protegen frente a los serotipos incluidos.[146][147]
La vacunación se considera hoy la solución ideal, pues sería capaz no solo de prevenir la infección neonatal precoz y tardía sino que también protegería a los adultos susceptibles. Sin embargo, aunque la investigación y ensayos clínicos sobre estas vacunas se están realizando,[148][149] no existe aún una vacuna comercialmente disponible en 2020.[150].Actualmente la autorización de estas vacunas es difícil por las dificultades de realizar ensayos clínicos adecuados dada la baja incidencia de infección neonatal por EGB.[34][150][151]
Infección por EGB en animales
El EGB se ha encontrado en mamíferos como elefantes, camellos, perros, gatos, focas, delfines y en otros animales como cocodrilos.[152]
Ganado vacuno
En el ganado vacuno el EGB puede causar mastitis (infección de las ubres). La mastitis causada por EGB puede presentarse como una enfermedad febril aguda o como una infección crónica, provocando en ambos casos una disminución de la producción de leche (de ahí procede el nombre de agalactiae que significa sin leche). La mastitis provocada por EGB puede tener un importante efecto sobre la cantidad y calidad de la leche producida y está asociada con contajes elevados de células y bacterias en la leche.[8][9][153][154] Los brotes de mastitis causadas por EGB en los rebaños son habituales y pueden tener un fuerte impacto en la producción industrial de leche. Por ello en muchos países se han desarrollado programas para reducir su impacto en el ganado vacuno.[155]
Peces
Se han descrito infecciones por EGB en diversas especies de peces, tanto en estadio libre como en piscifactorías (piscicultura), causando septicemia y hemorragias internas y externas y dando lugar lugar a importantes perdidas económicas.[156][157]
Asi mismo el consumo de peces infectados por EGB en piscifactorias ha causado brotes de infección humana por EGB. [158]
Para prevenir estas infecciones en peces causadas por EGB se está intentando el desarrollo de vacunas.[159][160][161]
Enlaces externos
http://www.groupbstrepinternational.org/
http://www.cdc.gov/groupbstrep/index.html Centers for Disease Control and Prevention. USA.
http://gbss.org.uk/ GBS Support Reino Unido.
http://www.ogbs.nl/ Holanda
Referencias
- ↑ Fry RM (1938). «Fatal infections by haemolytic streptococcus group». Lancet 1: 199-201.
- ↑ Eickhoff TC, Klein JO, Kathleen Daly A, David Ingall, Finland M. (1963). «Neonatal Sepsis and Other Infections Due to Group B Beta-Hemolytic Streptococci». New Enland J Med (271): 1221-1228. doi:10.1056/NEJM196412102712401.
- ↑ «Infección por estreptococo del grupo B». Academia Americana de Médicos de Familia. Consultado el 30 de octubre de 2023.
- ↑ CDC-Centro para el Control y la Prevencion de Enfermedades (18 de octubre de 2022). «Información acerca del estreptococo del grupo B». Consultado el 30 de octubre de 2023.
- ↑ a b c d Edwards MS, Baker CJ (2010). Streptococcus agalactiae (group B streptococcus). "In" Mandell GL, Bennett JE, Dolin R (eds). Principles and practice of infectious diseases. Vol 2. Capitulo 202 (7th edición). Elsevier. ISBN 978-0-443-06839-3.
- ↑ a b c d e f g h i j k l m n Edwards MS, Nizet V. (2011). Group B streptococcal infections. "in" Infectious Diseases of the Fetus and Newborn Infant. (7th 2011 edición). Elsevier. pp. 419-469. ISBN 978-0-443-06839-3.
- ↑ Perez Trallero E, Cueto Lopez M, Muñoz Garcia P., Capitulo 11. Cocos grampositivos y gramnegativos- Streptococcus agalactiae. p 124. (2011). "En" Microbiología en Ciencias de la Salud. 3ª Ed. 2011. Rosa-Fraile M, Prieto J, Navarro JM. (editores). Elsevier. ISBN 978-84-8086-692-7.
- ↑ a b Keefe GP. «Streptococcus agalactiae mastitis: a review.». Can Vet J. 1997; 38:199-204. Consultado el 10 de noviembre de 2019.
- ↑ a b University of Wisconsin-Madison, Dept of Dairy Science. «Milk Quality Factsheet. Streptococcus agalactiae. EN ESPAÑOL.». Archivado desde el original el 23 de febrero de 2016. Consultado el 10 de noviembre de 2019.
- ↑ Kabelitz T, Aubry E, van Vorst K, Amon T, Fulde M (2021). «The Role of Streptococcus spp. in Bovine Mastitis.». Microorganisms 9: 1497. doi:10.3390/microorganisms9071497. Consultado el 30 de octubre de 2023.
- ↑ a b Whiley RA, Hardie JM. Genus I. Streptococcus Rosenbach 1884. Pag. 655-657. "In" Bergey's Manual of Systematic Bacteriology: Vol 3: The Firmicutes. (2nd. ed.). 2009. (en inglés). Springer. ISBN 978-0-387-95041-9.
- ↑ Ryan KJ. Streptococci and Enterococci. "In" Sherris Medical Microbiology. Ryan KJ, Ray CG, eds. 2004. Chapter 17. Pag.286-288. (en inglés). McGraw Hill. ISBN 0-8385-8529-9.
- ↑ a b c Tille P. (2014). (2014). Bailey & Scott's Diagnostic Microbiology (13th. ed.). (en inglés). Elsevier. ISBN 978-0-323-08330-0.
- ↑ Toniolo C, Balducci E, Romano MR, Proietti D, Ferlenghi I, Grandi G, Berti F, Ros IM, Janulczyk R. (2015). «Streptococcus agalactiae capsule polymer length and attachment is determined by the proteins CpsABCD». J Biol Chem. 290: 9521-9532. doi:10.1074/jbc.M114.631499. Consultado el 7 de febrero de 2021.
- ↑ Slotved HC, Kong F, Lambertsen L, Sauer S, Gilbert GL. (2007). «Serotype IX, a proposed new Streptococcus agalactiae serotype.». J Clin Microbiol. 2007; 45:2929-2936. doi:10.1128/JCM.00117-07. Archivado desde el original el 22 de julio de 2018. Consultado el 10 de noviembre de 2019.
- ↑ Maisey HC, Doran KS, Nizet V. «Recent advances in understanding the molecular basis of group B Streptococcus virulence.». Expert Rev Mol Med. 2009;10: e27. (en ingles.). doi:10.1017/S1462399408000811.
- ↑ a b c Armistead B, Oler E, Adams Waldorf K, Rajagopal L. (2019). «The double life of Group B Streptococcus: Asymptomatic colonizer and potent pathogen». J Mol Biol 431: 2914-2931. doi:10.1016/j.jmb.2019.01.035. Consultado el 25 de enero de 2021.
- ↑ a b Rajagopal L. «Understanding the regulation of Group B Streptococcal virulence factors.». Future Microbiol. 2009; 4: 201-221. (en inglés). doi:10.2217/17460913.4.2.201.
- ↑ Leclercq SY, Sullivan MJ, Ipe DS, Smith JP, Cripps AW, Ulett GC. «Pathogenesis of Streptococcus urinary tract infection depends on bacterial strain and β-hemolysin/cytolysin that mediates cytotoxicity, cytokine synthesis, inflammation and virulence.». Sci Rep. 2016 Jul 7;6:29000. doi:10.1038/srep2900. Consultado el 30 de octubre de 2023.
- ↑ Whidbey C, Harrell MI, Burnside K, Ngo L, Becraft AK, Iyer LM, Aravind L, Hitti J, Waldorf KM, Rajagopal L. «A hemolytic pigment of Group B Streptococcus allows bacterial penetration of human placenta.». J Exp Med. 2013; 210: 1265-1281.
- ↑ Rosa-Fraile M, Dramsi S, Spellerberg B. (2014). «Group B streptococcal haemolysin and pigment, a tale of twins.». FEMS Microbiol Rev. 38.: 932-946.
- ↑ Whidbey C, Vornhagen J, Gendrin C, Boldenow E, Samson JM, Doering K, Ngo L, Ezekwe EA Jr, Gundlach JH, Elovitz MA, Liggitt D, Duncan JA, Adams Waldorf KM, Rajagopal L. (2015.). «A streptococcal lipid toxin induces membrane permeabilization and pyroptosis leading to fetal injury.». EMBO Mol Med. 2015; 7: 488-505. doi:10.15252/emmm.201404883.
- ↑ Christopher-Mychael Whidbey (2015). «Characterization of the Group B Streptococcus Hemolysin and its Role in Intrauterine Infection.». University of Washington. (en inglés). Consultado el 5 de noviembre de 2019.
- ↑ a b c d e f Rosa-Fraile M, Spellerberg B. (2017). «Reliable Detection of Group B Streptococcus in the Clinical Laboratory.». Journal of Clinical Microbiology 55 (9): 2590-2598. PMID 28659318. doi:10.1128/JCM.00582-17. Consultado el 30 de octubre de 2023.
- ↑ a b c d e f g h i j k Filkins L, Hauser J, Robinson-Dunn B, Tibbetts R, Boyanton B, Revell P. «10 March 2020. Guidelines for the Detection and Identification of Group B Streptococcus» (en inglés). Consultado el 30 de octubre de 2023.
- ↑ a b Ana Fernández Olmos, Celia García de la Fuente, Juan Antonio Saéz Nieto, Sylvia Valdezate Ramos (2010). Metodos de identificación bacteriana en el laboratorio de microbiología. Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica. ISBN 978-84-614-7932-0. Consultado el 30 de octubre de 2023.
- ↑ «hidrólisis del hipurato». Consultado el 30 de octubre de 2023.
- ↑ a b Rosa-Fraile M, Rodriguez-Granger J, Cueto-Lopez M, Sampedro A, Biel Gaye E, Haro M , Andreu A. (1999). «Use of Granada medium to detect group B streptococcal colonization in pregnant women». J Clin Microbiol. 37: 2674-2677.
- ↑ Rosa-Fraile M, Rodríguez-Granger J, Haidour-Benamin A, Cuerva JM, Sampedro A. (2006). «Granadaene: proposed structure of the group B Streptococcus polyenic pigment». Appl Environ Microbiol . 72: 6367-6370. doi:10.1128/AEM.00756-06. Consultado el 31 de octubre de 2023.
- ↑ Binghuai L, Yanli S, Shuchen Z, Fengxia Z, Dong L, YanchaoC. «Use of MALDI-TOF mass spectrometry for rapid identification of group B Streptococcus on chromID Strepto B agar.». International Journal of Infectious Diseases (IJID) 2014, 27: 44-48. doi:10.1016/j.ijid.2014.06.023. Consultado el 31 de octubre de 2023.
- ↑ Ka-Ning To, Emma Cornwell, Roger Daniel,3 Sweenie Goonesekera, Elita Jauneikaite, Victoria Chalker, Kirsty Le Doare (2019). «Evaluation of matrix-assisted laser desorption ionisation time-of-flight mass spectrometry (MALDI-TOF MS) for the Identification of Group B Streptococcus». BMC Res Note 12. doi:10.1186/s13104-019-4119-1.
- ↑ Russell NJ, Seale AC, O'Driscoll M, O'Sullivan C, et al. (2017). «Maternal Colonization With Group B Streptococcus and Serotype Distribution Worldwide: Systematic Review and Meta-analyses». Clin Infect Dis. 65, Suppl 2: S100. doi:10.1093/cid/cix658.
- ↑ a b Barcaite E, Bartusevicius A, Tameliene R, Kliucinskas M, Maleckiene L, Nadisauskiene R. «Prevalence of maternal group B streptococcal colonisation in European countries".». Acta Obstet Gynecol Scand. 2008, 87: 260-271. doi:10.1080/00016340801908759. Consultado el 31 de octubre de 2023.
- ↑ a b c d e Rodriguez-Granger J, Alvargonzalez JC, Berardi A, Berner R, Kunze M, Hufnagel M, Melin P, Decheva A, Orefici G, Poyart C, Telford J, Efstratiou A, Killian M, Krizova P, Baldassarri L, Spellerberg B, Puertas A, Rosa-Fraile M. «Prevention of group B streptococcal neonatal disease revisited. The DEVANI European project.». Eur J Clin Microbiol Infect Dis. 2012, 31: 2097-2114.
- ↑ a b c d e f g h i j k l m n ñ o p q r s t u v w x y z aa ab ac ad ae af ag Verani JR, McGee L, Schrag SJ. «Prevention of perinatal group B streptococcal disease: revised guidelines from CDC. En ingles». MMWR Recomm Rep. 2010, 59(RR-10).
- ↑ a b c d e f g h i j k l m n ñ o Alós Cortés JI, Andreu Domingo A, Arribas Mir L, Cabero Roura L, de Cueto López M, López Sastre J, Melchor Marcos JC, Puertas Prieto A, de la Rosa Fraile M, Salcedo Abizanda S, Sánchez Luna M, Sanchez Pérez MJ, Torrejón Cardoso R. (2012). «Prevención de la infección perinatal por estreptococo del grupo B. Recomendaciones españolas. Actualización 2012. Documento de consenso SEIMC/SEGO/SEN/SEQ/SEMFYC.». Rev Esp Quimioter 2012;25:79-88 EN ESPAÑOL. doi:10.1016/j.eimc.2012.03.013. Consultado el 10 de noviembre de 2019.
- ↑ a b c d e f g h i j k l m n ñ o p q r s t u v w x y z aa ab ac ad American College of Obstetricians and Gynecologists.Committee Opinion, Number 797 (2020). «Prevention of Group B Streptococcal Early-Onset Disease in Newborns». Obstetrics & Gynecology: 135: p e51-e72. doi:10.1097/AOG.0000000000003668. Consultado el 31 de octubre de 2023.
- ↑ Muller AE, Oostvogel PM, Steegers EA, Dörr PJ. (2016). «Morbidity related to maternal group B streptococcal infections.». Acta Obstet Gynecol Scand. 85(9):1027-37. doi:10.1080/00016340600780508. Consultado el 31 de octubre de 2023.
- ↑ a b c d Puopolo KM, Lynfield R, Cummings JJ, AAP COMMITTEE ON FETUS AND NEWBORN, AAP COMMITTEE ON INFECTIOUS DISEASES. (2019). «Management of Infants at Risk for Group B Streptococcal Disease.». Pediatrics 144: e20191881. doi:10.1542/peds.2019-1881. Consultado el 9 de febrero de 2021.
- ↑ Russell NJ, Seale AC, O'Driscoll M, O'Sullivan C, Bianchi-Jassir F, Gonzalez-Guarin J, Lawn JE, Baker CJ, Bartlett L, Cutland C, Gravett MG, Heath PT, Le Doare K, Madhi SA, Rubens CE, Schrag S, Sobanjo-Ter Meulen A, Vekemans J, Saha SK, Ip M (2017). «Risk of early-onset neonatal group B streptococcal disease with maternal colonization worldwide: systematic review and meta-analyses.». Clin Infect Dis. ;65(suppl_2):S152–S159: S152-159. doi:10.1093/cid/cix658. Consultado el 11 de febrero de 2021.
- ↑ a b c Boyer KM, Gotoff SP. «Strategies for chemoprophylaxis of GBS early-onset infections.». Antibiot Chemother. 1985; 35: 267-280. doi:10.1159/000410380.
- ↑ a b Libster R, Edwards KM, Levent F, Edwards MS, Rench MA, Castagnini LA, Cooper T, Sparks RC, Baker CJ, Shah PE. «Long-term outcomes of group B streptococcal meningitis.». Pediatrics 2012, 130: e8-15. doi:10.1542/peds.2011-3453.
- ↑ Polin RA. «Management of Neonates With Suspected or Proven Early-Onset Bacterial Sepsis». Pediatrics 2012; 129:1006-1015. (en ingles.). doi:10.1542/peds.2012-0541.
- ↑ Martinez E, Mintegi S, Vilar B, Martinez MJ, Lopez A, Catediano E, Gomez B. «Prevalence and predictors of bacterial meningitis in young infants with fever without a source.». Pediatr Infect Dis J. 2015; 34: 494-498. (en inglés).
- ↑ a b c d e f Nanduri SA, Petit S, Smelser C, Apostol M, Alden NB, Harrison LH, Lynfield R, Vagnone PS, Burzlaff K, Spina NL, Dufort EM, Schaffner W, Thomas AR, Farley MM, Jain JH, Pondo T, McGee L, Beall BW, Schrag SJ. (2019). «Epidemiology of Invasive Early-Onset and Late-Onset Group B Streptococcal Disease in the United States, 2006 to 2015: Multistate Laboratory and Population-Based Surveillance.». JAMA Pediatr. 173(3):224-233. doi:10.1001/jamapediatrics.2018.4826.
- ↑ a b c Lohrmann, Hufnagel et al.for the DEVANI Study Group (2023). «Neonatal invasive disease caused by Streptococcus agalactiae in Europe: the DEVANI multi‐center study». Infection 51: 981-991. doi:10.1007/s15010-022-01965-x. Consultado el 1 de noviembre de 2023.
- ↑ a b Baker CJ, Kasper DL. «Correlation of maternal antibody deficiency with susceptibility to neonatal infection with group B Streptococcus. En ingles». N Eng J Med. 1976; 294: 753-756.
- ↑ Baker CJ, Edwards MS, Kasper DL. «Role of antibody to native type III polysaccharide of group B Streptococcus in infant infection.». Pediatrics 1981; 68: 544-549. (en inglés).
- ↑ a b Edmond KM, Kortsalioudaki C, Scott S, Schrag SJ, Zaidi AK, Cousens S, Heath PT. «Group B streptococcal disease in infants aged younger than 3 months: systematic review and meta-analysis.». Lancet. 2012; 279: 547-556.
- ↑ Prieto Tato LM, Gimeno Díaz de Atauri A, Aracil Santos J, Omeñaca Teres F, del Castillo Martín F, de José Gómez MI. «Infección tardía por estreptococo del grupo B: experiencia en un hospital de tercer nivel (2000-2006)». An Pediatr (Barc). 2008 68:239-243.
- ↑ Lin FYC, Weisman LE ,Troendle J, Adams K. «Prematurity Is the Major Risk Factor for Late-Onset Group B Streptococcus Disease. En Ingles.». The Journal of Infectious Diseases. 2003; 188: 267-271.
- ↑ Campelo FA1, Pedrosa AC, Antúnez IÁ, Capuz BL. «Fenotipos y mecanismos de resistencia a macrólidos y lincosamidas en aislados de Streptococcus agalactiae con significación clínica en un período de ocho años (2002-2010)». Rev Esp Quimioter. 2012; 25:42-46. EN ESPAÑOL.
- ↑ Gonzalez JJ1, Andreu A; Spanish Group for the Study of Perinatal Infection from the Spanish Society for Clinical Microbiology and Infectious Diseases. (2005). «Multicenter study of the mechanisms of resistance and clonal relationships of Streptococcus agalactiae isolates resistant to macrolides, lincosamides, and ketolides in Spain.». Antimicrob Agents Chemother. 2005 49:2525-7. doi:10.1128/AAC.49.6.2525-2527.2005.
- ↑ Lin FY, Brenner RA, Johnson YR, Azimi PH, Philips JB 3rd, Regan JA, Clark P, Weisman LE, Rhoads GG, Kong F, Clemens JD. «The effectiveness of risk-based intrapartum chemoprophylaxis for the prevention of early-onset neonatal group B streptococcal disease. En ingles». American Journal of Obstetrics and Gynecology 2001; 184: 1204-1210. doi:10.1067/mob.2001.113875.
- ↑ De Cueto, M, Sanchez, MJ, Sampedro, A, Miranda, JA, Herruzo, AJ, Rosa-Fraile, M. «Timing of Intrapartum Ampicillin and Prevention of Vertical Transmission of Group B Streptococcus". Obstetrics & Gynecology. En ingles.». Obstetrics & Gynecology 1988; 91:112-114. PMID 9464732.
- ↑ Efficacy of intrapartum chemoprophylaxis less than 4 hours duration. En ingles. «Berardi A, Rossi C, Biasini A, Minniti S, Venturelli C, Ferrari F, Facchinetti F.». J Matern Fetal Neonatal Med. 2011; 24: 619-625.
- ↑ Siegel JD, Cushion NB. «Prevention of early-onset group B streptococcal disease: another look at single-dose penicillin at birth.». Obstet Gynecol. 1996; 87: 692-698.
- ↑ Velaphi S, Siegel JD, Wendel GD Jr, Cushion N, Eid WM, Sanchez PJ. «Early-onset group B streptococcal infection after a combined maternal and neonatal group B streptococcal chemoprophylaxis strategy.». Pediatrics 2003; 111: 541-547.
- ↑ Woodgate PG, Flenady V, Steer PA, Cochrane Library (2012). «Intramuscular penicillin for the prevention of early onset group Bstreptococcal infection in newborn infants (Review)» (en ingles). Consultado el 1 de noviembre de 2023.
- ↑ Bhattacharya S. «The facts about Penicillin Allergy: A Review. En ingles.». J Adv Pharm Technol Res.2010; 1: 11-17. Consultado el 2 de noviembre de 2023.
- ↑ Shilpa H Desai, Michael S Kaplan, Qiaoling Chen, Eric M Macy, (2017). «Morbidity in Pregnant Women Associated with Unverified Penicillin Allergies, Antibiotic Use, and Group B Streptococcus Infections». Perm J 21: 16-080. doi:10.7812/TPP/16-080. Consultado el 13 de febrero de 2021.
- ↑ Andreu A, Ortega E, Planes AM, Salcedo S. «Evolución de la sepsis perinatal por Escherichia coli en la era de la profilaxis del estreptococo del grupo B». Med Clin (Barc). 2001; 117:521-524. doi:10.1016/s0025-7753(01)72166-5.
- ↑ Baltimore RS, Huie SM, Meek JI, Schuchat A, O'Brien KL. «Early-onset neonatal sepsis in the era of group B streptococcal prevention.». Pediatrics. 2001; 108: 1094-1098.
- ↑ Sutkin G, Krohn MA, Heine RP, Sweet RL. «Antibiotic prophylaxis and non-group B streptococcal neonatal sepsis. En ingles». Obstet Gynecol. 2005; 105: 581-586.
- ↑ Cutland CL, Madhi SA, Zell ER, Kuwanda L, Laque M, Groome M, Gorwitz R, Thigpen MC, Patel R, Velaphi SC, Adrian P, Klugman K, Schuchat A, Schrag SJ; PoPS Trial Team. «Chlorhexidine maternal-vaginal and neonate body wipes in sepsis and vertical transmission of pathogenic bacteria in South Africa: A randomised, controlled trial. En Ingles». The Lancet 2009; 374 (9705): 1909-1916. doi:10.1016/S0140-6736(09)61339-8.
- ↑ Ohlsson, A; Shah, VS; Stade, BC (2014). «Vaginal chlorhexidine during labour to prevent early-onset neonatal group B streptococcal infection. The Cochrane database of systematic reviews.» (en inglés). Consultado el 2 Noviembre 2023..
- ↑ a b c Group B Strep Support. «FAQs (Frequently Asked Questions) Carrying GBS and water birth, and home birth».
- ↑ M Iriondo Sanza, M.Sánchez Lunab, F.Botet Mussonsc, T.Martínez-Astorquizad,J.M.LaillaVicensey J.Figueras Aloy (2015). «Atención del parto en el agua.Consenso de la Sociedad Española de Neonatología y de la Sección de Medicina Perinatal de la Sociedad Española de Obstetricia y Ginecología». Anales de Pediatria 82: 108. PMID 25074709. doi:10.1016/j.anpedi.2014.06.013. Consultado el 3 de noviembre de 2023.
- ↑ Emily Neiman , Elizabeth Austin, Alai Tan , Cindy M Anderson, Esther Chipps (2029). «Outcomes of Waterbirth in a US Hospital-Based Midwifery Practice: A Retrospective Cohort Study of Water Immersion During Labor and Birth». J Midwifery Womens Health . 65: 216-23. doi:10.1111/jmwh.13033.
- ↑ a b CDC 1996. «Prevention of Perinatal Group B Streptococcal Disease: A Public Health Perspective.». MMWR. 1996; 45-RR7: 1-24.
- ↑ Yancey MK1, Schuchat A, Brown LK, Ventura VL, Markenson GR. (1996). «The accuracy of late antenatal screening cultures in predicting genital group B streptococcal colonization at delivery.». Obstet Gynecol. 88(5):811-5. doi:10.1016/0029-7844(96)00320-1.
- ↑ Minna Virranniemi, Tytti Raudaskoski, Mervi Haapsamo, Jaana Kauppila, Marjo Renko, Joanna Peltola, Leila Risteli, Liisa Laatio. (2019). «The effect of screening‐to‐labor interval on the sensitivity of late‐pregnancy culture in the prediction of group B streptococcus colonization at labor: A prospective multicenter cohort study». Acta Obstet Gynecol Scand. 98: 494-9. doi:10.1111/aogs.13522. Consultado el 14 de febrero de 2021.
- ↑ Clifford V, Garland SM, Grimwood K. «Prevention of neonatal group B streptococcus disease in the 21st century. En ingles.». J Paediatr Child Health. 2011; 48: 808-815. (en inglés). doi:10.1111/j.1440-1754.2011.02203.x.
- ↑ a b c d Giménez M, Sanfeliu I, Sierra M, Dopico E, Juncosa T, Andreu A, Lite J, Guardià C, Sánchez F, Bosch J. «"Evolución de la sepsis neonatal precoz por Streptococcus agalactiae en el área de Barcelona (2004-2010). Análisis de los fallos del cumplimiento del protocolo de prevención.». Enf Infect Microbiol Clin. 2015; 33: 446-450. doi:10.1016/j.eimc.2014.10.015.
- ↑ Schrag SJ, Zell ER, Lynfield R, Roome A, Arnold KE, Craig AS, Harrison LH, Reingold A, Stefonek K, Smith G, Gamble M, Schuchat A; Active Bacterial Core Surveillance Team. «A population-based comparison of strategies to prevent early-onset group B streptococcal disease in neonates.». N Eng J Med. 2002, 347: 233-239.
- ↑ Håkansson S, Axemo P, Bremme K, Bryngelsson AL, Wallin MC, Ekström CM, Granlund M, Jacobsson B, Källén K, Spetz E, Tessin I; Swedish Working Group For The Prevention of Perinatal Group B Streptococcal Infections. «Group B streptococcal carriage in Sweden: a national study on risk factors for mother and infant colonisation. En ingles». Acta Obstet Gynecol Scand. 2008;87:50-58. doi:10.1080/00016340701802888.
- ↑ a b Phares CR, Lynfield R, Farley MM, Mohle-Boetani J, Harrison LH, Petit S, Craig AS, Schaffner W, Zansky SM, Gershman K, Stefonek KR, Albanese BA, Zell ER, Schuchat A, Schrag SJ; Active Bacterial Core surveillance/Emerging Infections Program Network. «Epidemiology of Invasive Group B Streptococcal Disease in the United States, 1999-2005. En ingles». JAMA 2008; 299: 2056-2065.
- ↑ a b Rosa-Fraile M, Alos JI (2022). «Group B Streptococcus neonatal infections, the ongoing history». Enferm Infecc Microbiol Clin 40: 349-352. doi:10.1016/j.eimce.2022.01.002.
- ↑ HONORABLE CONGRESO DE LA NACION ARGENTINA Ley 26369 2008-05-07 (2008). «examen de detección del estreptococo Grupo B». Consultado el 14 de febrero de 2021.
- ↑ Comité Consultivo infecciones Neonatales CCIN Sociedad Chilena de Infectología (2017). «Infección neonatal y tamizaje universal para Streptococcus agalactiae (βhemolítico del grupo B) a la mujer embarazada. Recomendación técnica». Revista Chilena de Infectologia (Vol 34 Nº3). PMID 28991323. doi:10.4067/S0716-10182017000300009. Consultado el 29 de noviembre de 2017.
- ↑ a b c d Royal College of Obstetricians and Gynaecologists. RCOG. Hughes RG, Brocklehurst P, Steer PJ, Heath P, Stenson BM (Septiembre de 2017). «Prevention of Early-onset Neonatal Group B Streptococcal Disease Green-top Guideline No. 36 September 2017» (en inglés). BJOG 2017;124:e280–e305. Consultado el 10 de noviembre de 2019.
- ↑ Valkenburg-van den Berg AW, Houtman-Roelofsen RL, Oostvogel PM, Dekker FW, Dorr PJ, Sprij AJ. «Timing of group B streptococcus screening in pregnancy: a systematic review.». Gynecol Obstet. 2010; 69: 174-183. (en inglés). doi:10.1159/000265942.
- ↑ a b Delgado S, García-Garrote F, Padilla B, Rodríguez Gómez JM, Romero B. «Diagnóstico microbiológico de la infección bacteriana asociada al parto y al puerperio.-». Procedimientos en Microbiología Clínica. No.54. Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC). 2015.
- ↑ Price D, Shaw E, Howard M, Zazulak J, Waters H, Kaczorowski J. «Self-sampling for group B Streptococcus in women 35 to 37 weeks pregnant is accurate and acceptable: a randomized cross-over trial. En ingles.». J Obstet Gynaecol Can. 2006. 28: 1983-1088.
- ↑ Hicks P, Diaz-Perez MJ. «Patient self-collection of group B streptococcal specimens during pregnancy. En ingles». J Am Board Fam Med. 2009; 22: 136-140.
- ↑ Arya A, Cryan B, O’Sullivan K, Greene RA, Higgins JR. «Self-collected versus health professional-collected genital swabs to identify the prevalence of group B streptococcus: A comparison of patient preference and efficacy.». The European Journal of Obstetrics & Gynecology and Reproductive Biology 2008; 139: 32-45. doi:10.1016/j.ejogrb.2007.12.005.
- ↑ Nebreda-Martín L, Albisu-Del Campo A, Valle-Ruiz de Larrea L, González-Rodríguez G, Arana-Arri E, Paz-Pascual C (2022). «Efectividad de la autotoma del exudado vaginorrectal para el cribado prenatal de la infección por Streptococcus agalactiae. Estudio GALL». Atención Primaria 54: 102366. doi:10.1016/j.aprim.2022.102366.
- ↑ a b c d Padilla-Ortega B, Delgado-Palacio S, García-Garrote F, Rodríguez-Gómez JM, Romero-Hernández B. «Diagnóstico microbiológico de la infección bacteriana asociada al parto y puerperio.». Enferm Infecc Microbiol Clin. 2015 Dec 16. EN ESPAÑOL. doi:10.1016/j.eimc.2015.10.017.
- ↑ Rosa-Fraile M, Camacho-Muñoz E, Rodríguez-Granger J, Liébana-Martos C. «Specimen storage in transport medium and detection of group B streptococci by culture. En Ingles». J Clin Microbiol. 2005; 43: 928-930.
- ↑ Rosa-Fraile M, Spellerberg B (Septiembre de 2017). «Reliable Detection of Group B Streptococcus in the Clinical Laboratory.». Journal of Clinical Microbiology (en inglés) 55 (9): 2590-2598. PMID 28659318. doi:10.1128/JCM.00582-17.
- ↑ Gil, EG; Rodríguez, MC; Bartolomé, R; Berjano, B; Cabero, L; Andreu, A. «Evaluation of the Granada agar plate for detection of vaginal and rectal group B streptococci in pregnant women». Journal of Clinical Microbiology. 1999; 37: 2648-2651.
- ↑ Claeys, G.; Verschraegen, G.; Temmerman, M. «Modified Granada Agar Medium for the detection of group B streptococcus carriage in pregnant women.En ingles». Clinical Microbiology and Infection 2001; 7: 22-24.
- ↑ a b El Aila NA, Tency I, Claeys G, Saerens B, Cools P, Verstraelen H, Temmerman M, Verhelst R, Vaneechoutte M. «Comparison of different sampling techniques and of different culture methods for detection of group B streptococcus carriage in pregnant women. En ingles». BMC Infect Dis. 2010; 10:285. doi:10.1186/1471-2334-10-285.
- ↑ a b Bou G, Figueira M, Canle D, Cartelle M, Eiros JM, Villanueva R. «Evaluation of Group B Streptococcus Differential Agar for detection and isolation of Streptococcus agalactiae.». Clinical Microbiology and Infection 2005; 11:676-678.
- ↑ Buchan BW, Faron ML, Fuller D, Davis TE, Mayne D, Ledeboer NA. «Multicenter Clinical Evaluation of the Xpert GBS LB Assay for Detection of Group B Streptococcus in Prenatal Screening Specimens. En ingles». J Clin Microbiol. 2015; 53: 443-448. doi:10.1128/JCM.02598-14.
- ↑ Daniels J, Gray J, Pattison H, Roberts T, Edwards E, Milner P, Spicer L, King E, Hills RK, Gray R, Buckley L, Magill L, Elliman N, Kaambwa B, Bryan S, Howard R, Thompson P, Khan KS. «Rapid testing for group B streptococcus during labour: a test accuracy study with evaluation of acceptability and cost-effectiveness. En ingles.». Health Technol Assess. 2009; 13; No.42. Archivado desde el original el 23 de febrero de 2016.
- ↑ Melin P. «Neonatal group B streptococcal disease: from pathogenesis to preventive strategies. En ingles». Clin Microbiol Infect. 2011; 17: 1294-1303.
- ↑ Berardi A, Lugli L, Baronciani D, Rossi C, Ciccia M, Creti R, Gambini L, Mariani S, Papa I, Tridapalli E, Vagnarelli F, Ferrari F; GBS Prevention Working Group of Emilia-Romagna. «Group B Streptococcus early-onset disease in Emilia-romagna: review after introduction of a screening-based approach.». Pediatr Infect Dis J. 2010; 29: 115-121.
- ↑ Schrag SJ, Verani JR. «Intrapartum antibiotic prophylaxis for the prevention of perinatal group B streptococcal disease: Experience in the United States and implications for a potential group B streptococcal vaccine. En ingles.». Vaccine. 2013; 31S: D20-26. doi:10.1097/AOG.0000000000000163.
- ↑ Pulver LS, Hopfenbeck MM, Young PC, Stoddard GJ, Korgenski K, Daly J, Byington CL. «Continued early onset group B streptococcal infections in the era of intrapartum prophylaxis.». J Perinatol. 2009; 29: 0-25. (en inglés). doi:10.1038/jp.2008.115.
- ↑ Heath PT, Balfour G, Weisner AM, Efstratiou A, Lamagni TL, Tighe H, O'Connell LA, Cafferkey M, Verlander NQ, Nicoll A, McCartney AC; PHLS Group B Streptococcus Working Group. «Group B streptococcal disease in UK and Irish infants younger than 90 days.». Lancet. 2004; 363: 292-294. (en inglés).
- ↑ a b Doare K, Heath PT. «An overview of global GBS epidemiology.». Vaccine.2013; 31 Suppl 4: D7-12. (en inglés). doi:10.1016/j.vaccine.2013.01.009.
- ↑ Brigtsen A.K. Jacobsen A.F. Dedi L. Melby K.K. Fugelseth D. Whitelaw A. «Maternal colonization with Group B Streptococcus Is associated with an increased rate of infants transferred to the neonatal intensive care unit.». Neonatology. 2015; 108: 157-163. (en inglés). doi:10.1159/000434716.
- ↑ Carbonell-Estrany X, Figueras-Aloy J, Salcedo-Abizanda S, de la Rosa-Fraile M, Castrillo Study Group. «Probable early-onset group B streptococcal neonatal sepsis: a serious clinical condition related to intrauterine infection.». Archives of Disease in Childhood. Fetal Neonatal Edition. 2008; 93: F85-89.
- ↑ Baker CJ. «The spectrum of perinatal group B streptococcal disease.». Vaccine 2013; 31s: D3-6. (en inglés). doi:10.1016/j.vaccine.2013.02.030.
- ↑ Lopez Sastre J, Fernandez Colomer B, Coto Cotallo Gil D, Members of “Grupo de Hospitales Castrillo". «An epidemiological study from the "Grupo de Hospitales Castrillo.». Early Human Development 2009; 85: S100. (en inglés). doi:10.1016/j.earlhumdev.2009.08.049.
- ↑ Andreu A, Sanfeliu I, Viñas L, Barranco M, Bosch J, Dopico E, Guardia C, Juncosa T, Lite J, Matas L, Sánchez F, Sierr M; Grupo de Microbiólogos pare el Estudio de las Infecciones de Transmissión Vertical, Societat Catalana de Malalties Infeccioses i Microbiologia Clínica,. «Declive de la incidencia de la sepsis perinatal por estreptococo del grupo B (Barcelona 1994-2001). Relación con las políticas profilácticas.». Enferm Infecc Microbiol Clin. 2003;21:174-179. EN ESPAÑOL. doi:10.1016/S0213-005X(03)72913-9.
- ↑ Sikias P, Biran V, Foix-L'Hélias L, Plainvert C, Boileau P, Bonacorsi S; EOS study group. (2023). «Early-onset neonatal sepsis in the Paris area: a population-based surveillance study from 2019 to 2021». Arch Dis Child Fetal Neonatal Ed . 108: 114-120. doi:10.1136/archdischild-2022-324080. Consultado el 7 de noviembre de 2023.
- ↑ Seale AC, Bianchi-Jassir F, Russell NJ, et al. (2017). «Estimates of the Burden of Group B Streptococcal Disease Worldwide for Pregnant Women, Stillbirths, and Children.». Clin Infect Dis. 65(suppl_2):S200-S219. 10.1093/cid/cix664. doi:10.1093/cid/cix664.
- ↑ a b Proma P., Goncalvez B.P., Le Doare k., Lawn E. (2023). «20 million pregnant women with group B streptococcus carriage: consequences, challenges, and opportunities for prevention». Curr Opin Pediatr 2023;35:223-30. 35: 223-230. doi:10.1097/MOP.0000000000001223. Consultado el 9 de noviembre de 2023.
- ↑ Raabe VN, Shane AL (2019). «Group B Streptococcus (Streptococcus agalactiae)». Microbiol Spectr 7: GPP3-0007-2018. doi:10.1128/microbiolspec.GPP3-0007-2018. Consultado el 16 de febrero de 2021.
- ↑ . Schrag SJ, Zywicki S, Farley MM, Reingold AL, Harrison LH, Lefkowitz LB, Hadler JL, Danila R, Cieslak PR, Schuchat A. «Group B streptococcal disease in the era of intrapartum antibiotic prophylaxis.». N Engl J Med. 2000; Jan 6;342(1):15-20. (en inglés). doi:10.1056/NEJM200001063420103.
- ↑ Centers for Disease Control and Prevention- CDC. «Prevention of Perinatal Group B Streptococcal Disease Revised Guidelines from CDC. 2002". Morbidity and Mortality Weekly Report. 51-RR11: 1-22.» (en inglés). Consultado el 10 de febrero de 2016.
- ↑ Centers for Disease Control and Prevention (CDC). «Perinatal group B streptococcal disease after universal screening recommendations--United States, 2003-2005.». MMWR Morb Mortal Wkly Rep. 2007; 56:701-7055. (en inglés).
- ↑ Sociedad Española de Obstetricia y Ginecología. «Recomendaciones para la prevención de la infección perinatal por estreptococo del grupo B». Prog Obstet Gynecol. 1998;41:431-5. EN ESPAÑOL.
- ↑ Sociedad Española de Obstetricia y Ginecología (SEGO). Sociedad Española de Neonatología (SEN). Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC). Sociedad Española de Quimioterapia (SEQ). Sociedad Española de Medicina Familiar y Comunitaria (SEMFYC). «Prevención de la infección perinatal por estreptococodel grupo B. Recomendaciones españolas revisadas.». Enferm Infecc Microbiol Clin. 2003; 21:417-423. PMID 14525707.
- ↑ Delgado S, García-Garrote F, Padilla B, Rodríguez Gómez JM, Romero B. (2015). «Diagnóstico microbiológico de la infección bacteriana asociada al parto y al puerperio.». Procedimientos en Microbiologia Clinica 54. Consultado el 17 de febrero de 2021.
- ↑ Group B Strep Support, Royal College of Obstetricians & Gynaecologists (2017). «Group B Streptococcus (GBS) in pregnancy and newborn babies». Group B Streptococcus (GBS) in pregnancy and newborn babies (en inglés). Consultado el 21 de febrero de 2021.
- ↑ UK GROUP B STREP SUPPORT (2018). «The cost of group B Strep infection».
- ↑ a b Ministerio de Salud de la Nación. Dirección Nacional de Salud Materno Infantil. Argentina,. «Recomendaciones para la prevención, diagnóstico y tratamiento de la infección neonatal precoz por Estreptococo β Hemolítico del Grupo B (EGB).». Consultado el 14 noviembre 2019..
- ↑ Ley 26.369 (2008). «Realización del examen de detección del estreptococo Grupo B Agalactiae, a todas las embarazadas con edad gestacional entre las semanas 35 y 37,». Consultado el 7 de noviembre de 2023.
- ↑ República de Colombia. Ministerio de Salud y Proteccion Social. (2018). «Resolucion 3280». Consultado el 7 de noviembre de 2023.
- ↑ Money D, Allen VM. (2018). «The Prevention of Early-Onset Neonatal Group B Streptococcal Disease.». J Obstet Gynaecol Can. 2018 :e665-e674. 10.1016/j.jogc.2018.05.032. (en inglés). doi:10.1016/j.jogc.2018.05.032. Consultado el 7 de noviembre de 2023.
- ↑ The Society of Obstetricians and Gynaecologists of Canada (SOGC). «Group B Streptococcus screening». Consultado el 7 de noviembre de 2023.
- ↑ Surbek D.Kommission für Qualitätssicherung der SGGG/gynécologie suisse. «Prophylaxe der frühen Neugeborenensepsis durch Streptokokken der Gruppe B-Prevention of early neonatal sepsis by GBS.». Gynäkol Geburtshilfliche Rundsch. 2007; 47: 103-104. (en aleman.).
- ↑ Leitlinien der Gesellschaft für Neonatologie und Pädiatrische Intensivmedizin (GNPI) Deutschen Gesellschaft für Gynäkologie und Geburtshilfe, Deutschen Gesellschaft für Pädiatrische Infektiologie (DGPI), und Deutsche Gesellschaft für Perinatale Medizin (DGPM). «Prophylaxe der Neugeborenensepsis - frühe Form - durch Streptokokken der Gruppe B» (en alemán). Archivado desde el original el 6 de julio de 2016. Consultado el 21 de febrero de 2021.
- ↑ Kotarski J, Heczko PB, Lauterbach R, Niemiec T, Leszczyńska- Gorzelak B. «Rekomendacje polskiego towarzystwa ginekologicznego dotyczące wykrywania nosicielstwa paciorkowców grupy B (GBS) u kobiet w ciąży i zapobiegania zakażeniom u noworodków--Recommendations Polish Gynecological Society for the detection of carriers of GBS in pregnant women and prevent infections in newborns..». Ginekol Pol 2008; 79: 221-223. (en polaco).
- ↑ A. Měchurová, V. Unzeitig, J. Mašata, P. Švihovec. «Diagnostika a léčba streptokoků skupiny B v těhotenství a za porodu - doporučený postup---Diagnosis and treatment of GBS in pregnancy and during birth - Recommendations.». Klin Mikrobiol Infekc Lek. 2013; 12: 11-14. (en checo.). Consultado el 7 de noviembre de 2023.
- ↑ Agence Nationale d’Accreditation et d’Evaluation en Santé. «Prévention anténatale du risque infectieux bactérien néonatal précoce. 2001.» (en frances.). Consultado el 7 de noviembre de 2023.
- ↑ Belgian Health Council (2003). «PREVENTION OF PERINATAL GROUP B STREPTOCOCCAL INFECTIONS Guidelines» (en ingles). Consultado el 7 de noviembre de 2023.
- ↑ Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG). «Preventie van neonatale groep-B-streptokokkenziekte (GBS- Ziekte). 2008.» (en holandés). Consultado el 14 de noviembre de 2019.
- ↑ Royal Australian and New Zealand College of Obstetricians and Gynaecologists. RANZCOG. «Maternal Group B Streptococcus (GBS) in Pregnancy: Screening and Management. July 2019.» (en ingles.). Consultado el 7 de noviembre de 2023.
- ↑ Peirotti MG; Gonzalez SE; Littvik AM; Vacaflor L; Kassar MA; Moreno S; Bottiglieri MT. «Infecciones por estreptococos grupo B en adultos excluyendo infecciones genitales.». Rev Argent Microbiol; 2002; 34: 226-229. EN ESPAÑOL. PMID 12600008.
- ↑ Farley MM. «Group B Streptococcal Disease in Nonpregnant Adults.». Clinical Infectious Diseases. 2001; 33: 556-561. (en iNGLES).
- ↑ Edwards MS,. Baker CJ. . «Group B streptococcal infections in elderly adults.». Clin Infect Dis. 2005; 41: 839-847. (en ingles.).
- ↑ Skoff TH, Farley MM, Petit S, Craig AS, Schaffner W, Gershman K, Harrison LH, Lynfield R, Mohle-Boetani J, Zansky S, Albanese BA, Stefonek K, Zell ER, Jackson D, Thompson T, Schrag SJ. «Increasing Burden of Invasive Group B Streptococcal Disease in Nonpregnant Adults, 1990-2007.». Clin Infect Dis. 2009; 49: 85-92. (en inglés). doi:10.1086/599369.
- ↑ a b Edwards MS, Rench MA, Rinaudo CD, Fabbrini M, Tuscano G, Buffi G, Bartolini E, Bonacci S, Baker CJ, Margarit I. (2016). «Immune Response to Invasive Group B Streptococcus Disease in Adults». Emerg Infect Dis. 22 (11): 1877-1883. doi:10.3201/eid2211.160914. Consultado el 7 de noviembre de 2023.
- ↑ a b Raabe VN, Shane AL. (2019). «Group B Streptococcus (Streptococcus agalactiae).». Microbiol Spectr. 2019;7(2). doi:10.1128/microbiolspec.GPP3-0007-2018. Consultado el 7 de noviembre de 2023.
- ↑ Ribas N , Arribas C, Murillas J. «Endocarditis tricuspídea por Streptococcus agalactiae. Descripción de un caso y revisión de la literatura.». Enf Infecc Microbiol Clin 2009; 27:191-194. doi:10.1016/j.eimc.2008.04.007.
- ↑ Collin SM, Shetty N, Guy R, Nyaga VN, Bull A, Richards MJ, van der Kooi TII, Koek MBG, De Almeida M, Roberts SA, Lamagni T. (2019). «Group B Streptococcus in surgical site and non-invasive bacterial infections worldwide: A systematic review and meta-analysis». Int J Infect Dis. 83: 116-129. doi:10.1016/j.ijid.2019.04.017. Consultado el 7 de noviembre de 2023.
- ↑ Graux E, Hites M, Martiny D, Maillar E, Delforge M, Melin P, Dauby N (2020). «Invasive group B Streptococcus among non-pregnant adults in Brussels-Capital Region, 2005–2019». Eur J Clin Microbiol Infect Dis: Sep 17;1-9. doi:10.1007/s10096-020-04041-0. Consultado el 17 de febrero de 2021.
- ↑ Collin SM, Shetty N, Lamagni T (2020). «Invasive Group B Streptococcus Infections in Adults, England, 2015-2016.». Emerging Infectious Diseases 26: 1174-1181. doi:10.3201/eid2606.191141. Consultado el 7 de noviembre de 2023.
- ↑ Juncosa-Morros T, Guardià-Llobet C, Bosch-Mestres J, Dopico-Ponte E, Sanfeliu-Sala I, Sierra-Soler M, Sánchez-Reus F, Giménez-Pérez M, Lite-Lite J, Andreu-Domingo A. «La infección neonatal tardía por Streptococcus agalactiae en el área de Barcelona (1996-2010).». Enferm Infecc Microbiol Clin. 2014; 32:574-378. EN ESPAÑOL. doi:10.1016/j.eimc.2013.09.012.
- ↑ a b Jordan HT, Farley MM, Craig A, Mohle-Boetani J, Harrison LH, Petit S, Lynfield R, Thomas A, Zansky S, Gershman K, Albanese BA, Schaffner W, Schrag SJ; Active Bacterial Core Surveillance (ABCs)/Emerging Infections Program Network, CDC . «Revisiting the need for vaccine prevention of late-onset neonatal group B streptococcal disease: a multistate, population-based analysis.». Pediatr Infect Dis J. 2008; 27: 1057-1064. (en ingles.). doi:10.1097/INF.0b013e318180b3b9.
- ↑ Baker CJ (2023). «Group B Streptococcal Vaccine — Sisyphus Reconciled». The New England Journal of Medicine 389: 275-277. doi:10.1056/NEJMe2306234.
- ↑ Carreras-Abad C, Ramkhelawon L, Heath PT, Le Doare K (2020). «A Vaccine Against Group B Streptococcus: Recent Advances.». Infect Drug Resist. 29: 1263-1272. doi:10.2147/IDR.S203454. Consultado el 18 de febrero de 2021.
- ↑ Song JY, Lim JH, Lim S, Yong Z, Seo HS. (2018). «Progress toward a group B streptococcal vaccine.». Hum Vaccin Immunother. 2018;14:2669-2681. doi:10.1080/21645515.2018.1493326. Consultado el 8 de noviembre de 2023.
- ↑
- ↑ Seale AC, Baker CJ, Berkley JA, Madhi SA, Ordi J, Saha SK6, Schrag SJ, Sobanjo-Ter Meulen A, Vekemans J. (2019). «Vaccines for maternal immunization against Group B Streptococcus disease: WHO perspectives on case ascertainment and case definitions». Vaccine. 2019 ;37:4877-4885. doi:10.1016/j.vaccine.2019.07.012. Consultado el 12 de noviembre de 2019.
- ↑ a b Davies HG, Carreras-Abad C, Le Doare K, Heath PT. (2019). «Group B Streptococcus: Trials and Tribulations.». Pediatr Infect Dis J. 2019 38(6S Suppl 1):S72-S76. doi:10.1097/INF.0000000000002328.
- ↑ Edwards MS, Gonik B. «Preventing the broad spectrum of perinatal morbidity and mortality through group B streptococcal vaccination.». Vaccine 2013; 31S: D66-71. (en ingles.). doi:10.1016/j.vaccine.2012.11.046.
- ↑ Delannoy CMJ, Crumlish M, Fontaine MC, Pollock J, Foster G, Dagleish MP, Turnbull JF, Zadoks RN. «Human Streptococcus agalactiae strains in aquatic mammal and fish.». BMC Microbiology 2013; 13: 41. (en ingles.). doi:10.1186/1471-2180-13-41.
- ↑ Ruegg PL (2017). «A 100-Year Review: Mastitis detection, management, and prevention.». J Dairy Sci. 2017;100:10381-10397. doi:10.3168/jds.2017-13023. Consultado el 10 de noviembre de 2019.
- ↑ Kabelitz T, Aubry E, van Vorst K, Amon T, Fulde M. (2021). «The Role of Streptococcus spp. in Bovine Mastitis.». Microorganisms 9: 1497. doi:10.3390/microorganisms9071497. Consultado el 9 de noviembre de 2023.
- ↑ Keefe, GP. «Streptococcus agalactiae mastitis: A review.». The Canadian veterinary journal 1997; 38: 429-37. (en inglés).
- ↑ Evans JJ, Klesius PH, Pasnik DJ, Bohnsack JF. «Human Streptococcus agalactiae isolate in Nile tilapia (Oreochromis niloticus).». Emerg Infect Dis. 2009; 15: 774-776. (en ingles.). doi:10.3201/eid1505.080222.
- ↑ Liu G, Zhang W, Lu C. . «Comparative genomics analysis of Streptococcus.». BMC Genomics. 2013; 14: 775. (en ingles.).
- ↑ Food and Agriculture Organization of the United Nations (2021). «RISK PROFILE Group B Streptococcus (GBS) Streptococcus agalactiae sequence type (ST) 283 in freshwater fish» (en ingles). Consultado el 9 de noviembre de 2023.
- ↑ Li LP, Wang R, Liang WW1, Huang T1, Huang Y2, Luo FG, Lei AY, Chen M, Gan X. «Development of live attenuated Streptococcus agalactiae vaccine for tilapia via continuous passage in vitro.». Fish Shellfish Immunol. 2015; 45: 955-963. (en ingles.). doi:10.1016/j.fsi.2015.06.014.
- ↑ Liu G, Zhu J, Chen K, Gao T, Yao H, Liu Y, Zhang W, Lu C. (2016). «Development of Streptococcus agalactiae vaccines for tilapia.». Dis Aquat Organ. (en inglés) 122 (2): 163-170. doi:10.3354/dao03084.
- ↑ Bashir S, Phuoc NN, Herath T, Basit A, Zadoks RN, Murdan S (2023). «An oral pH-responsive Streptococcus agalactiae vaccine formulation provides protective immunity to pathogen challenge in tilapia: A proof-of-concept study». PLoS ONE 18: e0278277. Consultado el 9 de noviembre de 2023.
