Tabla periódica de los elementos
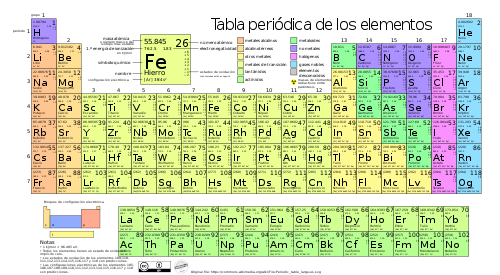
La tabla periódica de los elementos es una disposición de los elementos químicos en forma de tabla, ordenados por su número atómico (número de protones),[2] por su configuración de electrones y sus propiedades químicas. Este ordenamiento muestra tendencias periódicas como elementos con comportamiento similar en la misma columna.
En palabras de Theodor Benfey, la tabla y la ley periódica «son el corazón de la química —comparables a la teoría de la evolución en biología (que sucedió al concepto de la scala naturae), y a los principios de termodinámica en la física clásica—».[3]
Las filas de la tabla se denominan períodos y las columnas grupos.[4] Algunos grupos tienen nombres, así por ejemplo el grupo 17 es el de los halógenos y el grupo 18 el de los gases nobles.[5] La tabla también se divide en cuatro bloques con algunas propiedades químicas similares.[6] Debido a que las posiciones están ordenadas, se puede utilizar la tabla para obtener relaciones entre las propiedades de los elementos, o pronosticar propiedades de elementos nuevos todavía no descubiertos o sintetizados. La tabla periódica proporciona un marco útil para analizar el comportamiento químico y es ampliamente utilizada en química y otras ciencias.
Dmitri Mendeléyev publicó en 1869 la primera versión de tabla periódica que fue ampliamente reconocida, la desarrolló para ilustrar tendencias periódicas en las propiedades de los elementos entonces conocidos, al ordenar los elementos basándose en sus propiedades químicas,[7] si bien Julius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos.[8] Mendeléyev también pronosticó algunas propiedades de elementos entonces desconocidos que anticipó que ocuparían los lugares vacíos en su tabla. Posteriormente se demostró que la mayoría de sus predicciones eran correctas cuando se descubrieron los elementos en cuestión.
La tabla periódica de Mendeléyev ha sido desde entonces ampliada y mejorada con el descubrimiento o síntesis de elementos nuevos y el desarrollo de modelos teóricos nuevos para explicar el comportamiento químico. La estructura actual fue diseñada por Alfred Werner a partir de la versión de Mendeléyev. Existen además otros arreglos periódicos de acuerdo a diferentes propiedades y según el uso que se le quiera dar (en didáctica, geología, etc.).[9] Para celebrar el 150 aniversario de su creación, la UNESCO declaró 2019 como el Año Internacional de la Tabla Periódica de los Elementos Químicos.
Se han descubierto o sintetizado todos los elementos de número atómico del 1 (hidrógeno) al 118 (oganesón); la IUPAC confirmó los elementos 113, 115, 117 y 118 el 30 de diciembre de 2015,[10] y sus nombres y símbolos oficiales se hicieron públicos el 28 de noviembre de 2016.[1] Los primeros 94 existen naturalmente, aunque algunos solo se han encontrado en cantidades pequeñas y fueron sintetizados en laboratorio antes de ser encontrados en la naturaleza.[n. 1] Los elementos con números atómicos del 95 al 118 solo han sido sintetizados en laboratorios. Allí también se produjeron numerosos radioisótopos sintéticos de elementos presentes en la naturaleza. Los elementos del 95 a 100 existieron en la naturaleza en tiempos pasados, pero actualmente no.[11] La investigación para encontrar por síntesis nuevos elementos de números atómicos más altos continúa.
| Grupo | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| Bloque | s | d | p | |||||||||||||||
| ↓Período | ·El helio pertenece al bloque s | |||||||||||||||||
| 1 | 1 H |
2 He· | ||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
| 6 | 55 Cs |
56 Ba |
57-71 * |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
| 7 | 87 Fr |
88 Ra |
89-103 ** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og |
| 8 | 119 Uue |
|||||||||||||||||
| Bloque | f | d | |||||||||||||||
| * | Lantánidos | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |
|
| ** | Actínidos | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr |
|
| Leyenda | Estado de agregación de la materia a 0°C y 1 atm (Según el color del número atómico) | ||||
| 1 H |
<- Número atómico | Rojo | Azul | Negro | Gris |
| <- Símbolo químico | Gaseoso | Líquido | Sólido | Desconocido | |
| Metales | Metaloides | No metales | |||||||
| Alcalinos | Alcalino- térreos |
Lantánidos | Metales de transición |
Otros metales |
Otros no metales |
Halógenos | Gases nobles | ||
| Actínidos | |||||||||
Para una versión más detallada de la tabla periódica con hipertexto, consúltese Anexo:Tabla periódica.
Historia
La historia de la tabla periódica está muy relacionada con varios aspectos del desarrollo de la química y física:
- El descubrimiento de los elementos de la tabla periódica.
- El estudio de las propiedades comunes y la clasificación de los elementos.
- La noción de masa atómica (inicialmente denominada «peso atómico») y, posteriormente, ya en el siglo XX d. C., número másico.
- Las relaciones entre la masa atómica (y, más adelante, el número atómico) y las propiedades periódicas de los elementos y la aparición de nuevos elementos.
Descubrimiento de los elementos
Aunque algunos elementos como el oro (Au), plata (Ag), cobre (Cu), plomo (Pb) y mercurio (Hg) ya eran conocidos desde la antigüedad, el primer descubrimiento científico de un elemento ocurrió en el siglo XVII d. C., cuando el alquimista Hennig Brand descubrió el fósforo (P).[13] En el siglo XVIII d. C. se conocieron numerosos nuevos elementos, los más importantes de los cuales fueron los gases, con el desarrollo de la química neumática: oxígeno (O), hidrógeno (H) y nitrógeno (N). También se consolidó en esos años la nueva concepción de elemento, que condujo a Antoine Lavoisier a escribir su famosa lista de sustancias simples, donde aparecían 33 elementos. A principios del siglo XIX d. C., la aplicación de la pila eléctrica al estudio de fenómenos químicos condujo al descubrimiento de nuevos elementos, como los metales alcalinos y alcalino-térreos, sobre todo gracias a los trabajos de Humphry Davy. En 1830 ya se conocían 55 elementos. Posteriormente, a mediados del siglo XIX d. C., con la invención del espectroscopio, se descubrieron nuevos elementos, muchos de ellos nombrados por el color de sus líneas espectrales características: cesio (Cs, del latín caesĭus, azul), talio (Tl, de tallo, por su color verde), rubidio (Rb, rojo), etc. Durante el siglo XX d. C., la investigación en los procesos radioactivos llevó al descubrimiento en cascada de una serie de elementos pesados (casi siempre sustancias artificiales sintetizadas en laboratorio, con periodos de vida estable muy cortos), hasta alcanzar la cifra de 118 elementos con denominación oficialmente aceptados por la IUPAC en noviembre de 2016.[1]
Noción de elemento y propiedades periódicas
Lógicamente, un requisito previo necesario a la construcción de la tabla periódica era el descubrimiento de un número suficiente de elementos individuales, que hiciera posible encontrar alguna pauta en comportamiento químico y sus propiedades. Durante los siguientes dos siglos se fue adquiriendo un mayor conocimiento sobre estas propiedades, así como descubriendo muchos elementos nuevos.
La palabra «elemento» procede de la ciencia griega, pero su noción moderna apareció a lo largo del siglo XVII d. C., aunque no existe un consenso claro respecto al proceso que condujo a su consolidación y uso generalizado. Algunos autores citan como precedente la frase de Robert Boyle en su famosa obra El químico escéptico, donde denomina elementos «ciertos cuerpos primitivos y simples que no están formados por otros cuerpos, ni unos de otros, y que son los ingredientes de que se componen inmediatamente y en que se resuelven en último término todos los cuerpos perfectamente mixtos». En realidad, esa frase aparece en el contexto de la crítica de Robert Boyle a los cuatro elementos aristotélicos.
A lo largo del siglo XVIII d. C., las tablas de afinidad recogieron un nuevo modo de entender la composición química, que aparece claramente expuesto por Lavoisier en su obra Tratado elemental de química. Todo ello condujo a diferenciar en primer lugar qué sustancias de las conocidas hasta ese momento eran elementos químicos, cuáles eran sus propiedades y cómo aislarlas.
El descubrimiento de gran cantidad de elementos nuevos, así como el estudio de sus propiedades, pusieron de manifiesto algunas semejanzas entre ellos, lo que aumentó el interés de los químicos por buscar algún tipo de clasificación.
Los pesos atómicos
A principios del siglo XIX d. C., John Dalton (1766-1844) desarrolló una concepción nueva del atomismo, a la que llegó gracias a sus estudios meteorológicos y de los gases de la atmósfera. Su principal aportación consistió en la formulación de un «atomismo químico» que permitía integrar la nueva definición de elemento realizada por Antoine Lavoisier (1743-1794) y las leyes ponderales de la química (proporciones definidas, proporciones múltiples, proporciones recíprocas).
Dalton empleó los conocimientos sobre proporciones en las que reaccionaban las sustancias de su época y realizó algunas suposiciones sobre el modo como se combinaban los átomos de las mismas. Estableció como unidad de referencia la masa de un átomo de hidrógeno (aunque se sugirieron otros en esos años) y refirió el resto de los valores a esta unidad, por lo que pudo construir un sistema de masas atómicas relativas. Por ejemplo, en el caso del oxígeno, Dalton partió de la suposición de que el agua era un compuesto binario, formado por un átomo de hidrógeno y otro de oxígeno. No tenía ningún modo de comprobar este punto, por lo que tuvo que aceptar esta posibilidad como una hipótesis a priori.
Dalton sabía que una parte de hidrógeno se combinaba con siete partes (ocho, afirmaríamos en la actualidad) de oxígeno para producir agua. Por lo tanto, si la combinación se producía átomo a átomo, es decir, un átomo de hidrógeno se combinaba con un átomo de oxígeno, la relación entre las masas de estos átomos debía ser 1:7 (o 1:8 se calcularía en la actualidad). El resultado fue la primera tabla de masas atómicas relativas (o pesos atómicos, como los llamaba Dalton), que fue modificada y desarrollada en años posteriores. Las inexactitudes antes mencionadas dieron lugar a toda una serie de polémicas y disparidades respecto a las fórmulas y los pesos atómicos, que solo comenzarían a superarse, aunque no totalmente, en el congreso de Karlsruhe en 1860.
Primeros intentos de sistematización
En 1789 Antoine Lavoisier publicó una lista de 33 elementos químicos, agrupándolos en gases, metales, no metales y tierras.[14][15] Aunque muy práctica y todavía funcional en la tabla periódica moderna, fue rechazada debido a que había muchas diferencias tanto en las propiedades físicas como en las químicas.[cita requerida]
Los químicos pasaron el siglo siguiente buscando un esquema de clasificación más preciso. Uno de los primeros intentos para agrupar los elementos de propiedades análogas y relacionarlos con los pesos atómicos se debe al químico alemán Johann Wolfgang Döbereiner (1780-1849) quien en 1817 puso de manifiesto el notable parecido que existía entre las propiedades de ciertos grupos de tres elementos, con una variación gradual del primero al último. Posteriormente (1827) señaló la existencia de otros grupos en los que se daba la misma relación —cloro, bromo y yodo; azufre, selenio y telurio; litio, sodio y potasio—.
| Litio | LiCl LiOH |
Calcio | CaCl2 CaSO4 |
Azufre | H2S SO2 | ||||||
| Sodio | NaCl NaOH |
Estroncio | SrCl2 SrSO4 |
Selenio | H2Se SeO2 | ||||||
| Potasio | KCl KOH |
Bario | BaCl2 BaSO4 |
Telurio | H2Te TeO2 |
A estos grupos de tres elementos se los denominó tríadas. Al clasificarlas, Döbereiner explicaba que el peso atómico promedio de los pesos de los elementos extremos, es parecido al del elemento en medio.[16] Esto se conoció como la ley de Tríadas.[17] Por ejemplo, para la tríada cloro-bromo-yodo, los pesos atómicos son respectivamente 36, 80 y 127; el promedio es 81, que es aproximadamente 80; el elemento con el peso atómico aproximado a 80 es el bromo, lo cual hace que concuerde con el aparente ordenamiento de tríadas.
El químico alemán Leopold Gmelin trabajó con este sistema, y en 1843 había identificado diez tríadas, tres grupos de cuatro, y un grupo de cinco. Jean-Baptiste Dumas publicó el trabajo en 1857 que describe las relaciones entre los diversos grupos de metales. Aunque los diversos químicos fueron capaces de identificar las relaciones entre pequeños grupos de elementos, aún tenían que construir un esquema que los abarcara a todos.[16]
En 1857 el químico alemán August Kekulé observó que el carbono está a menudo unido a otros cuatro átomos. El metano, por ejemplo, tiene un átomo de carbono y cuatro átomos de hidrógeno.[18] Este concepto finalmente se conocería como «valencia».[19]
En 1862 de Chancourtois, geólogo francés, publicó una primera forma de tabla periódica que llamó la «hélice telúrica» o «tornillo». Fue la primera persona en notar la periodicidad de los elementos. Al disponerlos en espiral sobre un cilindro por orden creciente de peso atómico, de Chancourtois mostró que los elementos con propiedades similares parecían ocurrir a intervalos regulares. Su tabla incluye además algunos iones y compuestos. También utiliza términos geológicos en lugar de químicos y no incluye un diagrama; como resultado, recibió poca atención hasta el trabajo de Dmitri Mendeléyev.[20]
En 1864 Julius Lothar Meyer, un químico alemán, publicó una tabla con 44 elementos dispuestos por valencia. La misma mostró que los elementos con propiedades similares a menudo compartían la misma valencia.[21] Al mismo tiempo, William Odling —un químico inglés— publicó un arreglo de 57 elementos ordenados en función de sus pesos atómicos. Con algunas irregularidades y vacíos, se dio cuenta de lo que parecía ser una periodicidad de pesos atómicos entre los elementos y que esto estaba de acuerdo con «las agrupaciones que generalmente recibían».[22] Odling alude a la idea de una ley periódica, pero no siguió la misma.[23] En 1870 propuso una clasificación basada en la valencia de los elementos.[24]
Ley de las octavas de Newlands
El químico inglés John Newlands produjo una serie de documentos de 1863 a 1866 y señaló que cuando los elementos se enumeran en orden de aumentar el peso atómico, las propiedades físicas y químicas similares se repiten a intervalos de ocho.[n. 2]
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Li 6,9 Na 23,0 K 39,0 |
Be 9,0 Mg 24,3 Ca 40,0 |
B 10,8 Al 27,0 |
C 12,0 Si 28,1 |
N 14,0 P 31,0 |
O 16,0 S 32,1 |
F 19,0 Cl 35,5 |
Comparó esta periodicidad con las octavas de la música.[25][26] Esta llamada «ley de las octavas» fue ridiculizada por los contemporáneos de Newlands y la Chemical Society se negó a publicar su obra,[27] porque dejaba de cumplirse a partir del calcio. Newlands fue, sin embargo, capaz de elaborar una tabla de los elementos y la utilizó para predecir la existencia de elementos faltantes, como el germanio.[28] La Chemical Society solamente reconoció la importancia de sus descubrimientos cinco años después de que se le acreditaran a Mendeléyev,[29] y posteriormente fue reconocido por la Royal Society, que le concedió a Newlands su más alta condecoración, la medalla Davy.[30]
En 1867 Gustavus Hinrichs, un químico danés, publicó un sistema periódico en espiral sobre la base de los espectros, los pesos atómicos y otras similitudes químicas. Su trabajo fue considerado como demasiado complicado y por eso no fue aceptado.[31][32]
Tabla periódica de Mendeléyev

En 1869, el profesor de química ruso Dmitri Ivánovich Mendeléyev publicó su primera Tabla Periódica en Alemania. Un año después Julius Lothar Meyer[33] publicó una versión ampliada de la tabla que había creado en 1864, basadas en la periodicidad de los volúmenes atómicos en función de la masa atómica de los elementos.[34][35]
Por esta fecha ya eran conocidos 63 elementos de los 92 que existen de forma natural entre el Hidrógeno y el Uranio. Ambos químicos colocaron los elementos por orden creciente de sus masas atómicas, los agruparon en filas o periodos de distinta longitud y situaron en el mismo grupo elementos que tenían propiedades químicas similares, como la valencia. Construyeron sus tablas haciendo una lista de los elementos en filas o columnas en función de su peso atómico y comenzando una nueva fila o columna cuando las características de los elementos comenzaron a repetirse.[36]
El reconocimiento y la aceptación otorgada a la tabla de Mendeléyev vino a partir de dos decisiones que tomó. La primera fue dejar huecos cuando parecía que el elemento correspondiente todavía no había sido descubierto.[37] No fue el primero en hacerlo, pero sí en ser reconocido en el uso de las tendencias en su tabla periódica para predecir las propiedades de esos elementos faltantes.[38] Incluso pronosticó las propiedades de algunos de ellos: el galio (Ga), al que llamó eka-aluminio por estar situado debajo del aluminio; el germanio (Ge), al que llamó eka-silicio; el escandio (Sc); y el tecnecio (Tc), que, aislado químicamente a partir de restos de un sincrotrón en 1937, se convirtió en el primer elemento producido de forma predominantemente artificial.
La segunda decisión fue ignorar el orden sugerido por los pesos atómicos y cambiar los elementos adyacentes, tales como telurio y yodo, para clasificarlos mejor en familias químicas. En 1913, Henry Moseley determinó los valores experimentales de la carga nuclear o número atómico de cada elemento, y demostró que el orden de Mendeléyev corresponde efectivamente al que se obtiene de aumentar el número atómico.[39]
El significado de estos números en la organización de la tabla periódica no fue apreciado hasta que se entendió la existencia y las propiedades de los protones y los neutrones. Las tablas periódicas de Mendeléyev utilizan el peso atómico en lugar del número atómico para organizar los elementos, información determinable con precisión en ese tiempo. El peso atómico funcionó bastante bien para la mayoría de los casos permitiendo predecir las propiedades de los elementos que faltan con mayor precisión que cualquier otro método conocido entonces. Moseley predijo que los únicos elementos que faltaban entre aluminio (Z = 13) y oro (Z = 79) eran Z = 43, 61, 72 y 75, que fueron descubiertos más tarde. La secuencia de números atómicos todavía se utiliza hoy en día incluso, aunque se han descubierto y sintetizado nuevos elementos.[40]
Segunda tabla periódica de Mendeléyev y desarrollos posteriores

En 1871, Mendeléyev publicó su tabla periódica en una nueva forma, con grupos de elementos similares dispuestos en columnas en lugar de filas, numeradas I a VIII en correlación con el estado de oxidación del elemento. También hizo predicciones detalladas de las propiedades de los elementos que ya había señalado que faltaban, pero deberían existir.[41] Estas lagunas se llenaron posteriormente cuando los químicos descubrieron elementos naturales adicionales.[42]
En su nueva tabla consigna el criterio de ordenación de las columnas, las cuales se basan en los hidruros y óxidos que puede formar esos elementos y por tanto, implícitamente, las valencias de esos elementos. Aún seguía dando resultados contradictorios (Plata y Oro aparecen duplicados, y no hay separación entre berilio y magnesio con boro y aluminio), pero significó un gran avance. Esta tabla fue completada con un grupo más, constituido por los gases nobles descubiertos en vida de Mendeléyev, pero que, por sus características, no tenían cabida en la tabla, por lo que hubo de esperar casi treinta años, hasta 1904, con el grupo o valencia cero, quedando la tabla más completa.
A menudo se afirma que el último elemento natural en ser descubierto fue el francio —designado por Mendeléyev como eka-cesio— en 1939.[43] Sin embargo, el plutonio, producido sintéticamente en 1940, fue identificado en cantidades ínfimas como un elemento primordial de origen natural en 1971.[44]
La disposición de la tabla periódica estándar[45] es atribuible a Horace Groves Deming, un químico americano que en 1923 publicó una tabla periódica de 18 columnas.[46] En 1928 Merck and Company preparó un folleto con esta tabla, que fue ampliamente difundida en las escuelas estadounidenses. Por la década de 1930 estaba apareciendo en manuales y enciclopedias de química. También se distribuyó durante muchos años por la empresa Sargent-Welch Scientific Company.[47][48][49]
Mecánica cuántica y expansión progresiva de la tabla
La tabla periódica de Mendeléyev presentaba ciertas irregularidades y problemas. En las décadas posteriores tuvo que integrar los descubrimientos de los gases nobles, las «tierras raras» y los elementos radioactivos. Otro problema adicional eran las irregularidades que existían para compaginar el criterio de ordenación por peso atómico creciente y la agrupación por familias con propiedades químicas comunes. Ejemplos de esta dificultad se encuentran en las parejas telurio-yodo, argón-potasio y cobalto-níquel, en las que se hace necesario alterar el criterio de pesos atómicos crecientes en favor de la agrupación en familias con propiedades químicas semejantes.
Durante algún tiempo, esta cuestión no pudo resolverse satisfactoriamente hasta que Henry Moseley (1867-1919) realizó un estudio sobre los espectros de rayos X en 1913. Moseley comprobó que al representar la raíz cuadrada de la frecuencia de la radiación en función del número de orden en el sistema periódico se obtenía una recta, lo cual permitía pensar que este orden no era casual, sino reflejo de alguna propiedad de la estructura atómica. Hoy sabemos que esa propiedad es el número atómico (Z) o número de cargas positivas del núcleo.
La explicación que se acepta actualmente de la ley periódica surgió tras los desarrollos teóricos producidos en el primer tercio del siglo XX, cuando se construyó la teoría de la mecánica cuántica. Gracias a estas investigaciones y a desarrollos posteriores, se acepta que la ordenación de los elementos en el sistema periódico está relacionada con la estructura electrónica de los átomos de los diversos elementos, a partir de la cual se pueden predecir sus diferentes propiedades químicas.[50]
En 1945 Glenn Seaborg, un científico estadounidense, sugirió que los actínidos, como los lantánidos, estaban llenando un subnivel f en vez de una cuarta fila en el bloque d, como se pensaba hasta el momento. Los colegas de Seaborg le aconsejaron no publicar una teoría tan radical, ya que lo más probable era arruinar su carrera. Como consideraba que entonces no tenía una carrera que pudiera caer en descrédito, la publicó de todos modos. Posteriormente se encontró que estaba en lo cierto y en 1951 ganó el Premio Nobel de Química por su trabajo en la síntesis de los actínidos.[51][52][n. 3]
En 1952, el científico costarricense Gil Chaverri presentó una nueva versión basada en la estructura electrónica de los elementos, la cual permite ubicar las series de lantánidos y actínidos en una secuencia lógica de acuerdo con su número atómico.[54]
Aunque se producen de forma natural pequeñas cantidades de algunos elementos transuránicos,[11] todos ellos fueron descubiertos por primera vez en laboratorios, el primero de los cuales fue el neptunio, sintetizado en 1939. La producción de estos elementos ha expandido significativamente la tabla periódica.[55] Debido a que muchos son altamente inestables y decaen rápidamente, son difíciles de detectar y caracterizar cuando se producen. Han existido controversias relativas a la aceptación de las pretensiones y derechos de descubrimiento de algunos elementos, lo que requiere una revisión independiente para determinar cuál de las partes tiene prioridad, y por lo tanto los derechos del nombre. Flerovio (elemento 114) y livermorio (elemento 116) fueron nombrados el 31 de mayo de 2012.[56] En 2010, una colaboración conjunta entre Rusia y Estados Unidos en Dubná, región de Moscú, Rusia, afirmó haber sintetizado seis átomos de teneso (elemento 117).[57]
El 30 de diciembre de 2015 la IUPAC reconoció oficialmente los elementos 113, 115, 117, y 118, completando la séptima fila de la tabla periódica.[58] El 28 de noviembre de 2016 se anunciaron los nombres oficiales y los símbolos de los últimos cuatro nuevos elementos aprobados hasta la fecha por la IUPAC (Nh, nihonio; Mc, moscovio; Ts, teneso; y Og, oganesón),[1] que sustituyen a las designaciones temporales.
Estructura y organización de la tabla periódica
La tabla periódica actual es un sistema donde se clasifican los elementos conocidos hasta la fecha. Se colocan De izquierda a derecha y de arriba abajo en orden creciente de sus números atómicos. Los elementos están ordenados en siete hileras horizontales llamadas periodos, y en 18 columnas verticales llamadas grupos o familias.[59]
Hacia abajo y a la izquierda aumenta el radio atómico y el radio iónico.
Hacia arriba y a la derecha aumenta la energía de ionización, la afinidad electrónica y la electronegatividad.
Grupos

A las columnas verticales de la tabla se las conoce como grupos o familias. Hay 18 grupos en la tabla periódica estándar. En virtud de un convenio internacional de denominación, los grupos están numerados de 1 a 18 desde la columna más a la izquierda —los metales alcalinos— hasta la columna más a la derecha —los gases nobles—.[60]
Anteriormente se utilizaban números romanos según la última cifra del convenio de denominación de hoy en día —por ejemplo, los elementos del grupo 4 estaban en el IVB y los del grupo 14 en el IVA—. En Estados Unidos, los números romanos fueron seguidos por una letra «A» si el grupo estaba en el bloque s o p, o una «B» si pertenecía al d. En Europa, se utilizaban letras en forma similar, excepto que «A» se usaba si era un grupo precedente al 10, y «B» para el 10 o posteriores. Además, solía tratarse a los grupos 8, 9 y 10 como un único grupo triple, conocido colectivamente en ambas notaciones como grupo VIII. En 1988 se puso en uso el nuevo sistema de nomenclatura IUPAC y se desecharon los nombres de grupo previos.[61]
Algunos de estos grupos tienen nombres triviales —no sistemáticos—, como se ve en la tabla de abajo, aunque no siempre se utilizan. Los grupos del 3 al 10 no tienen nombres comunes y se denominan simplemente mediante sus números de grupo o por el nombre de su primer miembro —por ejemplo, «el grupo de escandio» para el 3—, ya que presentan un menor número de similitudes y/o tendencias verticales.[60]
La explicación moderna del ordenamiento en la tabla periódica es que los elementos de un grupo poseen configuraciones electrónicas similares y la misma valencia, entendida como el número de electrones en la última capa. Dado que las propiedades químicas dependen profundamente de las interacciones de los electrones que están ubicados en los niveles más externos, los elementos de un mismo grupo tienen propiedades químicas similares y muestran una tendencia clara en sus propiedades al aumentar el número atómico.[62]
Por ejemplo, los elementos en el grupo 1 tienen una configuración electrónica ns1 y una valencia de 1 —un electrón externo— y todos tienden a perder ese electrón al enlazarse como iones positivos de +1. Los elementos en el último grupo de la derecha son los gases nobles, los cuales tienen lleno su último nivel de energía —regla del octeto— y, por ello, son excepcionalmente no reactivos y son también llamados «gases inertes».
Los elementos de un mismo grupo tienden a mostrar patrones en el radio atómico, energía de ionización y electronegatividad. De arriba abajo en un grupo, aumentan los radios atómicos de los elementos. Puesto que hay niveles de energía más llenos, los electrones de valencia se encuentran más alejados del núcleo. Desde la parte superior, cada elemento sucesivo tiene una energía de ionización más baja, ya que es más fácil quitar un electrón en los átomos que están menos fuertemente unidos. Del mismo modo, un grupo tiene una disminución de electronegatividad desde la parte superior a la inferior debido a una distancia cada vez mayor entre los electrones de valencia y el núcleo.[63]
Hay excepciones a estas tendencias, como por ejemplo lo que ocurre en el grupo 11, donde la electronegatividad aumenta más abajo en el grupo.[64] Además, en algunas partes de la tabla periódica como los bloques d y f, las similitudes horizontales pueden ser tan o más pronunciadas que las verticales.[65][66][67]
Períodos
Las filas horizontales de la tabla periódica son llamadas períodos.[68] El número de niveles energéticos de un átomo determina el periodo al que pertenece. Cada nivel está dividido en distintos subniveles, que conforme aumenta su número atómico se van llenando en este orden:
|
Siguiendo esa norma, cada elemento se coloca según su configuración electrónica y da forma a la tabla periódica.
Los elementos en el mismo período muestran tendencias similares en radio atómico, energía de ionización, afinidad electrónica y electronegatividad. En un período el radio atómico normalmente decrece si nos desplazamos hacia la derecha debido a que cada elemento sucesivo añadió protones y electrones, lo que provoca que este último sea arrastrado más cerca del núcleo.[69] Esta disminución del radio atómico también causa que la energía de ionización y la electronegatividad aumenten de izquierda a derecha en un período, debido a la atracción que ejerce el núcleo sobre los electrones.[63] La afinidad electrónica también muestra una leve tendencia a lo largo de un período. Los metales —a la izquierda— generalmente tienen una afinidad menor que los no metales —a la derecha del período—, excepto para los gases nobles.[70]
La tabla periódica consta de 7 períodos:
Bloques
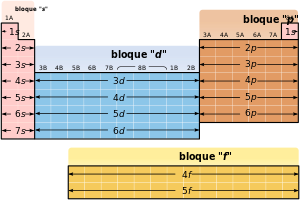
La tabla periódica se puede también dividir en bloques de acuerdo a la secuencia en la que se llenan las capas de electrones de los elementos. Cada bloque se denomina según el orbital en el que en teoría reside el último electrón: s, p, d y f.[71][n. 4] El bloque s comprende los dos primeros grupos (metales alcalinos y alcalinotérreos), así como el hidrógeno y el helio. El bloque p comprende los últimos seis grupos —que son grupos del 13 al 18 en la IUPAC (3A a 8A en América)— y contiene, entre otros elementos, todos los metaloides. El bloque d comprende los grupos 3 a 12 —o 3B a 2B en la numeración americana de grupo— y contiene todos los metales de transición. El bloque f, a menudo colocado por debajo del resto de la tabla periódica, no tiene números de grupo y se compone de lantánidos y actínidos.[72] Podría haber más elementos que llenarían otros orbitales, pero no se han sintetizado o descubierto; en este caso se continúa con el orden alfabético para nombrarlos. Así surge el bloque g, que es un bloque hipotético.
Metales, metaloides y no metales
De acuerdo con las propiedades físicas y químicas que comparten, los elementos se pueden clasificar en tres grandes categorías: metales, metaloides y no metales. Los metales son sólidos generalmente brillantes, altamente conductores que forman aleaciones de unos con otros y compuestos iónicos similares a sales con compuestos no metálicos —siempre que no sean los gases nobles—. La mayoría de los no metales son gases incoloros o de colores; pueden formar enlaces covalentes con otros elementos no metálicos. Entre metales y no metales están los metaloides, que tienen propiedades intermedias o mixtas.[73]
Metales y no metales pueden clasificarse en sub_categorías que muestran una gradación desde lo metálico a las propiedades no metálicas, de izquierda a derecha, en las filas: metales alcalinos —altamente reactivos—, metales alcalinotérreos —menos reactivos—, lantánidos y actínidos, metales de transición y metales post-transición. Los no metales se subdividen simplemente en no metales poliatómicos —que, por estar más cercanos a los metaloides, muestran cierto carácter metálico incipiente—, no metales diatómicos —que son esencialmente no metálicos— y los gases nobles, que son monoatómicos no metálicos y casi completamente inertes. Ocasionalmente también se señalan subgrupos dentro de los metales de transición, tales como metales refractarios y metales nobles.[74][75]
La colocación de los elementos en categorías y subcategorías en función de las propiedades compartidas es imperfecta. Hay un espectro de propiedades dentro de cada categoría y no es difícil encontrar coincidencias en los límites, como es el caso con la mayoría de los sistemas de clasificación.[76] El berilio, por ejemplo, se clasifica como un metal alcalinotérreo, aunque su composición química anfótera y su tendencia a formar compuestos covalentes son dos atributos de un metal de transición químicamente débil o posterior. El radón se clasifica como un no metal y un gas noble, aunque tiene algunas características químicas catiónicas más características de un metal. También es posible clasificar con base en la división de los elementos en categorías de sucesos, mineralógicos o estructuras cristalinas. La categorización de los elementos de esta forma se remonta a por lo menos 1869, cuando Hinrichs escribió que se pueden extraer líneas sencillas de límites para mostrar los elementos que tienen propiedades similares, tales como metales y no metales, o los elementos gaseosos.[77]
Otras formas de representar la tabla periódica
Variantes de la composición del grupo 3
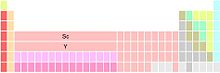
Hay tres variantes principales de la tabla periódica, cada una diferente en cuanto a la constitución del grupo 3. Escandio e itrio se muestran de manera uniforme, ya que son los dos primeros miembros de este grupo; las diferencias dependen de la identidad de los miembros restantes.[78]
El grupo 3 está formado por Sc, Y, y La, Ac. Lantano (La) y actinio (Ac) ocupan los dos puestos por debajo del itrio (Y). Esta variante es la más común.[79] Hace hincapié en las similitudes de las tendencias periódicas bajando los grupos 1, 2 y 3, a expensas de las discontinuidades en las tendencias periódicas entre los grupos 3 y 4 y la fragmentación de los lantánidos y actínidos.[80]
El grupo 3 está formado por Sc, Y, y Lu, Lr. Lutecio (Lu) y lawrencio (Lr) ocupan los dos puestos por debajo del itrio. Esta variante conserva un bloque f de 14 columnas de ancho, a la vez que desfragmenta a lantánidos y actínidos. Enfatiza las similitudes de tendencias periódicas entre el grupo 3 y los siguientes grupos a expensas de discontinuidades en las tendencias periódicas entre los grupos 2 y 3.[81]
El grupo 3 está formado por Sc, Y, y 15 lantánidos y 15 actínidos. Las dos posiciones por debajo de itrio contienen los lantánidos y los actínidos (posiblemente por notas al pie). Esta variante enfatiza las similitudes en la química de los 15 elementos lantánidos (La-Lu), a expensas de la ambigüedad en cuanto a los elementos que ocupan las dos posiciones por debajo de itrio del grupo 3, y aparentemente de un bloque f amplio de 15 columnas —solo puede haber 14 elementos en cualquier fila del bloque f—.[n. 5]
Las tres variantes se originan de las dificultades históricas en la colocación de los lantánidos de la tabla periódica, y los argumentos en cuanto a dónde empiezan y terminan los elementos del bloque f.[82][n. 6] Se ha afirmado que tales argumentos son la prueba de que «es un error de romper el sistema [periódico] en bloques fuertemente delimitados».[84] Del mismo modo, algunas versiones de la tabla dos marcadores han sido criticados por lo que implica que los 15 lantánidos ocupan la caja única o lugar por debajo de itrio,[85][n. 7] en violación del principio básico de «un lugar, un elemento».[n. 8]
Tablas periódicas con estructura diferente
La tabla periódica moderna a veces se expande a su forma larga o de 32 columnas restableciendo los elementos del bloque f a su posición natural entre los bloques s y d. A diferencia de la forma de 18 columnas, esta disposición da como resultado «el aumento sin interrupciones a la secuencia de los números atómicos».[87] También se hace más fácil ver la relación del bloque f con los otros bloques de la tabla periódica.[88] Jensen aboga por una forma de tabla con 32 columnas con base en que los lantánidos y actínidos son relegados en la mente de los estudiantes como elementos opacos y poco importantes que pueden ser puestos en cuarentena e ignorados.[89] A pesar de estas ventajas, los editores generalmente evitan la formulación de 32 columnas porque su relación rectangular no se adapta adecuadamente a la proporción de una página de libro.[90]

Los científicos discuten la eficiencia de cada modelo de tabla periódica. Muchos cuestionan incluso que la distribución bidimensional sea la mejor. Argumentan que se basa en una convención y en conveniencia, principalmente por la necesidad de ajustarlas a la página de un libro y otras presentaciones en el plano. El propio Mendeléyev no estaba conforme y consideró la distribución en espiral, sin suerte. Algunos argumentos en favor de nuevos modelos consisten en, por ejemplo, la ubicación del grupo de los lantánidos y de los actínidos fuera del cuerpo de la tabla, e incluso que el helio debería estar ubicado en el grupo 2 de los alcaniotérreos, pues comparte con ellos dos electrones en su capa externa.[91] Por ello con los años se han desarrollado otras tablas periódicas ordenadas en forma distinta, como por ejemplo en triángulo, pirámide, tablas en escalones, torre y en espiral.[9] A este último tipo corresponde la galaxia química, la espiral de Theodor Benfey[92] y la forma en espiral-fractal de Melinda E Green.[93] Se estima que se han publicado más de 700 versiones de la tabla periódica.[94]
Según Phillip Stewart, si Mendeléyev hubiera seguido desarrollando el modelo en espiral, hubiera podido predecir las propiedades de los halógenos. Utilizando esta idea, el propio Stewart creó una tabla periódica en espiral a la que dio en llamar «Galaxia química», en la que acomoda la longitud creciente de los períodos en los brazos de una galaxia en espiral.[91]
En palabras de Theodor Benfey, la tabla y la ley periódica
son el corazón de la química —comparables a lo que la teoría de la evolución en biología (que sucedió al concepto de la scala naturae) y los principios de termodinámica en la física clásica. Sin embargo, la tabla periódica estándar como se muestra en los salones de clase y se utiliza en los libros de texto siempre me pareció completamente insatisfactoria. Con sus lagunas de mamut en el primer y segundo períodos y las colecciones no unidas de lantánidos y actínidos flotantes por debajo de la tabla, la última impresión que un estudiante tendría sería el sentido de la periodicidad de un elemento.Theodor Benfey[3]

Su preocupación, pues, era estrictamente pedagógica. Por ese motivo diseñó una tabla periódica oval similar a un campo de fútbol que no mostraba saltos ni elementos flotantes.[3] Ordena los elementos en una espiral continua, con el hidrógeno en el centro y los metales de transición, los lantánidos y los actínidos ocupando las penínsulas.[95] No obstante, no se sintió satisfecho con el resultado, ya que no tenía espacio suficiente para los lantánidos. Por ello en un rediseño posterior creó una protrusión para hacerles sitio y lo publicó en 1964 en la revista de la que era redactor jefe, Chemistry (química), de la American Chemical Society. La tabla fue modificada para dejar abierta la posibilidad de acomodar nuevos elementos transuránicos que todavía no se habían detectado, cuya existencia había sido sugerida por Glenn Seaborg, así como otros cambios menores. La espiral de Benfey fue publicada en calendarios, libros de texto y utilizada por la industria química,[3] por lo cual se volvió popular.[96]
La tabla fractal se basa en la continuidad de las características del elemento al final de una fila con el que se encuentra al inicio de la siguiente, lo que sugiere que la distribución podría representarse mejor con un cilindro en lugar de fraccionar la tabla en columnas. Además, en algunos casos había muchas diferencias entre algunos elementos con números atómicos bajos. Por otra parte, la tabla incorpora la familia de los actínidos y los lantánidos al diseño general, ubicándolos en el lugar que les correspondería por número atómico, en lugar de mantenerlos separados en dos grupos flotantes al final como sucede en la tabla estándar. El resultado es que las familias, en lugar de seguir columnas, siguen arcos radiales. Esta tabla evidencia la periodicidad introduciendo horquillas en el inicio de los períodos de longitud 8, 18 y 32.[93]
La mayoría de las tablas periódicas son de dos dimensiones; sin embargo, se conocen tablas en tres dimensiones al menos desde 1862 (pre-data tabla bidimensional de Mendeléyev de 1869). Como ejemplos más recientes se puede citar la Clasificación Periódica de Courtines (1925),[97] el Sistema de Lámina de Wrigley (1949),[98] la hélice periódica de Giguère (1965)[99] y el árbol periódico de Dufour (1996).[100] Se ha descrito que la Tabla Periódica de Stowe (1989)[101] tiene cuatro dimensiones —tres espaciales y una de color—.[102]
Las diversas formas de tablas periódicas pueden ser consideradas como un continuo en la química-física.[103] Hacia el final del continuo químico se puede encontrar, por ejemplo, la Tabla Periódica Inorgánica de Rayner-Canham (2002),[104] que hace hincapié en las tendencias, patrones, relaciones y propiedades químicas inusuales. Cerca del final del continuo físico está la tabla periódica ampliada escalonada por la izquierda de Janet (1928). Tiene una estructura que muestra una relación más estrecha con el orden de llenado de electrones por capa y, por asociación, la mecánica cuántica.[105] En algún lugar en medio del continuo se ubica la tabla periódica estándar; se considera que expresa las mejores tendencias empíricas en el estado físico, la conductividad eléctrica y térmica, los números de oxidación, y otras propiedades fácilmente inferidas de las técnicas tradicionales del laboratorio químico.[106]
Datos adicionales y controversias
Elementos sin propiedades químicas conocidas
Los elementos 108 (hasio), 112 (copernicio) y 114 (flerovio) no tienen propiedades químicas conocidas. Otros elementos superpesados pueden comportarse de forma diferente a lo que se predice por extrapolación, debido a los efectos relativistas; por ejemplo, se predijo que el flerovio exhibiría posiblemente algunas propiedades similares a las de los gases nobles, aunque actualmente (2016) se coloca en el grupo del carbono.[107] Sin embargo, experimentos posteriores sugieren que se comporta químicamente como plomo, como se espera a partir de su posición de la tabla periódica.[108]
Otras extensiones de la tabla periódica
No está claro si los nuevos elementos encontrados continuarán el patrón de la tabla periódica estándar como parte del período 8 o se necesitará nuevos ajustes o adaptaciones. Seaborg espera que este periodo siga el patrón previamente establecido exactamente, de modo que incluiría un bloque s para los elementos 119 y 120, un nuevo bloque g para los próximos 18 elementos, y 30 elementos adicionales continuarían los bloques actuales f, d, y p.[109] Físicos tales como Pekka Pyykkö han teorizado que estos elementos adicionales no seguirían la regla de Madelung, que predice cómo se llenan las capas de electrones, situación que por lo tanto afectaría a la apariencia de la tabla periódica estándar.[110]
Elemento con el número atómico más alto posible
El número de posibles elementos no se conoce. En 1911 Elliot Adams, con base en la disposición de los elementos en cada fila de la tabla periódica horizontal, predijo que no existirían los elementos de peso atómico superior a 256 —lo que estaría entre los elementos 99 y 100 en términos de hoy en día—.[111] La estimación reciente más alta es que la tabla periódica puede terminar poco después de la isla de estabilidad,[112] que según se considere un modelo relativista o no se centrará alrededor de Z = 120 y N = 172 o Z = 124-126 y N = 184,[113] ya que la extensión de la tabla periódica está restringida por las líneas de goteo[n. 9] de protones y de neutrones.[114] Otras predicciones del fin de la tabla periódica incluyen al elemento 128 de John Emsley,[11] al elemento 137 de Richard Feynman,[115] y al elemento 155 de Albert Khazan.[11][n. 10]
- Modelo de Bohr
El modelo de Bohr, no relativista, exhibe dificultad para los átomos con número atómico superior a 137, ya que estos requerirían que los electrones 1s viajen más rápido que c, la velocidad de la luz, lo que lo vuelve inexacto y no se puede aplicar a estos elementos.[117]
- Ecuación relativista de Dirac
La ecuación relativista de Dirac tiene problemas para elementos con más de 137 protones. Para ellos, la función de onda del estado fundamental de Dirac es oscilatoria, y no hay diferencia entre los espectros de energía positivo y negativo, como en la paradoja de Klein.[118] Si se realizan cálculos más precisos, teniendo en cuenta los efectos del tamaño finito del núcleo, se encuentra que la energía de enlace excede el límite para los elementos con más de 173 protones. Para los elementos más pesados, si el orbital más interno (1s) no está lleno, el campo eléctrico del núcleo tira de un electrón del vacío, lo que resulta en la emisión espontánea de un positrón;[119] sin embargo, esto no sucede si el orbital más interno está lleno, de modo que el elemento 173 no es necesariamente el final de la tabla periódica.[115]
Colocación del hidrógeno y el helio
Solamente siguiendo las configuraciones electrónicas, el hidrógeno (configuración electrónica 1s1) y el helio (1s2) se colocan en los grupos 1 y 2, por encima de litio ([He]2s1) y berilio ([He]2s2).[71] Sin embargo, esta colocación se utiliza rara vez fuera del contexto de las configuraciones electrónicas: cuando los gases nobles —entonces llamados «gases inertes»— fueron descubiertos por primera vez alrededor de 1900, se los identificaba como «el grupo 0», lo que reflejaba que no se les conocía ninguna reactividad química en ese momento, y el helio se colocó en la parte superior de ese grupo, porque compartía esta situación extrema. Aunque el grupo cambió su número formal, muchos autores siguieron colocando al helio directamente por encima del neón, en el grupo 18; uno de los ejemplos de tal colocación es la tabla IUPAC actual.[120] Las propiedades químicas del hidrógeno no son muy cercanas a los de los metales alcalinos, que ocupan el grupo 1, y por eso el hidrógeno a veces se coloca en otra parte: una de las alternativas más comunes es en el grupo 17. Una de las razones para ello es la estrictamente univalente química predominantemente no metálica del hidrógeno, la del flúor —el elemento colocado en la parte superior del grupo 17— es estrictamente univalente y no metálica. A veces, para mostrar cómo el hidrógeno tiene tanto propiedades correspondientes a las de los metales alcalinos y a los halógenos, puede aparecer en dos columnas al mismo tiempo.[121] También puede aparecer por encima del carbono en el grupo 14: así ubicado, se adapta bien al aumento de las tendencias de los valores de potencial de ionización y los valores de afinidad de electrones, y no se aleja demasiado de la tendencia de electronegatividad.[122] Por último, el hidrógeno a veces se coloca por separado de cualquier grupo porque sus propiedades en general difieren de las de cualquier grupo: a diferencia del hidrógeno, los otros elementos del grupo 1 muestran un comportamiento extremadamente metálico; los elementos del grupo 17 comúnmente forman sales —de ahí el vocablo «halógeno»—; los elementos de cualquier otro grupo muestran una química multivalente. El otro elemento del periodo 1, el helio, a veces se coloca separado de cualquier grupo también.[123] La propiedad que distingue al helio del resto de los gases nobles —a pesar de que su extraordinario carácter inerte está muy cerca del neón y el argón—[124] es que, en su capa cerrada de electrones, el helio tiene solo dos electrones en el orbital más externo, mientras que el resto de los gases nobles tienen ocho.
Grupos incluidos en los metales de transición
Según IUPAC un metal de transición es «un elemento cuyo átomo tiene una subcapa d incompleta o que puede dar lugar a cationes».[125] De acuerdo con esta definición, todos los elementos en los grupos del 3 al 11 son metales de transición y se excluye al grupo 12, que comprende zinc, cadmio y mercurio.
Algunos químicos consideran que los «elementos del bloque d» y los «metales de transición» son categorías intercambiables, incluyendo por tanto al grupo 12 como un caso especial de metal de transición en el que los electrones d no participan normalmente en el enlace químico. El descubrimiento de que el mercurio puede utilizar sus electrones d en la formación de fluoruro de mercurio (IV) (HgF4) llevó a algunos científicos a sugerir que el mercurio puede ser considerado un metal de transición.[126] Otros, como Jensen, argumentan que la formación de un compuesto como HgF4 puede ocurrir solo bajo condiciones muy anormales. Como tal, el mercurio no puede ser considerado como un metal de transición por ninguna interpretación razonable en el sentido normal del término.[127]
En otros casos hay quienes no incluyen al grupo 3, argumentando que estos no forman iones con una capa d parcialmente ocupada y por lo tanto no presentan las propiedades características de la química de los metales de transición.[128]
Elementos en el grupo 3 del periodo 6 y 7
Aunque el escandio y el itrio son siempre los dos primeros elementos del grupo 3, la identidad de los próximos dos elementos no se resuelve. O bien son lantano y actinio, o lutecio y lawrencio. Existen argumentos físicos y químicos para apoyar esta última disposición,[82][129] pero no todos los autores están convencidos.[130]
Tradicionalmente se representa al lantano y al actinio como los restantes miembros del grupo 3.[131] Se ha sugerido que este diseño se originó en la década de 1940, con la aparición de las tablas periódicas que dependen de las configuraciones electrónicas de los elementos y la noción de la diferenciación de electrones.
Las configuraciones de cesio, bario y lantano son [Xe]6s1, [Xe]6s2 y [Xe]5d16s2. Por lo tanto el lantano tiene un electrón diferenciador 5d y esto lo establece «en el grupo 3 como el primer miembro del bloque d para el periodo 6».[132]
En el grupo 3 se ve un conjunto consistente de configuraciones electrónicas: escandio [Ar]3d14s2, itrio [Kr]4d15s2 y lantano. Aún en el período 6, se le asignó al iterbio una configuración electrónica de [Xe]4f135d16s2 y [Xe]4f145d16s2 para el lutecio, lo que resulta «en un electrón diferenciante 4f para el lutecio y lo establece firmemente como el último miembro del bloque f para el período 6.»[132] Matthias[133] describe la colocación del lantano en virtud del itrio como «un error en el sistema periódico —por desgracia propagado mayoritariamente por la compañía Welch [Sargent-Welch]... y ...todo el mundo la copió». Lavelle lo refutó aportando una serie de libros de referencia conocidos en los que se presentaban tablas periódicas con tal disposición.[134]
Las primeras técnicas para separar químicamente escandio, itrio y lutecio se basaron en que estos elementos se produjeron juntos en el llamado «grupo de itrio», mientras que La y Ac se produjeron juntos en el «grupo del cerio».[132] Por consiguiente, en los años 1920 y 30 algunos químicos colocaron el lutecio en el grupo 3 en lugar del lantano.[n. 11]
Posteriores trabajos espectroscópicos encontraron que la configuración electrónica de iterbio era de hecho [Xe]4f146s2. Esto significaba que iterbio y lutecio tenían 14 electrones f, «resultando en un electrón diferenciante d en lugar de f» para el último, lo que lo hacía un «candidato igualmente válido» para la siguiente posición de la tabla periódica en el grupo 3 debajo del itrio.[132] Varios físicos en los años 1950 y 60 optaron por lutecio, a la luz de una comparación de varias de sus propiedades físicas con las del lantano.[132] Esta disposición, en la que el lantano es el primer miembro del bloque f, es cuestionada por algunos autores, ya que este elemento carece de electrones f. Sin embargo, se ha argumentado que esta no es una preocupación válida dado que existen otras anomalías en la tabla periódica, como por ejemplo el torio, que no tiene electrones f, pero forma parte de ese bloque.[135] En cuanto al lawrencio, su configuración electrónica se confirmó en 2015 como [Rn]5f147s27p1, lo que representa otra anomalía de la tabla periódica, independientemente de si se coloca en el bloque d o f, pues la potencialmente aplicable posición de bloque p se ha reservado para el nihonio al que se le prevé una configuración electrónica de [Rn]5f146d107s27p1.[136]
Forma óptima
Las muchas formas diferentes de la tabla periódica han llevado a preguntarse si existe una forma óptima o definitiva. Se cree que la respuesta a esta pregunta depende de si la periodicidad química tiene una verdad subyacente, o es en cambio el producto de la interpretación humana subjetiva, dependiente de la circunstancias, las creencias y las predilecciones de los observadores humanos. Se podría establecer una base objetiva para la periodicidad química determinando la ubicación del hidrógeno y el helio, y la composición del grupo 3. En ausencia de una verdad objetiva, las diferentes formas de la tabla periódica pueden ser consideradas variaciones de la periodicidad química, cada una de las cuales explora y hace hincapié en diferentes aspectos, propiedades, perspectivas y relaciones de y entre los elementos. Se cree que la ubicuidad de la tabla periódica estándar es una consecuencia de su diseño, que tiene un equilibrio de características en términos de facilidad de construcción y tamaño, y su descripción de orden atómico y tendencias periódicas.[23][137]
Elementos
Estado de los elementos en condiciones normales de presión y temperatura (0 °C y 1 atm).
Gases
| Elemento | Símbolo | Grupo | Período | Átomo | Masa | Protones | Neutrones | Electrones |
|---|---|---|---|---|---|---|---|---|
| Hidrógeno | H | 1 | 1 | 1 | 1 | 1 | 0 | 1 |
| Nitrógeno | N | 15 | 2 | 7 | 14 | 7 | 7 | 7 |
| Oxígeno | O | 16 | 2 | 8 | 16 | 8 | 8 | 8 |
| Flúor | F | 17 | 2 | 9 | 19 | 9 | 10 | 9 |
| Cloro | Cl | 17 | 3 | 17 | 35 | 17 | 19 | 17 |
| Helio | He | 18 | 1 | 2 | 4 | 2 | 2 | 2 |
| Neón | Ne | 18 | 2 | 10 | 20 | 10 | 10 | 10 |
| Argón | Ar | 18 | 3 | 18 | 40 | 18 | 22 | 18 |
| Kriptón | Kr | 18 | 4 | 36 | 84 | 36 | 48 | 36 |
| Xenón | Xe | 18 | 5 | 54 | 131 | 54 | 77 | 54 |
| Radón | Rn | 18 | 6 | 86 | 222 | 86 | 136 | 86 |
Líquidos
| Elemento | Símbolo | Grupo | Período | Átomo | Masa | Protones | Neutrones | Electrones |
|---|---|---|---|---|---|---|---|---|
| Cesio | Cs | 1 | 6 | 55 | 133 | 55 | 78 | 55 |
| Francio | Fr | 1 | 7 | 87 | 223 | 87 | 136 | 87 |
| Mercurio | Hg | 12 | 6 | 80 | 201 | 80 | 121 | 80 |
| Galio | Ga | 13 | 4 | 31 | 70 | 31 | 39 | 31 |
| Bromo | Br | 17 | 4 | 35 | 80 | 35 | 45 | 35 |
Elementos de transición
| Elemento | Símbolo | Grupo | Período | Átomo | Masa | Protones | Neutrones | Electrones |
|---|---|---|---|---|---|---|---|---|
| Rutherfordio | Rf | 4 | 7 | 104 | 261 | 104 | 157 | 104 |
| Dubnio | Db | 5 | 7 | 105 | 262 | 105 | 157 | 105 |
| Seaborgio | Sg | 6 | 7 | 106 | 263 | 106 | 157 | 106 |
| Tecnecio | Tc | 7 | 5 | 43 | 99 | 43 | 56 | 43 |
| Bohrio | Bh | 7 | 7 | 107 | 262 | 107 | 155 | 107 |
| Hassio | Hs | 8 | 7 | 108 | 265 | 108 | 157 | 108 |
| Meitnerio | Mt | 9 | 7 | 109 | 266 | 109 | 157 | 109 |
| Darmstadtio | Ds | 10 | 7 | 110 | 271 | 110 | 161 | 110 |
| Roentgenio | Rg | 11 | 7 | 111 | 272 | 111 | 161 | 111 |
| Copernicio | Cn | 12 | 7 | 112 | 272 | 112 | 160 | 112 |
| Nihonio | Nh | 13 | 7 | 113 | 283 | 113 | 170 | 113 |
| Flerovio | Fl | 14 | 7 | 114 | 285 | 114 | 171 | 114 |
| Moscovio | Mc | 15 | 7 | 115 | 288 | 115 | 173 | 115 |
| Livermorio | Lv | 16 | 7 | 116 | 289 | 116 | 173 | 116 |
| Teneso | Ts | 17 | 7 | 117 | 291 | 117 | 174 | 117 |
| Oganesón | Og | 18 | 7 | 118 | 293 | 118 | 175 | 118 |
Elementos lantánidos y actínidos
| Elemento | Símbolo | Grupo | Período | Átomo | Masa | Protones | Neutrones | Electrones |
|---|---|---|---|---|---|---|---|---|
| Prometio | Pm | Lantánido | (-) | 61 | 147 | 61 | 86 | 61 |
| Neptunio | Np | Actínido | (-) | 93 | 237 | 93 | 144 | 93 |
| Plutonio | Pu | Actínido | (-) | 94 | 244 | 94 | 150 | 94 |
| Americio | Am | Actínido | (-) | 95 | 243 | 95 | 148 | 95 |
| Curio | Cm | Actínido | (-) | 96 | 247 | 96 | 151 | 96 |
| Berkelio | Bk | Actínido | (-) | 97 | 247 | 97 | 150 | 97 |
| Californio | Cf | Actínido | (-) | 98 | 251 | 98 | 153 | 98 |
| Einstenio | Es | Actínido | (-) | 99 | 252 | 99 | 153 | 99 |
| Fermio | Fm | Actínido | (-) | 100 | 257 | 100 | 157 | 100 |
| Mendelevio | Md | Actínido | (-) | 101 | 258 | 101 | 157 | 101 |
| Nobelio | No | Actínido | (-) | 102 | 259 | 102 | 157 | 102 |
| Laurencio | Lr | Actínido | (-) | 103 | 262 | 103 | 159 | 103 |
Sólidos alcalinos y alcalinotérreos
| Elemento | Símbolo | Grupo | Período | Átomo | Masa | Protones | Neutrones | Electrones |
|---|---|---|---|---|---|---|---|---|
| Litio | Li | Alcalino | 2 | 3 | 7 | 3 | 4 | 3 |
| Sodio | Na | Alcalino | 3 | 11 | 23 | 11 | 12 | 11 |
| Potasio | K | Alcalino | 4 | 19 | 39 | 19 | 20 | 19 |
| Rubidio | Rb | Alcalino | 5 | 37 | 86 | 37 | 49 | 37 |
| Berilio | Be | Alcalinotérreo | 2 | 4 | 9 | 4 | 5 | 4 |
| Magnesio | Mg | Alcalinotérreo | 3 | 12 | 24 | 12 | 12 | 12 |
| Calcio | Ca | Alcalinotérreo | 4 | 20 | 40 | 20 | 20 | 20 |
| Estroncio | Sr | Alcalinotérreo | 5 | 38 | 88 | 38 | 50 | 38 |
| Bario | Ba | Alcalinotérreo | 6 | 56 | 137 | 56 | 81 | 56 |
| Radio | Ra | Alcalinotérreo | 7 | 88 | 226 | 88 | 138 | 88 |
Sólidos de las familias del escandio, titanio, vanadio y cobre
| Elemento | Símbolo | Grupo | Período | Átomo | Masa | Protones | Neutrones | Electrones |
|---|---|---|---|---|---|---|---|---|
| Escandio | Sc | Escandio | 4 | 21 | 45 | 21 | 24 | 21 |
| Itrio | Y | Escandio | 5 | 39 | 89 | 39 | 50 | 39 |
| Lantano | La | Escandio | 6 | 57 | 139 | 57 | 82 | 57 |
| Actinio | Ac | Escandio | 7 | 89 | 227 | 89 | 138 | 89 |
| Titanio | Ti | Titanio | 4 | 22 | 48 | 22 | 26 | 22 |
| Circonio | Zr | Titanio | 5 | 40 | 91 | 40 | 51 | 40 |
| Hafnio | Hf | Titanio | 6 | 72 | 179 | 72 | 105 | 72 |
| Vanadio | V | Vanadio | 4 | 23 | 50 | 23 | 27 | 23 |
| Niobio | Nb | Vanadio | 5 | 41 | 93 | 41 | 52 | 41 |
| Tantalio | Ta | Vanadio | 6 | 73 | 181 | 73 | 108 | 73 |
| Cobre | Cu | Cobre | 4 | 29 | 64 | 29 | 35 | 29 |
| Plata | Ag | Cobre | 5 | 47 | 107 | 47 | 61 | 47 |
| Oro | Au | Cobre | 6 | 79 | 196 | 79 | 118 | 79 |
Véase también
- Alternativas de tablas periódicas
- Tabla periódica de los elementos ampliada
- Tabla periódica ampliada escalonada por la izquierda
- Tabla periódica de Miguel Catalán
- La tabla periódica de Dmitri Mendeléyev
- Nomenclatura química de los compuestos inorgánicos (para consultar los números de valencia de los elementos)
- Anexo:Elementos químicos por símbolo
- Anexo:Elementos químicos por orden alfabético
- Abundancia de los elementos químicos
- Nombres de los elementos
- Descubrimiento de los elementos químicos
- Anexo:Controversias sobre la denominación de los elementos
Notas
- ↑ Los elementos descubiertos inicialmente por síntesis y más tarde en la naturaleza son el tecnecio (43), el prometio (61), el ástato (85), el neptunio (93) y el plutonio (94).
- ↑ En esta época, los llamados gases nobles no habían sido aún descubiertos.
- ↑ Ya en 1892 se había postulado una tabla periódica extralarga con una segunda fila para dar cabida a los elementos conocidos y desconocidos con un peso atómico mayor de bismuto —torio, protactinio y uranio, por ejemplo—. La mayoría de los investigadores, sin embargo, consideró que estos elementos eran análogos a los del grupo 3 de transición —hafnio, tantalio y tungsteno—. La existencia de una segunda serie de transición interna, en forma de los actínidos, no fue aceptado hasta que establecieron similitudes con las estructuras electrónicas de los lantánidos.[53]
- ↑ Hay inconsistencias y algunas irregularidades en esta convención. Por ejemplo, el helio aparece en el bloque p, pero de hecho es un elemento del bloque s y, por ejemplo, la subcapa d en el bloque d se llena cuando se alcanza el bloque 11, en lugar del 12.
- ↑ Housecroft C. E. & Sharpe A. G. (2008). Inorganic Chemistry (3ra ed.; en inglés).
- ↑ Se atribuye al químico checo Bohuslav Brauner la separación de los lantánidos desde el cuerpo principal de la tabla periódica quien, en 1902, asigna todos ellos ("Ce, etc.") a una posición en el grupo 4, por debajo de circonio. Esta disposición se conoce como la «hipótesis de asteroides», en analogía con los asteroides que ocupan una sola órbita en el sistema solar. Antes de eso los lantánidos fueron en general (y con éxito) colocados a lo largo de los grupos I a VIII en la forma más antigua de la tabla periódica, de 8 columnas. Aunque se registran predecesores del arreglo de Brauner desde 1895, se sabe que se han referido a la «química de los asteroides» en una carta de 1881 a Mendeleev. Otros autores asignan todos los lantánidos al grupo 3, los grupos 3 y 4, o los grupos 2, 3 y 4. En 1922 Niels Bohr continuó el proceso de desprendimiento mediante la localización de los lantánidos entre los bloques s y d. En 1949 Glenn T. Seaborg presenta la forma de tabla periódica que es popular hoy en día, en la que lantánidos y actínidos aparecen como notas al pie. Publicó por primera vez su tabla en un informe clasificado en 1944. Fue publicado de nuevo por él en 1945 en Chemical and Engineering News, y en 1949 varios autores comentaron, y en general estuvieron de acuerdo con, su propuesta. En ese año se observó que el mejor método de presentar los actínidos parecía ser colocándolos a continuación, y como análogos de los lantánidos.[82][83]
- ↑ Jensen escribe: «Los dos cuadros bajo Sc e Y ...o contienen los números atómicos 57-71 y 89-103 o los símbolos de La-Lu y Ac-Lr, respectivamente, lo que indica que los 30 elementos en la nota al pie solo pertenecen a esas dos cajas. La ampliación de dicha tabla en una de 32 columnas requeriría estirar las cajas de Sc e Y para que abarquen todos los 15 de las columnas insertadas.»
- ↑ Habashi intenta superar esta objeción mediante la colocación de los 15 lantánidos en una torre de gran altura de 15 plantas que se eleva desde la posición de la tabla periódica por debajo del itrio.[86]
- ↑ Para cada masa atómica existe una cantidad máxima de protones y otra de neutrones que pueden mantenerse unidos. Si se realiza un diagrama de Segrè con esta información se obtienen dos líneas, a las que se denomina «líneas de goteo» de protones y neutrones respectivamente, porque si se agregan más nucleidos se escurrirían o gotearían sin unirse al núcleo en forma permanente.[113]
- ↑ P. J. Karol sostiene que los efectos gravitacionales podrían llegar a ser significativos cuando los números atómicos se vuelvan astronómicamente grandes, superando de esta manera otros fenómenos de inestabilidad generados por la gran masa de los núcleos, y que las estrellas de neutrones —con números atómicos del orden de 1021— podrían considerarse como la representación de los elementos más pesados conocidos en el universo.[116]
- ↑ El fenómeno de la separación en grupos distintos es causado por el incremento de la basicidad con el aumento del radio, y no constituye una razón fundamental para mostrar al lutecio debajo del itrio en lugar del lantano. Así, entre los metales alcalinotérreos del grupo 2, el magnesio —menos básico— pertenece al «grupo soluble» y calcio, estroncio y bario —más básicos— están en el «grupo del carbonato de amonio». Sin embargo, rutinariamente se los coloca a todos en el mismo grupo.
Referencias
- ↑ a b c d «IUPAC». Periodic Table of Elements (30 de noviembre de 2016) (en inglés). Consultado el 30 de noviembre de 2016. «Cuatro nuevos elementos aprobados oficialmente por la IUPAC: Nh, Mc, Ts y Og.»
- ↑ Klein, Cornelis; Hurlbut, Cornelius S. (1996). Manual de mineralogía. Reverte. ISBN 9788429146066. Consultado el 5 de febrero de 2018.
- ↑ a b c d Benfey, Theodor (2009). «The biography of a periodic spiral:from Chemistry Magazine, via Industry, to a Foucalt Pendulum». Bull. Hist. Chem. (en inglés) 34 (2): 141-145. Consultado el 8 de febrero de 2016.
- ↑ Atkins, Peter; Jones, Loretta (2006). crackPA20&dq=filas+de+la+tabla+se+denominan+per%C3%ADodo&hl=es&sa=X&ved=0ahUKEwjiybnTlI_ZAhWIxRQKHbuUBCsQ6AEIKTAA#v=onepage&q=filas%20de%20la%20tabla%20se%20denominan%20per%C3%ADodo&f=false Principios de química: los caminos del descubrimiento. Ed. Médica Panamericana. ISBN 9789500600804. Consultado el 5 de febrero de 2018.
- ↑ Atkins, Peter; Jones, Loretta (2006). Principios de química: los caminos del descubrimiento. Ed. Médica Panamericana. ISBN 9789500600804. Consultado el 5 de febrero de 2018.
- ↑ Loyola, María Dolores de la Llata (2001). Química inórganica. Editorial Progreso. ISBN 9789706413512. Consultado el 5 de febrero de 2018.
- ↑ Bernardo Herradón: La química y su relación con otras ciencias Journal of Feelsynapsis (JoF). ISSN 2254-3651. 2011.(1): 81-86
- ↑ Therald Moeller: Química inorgánica: nueva versión puesta al día., p. 108, en Google Libros
- ↑ a b Ham, Becky (2008). The Periodic Table (en inglés). Nueva York: Infobase Pub. pp. 27-28. ISBN 9781438102382. Consultado el 8 de febrero de 2016.
- ↑ «La tabla periódica se completa con cuatro nuevos elementos químicos». El Mundo. 4 de enero de 2016.
- ↑ a b c d Emsley, J. (2011). Nature's Building Blocks: An A-Z Guide to the Elements (en inglés). Nueva York, NY: Oxford University Press. ISBN 978-0-19-960563-7.
- ↑ Tabla periódica de los elementos
- ↑ Fenómenos Químicos Escrito por Carlos Arturo Correa Maya en Google Libros
- ↑ Siegfried, R. (2002). From elements to atoms a history of chemical composition. Philadelphia, Pennsylvania: Library of Congress Cataloging-in-Publication Data. p. 92. ISBN 0-87169-924-9.
- ↑ Jiménez, Javier (8 de febrero de 2016). «Dmitri Mendeléyev, el hombre que ordenó los elementos». Consultado el 5 de febrero de 2018.
- ↑ a b Ball, p. 100.
- ↑ Horvitz, L. (2002). Eureka!: Scientific Breakthroughs that Changed the World. Nueva York: John Wiley. p. 43. ISBN 978-0-471-23341-1. OCLC 50766822.
- ↑ Aug. Kekulé (1857). «Über die s. g. gepaarten Verbindungen und die Theorie der mehratomigen Radicale». Annalen der Chemie und Pharmacie 104 (2): 129-150. doi:10.1002/jlac.18571040202.
- ↑ van Spronsen, J. W. (1969). The periodic system of chemical elements. Amsterdam: Elsevier. p. 19. ISBN 0-444-40776-6.
- ↑ «Alexandre-Emile Bélguier de Chancourtois (1820-1886)» (en francés). Annales des Mines history page. Consultado el 18 de septiembre de 2014.
- ↑ Venable, pp. 85-86; 97.
- ↑ Odling, W. (2002). «On the proportional numbers of the elements». Quarterly Journal of Science (en inglés) 1: 642-648 (643).
- ↑ a b Scerri, E. (2011). The periodic table: A very short introduction (en inglés). Oxford: Oxford University Press. ISBN 978-0-19-958249-5.
- ↑ Kaji, M. (2004). «Discovery of the periodic law: Mendeleev and other researchers on element classification in the 1860s». En Rouvray, D. H.; King, R. Bruce, eds. The periodic table: Into the 21st Century (en inglés). Research Studies Press. pp. 91-122 (95). ISBN 0-86380-292-3.
- ↑ Newlands, J. A. R. (20 de agosto de 1864). «On Relations Among the Equivalents». Chemical News (en inglés) 10: 94-95.
- ↑ Newlands, J. A. R. (18 de agosto de 1865). «On the Law of Octaves». Chemical News (en inglés) 12: 83.
- ↑ Bryson, B. (2004). A Short History of Nearly Everything (en inglés). Black Swan. pp. 141-142. ISBN 978-0-552-15174-0.
- ↑ Scerri 2007, p. 306.
- ↑ Brock, W. H.; Knight, D. M. (1965). «The Atomic Debates: 'Memorable and Interesting Evenings in the Life of the Chemical Society'». Isis (en inglés) ([[The University of Chicago Press]]) 56 (1): 5-25. doi:10.1086/349922.
- ↑ «Davy Medal». royalsociety.org (en inglés británico). Consultado el 2 de junio de 2018.
- ↑ Scerri 2007, pp. 87, 92.
- ↑ Kauffman, G. B. (marzo de 1969). «American forerunners of the periodic law». Journal of Chemical Education (en inglés) 46 (3): 128-135 (132). Bibcode:1969JChEd..46..128K. doi:10.1021/ed046p128.
- ↑ Mendelejew, D. (1869). «Über die Beziehungen der Eigenschaften zu den Atomgewichten der Elemente». Zeitschrift für Chemie (en alemán): 405-406.
- ↑ Química 1. Escrito por J. Eduardo Martínez Márquez en Google Libros
- ↑ Venable, pp. 96-97; 100-102.
- ↑ Ball, pp. 100-102.
- ↑ Pullman, B. (1998). The Atom in the History of Human Thought (en inglés). Translated by Axel Reisinger. Oxford University Press. p. 227. ISBN 0-19-515040-6.
- ↑ Ball, p. 105.
- ↑ Atkins, P. W. (1995). The Periodic Kingdom (en inglés). HarperCollins Publishers, Inc. p. 87. ISBN 0-465-07265-8.
- ↑ Samanta, C.; Chowdhury, P. Roy; Basu, D. N. (2007). «Predictions of alpha decay half lives of heavy and superheavy elements». Nucl. Phys. A (en inglés) 789: 142-154. Bibcode:2007NuPhA.789..142S. arXiv:nucl-th/0703086. doi:10.1016/j.nuclphysa.2007.04.001.
- ↑ Scerri 2007, p. 112.
- ↑ Kaji, M. (2002). «D.I. Mendeleev's Concept of Chemical Elements and the Principle of Chemistry». Bull. Hist. Chem. (en inglés) (Tokyo Institute of Technology) 27 (1): 4-16. Consultado el 13 de febrero de 2016.
- ↑ Adloff, J-P.; Kaufman, G. B. (25 de septiembre de 2005). «Francium (Atomic Number 87), the Last Discovered Natural Element» (en inglés). The Chemical Educator. Archivado desde el original el 4 de junio de 2013. Consultado el 13 de febrero de 2016.
- ↑ Hoffman, D. C.; Lawrence, F. O.; Mewherter, J. L.; Rourke, F. M. (1971). «Detection of Plutonium-244 in Nature». Nature (en inglés) 234 (5325): 132-134. Bibcode:1971Natur.234..132H. doi:10.1038/234132a0.
- ↑ Gray, p. 12.
- ↑ Deming, H. G. (1923). General chemistry: An elementary survey (en inglés). Nueva York: J. Wiley & Sons. pp. 160, 165.
- ↑ Abraham, M; Coshow, D; Fix, W. Periodicity:A source book module, version 1.0. Nueva York: Chemsource, Inc. p. 3. Archivado desde el original el 14 de mayo de 2012.
- ↑ Emsley, J (7 de marzo de 1985). «Mendeleyev's dream table». New Scientist (en inglés): 36.
- ↑ Fluck, E (1988). «New notations in the period table». Pure & Applied Chemistry (en inglés) 60 (3): 432. doi:10.1351/pac198860030431.
- ↑ Ball, p. 111.
- ↑ Scerri 2007, pp. 270-71.
- ↑ Masterton, W. L.; Hurley, C. N.; Neth, E. J. (2012). Chemistry: Principles and reactions (7th edición). Belmont, CA: Brooks/Cole Cengage Learning. p. 173. ISBN 1-111-42710-0.
- ↑ van Spronsen, J. W. (1969). The periodic system of chemical elements. Amsterdam: Elsevier. pp. 315-316, ISBN 0-444-40776-6.
- ↑ «Periodic table by Dr. Gil Chaverri (1921-2005), University of Costa Rica» (en inglés). 1951. Archivado desde el original el 22 de octubre de 2013. Consultado el 13 de febrero de 2016.
- ↑ Ball, p. 123.
- ↑ Barber, R. C.; Karol, P. J; Nakahara, Hiromichi; Vardaci, Emanuele; Vogt, E. W. (2011). «Discovery of the elements with atomic numbers greater than or equal to 113 (IUPAC Technical Report)». Pure Appl. Chem. 83 (7): 1485. doi:10.1351/PAC-REP-10-05-01.
- ↑ «ru:Эксперимент по синтезу 117-го элемента получает продолжение» [Experiment on sythesis of the 117th element is to be continued] (en ruso). JINR. 2012.
- ↑ «Periodic table's seventh row finally filled as four new elements are added». The Guardian. 3 de enero de 2016. Consultado el 13 de febrero de 2016.
- ↑ Química I Primer Semestre Tacaná. Escrito por Iger, p. 223, en Google Libros
- ↑ a b Leigh, G. J. (1990). Nomenclature of Inorganic Chemistry: Recommendations 1990 (en inglés). Blackwell Science. ISBN 0-632-02494-1.
- ↑ International Union of Pure and Applied Chemistry (1988). «New Anotations in the Periodic Table». Pure&Appl. Chem. (en inglés) (Gran Bretaña) 60 (3): 431-436.
- ↑ Messler, R. W. (2010). The essence of materials for engineers (en inglés). Sudbury, MA: Jones & Bartlett Publishers. p. 32. ISBN 0-7637-7833-8.
- ↑ a b Moore, J. (2003). Chemistry for Dummies (en inglés). Nueva York: Wiley Publications. p. 111. ISBN 978-0-7645-5430-8.
- ↑ Greenwood & Earnshaw, p. 30.
- ↑ Bagnall, K. W. (1967). «Recent advances in actinide and lanthanide chemistry». En Fields, P. R.; Moeller, T., eds. Advances in chemistry, Lanthanide/Actinide chemistry. Advances in Chemistry (en inglés) 71. American Chemical Society. pp. 1-12. ISBN 0-8412-0072-6. doi:10.1021/ba-1967-0071.
- ↑ Day, M. C., Jr.; Selbin, J. (1969). Theoretical inorganic chemistry (en inglés) (2da edición). Nueva York: Nostrand-Rienhold Book Corporation. p. 103. ISBN 0-7637-7833-8.
- ↑ Holman, J.; Hill, G. C. (2000). Chemistry in context (en inglés) (5th edición). Walton-on-Thames: Nelson Thornes. p. 40. ISBN 0-17-448276-0.
- ↑ Stoker, S. H. (2007). General, organic, and biological chemistry (en inglés). Nueva York: Houghton Mifflin. p. 68. ISBN 978-0-618-73063-6. OCLC 52445586.
- ↑ Mascetta, J. (2003). Chemistry The Easy Way (en inglés) (4th edición). Nueva York: Hauppauge. p. 50. ISBN 978-0-7641-1978-1. OCLC 52047235.
- ↑ Kotz, J.; Treichel, P.; Townsend, John (2009). Chemistry and Chemical Reactivity, Volume 2 (en inglés) (7th edición). Belmont: Thomson Brooks/Cole. p. 324. ISBN 978-0-495-38712-1. OCLC 220756597.
- ↑ a b Gray, p. 12.
- ↑ Jones, C. (2002). d- and f-block chemistry (en inglés). Nueva York: J. Wiley & Sons. p. 2. ISBN 978-0-471-22476-1. OCLC 300468713.
- ↑ Silberberg, M. S. (2006). Chemistry: The molecular nature of matter and change (en inglés) (4th edición). Nueva York: McGraw-Hill. p. 536. ISBN 0-07-111658-3.
- ↑ Manson, S. S.; Halford, G. R. (2006). Fatigue and durability of structural materials (en inglés). Materials Park, Ohio: ASM International. p. 376. ISBN 0-87170-825-6.
- ↑ Bullinger, H-J. (2009). Technology guide: Principles, applications, trends (en inglés). Berlín: Springer-Verlag. p. 8. ISBN 978-3-540-88545-0.
- ↑ Jones, B. W. (2010). Pluto: Sentinel of the outer solar system (en inglés). Cambridge: Cambridge University Press. pp. 169-71. ISBN 978-0-521-19436-5.
- ↑ Hinrichs, G. D. (1869). «On the classification and the atomic weights of the so-called chemical elements, with particular reference to Stas's determinations». Proceedings of the American Association for the Advancement of Science (en inglés) 18 (5): 112-124.
- ↑ Clark, R. W.; White, G. D. (2008). «The Flyleaf Periodic Table». Journal of Chemical Education 85 (4): 497. doi:10.1021/ed085p497.
- ↑ Myers, R. T.; Oldham, K. B.; S., Tocci (2004). Holt Chemistry. Orlando: Holt, Rinehart and Winston. p. 130. ISBN 0-03-066463-2.
- ↑ Atkins et al. (2006). Shriver & Atkins Inorganic Chemistry (4ta ed.). Oxford: Oxford University Press; en inglés.
- ↑ Rayner-Canham G. & Overton T. (2013). Descriptive Inorganic Chemistry (6ta ed.; en inglés).
- ↑ a b c Thyssen, P.; Binnemans, K (2011). «Accommodation of the Rare Earths in the Periodic Table: A Historical Analysis». En Gschneidner Jr., K.A.; Bünzli, J-C.G; Vecharsky, Bünzli, eds. Handbook on the Physics and Chemistry of Rare Earths 41 (Amsterdam: Elsevier). pp. 1-94. ISBN 978-0-444-53590-0.
- ↑ Seaborg, G. T. (1994). «Origin of the Actinide Concept.» En K. A. Gschneider Jr. (ed). Handbook on the Physics and Chemistry of the Rare Earths. 18. Amsterdam: Elsevier, pp. 1-27.
- ↑ Stewart, P. J. (2008). «The Flyleaf Table: An Alternative». Journal of Chemical Education 85 (11): 1490. doi:10.1021/ed085p1490.
- ↑ Jensen, W. B. (2008). «The Periodic Table: Facts or Committees?». Journal of Chemical Education 85 (11): 1491-1492. doi:10.1021/ed085p1491.2.
- ↑ Habashi F. (2015). 'A New Look at the Periodic Table' Archivado el 25 de diciembre de 2015 en Wayback Machine.. European Chemical Bulletin 4(1):p. 5; en inglés.
- ↑ Scerri, E. A Tale of 7 Elements. Oxford: Oxford University Press. ISBN 978-0-19-539131-2.
- ↑ Newell, S. B. (2013). Chemistry: An introduction (en inglés). Boston: Little, Brown and Company. p. 196. ISBN 978-0-19-539131-2.
- ↑ Jensen, W. B. (1982). «Classification, Symmetry and the Periodic Table». Computers & Mathematics with Applications (en inglés). 12B (1/2): 487-510(498). doi:10.1016/0898-1221(86)90167-7.
- ↑ Leach, M. R. «Concerning electronegativity as a basic elemental property and why the periodic table is usually represented in its medium form». Foundations of Chemistry (en inglés) 15 (1): 13-29. doi:10.1007/s10698-012-9151-3.
- ↑ a b Eric Scerri, ed. (2007). Selected Papers on the Periodic Table by Eric Scerri (en inglés). Weinheim: World Scientific. pp. 129-129. ISBN 9783527611584. Consultado el 8 de febrero de 2016.
- ↑ Quadbeck-Seeger, Hans-Jürgen (2007). World of the elements elements of the world (1st ed. edición). Weinheim: Wiley-VCH. p. 107. ISBN 9783527611584. Consultado el 8 de febrero de 2016.
- ↑ a b Green, Melinda. «Periodic fractal of the elements» (en inglés). http://superliminal.com. Consultado el 8 de febrero de 2016.
- ↑ Scerri 2007, p. 20.
- ↑ Seaborg, G. (1964). «Plutonium: The Ornery Element». Chemistry (en inglés) 37 (6): 14.
- ↑ Emsely, J.; Sharp, R. (21 de junio de 2010). «The periodic table: Top of the charts». The Independent.
- ↑ Mark R. Leach. «1925 Courtines' Periodic Classification» (en inglés). Consultado el 10 de febrero de 2016.
- ↑ Mark R. Leach. «1949 Wringley's Lamina System» (en inglés). Consultado el 16 de octubre de 2012.
- ↑ Mazurs, E. G. (1974). Graphical Representations of the Periodic System During One Hundred Years (en inglés). Alabama: University of Alabama Press. p. 111. ISBN 978-0-8173-3200-6.
- ↑ Mark R. Leach. «1996 Dufour's Periodic Tree». Consultado el 10 de febrero de 2016.
- ↑ Mark R. Leach. «1989 Physicist's Periodic Table by Timothy Stowe» (en inglés). Consultado el 10 de febrero de 2016.
- ↑ Bradley, D. (20 de julio de 2011). «At last, a definitive periodic table?». ChemViews Magazine (en inglés). doi:10.1002/chemv.201000107. Consultado el 10 de febrero de 2016.
- ↑ Scerri 2007, pp. 285-86.
- ↑ Mark R. Leach. «2002 Inorganic Chemist's Periodic Table» (en inglés). Consultado el 10 de febrero de 2016.
- ↑ Scerri, E. (2008). «The role of triads in the evolution of the periodic table: Past and present». Journal of Chemical Education (en inglés) 85 (4): 585-89 (see p. 589). Bibcode:2008JChEd..85..585S. doi:10.1021/ed085p585.
- ↑ Bent, H. A.; Weinhold, F (2007). «Supporting information: News from the periodic table: An introduction to "Periodicity symbols, tables, and models for higher-order valency and donor–acceptor kinships"». Journal of Chemical Education (en inglés) 84 (7): 3-4. doi:10.1021/ed084p1145.
- ↑ Schändel, M (2003). The Chemistry of Superheavy Elements (en inglés). Dordrecht: Kluwer Academic Publishers. p. 277. ISBN 1-4020-1250-0.
- ↑ Scerri 2011, pp. 142-143.
- ↑ Frazier, K. (1978). «Superheavy Elements». Science News (en inglés) 113 (15): 236-238. JSTOR 3963006. doi:10.2307/3963006.
- ↑ Pyykkö, P. (2011). «A suggested periodic table up to Z ≤ 172, based on Dirac–Fock calculations on atoms and ions». Physical Chemistry Chemical Physics (en inglés) 13 (1): 161-168. Bibcode:2011PCCP...13..161P. PMID 20967377. doi:10.1039/c0cp01575j.
- ↑ Elliot, Q. A. (1911). «A modification of the periodic table». Journal of the American Chemical Society (en inglés) 33 (5): 684-688 (688). doi:10.1021/ja02218a004.
- ↑ Seaborg, G. (c. 2006). «transuranium element (chemical element)» (en inglés). Encyclopædia Britannica. Consultado el 9 de febrero de 2016.
- ↑ a b García Borge, Mª José; Poves, Alfredo (enero-marzo de 2008). «Estructura Nuclear: A la búsqueda de los límites». En Real Sociedad Española de Física, ed. Revista Española de Física 22 (1): 4-13. ISSN 0213-862X. Consultado el 9 de febrero de 2016.
- ↑ Cwiok, S.; Heenen, P.-H.; Nazarewicz, W. (2005). «Shape coexistence and triaxiality in the superheavy nuclei». Nature (en inglés) 433 (7027): 705-709. Bibcode:2005Natur.433..705C. PMID 15716943. doi:10.1038/nature03336.
- ↑ a b Ball, P. (2010). «Column: The crucible». Chemistry World (en inglés). Royal Society of Chemistry. Consultado el 9 de febrero de 2016.
- ↑ Karol, P. J. (2002). «The Mendeleev–Seaborg periodic table: Through Z = 1138 and beyond». Journal of Chemical Education (en inglés) 79 (1): 60-63. Consultado el 9 de febrero de 2016.
- ↑ Eisberg, R.; Resnick, R. (1985). Quantum Physics of Atoms, Molecules, Solids, Nuclei and Particles (en inglés). Wiley.
- ↑ Bjorken, J. D.; Drell, S. D. (1964). Relativistic Quantum Mechanics (en inglés). McGraw-Hill.
- ↑ Greiner, W.; Schramm, S. (2008). American Journal of Physics (en inglés) 76. p. 509.
- ↑ IUPAC (1 de mayo de 2013). «IUPAC Periodic Table of the Elements». iupac.org (en inglés). IUPAC. Archivado desde el original el 22 de agosto de 2015. Consultado el 9 de febrero de 2016.
- ↑ Seaborg, G. (1945). «The chemical and radioactive properties of the heavy elements». Chemical English Newspaper (en inglés) 23 (23): 2190-2193.
- ↑ Cronyn, M. W. (agosto de 2003). «The Proper Place for Hydrogen in the Periodic Table». Journal of Chemical Education (en inglés) 80 (8): 947-951. Bibcode:2003JChEd..80..947C. doi:10.1021/ed080p947.
- ↑ Greenwood & Earnshaw, a lo largo del libro
- ↑ Lewars, Errol G. (5 de diciembre de 2008). Modeling Marvels: Computational Anticipation of Novel Molecules (en inglés). Springer Science & Business Media. pp. 69-71. ISBN 9781402069734.
- ↑ «transition element». IUPAC Compendium of Chemical Terminology (en inglés). IUPAC. 1997. Archivado desde el original el 11 de octubre de 2008. Consultado el 9 de febrero de 2016.
- ↑ Xuefang, W.; Andrews, L.; Riedel, S.; Kaupp, M (2007). «Mercury Is a Transition Metal: The First Experimental Evidence for HgF4». Angew. Chem. Int. Ed. (en inglés) 46 (44): 8371-8375. PMID 17899620. doi:10.1002/anie.200703710.
- ↑ Jensen, W. B. (2008). «Is Mercury Now a Transition Element?». J. Chem. Educ. (en inglés) 85 (9): 1182-1183. Bibcode:2008JChEd..85.1182J. doi:10.1021/ed085p1182.
- ↑ Rayner-Canham, G; Overton, T (2006). Descriptive inorganic chemistry (en inglés) (4th edición). Nueva York: W H Freeman. pp. 484-485. ISBN 0-7167-8963-9.
- ↑ Keeler, J.; Wothers, P. (2014). Chemical Structure and Reactivity: An Integrated Approach (en inglés). Oxford: Oxford University. p. 259. ISBN 978-0-19-9604135.
- ↑ Scerri, E. (2012). «Mendeleev's Periodic Table Is Finally Completed and What To Do about Group 3?». Chemistry International (en inglés) 34 (4).
- ↑ Emsley, J. (2011). Nature's Building Blocks (en inglés) (new edición). Oxford: Oxford University. p. 651. ISBN 978-0-19-960563-7.
- ↑ a b c d e William B. Jensen (1982). «The Positions of Lanthanum (Actinium) and Lutetium (Lawrencium) in the Periodic Table». J. Chem. Educ. (en inglés) 59 (8): 634-636. doi:10.1021/ed059p634.
- ↑ Matthias, B. T. (1969). «Systematics of Super Conductivity». En Wallace, P. R., ed. Superconductivity, Proceedings of the Advanced Summer Study Institute, McGill University, Montreal (en inglés) 1. Nueva York: Gordon and Breach, Science Publishers. pp. 225-294 (249).
- ↑ Lavelle, L. (2009). «Response to Misapplying the periodic law». Journal of Chemical Education (en inglés) 86 (10): 1187. doi:10.1021/ed086p118.
- ↑ Scerri, E (2015). «Five ideas in chemical education that must die - part five». educationinchemistryblog (en inglés). Royal Society of Chemistry. Archivado desde el original el 23 de diciembre de 2015. Consultado el 10 de febrero de 2016.
- ↑ Jensen, W. B. (2015). «Some Comments on the Position of Lawrencium in the Periodic Table» (en inglés). Archivado desde el original el 23 de diciembre de 2015. Consultado el 10 de febrero de 2016.
- ↑ Francl, M. (mayo de 2009). «Table manners». Nature Chemistry (en inglés) 1 (2): 97-98. Bibcode:2009NatCh...1...97F. PMID 21378810. doi:10.1038/nchem.183.
Bibliografía
- AGAFOSHIN, N. P., Ley periódica y sistema periódico de los elementos de Mendeleiev, Madrid, Editorial Reverté, 1977, 200 p.
- BENSAUDE-VICENT, B. D. «Mendeleiev: El sistema periódico de los elementos.» Mundo científico, (1984), 42, 184-189.
- CALVO REBOLLAR, M. Construyendo la Tabla Periódica. Prames, Zaragoza, 2019. 407 p.
- CHAVERRI, GIL. «Periodic Table of the Elements.» Journal of Chemical Education, 30:632:1951.
- ERNSLEY, J. Nature's Building blocks. Oxford University Press, 2011. 699 p.
- FONTANI, M., COSTA, M. Y ORMA, M.V. The Lost Elements: The Periodic Table's Shadow Side. Oxford University Press, 2014. 508 p.
- MUÑOZ, R. y BERTOMEU SÁNCHEZ, J. R. «La historia de la ciencia en los libros de texto: la(s) hipótesis de Avogadro.» Enseñanza de las ciencias (2003), 21 (1), 147-161. Texto completo
- ROCKE, A. J. 1984 Chemical Atomism in the Nineteenth Century. From Dalton to Cannizzaro. Ohio. Ohio State University Press, 1984.
- ROMÁN POLO, P: El profeta del orden químico: Mendeléiev. Madrid: Nivola, 2002, 190 p.
- SCERRI, E. R., «Evolución del sistema periódico.» Investigación y Ciencia (1998), 266, pp. 54-59.
- SCERRI, E. R., The Periodic Table: Its Story and Its Significance, Oxford University Press, 2007, 346 p.
- STRATHERN, Paul (2000), El sueño de Mendeléiev, de la alquimia a la química, Madrid: Siglo XXI d. C. de España Editores, 288 p.
Enlaces externos
- Esta obra contiene una traducción derivada de «Periodic table» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
 Wikcionario tiene definiciones y otra información sobre tabla periódica de los elementos.
Wikcionario tiene definiciones y otra información sobre tabla periódica de los elementos. Wikimedia Commons alberga una galería multimedia sobre Tabla periódica de los elementos.
Wikimedia Commons alberga una galería multimedia sobre Tabla periódica de los elementos.- Tabla periódica dinámica
- Tabla periódica editorial McGraw-Hill
- Tabla periódica IUPAC actualizada a 28 de noviembre de 2016 (en inglés)
- Tabla periódica en alta resolución (en inglés)
- Examen sobre la tabla periódica
