Acytota
| Acytota | ||
|---|---|---|
 Diferentes tipos de acelulares. Virus con virión, virus sin virión, virus satélite, viroide y plásmido. | ||
| Taxonomía | ||
| (sin rango) | Biota | |
| (sin rango) |
Acytota (P) Jeffrey, 1971 | |
| Clasificación de Baltimore | ||
En biología, Acytota (acelular) o Aphanobionta es un grupo taxonómico que describe a los virus y los agentes subvirales en las clasificaciones biológicas.[1][2] Los virus, junto con los agentes subvirales, son clasificados por el Comité Internacional de Taxonomía de Virus. Actualmente dicho comité clasifica a los virus en 6 dominios y 10 reinos.[3]
También se puede considerar como acelulares a los plásmidos que son comparables a los virus y agentes subvirales en comportamiento replicativo, transmisión entre huéspedes y por ser autónomos del genoma del huésped. A diferencia de los virus y agentes subvirales que son infectivos los plásmidos son endosimbiontes mutualistas que le confieren beneficios a sus células huésped como la transmisión de genes de resistencia a antibióticos. Los plásmidos están estrechamente emparentados con los virus de ADN, especialmente con Monodnaviria y algunos virus satélite de ADN, puesto que estos comparten una proteína única denominada Rep que les permite una replicación en círculo rodante y que no tiene homología con proteínas celulares.
La inclusión de Acytota en el árbol filogenético hace que la vida celular deba definirse en un superdominio Cytota (celular) para diferenciarlos de los virus que son acelulares. Acytota y Cytota son situados en un taxón llamado Biota.
Acytota incluye grupos muy diversos con diferentes tipos de genomas, diferentes estrategias de replicación, un módulo de replicación diferente del celular, proteínas o moléculas no homólogas en muchos casos y secuencias muy divergentes de las celulares, lo que puede indicar que es un taxón parafilético y los diferentes tipos de acelulares como los virus o plásmidos tienen orígenes polifiléticos que incluyó transiciones de una forma a la otra.
La principal razón que se ha usado para excluir a este grupo del árbol filogenético es la ausencia de ribosomas. Además a todos les falta un ácido nucleico y no tienen registro fósil.
Sinonimia
[editar]Se han usado los términos Aphanobionta (Novak 1930, Rothmaler 1951), Archaeophyta (Barkley 1939 non Archephyta-Haeckel 1866), Archetista (Jahn & Jahn 1949), Acellularae (Traub 1963), Protobiota (Hsen-Hsu 1965), Acytota (Jeffrey 1971) y Akamara (Hurst, 2000).
Consideraciones generales
[editar]
Teoría celular
[editar]Se ha vuelto a proponer este término para evitar la polémica que causa considerar a los virus y los agentes subvirales como seres vivos, puesto que, aunque contienen material genético propio, todos son capaces de replicación, ninguno de ellos contiene células, es decir, son acelulares (de ahí el término Acytota).
Para que pudieran considerarse seres vivos tendrían que pasar la prueba de la teoría celular, la cual establece que:
- La célula es la unidad básica y estructural de los seres vivos; todos los organismos están compuestos por células.
- Todas se forman por la división de células preexistentes. Cada una contiene material genético que se transmite.
- Toda función química y fisiológica básica ocurre en el interior de la célula.
- Las células contienen información hereditaria indispensable para regular sus funciones y ser transmitida a las siguientes generaciones.
Entre las razones por las que no se considera a este imperio como vivo, además de la prueba de teoría celular, se citan el que necesitan reproducirse dentro de una célula huésped, no pueden realizar ningún intercambio proteínico fuera de una célula hospedadora, ni de ADN y ARN, y que también, por ejemplo, un virus no puede entrar en un huésped sin inducirle una enfermedad o una mutación.
Todos los conformantes de este gran imperio, no conocido en toda su variedad, pueden surgir dentro de un huésped en cualquier momento, por lo que son considerados como entidades virales o subvirales. Además, su tamaño los coloca como los seres ultramicroscópicos, justo a continuación de las proteínas.
Como última razón, después de entrar en un huésped al intentar ser eliminados es casi imposible hasta ahora liberarse totalmente de ellos, ya que aunque sean destruidos, sus genes continúan mostrándose en las células dañadas por estos de por vida.
Exclusión del árbol filogenético de la vida
[editar]Se ha propuesto las siguientes diez razones para excluir a los virus del árbol filogenético de la vida:[4]
1. Los virus no están vivos. Los virus no cumplen ninguno de los criterios para cualquiera de las definiciones de vida que se han dado a lo largo de la historia desde Aristóteles hasta la actualidad. Carecen de cualquier forma de energía y metabolismo del carbono, y no pueden replicarse ni evolucionar por sí solos. Se reproducen y evolucionan únicamente dentro de las células. Sin las células del huésped, los virus son "materia orgánica compleja inanimada".2. Los virus "van por libre" filogenéticamente hablando. En un árbol filogenético, las características de los miembros de un taxón se heredan de los antepasados. Los virus no se pueden incluir en el árbol de la vida porque no comparten características con las células, y no hay un solo gen que sea compartido por todos los virus. Si bien la vida celular tiene un origen único y común, los virus son polifiléticos: tienen muchos orígenes evolutivos.
3. No hay linajes virales ancestrales. No se ha identificado un solo gen que sea compartido por todos los virus. Existen motivos proteicos comunes en las cápsides virales, pero estos probablemente se han producido a través de la evolución convergente o la transferencia horizontal de genes.
4. ¿El hecho de que los virus de hoy en día infecten a huéspedes primitivos significa que sean antiguos?. No se ha podido demostrar con certeza que los primeros virus aparecieron junto con las primeras células. El problema es que los virus se mueven fácilmente entre diversos hospedadores. La capacidad de un virus para infectar una especie en particular podría llevar a falsas conclusiones sobre la antigüedad de ese virus.
5. Los virus no tienen una estructura derivada de un ancestro común. Las células obtienen membranas de otras células durante la división celular. Por lo tanto, se puede decir que "heredan la membrana", y es correcto afirmar que las células actuales han heredado las membranas de las primeras células. Los virus no tienen esas estructuras heredadas. Todo es de nueva síntesis.
6. Los genes metabólicos virales tienen su origen en las células. Muchos genomas virales codifican proteínas involucradas en el metabolismo energético, el carbono y el metabolismo celular. Se ha argumentado que la presencia de estos genes indica que los virus son ancestros de las células. Pero no es así, los genes metabólicos no están presentes en los antepasados de estos virus. Esto implica que los virus no pueden ser ancestros de las células.
7. Los genes de traducción viral tienen su origen en las células. Algunos virus, como el caso del Mimivirus alberga genes que codifican elementos de la maquinaria de síntesis de proteínas. Se ha interpretado que esta observación significa que los virus no siempre dependieron de las células para la traducción. Sin embargo, el análisis de su secuencia indica que estos genes son derivados de las células mediante transferencia horizontal de genes, y por lo tanto no permite que los virus puedan ser incluidos en el árbol filogenético.
8. Los virus roban genes de las células. Los genomas virales codifican muchos genes que no tienen homólogos en las células. Por esto se ha sugerido que los virus han influido en la evolución de las células al donar nuevos genes. Sin embargo, los análisis moleculares no han podido confirmar esta hipótesis. De hecho, como veremos en el siguiente punto, los virus son "ladrones de genes", no inventores de genes y proveedores genéticos masivos.
9. La transferencia genética mayoritaria es de células a virus. Como corolario a los puntos 7 y 8 podemos afirmar que el movimiento de genes es principalmente de las células a virus. La transferencia en la dirección inversa es mínima. Por lo tanto, los virus no han tenido un papel significativo en la configuración del contenido genético de las células, sino más bien al contrario, han "cogido" genes de las células y luego, mediante una capacidad de evolución y recombinación enorme, los han modificado.
10. ¿El hecho de que los virus sean simples significa que sean primitivos?. Una visión de la evolución es que es un proceso por el cual los organismos simples se vuelven más complejos. La simplicidad de muchos virus conduce a su ubicación en el origen de la vida. Sin embargo esta hipótesis ignora el hecho de que los genomas virales están sujetos a una presión selectiva para mantener un tamaño mínimo para garantizar tasas de replicación rápidas.
De todos modos, aunque la conclusión sea que los virus no están vivos y no deberían incluirse en el árbol de la vida, no implica que no sean importantes para "la vida". Los virus juegan y han jugado un papel importante en la evolución de la vida en la Tierra, aunque solo por el hecho de la presión selectiva que ejercen para que los huéspedes se defiendan y libren de ellos. Además, junto con los elementos genéticos móviles como plásmidos y transposones, pueden acabar formando parte del genoma de sus huéspedes, lo que contribuye a la creación de variabilidad genética; pueden contribuir a la transferencia horizontal de genes y por supuesto, a regular la población y la biodiversidad.
Pero, aunque sean muy importantes para la vida, su incapacidad para sostenerse y replicarse a sí mismos, su "polifiletismo", el origen celular de sus genes similares y la volatilidad de sus genomas a través del tiempo hacen imposible que incorporemos a los virus al maravilloso "Árbol de la vida".
Las razones por las cuales se han excluido a los acelulares del árbol filogenético de la vida es porque no cumplen todas los atributos que definen la vida. Además a todos los acelulares les falta un ácido nucleico, no tienen ribosomas, por tanto no tienen los componentes necesarios para agruparlos de una manera fiable en el árbol filogenético de la vida. Los acelulares también pueden intercambiar genes con sus huéspedes lo que impide reconstruir su historia evolutiva.
En cuanto a su origen y filogenia los acelulares son parafiléticos porque su origen es antiguo al de los organismos celulares y son polifiléticos debido a los repetidos orígenes que han tenido sus miembros dentro las células.[5] El origen parafilético de los acelulares y el origen polifilético de alguno de sus miembros esta respaldado por la mayoría de los análisis moleculares. En un análisis proteico de virus y células los virus gigantes fueron los más cercanos a los organismos celulares, seguido de los demás virus de ADN y los virus de ARN junto con los virus de retrotranscripción.[6][7] Por ello el ICTV clasifica a los virus en 6 dominios y varios reinos.
Tipos de acelulares
[editar]Los acelulares se clasifican dependiendo el tipo de material genético que porten, sin embargo presentan diversas composiciones genómicas o biomoleculares:[8]
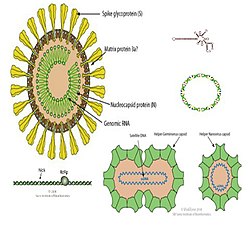
- Virión o virus verdadero: Compuestos por un tipo de material genético puede ser ADN o ARN, una capa proteica llamada cápside y en algunos tipos, una envoltura lipídica. Se especializan en infectar cualquier tipo de organismo como los bacteriófagos en bacterias.
- Viroide: Están compuestos únicamente por una cadena de ARN circular que no codifican proteínas y no transcriben ADN. Infectan plantas y hongos,[9] sin embargo los viroides también han demostrado poder replicarse en bacterias y algas.[10][11][12] Por otra parte, un estudio de metagenómica ha detectado muchos ARN viroides no descubiertos que infectarían hongos, procariotas (arqueas y bacterias) y eucariotas unicelulares (protozoos y algas unicelulares).[13]
- Virus satélite: Comparten las mismas características que los viriones o viroides, pero se diferencian de estos en que son más pequeños y necesitan un virus auxiliar (virión) para la infección. Por tanto se consideran virus dependientes de otros virus. Dentro de los virus satélite se pueden distinguir algunos subtipos:
- Plásmido: Están compuestos únicamente por una cadena de ADN circular y viven como endosimbiontes mutualistas dentro los procariotas y en algunos eucariotas como las levaduras. No son infectivos y no forman parte del genoma del huésped. Los plásmidos sirven como un medio de transferencia horizontal de genes entre las células que hospedan, les pueden conferir beneficios a sus células huéspedes como la transferencia de genes de resistencia a antibióticos. Aunque se les considere un elemento genético de sus huéspedes, no siempre suelen estar dentro de ellos. En las arqueas se descubrió que algunos plásmidos arqueales dependen de los virus de la familia Fuselloviridae para poder replicarse y trasladarse entre sus huéspedes, siendo un tipo novedoso de "satélite" y el primer caso de plásmidos que dependen de virus para cumplir sus requisitos.[15][16]
Actualmente se han descrito más de 15000 especies de acelulares,[17] pero se cree que puede haber millones de especies que todavía no han sido halladas.[18] La mayor parte de la diversidad acelular se ha descrito exclusivamente en los eucariotas, sin embargo falta por describir más acelulares en los procariotas.
Clasificación de Baltimore
[editar]Por otra parte la clasificación de Baltimore ordena a los virus en los siguientes grupos. Esta clasificación también incluye virus satélite y virusoides, pero excluye a los viroides porque sus características replicativas no se adjuntan a la clasificación:[19][20]
- I: Virus ADN bicatenario
- II: Virus ADN monocatenario
- III: Virus ARN bicatenario
- IV: Virus ARN monocatenario positivo
- V: Virus ARN monocatenario negativo
- VI: Virus ARN monocatenario retrotranscrito
- VII: Virus ADN bicatenario retrotranscrito
Clasificación
[editar]- Acelulares de ARN
- Dominio Viroidia (Viroide) (propuesto)
- Dominio Ribozyviria (Virusoide)
- Dominio Riboviria
- Reino Orthornavirae (Virus ARN)
- Reino Pararnavirae (Virus retrotranscritos)
- Virus satélite ARN
- Virus satélites de ARN sin clasificar:
- Satélites de ARN bicatenario (sin nombrar)
- Satélites de ARN monocatenario (sin nombrar)
- Subgrupo 1
- Subgrupo 2
- Acelulares de ADN
- Dominio Adnaviria
- Dominio Duplodnaviria
- Dominio Varidnaviria
- Reino Bamfordvirae
- Reino Helvetiavirae
- Dominio Monodnaviria
- Reino Loebvirae
- Reino Sangervirae
- Reino Shotokuvirae
- Reino Trapavirae
- De colocación incierta
- Dominio propuesto
- Clavaviridae
- Virus fusiformes
- Ampullaviridae
- Clavaviridae
- Globuloviridae
- Guttaviridae
- Plasmaviridae
- Spiraviridae
- Ovaliviridae
- Satélites de ADN monocatenario
- Satélites de ADN bicatenario (sin nombrar)
- Dominio propuesto
- Plásmido
- Elementos virales endógenos o "fósiles acelulares"
- Provirus
- Retrovirus endógenos
- Transposones (como los polintones)
- Replicadores del mundo de ARN †
Origen y evolución
[editar]
Acytota es un grupo parafilético relacionado con el origen de la vida.[21] Estudios del proteoma y los pliegues de las proteínas virales que son secuencias que pueden conservarse por miles de millones de años[22] han encontrado que varias familias virales se habrían desarrollado de manera independiente antes que LUCA (último antepasado común universal) siendo las familias de virus de ARN las más antiguas de la naturaleza.[23][24] Además los virus tienen un módulo de replicación y estructural ausente en las células.[5] Otros acelulares como los viroides y virusoides además del módulo replicativo diferente, basan su replicación en el ARN (sin pasar por un extremo o secuencia de ARN, una característica ausente en las células) y poseen genes no homólogos, lo que implica que son los restos sobrevivientes de las primeras moléculas autorreplicantes de ARN correspondiente a la Hipótesis del mundo de ARN. Los virus de ARN también pueden considerarse reliquias puesto que su replicación se basa únicamente en el ARN y podrían estar relacionados con la primera codificación de proteínas.[25][26][27] Algunos virus de ADN bicatenario (principalmente bacteriófagos) tienen uracilo en su ADN denominado ADN-U, el uracilo es considerado un nucleótido típico del ARN. Este tipo de ADN está ausente en las células, por lo que dichos virus podrían representar una reliquia de la transición del ARN al ADN.[28] Los acelulares fueron algunos de los replicadores que caracterizaron el mundo de ARN junto con elementos genómicos celulares y dieron origen a las células al haber estado contenidos en protobiontes. Los virus pudieron servir como un medio transferencia horizontal entre las comunidades autorreplicativas del mundo de ARN porque sin acelulares como los virus, los replicadores no podrían sobrevivir debido al exceso de parásitos génicos siendo ciertos genes introducidos por los virus lo que favorecían a los replicadores.[29] Esto podría estar explicando la existencia de virus en los organismos celulares.
El descubrimiento de los acelulares que son fundamentalmente diferentes de los organismos celulares (al ser entidades acelulares) tiene implicaciones en el origen de la vida ya que respalda la hipótesis de que la vida pudo haber comenzado con moléculas orgánicas de autoensamblaje.[21][30][23][24] Por tanto el origen de los acelulares coincide con la formación del caldo primigenio. Los primeros acelulares fueron las moléculas autorreplicantes del mundo de ARN que son antepasados tanto de los acelulares virales como de los organismos celulares. Estos acelulares posiblemente fueron de ARN no segmentado.
La aparición de las entidades acelulares se estima en el Hádico hace 4500-4350 millones de años cuando se comenzaron a formar las primeras biomoléculas. En esta época, el flujo de calor de la Tierra era casi diez veces superior al de hoy, la actividad volcánica era muy alta, con numerosos puntos calientes, fosas tectónicas, dorsales oceánicas y lavas eruptivas muy calientes como la de komatita, inusual hoy en día. No hubo iluminidad solar y hubo el mayor volumen de gases de efecto invernadero que acidificaron los océanos por la disolución de dióxido de carbono. Más del 90% de la superficie terrestre la ocupaban los océanos y sus aguas tenían una temperatura de 100 °C. La Tierra también comenzó a ser presa del bombardeo intenso tardío de grandes meteoritos hasta hace 3200 Ma.
Actualmente se considera que virus y agentes subvirales evolucionan más rápidamente que los organismos celulares porque que se hacen resistentes a las vacunas y su genoma cambia mucho con el paso del tiempo, sobre todo los viroides y virusoides. Los virus y agentes subvirales no tienen registro fósil debido a que no fosilizan y han pasado inadvertidos durante millones de años. La técnica actual para rastrear el tiempo geológico de los virus es tratar de encontrar ADN o ARN viral integrado en los genomas celulares, estas secuencias son llamadas elementos virales endógenos. Los virus retrotranscritos y la mayoría de los virus de ADN tienen una enzima llamada integrasa que les permite integrar sus ácidos nucleicos en el genoma de las células huéspedes y que posteriormente estos se conviertan en transposones.[31] Ejemplos son los retrovirus endógenos que se derivaron de infecciones virales que atacaron a los primeros mamíferos con antigüedades de más de 180 millones de años y están asociados a la formación de la placenta en los placentarios.[32] Otro ejemplo son los provirus que son secuencias virales que pueden encontrarse en cualquier organismo celular. Estudios de elementos virales endógenos en insectos sugieren que los virus ya infectaban a los insectos hace más de 300 millones de años.[33] También la superfamilia de transposones de ADN eucariotas polintones, los plásmidos mitocondriales (plásmidos inactivos que encuentran en las mitocondrias), los plásmidos citoplasmáticos (plásmidos inactivos que se encuentran en los virus gigantes y en el citoplasma de algunos eucariotas) pudieron haberse originado de infecciones virales que atacaron a los antepasados de los eucariotas y por tanto podrían considerarse como fósiles virales. Estas secuencias pueden tener más de 2000 millones de años de acuerdo con la estimación de la eucariogénesis.[34][35] Otro ejemplo de elementos virales endógenos son los retrotransposones LTR de las familias Bel, Ty1-copia y Ty2-copia que se originaron de infecciones causadas por los virus retrotranscritos.
Los virus y agentes subvirales pudieron mediar las transiciones del mundo de ARN según algunos autores. Estas transiciones del mundo de ARN se les ha nombrado, mundo de ARN verdadero (la etapa inicial), mundo de ARN + proteínas, mundo de retrotranscripción y mundo de ADN (la etapa final). Se ha propuesto que los viroides, virusoides junto con los ribozimas e intrones del grupo I fueron los primeros replicadores de la etapa inicial del mundo de ARN debido a que no codifican proteínas y porque los viroides y virusoides tampoco transcriben ADN, estos replicadores al haberse unido con proteínas, darían paso al mundo de ARN + proteínas donde comenzaría la codificación de proteínas sin transcripción de ADN y surgirían los virus de ARN, satélites de ARN y la ARN polimerasa dependiente de ARN que codifican proteínas sin transcripción de ADN, posteriormente estos precederían a los retroelementos como los intrones del grupo II, retrones, exones, la transcriptasa inversa y elementos de ARN dependientes de ADN como los ribosomas, las ARN polimerasas dependientes de ADN, dando paso al mundo de retrotranscripción y el comienzo de la transcripción de ADN, a su vez estos elementos harían la transición del ARN al ADN pasando finalmente al mundo de ADN donde por último se originarían las ADN polimerasas, virus de ADN, satélites de ADN, los cromosomas, transposones, plásmidos, repeticiones en tándem, etc. Estos acelulares o elementos genéticos al haber estado contenidos en membranas lipídicas o protobiontes originarían a las primeras células.[36][37][38][39][40][41][42] Un experimento (2015) ha demostrado que las cápsides de los virus pudieron haberse originado en el mundo de ARN y servían como un medio de transferencia horizontal entre las comunidades de replicadores de los protobiontes dado que estas comunidades no podrían sobrevivir si el número de parásitos génicos aumentaba, siendo ciertos genes los responsables de la formación de estas estructuras y los que favorecían la supervivencia de las comunidades autorreplicativas.[29] El desplazamiento de estos genes entre los organismos celulares pudieron favorecer la aparición de nuevos virus durante la evolución.[5] Otra teoría que se ha propuesto es que los virus gigantes pudieron haber originado el núcleo de las células eucariotas al haberse incorporado el virus dentro de la célula donde en lugar de replicarse y destruir la célula huésped, permanecería dentro de la célula originando posteriormente el núcleo y dando lugar a otras innovaciones genómicas. Esta teoría es conocida como la "eucariogénesis viral".[43]
Origen y evolución de los virus
[editar]
Según las investigaciones científicas la hipótesis más plausible para el origen de los virus es un híbrido entre la hipótesis del virus primero y el escape.
La mayoría de las proteínas virales no tienen homólogos con las proteínas celulares y el módulo de replicación vírico es diferente del celular. También algunos genes específicos se han conservado determinados linajes virales y no tienen homólogos con genes celulares. En consecuencia ha surgido un consenso en el que realmente los virus se originaron antes que el último antepasado común universal en los protobiontes durante el mundo de ARN.[36] El descubrimiento de los microcompartimientos bacterianos y los nanocompartimientos de encapsulina, que son orgánulos procariotas proteicos que forman estructuras similares a las cápsides virales icosaédricas, pero sin genoma, da la credibilidad de que los virus surgieron de un evento en el que ciertos replicones quedaron atrapados dentro las cápsides, originando los genomas y que las cápsides habrían surgido primero a través de proteínas de microcompartimiento primordiales. Según este punto de vista los primeros virus fueron icosaédricos y las otras formas geométricas habrían derivado posteriormente. Los virus se originaron durante el Hádico antes que las células entre un período de 4500-4350 millones de años.[36]
Estudios de los pliegues de las proteínas virales y los proteomas de varias familias virales y varios filos celulares mostraron que los acelulares son un taxón complejamente parafilético.[44] El análisis demostró que los virus de ARN formaron un grupo parafilético de los virus de ADN como bien se había sugerido anteriormente, pero los organismos celulares (Cytota) surgieron dentro los virus de ADN siendo los mimivirus los más cercanos a estos. Los virus retrotranscritos y los virus gigantes no formaron grupos monofiléticos lo que implica que evolucionaron independientemente en diferentes líneas evolutivas. Los autores proponen es que los virus se originaron en protobiontes que se separaron para dar origen a las células procariotas.[45][23][24][46]
Estudios de las proteínas virales han identificado que los virus pueden dividirse en 5 dominios de acuerdo con sus características proteicas: Adnaviria, Duplodnaviria, Varidnaviria, Monodnaviria y Riboviria, mientras que los virusoides y viroides conformarían sus propios dominios Ribozyviria y Viroidia respectivamente.[47] Dos de virus de ARN y cuatro de virus de ADN.[48][49][50]

De acuerdo con estos estudios los virus de ARN y los virus retrotranscritos forman un dominio monofilético Riboviria dividido en dos reinos Orthornavirae que incluye los virus de ARN y Pararnavirae que incluye los virus retrotranscritos. Los virus de ARN se caracterizan por poseer una ARN polimerasa dependiente de ARN (RdRp) y los virus retrotranscritos por poseer una transcriptasa inversa. La agrupación surge debido a que se cree que las ARN polimerasas dependientes de ARN y las transcriptasas inversas tanto celulares como virales tienen un ancestro común.[47][40] Los virus de ARN tienen una gran importancia evolutiva ya que se ha sugerido que junto con los virusoides (Ribozyviria) y viroides son reliquias del antiguo mundo de ARN, puesto que su replicación se basa únicamente en el ARN (sin pasar por un extremo o secuencia de ADN, una característica ausente en las células). Se ha sugerido que los virus de ARN precedieron a los intrones y retrotransposones en el mundo precelular mediante un ancestro compartido con el filo Lenarviricota.[51] Los virus de ARN probablemente llegaron a los eucariotas por medio de las arqueas y las proteobacterias hace más de 2500 millones de años, en el momento que sucedió la endosimbiosis seriada que involucró a una arquea y una proteobacteria las cuales darían origen a los eucariotas. Estos virus tuvieron una gran diversificación que representan una parte importante del viroma eucariota. Por otra parte se ha propuesto que los virus retrotranscritos pudieron haber surgido de un evento en el que un retrotransposón se integró en la cápside de otro virus, reemplazando el genoma y las enzimas del virus típico, pero se ha sugerido que pudo ser un virus de ARN. Los virus retrotranscritos con posterioridad originaron a los retrotransposones LTR por infección viral.[47]
| Posible diversificación de los dominios virales. | |||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
El dominio Ribozyviria incluye a los virusoides, viroides de tipo virus satélite que dependen de virus de ARN y retrotranscritos, principalmente de animales, plantas, hongos y bacterias. Se caracterizan por ser moléculas de ARN que se replican a través de ribozimas, aunque en algunos miembros una parte de su ciclo implica utilizar la polimerasa propia del virus huésped (RdRP o RT), algunos de ellos obtienen un ensamblaje viral a partir del que porta el virus huésped. Incluye al agente causante de la Hepatitis D. El dominio Viroidia incluye a los viroides que son agentes infecciosos compuestos por una molécula de ARN sin cápside o polimerasas que no codifican proteínas y no transcriben ADN. Se replican mediante un mecanismo de círculo ARN-ARN mediado por enzimas del huésped o ribozimas propias. Los análisis filogenéticos y de homología basados en diferentes tipos de ARNs sugieren que los virusoides comparten un origen monofilético con los viroides y que ambos descienden de un ancestro común.[52] Los análisis filogenéticos también sugieren que las entidades de tipo viroide dieron origen a las retrozimas, un tipo de retrotransposón que se replica a través de una ribozima con cabeza de martillo presente en las plantas y animales y a los retroviroides un tipo de elemento genético móvil derivado de un viroide unido con el ADN y transcriptasa inversa de un caulimovirus, encontrado en los claveles.[53] Los viroides y virusoides se consideran reliquias de la primera fase del mundo de ARN, porque ambos carecen de homología con moléculas de ARN celulares, su replicación se basa únicamente en el ARN (sin pasar por un extremo o secuencia de ADN, una característica ausente en las células), no codifican proteínas, tienen propiedades químicas propuestas para el mundo de ARN y el caldo primigenio y ambos se replican en su mayor parte a través de ribozimas consideradas las primeras moléculas de ARN en surgir.[54][55][56][57][58]
Los virus de Varidnaviria se caracterizan por tener una proteína específica en rollo de gelatina vertical. La proteína específica es similar a una proteína celular llamada nucleoplasmina. Los bacteriófagos de este dominio pudieron originar la superfamilia de transposones de ADN "polintones" (transposones de ADN que se encuentran en los genomas eucariotas), los plásmidos mitocondriales (plásmidos inactivos que se encuentran en las mitocondrias) y los plásmidos de levaduras (también llamados citoplasmáticos). Los transposones de ADN "polintones" también llamados "polintovirus" probablemente son fósiles de los primeros virus de este dominio que infectaron a los eucariotas derivando de bacteriófagos y antes de integrarse al genoma eucariota originarían a los adenovirus, los virófagos, los virus gigantes, los plásmidos mitocondriales, los plásmidos de levaduras (citoplasmáticos) y los transpovirones (transposones de ADN que se encuentran en los genomas de los virus gigantes). Los virus gigantes parecen haber evolucionado de virus pequeños descendientes de los polintovirus, que aumentaron su genoma y el tamaño del virión mediante la duplicación y deleción de genes, la albergación de elementos genéticos móviles y la adquisición masiva de genes del huésped y sus bacterias endosimbióticas, incluido los genes para la traducción y los genes informáticos que se consideran los más resistentes a la transferencia horizontal. Algunos virus de Varidnaviria (principalmente virus procariotas) tienen uracilo en su ADN denominado ADN-U, el uracilo es considerado un nucleótido típico del ARN. Este tipo de ADN está ausente en las células, por lo que dichos virus podrían representar una reliquia de la transición del ARN al ADN de dicho mundo.[59][60][61][62][63] Los virus gigantes pudieron haber dado origen a los virus de la clase Naldaviricetes o descender de un ancestro compartido.[40][64][65] Casi todos los virus de este dominio son de ADN bicatenario.[50]
Los virus de Monodnaviria se caracterizan por codificar una endonucleasa de la superfamilia HUH y una proteína denominada Rep que les permite una replicación en círculo rodante. Esta es una proteína única de los virus de este dominio, los plásmidos y algunos virus satélite de ADN que no tiene homología con proteínas celulares. Casi todos sus miembros tienen genomas de ADN circular similares a los plásmidos. Pudieron haber surgido de tres eventos en los que plásmidos procariotas que codifican la endonucleasa HUH y la proteína Rep se integraron en las cápsides de ciertos virus de ARN monocatenario positivo del filo Kitrinoviricota, reemplazando el genoma y las enzimas del virus típico. Incluye la gran mayoría de los virus de ADN monocatenario. Los virus de este dominio llegaron a los eucariotas por medio de las proteobacterias cuando el endosimbionte bacteriano se convirtió en las mitocondrias (endosimbiosis seriada).[49] Con posterioridad los virus de Monodnaviria originaron a la superfamilia de transposones helitrones y ciertos plásmidos con la pérdida de las proteínas de la cápside.[49]
Los virus de Duplodnaviria se caracterizan por codificar una proteína exclusiva para la formación de la cápside llamada HK97-MCP y una enzima única llamada terminasa. Los miembros son virus de ADN bicatenario. La proteína específica es similar a una proteína procariota llamada encapsulina. Incluye los clásicos caudovirus procariotas, los herpesvirus que infectan animales y los mirusvirus que infectan eucariotas unicelulares. Estos últimos descienden de los primeros con la pérdida de la cola. Algunos virus de Duplodnaviria (principalmente los cuadovirus) tienen uracilo en su ADN denominado ADN-U, el uracilo es considerado un nucleótido típico del ARN. Este tipo de ADN está ausente en las células, por lo que dichos virus podrían representar una reliquia de la transición del ARN al ADN de dicho mundo.[48]
El dominio Adnaviria incluye virus de arqueas que se caracterizan por tener una proteína específica dímera denominada SIRV2 dentro la cápside, morfología filamentosa y ADN en forma de A. Todos los representantes son virus de ADN bicatenario. Es también el único dominio que hasta ahora no tiene descendientes en los eucariotas.[66]
Los virus de estos dominios, exceptuando a Monodnaviria se originaron en la etapa prebiótica, antes que las células en los protobiontes durante el mundo de ARN.[36]
De todos los virus existentes, los virus de ADN inusuales de arqueas son un complejo enigma en la historia evolutiva de los virus, puesto que no comparten ni una proteína ni un gen homólogo con los organismos celulares u otros virus. Tienen una gran cantidad de formas inusuales, que contrastan con la de los virus conocidos. Además, muchos de ellos no están emparentados entre sí, por lo que están desconectados de la virosfera y se ha sugerido que estos virus de arqueas son descendientes de varios linajes primordiales de virus de ADN que solo prosperaron en las arqueas, pero que no lograron colonizar a las bacterias o eucariotas. Incluso se ha sugerido que estos virus pudieron originar los plásmidos de arqueas. Su origen, al igual que otros virus, es anterior al del último antepasado común universal debido a la falta de homologías.[67] Algunos virus inusuales de arqueas como Ampullaviridae, Bicaudaviridae, Guttaviridae, Fuselloviridae, Thaspiviridae y Halspiviridae parecen estar relacionados con plásmidos y transposones procariotas y de hecho sus genomas pueden haber evolucionado a partir de estos elementos genéticos móviles no virales. Las familias Ampullaviridae, Thaspiviridae y Halspiviridae muestran una relación estrecha con los transposones capsones, mientras que las familias Guttaviridae, Bicaudaviridae y Fuselloviridae, están vinculadas con algunos tipos de plásmidos arqueales. Se ha planteado la posibilidad de que la enigmatica virosfera arqueal evoluciono mediante la recombinación genética entre elementos genéticos móviles no virales y virus.[68] Se ha sugerido que las familias Fuselloviridae, Halspiviridae, Thaspiviridae, Itzamnaviridae y Bicaudaviridae están relacionadas por la presencia de una proteína homóloga la SSV1, ATPasas de la superfamilia AAA, forma de limón y el ensamblaje, la proteína homóloga también está presente en la familia de virus arqueanos filamentosos Clavaviridae, por lo que se ha sugerido que estos virus evolucionaron de virus filamentosos emparentados con Clavaviridae que alteraron su forma para almacenar un genoma más grande y conformarían un dominio o linaje.[69] También queda sin asignar la familia de virus bacterianos de ADN inusuales Plasmaviridae que tampoco muestra relación filogenética con otros virus y organismos celulares, cuya procedencia podría ser similar a la que se propuso para los virus inusuales de arqueas.
En 2019 se propuso una hipótesis llamada "quimérica" para el origen de los virus. Esta hipótesis sostiene que los virus se originaron de distintos tipos de replicadores primordiales (protovirus) del mundo de ARN al reclutar proteínas de huéspedes primordiales para la formación de cápsides. Estos huéspedes habrían sido protobiontes, a su vez los virus también pudieron continuar reclutando proteínas de sus huéspedes celulares actuales.[36] Los virus retienen un módulo de replicación heredado de la etapa prebiótica ya que este está ausente en las células. También las infecciones virales produjeron el desplazamiento de genes asociados con la formación de cápsides y el módulo de replicación vírico entre los organismos celulares que pudieron fomentar la aparición de nuevos virus.[5] Los virus satélite parecen apoyar esta hipótesis ya que ellos son virus compuestos por ácidos nucleicos que no pueden replicarse sin la ayuda de un virus auxiliar y requieren la mayor parte de las enzimas del virus auxiliar para fabricar su cápside.
Véase también
[editar]- Virus (para información sobre virus)
- Protobionte
- Sistema de dos imperios
- Hipótesis del mundo del ARN
- Hipótesis del mundo del ácido peptidonucleico
Referencias
[editar]- ↑ Kango, Naveen (2013). Textbook of Microbiology. I. K. International. p. 128. ISBN 9380026447.
- ↑ Dupre, John (2012). Processes of Life: Essays in the Philosophy of Biology. OUP Oxford, 2012. p. 214. ISBN 0199691983.
- ↑ «Virus Taxonomy: 2019 Release» (html). International Committee on Taxonomy of Viruses (ICTV) (en inglés). October 2018. Consultado el 13 octobre 2019.
- ↑ David Moreira, Purificación-Lopéz García (2009). Ten reasons to exclude viruses from the tree of life. Nature.
- ↑ a b c d Krupovic, M; Dolja, VV; Koonin, EV (2019). «Origin of viruses: primordial replicators recruiting capsids from hosts.». Nature Reviews Microbiology 17 (7): 449-458. PMID 31142823. doi:10.1038/s41579-019-0205-6.
- ↑ Rijja Hussain Bokhari, Nooreen Amirjan, Hyeonsoo Jeong, Kyung Mo Kim, Gustavo Caetano-Anollés, Arshan Nasir (2020). Bacterial Origin and Reductive Evolution of the CPR Group. Oxford Academic. https://doi.org/10.1093/gbe/evaa024
- ↑ Arshan, Nasir; Caetano-Anollés, Gustavo (25 de septiembre de 2015). «A phylogenomic data-driven exploration of viral origins and evolution». Science Advances 1 (8): e1500527. Bibcode:2015SciA....1E0527N. PMC 4643759. PMID 26601271. doi:10.1126/sciadv.1500527.
- ↑ Agents subvirals Sciencedirect
- ↑ Shuang Wei, Ruiling Bian, Ida Bagus Andika, Erbo Niu, Qian Liu, Hideki Kondo (2019). Symptomatic plant viroid infections in phytopathogenic fungi. PNAS.
- ↑ L. F. Salazar, R. W. Hammond, T. O. Diener, R. A. Owens (1988). Analysis of Viroid Replication Following Agrobacterium-mediated Inoculation of Non-host Species with Potato Spindle Tuber Viroid cDNA Free. Microbiology Society.
- ↑ A Latifi. C Bernard, L Da Silva, Y Andéolo (2016). Replication of avocado sunblotch viroid in the cyanobacterium Nostoc sp. PCC 7120. Journal Plant Pathology Microbiology.
- ↑ Diego Molina-Serrano, Loreto Suay, María L. Salvador, Ricardo Flores, José-Antonio Daròs (2020). Processing of RNAs of the Family Avsunviroidae in Chlamydomonas reinhardtii Chloroplasts. American Society for Microbiology.
- ↑ Benjamin D. Lee, Uri Neri, Simon Roux, Yuri I. Wolf, Antonio Pedro Camargo, Mart Krupovic, RNA Virus Discovery Consortium, Peter Simmonds, Nikos Kyrpides, Uri Gophna, Valerian V. Dolja, Eugene V. Koonin, (2022). A vast world of viroid-like circular RNAs revealed by mining metatranscriptomes. Biorxiv.
- ↑ Sidik, Saima (29 de enero de 2024). «‘Wildly weird’ RNA bits discovered infesting the microbes in our guts». Nature (en inglés). doi:10.1038/d41586-024-00266-7. Consultado el 27 de febrero de 2024.
- ↑ Hans Peter Arnold, Qunxin She, Hien Phan, Kenneth Stedman, David Prangishvili, Ingelore Holz, Jakob K. Kristjansson, Roger Garrett, Wolfram Zillig (1999). The genetic element pSSVx of the extremely thermophilic crenarchaeon Sulfolobus is a hybrid between a plasmid and a virus. Online library.
- ↑ Ying Wanga, Zhenhong Duana, Haojun Zhub, Xin Guoa, Ziyi Wangav, Ju Zhoua, Qunxin Sheb, Li Huanga (2007). A novel Sulfolobus non-conjugative extrachromosomal genetic element capable of integration into the host genome and spreading in the presence of a fusellovirus. Science Direct.
- ↑ 2018 ICTV Newsletter #15, September 2018 International Committee on Taxonomy of Viruses. Consultado el 26 de septiembre de 2018.
- ↑ Dávila-Ramos S, Castelán-Sánchez HG, Martínez-Ávila L, Sánchez-Carbente MD, Peralta R, Hernández-Mendoza A, Dobson AD, Gonzalez RA, Pastor N, Batista-García RA (2019). «A Review on Viral Metagenomics in Extreme Environments». Frontiers in Microbiology 10: 2403. PMC 6842933. PMID 31749771. doi:10.3389/fmicb.2019.02403.
- ↑ Baltimore, D. (1974). «The strategy of RNA viruses». Harvey Lect. 70 Series: 57-74. PMID 4377923.
- ↑ Clasificación de Baltimore
- ↑ a b Koonin, E.V.; Senkevich, T.G.; Dolja, V.V. (2006). «The ancient Virus World and evolution of cells». Biology Direct 1: 29. PMC 1594570. PMID 16984643. doi:10.1186/1745-6150-1-29.
- ↑ Gustavo Caetano-Anollés, Arshan Nasir (2014).The distribution and impact of viral lineages in domains of life. Frontiers.
- ↑ a b c Arshan, Nasir; Caetano-Anollés, Gustavo (25 de septiembre de 2015). «A phylogenomic data-driven exploration of viral origins and evolution». Science Advances 1 (8): e1500527. Bibcode:2015SciA....1E0527N. PMC 4643759. PMID 26601271. doi:10.1126/sciadv.1500527.
- ↑ a b c Yates, Diana (25 de septiembre de 2015). «Study adds to evidence that viruses are alive». Champaign, IL: University of Illinois at Urbana–Champaign. Archivado desde el original el 19 de noviembre de 2015. Consultado el 20 de octubre de 2015.
- ↑ Marcelo Eiras, Jose Antonio Daròs, Ricardo Flores (2006). Viroids and Virusoids Relics of RNA World Scielo.
- ↑ Theodor Diener (2016). Viroids: “living fossils” of primordial RNAs? NCBI.
- ↑ Institut de Génétique et Microbiologie (abril de 2006). «The origin of viruses and their possible roles in major evolutionary transitions.». Virus Res. 5 (117): 5-16. PMID 16476498. Consultado el 25 de junio de 2010.
- ↑ Patrick Forterre, Jonathan Filée, Hannu Myllykallio (2004). Origin and Evolution of DNA and DNA Replication Machineries. Link Springer.
- ↑ a b Matti Jalasvuori, Sari Mattila, Ville Hoikkala (2015). Chasing the Origin of Viruses: Capsid-Forming Genes as a Life-Saving Preadaptation within a Community of Early Replicators. Plos One. https://doi.org/10.1371/journal.pone.0126094
- ↑ Gustavo Caetano-Anollés, Arshan Nasir (2019).Viral evolution: Primordial cellular origins and late adaptation to parasitism. NCBI.
- ↑ Feschotte, Cédric; Gilbert, Clement (March 2012). «Endogenous viruses: insights into viral evolution and impact on host biology.». Nat Rev Genet. 13 (4): 83-96. doi:10.1038/nrg3199.
- ↑ Taylor, D. J.; J. Bruenn (2009). «The evolution of novel fungal genes from non-retroviral RNA viruses». BMC Biology 7. doi:10.1186/1741-7007-7-88.
- ↑ Sergio Ferrer (2014). ¿Cuál es el origen de los virus? El Confidencial.
- ↑ Krupovic, Mart; Bamford, Dennis H; Koonin, Eugene V (2014). «Conservation of major and minor jelly-roll capsid proteins in Polinton (Maverick) transposons suggests that they are bona fide viruses». Biology Direct 9 (1): 6. PMC 4028283. PMID 24773695. doi:10.1186/1745-6150-9-6.
- ↑ Natalya Yutin, Eugene Koonin, Didier Raoult (2014). Virophages, Polintons, and Transpovirons: A Complex Evolutionary Network of Diverse Selfish Genetic Elements With Different Reproduction Strategies. Virology Journal.
- ↑ a b c d e Mart Krupovic, Valerian V. Dolja, Eugene V. Koonin (2020). The LUCA and its complex virome. Nature.
- ↑ Eugene Koonin, Valerian V Doljja (2014). A virocentric perspective on the evolution of life. Science Direct.
- ↑ Eugene V Koonin, Tatiana G Senkevich, Valerian V Dolja (2006). The ancient Virus World and evolution of cells. Biology Direct.
- ↑ Eugene Koonin (2015). Viruses and mobile elements as drivers of evolutionary transitions. NCBI.
- ↑ a b c Eugene Koonin, Valerian V Doljja (2014). Virus World as an Evolutionary Network of Viruses and Capsidless Selfish Elements. Microbiology and Molecular Biology Reviews.
- ↑ Patrick Forterre. The Two Ages of the RNA World, and the Transition to the DNA World: A Story of Viruses and Cells. Science Direct.
- ↑ Carl Zimmer (2006). Did DNA Come From Viruses?.
- ↑ Philip John Livingstone Bell (2001). «Viral eukaryogenesis: Was the ancestor of the nucleus a complex DNA virus?». Journal of Molecular Evolution 53 (3): 251-256. Bibcode:2001JMolE..53..251L. PMID 11523012. doi:10.1007/s002390010215.
- ↑ Rijja Hussain Bokhari, Nooreen Amirjan, Hyeonsoo Jeong, Kyung Mo Kim, Gustavo Caetano-Anollés, Arshan Nasir (2020). Bacterial Origin and Reductive Evolution of the CPR Group. Oxford Academic. https://doi.org/10.1093/gbe/evaa024
- ↑ Nasir, Arshan; Kim, Kyung Mo; Caetano-Anollés, Gustavo (1 de septiembre de 2012). «Viral evolution». Mobile Genetic Elements 2 (5): 247-252. ISSN 2159-2543. PMC 3575434. PMID 23550145. doi:10.4161/mge.22797.
- ↑ Arshan Nasir, Kyung Mo Kim, Gustavo Caetano-Anolles (2012). Giant viruses coexisted with the cellular ancestors and represent a distinct supergroup along with superkingdoms Archaea, Bacteria and Eukarya. BMC Evolutionary Biology.
- ↑ a b c Koonin EV, Dolja VV, Krupovic M, Varsani A, Wolf YI, Yutin N, Zerbini M, Kuhn JH (18 de octubre de 2019). «Create a megataxonomic framework, filling all principal taxonomic ranks, for realm Riboviria» (docx). International Committee on Taxonomy of Viruses (ICTV) (en inglés). Consultado el 15 de mayo de 2020.
- ↑ Ahmed A. Zayed, James M. Wainana, Guillermo Dominguez Huerta, Eric Pelletier, Matthew Sullivan (2022). Cryptic and abundant marine viruses at the evolutionary origins of Earth’s RNA virome. Science org.
- ↑ Elena, Santiago F .; Dopazo, Joaquín; de la Peña, Marcos; Flores, Ricardo; Diener, Theodor O .; Moya, Andrés (1991). Phylogeny of viroids, viroidlike satellite RNAs, and the viroidlike domain of hepatitis delta virus RNA.. PNAS.
- ↑ Ricardo Flores, Beatriz Navarro, Pedro Serra, Francesco Di Serio (2022). A Scenario for the Emergence of Protoviroids in the RNA World and for Their Further Evolution into Viroids and Viroid-Like RNAs by Modular Recombinations and Mutations. Oxford Academic.
- ↑ Create one new realm Ribozyviria including one new family Kolmioviridae including genus Deltavirus and seven new genera for a total of 15 species. ICTV.
- ↑ Marcelo Eiras, Jose Antonio Daròs, Ricardo Flores (2006). Viroids and virusoids: relics of the RNA world. SciELO.
- ↑ Flores R, Gago-Zachert S, Serra P, Sanjuán R, Elena SF (18 de junio de 2014). «Viroids: survivors from the RNA world?». Annu. Rev. Microbiol. 68: 395-414. PMID 25002087. doi:10.1146/annurev-micro-091313-103416.
- ↑ Viroidia. ICTV.
- ↑ Pending proposals. ICTV.
- ↑ Natalya Yutin, Eugene Koonin (2019). Chapter Five - Evolution of the Large Nucleocytoplasmic DNA Viruses of Eukaryotes and Convergent Origins of Viral Gigantism. Science Direct.
- ↑ Natalya Yutin, Yuri I.Wolf, Eugene V.Koonin (2014). Origin of giant viruses from smaller DNA viruses not from a fourth domain of cellular life. Science Direct. https://doi.org/10.1016/j.virol.2014.06.032
- ↑ Jonathan Filée (2013). Route of NCLDV evolution: the genomic accordion. Science Direct.
- ↑ David Moreira, Céline Brochier-Armanet (2008). Giant viruses, giant chimeras: The multiple evolutionary histories of Mimivirus genes. NCBI.
- ↑ Tom Williams, T Martin Embley, Eva Heinz (2011). Informational Gene Phylogenies Do Not Support a Fourth Domain of Life for Nucleocytoplasmic Large DNA Viruses. Researchgate.
- ↑ Eugene V. Koonin, Valerian V. Dolja, Mart Krupovic, Arvind Varsani, Yuri I. Wolf, Natalya Yutin, F. Murilo Zerbini, Jens H. Kuhn (2020). Global Organization and Proposed Megataxonomy of the Virus World. American Society for Microbiology.
- ↑ Johannes Jehlea, Yongjie Wang (2012). Phylogeny and Evolution of Hytrosaviridae. Science Direct.
- ↑ Create-one-new-realm-Adnaviria-for-classification-of-filamentous-archaeal-viruses-with-linear-dsDNA-genomes. ICTV.
- ↑ David Prangishvili. Archaeal viruses: living fossils of the ancient virosphere Archivado el 25 de mayo de 2021 en Wayback Machine..
- ↑ David Prangishvili, Dennis H. Bamford, Patrick Forterre, Jaime Iranzo, Eugene V. Koonin & Mart Krupovic. The enigmatic archaeal virosphere. Nature.
- ↑ Fengbin Wang, Virginija Cvirkaite-Krupovic, Matthijn Vos, Leticia C Beltran, Mark A B Kreutzberger, Jean-Marie Winter, Zhangli Su, Jun Liu, Stefan Schouten, Mart Krupovic, Edward H Egelman (2022) Spindle-shaped archaeal viruses evolved from rod-shaped ancestors to package a larger genome. Sciences Direct.




