Cloruro de zinc
| Cloruro de zinc | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Cloruro de zinc | ||
| General | ||
| Otros nombres |
Dicloruro de zinc Cloruro de zinc anhidro, Mantequilla de zinc | |
| Fórmula molecular | ZnCl2 | |
| Identificadores | ||
| Número CAS | 7646-85-7[1] | |
| ChEBI | 49976 | |
| ChEMBL | CHEMBL1200679 | |
| ChemSpider | 5525 | |
| DrugBank | DB14533 | |
| PubChem | 3007855 5727, 3007855 | |
| UNII | 86Q357L16B | |
| KEGG | D02058 | |
| Propiedades físicas | ||
| Apariencia | Gránulos cristalinos blancos. | |
| Densidad | 2907 kg/m³; 2907 g/cm³ | |
| Masa molar | 136,3 g/mol | |
| Punto de fusión | 556 K (283 °C) | |
| Punto de ebullición | 1029 K (756 °C) | |
| Estructura cristalina |
Cuatro formas conocidas En estado anhidro, la única forma estable es la Hexagonal de empaquetamiento cerrado (δ) | |
| Propiedades químicas | ||
| Solubilidad en agua | 432 g/100 mL (25 °C) | |
| Termoquímica | ||
| ΔfH0sólido | -415,05 kJ/mol | |
| S0sólido | 111,46 J·mol–1·K–1 | |
| Peligrosidad | ||
| Frases R | R34, R50, R53 | |
| Frases S |
S7/8, S28, S45, S60, S61 | |
| Compuestos relacionados | ||
| Otros aniones |
fluoruro de zinc, bromuro de zinc, ioduro de zinc, óxido de zinc | |
| Otros cationes |
cloruro de cobre (II), cloruro de cadmio, cloruro de aluminio | |
| Otros compuestos de Cl y Zn | clorato de cinc | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El cloruro de zinc es un compuesto químico cuya fórmula es ZnCl2. Se conocen nueve formas cristalinas diferentes de cloruro de zinc, incoloras o blancas, muy solubles en agua. El ZnCl
2 es higroscópico e incluso delicuescente. Por tanto, las muestras deben protegerse de las fuentes de humedad, incluido el vapor de agua presente en el medio ambiente.
El cloruro de zinc tiene muchas aplicaciones en los procesos textiles, fabricación de decapantes (flux, en inglés) y de catalizadores para síntesis orgánica.
Estructura y propiedades básicas
[editar]El cloruro de zinc presenta polimorfismo, se conocen cuatro formas cristalinas, llamadas polimorfos. En todos los casos el ion Zn2+ presenta coordinación tetraédrica con cuatro ligandos cloruro.[2] Por enfriamiento rápido de ZnCl2 fundido se obtiene un vidrio, es decir, un sólido amorfo. Adicionalmente el ZnCl2 forma hidratos por inclusión de agua de cristalización, y al menos un hidróxido mixto, ZnClOH.[2]
La forma anhidra presenta un enlace con marcado carácter covalente que se manifiesta en su relativamente bajo punto de fusión, entre 275 y 318 °C. Otras evidencias de su covalencia es su alta solubilidad en solventes como el éter, con los que forma aductos de fórmula ZnCl2L2 donde L es un ligando tal como dietiléter, O(C2H5)2.
Sus soluciones acuosas presentan carácter ácido, debido a que el ion Zn2+ es un ácido de Lewis. Por ejemplo una solución acuosa 6 M tiene un pH de 1.[3]
Se conocen cuatro hidratos de cloruro de cinc. Los cuatro hidratos de cloruro de cinc tienen la fórmula ZnCl2(H2O)n donde n = 1, 1.5, 2.5, y 3.[3] El 4-hidrato, ZnCl2(H2O)4 cristaliza a partir de disoluciones acuosas de cloruro de cinc. Cuando se calienta el cloruro de cinc hidratado a partir de una disolución acuosa, se obtiene un residuo de ZnOHCl.
En solución acuosa, el cloruro de cinc se disocia por completo dando iones Zn2+. Por ello, aunque las distintas sales de cinc tienen diferentes fórmulas y estructuras cristalinas, su comportamiento en solución acuosa es muy similar. Por ejemplo, las soluciones de los diferentes polimorfos de ZnCl2, así como las de otros haluros (bromuro, ioduro) y la de sulfato de cinc, a menudo se pueden utilizar en forma indistinta para la preparación de otros compuestos de cinc. Un ejemplo de esto es la obtención de carbonato de cinc:
Síntesis y purificación
[editar]La sal anhidra ZnCl2 puede prepararse a partir de cinc y cloruro de hidrógeno.
- Zn + 2 HCl → ZnCl2 + H2
Las formas hidratadas y disoluciones acuosas pueden prepararse fácilmente por tratamiento de piezas de cinc metálico con ácido clorhídrico concentrado.
El óxido de cinc y sulfuro de cinc reaccionan con HCl:
A diferencia de otros elementos que poseen varios estados de oxidación, el ion cinc solamente existe con carga 2+ por lo que su purificación es más simple.
Las muestras comerciales de cloruro de cinc contienen como impurezas típicas algo de agua y productos de hidrólisis. Tales muestras pueden purificarse por extracción con dioxano en caliente, que lo disuelve. Luego se filtra en caliente y al enfriar el filtrado se obtiene un precipitado de ZnCl2. Las muestras anhidras se purifican por sublimación en una corriente de cloruro de hidrógeno gas, seguido de calentamiento a 400 °C en corriente de gas nitrógeno. Finalmente, el método más simple parte del tratamiento de cloruro de cinc con cloruro de tionilo.[4]
Aplicaciones
[editar]Decapante en metalurgia
[editar]El cloruro de zinc tiene la capacidad de atacar a los óxidos metálicos dando derivados de fórmula MZnOCl2. Esta reacción es importante por el uso del ZnCl2 como decapante en soldadura metálica - disuelve las capas de óxido exponiendo la superficie de metal limpia.[3] Estos decapantes se preparan disolviendo una hoja metálica de cinc en ácido clorhídrico hasta que el líquido deja de desprender hidrógeno. Debido a su naturaleza corrosiva, este decapante no es adecuado para situaciones en las que no puedan limpiarse los residuos, tales como en trabajos de electrónica. Esta propiedad también permite su uso en la fabricación de cementos de óxido de magnesio para empaste dental y como ingrediente activo en ciertos enjuagues bucales.
En síntesis orgánicas
[editar]En el laboratorio, es ampliamente usado el cloruro de cinc, principalmente como ácido de Lewis de fuerza moderada. Puede catalizar reacciones en las que intervienen anillos aromáticos activados,[5][6] como: (A) Síntesis de indoles de Fischer,[7] y también (B) Acilación de Friedel-Crafts.
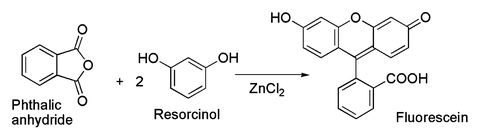
Un ejemplo es la conocida preparación del pigmento fluoresceína a partir de anhídrido ftálico y resorcinol, en la que interviene una acilación de Friedel-Crafts.[8] De hecho, esta transformación ha sido llevada a cabo usando incluso ZnCl2 hidratado tal como aparece en la reacción anterior.
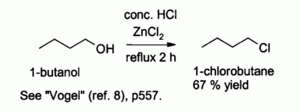
El ácido clorhídrico por sí solo reacciona pobremente frente a alcoholes primarios y alcoholes secundarios, pero una combinación de HCl con ZnCl
2 (mezcla conocida como "reactivo de Lucas") es eficaz para preparar cloruros de alquilo, típicamente a la temperatura de 130 °C. Esta reacción probablemente transcurre mediante un mecanismo de reacción SN2 con alcoholes primarios pero un mecanismo de reacción SN1 con alcoholes secundarios.
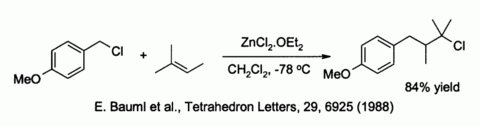
El cloruro de cinc también activa a los haluros de bencilo y alilo en reacciones de sustitución con nucleófilos débiles como alquenos:[9]
De igual modo, ZnCl2 promueve la reducción selectiva con NaBH3CN de haluros alílicos o bencílicos terciarios, dando los correspondientes hidrocarburos.
El cloruro de cinc es también un útil reactivo iniciador para la síntesis de muchos reactivos de organocinc, tales como los usados en la reacción de acoplamiento de Negishi con haluros de arilo o de vinilo, catalizada por paladio.[10] En tales casos el compuesto de organocinc se prepara normalmente por transmetalación de un compuesto de organolitio o de un reactivo de Grignard, por ejemplo:
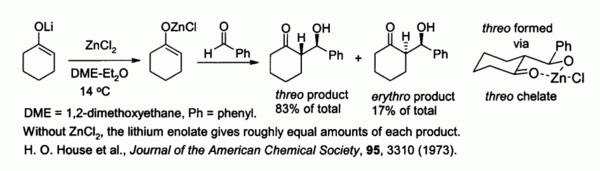
Los enolatos de cinc, preparados a partir de metales alcalinos y ZnCl2, proporcionan control de estereoquímica en reacciones de condensación aldólica debidas a quelación sobre el átomo de cinc. En el ejemplo mostrado debajo, el producto treo se favorece sobre la forma eritro en un factor de 5:1 cuando se usa ZnCl2 en dimetoxietano (DME)/éter.[11] El quelato es más estable cuando el voluminoso grupo fenilo es pseudoecuatorial más que cuando es pseudoaxial, esto es, treo más bien que eritro.
En procesado textil
[editar]Las disoluciones acuosas concentradas (más del 64% masa/masa de cloruro de cinc en agua) tienen la interesante propiedad de disolver el almidón, la seda, y la celulosa. Por tanto, tales disoluciones no se pueden filtrar a través de papel de filtro ordinario. El ZnCl2 se usa como agente resistente al fuego y en ambientadores o absorbeolores textiles tales como Febreze.
Consideraciones de seguridad
[editar]Las sales de cinc son relativamente no tóxicas. Las precauciones aplicables al cloruro de cinc anhidro ZnCl2 son las mismas aplicables a otros haluros de metal anhidro, esto es, la hidrólisis puede ser exotérmica y debería evitarse el contacto. Las disoluciones concentradas son ácidas y corrosivas, atacando específicamente a la celulosa y la seda.
Referencias
[editar]- ↑ Número CAS
- ↑ a b Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6. En inglés.
- ↑ a b c Holleman, A. F.; Wiberg, E,. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5. En inglés.
- ↑ Pray, A. P. “Anhydrous Metal Chlorides” "Inorganic Syntheses," vol. XXVIII, 321-2, 1990ISBN 0-471-52619-3. Describe la formación de LiCl anhidro, CuCl2, ZnCl2, C d. C.l2, ThCl4, CrCl3, FeCl3, CoCl2, and NiCl2 a partir de sus correspondientes hidratos. En inglés.
- ↑ S. R. Cooper, in Organic Syntheses Collective Volume 3, p 761, Wiley, New York, 1955. En inglés.
- ↑ S. Y. Dike, J. R. Merchant, N. Y. Sapre, Tetrahedron, 47, 4775 (1991). En inglés.
- ↑ R. L. Shriner, W. C. Ashley, E. Welch, in Organic Syntheses Collective Volume 3, p 725, Wiley, New York, 1955. En inglés.
- ↑ B. S. Furnell et al., Vogel's Textbook of Practical Organic Chemistry, 5th edition, Longman/Wiley, New York, 1989. En inglés.
- ↑ E. Bauml, K. Tschemschlok, R. Pock, H. Mayr, Tetrahedron Letters, 29, 6925 (1988). En inglés.
- ↑ S. Kim, Y. J. Kim, K. H. Ahn, Tetrahedron Letters, 24, 3369 (1983). En inglés.
- ↑ H. O. House, D. S. Crumrine, A. Y. Teranishi, H. D. Olmstead, Journal of the American Chemical Society, 95, 3310 (1973). En inglés.
Bibliografía
[editar]- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997. En inglés.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990. En inglés.
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960. En inglés.
- D. Nicholls, Complexes and First-Row Transition Elements, Macmillan Press, London, 1973. En inglés.
- A. F. Wells, 'Structural Inorganic Chemistry, 5th ed., Oxford University Press, Oxford, UK, 1984. En inglés.
- J. March, Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992. En inglés.
- G. J. McGarvey, in Handbook of Reagents for Organic Synthesis, Volume 1: Reagents, Auxiliaries and Catalysts for C-C Bond Formation, (R. M. Coates, S. E. Denmark, eds.), pp. 220-3, Wiley, New York, 1999. En inglés.
Enlaces externos
[editar]- Grades and Applications of Zinc Chloride. En inglés.
- PubChem ZnCl2 summary. En inglés.
- External MSDS Data Sheet Archivado el 1 de julio de 2007 en Wayback Machine. En inglés.
- Ficha de seguridad. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).. En español.