Diferencia entre revisiones de «Testosterona»
| Línea 97: | Línea 97: | ||
*La terminación de la maduración ósea y crecimiento óseo. Esto ocurre indirectamente vía los [[Metabolito|metabolitos]] del [[estradiol]] y por lo tanto ocurre de forma más gradual en los hombres que las mujeres. |
*La terminación de la maduración ósea y crecimiento óseo. Esto ocurre indirectamente vía los [[Metabolito|metabolitos]] del [[estradiol]] y por lo tanto ocurre de forma más gradual en los hombres que las mujeres. |
||
=== Adulto === |
|||
| ⚫ | 1. Acciones sexuales: La testosterona es necesaria para el normal desarrollo de los genitales externos e internos masculinos. Ello sucede durante el primer trimestre de la vida fetal. Si la síntesis fetal de andrógenos es insuficiente, por un error enzimático congénito o por defectos del receptor, el fenotipo genital puede ser femenino o ambiguo. Son los llamados pseudohermafroditas masculinos (síndrome de Morrison), que presentan testículos pero cuyos genitales se desarrollan según el modelo femenino. los verdaderos hermafroditas tienen ovario y testículo. En la época prepuberal hay una secreción mínima de testosterona. A través de mecanismos no bien conocidos, las secreciones de LH y FSH aumentan progresivamente en la [[pubertad]]. El tamaño testicular crece también por acción de la hormona de crecimiento, el número de células de Leydig aumenta y la concentración plasmática de testosterona también se incrementa progresivamente dando lugar a la maduración sexual. Resumiendo la testosterona produce los siguientes efectos sobre los órganos sexuales primarios: |
||
Los ''efectos de la testosterona en adultos'' son mas claramente demostrables en el varón que la mujere, pero son igualmente de importante para ambos sexos. Algunos de estos efectos pueden disminuir cuando los niveles de testosterona disminuyen en las ultimas décadas de la vida adulta. |
|||
[[Archivo:Blood values sorted by mass and molar concentration.png|thumb|center|600px|[[Anexo:Rangos de referencia para exámenes de sangre comunes|Rangos de referencia para exámenes de sangre]], mostrando los niveles de testosterona para un adulto masculino en celeste.]] |
|||
*La testosterona es necesaria para el desarrollo normal del [[espermatozoide]]. La testosterona activa genes en las [[Célula de Sertoli|Células de Sertoli]] quienes promueves la diferenciación de [[espermatogonia]]. |
|||
*Regula la respuesta aguda del HHA ([[eje hipotalámico-hipofisario-adrenal]] bajo un desafío de dominancia<ref name="pmid18505319">{{cite journal | author = Mehta PH, Jones AC, Josephs RA | title = The social endocrinology of dominance: basal testosterone predicts cortisol changes and behavior following victory and defeat | journal = J Pers Soc Psychol | volume = 94 | issue = 6 | pages = 1078–93 | year = 2008 | month = June | pmid = 18505319 | doi = 10.1037/0022-3514.94.6.1078 | url = http://homepage.psy.utexas.edu/homepage/faculty/josephs/pdf_documents/index.cfm.pdf | issn = }}</ref> |
|||
*Energía física y mental |
|||
*Mantenimiento del trofismo muscular |
|||
*La testosterona regula la población de receptores [[Tromboxano|Tromboxano A<sub>2</sub>]] en [[megacariocito]]s y [[plaqueta]]s y por lo tanto la agrupación de plaquetas en humanos<ref name="pmid15820970">{{cite journal | author = Ajayi AA, Halushka PV | title = Castration reduces platelet thromboxane A2 receptor density and aggregability | journal = QJM | volume = 98 | issue = 5 | pages = 349–56 | year = 2005 | month = May | pmid = 15820970 | doi = 10.1093/qjmed/hci054 | url = | issn = }}</ref><ref name="pmid7758179">{{cite journal | author = Ajayi AA, Mathur R, Halushka PV | title = Testosterone increases human platelet thromboxane A2 receptor density and aggregation responses | journal = Circulation | volume = 91 | issue = 11 | pages = 2742–7 | year = 1995 | month = June | pmid = 7758179 | doi = | url = | issn = }}</ref> |
|||
*La testosterona no causa o produce efectos nocivos en el [[cáncer de próstata]]. En gente que se han sometido a terapia de privación de testosterona, incrementos de testosterona más allá de niveles de castrado han demostrado de incrementar la rapidez de propagación de un cáncer prostático existente.<ref name="pmid19011298">{{cite journal | author = Morgentaler A, Schulman C | title = Testosterone and prostate safety | journal = Front Horm Res | volume = 37 | issue = | pages = 197–203 | year = 2009 | pmid = 19011298 | doi = 10.1159/000176054 | url = | issn = }}</ref><ref>{{cite journal | author = Rhoden, E.L., M.A. Averbeck, and P.E. Teloken | title = Androgen replacement in men undergoing treatment for prostate cancer | journal = J Sex Med | volume = 5 | issue = 9 | pages = 2202–8 | year = 2008 | doi = 10.1111/j.1743-6109.2008.00925.x | pmid = 18638000}}</ref><ref>{{cite journal | author = Morgentaler, A. and A.M. Traish | title = Shifting the paradigm of testosterone and prostate cancer: the saturation model and the limits of androgen-dependent growth | journal = Eur Urol | volume = 55 | issue = 2 | pages = 310–20 | year = 2009 | doi = 10.1016/j.eururo.2008.09.024 | pmid = 18838208}}</ref> |
|||
*Estudios recientes han mostrados resultados conflictivos acerca de la importancia de la testosterona en manteniendo la salud [[Aparato circulatorio|cardiovascular]].<ref name="pmid17285783">{{cite journal | author = Haddad RM, Kennedy CC, Caples SM, Tracz MJ, Boloña ER, Sideras K, Uraga MV, Erwin PJ, Montori VM | title = Testosterone and cardiovascular risk in men: a systematic review and meta-analysis of randomized placebo-controlled trials | journal = Mayo Clin. Proc. | volume = 82 | issue = 1 | pages = 29–39 | year = 2007 | month = January | pmid = 17285783 | doi = 10.4065/82.1.29| url = | issn = }}</ref><ref name="pmid19464009">{{cite journal | author = Jones TH, Saad F | title = The effects of testosterone on risk factors for, and the mediators of, the atherosclerotic process | journal = Atherosclerosis | volume = 207| issue = 2| pages = 318–27| year = 2009 | month = April | pmid = 19464009 | doi = 10.1016/j.atherosclerosis.2009.04.016 | url = | issn = }}</ref> Sin embargo, mantener niveles normales de testosterona en hombres de la tercera edad ha demostrado la mejora de varios parámetros que se piensan que reducen el riesgo de enfermedades cardiovasculares, tales como el incremento de la masa magra, las disminución de la grasa visceral, disminución del colesterol total, y control sobre los niveles glucémicos.<ref name="pmid18488876">{{cite journal | author = Stanworth RD, Jones TH | title = Testosterone for the aging male; current evidence and recommended practice | journal = Clin Interv Aging | volume = 3 | issue = 1 | pages = 25–44 | year = 2008 | pmid = 18488876 | pmc = 2544367 | doi = | url = | issn = }}</ref> |
|||
*Bajo un desafío de dominancia, la testosterona puede que juegue un papel en la regulación de la respuesta de "lucha o huida"<ref name="pmid16928375"/> |
|||
*Enamorarse disminuye los niveles de testosterona en los hombres mientras que incrementa los niveles de las mujeres. Es especulado que estos cambios en los niveles de testosterona resulten en la reducción temporal de las diferencias del comportamiento entre ambos sexos.<ref name="pmid15177709">{{cite journal | author = Marazziti D, Canale D | title = Hormonal changes when falling in love | journal = Psychoneuroendocrinology | volume = 29 | issue = 7 | pages = 931–6 | year = 2004 | month = August | pmid = 15177709 | doi = 10.1016/j.psyneuen.2003.08.006 | url = | issn = }}</ref> Se ha comprobado que cuando la testosterona y las [[endorfina]]s en el semen eyaculado se encuentran con la pared cervical después de una relación sexual, las mujeres reciben un golpe de testosterona, endorfina, y [[oxitocina]], y los varones después del orgasmo experimentan un incremento de endorfinas y un incremento marcado en los niveles de oxitocina. Esto se añade al entorno fisiológico acogedor en el tracto reproductivo femenino para la concepción, y luego para la alimentación del embrión, y estimula el sentimiento de amor, deseo, y cuidado paternal en los varones (esta es la única ves que los niveles de oxitocina del varón rivalizan con los de las mujeres).<ref>{{cite journal | pmid = 15177709 | doi=10.1016/j.psyneuen.2003.08.006 | volume=29 | issue=7 | title=Hormonal changes when falling in love | year=2004 | month=August | author=Marazziti D, Canale D | pages=931–6}}</ref> |
|||
*Estudios recientes sugieren que los niveles de testosterona juegan un papel importante en la toma de riesgos durante decisiones financieras. <ref name="pmid19706398">{{cite journal | author = Sapienza P, Zingales L, Maestripieri D | title = Gender differences in financial risk aversion and career choices are affected by testosterone | journal = Proc. Natl. Acad. Sci. U.S.A. | volume = 106 | issue = 36 | pages = 15268–73 | year = 2009 | month = September | pmid = 19706398 | doi = 10.1073/pnas.0907352106 | url = | issn = | pmc = 2741240 |bibcode = 2009PNAS..10615268S }}</ref><ref name="Apicella_2008">{{cite journal | author = Apicella CL, Dreber A, Campbell B, Gray PB, Hoffman M, Little AC | title = Testosterone and financial risk preferences | journal = Evolution and Human Behavior | volume = 29 | issue = 6 | pages = 384–390 | year = 2008 | month = November | pmid = | doi = 10.1016/j.evolhumbehav.2008.07.001 | url = | issn = }}</ref> |
|||
*La administración de testosterona hace a los varones mas egoístas y mas probable de castigar a otros por ser egoístas con ellos.<ref name="Zak_2009">{{cite journal | author = Zak PJ, et al. | title = Testosterone administration decreases generosity in the ultimatum game| journal = PLoS ONE | volume = 4 | pages = e8330 | year = 2009 | pmid = | doi = 10.1371/journal.pone.0008330 | url = http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0008330| issn = |bibcode = 2009PLoSO...4.8330Z }}</ref> |
|||
*La paternidad también disminuye los niveles de testosterona en los hombres, sugiriendo que los cambios en el comportamiento y emocionales promueven el cuidado paternal.<ref>{{cite journal | author = Berg SJ, Wynne-Edwards KE | year = 2001 | title = Changes in testosterone, cortisol, and estradiol levels in men becoming fathers | url = | journal = Mayo Clinic Proceedings | volume = 76 | issue = 1| pages = 582–592 }}</ref> |
|||
*En los animales ([[tetraoninos]] y los [[lagarto ágil|lagartos ágiles]]), los niveles altos de testosterona han sido relacionadas con una reducción en la actividad del [[sistema inmune]]. La testosterona parece haberse vuelto parte del sistema de señalización honesta entre las potenciales parejas en el curso de la evolución.<ref name="Braude_1999">{{cite journal | author = Braude S, Tang-Martinezb Z, Taylor GT | title = Stress, testosterone, and the immunoredistribution hypothesis | journal = Behavioral Ecology | volume = 10 | issue = 3 | pages = 345–350 | year = 1999 | month = March| doi = 10.1093/beheco/10.3.345| url = http://beheco.oxfordjournals.org/cgi/content/full/10/3/345 | issn = }}</ref><ref name="pmid11413653">{{cite journal | author = Olsson M, Wapstra E, Madsen T, Silverin B | title = Testosterone, ticks and travels: a test of the immunocompetence-handicap hypothesis in free-ranging male sand lizards | journal = Proc. Biol. Sci. | volume = 267 | issue = 1459 | pages = 2339–43 | year = 2000 | month = November | pmid = 11413653 | pmc = 1690810 | doi = 10.1098/rspb.2000.1289 | url = | issn = }}</ref> |
|||
| ⚫ | <!-- FAVOR DE INTRODUCIR ESTA INFORMACIÓN A LAS SECCIONES CORRESPONDIENTES DE ARRIBA 1. Acciones sexuales: La testosterona es necesaria para el normal desarrollo de los genitales externos e internos masculinos. Ello sucede durante el primer trimestre de la vida fetal. Si la síntesis fetal de andrógenos es insuficiente, por un error enzimático congénito o por defectos del receptor, el fenotipo genital puede ser femenino o ambiguo. Son los llamados pseudohermafroditas masculinos (síndrome de Morrison), que presentan testículos pero cuyos genitales se desarrollan según el modelo femenino. los verdaderos hermafroditas tienen ovario y testículo. En la época prepuberal hay una secreción mínima de testosterona. A través de mecanismos no bien conocidos, las secreciones de LH y FSH aumentan progresivamente en la [[pubertad]]. El tamaño testicular crece también por acción de la hormona de crecimiento, el número de células de Leydig aumenta y la concentración plasmática de testosterona también se incrementa progresivamente dando lugar a la maduración sexual. Resumiendo la testosterona produce los siguientes efectos sobre los órganos sexuales primarios: |
||
# Promueve el crecimiento del [[escroto]], [[pene]] y glándulas secretorias sexuales. |
# Promueve el crecimiento del [[escroto]], [[pene]] y glándulas secretorias sexuales. |
||
# Aumenta el peso y crecimiento testicular. |
# Aumenta el peso y crecimiento testicular. |
||
| Línea 131: | Línea 150: | ||
4. Estímulo de la [[eritropoyesis]]: Los efectos eritropoyéticos de los andrógenos son bien conocidos. La concentración de [[hemoglobina]] es habitualmente de 1 a 2g/dl superior en el hombre adulto que en la mujer o en los niños. Además es frecuente observar una [[anemia]] moderada en hombres hipogonadotrópicos. Los andrógenos estimulan la eritropoyesis a través de un incremento en la producción renal de [[eritropoyetina]]. El efecto eritropoyético de la testosterona no se observa en ratas nefrectomizadas bilateralmente, ni en ratas normales que previamente recibieron anticuerpos contra la eritropoyetina. Debido a estos efectos los andrógenos han sido utilizados para el tratamiento de [[anemia aplásica|anemias aplásicas]] de distintas etiologías con respuestas variadas. También fue observado un efecto eritropoyético en pacientes con anemia asociada a insuficiencia renal crónica (IRC) tratados con andrógenos. Los efectos de la testosterona en la anemia de la IRC son sin embargo controvertidos. Actualmente se han observado efectos directos estimulantes de la eritropoyesis en cultivos celulares de médula ósea por la testosterona. Así se ha demostrado un aumento del desarrollo del número de colonias eritroides BFU-E y CFU-E en placas de cultivo que contenían testosterona. |
4. Estímulo de la [[eritropoyesis]]: Los efectos eritropoyéticos de los andrógenos son bien conocidos. La concentración de [[hemoglobina]] es habitualmente de 1 a 2g/dl superior en el hombre adulto que en la mujer o en los niños. Además es frecuente observar una [[anemia]] moderada en hombres hipogonadotrópicos. Los andrógenos estimulan la eritropoyesis a través de un incremento en la producción renal de [[eritropoyetina]]. El efecto eritropoyético de la testosterona no se observa en ratas nefrectomizadas bilateralmente, ni en ratas normales que previamente recibieron anticuerpos contra la eritropoyetina. Debido a estos efectos los andrógenos han sido utilizados para el tratamiento de [[anemia aplásica|anemias aplásicas]] de distintas etiologías con respuestas variadas. También fue observado un efecto eritropoyético en pacientes con anemia asociada a insuficiencia renal crónica (IRC) tratados con andrógenos. Los efectos de la testosterona en la anemia de la IRC son sin embargo controvertidos. Actualmente se han observado efectos directos estimulantes de la eritropoyesis en cultivos celulares de médula ósea por la testosterona. Así se ha demostrado un aumento del desarrollo del número de colonias eritroides BFU-E y CFU-E en placas de cultivo que contenían testosterona. |
||
5. Acciones antineoplásicas: La testosterona posee acciones antineoplásicas en el [[cáncer de mama|carcinoma de mama]] avanzado y metastásico inoperable y donde la [[radioterapia]] no tiene indicación. El mecanismo de la acción antineoplásica no es bien conocido pero existe un porcentaje de efectos positivos en aproximadamente el 30% de los casos. Como este porcentaje de resultados favorables es menor que otros tratamientos hormonales del carcinoma de mama, el uso de andrógenos debe ser reservado como una alternativa de segunda línea. La mayor parte de los carcinomas sensibles a la andrógenoterapia poseen células con receptores específicos para los andrógenos que pueden detectarse con técnicas de unión de ligandos (binding) marcados [[radiactividad|radiactivamente]] en pacientes o en muestras de [[biopsia]]. Los carcinomas de mama o sus [[metástasis]] que poseen receptores responden en general a la terapia androgénica. En cambio los tumores que carecen de receptores no responden generalmente al tratamiento endocrino. Se ha especulado que en los casos de reactivación de las metástasis de un cáncer mamario que había respondido previamente al tratamiento con andrógenos, se asocie con la pérdida de la producción de la proteína receptora por parte de las células neoplásicas. Los andrógenos de mayor potencia son inaceptables en la mujer debido a la virilización y andrógenos menos potentes como el danazol producen efectos poco evidentes. El danazol es un derivado androgénico, también utilizado para el tratamiento de la [[endometriosis]], en la enfermedad fibroquística de la mama y en el [[síndrome de tensión premenstrual]]. Los efectos posiblemente se relacionen con las acciones antiestrogénicas. El danazol es también utilizado para el tratamiento del edema angioneurótico hereditario. |
5. Acciones antineoplásicas: La testosterona posee acciones antineoplásicas en el [[cáncer de mama|carcinoma de mama]] avanzado y metastásico inoperable y donde la [[radioterapia]] no tiene indicación. El mecanismo de la acción antineoplásica no es bien conocido pero existe un porcentaje de efectos positivos en aproximadamente el 30% de los casos. Como este porcentaje de resultados favorables es menor que otros tratamientos hormonales del carcinoma de mama, el uso de andrógenos debe ser reservado como una alternativa de segunda línea. La mayor parte de los carcinomas sensibles a la andrógenoterapia poseen células con receptores específicos para los andrógenos que pueden detectarse con técnicas de unión de ligandos (binding) marcados [[radiactividad|radiactivamente]] en pacientes o en muestras de [[biopsia]]. Los carcinomas de mama o sus [[metástasis]] que poseen receptores responden en general a la terapia androgénica. En cambio los tumores que carecen de receptores no responden generalmente al tratamiento endocrino. Se ha especulado que en los casos de reactivación de las metástasis de un cáncer mamario que había respondido previamente al tratamiento con andrógenos, se asocie con la pérdida de la producción de la proteína receptora por parte de las células neoplásicas. Los andrógenos de mayor potencia son inaceptables en la mujer debido a la virilización y andrógenos menos potentes como el danazol producen efectos poco evidentes. El danazol es un derivado androgénico, también utilizado para el tratamiento de la [[endometriosis]], en la enfermedad fibroquística de la mama y en el [[síndrome de tensión premenstrual]]. Los efectos posiblemente se relacionen con las acciones antiestrogénicas. El danazol es también utilizado para el tratamiento del edema angioneurótico hereditario.--> |
||
<!-- FAVOR DE INTRODUCIR ESTA INFORMACIÓN A LA SECCIÓN "Infancia temprana" == Testosterona en el desarrollo fetal masculino == |
<!-- FAVOR DE INTRODUCIR ESTA INFORMACIÓN A LA SECCIÓN "Infancia temprana" == Testosterona en el desarrollo fetal masculino == |
||
Revisión del 03:38 14 jul 2011
| Testosterona | ||
|---|---|---|
| Archivo:Testosterone.svg | ||
 | ||
| Nombre (IUPAC) sistemático | ||
| (8R,9S,10R,13S,14S,17S)- 17-hydroxy-10,13-dimethyl- 1,2,6,7,8,9,11,12,14,15,16,17- dodecahydrocyclopenta[a]phenanthren-3-one | ||
| Identificadores | ||
| Número CAS | 58-22-0 | |
| Código ATC | G03BA03 | |
| PubChem | 6013 | |
| DrugBank | DB00624 | |
| ChEBI | 17347 | |
| Datos químicos | ||
| Fórmula | C19H28O2 | |
| Peso mol. | 288.42 | |
| Datos físicos | ||
| P. de fusión | 155 °C (311 °F) | |
| Rot. esp. | +110,2° | |
| Variación E.E.C. | −11080 kJ/mol | |
| Farmacocinética | ||
| Biodisponibilidad | Baja | |
| Metabolismo | Hígado, Testículo, y Próstata | |
| Vida media | 2-4 horas | |
| Excreción | Orina (90%), Heces (6%) | |
| Datos clínicos | ||
| Cat. embarazo | X. Restricción total del uso del fármaco. Los riesgos superan los beneficios potenciales (EUA) Efectos teratogénicos | |
| Estado legal | Lista IV (CA) Lista III (EUA) | |
| Vías de adm. |
Inyección intramuscular; Transdérmico (cremas, parches, geles) | |
La testosterona es una hormona esteroide del grupo andrógeno y es encontrada en mamíferos, repitles,[1] aves,[2] y otros vertebrados. En los mamíferos, la testosterona es producida principalmente en los testículos de los machos y en los ovarios de las hembras, aunque pequeñas cantidades son secretadas por las glándulas suprarrenales. Es la hormona sexual principal masculina y esteroide anabólico.
En los hombres, la testosterona juega un papel clave en el desarrollo de los tejidos reproductivos masculinos como los testículos y próstata como también la promoción de las características sexuales secundarias tales como el incremento de la masa muscular y ósea y el crecimiento del pelo corporal.[3] Además, la testosterona es esencial para la salud y el bienestar[4] como también la prevención de la osteoporosis.[5]
En promedio, el cuerpo de un adulto humano masculino produce alrededor de diez veces más testosterona que el cuerpo de un adulto humano femenino, pero las mujeres son más sensibles a la hormona.[6]
La testosterona es conservada a través de la mayoría de los vertebrados, aun que los peces producen una ligeramente distinta llamada 11-Ketotestosterone.[7] Su homólogo en los insectos es la ecdisona.[8] Estos esteroides ubicuos sugieren que las hormonas sexuales tienen una historia evolutiva antigua.[9]
Efectos fisiológicos
En general, los andrógenos promueven la biosíntesis proteica y el crecimiento de los tejidos con receptores androgénicos. Los efectos de la testosterona se puede clasificar como virilizante y anabólico, aunque la distinción es un poco artificial, ya que mucho de los efectos se podrían considerar como ambos. Las testosterona es anabólica, significando que promueve el crecimiento de masa ósea y muscular.
- Efectos anabólicos incluyen el crecimiento de la masa muscular y fuerza, el incremento de la densidad ósea y fuerza, y la estimulación del crecimiento longitudinal y la maduración de los huesos.
- Efectos androgénicos incluyen la maduración del los órganos sexuales, particularmente el pene y la formación del escroto en el feto, y después del nacimiento (usualmente en la pubertad) una profundización de la voz, crecimiento de la barba y vello axilar. Muchos de esto caen en la categoría de caracteres sexuales secundarios.
Los efectos de la testosterona también pueden ser clasificados por la edad de su ocurrencia. Para los efectos postnatales en ambos hombres y mujeres, estos son mayoritariamente dependientes de los niveles y duración de la testosterona libre circulante.
Prenatales
los efectos androgénicos prenatales ocurren entre 4 y 6 semanas de gestación.
- Virilización genital (fusion de la línea media, uretra fálica, adelgazamiento escrotal, crecimiento fálico); aunque el rol de la testosterona es mucho menor que la de la Dihidrotestosterona.
- Desarrollo de la próstata y las vesículas seminales.
- Identidad de género.[10]
Infancia temprana
los efectos androgénicos en la infancia temprana son los menos entendidos. En las primeras semanas de vida del infante masculino, los niveles de testosterona aumentan. Los niveles se mantienen en el rango puberal por algunos meses, pero usualmente alcanzan los niveles apenas detectables de la niñez a los 4-6 meses de vida.[11][12] La función de este aumento en los humanos es desconocida. Has sido especulado que la "masculinización del cerebro" está ocurriendo ya que no se han identificado cambios significativos en otras partes del cuerpo.[13] Sorpresivamente, el cerebro masculino es masculinizado por la testosterona siendo aromatizada a estrogeno, que cruza la barrera hematoencefálica y entra al cerebro masculino, mientras que los fetos femeninos tienen alfa-fetoproteína que se unen a los estrogenos de modo que el cerebro femenino no es afectado.[14]
Pre-peripuberal
los efectos androgénicos pre-peripuberales son los primeros efectos observables del incremento en los niveles de andrógenos al final de la infancia, ocurriendo en ambos niños y niñas.
- Olor corporal como los adultos
- Incremento aceitoso en la piel y pelo, acné
- Pubarquia (aparición de vello púbico)
- Vello axilar
- Crecimiento, maduración ósea acelerada
- Pelo en el labio superior y patillas.
Puberales
Los efectos puberales empiezan a ocurrir cuando los niveles androgénicos han estado mas altos que los de un adulto femenino por meses o años. En los varones, estos son usualmente efectos puberales que ocurren más al final de la pubertad, y ocurren en mujeres después de periodos prolongados de niveles elevados de testosterona libre en la sangre.
- Agrandamiento de las glándulas sebáceas. Esto podría causar acné.
- Agrandamiento fálico o clitoromegalia
- Incremento del libido y frecuencia de erecciónes o crecimiento clitoral
- Vello púbico se extiende hacia los muslos y para arriba hacia el ombligo
- Vello facial (patillas, barba, bigote)
- Perdida del pelo (Alopecia androgénica)
- Vello pectoral, vello periareolar, vello perianal
- Vello en las piernas
- Vello axilar
- La grasa subcutánea disminuye
- Incremento de la fuerza y masa muscular[15]
- Profundización de la voz
- Crecimiento de la nuez de Adán
- Crecimiento del tejido espermatogénico en los testículos, fertilidad masculina
- Crecimiento de la mandíbula, cejas, barbilla, nariz, y remodelación de los contornos de los huesos faciales
- Los hombros se vuelven más amplios y la caja torácica se expande
- La terminación de la maduración ósea y crecimiento óseo. Esto ocurre indirectamente vía los metabolitos del estradiol y por lo tanto ocurre de forma más gradual en los hombres que las mujeres.
Adulto
Los efectos de la testosterona en adultos son mas claramente demostrables en el varón que la mujere, pero son igualmente de importante para ambos sexos. Algunos de estos efectos pueden disminuir cuando los niveles de testosterona disminuyen en las ultimas décadas de la vida adulta.

- La testosterona es necesaria para el desarrollo normal del espermatozoide. La testosterona activa genes en las Células de Sertoli quienes promueves la diferenciación de espermatogonia.
- Regula la respuesta aguda del HHA (eje hipotalámico-hipofisario-adrenal bajo un desafío de dominancia[16]
- Energía física y mental
- Mantenimiento del trofismo muscular
- La testosterona regula la población de receptores Tromboxano A2 en megacariocitos y plaquetas y por lo tanto la agrupación de plaquetas en humanos[17][18]
- La testosterona no causa o produce efectos nocivos en el cáncer de próstata. En gente que se han sometido a terapia de privación de testosterona, incrementos de testosterona más allá de niveles de castrado han demostrado de incrementar la rapidez de propagación de un cáncer prostático existente.[19][20][21]
- Estudios recientes han mostrados resultados conflictivos acerca de la importancia de la testosterona en manteniendo la salud cardiovascular.[22][23] Sin embargo, mantener niveles normales de testosterona en hombres de la tercera edad ha demostrado la mejora de varios parámetros que se piensan que reducen el riesgo de enfermedades cardiovasculares, tales como el incremento de la masa magra, las disminución de la grasa visceral, disminución del colesterol total, y control sobre los niveles glucémicos.[24]
- Bajo un desafío de dominancia, la testosterona puede que juegue un papel en la regulación de la respuesta de "lucha o huida"[25]
- Enamorarse disminuye los niveles de testosterona en los hombres mientras que incrementa los niveles de las mujeres. Es especulado que estos cambios en los niveles de testosterona resulten en la reducción temporal de las diferencias del comportamiento entre ambos sexos.[26] Se ha comprobado que cuando la testosterona y las endorfinas en el semen eyaculado se encuentran con la pared cervical después de una relación sexual, las mujeres reciben un golpe de testosterona, endorfina, y oxitocina, y los varones después del orgasmo experimentan un incremento de endorfinas y un incremento marcado en los niveles de oxitocina. Esto se añade al entorno fisiológico acogedor en el tracto reproductivo femenino para la concepción, y luego para la alimentación del embrión, y estimula el sentimiento de amor, deseo, y cuidado paternal en los varones (esta es la única ves que los niveles de oxitocina del varón rivalizan con los de las mujeres).[27]
- Estudios recientes sugieren que los niveles de testosterona juegan un papel importante en la toma de riesgos durante decisiones financieras. [28][29]
- La administración de testosterona hace a los varones mas egoístas y mas probable de castigar a otros por ser egoístas con ellos.[30]
- La paternidad también disminuye los niveles de testosterona en los hombres, sugiriendo que los cambios en el comportamiento y emocionales promueven el cuidado paternal.[31]
- En los animales (tetraoninos y los lagartos ágiles), los niveles altos de testosterona han sido relacionadas con una reducción en la actividad del sistema inmune. La testosterona parece haberse vuelto parte del sistema de señalización honesta entre las potenciales parejas en el curso de la evolución.[32][33]
Estructura química
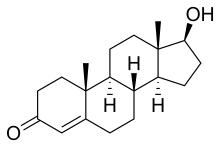
La testosterona es un andrógeno, esteroide derivado del ciclopentanoperhidrofenantreno, que tiene 19 átomos de carbono, un doble enlace entre C4 y C5, un átomo de oxígeno en C3 y un radical hidroxilo (OH) en C12. Su fórmula es C19H28O2. Esta estructura es necesaria para el mantenimiento de la actividad androgénica. La testosterona puede ser aromatizada en varios tejidos para formar estradiol, de tal manera que en el hombre es normal una producción diaria de 50 microgramos. El papel del estradiol en el hombre aún no está aclarado, pero su exceso absoluto o relativo puede provocar feminización. La testosterona del testículo es producida por las células de Leydig, pero también es sintetizada en otros tejidos a partir de los andrógenos circulantes (DHEA,DHEA-S), provenientes de la corteza suprarrenal (zona reticular).
Derivados sintéticos de la testosterona
Los derivados de la testosterona se originan a partir de modificaciones de su estructura química.
A) Testosterona oral: El agregado de grupos metilos en C1, C7 y C17 aumenta la actividad biológica. La 17-alfa-metiltestosterona es un derivado especial porque conserva su acción androgénica y es activa por vía oral. La fluoximesterona es un derivado fluorado en C9 de la metiltestosterona. Estos derivados alquilados de la testosterona son metabolizados lentamente en el hígado, después de su absorción oral. Sin embargo la hepatotoxicidad, ictericia colestásica principalmente, y la incidencia de adenocarcinoma hepático aumenta en pacientes tratados durante períodos prolongados de tiempo con estos andrógenos 17-alquil-sustituidos. La testosterona natural, en cambio, sufre una rápida degradación en su primer paso por el hígado y no produce prácticamente estos efectos adversos.
B) Testosterona parenteral: La esterificación de la testosterona en posición del OH en C17 aumenta la liposolubilidad de la testosterona y prolonga su acción. El propionato de testosterona es particularmente activo por vía parenteral y de acción relativamente corta, 1-2 días. El ciclopentilpropionato o cipionato y el enantato son andrógenos de acción prolongada. Administrados por vía intramuscular profunda producen efectos androgénicos durante 2 ó 3 semanas. Los ésteres son convertidos en testosterona libre en la circulación. La testosterona se ha administrado también por vía subcutánea y últimamente se ha administrado testosterona por vía transdérmica a través de un parche autoadhesivo que se aplica en la piel del escroto aprovechando que en esta superficie la absorción es considerablemente mayor que en el resto de la piel (Testoderm). Aunque también hay parches cuya aplicación se debe hacer en otras partes del cuerpo como el abdomen o los muslos (Androderm). Existen también geles de reciente aparición cuya aplicación es transdermal (Testim y Testogel).
Síntesis, secreción y circulación de la testosterona

Las células de Leydig del testículo son el lugar de síntesis principal de la testosterona a partir del colesterol. También se puede sintetizar en la zona rugosa de la corteza suprarrenal, en las células tecales del ovario y en la placenta. La gonadotropina hipofisaria LH, hormona luteinizante, es la hormona reguladora específica de la producción de la testosterona. La acción de la LH, está mediada por la activación de la adenilciclasa y proteínas específicas reguladoras de nucleótidos de guanina (proteínas G), para la producción intracelular de AMPc. Además la acción de la LH, también puede precipitar la activación de fosfolipasa C e incremento de la producción de los segundos mensajeros, diacilglicerol (DAG) e inositol trifosfato (IP3) a partir de fosfoinositoles de la membrana plasmática. Otras hormonas que influyen en grados variables la síntesis de la testosterona, son la prolactina, el cortisol, la insulina, factor de crecimiento insulínico (insulin-like growth factor), estradiol, e inhibina. El AMPc activa la captación de acetato procedente de la glucosa o del metabolismo lipídico y la síntesis del colesterol en el retículo endoplásmico liso. El colesterol es transformado por enzimas mitocondriales en pregnenolona, que es el precursor de la testosterona, vía 17-alfa-pregnenolona, dihidroepiandrosterona, androstendiona y finalmente testosterona. Las células testiculares de Sértoli, tienen como función principal el control de la espermatogénesis y su función biológica es regulada por la gonadotropina FSH u hormona folículoestimulante. Las células de Sértoli también producen una proteína transportadora de andrógenos, ABP, (androgen binding protein), que sirve para fijar la testosterona en el testículo y es la proteína específica en el transporte de testosterona por la circulación sanguínea. Las células de Sértoli también producen testosterona en cantidades limitadas. Estas células están localizadas en los túbulos seminíferos y la testosterona producida parece tener una acción local de especial importancia en la espermatogénesis. La testosterona producida por las células de Leydig, es la que pasa a la circulación sanguínea.
La concentración plasmática de testosterona en el adulto normal es de 300 a 1000 nanogramos/dl. Antes de la pubertad la concentración es menor a 20 ng/dl. El contenido de testosterona en el testículo humano es de aproximadamente 300 ng/g de tejido. En el hombre adulto el testículo produce entre 2,5 y 11 mg/día de testosterona. En la mujer los ovarios producen aproximadamente 0.25 mg/día de testosterona.
La LH y la FSH tienen también efectos tróficos al estimular el crecimiento testicular, en el que también interviene la hormona del crecimiento. La testosterona a través de un mecanismo de retroalimentación negativa inhibe la secreción de gonadotropinas aunque este mecanismo no ha sido completamente aclarado. De todos modos es evidente que disminuye la liberación del factor de liberación gonadotrópico. Las células de Sertoli secretan una serie de proteínas, algunas de las cuales entran en la luz del túbulo seminífero y son importantes para la espermatogénesis, mientras que otras son segregadas hacia la capa basal de las células y entran en la circulación sistémica. Así las células de Sértoli segregan la mencionada ABP, transferrina y un agente de tipo hormonal llamado inhibina. La administración parenteral de testosterona y de andrógenos anabólicos, sobre todo si estos últimos son usados indiscriminadamente o durante períodos prolongados de tiempo, producen la supresión por retroalimentación negativa de la secreción de LH. También en dosis altas suprimen la secreción de FSH, lo que conduce a medio o largo plazo a la atrofia o hipotrofia del tejido intersticial y la anulación o marcada disminución de la producción endocrina de testosterona.
Mecanismo de acción
La testosterona (hormona sexual masculina) y los andrógenos atraviesan fácilmente la membrana celular y se unen a receptores intracelulares específicos. Estos receptores que han sido purificados, son proteínas con un peso molecular de aproximadamente 120 kilodaltons. Su síntesis está determinada genéticamente en el cromosoma X. La DHT se une en un sitio del receptor cerca de un grupo carboxilo terminal. El complejo receptor-esteroide se activa y es transportado al núcleo celular y se une en un sitio receptor del ADN, aumentado la actividad de la ARN polimerasa y la formación de ARN mensajeros estimulando la síntesis de proteínas celulares responsables finales de las acciones fisiofarmacológicas. El músculo esquelético no posee receptores de testosterona o a la DHT por lo que los efectos anabólicos no son aún lo suficientemente explicados. Se ha sugerido que los andrógenos podrían bloquear en el músculo los receptores citosólicos de los glucocorticoides inhibiendo las acciones catabólicas de estos agentes.
Farmacocinética
La testosterona no se administra por vía oral ya que es rápidamente metabolizada en el hígado. En cambio los ésteres, propionato, cipionato o enantato administrados por vía intramuscular son activos farmacológicamente. La metiltestosterona, fluoximesterona y los andrógenos anabólicos pueden administrarse por vía oral, son de acción corta y generan importantes efectos adversos después de un uso prolongado. La testosterona circula ligada a proteínas en un 98-99%. Entre estas están la GBG (gonadal steroids binding protein) mas conocida como SHBG (Steroids Hormone Binding Globulin)y la albúmina y entre 1-2% circula libre. Dado que la SHBG liga solo una molécula de testosterona con alta afinidad y la albúmina varias moléculas con baja afinidad, se define el término testosterona biodisponible como la suma de la libre con la unida a la albumina. La testosterona se introduce por difusión simple en las células diana dada su liposolubilidad. En muchos tejidos diana es convertida enzimáticamente a dihidrotestosterona (DHT) por la acción de una enzima llamada 5-alfa-reductasa. La DHT es más activa que la testosterona. Una de las formas de pseudohermafroditismo se debe a la falta, determinada genéticamente, de esta enzima. En ella, la ausencia de DHT impide que se desarrollen los genitales externos masculinos en el feto genéticamente varón. En cambio la acción de inhibición de la secreción de LH no requiere la conversión a DHT. La biotransformación ocurre en el hígado por oxidación del grupo 17-OH, reducción del anillo A o del grupo cetónico en C3. Los principales metabolitos que se eliminan por orina, previamente conjugados con ácido glucurónico y sulfatos, son la etiocolonalona, metabolito de la testosterona y la androsterona, metabolito de la dihidrotestosterona, (ambos inactivos). Estos son 17-cetoesteroides que se encuentran en orina con otros 17 cetoesteroides procedentes de la corteza suprarrenal, metabolitos de la androstendiona y de la dihidroepiandrosterona. Los de origen testicular constituyen aproximadamente el 30% de los 17-cetoesteroides urinarios. La metiltestosterona y la fluoximesterona se metabolizan más lentamente, en menor grado, y por lo tanto poseen una vida media mayor que la testosterona.
Usos terapéuticos
- Hipogonadismos: Como tratamiento hormonal sustitutivo. Por falta de producción de testosterona, debido a enfermedad testicular o de origen hipofisario congénito o adquirido (falta de secreción de LH). El hipogonadismo puede ser tratado con andrógenos cuando la pubertad se retrasa en su aparición, aunque el uso terapéutico es todavía muy discutido en estos casos. La administración de andrógenos no debe ser continua porque el crecimiento puede detenerse al soldarse las epífisis por la acción androgénica. El hipogonadismo hipofisario puede responder ocasionalmente a la administración de análogos de los factores de liberación gonadotrópica como la leuprolida y buserelina y también a la administración de gonadotropinas hipofisarias. Cuando el hipogonadismo ocurre después de la pubertad, tras la maduración sexual, las dosis de andrógenos de sustitución pueden ser menores que en el caso anterior. En caso de hipopituitarismo (insuficiencia global de la hipófisis anterior) los andrógenos pueden administrarse conjuntamente con somatotropina, tiroxina y un corticosteroide. La testosterona debe retrasarse lo máximo posible con el fin de permitir el máximo crecimiento y estatura.
- Climaterio masculino: Es un estado fisiopatológico discutido, la castración quirúrgica por ejemplo se acompaña de signos típicos de supresión tipo climaterio, pero en el envejecimiento normal esta situación no ocurre. Después de los 50-60 años se observa una disminución de la libido, disminución de la producción de semen y de la espermatogénesis, menor actividad sexual y disminución de la masa muscular y corporal. Puede demostrarse un incremento de gonadotropinas plasmáticas, lo que indicaría una menor secreción de testosterona. El tratamiento sustitutivo con testosterona en los casos de andropausia o climaterio masculino, cuyo principal síntoma es la impotencia está muy discutido y las respuestas positivas son muy poco frecuentes.
- Osteoporosis: La testosterona y principalmente los andrógenos anabólicos han sido utilizados para el tratamiento de la osteoporosis postmenopáusica en la mujer con buenos resultados. El balance de nitrógeno positivo el estímulo a la retención de fósforo y calcio y la formación del hueso determinan esta indicación. Su utilización clínica debe ser sin embargo cuidadosamente controlada dado los efectos adversos que pueden desarrollarse.
- Anemia: La testosterona fue utilizada en el tratamiento de diversas anemias, en general su uso puede ser el tratamiento de anemias refractarias. Sus efectos son principalmente indirectos, previo estímulo a la secreción de eritropoyetina. Se ha indicado el tratamiento con andrógenos en anemias aplásicas, por mielofibrosis o por insuficiencia renal crónica. En este último caso la administración de andrógenos ha caído en desuso por la síntesis de eritropoyetina recombinante humana, de elección en este tipo de anemia.
- Carcinoma de mama metastásico: Un 20-30% de pacientes con cáncer de mama metastásico inoperable, pueden responder con una remisión al tratamiento androgénico. Su uso es solo paliativo, de segunda línea y los resultados transitorios.
- Edema angioneurótico hereditario: Este padecimiento se caracteriza por edemas recurrentes en piel y mucosas. Estos pacientes carecen de la función del inhibidor del primer componente activador del complemento y los andrógenos parecen aumentar la concentración plasmática de esta proteína.
- Usos en estados catabólicos: En casos de desnutrición crónica, pérdida de proteínas, balance de nitrógeno negativo, los andrógenos pueden ejercer algunos efectos positivos. Su uso sin embargo debe ser rigurosamente controlado. Se han utilizado en la caquexia cancerosa y en sida, pero el acetato de megestrol los ha desbancado. También pueden estimular el crecimiento prepuberal en jóvenes con baja estatura. En este último caso se debe prestar mucha atención porque después de un crecimiento inicial rápido se produce el cierre acelerado de las epífisis.
- Rendimiento atlético: Los andrógenos son frecuentemente utilizados en forma indiscriminada por atletas para mejorar el rendimiento de los mismos. Debe enfatizarse que todas las drogas anabólicas poseen también efectos androgénicos. Estos efectos limitan el uso de estos agentes por los efectos adversos que inevitablemente aparecen: disminución de la espermatogénesis, esterilidad, disminución de la libido, ginecomastia y efectos feminizantes por supresión de la secreción de gonadotropinas. Las acciones adversas en hombres adultos son reversibles en general, aunque la supresión de la espermatogénesis puede persistir durante mucho tiempo o ser permanente.
- Trastorno de identidad de género: En el caso de los transexuales masculinos, es decir, de las personas transexuales que transicionan de mujer a 'hombre', el uso de los andrógenos como tratamiento hormonal tiene un objetivo doble: por un lado, revertir, en la medida de lo posible, las características sexuales secundarias del cuerpo femenino del cual parten, y por otro lado, la consecución de las características sexuales secundarias masculinas que desean. Dicho tratamiento es parcialmente reversible mientras no se produzca extirpación de las gónadas. Una vez producida la extirpación de los ovarios, el tratamiento hormonal se convierte en crónico pues estos hombres transexuales se convierten en hombres hipogonadales con necesidad de tratamiento hormonal sustitutorio como cualquier otro hombre de su edad.
Niveles alterados de testosterona en sangre
Los niveles más altos de testosterona se encuentran después de la adolescencia, entre 800 y 1200 nanogramos por decilitro (ng/dl) de sangre. Estos niveles se mantienen durante aproximadamente diez o veinte años, después de los cuales comienzan a disminuir alrededor del 1 por ciento por año.
- Los niveles aumentados de testosterona en sangre pueden ocurrir en:
- Pubertad precoz.
- Resistencia a los andrógenos.
- Cáncer de ovario.
- Hiperplasia suprarrenal congénita.
- Enfermedad ovárica poliquística.
- Cáncer testicular.
- Los niveles disminuidos de testosterona pueden ocurrir en:
- Hipopituitarismo.
- Insuficiencia testicular.
- Retraso en la pubertad.
- Enfermedad crónica.
- Prolactinoma.
Efectos adversos de los andrógenos
- Efectos androgénicos adversos (masculinización): Estos efectos son dosis dependientes en general y ocurren cuando los tejidos diana son estimulados excesivamente. Adquieren una mayor trascendencia en la mujer y en niños en edad prepuberal. En la mujer puede aparecer crecimiento de la barba, voz grave, irregularidades del ciclo menstrual, amenorrea, aumento de la masa muscular viril, hipertrofia del clítoris y otros. Estos efectos ocurren en realidad después de tratamientos prolongados, como en el tratamiento paliativo del cáncer mamario metastásico. En niños en la etapa prepuberal, la testosterona acelera el cierre epifisario, produce una maduración sexual precoz y detención del crecimiento. En los hombres la testosterona puede producir priapismo, acné, policitemia moderada y aumento del tamaño prostático. Por este motivo los andrógenos están contraindicados ante la sospecha de un cáncer de próstata. Los andrógenos también producen una disminución de las HDL (lipoproteínas de alta densidad) por lo que son aterogénicos.
- Hepatotoxicidad: Ictericia colestásica. Los andrógenos 17-alquil-sustituidos como la metiltestosterona y la fluoximesterona pueden producir ictericia colestásica, caracterizada por ictericia, acumulación y espesamiento de la bilis en los canalículos biliares de los lobulillos hepáticos. Este efecto puede ser una respuesta idiosincrática. En principio no hay agresión a los hepatocitos, ni obstrucción de los canalículos biliares mayores. La ictericia se acompaña de hiperbilirrubinemia, aumento de Aspartato aminotransferasa y fosfatasa alcalina. La ictericia colestásica no se observa con la administración parenteral de la testosterona. Los andrógenos de uso oral por lo tanto, deben ser solamente utilizados en tratamientos de corta duración y están contraindicados en pacientes con enfermedad hepática.
- Carcinoma hepático: La incidencia de adenocarcinoma hepático aumenta significativamente en pacientes que han recibido tratamientos con andrógenos 17-alquil-sustituidos, durante largo período de tiempo (1 a 7 años).
- Cáncer de próstata: Se ha descrito que varones fisioculturistas que han consumido anabolizantes androgénicos con la intención de aumentar su masa muscular y rendimiento físico, han desarrollado carcinoma prostático precozmente (antes de los 50 años).
- Retención hidrosalina: Por sus efectos mineralcorticoides los andrógenos pueden producir retención hidrosalina. El edema franco secundario al tratamiento androgénico solo se observa cuando se administran grandes dosis para el tratamiento de enfermedades neoplásicas (cáncer). El edema puede ser más importante en pacientes con insuficiencia cardíaca congestiva o con insuficiencia renal. Este efecto puede además complicar una hipertensión arterial. La retención hidrosalina puede ser tratada con diuréticos tiazídicos.
- Disminución de la espermatogénesis y efectos secundarios feminizantes: En tratamientos prolongados con andrógenos se suprime la secreción de gonadotropinas que provoca hipotrofia testicular, disminución del peso de los testículos y supresión de la espermatogénesis. La inhibición de la secreción de gonadotropinas puede también ocasionar azoospermia e incremento de la conversión de andrógenos en estrógenos. Por eso la concentración plasmática de estrógenos aumenta en el hombre que recibe andrógenos. La actividad de la enzima aromatasa que provoca la aromatización de la testosterona y su conversión a estradiol es mayor, sobre todo en niños y en pacientes con enfermedad hepática subyacente. Los efectos secundarios feminizantes son a veces importantes (ginecomastia, disminución de la libido y de la espermatogénesis) y los abolizante androgénico esteroideo pueden producir los mismos efectos. Debido a los numerosos efectos adversos, el uso indiscriminado de andrógenos anabólicos ha sido prohibido por el Comité Olímpico Internacional y numerosos países se han adherido a esta resolución.
Referencias
- ↑ Cox RM, John-Alder HB (December de 2005). «Testosterone has opposite effects on male growth in lizards (Sceloporus spp.) with opposite patterns of sexual size dimorphism». J. Exp. Biol. 208 (Pt 24): 4679-87. PMID 16326949. doi:10.1242/jeb.01948.
- ↑ Reed WL, Clark ME, Parker PG, Raouf SA, Arguedas N, Monk DS, Snajdr E, Nolan V, Ketterson ED (May de 2006). «Physiological effects on demography: a long-term experimental study of testosterone's effects on fitness». Am. Nat. 167 (5): 667-83. PMID 16671011. doi:10.1086/503054. Resumen divulgativo – ScienceDaily.
- ↑ Mooradian AD, Morley JE, Korenman SG (February de 1987). «Biological actions of androgens». Endocr. Rev. 8 (1): 1-28. PMID 3549275. doi:10.1210/edrv-8-1-1.
- ↑ Bassil N, Alkaade S, Morley JE (June de 2009). «The benefits and risks of testosterone replacement therapy: a review». Ther Clin Risk Manag 5 (3): 427-48. PMC 2701485. PMID 19707253.
- ↑ Tuck SP, Francis RM (2009). «Testosterone, bone and osteoporosis». Front Horm Res 37: 123-32. PMID 19011293. doi:10.1159/000176049.
- ↑ Dabbs M, Dabbs JM (2000). Heroes, rogues, and lovers: testosterone and behavior. New York: McGraw-Hill. ISBN 0-07-135739-4.
- ↑ Nelson, Randy F. (2005). An introduction to behavioral endocrinology. Sunderland, Mass: Sinauer Associates. p. 143. ISBN 0-87893-617-3.
- ↑ De Loof A, Arnold (October de 2006). «Ecdysteroids: the overlooked sex steroids of insects? Males: the black box». Insect Science 13 (5): 325-338. doi:10.1111/j.1744-7917.2006.00101.x.
- ↑ Mechoulam R, Brueggemeier RW, Denlinger DL, R.; Brueggemeier, R. W.; Denlinger, D. L. (September de 1984). «Estrogens in insects». Journal Cellular and Molecular Life Sciences 40 (9): 942-944. doi:10.1007/BF01946450.
- ↑ Swaab DF, Garcia-Falgueras A (2009). «Sexual differentiation of the human brain in relation to gender identity and sexual orientation». Funct. Neurol. 24 (1): 17-28. PMID 19403051.
- ↑ Forest MG, Cathiard AM, Bertrand JA (July de 1973). «Evidence of testicular activity in early infancy». J. Clin. Endocrinol. Metab. 37 (1): 148-51. PMID 4715291. doi:10.1210/jcem-37-1-148.
- ↑ Corbier P, Edwards DA, Roffi J (1992). «The neonatal testosterone surge: a comparative study». Arch Int Physiol Biochim Biophys 100 (2): 127-31. PMID 1379488. doi:10.3109/13813459209035274.
- ↑ Dakin CL, Wilson CA, Kalló I, Coen CW, Davies DC (May de 2008). «Neonatal stimulation of 5-HT(2) receptors reduces androgen receptor expression in the rat anteroventral periventricular nucleus and sexually dimorphic preoptic area». Eur. J. Neurosci. 27 (9): 2473-80. PMID 18445234. doi:10.1111/j.1460-9568.2008.06216.x.
- ↑ http://homepage.psy.utexas.edu/homepage/class/psy308/Humm/ReviewofSexualDifferentiation
- ↑ Bhasin S, Storer TW, Berman N, Callegari C, Clevenger B, Phillips J, Bunnell TJ, Tricker R, Shirazi A, Casaburi R (July de 1996). «The effects of supraphysiologic doses of testosterone on muscle size and strength in normal men». N. Engl. J. Med. 335 (1): 1-7. PMID 8637535. doi:10.1056/NEJM199607043350101.
- ↑ Mehta PH, Jones AC, Josephs RA (June de 2008). «The social endocrinology of dominance: basal testosterone predicts cortisol changes and behavior following victory and defeat». J Pers Soc Psychol 94 (6): 1078-93. PMID 18505319. doi:10.1037/0022-3514.94.6.1078.
- ↑ Ajayi AA, Halushka PV (May de 2005). «Castration reduces platelet thromboxane A2 receptor density and aggregability». QJM 98 (5): 349-56. PMID 15820970. doi:10.1093/qjmed/hci054.
- ↑ Ajayi AA, Mathur R, Halushka PV (June de 1995). «Testosterone increases human platelet thromboxane A2 receptor density and aggregation responses». Circulation 91 (11): 2742-7. PMID 7758179.
- ↑ Morgentaler A, Schulman C (2009). «Testosterone and prostate safety». Front Horm Res 37: 197-203. PMID 19011298. doi:10.1159/000176054.
- ↑ Rhoden, E.L., M.A. Averbeck, and P.E. Teloken (2008). «Androgen replacement in men undergoing treatment for prostate cancer». J Sex Med 5 (9): 2202-8. PMID 18638000. doi:10.1111/j.1743-6109.2008.00925.x.
- ↑ Morgentaler, A. and A.M. Traish (2009). «Shifting the paradigm of testosterone and prostate cancer: the saturation model and the limits of androgen-dependent growth». Eur Urol 55 (2): 310-20. PMID 18838208. doi:10.1016/j.eururo.2008.09.024.
- ↑ Haddad RM, Kennedy CC, Caples SM, Tracz MJ, Boloña ER, Sideras K, Uraga MV, Erwin PJ, Montori VM (January de 2007). «Testosterone and cardiovascular risk in men: a systematic review and meta-analysis of randomized placebo-controlled trials». Mayo Clin. Proc. 82 (1): 29-39. PMID 17285783. doi:10.4065/82.1.29.
- ↑ Jones TH, Saad F (April de 2009). «The effects of testosterone on risk factors for, and the mediators of, the atherosclerotic process». Atherosclerosis 207 (2): 318-27. PMID 19464009. doi:10.1016/j.atherosclerosis.2009.04.016.
- ↑ Stanworth RD, Jones TH (2008). «Testosterone for the aging male; current evidence and recommended practice». Clin Interv Aging 3 (1): 25-44. PMC 2544367. PMID 18488876.
- ↑ Error en la cita: Etiqueta
<ref>no válida; no se ha definido el contenido de las referencias llamadaspmid16928375 - ↑ Marazziti D, Canale D (August de 2004). «Hormonal changes when falling in love». Psychoneuroendocrinology 29 (7): 931-6. PMID 15177709. doi:10.1016/j.psyneuen.2003.08.006.
- ↑ Marazziti D, Canale D (August de 2004). Hormonal changes when falling in love 29 (7). pp. 931-6. PMID 15177709. doi:10.1016/j.psyneuen.2003.08.006.
- ↑ Sapienza P, Zingales L, Maestripieri D (September de 2009). «Gender differences in financial risk aversion and career choices are affected by testosterone». Proc. Natl. Acad. Sci. U.S.A. 106 (36): 15268-73. Bibcode:2009PNAS..10615268S. PMC 2741240. PMID 19706398. doi:10.1073/pnas.0907352106.
- ↑ Apicella CL, Dreber A, Campbell B, Gray PB, Hoffman M, Little AC (November de 2008). «Testosterone and financial risk preferences». Evolution and Human Behavior 29 (6): 384-390. doi:10.1016/j.evolhumbehav.2008.07.001.
- ↑ Zak PJ, et al. (2009). «Testosterone administration decreases generosity in the ultimatum game». PLoS ONE 4: e8330. Bibcode:2009PLoSO...4.8330Z. doi:10.1371/journal.pone.0008330.
- ↑ Berg SJ, Wynne-Edwards KE (2001). «Changes in testosterone, cortisol, and estradiol levels in men becoming fathers». Mayo Clinic Proceedings 76 (1): 582-592.
- ↑ Braude S, Tang-Martinezb Z, Taylor GT (March de 1999). «Stress, testosterone, and the immunoredistribution hypothesis». Behavioral Ecology 10 (3): 345-350. doi:10.1093/beheco/10.3.345.
- ↑ Olsson M, Wapstra E, Madsen T, Silverin B (November de 2000). «Testosterone, ticks and travels: a test of the immunocompetence-handicap hypothesis in free-ranging male sand lizards». Proc. Biol. Sci. 267 (1459): 2339-43. PMC 1690810. PMID 11413653. doi:10.1098/rspb.2000.1289.
Véase también
Enlaces externos
- Ficha técnica de la testosterona en el sitio web del NIST
- Testostena: Artículo divulgativo
- Algo sobre testosterona
- Testosterona / Andropausia(Hipogonadismo) Informacion sobre Testosterona / Andropausia (Hipogonadismo)
- Artículo de la AESS sobre la testosterona como tratamiento de la disfunción eréctil
