Glicerol
| Glicerol | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| 1,2,3-propanotriol[1] | ||
| General | ||
| Otros nombres |
Glicerol Glicerina Propanotriol 1,2,3-Propanotriol 1,2,3-Trihidroxipropano | |
| Fórmula semidesarrollada | HOCH2-CHOH-CH2OH | |
| Fórmula estructural |
| |
| Fórmula molecular | C3H8O3 | |
| Identificadores | ||
| Número CAS | 56-81-5[2] | |
| Número RTECS | MA8050000 | |
| ChEBI | 17754 | |
| ChEMBL | CHEMBL692 | |
| ChemSpider | 733 | |
| DrugBank | DB09462 | |
| PubChem | 753 | |
| UNII | PDC6A3C0OX | |
| KEGG | C00116 D00028, C00116 | |
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 1261 kg/m³; 1,261 g/cm³ | |
| Masa molar | 92,09382 g/mol | |
| Punto de fusión | 291 K (18 °C) | |
| Punto de ebullición | 563 K (290 °C) | |
| Viscosidad | 1,5 Pa·s | |
| Índice de refracción (nD) | 1,66 | |
| Propiedades farmacológicas | ||
| Categoría embarazo | H361fd Se sospecha puede perjudicar la fertilidad y al feto | |
| Peligrosidad | ||
| SGA |
  | |
| Punto de inflamabilidad | 433 K (160 °C) | |
| NFPA 704 |
1
1
0
| |
| Temperatura de autoignición | 623 K (350 °C) | |
| Frases H |
H361fd H319 | |
| Riesgos | ||
| Riesgos principales |
H361fd Se sospecha que perjudica a la fertilidad. Se sospecha que daña al feto (en caso de exposición) H319 Provoca irritación ocular grave | |
| Ingestión | En grandes cantidades, puede causar daño renal. | |
| Inhalación | Tras exposición prolongada, puede causar irritación del tracto respiratorio e incluso dificultad respiratoria. | |
| Piel | Tras exposición prolongada, puede causar irritación en la piel | |
| Ojos | Tras exposición prolongada, puede causar irritación de las mucosas oculares. | |
| LD50 | >2000mg/kg | |
| Más información | El glicerol puede perjudicar la fertilidad y al feto. En altas concentraciones y tras exposiciones prolongadas al mismo puede causar síntomas adicionales como náuseas, dolor de cabeza y vómito. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El propano-1,2,3-triol, glicerol o glicerina (C3H8O3) (del griego glykos, dulce) es un alcohol con tres grupos hidroxilos (–OH). Se trata de uno de los principales productos de la degradación digestiva de los lípidos, paso previo para el ciclo de Krebs y también aparece como un producto intermedio de la fermentación alcohólica. Además, junto con los ácidos grasos, es uno de los componentes de lípidos como los triglicéridos y los fosfolípidos. Se presenta en forma de líquido a una temperatura ambiental de 25 °C y es higroscópico e incoloro. Posee un coeficiente de viscosidad alto y tiene un sabor dulce como otros polialcoholes.
La glicerina en el ámbito automotriz funciona como un abrillantador de metales o llantas su principal función es destacar el cuidado del vehículo brindando un brillo y humectación natural.[3]
Estructura
[editar]Aunque se trate de un compuesto aquiral, el glicerol o glicerina es proquiral con respecto a las reacciones de uno de sus dos alcoholes primarios. Por lo tanto, en los derivados del glicerol (por substitución), la numeración estereoespecífica etiqueta la molécula con un prefijo antes de la raíz de la molécula.
Historia
[editar]Alrededor del año 600 a C., los fenicios divulgaron el conocimiento alquímico de cómo hacer jabón, que unos siglos más tarde tuvo su difusión a través de Marsella, en los galos y en los pueblos germánicos. Anteriormente, este compuesto orgánico no se llamaba "glicerina" o "glicerol", porque estos nombres se crearon en el siglo XX. En el siglo XIV durante el reinado de Carlos I, la Corona inglesa monopolizaba el comercio y la fabricación de jabón. En el siglo siguiente, este conocimiento se tomó de la alquimia para la química, un ejemplo histórico estaría en el del químico inglés Claude Joseph Geoffroy (1741), que intensificó sus estudios sobre la naturaleza de las grasas, lo que le llevó al descubrimiento de la glicerina. Menos de 40 años después, el químico sueco Carl Wilhelm Scheele fue el primero en aislar este compuesto en 1779, calentando una mezcla de litargirio (PbO) con aceite de oliva. Fue él quien formalizó el descubrimiento de que las grasas y aceites naturales contienen glicerina.
Presencia
[editar]El glicerol está presente en todos los aceites, grasas animales y vegetales en forma combinada, es decir, vinculado a los ácidos grasos como el ácido esteárico, oleico, palmítico y ácido láurico para formar una molécula de triglicéridos. Los aceites de coco y de palma contienen una cantidad elevada (70-80 %) de ácidos grasos de cadena de carbono 6 a 14 átomos de carbono.
Estos producen[cita requerida] más moléculas de glicerol en los aceites que contienen ácidos grasos de 16 a 18 átomos de carbono, como las grasas, el aceite de semilla de algodón, el aceite de soja, el aceite de oliva y el aceite de palma. El glicerol combinado también está presente en todas las células animales y vegetales como parte de su membrana celular en forma de fosfolípidos.
Producción
[editar]Todo el glicerol producido en el mundo hasta 1949, provenía de la industria del jabón. Actualmente, el mayor exportador y productor de glicerol en bruto es Indonesia,[4] y proviene de los glicéridos (grasas y aceites naturales), y el resto de la producción de glicerina sintética (subproducto del propileno), la producción de ácidos grasos y ésteres de ácidos grasos (biodiésel).
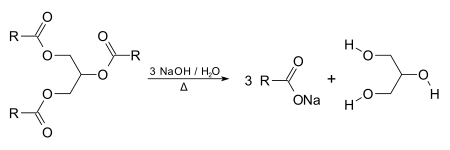
Se puede producir mediante saponificación de las grasas, como un subproducto de la fabricación del jabón.
También puede obtenerse como un subproducto durante la producción del biodiésel mediante transesterificación, o también desde compuestos de propileno. Los triglicéridos reaccionan con un alcohol como el etanol con un catalizador para proporcionar ésteres etílicos de ácidos grasos y glicerol.
El glicerol tiene una temperatura de fusión de unos 18 °C, una temperatura de ebullición de 290 °C, empieza a inflamarse a partir de los 160 °C y su temperatura de autoignición es de cerca de 350 °C.
Puede ser extraído de organismos vegetales tales como la soja o la palma o de organismos animales como sebo. En el año 2018 se produjeron aproximadamente 2 000 000 toneladas de glicerol, siendo casi 500 000 toneladas producidas en Indonesia.[4]
El glicerol crudo de la hidrólisis de triglicéridos se puede purificar por tratamiento con carbón activado para remover impurezas orgánicas, con álcalis para remover ésteres de glicerol y cromatográfica de intercambio iónico para remover sales. Para la obtención de glicerol de alta pureza (mayor al 99,5 %) se utiliza una destilación fraccionada, con un cámara de vacío (debido al alto punto de ebullición, el cual es 290 °C).[5]
Aplicaciones
[editar]Dentro de los principales usos se encuentran:
- La elaboración de cosméticos como por ejemplo, jabones de tocador. La glicerina aumenta su detergencia, da blancura a la piel y la suaviza. Se puede encontrar entre un 8-15 % de glicerina en la composición de estos jabones. En la elaboración de cremas (emulsiones) la glicerina en muchos casos es fundamental.[6]
- En el área de la medicina se utiliza en la elaboración de medicamentos en forma de jarabes (como excipiente; como antiséptico para prevenir infecciones en heridas; como inhibidor de cambios enzimáticos durante la fermentación de ungüentos, pastas o cremas; como disolvente de iodo, bromo, fenol, timol, taninos, alcaloides y cloruro de mercurio). También es utilizado para lubricantes y humectantes oftalmológicos.
- Además, se utiliza formando parte de los supositorios de glicerina, que tienen acción laxante. El mecanismo de acción de estos supositorios se basa en dos propiedades de la glicerina: es higroscópico y ligeramente irritante de mucosas.
- Como baño calefactor para temperaturas superiores a los 250 °C.
- Lubricación de maquinarias específicas. Por ejemplo, de producción de alimentos y medicamentos (por no ser tóxica), de petróleo, etc.
- En las industrias militar y minería para la fabricación de explosivos, como la nitroglicerina así como para enfriar los cañones de las armas de fuego.
- Anticongelante (baja el punto de fusión del agua, por el descenso crioscópico).
- Elaboración de productos de consumo. Principalmente, se utiliza para preparar extractos de té, café, jengibre y otros vegetales; fabricación de refrescos; aditivo (tipo tensioactivo comestible) para mejorar la calidad del producto.
- Elaboración de resinas alquídicas, que se utilizan como aislantes.
- Fluido separador en tubos capilares de instrumentos.
- Industria de lacas y pinturas. Componente clave de los barnices que se utilizan para acabados. En algunos casos, se utiliza glicerina al 98 % para preparar barnices electroaislantes.
- Industria tabacalera. Debido a la elevada capacidad higroscópica de la glicerina, es posible regular la humedad con el fin de eliminar el sabor desagradable e irritante del humo de tabaco.
- Industria del cigarrillo electrónico/vapeo: junto al propilenglicol, la glicerina se utiliza como base para el líquido de vapeo. En algunos casos, la base se compone sólo de glicerina (sin propilenglicol), aunque lo habitual es mezclarla en una proporción de entre el 20 y el 80 % de la base. Proporciona un sabor dulce y es el compuesto que crea el vapor en el cigarrillo electrónico.
- Industria textil. Proporciona elasticidad y suavidad a las telas.
- Industria del cuero. Se añade a disoluciones acuosas de cloruro de bario con el fin de preservar las pieles. También se añade a emulsiones de cera para curtirlas.
Salud y factores de riesgo
[editar]El glicerol es reconocido como seguro para el consumo humano desde 1959. Puede ser utilizado en diversos productos alimenticios para diferentes propósitos. Los niveles de la dosis letal mediana en ratas son de 12 600 mg por kg, en conejillos de Indias de 18 700 mg por kg. Varios estudios han demostrado que una gran cantidad de glicerol (sintético o natural) se puede administrar sin la aparición de efectos adversos para la salud.
Glicerol: subproducto del biodiésel
[editar]El glicerol se genera en grandes cantidades como coproducto del proceso de fabricación de biodiésel. Actualmente, una de las preocupaciones más importantes es como dar salida a este subproducto que está causando un gran impacto a nivel económico y medioambiental en la biorrefinería industrial.
Se trata de un compuesto que no es tóxico ni irritante, es biodegradable y reciclable y presenta una serie de propiedades físicas y químicas que pueden convertirlo en un disolvente alternativo a los disolventes orgánicos convencionales. Se caracteriza por su alto punto de ebullición, escasa presión de vapor, elevada capacidad para disolver compuestos orgánicos e inorgánicos y estabilidad en condiciones normales de presión y temperatura. Además, el glicerol puede ser convertido fácilmente en metanol, etanol, 1-propanol y propanodiol dab. (1,2-propanodiol; 1,3-propanodiol) por medio de reacciones de hidrogenólisis, siendo entonces, una buena materia prima para la preparación de otros disolventes.
Por todas estas cualidades puede utilizarse como humectante, plastificante, emoliente, espesante, medio dispersor, lubricante, endulzante y anticongelante. También se puede utilizar como ingrediente en cosmética, artículos de aseo, medicamentos y productos alimenticios.
Por otra parte, el glicerol es utilizado como producto bruto en síntesis química de dendrímeros, poliéteres hiperramificados y poliésteres con gran área específica y numerosas ramificaciones funcionales. Siguiendo en esta línea, el glicerol puede utilizarse como disolvente verde en reacciones orgánicas catalíticas y no catalíticas y en metodologías sintéticas ofreciendo buenos rendimientos de conversión y selectividad. Se trata de un disolvente que respeta el medio ambiente, que puede actuar como medio de reacción, que posibilita la solubilidad de reactivos y catalizadores, que permite llevar a cabo reacciones en microondas, que ofrece una separación sencilla del producto y del reciclado de complejos de metales de transición. Se ha trabajado en reacciones de sustitución nucleofílica; reducciones estequiométricas con NaBH4 y catalíticas con H2/Pd; acoplamientos tipo Suzuki y tipo Heck y transesterificaciones enzimáticas. Se han obtenido altas conversiones y selectividades de los productos y aunque no puede afirmarse que se trata del mejor disolvente de todos los posibles, estas conclusiones apoyan la continuidad de las investigaciones sobre el glicerol como disolvente verde. Por otra parte, la reducción catalítica de β-cetoésteres proquirales y cetonas en presencia de glicerol proporciona excelentes rendimientos y selectividades. Estos resultados son comparables con los obtenidos al utilizar agua como disolvente y superiores a los resultados obtenidos para líquidos iónicos y medios fluorados.
Se está planteando también el uso de glicerol en la industria microbiológica para la obtención de productos de alto valor añadido, ya que promete ser una nueva fuente de carbono para las fermentaciones con microorganismos. Recientemente, se está estudiando la posibilidad de convertir el bio-glicerol en carbonato de glicerol a través de una ruta alternativa: glicerólisis de urea, que podría ser útil a nivel industrial en un futuro no muy remoto. Este proceso presenta una conversión del 80 % y una selectividad próxima al 100 %.
Triglicérido
[editar]Un triglicérido está formado por una molécula de propanotriol al que se unen por enlaces éster tres moléculas de ácidos grasos. Los ácidos grasos pueden estar saturados de átomos de hidrógeno, de modo que todos los enlaces entre carbonos son simples. Normalmente se asocia un ácido graso saturado con enfermedades circulatorias y con un origen animal. Los ácidos grasos que contienen menos hidrógenos se llaman ácidos grasos insaturados y se caracterizan por presentar en su estructura uno o más dobles enlaces; son de origen vegetal.
Derivados
[editar]
Un derivado importante del glicerol es el α-glicerol-3-fosfato en el cual el –OH del carbono 3 se ésterifica con un grupo fosfato (–PO32–); la mayoría de los tejidos vivos sintetizan los triglicéridos y fosfolípidos a partir de α-glicerol-3-fosfato y acil CoA grasos.
Metabolismo
[editar]
El glicerol es un precursor para la síntesis de triglicéridos y fosfolípidos en el hígado y el tejido adiposo. Cuando el cuerpo utiliza la grasa almacenada para la energía, glicerol y ácidos grasos se liberan en el torrente sanguíneo. El glicerol puede ser convertido en glucosa en el hígado, el suministro de energía para el metabolismo celular.
La quinasa sólo está presente en el hígado. En el tejido adiposo, el glicerol 3-fosfato se deriva de la dihidroxiacetona fosfato por la enzima deshidrogenasa glicerol-3-fosfato.
Referencias
[editar]- ↑ https://pubchem.ncbi.nlm.nih.gov/compound/glycerol#section=Names-and-Identifiers Glycerol: Names and Identifiers. PubChem. Consultado el 17 de febrero de 2016.
- ↑ Número CAS
- ↑ Martinez Mateo, Gilberto David (2023). [Santa María Citendeje «"El ABC de la Materia Prima "»]
|url=incorrecta (ayuda). En Independiente, ed. ¡Génesis Limpieza Azteca!. Jocotitlan Edomex: S.A. p. 4|página=y|páginas=redundantes (ayuda). - ↑ a b «ITC: Estadísticas del comercio. Glicerol en bruto; aguas y lejías glicerinosas». Consultado el 21 de agosto de 2023.
- ↑ Christoph, Ralf; Schmidt, Bernd; Steinberner, Udo; Dilla, Wolfgang; Karinen, Reetta (15 de abril de 2006). Wiley-VCH Verlag GmbH & Co. KGaA, ed. Glycerol (en inglés). Wiley-VCH Verlag GmbH & Co. KGaA. pp. a12_477.pub2. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a12_477.pub2. Consultado el 15 de abril de 2023.
- ↑ «Funciones de la glicerina en emulsiones».
Bibliografía
[editar]- Kerton, Francesca (2009). Alternative solvents for green chemistry. The Royal Society of Chemistry.
- Da Silva. G.P., Mack.M, Contiero. J. (2009). «Glycerol: A promising and abundant carbon source for industrial microbiology». Biotechnology Advances 27. p. 30-39. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- Norhasyimi. R, Ahmad Zuhari. A, Abdul Rahman. M. (2010). «Recent progress on innovative and potencial technologies for glycerol tranformations into fuel additives: A critical review.». Renewable and sustainable energy reviews 14. p. 987-1000. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- Wolfson. A., Litval. G., Dlugy. C., Shortland. Y., Tavor. D. (2009). «Employing crude glycerol from biodiesel production as an alternative green reaction medium». Industrial crops and products 30. p. 78-81. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- Aresta. M., Dibenedetto. A., Nocito. F., Ferragina. C. (2009). «Valorization of bio-glycerol: New catalytic materials for the synthesis of glycerol carbonate via glycerolusis of urea». Journal of catalysis 268. p. 106-114. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- Ralf Christoph, Bernd Schmidt, Udo Steinberner, Wolfgang Dilla, Reetta Karinen (2006) Glycerol
- Dave Nilles (2005) A Glycerin Factor
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre Glicerol.
Wikimedia Commons alberga una categoría multimedia sobre Glicerol.- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del glicerol.
- WebBook para el glicerol
- Aplicaciones glicerina
- Glicerina en pasta (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ¿Qué es la Glicerina y Para Qué Sirve?
- ¿Cuanto cuesta y donde comprarla?
- Glicerina en emulsiones: funciones y usos