Diferencia entre revisiones de «Ácido carboxílico»
Sin resumen de edición |
m Revertidos los cambios de 189.192.60.24 a la última edición de BlackBeast |
||
| Línea 5: | Línea 5: | ||
== Características y propiedades == |
== Características y propiedades == |
||
[[Archivo:reactividad del carboxilo.png|thumb|right|350px|Comportamiento químico de las diferentes posiciones del grupo carboxilo]]Los derivados de los ácidos carboxílicos tienen como formula general R-COOH. Tiene propiedades [[ácido|ácidas]]; los dos [[átomo]]s de [[oxígeno]] son [[electronegatividad|electronegativos]] y tienden a atraer a los [[electrones]] del átomo de [[hidrógeno]] del grupo [[hidroxilo]] con lo que se debilita el enlace, produciéndose en ciertas condiciones, una [[heterólisis|ruptura heterolítica]] cediendo el correspondiente [[protón]] o [[hidrón]], H<sup>+</sup>, y quedando el resto de la molécula con carga -1 debido al [[electrón]] que ha perdido el átomo de hidrógeno, por lo que la molécula queda como R-COO<sup>-</sup>. |
|||
<center> <math> R-COOH \rightleftharpoons R-COO^- + H^+</math> </center> |
|||
Además, en este anión, la carga negativa se distribuye (se deslocaliza) simétricamente entre los dos átomos de oxígeno, de forma que los enlaces carbono-oxígeno adquieren un carácter de enlace parcialmente doble. |
|||
Generalmente los ácidos carboxílicos son ácidos débiles, con sólo un 1% de sus moléculas disociadas para dar los correspondientes [[ion]]es, a [[temperatura ambiente]] y en disolución acuosa. |
|||
Pero sí son más ácidos que otros, en los que no se produce esa [[deslocalización electrónica]], como por ejemplo los [[alcohol]]es. Esto se debe a que la [[constante de disociación ácida|estabilización]] por resonancia o deslocalización electrónica, provoca que la base conjugada del ácido sea más estable que la base conjugada del alcohol y por lo tanto, la concentración de protones provenientes de la disociación del ácido carboxílico sea mayor a la concentración de aquellos protones provenientes del alcohol; hecho que se verifica experimentalmente por sus valores relativos menores de [[PKa|pK<sub>a</sub>]]. El ion resultante, R-COOH<sup>-</sup>, se nombra con el [[sufijo]] "-ato".[[Archivo:Resonancia del carboxilato.png|thumb|center|600px|El grupo carboxilo actuando como ácido genera un ión carboxilato que se estabiliza por resonancia]] |
|||
Por ejemplo, el [[anión]] procedente del [[ácido acético]] se llama ion acetato. Al grupo RCOO<sup>-</sup> se le denomina '''carboxilato'''. |
|||
[[Archivo:disociación_del_ácido_acético.png|thumb|600px|center|Disociación del ácido acético, sólo se muestran los dos contribuyentes de resonancia que más afectan la estabilidad]] |
|||
== Propiedades físicas == |
|||
Los ácidos de masa molar baja (hasta diez átomos de carbono) son líquidos incoloros, de olor muy desagradable. El olor del vinagre se debe al ácido acético; el de la mantequilla rancia al ácido butírico. El ácido caproico se encuentra en el pelo y secreciones del ganado caprino. Los ácidos C5 a C10 poseen olores a “cabra”. El resto sólidos cerosos e inodoros a temperatura ambiente. Sus puntos de fusión y ebullición crecen al aumentar la masa molar. |
|||
Los ácidos inferiores son solubles en agua; su solubilidad decrece a partir del ácido butírico con el aumento del carácter hidrocarbonado de la molécula. Todos los ácidos son solubles en solventes orgánicos |
|||
== Síntesis == |
|||
=== Rutas industriales === |
|||
Las rutas industriales a los ácidos carboxílicos difieren generalmente de las usadas a pequeña escala porque requieren equipamiento especializado. |
|||
* Oxidación de aldehídos con aire, utilizando catalizadores de cobalto y manganeso. Los aldehídos necesarios son obtenidos fácilmente a partir de alquenos por [[hidroformilación]]. |
|||
* Oxidación de hidrocarburos usando aire. Para los alcanos más simples, el método no es selectivo. Los compuestos alílicos y bencílicos sufren oxidaciones más selectivas. Los grupos alquilo en un anillo bencénico se oxidan al ácido carboxílico, sin importar la longitud de la cadena. La formación de [[ácido benzoico]] a partir del [[tolueno]], de [[ácido tereftálico]] a partir del [[p-xileno|''p''-xileno]], y de [[ácido ftálico]] a partir de [[o-xileno|''o''-xileno]], son algunas conversiones ilustrativas a gran escala. El [[ácido acrílico]] es generado a partir del propeno.<ref>Wilhelm Riemenschneider “Carboxylic Acids, Aliphatic” in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. {{DOI| 10.1002/14356007.a05_235}}.</ref> |
|||
* Deshidrogenación de alcoholes, catalizada por bases. |
|||
* La carbonilación es el método más versátil cuando va acompañado a la adición de agua. Este método es efectivo para alquenos que generan [[carbocatión|carbocationes]] secundarios y terciarios, por ejemplo, de [[isobutileno]] a [[ácido piválico]]. En la [[reacción de Koch]], la adición de agua y monóxido de carbono a alquenos está catalizada por ácidos fuertes. El ácido acético y el ácido fórmico son producidos por la [[carbonilación]] del metanol, llevada a cabo con [[yodo]] y [[alcóxido]], quienes actúan como promotores, y frecuentemente con altas presiones de [[monóxido de carbono]], generalmente involucrando varios pasos [[hidrólisis|hidrolíticos]] adicionales, en los [[Proceso Monsanto]] y [[proceso Cativa]]. Las hidrocarboxilaciones involucran la adición simultánea de agua y CO. Tales reacciones son llamadas algunas veces como "[[Water Reppe|Química de Reppe]]": |
|||
:HCCH + CO + H<sub>2</sub>O → CH<sub>2</sub>=CHCO<sub>2</sub>H |
|||
* Algunos ácidos carboxílicos de cadena larga son obtenidos por la hidrólisis de los [[triglicérido]]s obtenidos de aceites y grasas de plantas y animales. Estos métodos están relacionados a la elaboración del [[jabón]]. |
|||
=== Métodos de laboratorio === |
|||
Los métodos de preparación para reacciones a pequeña escala con fines de investigación, instrucción, o producción de pequeñas cantidades de químicos, suelen utilizar reactivos caros. |
|||
* La oxidación de alcoholes primarios con agentes [[oxidante]]s fuertes como el [[dicromato de potasio]], el [[reactivo de Jones]], el [[permanganato de potasio]], o el [[clorito de sodio]]. El método es adecuado a las condiciones de laboratorio, comparado con el uso industrial del aire, pero este último es más ecológico, puesto que conduce a menos subproductos inorgánicos, tales omo óxidos de [[cromo]] o [[manganeso]]. |
|||
* Ruptura oxidativa de [[olefina]]s, por [[ozonólisis]], [[permanganato de potasio]], o [[dicromato de potasio]]. |
|||
* Los ácidos carboxílicos también pueden obtenerse por la hidrólisis de los [[nitrilo]]s, [[éster]]es, o [[amida]]s, generalmente con [[catálisis]] ácida o básica. |
|||
* Carbonatación de un reactivo de [[organolitio]] o [[reactivo de Grignard|Grignard]]: |
|||
:RLi + CO<sub>2</sub> RCO<sub>2</sub>Li |
|||
:RCO<sub>2</sub>Li + HCl RCO<sub>2</sub>H + LiCl |
|||
* Halogenación de metilcetonas, seguida por hidrólisis en la [[reacción del haloformo]] |
|||
* La [[reacción de Kolbe-Schmitt]], que provee una ruta de síntesis al [[ácido salicílico]], precursor de la [[aspirina]] |
|||
=== Reacciones menos comunes === |
|||
Muchas reacciones conducen a ácidos carboxílicos, pero son usadas sólo en casos muy específicos, o principalmente son de interés académico: |
|||
* Desproporción de un [[aldehído]] en la [[reacción de Cannizzaro]] |
|||
* Rearreglo de dicetonas, en el [[rearreglo del ácido bencílico]], involucrando la generación de ácidos benzoicos en la [[reacción de von Richter]], a partir de nitrobencenos, y en la [[reacción de Kolbe-Schmitt]], a partir de [[fenol]]es. |
|||
== Reacciones == |
|||
* <big>'''Obtención de sales de ácidos carboxílicos y amidas a partir del ácido'''</big>: |
|||
:Los ácidos carboxílicos reaccionan con [[base (química)|bases]] para formar [[sal (química)|sales]]. En estas sales el hidrógeno del grupo OH se reemplaza con el ion de un metal, por ejemplo Na<sup>+</sup>. De esta forma, el ácido acético reacciona con bicarbonato de sodio para dar acetato de sodio, dióxido de carbono y agua. |
|||
<center> <math> CH_3COOH + NaHCO_3 \rightarrow CH_3COO^-Na^+ + CO_2 + H_2O</math> </center> |
|||
Entonces, luego de haber obtenido la sal, podemos calentar la misma para que mediante la deshidratación lleguemos a la amida.<ref>Vollhardt, K. Peter. Química Orgánica. 3ra edición. Año 2000. Omega. Madrid. pp. 849-850. ISBN 84-282-1172-8.</ref> La reacción general y su mecanismo son los siguientes: |
|||
[[Archivo:obtencion de una amida a partir del acido y la amina.png|thumb|600px|center|Reacción general]] |
|||
[[Archivo:mecanismo de formación de una amida.png|center|thumb|750px|Mecanismo de reacción]] |
|||
* <big>'''Halogenación en la posición alfa'''</big>: Llamada [[Halogenación de Hell-Volhard-Zelinsky]] o también conocida como Reacción de Hell-Volhard-Zelinsky. La misma sustituye un átomo de hidrógeno en la posición alfa con un halógeno, reacción que presenta utilidad sintética debido a la introducción de buenos grupos salientes en la posición alfa. |
|||
[[Archivo:HVZReaction.png|400px|thumb|center|Resumen de la [[Halogenación]] de Hell-Volhard-Zelinsky]] |
|||
Los grupos carboxilos reaccionan con los grupos amino para formar [[amida]]s. En el caso de [[aminoácido]]s que reaccionan con otros aminoácidos para dar [[proteína]]s, al enlace de tipo amida que se forma se denomina [[enlace peptídico]]. Igualmente, los ácidos carboxílicos pueden reaccionar con alcoholes para dar [[éster]]es, o bien con halogenuros para dar halogenuros de ácido, o entre sí para dar anhídridos. Los [[éster]]es, [[anhídrido]]s, [[halogenuro de ácido|halogenuros de ácido]] y [[amidas]] se llaman '''derivados de ácido'''. |
|||
== Nomenclatura == |
|||
Los nombres de los '''ácidos carboxílicos''' se designan según la fuente natural de la que inicialmente se aislaron. Se clasificaron así: |
|||
{| border=1 style="left; margin:0 0 1em 1em" |
|||
|+Nombres y fuentes naturales de los ácidos carboxílicos |
|||
!Estructura!!Nombre [[IUPAC]]!!Nombre común!!Fuente natural |
|||
|----------------- |
|||
|HCOOH||Ácido metanoico||Ácido fórmico||Destilación destructiva de hormigas (formica en latín) |
|||
|----------------- |
|||
|CH<sub>3</sub>COOH||Ácido etanoico||[[Ácido acético]]||Fermentación del [[vino]] |
|||
|----------------- |
|||
|CH<sub>3</sub>CH<sub>2</sub>COOH||Ácido propanoico||[[Ácido propiónico]]||Fermentación de lácteos (pion en griego) |
|||
|----------------- |
|||
|CH<sub>3</sub>CH<sub>2</sub>CH<sub>2</sub>COOH||Ácido butanoico||[[Ácido butírico]]||[[Mantequilla]] (butyrum, en latín) |
|||
|----------------- |
|||
|CH<sub>3</sub>(CH<sub>2</sub>)<sub>3</sub>COOH||Ácido pentanoico||[[Ácido valérico]]||Raíz de la [[valeriana officinalis]] |
|||
|----------------- |
|||
|CH<sub>3</sub>(CH<sub>2</sub>)<sub>4</sub>COOH||Ácido hexanoico||[[Ácido caproico]]||Dolor de cabeza |
|||
|----------------- |
|||
|} |
|||
En el sistema [[IUPAC]] los nombres de los ácidos carboxílicos se forman reemplazando la terminación “o” de los alcanos por “oico”, y anteponiendo la palabra ácido. |
|||
El esqueleto de los ácidos alcanoicos se enumera asignando el N° 1 al carbono carboxílico y continuando por la cadena más larga que incluya el grupo COOH. |
|||
== Ejemplos de ácidos carboxílicos == |
|||
* HCOOH [[ácido fórmico]] (se encuentra en insectos, ''fórmico'' se refiere a las [[hormiga]]s) |
|||
* CH<sub>3</sub>COOH [[ácido acético]] o etanoico (se encuentra en el [[vinagre]]) |
|||
* HOOC-COOH ácido etanodioico, también llamado [[ácido oxálico]], |
|||
* CH<sub>3</sub>CH<sub>2</sub>COOH [[ácido propanoico]] |
|||
* C<sub>6</sub>H<sub>5</sub>COOH [[ácido benzoico]] (el benzoato de sodio, la sal de sodio del ácido benzoico se emplea como conservante) |
|||
* [[Ácido láctico]] |
|||
* Todos los [[aminoácido]]s contienen un grupo carboxilo y un grupo amino. Cuando reacciona el grupo carboxilo de un aminoácido con el grupo amino de otro se forma un enlace amida llamado [[enlace peptídico]]. Las proteínas son polímeros de aminoácidos y tienen en un extremo un grupo carboxilo terminal. |
|||
* Todos los [[ácido graso|ácidos grasos]] son ácidos carboxílicos. Por ejemplo, el ácido palmítico, esteárico, oleico, linoleico, etcétera. Estos ácidos con la [[glicerina]] forman ésteres llamados [[triglicérido]]s. |
|||
<div style="float:center; border:1px; padding:2px; text-align:center"> [[Archivo:Palmiticacid.png]]<br /> |
|||
<font size=1>Ácido palmítico o ácido hexadecanoico, se representa con la fórmula CH<sub>3</sub>(CH<sub>2</sub>)<sub>14</sub>COOH</font> |
|||
</div> |
|||
* Las sales de ácidos carboxílicos de cadena larga se emplean como [[tensoactivo]]s. Por ejemplo, el estearato de sodio (octadecanoato de sodio), de fórmula CH<sub>3</sub>(CH<sub>2</sub>)<sub>16</sub>COO<sup>-</sup>Na<sup>+</sup> |
|||
* [[Cianoacrilato]] |
|||
== Referencias == |
|||
{{listaref}} |
|||
[[Categoría:Ácidos carboxílicos| ]] |
|||
[[Categoría:Ácidos|Carboxilico]] |
|||
[[Categoría:Grupos funcionales|Carboxilo]] |
|||
[[ar:حمض كربوكسيلي]] |
|||
[[bg:Карбоксилна киселина]] |
|||
[[bn:কার্বক্সিলিক অ্যাসিড]] |
|||
[[bs:Karboksilne kiseline]] |
|||
[[ca:Àcid carboxílic]] |
|||
[[cs:Karboxylové kyseliny]] |
|||
[[cy:Asid carbocsylig]] |
|||
[[da:Carboxylsyre]] |
|||
[[de:Carbonsäuren]] |
|||
[[el:Καρβονικά οξέα]] |
|||
[[en:Carboxylic acid]] |
|||
[[et:Karboksüülhapped]] |
|||
[[fa:کربوکسیلیک اسید]] |
|||
[[fi:Karboksyylihappo]] |
|||
[[fo:Carboxylsýra]] |
|||
[[fr:Acide carboxylique]] |
|||
[[ga:Aigéad carbocsaileach]] |
|||
[[he:חומצה קרבוקסילית]] |
|||
[[hi:कार्बाक्सिलिक अम्ल]] |
|||
[[hr:Karboksilne kiseline]] |
|||
[[hu:Karbonsavak]] |
|||
[[id:Asam alkanoat]] |
|||
[[it:Acidi carbossilici]] |
|||
[[ja:カルボン酸]] |
|||
[[ko:카복실산]] |
|||
[[la:Acidum carboxylicum]] |
|||
[[lt:Karboksirūgštys]] |
|||
[[lv:Karbonskābes]] |
|||
[[mk:Карбоксилна киселина]] |
|||
[[ms:Asid karboksilik]] |
|||
[[nl:Carbonzuur]] |
|||
[[nn:Karboksylsyre]] |
|||
[[no:Karboksylsyre]] |
|||
[[pl:Kwasy karboksylowe]] |
|||
[[pt:Ácido carboxílico]] |
|||
[[ro:Acid carboxilic]] |
|||
[[ru:Карбоновые кислоты]] |
|||
[[sk:Karboxylová kyselina]] |
|||
[[sl:Karboksilna kislina]] |
|||
[[sq:Derivatet karboksilike]] |
|||
[[sr:Карбоксилна киселина]] |
|||
[[su:Asam karboksilat]] |
|||
[[sv:Karboxylsyra]] |
|||
[[th:กรดคาร์บอกซิลิก]] |
|||
[[tr:Karboksilik asit]] |
|||
[[uk:Карбонові кислоти]] |
|||
[[vi:Axit cacboxylic]] |
|||
[[zh:羧酸]] |
|||
Revisión del 04:09 27 abr 2010

Los ácidos carboxílicos constituyen un grupo de compuestos que se caracterizan porque poseen un grupo funcional llamado grupo carboxilo o grupo carboxi (–COOH); se produce cuando coinciden sobre el mismo carbono un grupo hidroxilo (-OH) y carbonilo (C=O). Se puede representar como COOH ó CO2H.
Características y propiedades
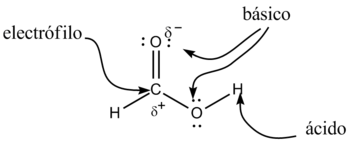
Los derivados de los ácidos carboxílicos tienen como formula general R-COOH. Tiene propiedades ácidas; los dos átomos de oxígeno son electronegativos y tienden a atraer a los electrones del átomo de hidrógeno del grupo hidroxilo con lo que se debilita el enlace, produciéndose en ciertas condiciones, una ruptura heterolítica cediendo el correspondiente protón o hidrón, H+, y quedando el resto de la molécula con carga -1 debido al electrón que ha perdido el átomo de hidrógeno, por lo que la molécula queda como R-COO-.
Además, en este anión, la carga negativa se distribuye (se deslocaliza) simétricamente entre los dos átomos de oxígeno, de forma que los enlaces carbono-oxígeno adquieren un carácter de enlace parcialmente doble.
Generalmente los ácidos carboxílicos son ácidos débiles, con sólo un 1% de sus moléculas disociadas para dar los correspondientes iones, a temperatura ambiente y en disolución acuosa.
Pero sí son más ácidos que otros, en los que no se produce esa deslocalización electrónica, como por ejemplo los alcoholes. Esto se debe a que la estabilización por resonancia o deslocalización electrónica, provoca que la base conjugada del ácido sea más estable que la base conjugada del alcohol y por lo tanto, la concentración de protones provenientes de la disociación del ácido carboxílico sea mayor a la concentración de aquellos protones provenientes del alcohol; hecho que se verifica experimentalmente por sus valores relativos menores de pKa. El ion resultante, R-COOH-, se nombra con el sufijo "-ato".

Por ejemplo, el anión procedente del ácido acético se llama ion acetato. Al grupo RCOO- se le denomina carboxilato.

Propiedades físicas
Los ácidos de masa molar baja (hasta diez átomos de carbono) son líquidos incoloros, de olor muy desagradable. El olor del vinagre se debe al ácido acético; el de la mantequilla rancia al ácido butírico. El ácido caproico se encuentra en el pelo y secreciones del ganado caprino. Los ácidos C5 a C10 poseen olores a “cabra”. El resto sólidos cerosos e inodoros a temperatura ambiente. Sus puntos de fusión y ebullición crecen al aumentar la masa molar.
Los ácidos inferiores son solubles en agua; su solubilidad decrece a partir del ácido butírico con el aumento del carácter hidrocarbonado de la molécula. Todos los ácidos son solubles en solventes orgánicos
Síntesis
Rutas industriales
Las rutas industriales a los ácidos carboxílicos difieren generalmente de las usadas a pequeña escala porque requieren equipamiento especializado.
- Oxidación de aldehídos con aire, utilizando catalizadores de cobalto y manganeso. Los aldehídos necesarios son obtenidos fácilmente a partir de alquenos por hidroformilación.
- Oxidación de hidrocarburos usando aire. Para los alcanos más simples, el método no es selectivo. Los compuestos alílicos y bencílicos sufren oxidaciones más selectivas. Los grupos alquilo en un anillo bencénico se oxidan al ácido carboxílico, sin importar la longitud de la cadena. La formación de ácido benzoico a partir del tolueno, de ácido tereftálico a partir del p-xileno, y de ácido ftálico a partir de o-xileno, son algunas conversiones ilustrativas a gran escala. El ácido acrílico es generado a partir del propeno.[1]
- Deshidrogenación de alcoholes, catalizada por bases.
- La carbonilación es el método más versátil cuando va acompañado a la adición de agua. Este método es efectivo para alquenos que generan carbocationes secundarios y terciarios, por ejemplo, de isobutileno a ácido piválico. En la reacción de Koch, la adición de agua y monóxido de carbono a alquenos está catalizada por ácidos fuertes. El ácido acético y el ácido fórmico son producidos por la carbonilación del metanol, llevada a cabo con yodo y alcóxido, quienes actúan como promotores, y frecuentemente con altas presiones de monóxido de carbono, generalmente involucrando varios pasos hidrolíticos adicionales, en los Proceso Monsanto y proceso Cativa. Las hidrocarboxilaciones involucran la adición simultánea de agua y CO. Tales reacciones son llamadas algunas veces como "Química de Reppe":
- HCCH + CO + H2O → CH2=CHCO2H
- Algunos ácidos carboxílicos de cadena larga son obtenidos por la hidrólisis de los triglicéridos obtenidos de aceites y grasas de plantas y animales. Estos métodos están relacionados a la elaboración del jabón.
Métodos de laboratorio
Los métodos de preparación para reacciones a pequeña escala con fines de investigación, instrucción, o producción de pequeñas cantidades de químicos, suelen utilizar reactivos caros.
- La oxidación de alcoholes primarios con agentes oxidantes fuertes como el dicromato de potasio, el reactivo de Jones, el permanganato de potasio, o el clorito de sodio. El método es adecuado a las condiciones de laboratorio, comparado con el uso industrial del aire, pero este último es más ecológico, puesto que conduce a menos subproductos inorgánicos, tales omo óxidos de cromo o manganeso.
- Ruptura oxidativa de olefinas, por ozonólisis, permanganato de potasio, o dicromato de potasio.
- Los ácidos carboxílicos también pueden obtenerse por la hidrólisis de los nitrilos, ésteres, o amidas, generalmente con catálisis ácida o básica.
- Carbonatación de un reactivo de organolitio o Grignard:
- RLi + CO2 RCO2Li
- RCO2Li + HCl RCO2H + LiCl
- Halogenación de metilcetonas, seguida por hidrólisis en la reacción del haloformo
- La reacción de Kolbe-Schmitt, que provee una ruta de síntesis al ácido salicílico, precursor de la aspirina
Reacciones menos comunes
Muchas reacciones conducen a ácidos carboxílicos, pero son usadas sólo en casos muy específicos, o principalmente son de interés académico:
- Desproporción de un aldehído en la reacción de Cannizzaro
- Rearreglo de dicetonas, en el rearreglo del ácido bencílico, involucrando la generación de ácidos benzoicos en la reacción de von Richter, a partir de nitrobencenos, y en la reacción de Kolbe-Schmitt, a partir de fenoles.
Reacciones
- Obtención de sales de ácidos carboxílicos y amidas a partir del ácido:
- Los ácidos carboxílicos reaccionan con bases para formar sales. En estas sales el hidrógeno del grupo OH se reemplaza con el ion de un metal, por ejemplo Na+. De esta forma, el ácido acético reacciona con bicarbonato de sodio para dar acetato de sodio, dióxido de carbono y agua.
Entonces, luego de haber obtenido la sal, podemos calentar la misma para que mediante la deshidratación lleguemos a la amida.[2] La reacción general y su mecanismo son los siguientes:
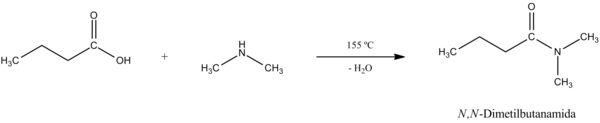

- Halogenación en la posición alfa: Llamada Halogenación de Hell-Volhard-Zelinsky o también conocida como Reacción de Hell-Volhard-Zelinsky. La misma sustituye un átomo de hidrógeno en la posición alfa con un halógeno, reacción que presenta utilidad sintética debido a la introducción de buenos grupos salientes en la posición alfa.

Los grupos carboxilos reaccionan con los grupos amino para formar amidas. En el caso de aminoácidos que reaccionan con otros aminoácidos para dar proteínas, al enlace de tipo amida que se forma se denomina enlace peptídico. Igualmente, los ácidos carboxílicos pueden reaccionar con alcoholes para dar ésteres, o bien con halogenuros para dar halogenuros de ácido, o entre sí para dar anhídridos. Los ésteres, anhídridos, halogenuros de ácido y amidas se llaman derivados de ácido.
Nomenclatura
Los nombres de los ácidos carboxílicos se designan según la fuente natural de la que inicialmente se aislaron. Se clasificaron así:
| Estructura | Nombre IUPAC | Nombre común | Fuente natural |
|---|---|---|---|
| HCOOH | Ácido metanoico | Ácido fórmico | Destilación destructiva de hormigas (formica en latín) |
| CH3COOH | Ácido etanoico | Ácido acético | Fermentación del vino |
| CH3CH2COOH | Ácido propanoico | Ácido propiónico | Fermentación de lácteos (pion en griego) |
| CH3CH2CH2COOH | Ácido butanoico | Ácido butírico | Mantequilla (butyrum, en latín) |
| CH3(CH2)3COOH | Ácido pentanoico | Ácido valérico | Raíz de la valeriana officinalis |
| CH3(CH2)4COOH | Ácido hexanoico | Ácido caproico | Dolor de cabeza |
En el sistema IUPAC los nombres de los ácidos carboxílicos se forman reemplazando la terminación “o” de los alcanos por “oico”, y anteponiendo la palabra ácido.
El esqueleto de los ácidos alcanoicos se enumera asignando el N° 1 al carbono carboxílico y continuando por la cadena más larga que incluya el grupo COOH.
Ejemplos de ácidos carboxílicos
- HCOOH ácido fórmico (se encuentra en insectos, fórmico se refiere a las hormigas)
- CH3COOH ácido acético o etanoico (se encuentra en el vinagre)
- HOOC-COOH ácido etanodioico, también llamado ácido oxálico,
- CH3CH2COOH ácido propanoico
- C6H5COOH ácido benzoico (el benzoato de sodio, la sal de sodio del ácido benzoico se emplea como conservante)
- Ácido láctico
- Todos los aminoácidos contienen un grupo carboxilo y un grupo amino. Cuando reacciona el grupo carboxilo de un aminoácido con el grupo amino de otro se forma un enlace amida llamado enlace peptídico. Las proteínas son polímeros de aminoácidos y tienen en un extremo un grupo carboxilo terminal.
- Todos los ácidos grasos son ácidos carboxílicos. Por ejemplo, el ácido palmítico, esteárico, oleico, linoleico, etcétera. Estos ácidos con la glicerina forman ésteres llamados triglicéridos.
- Las sales de ácidos carboxílicos de cadena larga se emplean como tensoactivos. Por ejemplo, el estearato de sodio (octadecanoato de sodio), de fórmula CH3(CH2)16COO-Na+
- Cianoacrilato
Referencias
- ↑ Wilhelm Riemenschneider “Carboxylic Acids, Aliphatic” in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi 10.1002/14356007.a05_235 10.1002/14356007.a05_235.
- ↑ Vollhardt, K. Peter. Química Orgánica. 3ra edición. Año 2000. Omega. Madrid. pp. 849-850. ISBN 84-282-1172-8.



