Leishmaniasis
| Leishmaniasis | ||
|---|---|---|
 | ||
| Especialidad | infectología | |
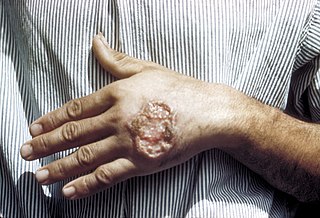
| Síntomas | Úlceras en la piel, fiebre, glóbulos rojos bajos, hígado agrandado | |
| Causas | Parásitos de leishmania propagados por flebótomos | |
| Prevención | Mosquiteras, insecticida | |
La leishmaniosis (o leishmaniasis) es un conjunto de enfermedades zoonóticas y antroponóticas causadas por parásitos protozoos del género tripanosomatida Leishmania.[1] La enfermedad puede presentarse en tres formas principales: cutánea (úlceras cutáneas), mucocutánea o visceral.[2] Las manifestaciones clínicas de la enfermedad van desde úlceras cutáneas que cicatrizan espontáneamente, hasta formas fatales en las cuales se presenta inflamación grave del hígado y del bazo. La leishmaniasis cutánea se presenta con úlceras cutáneas, mientras que la mucocutánea se presenta con úlceras cutáneas y de boca y nariz. La forma visceral empieza con úlceras cutáneas y luego aparece fiebre, bajo número de glóbulos rojos sanguíneos y un bazo e hígados inflamados.[2][3] Los tres tipos de leishmanisis pueden diagnosticarse observando a los parásitos bajo microscopía.[4] Adicionalmente, la leishmaniasis visceral puede diagnosticarse con pruebas sanguíneas.[5]
Es una enfermedad zoonótica que afecta tanto a perros como a humanos. Sin embargo, animales silvestres como liebres, zarigüeyas, coatíes y jurumíes, entre otros, son portadores asintomáticos del parásito, por lo que se les considera animales reservorios. En los seres humanos, las infecciones son causadas por más de 20 especies de Leishmania.[6][4] El agente se transmite al humano y a otros animales a través de la picadura de hembras de los flebótomos, un grupo de insectos chupadores de sangre pertenecientes a los géneros Phlebotomus del Viejo Mundo, (Europa, África y Asia) y Lutzomyia en América, de la familia Psychodidae. En Colombia, en ciertas regiones, conocido como palomilla, en Ecuador arenilla, en Perú jején,[7] en Argentina torito, plumilla o carachai, y en Costa Rica papalomoyo.
Entre 4 y 12 millones de personas son infectadas actualmente[8][9]en unos 98 países.[3]Cerca de 2 millones de casos nuevos[3] y entre 20 000 y 50 000 muertes son causadas por la leishmaniosis cada año.[2][10] Unos doscientos millones de personas en Asia, África, Centro y Sudamérica, y Europa meridional viven en áreas en las que la enfermedad es común.[3][11]Está clasificada como una enfermedad tropical desatendida.[12]Factores de riesgo incluyen la pobreza, desnutrición, deforestación y urbanización.[4]La leishmaniosis puede prevenirse parcialmente durmiendo bajo toldos tratados con insecticidas.[4] Otras medidas incluyen la fumigación con insecticidas para matar a los insectos, así como brindar tratamiento temprano a las personas que tienen la enfermedad para evitar que se expanda.[4]El tratamiento se decide dependiendo del lugar en el que se haya adquirido la enfermedad, de la especie de Leishmania, y del tipo de infección.[4]Algunos medicamentos usados en la leishmaniasis visceral incluyen la anfotericina B liposomal,[13] una combinación de antimonios pentavalentes, y paromomicina[14] y miltefosina.[15]Para la leishmaniasis cutánea, pueden ser efectivas la paromicina, el fluconazol o la pentamidina.[16]
Historia
[editar]La leishmaniosis es una enfermedad de la que pueden encontrarse antecedentes en épocas antiguas. Hay descripciones de leishmaniosis cutánea del año 650 a. C. en la antigua Babilonia. La misma enfermedad conocida en Oriente como «úlcera oriental» fue descrita por Avicena en el siglo X con el nombre de «úlcera de Balj», por la ciudad situada al norte del actual Afganistán. Posteriormente hay varios casos descritos en el Oriente Medio, por ejemplo en Bagdad y Jericó, denominándola de diferentes formas. En los siglos XV y XVI, durante la colonización española de América, se describe la enfermedad en las zonas del actual Ecuador y Perú llamándola «lepra blanca»; en dichos lugares había evidencia de la presentación de la forma cutánea desde épocas preincaicas. Fernando de Oviedo en 1535, Pedro Pizarro en 1571, Fernando de Santillán en 1572, fray Rodrigo de Loayza en 1586, Diego de Morales en 1602, Reginaldo Lizárraga en 1605, Bartolomé de la Vega y el médico Cosme Bueno, describen la enfermedad que afecta a los indígenas de la ladera oriental de la cordillera de los Andes, en los valles cálidos y húmedos donde se produce coca, produciéndoles destrucción de nariz y cavidades nasales.[17][18]
En 1756, Alexander Russell, al examinar un paciente turco en Alepo, describió una lesión que deja cicatriz de por vida y que durante su evolución rara vez da mucho dolor. La llamó, "forúnculo de Alepo".[17]
En 1903, Leishman y Donovan, de forma separada, describieron el protozoo que ahora se conoce como Leishmania donovani, en el tejido del bazo de pacientes en la India con una severa enfermedad letal y que se denominaría leishmaniosis visceral.[19]
Clasificación
[editar]- Leishmaniosis cutánea: conocida en Perú como uta, se caracteriza por la aparición de úlceras cutáneas indoloras en el sitio de la picadura, las cuales se pueden curar espontáneamente o permanecer de manera crónica durante años.
- Leishmaniosis visceral o kala azar: es la forma clínica que cobra más vidas mundialmente; tal es el caso de Bangladés, India, Sudán y Brasil.[20] Esta presentación puede ser fatal si no se trata a tiempo. En perros se presenta principalmente la leishmaniosis visceral. Se ha intentado prevenir la enfermedad con repelentes de insectos aplicados a toldillos en la época de mayor riesgo de contagio con resultados dispares.
- Leishmaniosis cutánea localizada o botón de Oriente
- Leishmaniosis mucocutánea o espundia
- Leishmaniosis cutánea difusa
- Leishmaniosis cutánea post-kala azar
Epidemiología
[editar]
La leishmaniasis a nivel mundial afecta a 88 países, 67 del Viejo Mundo y 21 en América. Más del 90% de los casos de leishmaniosis visceral se presenta en cinco países: Bangladés, India, Nepal, Sudán y Brasil; cerca del 90% de los casos de leishmaniosis mucocutánea se producen en cuatro países: Bolivia, Brasil, Perú y Ecuador; y el 90% de los casos de leishmaniosis cutánea se presentan en ocho países: Afganistán, Arabia Saudí, Brasil, Argelia, Irán, Perú, Paraguay y Siria. La incidencia anual se estima entre 1 y 1.5 millones de casos en el mundo.[21]
Globalmente, alrededor de 350 000 000 personas se considera que están en riesgo de infectarse y enfermar. Cada año, un estimado de 1 500 000 a 2 000 000 niños y adultos desarrollan los síntomas de la enfermedad (forma cutánea y mucocutánea 1 000 000 a 1 500 000; forma visceral 500 000), y la incidencia de la infección es mayor cuando se presentan otras infecciones. La leishmaniosis se asocia con unos 2 400 000 personas con discapacidad y alrededor de 70 000 muertes por año.[22]
Etiología
[editar]

Los vectores de la leishmaniosis son mosquitos del orden Diptera, familia Psychodidae, subfamilia Phlebotominae y géneros Phlebotomus y Lutzomyia.
La Leishmania presenta 2 estados morfológicos, el promastigote, presente de forma extracelular y ubicado en el intestino de los mosquitos, se caracteriza por tener un cuerpo alargado y un flagelo que les permite el movimiento. Esta forma, al ser inoculada dentro de los hospedadores, se transforma en el segundo estado morfológico conocido como amastigote. Los amastigotes se caracterizan por ser redondeados, sin la presencia del flagelo, de 2 a 4 μm (micras) de diámetro con un núcleo y un kinetoplasto (estructura mitocondrial especializada que contiene ADN). Esta forma aflagelada es la visualizada en los frotis y biopsia para el diagnóstico de la enfermedad. Los amastigotes son exclusivamente intracelulares pero pueden encontrarse en el intersticio en los casos en los que el parásito se reproduce hasta ocasionar la ruptura de la célula hospedadora.
Cuadro clínico
[editar]
En la leishmaniosis cutánea el parásito se localiza en la piel. Después de la picadura del mosquito, transcurren entre una y doce semanas para que se desarrolle una pápula eritematosa, que crece y se ulcera, generando una costra de exudado seco. La mayoría de los pacientes desarrolla una o dos de estas lesiones, en cara, manos o piernas, con un tamaño de cada lesión entre 0,5 y 3 centímetros de diámetro, aunque existe una gran variabilidad en la presentación de ellas. Las lesiones tienden a curarse espontáneamente en un lapso de meses, dejando cicatrices hipopigmentadas con bordes hiperpigmentados sobrelevantados. Este tipo de leishmaniosis es más común en América Central y del Sur.[23] La leishmaniosis cutánea se subdivide de acuerdo con su duración en una forma aguda si dura menos de un año en las zoonosis o menos de dos años si es antroponótica.
La leishmaniosis visceral se caracteriza por la inflamación del hígado y del bazo, acompañada por distensión abdominal severa, pérdida de condición corporal, desnutrición y anemia.
Diagnóstico
[editar]
El diagnóstico de la leishmaniosis requiere la visualización directa del parásito en improntas del sitio de la lesión, las cuales se tiñen con Giemsa o tinción de Romanowsky o por medio de biopsias. Otras formas de diagnósticar la leishmaniasis consisten en el uso de técnicas moleculares como la PCR (reacción en cadena de la polimerasa) para amplificar e identificar el ADN del parásito. La PCR más sensible detecta el ADN del kinetoplasto del parásito, mientras que para identificar su especie, se puede secuenciar parte de genes como el citocromo B.[24]
Entre los métodos indirectos de diagnóstico se encuentran el hemocultivo en medio NNN (Wikipedia inglesa) y los ensayos serológicos tradicionales como la fijación del complemento (Wikipedia inglesa) y la inmunofluorescencia, además los modernos como el ELISA. La intradermorreacción de Montenegro o Leishmanina es la más usada en el mundo y consiste en la inoculación de extractos parasitarios en la piel. Si el paciente es positivo a Leishmania, se genera una reacción de hipersensibilidad de tipo celular (IV), caracterizada por el rubor y tumefacción del área inoculada. Esta prueba es semejante a la tuberculina usada para el diagnóstico de tuberculosis.
Tratamiento
[editar]El tratamiento para la leishmaniosis[25] depende de la forma clínica de la enfermedad (cutánea localizada, cutánea difusa, mucocutánea, visceral), del vector y la especie (Nuevo Mundo, L. naiffi, L. chagasi, L. mexicana, L. viannia; Viejo Mundo, L. viannia) y de la experiencia local (aspectos del huésped, efectos adversos, disponibilidad, resistencia, aplicación de guías clínicas).[26][27][28][29][30][31]
Uno de los fármacos efectivos, tanto en los resultados clínicos como microbiológicos, es el antimonio pentavalente (SbV) por vía intravenosa.[26] Se presenta como el estibogluconato sódico (Pentostam) -usado principalmente en Europa- y el antimoniato de meglumina (Glucantime) -en América-. La adherencia de los pacientes al tratamiento presenta dificultades dada la toxicidad del fármaco y lo doloroso de este, pues consiste en 20 inyecciones de material oleoso.
Sin embargo, cada vez son más frecuentes los avisos de fallos terapéuticos, lo que se debe a la resistencia del parásito al antimonio; áreas como la de Bihar en La India informan de resistencia en el 70% de los casos tratados de leishmaniosis visceral.
También se utiliza:
- Anfotericina B.
- Paromomicina: aminoglucósido activo frente a la leishmania, a un a dosis de 15 mg/kg/día, entre 3 y 4 semanas, en inyección intramuscular.
- Miltefosina: fármaco aprobado por la FDA en 2014 para la leishmania donovani, y la dosis según el peso es 50 mg/12h (si el peso está entre 30 y 45 kg) o 50 mg/8h, si el peso es mayor. La duración del tratamiento también es de 4 semanas completas.
En caso de resistencia, se usan combinaciones de estos fármacos para intentar mejorar las tasas de curación.
Cirugía
[editar]Consiste en la extirpación de lesiones pequeñas.
Fisioterapia
[editar]Pronóstico
[editar]- El pronóstico de las formas cutáneas localizadas en pacientes inmuno-competentes es bueno; muchos de estos casos curan espontáneamente, si bien pueden quedar lesiones cicatrizales con impacto estético.
- En el caso de la leishmaniosis visceral, sin tratamiento la mortalidad es muy elevada, y aun con tratamiento es también considerable. Los pacientes inmuno-competentes diagnosticados tempranamente y tratados de forma adecuada tienen mejor pronóstico.
- En los pacientes infectados con el VIH la tasa de recidivas es elevada, incluso después de un tratamiento adecuado, debido a reactivaciones.
Profilaxis
[editar]- Luchar contra los vectores: se realiza mediante nebulizaciones de insecticidas en zonas donde generalmente se crían los flebótomos.
- Diagnóstico y tratamiento de casos humanos y en animales reservorios (principalmente perros).
- Lucha contra el reservorio mediante exterminio de los perros vagabundos (culling del habla inglesa)[32]
- Rígido control sobre perros, realizando una vigilancia veterinaria periódica de los animales sanos.
- Los mayores esfuerzos en la actualidad van encaminados a conseguir fármacos quimio profilácticos y sobre todo a obtener vacunas polivalentes eficaces contra todas las especies de Leishmania. Los resultados más prometedores se han observado empleando vacunas recombinantes con el fragmento Gp 63.
- Actualmente, no existe una vacuna eficaz, empleada de rutina, contra la Leishmania, en ninguna parte del mundo, aunque algunas se han empleado en situaciones muy especiales.
Leishmaniosis animal
[editar]
El parásito Leishmania puede invadir, en algunas situaciones, diferentes órganos del perro y otros mamíferos, como las liebres, provocando lesiones de gravedad variable. En algunos casos, las lesiones son de tal magnitud, que se produce la muerte del animal, sobre todo debido a un fallo renal.
La sintomatología clínica es muy variable, pero cabe destacar las lesiones en la piel, en las articulaciones y, cuando la enfermedad está ya bastante avanzada, en el riñón. No sólo la gravedad de las lesiones, sino también la patogenia, dependen de varios factores. Estos factores están relacionados con el mosquito, con el sistema inmunitario del perro, con su genética (no todas las razas son igualmente susceptibles), con el parásito y con la presencia de otras enfermedades concomitantes.[33]
Es importante dejar claro que no todas las infecciones por Leishmania producen enfermedad en el perro. Su progreso depende, como se acaba de decir, de la combinación de esos factores. Puede haber infecciones asintomáticas e infecciones mortales.
El parásito se transmite a través de los jejenes (también llamados flebotomos y papalotillas). Cuando el mosquito pica al animal, el parásito, situado en la probóscide, entra en el organismo del perro e inicia el proceso de infección.
A diferencia de mosquitos más comunes, como los culícidos, el jején es extremadamente pequeño. No es nada fácil de ver, y tampoco de oír, dado que no hace el típico zumbido al volar. Solamente pican las hembras, que necesitan sangre para desarrollar los huevos. Los machos se alimentan de azúcares y plantas.
La picadura del jején transmite la enfermedad sólo si previamente había picado a otro animal ya infectado. Los perros y otros mamíferos infectados no transmiten directamente la leishmaniosis a las personas, sino a través del vector alado, el jején. El reservorio habitual es el perro, pero para que la enfermedad se trasmita es imprescindible la participación del vector (mosquito flebótomo). Los perros no contagian la enfermedad directamente a otros animales ni a las personas por ninguna vía, o al menos no ha sido documentado.
A día de hoy, la leishmaniosis no se puede curar con ningún medicamento. El tratamiento es puramente sintomático y de soporte. La importancia de este, sin embargo, es mayúscula y se pretende ayudar al animal a que él mismo combata la enfermedad, paliando los signos clínicos y evitando complicaciones. Es muy importante detectar la enfermedad pronto, ya que así se puede mejorar el pronóstico de la misma gracias a la monitorización y al tratamiento rápido de los primeros síntomas.
Actualmente ya existe una vacuna contra la leishmaniosis, descubierta por el doctor e investigador venezolano Jacinto Convit.[34][35]
El riesgo de contraer esta enfermedad se da principalmente en los países del mediterráneo y América Latina, habiendo un mayor riesgo en las épocas de mayor calor, normalmente entre la puesta de sol y el amanecer.
Es importante hacer un diagnóstico diferencial, aunque este no es necesariamente certero debido a que hay enfermedades como esquistosomiasis, brucelosis, malaria, hepatitis viral, histoplasmosis sistémica, tuberculosis, paracoccidioidomicosis diseminada, leucemia, linfoma, entre otras, que pueden presentar síntomas similares a la leishmaniosis visceral.
Referencias
[editar]- ↑ Roy, Mrinalini; Rawat, Aadish; Kaushik, Sanket; Jyoti, Anupam; Srivastava, Vijay Kumar (1 de agosto de 2022). «Endogenous cysteine protease inhibitors in upmost pathogenic parasitic protozoa». Microbiological Research (en inglés) 261: 127061. ISSN 0944-5013. PMID 35605309. S2CID 248741177. doi:10.1016/j.micres.2022.127061.
- ↑ a b c «Leishmaniasis Fact sheet N°375». World Health Organization (en inglés). enero de 2014. Archivado desde el original el 21 de febrero de 2014. Consultado el 17 de febrero de 2014.
- ↑ a b c d Barrett, M. P.; Croft, S. L. (1 de diciembre de 2012). «Management of trypanosomiasis and leishmaniasis». British Medical Bulletin (en inglés) 104 (1): 175-196. ISSN 0007-1420. PMC 3530408. PMID 23137768. doi:10.1093/bmb/lds031. Consultado el 14 de agosto de 2024.
- ↑ a b c d e f «Leishmaniasis Fact sheet N°375». Organización Mundial de la Salud. enero de 2014. Archivado desde el original el 21 de febrero de 2014. Consultado el 17 de febrero de 2014.
- ↑ Barrett, M. P.; Croft, S. L. (1 de diciembre de 2012). «Management of trypanosomiasis and leishmaniasis». British Medical Bulletin (en inglés) 104 (1): 175-196. ISSN 0007-1420. PMC 3530408. PMID 23137768. doi:10.1093/bmb/lds031. Consultado el 14 de agosto de 2024.
- ↑ Rawat, Aadish; Roy, Mrinalini; Jyoti, Anupam; Kaushik, Sanket; Verma, Kuldeep; Srivastava, Vijay Kumar (August 2021). «Cysteine proteases: Battling pathogenic parasitic protozoans with omnipresent enzymes». Microbiological Research (en inglés) 249: 126784. PMID 33989978. S2CID 234597200. doi:10.1016/j.micres.2021.126784.
- ↑ Sulca, Rosalyn (25 de abril de 2016). «Leishmaniasis: ¿qué es la uta y cómo se transmite?». rpp.pe. Consultado el 7 de julio de 2021.
- ↑ «WHO | Magnitude of the problem». web.archive.org. 26 de octubre de 2013. Consultado el 14 de agosto de 2024.
- ↑ Vos, Theo; Allen, Christine; Arora, Megha; Barber, Ryan M; Bhutta, Zulfiqar A; Brown, Alexandria; Carter, Austin; Casey, Daniel C et al. (2016-10). «Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015». The Lancet (en inglés) 388 (10053): 1545-1602. PMC 5055577. PMID 27733282. doi:10.1016/S0140-6736(16)31678-6. Consultado el 14 de agosto de 2024.
- ↑ Lozano, Rafael; Naghavi, Mohsen; Foreman, Kyle; Lim, Stephen; Shibuya, Kenji; Aboyans, Victor; Abraham, Jerry; Adair, Timothy et al. (2012-12). «Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010». The Lancet (en inglés) 380 (9859): 2095-2128. PMC 10790329. PMID 23245604. doi:10.1016/S0140-6736(12)61728-0. Consultado el 14 de agosto de 2024.
- ↑ Ejazi, Sarfaraz Ahmad; Ali, Nahid (2013-01). «Developments in diagnosis and treatment of visceral leishmaniasis during the last decade and future prospects». Expert Review of Anti-infective Therapy (en inglés) 11 (1): 79-98. ISSN 1478-7210. doi:10.1586/eri.12.148. Consultado el 14 de agosto de 2024.
- ↑ «CDC - Neglected Tropical Diseases - Diseases». web.archive.org. 4 de diciembre de 2014. Consultado el 14 de agosto de 2024.
- ↑ Sundar, Shyam; Chakravarty, Jaya (2013-01). «Leishmaniasis: an update of current pharmacotherapy». Expert Opinion on Pharmacotherapy (en inglés) 14 (1): 53-63. ISSN 1465-6566. doi:10.1517/14656566.2013.755515. Consultado el 14 de agosto de 2024.
- ↑ «Leishmaniasis: an update of current pharmacotherapy». Expert Opinion on Pharmacotherapy 14 (1): 53-63. January 2013. PMID 23256501. S2CID 207479873. doi:10.1517/14656566.2013.755515. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ Dorlo, T. P. C.; Balasegaram, M.; Beijnen, J. H.; de Vries, P. J. (1 de noviembre de 2012). «Miltefosine: a review of its pharmacology and therapeutic efficacy in the treatment of leishmaniasis». Journal of Antimicrobial Chemotherapy (en inglés) 67 (11): 2576-2597. ISSN 0305-7453. doi:10.1093/jac/dks275. Consultado el 14 de agosto de 2024.
- ↑ Minodier, Philippe; Parola, Philippe (2007-05). «Cutaneous leishmaniasis treatment». Travel Medicine and Infectious Disease (en inglés) 5 (3): 150-158. doi:10.1016/j.tmaid.2006.09.004. Consultado el 14 de agosto de 2024.
- ↑ a b ul Bari, Arfan (2006). «Chronology of cutaneous leishmaniasis: An overview of the history of the disease» [Cronología de la leishmaniasis cutánea: una perspectiva general de la historia de la enfermedad]. Journal of Pakistan Association of Dermatologists (en inglés) (Muzaffarabad, Pakistán) 16: 24-27. Archivado desde el original el 15 de octubre de 2013. Consultado el 10 de octubre de 2013.
- ↑ Sánchez-Saldaña, Leonardo; Sáenz-Anduaga, Eliana; Pancorbo-Mendoza, Julia; Zegarra-Del-Carpio, Robert; Garcés-Velasco, Norma; Regis-Roggero, Alberto (2004). «Leishmaniasis». Dermatología Peruana (Lima, Perú: Sociedad Peruana de Dermatología) 14 (2): 82-98. Consultado el 15 de octubre de 2013.
- ↑ Herwaldt, Barbara L (octubre de 1999). «Leishmaniasis». Lancet (en inglés) (Atlanta, Estados Unidos) 354 (9185): 1191-9. PMID 10513726. doi:10.1016/S0140-6736(98)10178-2. Consultado el 8 de octubre de 2013.
- ↑ Kala azar. La fiebre negra de los desfavorecidos.
- ↑ Dey A, Singh S (2006). «Transfusion transmitted leishmaniasis: a case report and review of literature» [Leishmaniasis transmitida por transfusión: reporte de un caso y revisión de la literatura]. Ind J Med Micro (en inglés) (Nueva Delhi, India) 24 (3): 165 - 70. PMID 16912434. Consultado el 9 de octubre de 2013.
- ↑ Murray HW, Berman JD, Davies CR, Saravia NG, (2005). «Advances in leishmaniasis». Lancet 366: 1561 - 77. PMID 16257344.
- ↑ González, U; Pinart, M; Rengifo-Pardo, M; Macaya, A; Alvar, J; Tweed, JA (2009). «Interventions for American cutaneous and mucocutaneous leishmaniasis». Cochrane Database of Systematic Reviews (en inglés) 2 (CD004834). doi:10.1002/14651858.CD004834.pub2. Consultado el 10 de octubre de 2013.
- ↑ Bezemer, Jacob M.; Freire-Paspuel, Byron P.; Schallig, Henk D. F. H.; de Vries, Henry J.C.; Calvopiña, Manuel (12 de junio de 2023). «Leishmania species and clinical characteristics of Pacific and Amazon cutaneous leishmaniasis in Ecuador and determinants of health-seeking delay: a cross-sectional study». BMC Infectious Diseases (en inglés) 23 (1). ISSN 1471-2334. PMC 10258766. PMID 37308815. doi:10.1186/s12879-023-08377-8. Consultado el 22 de julio de 2023.
- ↑ «Tratamiento de leishmaniosis en perros».
- ↑ a b Torres-Guerrero, Edoardo; Quintanilla-Cedillo, Marco Romano; Ruiz-Esmenjaud, Julieta; Arenas, Roberto (mayo de 2017). «Leishmaniasis: a review» [Leishmaniasis: una revisión]. F1000Res (en inglés) (F1000 Research Ltd) 6: 750. PMID 28649370. doi:10.12688/f1000research.11120.1. Consultado el 10 de agosto de 2017.
- ↑ Sundar, Shyam; Singh, Anup (junio de 2016). «Recent developments and future prospects in the treatment of visceral leishmaniasis» [Desarrollos recientes y proyecciones futuras en el tratamiento de la leishmaniasis visceral]. Ther Adv Infect Dis (en inglés) (SAGE Publications) 3 (3-4): 98-109. PMID 27536354. doi:10.1177/2049936116646063. Consultado el 10 de agosto de 2017.
- ↑ van Griensven, Johan; Gadisa, Endalamaw; Aseffa, Abraham; Hailu, Asrat; Abate Mulugeta, Beshah; Diro, Ermias (marzo de 2016). «Treatment of Cutaneous Leishmaniasis Caused by : A Systematic Review» [Tratamiento de la leishmaniasis cutánea provocada por Leishmania aethiopica: una revisión sistemática]. PLoS Negl Trop Dis (en inglés) (Public Library of Science) 10 (3): e0004495. PMID 26938448. doi:10.1371/journal.pntd.0004495. Consultado el 10 de agosto de 2017.
- ↑ de Vries, Henry J. C.; Reedijk, Sophia H.; Schallig, Henk D. F. H. (febrero de 2015). «Cutaneous Leishmaniasis: Recent Developments in Diagnosis and Management» [Leishmaniasis cutánea: desarrollos recientes en diagnóstico y tratamiento]. Am J Clin Dermatol (en inglés) (Springer) 16 (2): 99-109. PMID 25687688. doi:10.1007/s40257-015-0114-z. Consultado el 10 de agosto de 2017.
- ↑ Georgiadou, Sarah P.; Makaritsis, Konstantinos P.; Dalekos, George N. (abril a junio de 2015). «Leishmaniasis revisited: Current aspects on epidemiology, diagnosis and treatment» [Leishmaniasis revisitada: aspectos actuales sobre la epidemiología, el diagnóstico y el tratamiento]. J Transl Int Med (en inglés) (De Gruyter Open) 3 (2): 43-50. PMID 27847886. doi:10.1515/jtim-2015-0002. Consultado el 10 de agosto de 2017.
- ↑ del Rosal Rabesa, T.; Baquero-Artigaob, F.; García Miguel, M.J. (abril a junio de 2010). «Leishmaniasis cutánea». Rev Pediatr Aten Primaria (Madrid, España: Scielo) 12 (46). ISSN 1139-7632. Consultado el 10 de agosto de 2017.
- ↑ Pedro-Pons, Agustín (1974). Patología y Clínica Médicas 6 (tercera edición). España: Salvat. p. 927. ISBN 8434511061.
- ↑ González-Núñez, Carlos (16 de marzo de 2017). «Leishmaniosis en perros: Síntomas, Diagnóstico, Tratamiento y Prevención». Archivado desde el original el 8 de abril de 2017. Consultado el 8 de abril de 2017.
- ↑ Convit, Jacinto (2005). «Desarrollo de una vacuna contra la Leishmaniasis cutánea en sus aspectos de inmunoterapia y posible aplicación en inmunoprofilaxis». Academia Biomédica Digital.
- ↑ Carrero Rangel, José Albar; Borges, Rafael Horacio; Convit García, Jacinto; Avilan Rovira, José; De Lima, Hector (enero a julio de 2011). «Inmunoterapia de la leishmaniasis cutánea: factores que infuencian su efectividad». Boletín de malariología y salud ambiental (Venezuela) 51 (1): 25-33. Consultado el 19 de noviembre de 2017.
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre Leishmaniasis.
Wikimedia Commons alberga una categoría multimedia sobre Leishmaniasis.- Manual de lucha contra la Leishmaniasis Archivado el 12 de marzo de 2007 en Wayback Machine.
- The International Leishmania Network (ILN).
- "Leishmaniosis en perros – Síntomas, tratamiento y contagio"
- KBD: Kinetoplastid Biology and Disease Sobre Leishmaniasis y Chagas.
- Proyecto de World Community Grid Para la búsqueda de una cura para la enfermedad.
- Informe para veterinarios clínicos
- Organización Panamericana de la Salud. Manual de procedimientos para la vigilancia y el control de las leishmaniasis en la Región de las Américas. Washington, D.C: OPS; 2023. Disponible en: https://doi.org/10.37774/9789275327340
