Enfermedades tropicales desatendidas

Las enfermedades tropicales desatendidas (a menudo designadas por sus siglas en inglés NTD - Neglected tropical diseases) son un grupo de diversas enfermedades tropicales frecuentes en el seno de las poblaciones de bajos ingresos en regiones en desarrollo de África, Asia y América. Están causadas por varios patógenos entre los que destacan los parásitos helmintos o los protozoos, pero igualmente los virus y las bacterias. En el África subsahariana, el impacto del conjunto de estas patologías es comparable al de la malaria y la tuberculosis.[1] Algunas de estas patologías pueden prevenirse o tratarse por medios accesibles en los países más desarrollados, pero no en las regiones más pobres del globo. En ciertos casos, sin embargo, los tratamientos son relativamente baratos. Por ejemplo, el tratamiento de la esquistosomiasis costaba 0,20 dólares norteamericanos por niño y año en 2007. No obstante, para el periodo 2010-2017, el coste del control de estas patologías a escala mundial se estima entre 2 y 3 mil millones de dólares.[2]
Estas enfermedades son puestas a menudo en contraste con las tres grandes plagas mundiales, que son la infección por el VIH (sida), la tuberculosis y el paludismo (malaria), las cuales se benefician de numerosos fondos para su investigación y tratamiento. Sin embargo las enfermedades tropicales desatendidas constituyen las comorbilidades frecuentes de estas tres infecciones.[3] No obstante, por parte de ciertas compañías farmacéuticas se producen de manera esporádica donativos de los medicamentos necesarios, y políticas para administrarlos masivamente han sido eficaces en varios países.[4]
La Organización Mundial de la Salud (OMS) ha priorizado 17 NTD. Estas enfermedades están consideradas como endémicas en 149 países y afectan a más de mil millones de personas, de las cuales más de la mitad son niños. Aunque el peso económico de estas patologías sobre las economías en desarrollo es difícil de cuantificar, se estima en varios miles de millones de dólares cada año. Han provocado 142 000 muertes en 2013, cifra que supone un descenso respecto a los 204 000 fallecimientos en 1990. De estas 17 patologías, 2 son el objetivo de una próxima erradicación: la dracunculiasis en 2015 y el pian de aquí a 2020. Por otra parte, el objetivo es eliminar otras 4: el tracoma, la enfermedad del sueño, la lepra y la filariosis linfática de aquí a 2020.[5][6][7]
Lista de estas enfermedades[editar]
Existe debate en el seno de la Organización Mundial de la Salud (OMS), de los Centros para el Control y Prevención de Enfermedades (CDC por sus siglas en inglés), y de los expertos en enfermedades infecciosas con relación a las patologías clasificables como enfermedades tropicales desatendidas. Feasey, que investiga la cuestión, enumera 13: ascariasis, la úlcera de Buruli, la enfermedad de Chagas, la dracunculiasis, la anquilostomiasis, la enfermedad del sueño, la leishmaniasis, la lepra, la filariosis linfática, la oncocercosis, la esquistosomiasis (bilharziosis), el tracoma y la tricuriasis.[8] Por su parte, Fenwick reconoce solo 12 NTD «esenciales»: las 13 anteriores menos la anquilostomiasis.[9]
Estas patologías las producen 4 tipos de patógenos:
- (i) parásitos protozoarios (enfermedad de Chagas, enfermedad del sueño, leishmaniosis);
- (ii) bacterias (úlcera de Buruli, lepra, tracoma, pian),
- (iii) los parásitos helmintos o gusanos (cisticercosis/teniasis, dracunculosis, equinocosis, distomatosis, filariosis linfática, oncocercosis, bilharziosis, nemátodos intestinales); y
- (iv) los virus (dengue, chikunguña, rabia).
La Organización Mundial de la Salud reconoce las 17 patologías descritas a continuación como enfermedades tropicales desatendidas.[10]
Protozoosis[editar]
Tripanosomiasis africana[editar]

La Tripanosomiasis africana es comúnmente llamada «enfermedad del sueño». Actualmente se cuentan menos de 10000 casos. Si no se trata, la enfermedad puede acabar con la muerte de la persona afectada. Es una enfermedad vectorial,[11] transmitida cuando la persona es picada por la glossina, también llamada mosca tsé-tsé.[12]
Los tratamientos existentes son poco eficaces, sobre todo debido al desarrollo de resistencias por el parásito, y producen numerosos efectos secundarios indeseables potencialmente graves. Los síntomas más frecuentes son fiebre, cefaleas, adenopatías (agrandamiento de los ganglios), una perturbación del ciclo sueño-vigilia, trastornos de la personalidad, decadencia cognitiva y, al final, el coma y la muerte. La enfermedad puede ser diagnosticada a través de un simple análisis serológico (de anticuerpos).[13] En 2015 el número de nuevos casos de enfermedad del sueño se ha reducido a 3000 desde los 37000 de 1999.[14]
Tripanosomiasis americana[editar]
La tripanosomiasis americana es comúnmente llamada «enfermedad de Chagas» o «mal de Chagas». Se estima en 6 - 7 millones el número de personas infectadas por el Trypanosoma cruzi, el agente causal de la enfermedad.[15] La morbilidad es superior en los pacientes con un sistema inmune debilitado, en los niños y en las personas mayores, pero es muy baja si se trata preventivamente de un modo eficaz. La enfermedad de Chagas es de evolución lenta, provocando la aparición de síntomas crónicos a lo largo de varios años. Se trata de una enfermedad vectorial: el parásito lo transmiten las heces de un triatoma infectado.[16] El protozoo puede penetrar en el organismo por una herida cutánea, ligada o no a la picadura hematófaga (para sacar sangre) del insecto, o por las mucosas. La infección puede igualmente resultar de la ingesta de líquido o de alimento infectados, o incluso de la inhalación de grandes cantidades de polvo que contienen heces del insecto. Finalmente, se produce una proporción no desdeñable de transmisión vertical durante el embarazo, o incluso por la transfusión de sangre infectada.[17]
De esta forma se puede prevenir la enfermedad de Chagas primeramente por la eliminación de los focos de triatoma en las casas, la mejora de los hábitats, la instalación de mosquiteras, la mejora de la higiene alimentaria, y el testado, sobre todo de las mujeres en edad de procrear y de los donantes de sangre.
Se describen 2 fases en la enfermedad de Chagas. La fase aguda es normalmente asintomática. Los primeros síntomas son, habitualmente: chancro, chagoma (un edema o inflamación de uno de los 2 párpados), adenopatías locales y fiebre, acompañados de otros síntomas variados y dependientes del punto de inoculación. El 30% de los infectados desarrolla una fase crónica que puede manifestarse de 3 formas: asintomática (la más frecuente), cardíaca o digestiva.[18] La enfermedad es de diagnóstico difícil: serológico o microscópico, o atribuir al mal de Chagas las complicaciones cardíacas o digestivas que se observan en imágenes médicas (rayos X, resonancias, etc.). Existe un tratamiento curativo, aunque causa efectos secundarios potencialmente severos.
Leishmaniosis[editar]

Las 3 formas de leishmaniosis son visceral (Kala azar), cutánea y muco-cutánea. Se estima en 12 millones el número de personas afectadas. Si no se trata, la enfermedad es mortal. Se estima en 20000 el número de fallecimientos anuales. Se trata de una enfermedad vectorial transmitida durante la picadura de las hembras de diferentes especies de flebótomos. Al menos 90% de las leishmaniosis viscerales están repartidas entre Bangladés, Brasil, Etiopía, India, Sudán y Sudán del Sur. La leishmaniosis cutánea se da en Afganistán, Argelia, Brasil, Colombia, Irán, Pakistán, Perú, Arabia Saudita y Siria. En torno al 90% de las leishmanioses cutáneo-mucosas tienen lugar en Bolivia, Brasil y Perú.[19]
El diagnóstico se realiza mediante exploración clínica, análisis de sangre e identificación del parásito en las muestras extraídas del paciente, entre ellas el frotis sanguíneo y la punción de médula ósea.[20] Existen tratamientos, pero son caros, y por tanto relativamente poco accesibles para las poblaciones afectadas.[21] La prevención se basa en evitar la picadura del insecto transmisor. Además, una vacuna se encuentra en fase de desarrollo.
En 2015 se logró erradicar la leishmaniosis visceral en el 82% de los subdistritos de la India, el 97% de los subdistritos de Bangladés y el 100% de los distritos de Nepal.[14]
Infecciones bacterianas[editar]
Lepra[editar]

En 2012 hubo 232.857 nuevos casos de lepra diagnosticados y en marzo de 2013 se contaban 189.018. Entre 1 y 2 millones de individuos discapacitados o desfigurados debido a una lepra activa o pasada viven en Angola, Brasil, República Centroafricana, República Democrática del Congo, India, Madagascar, Mozambique, Nepal y Tanzania. Efectivamente, si no se trata, la lepra es una enfermedad devastadora causada por una bacteria, Mycobacterium leprae. La transmisión se produce entre individuos por medio de gotitas exhaladas por la boca y la nariz (gotitas de Pflügge). La incubación puede ir de 5 a 20 años. Los síntomas afectan a la piel, los nervios y los ojos, y conducen a una atrofia tisular. La enfermedad es curable si el tratamiento está adaptado y es precoz. Este tratamiento consiste en administrar varios antibióticos. La vacuna BCG posee un cierto efecto preventivo contra la lepra.[22][23][24]
Úlcera de Buruli[editar]
La prevalencia de la úlcera de Buruli es desconocida, pero esta patología se da en África, Asia y Latinoamérica.[25]
La enfermedad está causada por una bacteria, Mycobacterium ulcerans, que primero produce nódulos cutáneos. Después se transforman en úlceras, que pueden sobreinfectarse (ser invadidas por otro organismo patógeno), provocando deformidades responsables de discapacidades. El riesgo de mortalidad es bajo, aunque las sobreinfecciones pueden ser mortales.[26] El tratamiento se basa en cirugía y antibióticos. Cuando es precoz, permite evitar el desarrollo de la mayoría de los síntomas.
Tracoma[editar]
Se estima en 21,4 millones el número de personas afectadas por tracoma, de las cuales 2,2 millones ven mal y 1,2 millones se han quedado ciegas por esta causa. Esta enfermedad se da en África, Asia, América central y del Sur, Oriente Medio y Australia. La enfermedad alcanza sobre todo a las mujeres y las niñas. A pesar de que el daño a la vista es difícilmente reparable, el riesgo de mortalidad es muy bajo,.[27]
La enfermedad está causada por la bacteria Chlamydia trachomatis, que se disemina por secreciones oculares en las manos, la ropa o incluso las moscas que beben directamente de los ojos. El síntoma consiste en una inflamación de la cara interna de los párpados que provoca su deformación y una puesta en contacto de las pestañas con la córnea que, debido a los arañazos, se vuelve opaca. El tracoma se trata con antibióticos aplicados tópicamente, entre ellos la azitromicina en colirio. La única forma de prevención que se conoce consiste en la higiene personal. Desafortunadamente las repetidas campañas de tratamiento y educación de las poblaciones afectadas parecen haber tenido muy poco efecto.[28]
Pian[editar]

Hay pocos datos sobre la prevalencia del pian, pero se sabe que afecta sobre todo a la infancia.[29] La enfermedad es la más prevalente en las regiones cálidas y húmedas de África, Asia, América del Sur y las islas del Océano Pacífico.
Se trata de una enfermedad bacteriana crónica transmitida por contacto y debida a un treponema, Treponema pallidum pertenue. El tratamiento se basa en antibióticos (sobre todo penicilina). La enfermedad puede prevenirse con simples medidas de higiene individual. Los síntomas son lesiones cutáneas ulceradas sobre un fondo que escuece, que a menudo se sobreinfecta, provocando abscesos. Aunque el riesgo de mortalidad sea bajo, las lesiones en los miembros pueden ser incapacitantes y no reversibles tras el tratamiento. Si las lesiones son en la cara, pueden ocasionar un gran daño estético.
Verminosis[editar]
Cisticercosis y teniasis[editar]
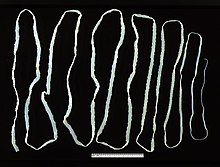
La cisticercosis y, de manera más general, las teniasis, son enfermedades parasitarias causadas por gusanos planos. Efectivamente, es la larva de Taenia solium la responsable de la cisticercosis, mientras que el gusano adulto de numerosas especies —como las conocidas Taenia solium o Taenia saginata, pero también Hymenolepis nana, Dipylidium caninum o Diphyllobothrium latum— es responsable de la teniasis. Estas enfermedades se llaman helmintiasis (por el nombre biológico de los animales que las causan, los helmintos). La cisticercosis representa la primera causa evitable de epilepsia en los países en vías de desarrollo. Aunque se dan en todo el mundo, estas patologías se encuentran principalmente en Asia, África subsahariana y Latinoamérica.
A diferencia de la cisticercosis que, en su forma neurológica, puede ser mortal, las teniasis no ponen en riesgo la vida del paciente. Estas infecciones se contraen por vía oral por la ingesta de huevos de Taenia solium dentro de un alimento contaminado: carne de cerdo, de ternera o incluso pescado. Los síntomas de las teniasis son normalmente bastante difusos: dolores abdominales, náuseas, estreñimiento, diarreas, trastornos del sueño e incluso irritabilidad.[30] La cisticercosis, en cambio, por afectar al sistema neurológico, implica la formación de quistes y de lesiones cerebrales que pueden ser la causa de cefaleas, cegueras, convulsiones, hidrocefalia, meningitis o incluso demencia. Los medicamentos antihelmínticos como el albendazol o el flubendazol se utilizan habitualmente para tratar estas afecciones. Una localización cerebral de la cisticercosis puede hacer recomendable un tratamiento inmunodepresor concomitante por corticoides. La prevención pasa principalmente por medidas de higiene que incluyen el examen de la carne antes de su consumo, la cocción larga para matar los huevos o larvas, la limitación del uso de los excrementos humanos para fertilizar los cultivos o incluso la instalación de un sistema de alcantarillado eficaz.[31]
Equinocosis[editar]

Actualmente se estima que la equinocosis afecta a más de un millón de personas en el mundo, particularmente en zonas rurales. Bajo el vocablo equinocosis se agrupan 2 enfermedades diferentes causadas por 2 parásitos distintos: la equinocosis alveolar (Echinococcus multilocularis) y la equinocosis quística o hidatidica o hidatidosis (Echinococcus granulosus). La equinocosis quística se da alrededor del Mediterráneo, la mitad sur de América del Sur, América central y Asia Central. La equinocosis alveolar se produce en China occidental y septentrional, Rusia, Europa y América del Norte.[32]

La enfermedad está causada por la ingesta de parásitos presentes en las deyecciones de ciertos animales salvajes, generalmente los cánidos.[33] Ambas infecciones tienen un periodo de incubación de varios años. La equinocosis quística provoca, como su propio nombre indica, quistes hepáticos llamados quistes hidatídicos que causan dolores abdominales, náuseas y vómitos. Estos quistes pueden igualmente producirse en los pulmones, provocando tos, dolor torácico y disnea (falta de aire). La equinocosis alveolar comienza igualmente por un quiste, en general hepático, que va a invadir progresivamente el órgano, provocando astenia, dolores abdominales, náuseas y vómitos, pudiendo, al término de una evolución de varios años, inducir una insuficiencia hepática, una cirrosis del hígado o un cáncer hepático. Por tanto la equinocosis no tratada puede ser mortal.[34] La enfermedad se diagnostica examinando imágenes médicas (rayos X, resonancias, etc.) y análisis de sangre. El tratamiento de la equinocosis es a la vez quirúrgico y medicamentoso, añadiendo a la cirugía la administración de albendazol. La enfermedad puede prevenirse vermifugando a los animales de compañía, mejorando la eliminación de sus deyecciones, y mejorando las condiciones generales de higiene sobre todo en lo referente a la alimentación y la bebida.[35]
Dracunculiasis[editar]

La dracunculiasis es conocida igualmente por el nombre de filariosis de Medina. En 2012, los cuatro países endémicos eran Chad, Etiopía, Malí y Sudán del Sur. Un programa de erradicación de la OMS, sostenido por la Fundación Carter ha permitido reducir la prevalencia y la incidencia de la enfermedad de modo drástico: en 2013 solo se registraron 113 casos de dracunculiasis, menos de la cuarta parte de los 542 registrados en 2012 y comparativamente en caída libre respecto a los 3.500.000 casos estimados en 1986. En 2016 solo se notificaron 25 casos humanos de dracunculiasis, lo que pone al alcance de la mano la erradicación de la enfermedad.[14]
La enfermedad se debe a un helminto, Dracunculus medinensis, igualmente llamado filaria de Medina o gusano de Guinea. La transmisión tiene lugar durante la ingesta de agua infestada por unos crustáceos, las cladoceras, infectados por la larva de Dracunculus medinensis. La patología no es mortal por sí misma, pero puede ser la causa de una inactividad prolongada debido a las llagas duraderas e incapacitantes que induce. El tratamiento consiste en la limpieza y vendado de las llagas provocadas por la salida del parásito aproximadamente un año después de la infección, en general en la zona distal del miembro inferior (generalmente en torno al maléolo). Además debe extraerse muy lentamente el parásito enrollándolo en un pequeño trozo de madera. La extracción es del orden de un centímetro por día, siendo por tanto el tratamiento muy largo, pues el parásito puede medir más de un metro de longitud. Una extracción más rápida es peligrosa por el riesgo de ruptura del parásito que podría suponer perturbaciones alérgicas en el paciente, e incluso un choque anafiláctico con resultado de muerte. La dracunculiasis puede prevenirse filtrando el agua, identificando rápidamente los casos para evitar la diseminación y tratando con larvicidas el agua que se va a beber. Al ser largo el ciclo del parásito, del orden de un año, estos métodos son rápidamente eficaces cuando se siguen en toda una población.[36][37]
Filariosis linfática[editar]
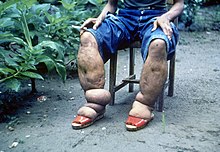
La filariosis o filariasis linfática, que provoca la impresionante elefantiasis, afecta aproximadamente a 120 millones de individuos, de los cuales 40 millones sufren deformidades. Dos tercios de los casos se dan en el Sudeste Asiático, mientras que el tercio restante se produce en el África subsahariana.
La enfermedad puede ser causada por diferentes especies de nemátodos: Wuchereria bancrofti (filaria de Bancroft, la más frecuente), Brugia malayi (filariosis de Malasia) y Brugia timori. Se trata de una enfermedad vectorial transmitida por diversas especies de mosquitos de los géneros Anopheles, Culex, Aedes o Mansonia. La enfermedad raramente resulta mortal, pero los daños relacionados con el parásito perduran para el resto de la vida de los pacientes. Consisten en linfedemas en los miembros, patologías genitales y crisis dolorosas. La mayoría de los infectados no muestran síntomas aparentes, pero al examinarlos presentan daños en el sistema linfático y, en más del 40% de los casos, daños renales que pueden generar una insuficiencia renal. El diagnóstico se hace por el examen parasitológico de la sangre del paciente, extraída a la mitad de la jornada o en medio de la noche (en general, ambos) en función de la especie infectante considerada. Históricamente las filariosis se tratan con dietilcarbamazina. Sin embargo, un tratamiento antihelmíntico a base de ivermectina, albendazol o incluso praziquantel es eficaz. Otra estrategia consiste en la administración de doxiciclina, antibiótico que mata a la Wolbachia, bacteria simbiótica del parásito. La prevención pasa por la lucha contra los vectores y sus picaduras y la administración preventiva de filaricidas y microfilaricidas.[38][39]
Oncocercosis[editar]

La oncocercosis, también conocida como «ceguera de los ríos», afecta aproximadamente a 37 millones de personas, el 99% en África subsahariana, sobre todo en las zonas rurales.[40] La enfermedad está causada por una filaria, Onchocerca volvulus, transmitida por una mosca hematófaga del género Simulie. Estos insectos se encuentran principalmente a lo largo de cursos de agua, sombreados y aireados. Estas características del vector explican el nombre clásico de «ceguera de los ríos». De esta forma la oncocercosis provoca el desplazamiento de poblaciones, alejándolas de puntos de agua dulce, y el abandono de pueblos enteros.
El parásito provoca ceguera en su estado larvario, erupciones cutáneas, una despigmentación de la piel y picores.[40] La enfermedad puede tratarse con ivermectina y prevenirse con la aplicación de insecticidas y la administración preventiva de antihelmínticos.
Esquistosomiasis[editar]
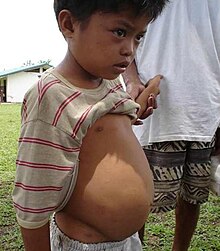
Se cuentan más de 200 millones de casos de esquistosomiasis (antiguamente llamada bilharziasis o bilharziosis) en el mundo. Se estima que el 85% de ellos se ubican en el África subsahariana, de los cuales la mayoría son esquistosomiasis intestinales y urinarias. En otras regiones del mundo, sobre todo en el sudeste Asiático, existen formas clínicas particulares de esquistosomiasis debidas a ciertas especies específicas.
Las diferentes especies de esquistosoma tienen un ciclo parasitario complejo donde el ser humano es el huésped definitivo, mientras que de los moluscos de agua dulce hacen de huéspedes intermedios. Cada especie distinta de esquistosoma se hospeda de forma intermedia en una especie diferente de molusco. La infección se produce por el contacto de la piel de la persona con agua contaminada. Los daños orgánicos consecutivos a la infección no son tanto debidos al gusano en sí mismo o a su larva, sino a la cantidad de huevos producidos por los parásitos. Las consecuencias clásicas están representadas por hematuria, obstrucción de la vesícula biliar, insuficiencia renal, cáncer de vejiga, fibrosis periportal y posteriormente hipertensión portal, ascitis y fuertes hemorragias intestinales como consecuencia de la aparición de varices esofágicas. La enfermedad puede por tanto ser mortal al término de una evolución relativamente larga. La infección por el parásito es igualmente la causa de lesiones del cuello del útero en la mujer y la niña, aumentando el riesgo de transmisión del VIH.
La enfermedad puede ser diagnosticada mediante un análisis de sangre, pero de esta forma se producen numerosos falsos positivos. También se puede diagnosticar si, examinando directamente las heces o la orina (eventualmente también los esputos), se encuentran huevos del parásito. Para tratar a los afectados de esquistosomiasis, se utiliza praziquantel, aunque no evita la reinfección. El coste de prevención se estima en 0,32 dólares por niño y año, y consistiría en una administración de praziquantel a toda la población, un mejor acceso a agua limpia, una mejora de las condiciones higiénicas y una educación sanitaria de las poblaciones implicadas. Varias vacunas se encuentran actualmente en desarrollo, sobre todo el Bilhvax.[41]
Nematodosis digestivas[editar]
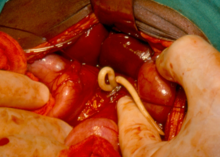
El término nematodosis digestiva incluye, en el marco de las enfermedades tropicales desatendidas, la tricuriasis (causada por el nemátodo Trichuris trichiura), la ascariasis (por el Ascaris lumbricoides) y la anquilostomiasis (por el Ancylostoma duodenale y Necator americanus).[42] Se estima en 1,5 miles de millones el número de personas infectadas por estos organismos. Las nematodosis digestivas se dan en África subsahariana, América Central y del Sur, China y el sudeste asiático.
La transmisión de estos gusanos parásitos se debe generalmente a la exposición a heces infectadas por vía cutánea o intestinal (peligro fecal), difundidas por prácticas como la defecación al aire libre o el empleo de las heces humanas como abono agrícola. Los síntomas más comunes son anemia, retraso en el crecimiento y disminución de las capacidades físicas, así como de las prestaciones escolares y de la atención. La gravedad de la patología depende ampliamente de la carga parasitaria del paciente, pero puede incluir problemas intestinales y astenia, que pueden comprometer el desarrollo físico y cognitivo de los niños afectados. El tratamiento medicamentoso con flubendazol, albendazol o ivermectina puede a menudo bastar, pero a veces es necesario recurrir a la cirugía digestiva en caso de carga parasitaria muy elevada o de complicaciones digestivas. Estas enfermedades pueden prevenirse mediante la mejora de las condiciones de higiene doméstica y de las infraestructuras de tratamiento de aguas residuales, mediante acceso a agua limpia y con higiene en la preparación de los alimentos. En las regiones del mundo más afectadas por estos gusanos, la OMS recomienda, sin diagnóstico previo, administrar antihelmínticos (vermifugar) a la población.
Virosis[editar]
Dengue[editar]
Se estima entre 50 y 100 millones cada año el número de infectados sintomáticos por el virus del dengue.[43] Los casos de dengue se encuentran principalmente en Asia, Latinoamérica y el norte de Australia.
El dengue es una arbovirosis (enfermedad debida a un arbovirus, que no tienen que ver con los árboles, sino con los artrópodos) causada por un flavivirus transmitido por la picadura de un mosquito hematófago, Aedes aegypti. Solo se pueden tratar los síntomas, que son poco específicos: fiebre, dolor de cabeza, de las articulaciones, de los músculos, resultando por tanto parecido a una gripe. El dengue no es mortal en la mayoría de los casos, pero la infección con uno de los 4 serotipos puede aumentar la gravedad de una infección posterior por otro serotipo, que resulte en un dengue severo potencialmente mortal.
Rabia[editar]

La prevalencia es más elevada en las zonas rurales y afecta principalmente a los niños de Asia y África.[44]
La rabia es habitualmente mortal después del desarrollo de los síntomas. La enfermedad está causada por un Rhabdoviridae del género Lyssavirus transmitido por animales infectados a través de heridas o mordeduras. Hay dos formas de rabia: furiosa y paralítica. Se estima en 60.000 el número de víctimas de la rabia cada año. Los primeros síntomas son fiebre y dolor en el punto de infección entre uno y tres meses después del periodo de incubación.
La rabia furiosa, el tipo más común, causa hiperactividad, hidrofobia y miedo al aire fresco poco antes de que se produzca el fallecimiento por parada cardiorrespiratoria en algunos días. La rabia paralítica provoca una parálisis progresiva, después un coma y finalmente el óbito.
Es imposible diagnosticar una rabia antes del comienzo de los síntomas, pero puede detectarse una vez han empezado. Puede prevenirse vacunando a humanos o animales, por ejemplo, al perro (los perros transmiten el 99% de las rabias),[45] y también por la rápida limpieza con agua y jabón, y posterior desinfección de las heridas (o mordeduras) que haya producido un animal del que no se tenga la certeza de que está vacunado contra la rabia (profilaxis tras la exposición). No hay tratamiento curativo.[45]
En 2015 solamente se notificaron doce muertes humanas por rabia en la región de las Américas, lo que acerca dicha región al objetivo de erradicar la enfermedad en las personas.[14]
Otras enfermedades tropicales desatendidas[editar]
Mordedura de serpientes[editar]
La OMS considera la mordedura de serpiente como «otra condición desatendida».[46] Las mordeduras de serpientes son un problema de salud pública en las zonas rurales de África y Asia del sur y sudeste. Sin embargo, no hay ningún programa oficial de la OMS para el diagnóstico, el tratamiento o la prevención de estas mordeduras.
En 2017 a las NTD antes citadas la OMS ha añadido la cromomicosis y otras micosis profundas, y la sarna o escabiosis.[46]
Consecuencias económicas[editar]
Conteh, Engels y Molyneux atribuyen el bajo coste del tratamiento de las enfermedades tropicales desatendidas (NTD) al importante número de programas, la donación de medicamentos gratuitos por las compañías farmacéuticas, el modo de suministro de los medicamentos y la distribución de estos por voluntarios. Arguyen igualmente que el impacto en la economía de estas enfermedades está infravalorado, lo que no permite calcular correctamente la relación coste-eficacia en los tratamientos para estas enfermedades.[47] El retorno de la inversión de las medidas para el control de las NTD se estima entre 14 y 30 %, en función de la enfermedad y de la región del mundo que se considere.[47] Una eliminación de las verminosis a largo plazo permitiría una disminución del 25 % del absentismo escolar y un aumento sustancial del ingreso de los adultos.[48]
No obstante, el coste del tratamiento de algunas de estas enfermedades, como la úlcera de Buruli, puede elevarse a más de dos veces los ingresos anuales de un hogar en el cuartil más pobre, mientras que en el cuartil más rico, la carga representa un poco menos que los ingresos anuales medios. Estos costes elevados afectan a la calidad del tratamiento y pueden llevar a la ruina financiera. Estas enfermedades suponen igualmente menor desarrollo, pérdida de productividad de la mano de obra —debida a la morbilidad— y una reducción de la esperanza de vida. En Kenia, por ejemplo, se estima que una eliminación de las verminosis permitiría aumentar el ingreso de los adultos un 40 %, lo que representa una ratio beneficios/coste del 100 %. Se estima en 118 dólares la pérdida de productividad por cada caso de tracoma. Cada caso de esquistosomiasis causa una pérdida de 45,4 días laborales por año. La mayoría de las enfermedades consideradas provocan pérdidas económicas de los países en vías de desarrollo que se cifran en millones de dólares.
Impacto social[editar]
Numerosas NTD, como la lepra, pueden causar deformidades severas que resultan en la estigmatización de quienes las han sufrido y su separación del resto de la sociedad. Otro ejemplo asombroso es la filariosis linfática, cuyas consecuencias marginan a los pacientes impidiéndoles trabajar. Los estudios en Ghana y Sri Lanka han mostrado que de los grupos de apoyo a las personas afectadas de filariosis pueden mejorar la autoestima de los pacientes, su calidad de vida y sus relaciones sociales, aportándoles apoyo social y consejos prácticos sobre el modo de gestionar su enfermedad.[49]
Los tratamientos vermífugos están correlacionados con a un aumento de la asistencia escolar.
El impacto de las NTD es, en ciertas situaciones, mayor en las mujeres que en los varones. Las NTD afectan particularmente las mujeres, sobre todo la esquistosomiasis, el dengue o las helmintiasis. Por otra parte, son ellas las que sufren más infecciones durante el embarazo, y hay un riesgo de transmisión de la madre al feto, sobre todo en el caso de la enfermedad de Chagas. Un estudio en Uganda halló que las mujeres accedían más fácilmente al tratamiento debido a que lo aceptaban mejor y disponían de más tiempo, pero el desconocimiento de los posibles efectos secundarios del tratamiento en las mujeres encintas limitaba el recurso a curas adaptadas. Así, dicho estudio concluía que el sexo tenía que entrar cuenta en la elaboración de los protocolos de tratamiento adaptado.[50]
Salud pública[editar]
Según Fenwick, será imposible de alcanzar los Objetivos de Desarrollo del Milenio, como la educación, la mortalidad infantil o la salud maternal, mientras la prevalencia de las NTD se mantenga en el nivel actual. Afirma por otra parte que numerosos individuos sufren varias NTD a la vez.
Los tratamientos vermífugos están correlacionados con la recuperación de un peso fisiológico, lo que lleva a considerar que los gusanos son en parte responsables de la malnutrición de su huésped. No obstante, solo se ha demostrado que las campañas masivas de vermifugación mejoran los pronósticos a largo plazo. Todavía faltan pruebas con relación a la mejora del peso o la tasa de hemoglobina. En cambio se ha demostrado que la vermifugación mejora los resultados académicos: un estudio[48] en Kenia halló que el 41 % de niñas de un grupo de control aprobaban el examen de ingreso en la educación secundaria, mientras que del grupo vermifugado aprobaban el 50,6 %. Finalmente, los tratamientos vermífugos por sí solos no permitirán mejorar a largo plazo la salud de las poblaciones implicadas si no se asocian con medidas de mejora de las condiciones sanitarias públicas e individuales.
Hotez milita para la inclusión de las NTD en el seno de la iniciativa para el paludismo, la infección por el VIH y la tuberculosis, habida cuenta de los numerosos vínculos existentes entre estas 3 plagas y las NTD. Anota igualmente la correlación que existe entre tasas elevadas de NTD y tasas elevadas de enfermedades crónicas no transmisibles, como patologías cardíacas degenerativas o cánceres. Atribuye esta correlación a las consecuencias a largo plazo de patologías inflamatorias (como son las NTD) que favorecen el terreno a enfermedades crónicas no transmisibles.[51]
¿Por qué no se tratan estas enfermedades?[editar]
Según Feasey, este grupo de enfermedades es desatendido debido a la población a la que afectan, los pacientes pobres en los países más pobres, pero igualmente a que se presta mayor atención al control de la infección por el VIH, la tuberculosis y el paludismo. Según Fenwick, es lógico que la lucha contra estas 3 grandes plagas haya sido privilegiada financieramente, habida cuenta del gran número de personas afectadas y de la opinión pública sobre ellas. Por otra parte, Fenwick supone que la importancia de las NTD ha sido subestimada, ya que son a menudo asintomáticas durante un periodo de incubación que puede ser de muchos años. A menudo no se establece el vínculo entre un fallecimiento y una NTD de evolución muy lenta, incluso latente. En un artículo del Financial Times se podía leer que la carencia de atractivo comercial de estas patologías y los pacientes a los que afectan limitaban el desarrollo de la investigación y la innovación en este dominio. De esta forma la responsabilidad de la gestión de las NTD queda en manos de los gobiernos de los países que las sufren o de organizaciones filantrópicas.[52]
Prevención[editar]
Fenwick sostiene que la prevención y la erradicación de las NTD son importantes por «la espantosa estigmatización, la desfiguración, la ceguera y las deficiencias causadas». Por su parte, Hotez publica un artículo en 2013, en el cual evoca una potencial eliminación o erradicación de la dracunculiasis, la lepra, la filariosis linfática, la oncocercosis, el tracoma, la enfermedad del sueño, la leishmaniosis visceral, y la rabia en los diez años siguientes.[53] En 2007 se lanzó una revista científica dedicada a las NTD: PLOS Neglected Tropical Diseases. Hay igualmente un grupo internacional dedicado al control de las NTD llamado Global Network for Neglected Tropical Diseases Control.
Mercado e iniciativas farmacéuticas[editar]
Las empresas de biotecnología han tomado como objetivo las NTD debido a la necesidad de mejora del estado de salud global de las poblaciones de los países en desarrollo.[54]
La administración masiva de medicamentos se considera un método posible de erradicación, en particular con relación a la filariosis linfática, la oncocercosis y el tracoma, y esto a pesar del problema potencial representado por el desarrollo de resistencias a los medicamentos.[55] Según Fenwick, la empresa Pfizer habría donado 70 millones de dosis de medicamentos en 2011 con el fin de eliminar el tracoma, en el marco de la Iniciativa Internacional contra el Tracoma. La empresa Merck, donando ivermectina, ha ayudado al Programa Africano contra la Oncocercosis (APOC por sus siglas en inglés) y al Programa para la Eliminación de la Oncocercosis en las Américas (OEPA por sus siglas en inglés). Esta compañía también habría prometido poner a disposición 200 millones de pastillas de praziquantel durante 10 años. El grupo GlaxoSmithKline ha donado 2 miles de millones de pastillas para el tratamiento de la filariosis linfática y prometido 400 millones de pastillas anthelmínticas para el periodo 2010-2015. El grupo Johnson & Johnson habría prometido 200 millones de pastillas anthelmínticas por año. Novartis habría prometido la puesta a disposición de un tratamiento contra la lepra. La empresa EISAI se compromete a poner a disposición 2 miles de millones de pastillas de tratamiento contra la filariosis linfática.
Acciones políticas[editar]
Hay numerosas campañas de prevención y de erradicación en marcha por la Organización Mundial de la Salud, la Agencia de los Estados Unidos para el Desarrollo Internacional, la Fundación Bill y Melinda Gates o incluso el Departamento británico de desarrollo internacional.
La estadounidense Administración de Alimentos y Medicamentos (FDA por sus siglas en inglés) emite bonos «de pareceres de prioridad» que pretenden incitar las compañías a invertir en la investigación de nuevos medicamentos y vacunas para las enfermedades tropicales. Así, la FDA tiene la posibilidad de otorgar estos bonos a cualquier compañía farmacéutica que obtiene una autorización para poner en el mercado un tratamiento contra alguna enfermedad tropical. La compañía puede utilizar más tarde este bono para acelerar el procedimiento de autorización por la FDA de cualquier molécula, incluso sin relación con las NTD. Este programa se aplica a todas las enfermedades tropicales, no solo las NTD, sino también el paludismo y la tuberculosis. El primer bono así otorgado ha sido para el Coartem, un antipalúdico.[56] El término «desatendida» no es utilizado en la definición del programa aunque la mayoría de las enfermedades listadas forman de hecho parte del grupo de las enfermedades tropicales desatendidas según la definición de la OMS.
Organizaciones No Gubernamentales[editar]
Hay actualmente 2 ONG que se concentran exclusivamente en las NTD: Schistosomiasis Control Initiative (SCI) y Deworm the World Initiative (DtWI). A pesar de la patente carencia de dinero para luchar contra ellas, la comparación mediante el análisis de costo-efectividad de las opciones a) tratar y prevenir las NTD y b) no tratarlas ni prevenirlas, arroja un resultado muy favorable a la opción a). El coste del tratamiento de un niño afectado de helmintiasis o esquistosomiasis es, por ejemplo, inferior a 0,50 dólares por año cuando se administra a toda la población escolar por DtWI. Este programa está recomendado por Giving What We Can y el Consenso de Copenhague como una de las soluciones más eficaces y baratas. Los esfuerzos de SCI para luchar contra las NTD incluyen el uso de un kit llamado «de impacto rápido» que contiene 4 o 5 medicamentos y una formación de los enseñantes sobre la manera de administrarlos.[57]
Iniciativas público-privadas[editar]
En 2013, el ejecutivo japonés, 5 compañías farmacéuticas japonesas, la Fundación Bill & Melinda Gates y el Programa de las Naciones Unidas para el Desarrollo (PNUD) han establecido una nueva alianza público-privada llamada Fondo de Tecnología Innovadora para la Salud Mundial (Global Health Innovative Technology Fund, GHIT por sus siglas en inglés). Los miembros han comprometido así cientos de millones de dólares durante 5 años para financiar cooperaciones de investigación y desarrollo en Japón y otros lugares con el fin de trabajar sobre nuevos medicamentos y vacunas de 17 NTD además del VIH, la malaria y la tuberculosis. El bajo coste de las vacunas y medicamentos así desarrollados es uno de los criterios decisivos para obtener financiación.
WIPO Re:Search[58] es un programa fundado en 2011 por la Organización Mundial de la Propiedad Intelectual (OMPI) en colaboración con BIO Ventures for Global Health (BVGH) y la participación de grandes compañías farmacéuticas y otras organizaciones de investigación privada o pública. Este programa permite a los organismos compartir —sin pagar regalías (copyright)— su propiedad intelectual, sus compuestos, su valoración, sus infraestructuras y su experiencia con destacados investigadores internacionales en el campo de las NTD, la malaria y la tuberculosis.[59][60][61]
Véase también[editar]
Referencias[editar]
- ↑ Hotez, Peter; Kamath, Aruna (25 de agosto de 2009). «Neglected tropical diseases in sub-saharan Africa: review of their prevalence, distribution, and disease burden». PLoS Negl Trop Dis. 3(8). PMID 19707588. Consultado el 2 de noviembre de 2017.
- ↑ Making the Case to Fight Schistosomiasis. 12 de marzo de 2007.
- ↑ «Beat neglected diseases to fight HIV, TB and malaria». 31 de enero de 2006. Archivado desde el original el 19 de mayo de 2006. Consultado el 2 de noviembre de 2017.
- ↑ Madhuri, Reddy; Sudeep, S. Gill; Sunila, R. Kalkar (2007). «Oral Drug Therapy for Multiple Neglected Tropical Diseases». JAMA. 298(16): :1911-1924. Consultado el 2 de noviembre de 2017.
- ↑ http://www.dndi.org/
- ↑ http://www.who.int/neglected_diseases/about/en/
- ↑ Lancet 385: 117-71. 17 de diciembre de 2014. PMID 25530442. doi:10.1016/S0140-6736(14)61682-2.
- ↑ Feasey, Nick; Wansbrough-Jones, Mark; Mabey, David C. W.; Solomon, Anthony W. (10 de diciembre de 2009). «Neglected tropical diseases». British Medical Bulletin 93 (1): 179-200. Consultado el 2 de noviembre de 2017.
- ↑ Fenwick, A. (Marzo de 2012). «The global burden of neglected tropical diseases». Public Health 123 (3): 233-236. Consultado el 2 de noviembre de 2017.
- ↑ Reddy y Gill, 2007, Table 1. Key Features of 13 Neglected Tropical Diseases Listed by Prevalence
- ↑ name="WorldHealthDay2014"
- ↑ «Human African trypanosomiasis: number of new cases drops to historically low level in 50 years». 1 de junio de 2010.
- ↑ «¿Qué es el análisis serológico ?». Página de CELY CITY. CELY CITY. 25 de abril de 2017. Consultado el 7 de noviembre de 2017.
- ↑ a b c d «La OMS informa de los avances sin precedentes en la lucha contra las enfermedades tropicales desatendidas». Sitio oficial de la OMS. OMS. 17 de abril de 2017. Consultado el 7 de noviembre de 2017.
- ↑ «La enfermedad de Chagas (tripanosomiasis americana)». www.who.int. Consultado el 24 de agosto de 2022.
- ↑ «Neglected tropical diseases».
- ↑ «La enfermedad de Chagas (tripanosomiasis americana». marzo de 2017).
- ↑ Kapusi, Pablo. «Inicio». Asociación Civil Hablemos de Chagas. Consultado el 25 de agosto de 2022.
- ↑ «Leishmaniasis - Epidemiological situation».
- ↑ «Diagnosis, detection and surveillance».
- ↑ «Access to essential antileishmanial medicines and treatment».
- ↑ «BCG Immunization coverage estimates by country».
- ↑ «Leprosy: the disease». Consultado el 16 de marzo de 2014.
- ↑ «Leprosy: key facts».
- ↑ «Buruli ulcer endemic countries».
- ↑ «What is Buruli ulcer?».
- ↑ «Prevention of Blindness and Visual Impairment».
- ↑ Goldschmidt, Pablo; Einterz, Ellen (Marzo de 2014). «The Limits of Medical Interventions for the Elimination of Preventable Blindness». Tropical Medicine and Health 42 (1): 43-52. Consultado el 7 de noviembre de 2017.
- ↑ «Yaws eradication».
- ↑ «What is taeniasis and cysticercosis? Symptoms».
- ↑ «About Taeniasis/cysticercosis».
- ↑ «Echinococcosis».
- ↑ «What is echinococcosis ?».]
- ↑ «Signs, symptoms and treatment of echinococcosis». Archivado desde el original el 24 de mayo de 2015. Consultado el 16 mars 2014.
- ↑ «Surveillance, prevention and control of echinococcosis». Consultado el 16 de marzo de 2014.
- ↑ «Dracunculiasis eradication».
- ↑ «Weekly epidemiological record» (PDF). Wkly. Epidemiol. Rec. 85: 166-76. mayo de 2010. PMID 20449943.
- ↑ «Lymphatic filariasis - Epidemiology».
- ↑ Utzinger, Juerg (ed.). «The Relationship between Water, Sanitation and Schistosomiasis: A Systematic Review and Meta-analysis». PLoS Negl Trop Dis 2: e171. PMID 18235853. doi:10.1371/journal.pntd.0000171.
- ↑ a b «Oncocercosis». Notas de prensa de la OMS. OMS. Septiembre de 2017. Consultado el 2 de noviembre de 2017.
- ↑ «Parasites-Schistosomiasis».
- ↑ «Soil-transmitted helminth infections». septiembre de 2017.
- ↑ «Dengue control-The human».
- ↑ «Rabies-What is rabies?».
- ↑ a b «Rabies-Key facts». septiembre de 2017.
- ↑ a b «Neglected tropical diseases». WHO.
- ↑ a b Conteh, Lesong; Engels, Thomas; Molyneux, David H. (16 de enero de 2010). «Socioeconomic aspects of neglected tropical diseases». The Lancet 375 (9710): 239-247. Consultado el 3 de noviembre de 2017.
- ↑ a b «School-based deworming» (en inglés). J-PAL. Consultado el 3 de noviembre de 2017.
- ↑ «Stigma and the Social Burden of Neglected Tropical Diseases». PLoS Negl Trop Dis 2: e237. PMC 2359851. PMID 18478049. doi:10.1371/journal.pntd.0000237.
- ↑ «Exploring Gender Dimensions of Treatment Programmes for Neglected Tropical Diseases in Uganda». PLoS Negl Trop Dis 7: e2312. PMC 3708858. PMID 23875047. doi:10.1371/journal.pntd.0002312.
- ↑ The Cochrane database of systematic reviews 11: CD000371. 14 novembre 2012. PMID 23152203. doi:10.1002/14651858.CD000371.pub5.
- ↑ http://www.ft.com/intl/cms/s/0/07bfe8f2-5e05-11e4-bc04-00144feabdc0.html#axzz3MMnaQdHZ
- ↑ Hotez, Peter J. (21 de noviembre de 2013). «NTDs V.2.0: “Blue Marble Health”—Neglected Tropical Disease Control and Elimination in a Shifting Health Policy Landscape». PLOS Neglected Tropical Diseases. Consultado el 3 de noviembre de 2017.
- ↑ Frew SE, Liu VY, Singer PA. «A Business Plan To Help The ‘Global South’ In: Its Fight Against Neglected Diseases». Health Aff (Millwood) 28: 1760-73. PMID 19887417. doi:10.1377/hlthaff.28.6.1760.
- ↑ Keenan JD, Hotez PJ, Amza A, et al. «Elimination and Eradication of Neglected Tropical Diseases with Mass Drug Administrations: A Survey of Experts». PLoS Negl Trop Dis 7: e2562. PMC 3855072. PMID 24340111. doi:10.1371/journal.pntd.0002562.
- ↑ ["http://archive.wikiwix.com/cache/?url=http%3A%2%2Fwww.fda.gov%2FNewsEvents%2FNewsroom%2FPressAnnouncements%2Fucm149559.htm" «FDA Approves Coartem Tablets to Treat Malaria»]. 8 de abril de 2009.
- ↑ «Giving What We Can; recommended interventions».
- ↑ «WIPO Re:Search».
- ↑ "Japan in pioneering partnership to fund global health research", by Andrew Jack, Financial Times, May 30, 2013
- ↑ "An Audience with… Tachi Yamada", by Asher Mullard, Nature magazine, September 2013, Volume 12, p. 658
- ↑ "Joining the Fight Against Neglected Diseases", Science magazine, June 7, 2013, Volume 340, p. 1148
Enlaces externos[editar]
- Esta obra contiene una traducción derivada de «Maladies tropicales négligées» de Wikipedia en francés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
- Programa de la agencia norteamericana de ayuda al desarrollo (USAID) contra las NTD Archivado el 4 de abril de 2016 en Wayback Machine. (en inglés)
- Programa de la Organización Mundial de la Salud (OMS) contra las NTD (en inglés)
