Trypanosoma cruzi
| Trypanosoma cruzi | ||
|---|---|---|
 | ||
| Taxonomía | ||
| Reino: | Protista | |
| (sin rango) | Excavata | |
| Filo: | Euglenozoa | |
| Clase: | Kinetoplastea | |
| Orden: | Trypanosomatida | |
| Familia: | Trypanosomatidae | |
| Género: | Petra Trypanosoma | |
| Especie: |
T. cruzi Chagas, 1909 | |
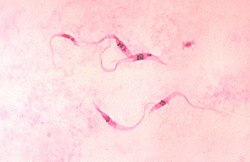
Trypanosoma cruzi es un protista de la clase Kinetoplastea, familia Trypanosomatidae, caracterizado por la presencia de un solo flagelo y una sola mitocondria, cuyo genoma se encuentra ordenado en una compleja y compacta región dentro de la propia mitocondria, y cerca de la base del flagelo denominada cinetoplasto. Es un parásito intracelular con un ciclo de vida que involucra vertebrados e invertebrados. Es el agente etiológico de la enfermedad de Chagas.
La enfermedad de Chagas es una de las más importantes enfermedades por vector. En México se conocen 31 especies de vectores triatominos, 18 de ellos son naturalmente infectados con Trypanosoma cruzi, el agente de la enfermedad de Chagas[1][2]. La mayoría de las especies son encontradas en viviendas y áreas peridomésticas humanos principalmente selváticas. (Zarate and Zárate, 1985; Velasco-Castrejón and Guzman-Bracho, 1986), por esto será necesario desarrollar estrategias de control apropiadas a las condiciones entomológicas locales.[3]
Morfología[editar]
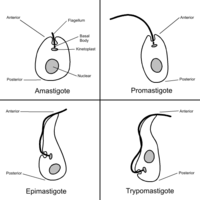
Presenta cuatro formas distintas de involución: amastigota, promastigota, epimastigota y tripomastigota.
- Amastigota: esférico u ovalado, es la forma reproductiva en el interior de las células mamíferas (principalmente en células musculares y nerviosas).
- Epimastigota: alargado y con el cinetoplasto localizado anteriormente al núcleo, es la forma reproductiva en el tracto digestivo de los invertebrados y en medio de cultivos.
- Tripomastigota: también alargado, pero con el cinetoplasto localizado posteriormente al núcleo. Se encuentra en la sangre de los mamíferos y es la forma infectante de ellos. Esta forma no se divide.[4]
Principales vectores[editar]
Subfamilia Triatominae:
- Triatoma infestans
- Rhodnius prolixus
- Triatoma dimidiata
- Triatoma brasiliensis
- Panstrongylus megistus
- Triatominos selváticos[5]
Ciclo biológico[editar]
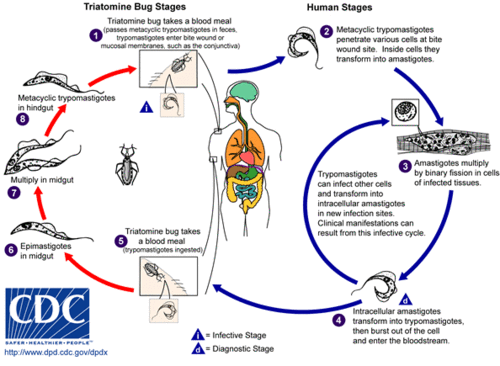
- Etapas en el ser humano. El ciclo se inicia cuando un insecto hematófago infectado pica a un ser humano y defeca. Los tripomastigotas metacíclicos se transmiten en las heces ('1 en la figura). Entran en el hospedador a través de la herida o por el cruce de las membranas mucosas. Cuando entran en una célula humana, se convierten en amastigotas (2). Esta es una etapa reproductiva a través de la fisión binaria. Después de la reproducción, una gran cantidad de amastigotas se encuentran en la célula infectada, formándose pseudoquistes (3). El amastigota se convierte de nuevo en tripomastigota y la célula se rompe. El tripomastigota vuelve a infectar otra célula repitiéndose el ciclo de multiplicación (4).
- Etapas en el insecto. Cuando el insecto pica a un hospedador infectado, algunos tripomastigotas pasan a él a través de la sangre (5). En el intestino del insecto, se transforman en epimastigotas (6), los cuales constituyen una segunda etapa reproductiva (7). Después de la reproducción a través de mitosis, los epimastigotas pasan al recto. Allí se convierten en tripomastigotas metacíclicos (8) y se evacúan a través de las heces. Las heces pueden infectar a un nuevo hospedador (1), repitiéndose el ciclo.
Existe una subespecie en Sudamérica la cual infecta murciélagos, es identificada como Trypanosoma cruzi marinkellei[6]
Genética[editar]
T. cruzi se divide en dos grandes grupos: T. cruzi I y T. cruzi II. Este último a su vez se divide en cinco grupos menores: T. cruzi IIa, IIb, IIc, IId y IIe. T. cruzi II está mucho más asociado a los casos crónicos de la enfermedad de chagas, al menos en el cono sur de Sudamérica.[7]
Patogenicidad[editar]
Produce la llamada enfermedad de Chagas en América. La diseminación del T. cruzi se da por el contacto con las heces de insectos del tipo hemípteros, del género Triatoma, entrando los parásitos por la herida causada por su picadura; llegan al torrente sanguíneo (forma tripomastigota metacíclico) viajando hacia los diferentes órganos y tejidos, replicándose principalmente en tejidos musculares y nervioso (forma amastigota). Pueden producir cardiopatía chagásica daños irreparables en los plexos mientéricos del tracto gastrointestinal, haciendo que la persona presente megaesófago, megacolon y que eventualmente muera, además de todo esto la persona puede no presentar síntomas lo que beneficia al parásito ya que a través del tiempo sea más patógeno.
Daño directo[editar]
Se presupone que el daño principal ocasionado en la enfermedad de Chagas se debe a la lesión directa que produce el parásito al invadir a las células del ser vivo, y también al consiguiente proceso inflamatorio localizado. El proceso de invasión celular, replicación y muerte de las células, con la consecuente liberación de los parásitos y reinfección de otras células, provoca daños irreversibles en los órganos afectados, sobre todo en corazón y órganos del sistema digestivo (esófago y colon en particular). Con el paso de los años, la extensión de las zonas afectadas, además del compromiso de células del sistema nervioso periférico que inervan estos órganos, produce las alteraciones que se observan en la fase crónica de la enfermedad.[8]
Teoría autoinmunitaria[editar]
Algunas proteínas del parásito poseen epítopos compartidos con proteínas del huésped. Se han descrito anticuerpos circulantes en pacientes con enfermedad de Chagas crónica que reaccionan contra proteínas de tejido conjuntivo, endocardio, laminina y proteínas de músculo estriado, entre otras. Se ha sugerido que estos autoanticuerpos son los causantes del proceso crónico de la afección en virtud del reconocimiento de partículas proteicas propias o extrañas, y activación de un proceso inmunológico humoral y celular en contra de los órganos del huésped. Cuando muere el parásito también es posible que sus componentes se depositen en la superficie de las células del huésped, siendo las más afectadas las del sistema nervioso. De esta manera, los componentes de la respuesta inmune reaccionan contra estos antígenos y, por consiguiente, contra el huésped.[8]
Teoría neurógena[editar]
Esta teoría asume que el daño del parásito se observa principalmente en las células del sistema parasimpático que inerva los órganos afectados. El daño tiene como consecuencia una estimulación simpática excesiva, que a través de los años causa una lesión irreversible por sobrecarga de trabajo. En esta teoría se considera el daño directo como un factor relevante de la fisiopatológica de la enfermedad, pero reduce la importancia del proceso sólo a las células del sistema nervioso periférico.
Control de la parasitosis[editar]
Una vez que el parásito logra infestar al huésped, mediante el empleo de posaconazol, el cual inhibe la síntesis de ergosterol y en consecuencia limita la sobrevida de este parásito, se puede controlar la parasitosis, más aún al combinarlo con amiodarona.
En otros países se siguen utilizando los medicamentos benzinidazol y nifurtimox.[8]
Véase también[editar]
Referencias[editar]
- ↑ Lent, H.; Wygodzinsky, P. (1979). «Revision of the Triatominae (Hemiptera, Reduviidae) andtheir significance as vectors of Chagas disease.». Bull. Am. Mus. Nat. Hist. (163): 125-520.
- ↑ CARCAVALLO, R. U.; GALINDEZ-GIRON I.; JURBERG, J.; GALVAO C. & LENT, H., 1997. Pictorial keys for tribes, genera & species of the subfamily triatominae. In: Atlas of Chagas' Disease Vectors in the Americas (R. U. Carcavallo, I. Galindez-Giron, J. Jurberg & H. Lent, ed.), v. 1, pp. 107-244, Rio de Janeiro: Editora Fiocruz.
- ↑ Magallón Gastélum, Ezequiel (Marzo, 2006). «Epidemiological risk for Trypanosoma cruzi transmission by species of Phyllosoma complex in the occidental part of Mexico». ACTA TROPICA.
- ↑ «Trypanosoma cruzi». Archivado desde el original el 8 de febrero de 2016. Consultado el 2 de julio de 2012.
- ↑ Magallón Gastélum, Ezequiel (Mayo, 2004). «Colonization of Rock Pile Boundary Walls in Fields by SylvaticTriatomines (Hemiptera: Reduviidae) in Jalisco State, Mexico». Entomological Society of America.
- ↑ Franzén, O., Talavera-López, C., Ochaya, S., Butler, C.E., Messenger, L.A., Lewis, M.D., Llewellyn, M.S., Marinkelle, C.J., Tyler, K.M., Miles, M.A., Andersson, B., 2012. Comparative genomic analysis of human infective Trypanosoma cruzi lineages with the bat-restricted subspecies T. cruzi marinkellei. BMC Genomics, 13:531.
- ↑ Souto, R.P., Fernandes, O., Macedo, A.M., Campbell, D.A., Zingales, B., (1996) DNA markers define two major phylogenetic lineages of Trypanosoma cruzi. Mol. Biochem. Parasitol. 83, 141–152.
- ↑ a b c Becerril Flores, Marco Antonio (2014). «10». En Bernal Pérez, Manuel, ed. Parasitología Médica. McGraw-Hill. p. 99-103. ISBN 978-607-15-1150-8.
Bibliografía[editar]
- Zingales, B., Souto, R.P., Mangia, R.H., Lisboa, C.V., Campbell, D.A., Coura, J.R., Jansen, A., Fernandes, O., 1998. Molecular epidemiology of American trypanosomiasis in Brazil based on dimorphisms of rRNA and mini-exon gene sequences. Int. J. Parasitol. 28, 105–112.
- Momen, H., 1999. Taxonomy of Trypanosoma cruzi: a commentary on characterization and nomenclature.Mem. Inst. Oswaldo Cruz 94, 181–184.
- Di Noia, J.M., Buscaglia, C.A., De Marchi, C.R., Almeida, I.C., Frasch, A.C., 2002. A Trypanosoma cruzi small surface molecule provides the first immunological evidence that Chagas’ disease is due to a single parasite lineage. J. Exp. Med. 185, 401–413.
- Burgos, J.M., Begher, S., Freitas, J.M., Bisio, M., Duffy, T., Altcheh, J.,Teijeid. Lineages in cerebral Chagas disease in a patient with AIDS. Am. J. Trop. Med. Hyg. 73, 1016–1018.
- Freitas, J.M., Augusto-Pinto, L., Pimenta, J.R., Bastos-Rodrigues, L., Goncalves, V.F., Teixeira, S.M., Chiari, E., Junqueira, A.C., Fernandes, O., Macedo, A.M., Machado, C.R., Pena, S.D., 2006. Ancestral genomes, Sex and the Population Structure of Trypanosoma cruzi. PLoS Pathogens 2, 226–235.
- Franzén, O., Talavera-López, C., Ochaya, S., Butler, C.E., Messenger, L.A., Lewis, M.D., Llewellyn, M.S., Marinkelle, C.J., Tyler, K.M., Miles, M.A., Andersson, B., 2012. Comparative genomic analysis of human infective Trypanosoma cruzi lineages with the bat-restricted subspecies T. cruzi marinkellei. BMC Genomics, 13:531.
Enlaces externos[editar]
 Wikimedia Commons alberga una categoría multimedia sobre Trypanosoma cruzi.
Wikimedia Commons alberga una categoría multimedia sobre Trypanosoma cruzi.- Instituto Regional de Investigación en Salud Pública, Guad. Jal. Méx.
