Gas de efecto invernadero

Un gas de efecto invernadero (GEI) es un gas que absorbe y emite radiación dentro del rango infrarrojo. Este proceso es la fundamental causa del efecto invernadero.[1] Los principales GEI en la atmósfera terrestre son el vapor de agua (H2O), el dióxido de carbono (CO2), el metano (CH4), el óxido nitroso (N2O) y el ozono (O3).[2] Sin los gases de efecto invernadero la temperatura promedio de la superficie terrestre sería de −18 °C,[3] en lugar de la media actual de 15 °C.[4][5][6] En el sistema solar, las atmósferas de Venus, Marte y Titán también albergan gases que causan un efecto invernadero.
Desde el inicio de la Revolución Industrial (considerado en 1750) la actividad humana ha producido un incremento del 45 % en la concentración atmosférica del dióxido de carbono, de fórmula CO2, desde 280 ppm en 1750 a 400 ppm en 2015.[7][8] Este incremento ha ocurrido a pesar de la absorción de una gran porción de las emisiones por varios depósitos naturales que participan del ciclo del carbono.[9][10][11] Las emisiones de CO2 antropogénicas (producidas por actividades humanas) provienen de la combustión de combustibles fósiles, principalmente carbón, petróleo y gas natural, además de la deforestación, la erosión del suelo y la crianza animal.[12] El mayor emisor de CO2 es China.[13][14]
Se ha estimado que si las emisiones de GEI continúan al ritmo actual, la temperatura de la superficie terrestre podría exceder los valores históricos hacia 2047, con efectos potencialmente dañinos en los ecosistemas, la biodiversidad y peligraría la subsistencia de las personas en el planeta.[15] Estimaciones de agosto de 2016 sugieren que de seguir la actual trayectoria de emisiones la Tierra podría superar el límite de 2 °C de calentamiento global, (el límite señalado por el IPCC como un calentamiento global "peligroso") en 2036.[16]
Gases en la atmósfera terrestre
[editar]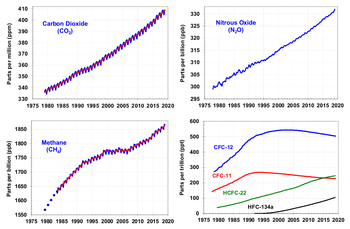
Gases invernadero
[editar]
- El vapor de agua (H2O) es un gas que se obtiene por evaporación o ebullición del agua líquida o por sublimación del hielo. Es el que más contribuye al efecto invernadero debido a la absorción de los rayos infrarrojos. Es inodoro e incoloro y, a pesar de lo que pueda parecer, las nubes o el vaho blanco de una cacerola o un congelador, vulgarmente llamado "vapor", no son vapor de agua, sino el resultado de minúsculas gotas de agua líquida o cristales de hielo.
- Dióxido de carbono (CO2) óxido de carbono (IV), también denominado dióxido de carbono, gas carbónico y anhídrido carbónico, es un gas cuyas moléculas están compuestas por dos átomos de oxígeno y uno de carbono. Su fórmula química es CO2.
- Metano (CH4) El metano (del griego methy, vino, y el sufijo -ano) es el hidrocarburo alcano más sencillo, cuya fórmula química es CH4.
- Cada uno de los átomos de hidrógeno está unido al carbono por medio de un enlace covalente. Es una sustancia no polar que se presenta en forma de gas a temperaturas y presiones ordinarias. Es incoloro e inodoro y apenas soluble en agua en su fase líquida.
- En la naturaleza se produce como producto final de la putrefacción anaeróbica de las plantas. Este proceso natural se puede aprovechar para producir biogás. Muchos microorganismos anaeróbicos lo generan utilizando el CO2 como aceptor final de electrones.
- Constituye hasta el 97 % del gas natural. En las minas de carbón se le llama grisú y es muy peligroso, ya que es fácilmente inflamable y explosivo.
- El metano es un gas de efecto invernadero relativamente potente que podría contribuir al calentamiento global del planeta Tierra, ya que tiene un potencial de calentamiento global de 23; pero que su concentración es bajísima. Esto significa que en una media de tiempo de 100 años cada kg de CH4 calienta la Tierra 25 veces más que la misma masa de CO2, sin embargo, hay aproximadamente 220 veces más dióxido de carbono en la atmósfera de la Tierra que metano por lo que el metano contribuye de manera menos importante al efecto invernadero.
- Óxidos de nitrógeno (NOx). El término óxidos de nitrógeno (NxOy) se aplica a varios compuestos químicos binarios gaseosos formados por la combinación de oxígeno y nitrógeno. El proceso de formación más habitual de estos compuestos inorgánicos es la combustión a altas temperaturas, proceso en el cual habitualmente el aire es el comburente.
- Ozono (O3). El ozono (O3), es una sustancia cuya molécula está compuesta por tres átomos de oxígeno, formada al disociarse los 2 átomos que componen el gas de oxígeno. Cada átomo de oxígeno liberado se une a otra molécula de oxígeno (O2), formando moléculas de ozono (O3).
- Clorofluorocarburos (CFC). Los clorofluorocarburos son cada uno de los derivados de los hidrocarburos saturados obtenidos mediante la sustitución de átomos de hidrógeno por átomos de flúor y/o cloro principalmente.
- Debido a su alta estabilidad fisicoquímica y su nula toxicidad, han sido muy usados como gases refrigerantes, agentes extintores y propelentes para aerosoles. Fueron introducidos a principios de la década de los años 1930 por ingenieros de General Motors, para sustituir materiales peligrosos como el dióxido de azufre y el amoníaco.
Gases sin efecto invernadero
[editar]Los principales constituyentes atmosféricos, nitrógeno (N2), oxígeno (O2) y argón (Ar), no son gases de efecto invernadero porque las moléculas que contienen dos átomos del mismo elemento, como N2 y O2, no tienen un cambio neto en la distribución de sus cargas eléctricas cuando vibran, y los gases monoatómicos como Ar no tienen modos vibratorios. Por lo tanto, no se ven afectados casi en su totalidad por la radiación infrarroja. Algunas moléculas heterodiatómicas que contienen átomos de diferentes elementos como el monóxido de carbono (CO) o el cloruro de hidrógeno (HCl) absorben la radiación infrarroja, aunque estas moléculas tienen una vida corta en la atmósfera debido a su reactividad y solubilidad. Por lo tanto, no contribuyen significativamente al efecto invernadero y a menudo se omiten cuando se habla de los gases de efecto invernadero.
Efecto invernadero
[editar]La atmósfera, por el hecho de ser muy transparente para la luz visible, pero mucho menos para la radiación infrarroja, produce para la superficie terrestre el mismo efecto que el techo de cristal produce en un invernadero; la luz solar, que llega sin grandes obstáculos hasta el suelo, lo calienta, dando lugar a que emita rayos infrarrojos (ondas caloríficas), los cuales, a diferencia de los rayos de luz, son absorbidos en gran parte por el vidrio o la atmósfera. Al final la cantidad de energía emitida al espacio tiene que ser la misma que la absorbida, pero la superficie terrestre tiene que alcanzar la temperatura en que ambos flujos se equilibran, la cual es más alta en presencia de una atmósfera (en un planeta) o de techos de cristal (en un invernadero; aunque en realidad el cristal de un invernadero protege de la pérdida de calor más porque interrumpe la circulación del aire, que porque sea opaco a los rayos infrarrojos).
Es importante señalar que el efecto invernadero afecta a todos los cuerpos planetarios del sistema solar dotados de atmósfera, porque aunque no todos los gases absorben radiación infrarroja, en ninguna de esas atmósferas faltan los que sí lo hacen. En la Tierra el efecto invernadero es responsable de un exceso de 33 °C de la temperatura superficial (15 °C de valor medio) sobre la temperatura de emisión (−18 °C), pero en Marte la diferencia es de tan solo 3 °C y en Venus la diferencia alcanza los 466 °C.
El efecto invernadero es un fenómeno natural, pero la alusión frecuente a él en relación con el calentamiento global hace creer a algunos que es en sí indeseable, y una consecuencia reciente de la contaminación atmosférica. Hay que aclarar que el calentamiento no es atribuido a la simple existencia, sino al aumento del efecto invernadero por encima de sus valores naturales por acción del hombre.
Mecanismo
[editar]No todos los componentes de la atmósfera contribuyen al efecto invernadero. Los gases de invernadero absorben los fotones infrarrojos emitidos por el suelo calentado por el sol. La energía de esos fotones no basta para causar reacciones químicas —para romper enlaces covalentes—, sino que simplemente aumenta la energía de rotación y de vibración de las moléculas implicadas. El exceso de energía es a continuación transferido a otras moléculas, por las colisiones moleculares, en forma de energía cinética, es decir, de calor; aumentando la temperatura del aire. De la misma forma, la atmósfera se enfría emitiendo energía infrarroja cuando se producen las correspondientes transiciones de estado vibracional y rotacional en las moléculas hacia niveles menores de energía. Todas esas transiciones requieren cambios en el momento dipolar de las moléculas (es decir, modificaciones de la separación de cargas eléctricas en sus enlaces polares) lo que deja fuera de este papel a los dos gases principales en la composición del aire, nitrógeno (N2) y oxígeno (O2), cuyas moléculas, por estar formadas por dos átomos iguales, carecen de cualquier momento dipolar.
Contaminación
[editar]Si bien todos ellos —salvo los compuestos del flúor— son naturales, en tanto que existen en la atmósfera desde antes de la aparición de los seres humanos, a partir de la Revolución industrial de mediados del siglo XIX, y debido principalmente al uso intensivo de combustibles fósiles en las actividades industriales, la ganadería y el transporte, se han producido sensibles incrementos en las cantidades de óxidos de nitrógeno y dióxido de carbono emitidas a la atmósfera. Se estima que también el metano y el óxido nitroso están aumentando su presencia por razones antropogénicas (debidas a la actividad humana, en mayor parte la ganadería y la agricultura ganadera). Además, a este incremento de emisiones se suman otros problemas, como la deforestación, que han reducido la cantidad de dióxido de carbono retenida en materia orgánica, contribuyendo así indirectamente al aumento antropogénico del efecto invernadero. Asimismo, el excesivo dióxido de carbono está acidificando los océanos y reduciendo el fitoplancton.
Impactos sobre el efecto invernadero en general
[editar]Componente
[editar]
La contribución de cada gas al efecto invernadero está determinada por las características de ese gas, su abundancia y los efectos indirectos que pueda causar. Por ejemplo, el efecto radiativo directo de una masa de metano es aproximadamente 84 veces más fuerte que la misma masa de dióxido de carbono en un período de 20 años, pero está presente en concentraciones mucho más pequeñas, de modo que su efecto radiativo directo total es menor, en parte debido a su menor vida atmosférica.[17] Por otro lado, además de su impacto radiativo directo, el metano tiene un gran efecto radiativo indirecto porque contribuye a la formación de ozono. Shindell et al. (2005)[18] sostienen que la contribución del metano al cambio climático es al menos el doble de las estimaciones anteriores como resultado de este efecto.[19] Cuando se clasifican por su contribución directa al efecto invernadero, las más importantes son:[20]
| Compuesto | Fórmula | Concentración en la atmósfera (ppm) | Contribución
(%) |
|---|---|---|---|
| Vapor de agua y nubes | H 2O |
10–50 000(A) | 36–72 |
| Dióxido de carbono | CO2 | ~400 | 9–26 |
| Metano | CH 4 |
~1.8 | 4–9 |
| Ozono | O 3 |
2–8(B) | 3–7 |
| (A) El vapor de agua varía mucho localmente
(B) La concentración en la estratosfera. Alrededor del 90 % del ozono de la atmósfera terrestre está contenido en la estratosfera. | |||
Además de los principales gases de efecto invernadero enumerados anteriormente, otros gases de efecto invernadero incluyen el hexafluoruro de azufre, los hidrofluorocarburos y los perfluorocarbonos (véase la lista de gases de efecto invernadero del IPCC). Algunos gases de efecto invernadero no suelen figurar en la lista. Por ejemplo, el trifluoruro de nitrógeno tiene un alto potencial de calentamiento global (GWP), pero solo está presente en cantidades muy pequeñas.[21]
Proporción de efectos directos en un momento dado
[editar]No es posible afirmar que un determinado gas cause un porcentaje exacto del efecto invernadero. Esto se debe a que algunos de los gases absorben y emiten radiación a las mismas frecuencias que otros, de modo que el efecto invernadero total no es simplemente la suma de la influencia de cada gas. Los extremos más altos de los rangos citados son sólo para cada gas; los extremos más bajos representan solapamientos con los otros gases.[20][22] Además, se sabe que algunos gases, como el metano, tienen grandes efectos indirectos que todavía se están cuantificando.[23]
Forzamiento radiativo
[editar]La Tierra absorbe parte de la energía radiante recibida del sol, refleja parte de ella en forma de luz y refleja o irradia el resto al espacio en forma de calor. La temperatura de la superficie de la Tierra depende de este equilibrio entre la energía entrante y saliente. Si se cambia este equilibrio energético, la superficie de la Tierra se vuelve más cálida o más fría, lo que conduce a una variedad de cambios en el clima global.[24]
Una serie de mecanismos naturales y artificiales pueden afectar el equilibrio energético mundial y forzar cambios en el clima de la Tierra. Los gases de efecto invernadero son uno de esos mecanismos. Los gases de efecto invernadero absorben y emiten parte de la energía saliente que irradia la superficie de la Tierra, lo que hace que ese calor se retenga en la atmósfera inferior. Como se ha explicado anteriormente, algunos gases de efecto invernadero permanecen en la atmósfera durante décadas o incluso siglos y, por lo tanto, pueden afectar al equilibrio energético de la Tierra durante un largo período. El forzamiento radiativo cuantifica el efecto de los factores que influyen en el balance energético de la Tierra, incluyendo los cambios en las concentraciones de gases de efecto invernadero. El forzamiento radiativo positivo conduce al calentamiento al aumentar la energía neta entrante, mientras que el forzamiento radiativo negativo conduce al enfriamiento.[24]
Potencial de calentamiento global
[editar]El potencial de calentamiento global (GWP) depende tanto de la eficiencia de la molécula como del gas de efecto invernadero como de su vida atmosférica. El GWP se mide en relación con la misma masa de CO2 y se evalúa en una escala de tiempo específica. Por lo tanto, si un gas tiene una fuerza radiativa alta (positiva) pero también una vida corta, tendrá un GWP grande en una escala de 20 años, pero uno pequeño en una escala de 100 años. Por el contrario, si una molécula tiene una vida atmosférica más larga que el CO2, su GWP aumentará cuando se considere la escala de tiempo. El dióxido de carbono se define como un GWP de 1 en todos los períodos de tiempo.
El metano tiene una vida útil de 12 ± 3 años. El informe de 2007 del IPCC enumera el GWP como 72 en una escala de tiempo de 20 años, 25 en 100 años y 7,6 en 500 años. Un análisis de 2014, sin embargo, establece que aunque el impacto inicial del metano es aproximadamente 100 veces mayor que el del CO2, debido a la menor vida atmosférica, después de seis o siete décadas, el impacto de los dos gases es casi igual, y a partir de entonces el papel relativo del metano continúa disminuyendo.[25] La disminución del GWP en tiempos más largos se debe a que el metano se degrada a agua y CO2 a través de reacciones químicas en la atmósfera.
En la siguiente tabla se dan ejemplos de la vida atmosférica y del GWP en relación con el CO2 de varios gases de efecto invernadero:
| Nombre del gas | Fórmula química | Años de vida | Potencial de calentamiento global (PCA) para un tiempo determinado | ||
|---|---|---|---|---|---|
| 20 años | 100 años | 500 años | |||
| Dióxido de carbono | CO2 | 30–95 | 1 | 1 | 1 |
| Metano | CH4 | 12 | 84 | 28 | 7.6 |
| Óxido nitroso | N2O | 121 | 264 | 265 | 153 |
| Diclorodifluorometano | CCl2F2 | 100 | 10 800 | 10 200 | 5200 |
| Clorodifluorometano | CHClF2 | 12 | 5280 | 1760 | 549 |
| Tetrafluorometano | CF4 | 50 000 | 4880 | 6630 | 11 200 |
| Hexafluoretano | C2F6 | 10 000 | 8210 | 11 100 | 18 200 |
| Hexafluoruro de azufre | SF6 | 3200 | 17 500 | 23 500 | 32 600 |
| Trifluoruro de nitrógeno | NF3 | 500 | 12 800 | 16 100 | 20 700 |
Emisiones directas de gases de efecto invernadero
[editar]Entre 1970 y 2004, las emisiones de gases de efecto invernadero (medidas en equivalente de CO2) aumentaron a un ritmo medio del 1,6 % anual, mientras que las emisiones de CO2 procedentes del uso de combustibles fósiles aumentaron a un ritmo del 1,9 % anual.[26][27] Las emisiones antropogénicas totales a finales de 2009 se estimaron en 49,5 gigatoneladas equivalentes de CO2.[28]Estas emisiones incluyen el CO2 procedente del uso de combustibles fósiles y del uso de la tierra, así como las emisiones de metano, óxido nitroso y otros gases de efecto invernadero cubiertos por el Protocolo de Kioto.
En la actualidad, la principal fuente de emisiones de CO2 es la quema de carbón, gas natural y petróleo para producir electricidad y calor son las mayor fuente de emisiones de gases de efecto invernadero a nivel mundial.[29]
Otra medida es la de las emisiones per cápita. Esto divide las emisiones anuales totales de un país entre su población de mediados de año. Las emisiones per cápita pueden basarse en emisiones históricas o anuales (Banuri et al., 1996, pp. 106-07).
Aunque a veces se considera que las ciudades contribuyen de manera desproporcionada a las emisiones, las emisiones per cápita tienden a ser más bajas para las ciudades que los promedios de sus países.[30]
Atribución regional y nacional de las emisiones
[editar]Según la Agencia de Protección Ambiental (EPA), las emisiones de gases de efecto invernadero en Estados Unidos pueden rastrearse desde diferentes sectores.[31] Algunas de las variables que se han reportado[32] incluyen:
- Definición de los límites de medición: Las emisiones pueden atribuirse geográficamente, a la zona donde fueron emitidas (principio del territorio) o por el principio de actividad al territorio donde se produjeron las emisiones. Estos dos principios dan lugar a totales diferentes cuando se miden, por ejemplo, las importaciones de electricidad de un país a otro, o las emisiones en un aeropuerto internacional.
- Horizonte temporal de los diferentes gases: La contribución de un determinado gas de efecto invernadero se notifica como equivalente de CO2. El cálculo para determinar esto tiene en cuenta cuánto tiempo permanece ese gas en la atmósfera. Esto no siempre se sabe con exactitud y los cálculos deben actualizarse regularmente para reflejar la nueva información.
- Qué sectores se incluyen en el cálculo (por ejemplo, industrias energéticas, procesos industriales, agricultura, etc.): A menudo existe un conflicto entre la transparencia y la disponibilidad de los datos.
- El protocolo de medición en sí mismo: Esto puede ser a través de una medición o estimación directa. Los cuatro métodos principales son el método basado en factores de emisión, el método de balance de masa, los sistemas de monitoreo predictivo de emisiones y los sistemas de monitoreo continuo de emisiones. Estos métodos difieren en precisión, costo y usabilidad.
Estas diferentes medidas son utilizadas a veces por diferentes países para afirmar diversas posiciones políticas/éticas sobre el cambio climático (Banuri et al., 1996, p. 94).[33] El uso de diferentes medidas conduce a una falta de comparabilidad, lo que resulta problemático a la hora de monitorear el progreso hacia las metas. Existen argumentos para la adopción de una herramienta de medición común, o al menos para el desarrollo de la comunicación entre las diferentes herramientas.[32]
Las emisiones pueden medirse a lo largo de largos períodos de tiempo. Este tipo de medición se denomina emisiones históricas o acumulativas. Las emisiones acumuladas dan alguna indicación de quién es responsable de la acumulación de la concentración atmosférica de gases de efecto invernadero (IEA, 2007, p. 199).[34]
El balance de las cuentas nacionales estaría positivamente relacionado con las emisiones de carbono. El saldo de las cuentas nacionales muestra la diferencia entre las exportaciones y las importaciones. Para muchas naciones más ricas, como Estados Unidos, el saldo de las cuentas es negativo porque se importan más bienes de los que se exportan. Esto se debe principalmente al hecho de que es más barato producir bienes fuera de los países desarrollados, lo que lleva a las economías de los países desarrollados a depender cada vez más de los servicios y no de los bienes. Creíamos que un balance positivo de las cuentas significaría que se estaba produciendo más producción en un país, por lo que más fábricas trabajando aumentarían los niveles de emisión de carbono.[35]
Las emisiones también pueden medirse en períodos de tiempo más cortos. Los cambios en las emisiones pueden, por ejemplo, medirse con respecto a un año base de 1990. En 1990 se utilizó en la Convención Marco de las Naciones Unidas sobre el Cambio Climático (CMNUCC) como año de referencia para las emisiones, y también se utiliza en el Protocolo de Kioto (algunos gases también se miden a partir del año 1995). Las emisiones de un país también pueden reportarse como una proporción de las emisiones globales para un año en particular.
Por cambio de uso de la tierra
[editar]El cambio en el uso de la tierra, por ejemplo, la tala de bosques para uso agrícola, puede afectar la concentración de gases de efecto invernadero en la atmósfera al alterar la cantidad de carbono que fluye fuera de la atmósfera hacia los sumideros de carbono.[36]
La consideración del cambio en el uso de la tierra puede entenderse como un intento de medir las emisiones "netas", es decir, las emisiones brutas de todas las fuentes menos la remoción de emisiones de la atmósfera por parte de los sumideros de carbono (Banuri et al., 1996, págs. 92-93).
Existen grandes incertidumbres en la medición de las emisiones netas de carbono.[37] Además, existe controversia sobre cómo se deben distribuir los sumideros de carbono entre las diferentes regiones y a lo largo del tiempo (Banuri et al., 1996, p. 93). Por ejemplo, es probable que concentrarse en los cambios más recientes en los sumideros de carbono favorezca a las regiones que han deforestado antes, por ejemplo, Europa.
Intensidad de gases de efecto invernadero
[editar]
La intensidad de los gases de efecto invernadero es una relación entre las emisiones de gases de efecto invernadero y otra medida, por ejemplo, el producto interno bruto (PIB) o el uso de energía.[38] Los términos "intensidad de carbono" e "intensidad de las emisiones" también se utilizan a veces. Las intensidades de emisión pueden calcularse utilizando los tipos de cambio de mercado (TCM) o la paridad de poder adquisitivo (PPA) (Banuri et al., 1996, p. 96). Los cálculos basados en el TCM muestran grandes diferencias en las intensidades entre los países desarrollados y en desarrollo, mientras que los cálculos basados en la PPA muestran diferencias menores.
Emisiones acumuladas e históricas
[editar]Las emisiones antropogénicas acumuladas (es decir, emitidas por el hombre) de CO2 procedentes del uso de combustibles fósiles son una de las principales causas del calentamiento global,[39] y dan alguna indicación de qué países han contribuido más al cambio climático inducido por el hombre.[40]
En general, los países desarrollados representaron el 83,8 % de las emisiones industriales de CO2 durante este período y el 67,8 % de las emisiones totales de CO2. Los países en desarrollo representaron el 16,2 % de las emisiones industriales de CO2 durante este período y el 32,2 % de las emisiones totales de CO2. La estimación de las emisiones totales de CO2 incluye las emisiones de carbono biótico, principalmente de la deforestación. Banuri et al. (1996, p. 94) calculó las emisiones per cápita acumuladas sobre la base de la población de entonces. La relación entre las emisiones per cápita de los países industrializados y los países en desarrollo se estimó en más de 10 a 1.
La inclusión de las emisiones bióticas provoca la misma controversia mencionada anteriormente en relación con los sumideros de carbono y el cambio de uso de la tierra (Banuri et al., 1996, págs. 93-94). El cálculo real de las emisiones netas es muy complejo y se ve afectado por la forma en que se distribuyen los sumideros de carbono entre las regiones y la dinámica del sistema climático.
Los países no miembros de la Organización para la Cooperación y el Desarrollo Económicos representaron el 42 % de las emisiones acumuladas de CO2 relacionadas con la energía entre 1890 y 2007.[41] Durante este período, EE. UU. representó el 28 % de las emisiones; la UE, el 23 %; Rusia, el 11 %; China, el 9 %; otros países de la OCDE, el 5 %; Japón, el 4 %; India, el 3 %; y el resto del mundo, el 18 %.
Emisiones anuales
[editar]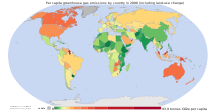
Debido al rápido desarrollo económico de China, sus emisiones anuales per cápita se están acercando rápidamente a los niveles del grupo del Anexo I del Protocolo de Kioto (es decir, los países desarrollados excluyendo a EE. UU.).[42] Otros países con emisiones de rápido crecimiento son Corea del Sur, Irán y Australia (que aparte de los estados ricos en petróleo del Golfo Pérsico, ahora tiene la tasa de emisión per cápita más alta del mundo). Por otra parte, las emisiones anuales per cápita de la UE-15 y de los EE. UU. disminuyen gradualmente con el tiempo. Las emisiones en Rusia y Ucrania han disminuido más rápidamente desde 1990 debido a la reestructuración económica de estos países.[43]
Las estadísticas energéticas de las economías de rápido crecimiento son menos precisas que las de los países industrializados. Para las emisiones anuales de China en 2008, la Agencia de Evaluación Ambiental de los Países Bajos estimó un rango de incertidumbre de alrededor del 10 %.[42]
La huella de gases de efecto invernadero se refiere a las emisiones resultantes de la creación de productos o servicios. Es más completa que la huella de carbono comúnmente utilizada, que mide sólo el dióxido de carbono, uno de los muchos gases de efecto invernadero.
2015 fue el primer año en el que se observó tanto un crecimiento económico mundial total como una reducción de las emisiones de carbono.[44]
Principales países emisores
[editar]Anual
[editar]En 2009, los diez principales países emisores anuales representaron alrededor de dos tercios de las emisiones anuales de CO2 relacionadas con la energía.[45]
| País | % de las emisiones anuales totales mundiales | Toneladas de GEI per cápita |
|---|---|---|
| 32.9 | 8.7 | |
| 12.6 | 14.2 | |
| 7.0 | 1.9 | |
| 5.1 | 13.5 | |
| 2.9 | 8.6 | |
| 1.9 | 8.4 | |
| 1.8 | ||
| 1.7 | ||
| 1.6 | ||
| 1.6 | 16.6 | |
| 1.5 | 14.9 |
| País | % de las emisiones anuales totales mundiales | Toneladas de GEI per cápita |
|---|---|---|
| 1.3 | ||
| 1.1 | ||
| 0.6 | 5.0 | |
| 0.5 | 4.1 | |
| 0.3 | 3.1 | |
| 0.2 | 4.6 | |
| 0.2 | ||
| 0.2 | ||
| 0.1 | ||
| 0.1 | 3.8 |
Acumulado
[editar]Emisión relativa de CO2 de varios combustibles
[editar]Un litro de gasolina, cuando se usa como combustible, produce 2,32 kg (unos 1300 litros o 1.3 metros cúbicos) de dióxido de carbono, un gas de efecto invernadero. Un galón estadounidense produce 19,4 lb (1291,5 galones o 172,65 pies cúbicos).[47][48][49]
| Nombre del combustible | CO2 emitido (lbs/106 Btu) | CO2 emitido (g/MJ) | CO2 emitido (g/kWh) |
|---|---|---|---|
| Gas natural | 117 | 50.30 | 181.08 |
| Gas licuado de petróleo | 139 | 59.76 | 215.14 |
| Propano | 139 | 59.76 | 215.14 |
| Combustible de turbina de aviación | 153 | 65.78 | 236.81 |
| Gasolina | 156 | 67.07 | 241.45 |
| Queroseno | 159 | 68.36 | 246.10 |
| Fuel oil | 161 | 69.22 | 249.19 |
| Neumático | 189 | 81.26 | 292.54 |
| Madera y residuos de madera | 195 | 83.83 | 301.79 |
| Hulla | 205 | 88.13 | 317.27 |
| Carbón sub-bituminoso | 213 | 91.57 | 329.65 |
| Lignito | 215 | 92.43 | 332.75 |
| Coque de petróleo | 225 | 96.73 | 348.23 |
| Arenas aceiteras | [cita requerida] | [cita requerida] | [cita requerida] |
| Antracita | 227 | 97.59 | 351.32 |
Métodos de eliminación de la atmósfera
[editar]Procesos naturales
[editar]Los gases de efecto invernadero pueden ser eliminados de la atmósfera por diversos procesos, como consecuencia de:
- un cambio físico (la condensación y la precipitación eliminan el vapor de agua de la atmósfera).
- una reacción química dentro de la atmósfera. Por ejemplo, el metano se oxida por reacción con el radical hidroxilo natural, OH- y se degrada a CO2 y vapor de agua (el CO2 de la oxidación del metano no se incluye en el potencial de calentamiento global del metano). Otras reacciones químicas incluyen la química en solución y en fase sólida que se produce en los aerosoles atmosféricos.
- un intercambio físico entre la atmósfera y los otros compartimentos del planeta. Un ejemplo es la mezcla de gases atmosféricos en los océanos.
- un cambio químico en la interfaz entre la atmósfera y los otros compartimentos del planeta. Este es el caso del CO2, que se reduce mediante la fotosíntesis de las plantas y que, tras disolverse en los océanos, reacciona para formar ácido carbónico e iones de bicarbonato y carbonato (ver acidificación oceánica).
- un cambio fotoquímico. Los halocarbonos son disociados por la luz UV liberando Cl- y F- como radicales libres en la estratosfera con efectos dañinos sobre el ozono (los halocarbonos son generalmente demasiado estables para desaparecer por reacción química en la atmósfera).
Proceso tecnológico
[editar]Varias tecnologías eliminan las emisiones de gases de efecto invernadero de la atmósfera. Las más analizadas son las que extraen el dióxido de carbono de la atmósfera, ya sea sepultándolo en formaciones geológicas como la bioenergía con captura y almacenamiento de carbono,[51][52][53] la captura directa del aire, o almacenándolo en el suelo agrícola superficial, como en el caso del biocarbón. El IPCC ha señalado que muchos modelos de escenarios climáticos a largo plazo requieren emisiones negativas a gran escala producidas por el hombre para evitar un cambio climático grave.[54]
Existe abierto un muy acalorado debate alrededor de lo que se conoce como la Geoingeniería, ingeniería climática o intervención climática.
Véase también
[editar]- Calentamiento global
- Huella de carbono
- Impuesto sobre el carbono
- Protocolo de Kioto
- Régimen de Comercio de Derechos de Emisión de la Unión Europea
Referencias
[editar]- ↑ «IPCC AR4 SYR Appendix Glossary» (PDF). Archivado desde el original el 17 de noviembre de 2018. Consultado el 14 de diciembre de 2008.
- ↑ «Gases de efecto invernadero». www.mendoza.conicet.gov.ar. Archivado desde el original el 26 de junio de 2020. Consultado el 30 de junio de 2020.
- ↑ «NASA GISS: Science Briefs: Greenhouse Gases: Refining the Role of Carbon Dioxide». www.giss.nasa.gov. Archivado desde el original el 3 de mayo de 2016. Consultado el 26 de abril de 2016.
- ↑ Karl TR; Trenberth KE (2003). «Modern global climate change». Science 302 (5651): 1719-23. Bibcode:2003Sci...302.1719K. PMID 14657489. doi:10.1126/science.1090228.
- ↑ Le Treut, H.; Somerville, R.; Cubasch, U.; Ding, Y.; Mauritzen, C.; Mokssit, A.; Peterson, T.; Prather, M. (2007). Historical overview of climate change science. En: Climate change 2007: The physical science basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change (Solomon, S., Qin, D., Manning, M., Chen, Z., Marquis, M., Averyt, K. B., Tignor, M. y Miller, H. L., coordinadores) (PDF). Cambridge University Press. Archivado desde el original el 26 de noviembre de 2018. Consultado el 14 de diciembre de 2008.
- ↑ «NASA Science Mission Directorate article on the water cycle». Nasascience.nasa.gov. Archivado desde el original el 17 de enero de 2009. Consultado el 16 de octubre de 2010.
- ↑ Blasing, T.J., 2013
- ↑ La estimación preliminar más reciente de la concentración media mensual global de CO2 (a mayo de 2013) es 396.71 ppm: (Ed Dlugokencky y Pieter Tans, NOAA/ESRL ([1])
- ↑ «Frequently asked global change questions». Carbon Dioxide Information Analysis Center. Archivado desde el original el 17 de agosto de 2011. Consultado el 14 de noviembre de 2016.
- ↑ ESRL Web Team (14 de enero de 2008). «Trends in carbon dioxide». Esrl.noaa.gov. Consultado el 11 de septiembre de 2011.
- ↑ «EL CICLO DE CARBONO». Intelligence survival. 6 de diciembre de 2021. Consultado el 14 de noviembre de 2022.
- ↑ «AR4 SYR Synthesis Report Summary for Policymakers – 2 Causes of change». ipcc.ch. Archivado desde el original el 28 de febrero de 2018. Consultado el 14 de noviembre de 2016.
- ↑ «China apuesta por el carbón ante la escasez de energía». El Estímulo. AFP. Consultado el 25 de septiembre de 2022. «China, el mayor emisor mundial de gases de efecto invernadero».
- ↑ Sha HuaFollow; Phred Dvorak. «China’s Ambitious Climate Goals Collide With Reality, Hampering Global Efforts». The Wall Street Journal (en inglés). Consultado el 25 de septiembre de 2022. «China, the world’s largest greenhouse-gas polluter».
- ↑ Mora, C (2013). «The projected timing of climate departure from recent variability». Nature 502: 183-187. doi:10.1038/nature12540.
- ↑ Mann, Michael E. (1 de abril de 2014). «Earth Will Cross the Climate Danger Threshold by 2036». Scientific American. Consultado el 30 de agosto de 2016.
- ↑ Lacis, A. (Octubre de 2010), NASA GISS: CO2: The Thermostat that Controls Earth's Temperature, New York: NASA GISS, archivado desde el original el 30 de octubre de 2019, consultado el 9 de octubre de 2018.
- ↑ Shindell, Drew T. (2005). «An emissions-based view of climate forcing by methane and tropospheric ozone». Geophysical Research Letters 32 (4): L04803. Bibcode:2005GeoRL..32.4803S. doi:10.1029/2004GL021900. Archivado desde el original el 11 de septiembre de 2005. Consultado el 9 de octubre de 2018.
- ↑ «Methane's Impacts on Climate Change May Be Twice Previous Estimates». Nasa.gov. 30 de noviembre de 2007. Archivado desde el original el 11 de septiembre de 2005. Consultado el 16 de octubre de 2010.
- ↑ a b Kiehl, J.T.; Kevin E. Trenberth (1997). «Earth's annual global mean energy budget» (PDF). Bulletin of the American Meteorological Society 78 (2): 197-208. Bibcode:1997BAMS...78..197K. doi:10.1175/1520-0477(1997)078<0197:EAGMEB>2.0.CO;2. Archivado desde el original el 30 de marzo de 2006. Consultado el 1 de mayo de 2006.
- ↑ Prather, Michael J.; J Hsu (2008). «NF
3, the greenhouse gas missing from Kyoto». Geophysical Research Letters 35 (12): L12810. Bibcode:2008GeoRL..3512810P. doi:10.1029/2008GL034542. - ↑ «Water vapour: feedback or forcing?». RealClimate. 6 de abril de 2005. Consultado el 1 de mayo de 2006.
- ↑ Isaksen, Ivar S.A.; Michael Gauss; Gunnar Myhre; Katey M. Walter Anthony; Carolyn Ruppel (20 de abril de 2011). «Strong atmospheric chemistry feedback to climate warming from Arctic methane emissions». Global Biogeochemical Cycles 25 (2): n/a. Bibcode:2011GBioC..25B2002I. doi:10.1029/2010GB003845. Archivado desde el original el 4 de marzo de 2016. Consultado el 29 de julio de 2011.
- ↑ a b «Climate Change Indicators in the United States». U.S. Environmental Protection Agency (EPA). 2010. Greenhouse Gases: Figure 1. The Annual Greenhouse Gas Index, 1979–2008: Background.. PDF (p. 18)
- ↑ Chandler, David L. «How to count methane emissions». MIT News. Consultado el 20 de agosto de 2018. Referenced paper is Trancik, Jessika; Edwards, Morgan (25 de abril de 2014). «Climate impacts of energy technologies depend on emissions timing». Nature Climate Change 4: 347. Archivado desde el original el 16 de enero de 2015. Consultado el 9 de octubre de 2018.
- ↑ «Introduction». Executive Summary. Archivado desde el original el 2 de noviembre de 2018. Consultado el 17 de octubre de 2018. in Rogner et al., 2007
- ↑ «Introduction». 1.3.1 Review of the last three decades. Archivado desde el original el 21 de enero de 2012. Consultado el 17 de octubre de 2018. in Rogner et al., 2007 Esta cita aclara el período de tiempo (1970-2004) para las tendencias de emisiones observadas.
- ↑ Bridging the Emissions Gap: A UNEP Synthesis Report (PDF) (en inglés), Nairobi, Kenya: United Nations Environment Programme (UNEP), Noviembre de 2011, ISBN 978-9280732290, archivado desde el original el 26 de noviembre de 2011, consultado el 17 de octubre de 2018. UNEP Stock Number: DEW/1470/NA
- ↑ «Global Greenhouse Gas Emissions Data». EPA (en inglés). Consultado el 4 de marzo de 2014. «La quema de carbón, gas natural y petróleo para producir electricidad y calor es la mayor fuente de emisiones de gases de efecto invernadero a nivel mundial.»
- ↑ Dodman, David (April 2009). «Blaming cities for climate change? An analysis of urban greenhouse gas emissions inventories». Environment and Urbanization 21 (1): 185-201. ISSN 0956-2478. doi:10.1177/0956247809103016.
- ↑ «What is GHG?». ADEC Innovations ESG Solutions. Consultado el 9 de enero de 2018.
- ↑ a b Bader, N.; Bleichwitz, R. (2009). «Measuring urban greenhouse gas emissions: The challenge of comparability. S.A.P.I.EN.S. 2 (3)». Sapiens.revues.org. Consultado el 11 de septiembre de 2011.
- ↑ Banuri, T. (1996). Equity and social considerations. In: Climate change 1995: Economic and social dimensions of climate change. Contribution of Working Group III to the Second Assessment Report of the Intergovernmental Panel on Climate Change (J.P. Bruce et al. Eds.) (PDF). This version: Printed by Cambridge University Press, Cambridge and New York. PDF version: IPCC website. ISBN 978-0521568548. doi:10.2277/0521568544. Archivado desde el original el 11 de octubre de 2017. Consultado el 17 de octubre de 2018.
- ↑ IEA (2007), World Energy Outlook 2007, IEA, Paris https://www.iea.org/reports/world-energy-outlook-2007, License: CC BY 4.0
- ↑ Holtz-Eakin, D. (1995). «Stoking the fires? CO2 emissions and economic growth». Journal of Public Economics 57 (1): 85-101. doi:10.1016/0047-2727(94)01449-X.
- ↑ O.R. Davidson, P.R. Bosch, R. Dave, L.A. Meyer (3 de mayo de 2010). «Annex I: Glossary J–P». Archivado desde el original el 3 de mayo de 2010.
- ↑ Markandya, A. (2001). «7.3.5 Cost Implications of Alternative GHG Emission Reduction Options and Carbon Sinks». En B. Metz, ed. Costing Methodologies. Climate Change 2001: Mitigation. Contribution of Working Group III to the Third Assessment Report of the Intergovernmental Panel on Climate Change. Print version: Cambridge University Press, Cambridge and New York. This version: GRID-Arendal website. ISBN 978-0521015028. doi:10.2277/0521015022. Archivado desde el original el 5 de agosto de 2011. Consultado el 11 de abril de 2011.
- ↑ Herzog, T. (Noviembre de 2006). Yamashita, M.B., ed. Target: intensity – an analysis of greenhouse gas intensity targets (PDF). World Resources Institute. ISBN 978-1569736388. Consultado el 11 de abril de 2011.
- ↑ Botzen, W.J.W. (2008). «Cumulative CO2 emissions: shifting international responsibilities for climate debt». Climate Policy 8 (6): 570. doi:10.3763/cpol.2008.0539.
- ↑ Höhne, N. (24 de septiembre de 2010). «Contributions of individual countries' emissions to climate change and their uncertainty» (PDF). Climatic Change 106 (3): 359-91. doi:10.1007/s10584-010-9930-6. Archivado desde el original el 26 de abril de 2012.
- ↑ World Energy Outlook 2009 (PDF), París: International Energy Agency (IEA), 2009, pp. 179-80, ISBN 978-9264061309, archivado desde el original el 24 de septiembre de 2015, consultado el 17 de octubre de 2018.
- ↑ a b «Global CO2 emissions: annual increase halves in 2008». Netherlands Environmental Assessment Agency (PBL) website. 25 de junio de 2009. Archivado desde el original el 19 de diciembre de 2010. Consultado el 5 de mayo de 2010.
- ↑ «Global Carbon Mechanisms: Emerging lessons and implications (CTC748)». Carbon Trust. Marzo de 2009. p. 24. Archivado desde el original el 4 de mayo de 2013. Consultado el 31 de marzo de 2010.
- ↑ Vaughan, Adam (7 de diciembre de 2015). «Global emissions to fall for first time during a period of economic growth». The Guardian. ISSN 0261-3077. Consultado el 23 de diciembre de 2016.
- ↑ CO2 Emissions From Fuel Combustion: Highlights (2011 edition), Paris, France: International Energy Agency (IEA), 2011, p. 9, archivado desde el original el 17 de marzo de 2017, consultado el 17 de octubre de 2018.
- ↑ a b https://edgar.jrc.ec.europa.eu/report_2022
- ↑ «Greenhouse Gas Emissions from a Typical Passenger Vehicle». Epa.gov. US Environment Protection Agency. Consultado el 11 de septiembre de 2011.
- ↑ Engber, Daniel (1 de noviembre de 2006). «How gasoline becomes CO2, Slate Magazine». Slate Magazine. Consultado el 11 de septiembre de 2011.
- ↑ «Volume calculation for carbon dioxide». Icbe.com. Consultado el 11 de septiembre de 2011.
- ↑ «Voluntary Reporting of Greenhouse Gases Program». Energy Information Administration. Archivado desde el original el 1 de noviembre de 2004. Consultado el 21 de agosto de 2009.
- ↑ Obersteiner M; Azar C; Kauppi P et al. (October 2001). «Managing climate risk». Science 294 (5543): 786-87. PMID 11681318. doi:10.1126/science.294.5543.786b.
- ↑ Azar, (youtube) C.; Lindgren, K.; Larson, E.D.; Möllersten, K. (2006). «Carbon capture and storage from fossil fuels and biomass – Costs and potential role in stabilising the atmosphere». Climatic Change 74: 47-79. doi:10.1007/s10584-005-3484-7.
- ↑ «Geoengineering the climate: science, governance and uncertainty». The Royal Society. 2009. Archivado desde el original el 7 de septiembre de 2009. Consultado el 12 de septiembre de 2009.
- ↑ Fischer, B.S.; Nakicenovic, N.; Alfsen, K.; Morlot, J. Corfee; de la Chesnaye, F.; Hourcade, J.-Ch.; Jiang, K.; Kainuma, M.; La Rovere, E.; Matysek, A.; Rana, A.; Riahi, K.; Richels, R.; Rose, S.; van Vuuren, D.; Warren, R., Issues related to mitigation in the long term context, archivado desde el original el 22 de septiembre de 2018, consultado el 17 de octubre de 2018. in Rogner et al., 2007
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre Gas de efecto invernadero.
Wikimedia Commons alberga una categoría multimedia sobre Gas de efecto invernadero.- Directiva 1999/94 CE sobre CO2 y Real Decreto español 837/2002 de 2 de agosto
- Ministerio del Medio Ambiente de España: Registro Estatal de Emisiones y Fuentes Contaminantes
- International Initiative for Impact Evaluation (3ie). (2009). Cambio climático: maneras eficaces de reducir las emisiones de gases de efecto invernadero (report). Caracas: Corporación Andina de Fomento
- Sobre una estrategia para dirigir al sector de la edificación hacia la eficiencia en la emisión de gases de efecto invernadero
