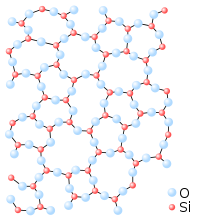
Sólido

El sólido (del latín solĭdus) es un estado de agregación de la materia, que se caracteriza porque opone resistencia a cambios de forma y de volumen. Sus partículas se encuentran juntas y también se ven correctamente ordenadas.[1] Las moléculas de un sólido tienen una gran cohesión y adoptan formas bien definidas. Existen varias disciplinas que estudian los sólidos:
- La física del estado sólido estudia de manera experimental y teórica la materia condensada, es decir, de líquidos y sólidos que contengan más de 1019 átomos en contacto entre sí.[2]
- La mecánica de sólidos deformables estudia propiedades microscópicas desde la perspectiva de la mecánica de medios continuos como tensión, deformación y magnitudes termodinámicas[3] e ignora la estructura atómica interna porque para cierto tipo de problemas esta no es relevante.
- La ciencia de materiales se ocupa principalmente de propiedades de los sólidos como estructura y transformaciones de fase.[4]
- La química del estado sólido se especializa en la síntesis de nuevos materiales.
Manteniendo constante la presión a baja temperatura los cuerpos se presentan en forma sólida y encontrándose entrelazados formando generalmente estructuras cristalinas. Esto confiere al cuerpo la capacidad de soportar fuerzas sin deformación aparente.
El sólido más ligero conocido es un material artificial, el aerogel con una densidad de 3 mg/cm³ o 3 kg/m³, el vidrio, que tiene una densidad de 1,9 g/cm³, mientras que el más denso es un metal, el osmio (Os), que tiene una densidad de 22,6 g/cm³.[5]
Descripción microscópica
[editar]
Los átomos, las moléculas o los iones que componen los sólidos pueden estar dispuestos en un patrón de repetición ordenado, o de forma irregular. Los materiales cuyos constituyentes están dispuestos en un patrón regular se conocen como cristales. En algunos casos, el ordenamiento regular puede continuar ininterrumpidamente a gran escala, por ejemplo los diamantes, donde cada diamante es un Monocristal. Los objetos sólidos que son lo suficientemente grandes como para verlos y manipularlos rara vez están compuestos por un solo cristal, sino que están formados por un gran número de cristales individuales, conocidos como cristalitos, cuyo tamaño puede variar desde unos pocos nanómetros hasta varios metros. Este tipo de materiales se denominan policristales. Casi todos los metales comunes, y muchos cerámicos, son policristalinos.
En otros materiales, no existe un orden de largo alcance en la posición de los átomos. Estos sólidos se denominan sólidos amorfos; algunos ejemplos son el poliestireno y el vidrio.
El hecho de que un sólido sea cristalino o amorfo depende del material del que se trate y de las condiciones en las que se haya formado. Los sólidos que se forman por enfriamiento lento tienden a ser cristalinos, mientras que los sólidos que se congelan rápidamente son más propensos a ser amorfos. Asimismo, la estructura cristalina específica que adopta un sólido cristalino depende del material en cuestión y de cómo se formó.
Mientras que muchos objetos comunes, como un cubito de hielo o una moneda, son químicamente idénticos en su totalidad, muchos otros materiales comunes están formados por una serie de sustancias diferentes empaquetadas entre sí. Por ejemplo, una roca típica es un agregado de varios minerales y mineraloides diferentes, sin una composición química específica. La madera es un material orgánico natural formado principalmente por fibras de celulosa incrustadas en una matriz de lignina orgánica. En la ciencia de los materiales, los composites de más de un material constituyente pueden ser diseñados para tener las propiedades deseadas.
Propiedades de un sólido
[editar]- Elasticidad: Un sólido recupera su forma original cuando es deformado.[6] Un resorte es un objeto en que podemos observar esta propiedad ya que vuelve a su forma original.
- Fragilidad: Un sólido puede romperse en muchos fragmentos (quebradizo).[7]
- Dureza: La dureza es la oposición que ofrecen los materiales a alteraciones como la penetración, la abrasión, el rayado, la cortadura, y las deformaciones permanentes entre otras.. El diamante es un sólido con dureza elevada.
- Forma definida: Tienen forma definida, son relativamente rígidos y no fluyen como lo hacen los gases y los líquidos, excepto bajo presiones extremas del medio.
- Alta densidad: Los sólidos tienen densidades relativamente altas debido a la cercanía de sus moléculas por eso se dice que son más “pesados”
- Flotación: Algunos sólidos cumplen con esta propiedad, solo si su densidad es menor a la del líquido en el cual se coloca.
- Inercia: es la dificultad o resistencia que opone un sistema físico o un sistema social a posibles cambios, en el caso de los sólidos pone resistencia a cambiar su estado de reposo.
- Tenacidad: En ciencia de los Materiales la tenacidad es la resistencia que opone un material a que se propaguen fisuras o grietas.
- Maleabilidad: Es la propiedad de la materia, que presentan los cuerpos a ser labrados por deformación. La maleabilidad permite la obtención de delgadas láminas de material sin que este se rompa, teniendo en común que no existe ningún método para cuantificarlas.
- Ductilidad: La ductilidad se refiere a la propiedad de los sólidos de poder obtener hilos de ellos.
- Rigidez: Algunos sólidos pueden resistir más que otros los dobleces y torceduras.
- Deformación: Algunos sólidos pueden deformarse sin romperse, adquiriendo una forma diferente a la que tenían.
- Aleabilidad: Propiedad que tienen los materiales para formar aleaciones que dan lugar a nuevos materiales mejorando sus prestaciones.
- Calor específico: La capacidad calorífica de una sustancia es la energía necesaria para aumentar 1 °C su temperatura
Clases de sólidos
[editar]Las fuerzas entre los átomos de un sólido pueden adoptar diversas formas. Por ejemplo, un cristal de cloruro de sodio (sal común) está formado por iones de sodio y cloro, que se mantienen unidos por enlaces iónicos.[8] En el diamante[9] o el silicio, los átomos comparten electrones y forman enlaces covalentes.[10] En los metales, los electrones se comparten en enlace metálicoing.[11] Algunos sólidos, en particular la mayoría de los compuestos orgánicos, se mantienen unidos con fuerza de van der Waals resultante de la polarización de la nube de carga electrónica en cada molécula. Las disimilitudes entre los tipos de sólidos resultan de las diferencias entre sus enlaces.
Metales
[editar]
Los metales suelen ser fuertes, densos y buenos conductores tanto de la electricidad como de la calor.[12][13] La mayor parte de los elementos de la tabla periódica, los que están a la izquierda de una línea diagonal que va desde el boro hasta el polonio, son metales. Las mezclas de dos o más elementos en las que el componente principal es un metal se conocen como aleaciones.
Desde la prehistoria, el hombre ha utilizado los metales para diversos fines. La fuerza y fiabilidad de los metales ha llevado a su uso generalizado en la construcción de edificios y otras estructuras, así como en la mayoría de los vehículos, muchos aparatos y herramientas, tuberías, señales de tráfico y vías férreas. El hierro y el aluminio son los dos metales estructurales más utilizados. También son los metales más abundantes en la Corteza terrestre. El hierro se utiliza sobre todo en forma de aleación, el acero, que contiene hasta un 2,1% de carbono, lo que lo hace mucho más duro que el hierro puro.
Como los metales son buenos conductores de la electricidad, son valiosos en los aparatos eléctricos y para transportar una corriente eléctrica a largas distancias con poca pérdida o disipación de energía. Así, las redes eléctricas se basan en cables metálicos para distribuir la electricidad. Los sistemas eléctricos domésticos, por ejemplo, se cablean con cobre por sus buenas propiedades conductoras y su fácil mecanización. La alta conductividad térmica de la mayoría de los metales también los hace útiles para los utensilios de cocina.
El estudio de los elementos metálicos y sus aleaciones constituye una parte importante de los campos de la química del estado sólido, la física, la ciencia de los materiales y la ingeniería.
Los sólidos metálicos se mantienen unidos por una alta densidad de electrones compartidos y deslocalizados, lo que se conoce como "enlace metálico". En un metal, los átomos pierden fácilmente sus electrones más externos ("valencia"), formando iones positivos. Los electrones libres se reparten por todo el sólido, que se mantiene unido firmemente por las interacciones electrostáticas entre los iones y la nube de electrones.[14] El gran número de electrones libres da a los metales sus altos valores de conductividad eléctrica y térmica. Los electrones libres también impiden la transmisión de la luz visible, haciendo que los metales sean opacos, brillantes y lustrosos.
Los modelos más avanzados de las propiedades de los metales consideran el efecto de los núcleos de iones positivos sobre los electrones deslocalizados. Como la mayoría de los metales tienen estructura cristalina, esos iones suelen estar dispuestos en una red periódica. Matemáticamente, el potencial de los núcleos iónicos puede tratarse mediante varios modelos, siendo el más sencillo el modelo de electrones casi libres.
Minerales
[editar]
Los minerales son sólidos naturales formados a través de diversos procesos geológicos[15] bajo altas presiones. Para ser clasificado como un verdadero mineral, una sustancia debe tener una estructura cristalina con propiedades físicas uniformes en su totalidad. La composición de los minerales varía desde los elementos puros y las sal simples hasta los silicatos muy complejos con miles de formas conocidas. En cambio, una muestra de roca es un agregado aleatorio de minerales y/o mineraloides, y no tiene una composición química específica. La gran mayoría de las rocas de la corteza terrestre están formadas por cuarzo (SiO2 cristalino), feldespato, mica, clorita, caolín, calcita, epidota, olivino, augita, hornblenda, magnetita, hematita, limonita y algunos otros minerales. Algunos minerales, como el cuarzo, la mica o el feldespato son comunes, mientras que otros sólo se han encontrado en unos pocos lugares del mundo. El mayor grupo de minerales es, con diferencia, el de los silicatos (la mayoría de las rocas son ≥95% silicatos), que están compuestos en gran parte por silicio y oxígeno, con la adición de iones de aluminio, magnesio, hierro, calcio y otros metales.
Cerámica
[editar]
Los sólidos cerámicos están formados por compuestos inorgánicos, normalmente óxidos de elementos químicos.[16] Son químicamente inertes, y a menudo son capaces de soportar la erosión química que se produce en un entorno ácido o cáustico. Los materiales cerámicos generalmente pueden soportar altas temperaturas que van desde 1000 a 1600 °C (1800 a 3000 °F). Las excepciones son los materiales inorgánicos no oxidados, como los nitruros, los boruros y los carburos.
Entre las materias primas cerámicas tradicionales se encuentran los minerales de arcilla, como la caolinita; entre los materiales más recientes se encuentra el óxido de aluminio (alúmina). Los materiales cerámicos modernos, clasificados como cerámicas avanzadas, incluyen el carburo de silicio y el carburo de tungsteno. Ambos son valorados por su resistencia a la abrasión, y por ello se utilizan en aplicaciones como las placas de desgaste de los equipos de trituración en las operaciones mineras.
La mayoría de los materiales cerámicos, como la alúmina y sus compuestos, se forman a partir de polvos finos, dando lugar a una policristalina de grano fino que está llena de centros de dispersión de la luz comparables a la longitud de onda de la luz visible. Por lo tanto, suelen ser materiales opacos, a diferencia de los materiales transparentes. Sin embargo, la reciente tecnología a nanoescala (por ejemplo, sol-gel) ha hecho posible la producción de cerámicas transparentes policristalinas, como la alúmina transparente y los compuestos de alúmina, para aplicaciones como los láseres de alta potencia. La cerámica avanzada también se utiliza en la medicina y en la industria eléctrica y electrónica.
La Cerámica técnica es la ciencia y la tecnología de la creación de materiales, piezas y dispositivos cerámicos en estado sólido. Esto se hace bien por la acción del calor o, a temperaturas más bajas, utilizando reacciones de precipitación a partir de soluciones químicas. El término incluye la purificación de las materias primas, el estudio y la producción de los compuestos químicos correspondientes, su formación en componentes y el estudio de su estructura, composición y propiedades.
Desde el punto de vista mecánico, los materiales cerámicos son frágiles, duros, fuertes a la compresión y débiles a la cizalla y la tensión. Los materiales frágiles pueden presentar una importante resistencia a la tracción al soportar una carga estática. La Dureza indica cuánta energía puede absorber un material antes de fallar mecánicamente, mientras que la tenacidad a la fractura (denotada KIc ) describe la capacidad de un material con defectos microestructurales inherentes para resistir la fractura mediante el crecimiento y la propagación de grietas. Si un material tiene un valor grande de resistencia a la fractura, los principios básicos de la Mecánica de la fractura sugieren que lo más probable es que sufra una fractura dúctil. La fractura frágil es muy característica de la mayoría de los materiales de cerámica y vitrocerámica que suelen presentar valores bajos (e inconsistentes) de KIc.
Como ejemplo de aplicaciones de la cerámica, la extrema dureza del zirconia se utiliza en la fabricación de hojas de cuchillo, así como en otras herramientas de corte industriales. Cerámicas como la alúmina, el carburo de boro y el carburo de silicio se han utilizado en los chalecos antibala para repeler los disparos de rifles de gran calibre. Las piezas de nitruro de silicio se utilizan en los rodamientos de bolas de cerámica, donde su alta dureza los hace resistentes al desgaste. En general, las cerámicas también son químicamente resistentes y pueden utilizarse en entornos húmedos en los que los cojinetes de acero serían susceptibles de oxidación (o herrumbre).
Como otro ejemplo de aplicaciones de la cerámica, a principios de los años 80, Toyota investigó la producción de un motor cerámico adiabático con una temperatura de funcionamiento de más de 6000 °F (3300 °C). Los motores cerámicos no necesitan un sistema de refrigeración y, por lo tanto, permiten una importante reducción de peso y, en consecuencia, una mayor eficiencia de combustible. En un motor metálico convencional, gran parte de la energía liberada por el combustible debe disiparse como calor residual para evitar la fusión de las piezas metálicas. También se está trabajando en el desarrollo de piezas cerámicas para turbina de gas motores. Los motores de turbina fabricados con cerámica podrían funcionar de forma más eficiente, proporcionando a los aviones una mayor autonomía y carga útil por una cantidad determinada de combustible. Sin embargo, estos motores no se fabrican porque la fabricación de piezas cerámicas con la suficiente precisión y durabilidad es difícil y costosa. Los métodos de procesamiento suelen dar lugar a una amplia distribución de defectos microscópicos que a menudo desempeñan un papel perjudicial en el proceso de sinterización, lo que da lugar a la proliferación de grietas y al fallo mecánico final.
Vitrocerámica
[editar]
Los materiales vitrocerámicos comparten muchas propiedades tanto con los vidrios no cristalinos como con los materiales cristalinos y materiales cerámicos. Se forman como un vidrio y luego se cristalizan parcialmente mediante un tratamiento térmico, produciendo fases tanto amorfas como cristalinas, de modo que los granos cristalinos están incrustados dentro de una fase intergranular no cristalina.
La vitrocerámica se utiliza para fabricar utensilios de cocina, originalmente conocidos por la marca CorningWare, y placas de cocina que tienen tanto una alta resistencia al choque térmico como una permeabilidad extremadamente baja a los líquidos. El coeficiente de expansión térmica negativo de la fase cerámica cristalina puede equilibrarse con el coeficiente positivo de la fase vítrea. En un punto determinado (~70% cristalino) la vitrocerámica tiene un coeficiente neto de expansión térmica cercano a cero. Este tipo de vitrocerámica presenta excelentes propiedades mecánicas y puede soportar cambios de temperatura repetidos y rápidos de hasta 1000 °C.
La vitrocerámica también puede producirse de forma natural cuando un rayo golpea los granos cristalinos (por ejemplo, de cuarzo) que se encuentran en la mayoría de la arena de las playas. En este caso, el calor extremo e inmediato del rayo (~2500 °C) crea estructuras huecas y ramificadas en forma de raíz llamadas fulgurita mediante fusión.
Sólidos orgánicos
[editar]
La química orgánica estudia la estructura, las propiedades, la composición, las reacciones y la preparación por síntesis (u otros medios) de los compuestos químicos de carbono e hidrógeno, que pueden contener cualquier otro elemento como nitrógeno, oxígeno y los halógenos: flúor, cloro, bromo y yodo. Algunos compuestos orgánicos pueden contener también los elementos fósforo o azufre. Algunos ejemplos de sólidos orgánicos son la madera, la cera de parafina, el naftaleno y una gran variedad de polímeros y plásticos.
Madera
[editar]La madera es un material orgánico natural formado principalmente por fibras de celulosa incrustadas en una matriz de lignina. En cuanto a las propiedades mecánicas, las fibras son fuertes en tensión, y la matriz de lignina resiste la compresión. Por ello, la madera ha sido un importante material de construcción desde que el ser humano comenzó a construir refugios y a utilizar embarcaciones. La madera que se utiliza para la construcción se conoce comúnmente como madera o madera'. En la construcción, la madera no sólo es un material estructural, sino que también se utiliza para formar el molde del hormigón.
Los materiales derivados de la madera también se utilizan ampliamente para los envases (por ejemplo, el cartón) y el papel, que se crean a partir de la pulpa refinada. Los procesos de fabricación de pasta química utilizan una combinación de alta temperatura y productos químicos alcalinos (kraft) o ácidos (sulfito) para romper los enlaces químicos de la lignina antes de quemarla.
Polímeros
[editar]
Una propiedad importante del carbono en la química orgánica es que puede formar ciertos compuestos, cuyas moléculas individuales son capaces de unirse entre sí, formando así una cadena o una red. El proceso se denomina polimerización y las cadenas o redes, polímeros, mientras que el compuesto de origen es un monómero. Existen dos grupos principales de polímeros: los fabricados artificialmente se denominan polímeros industriales o polímeros sintéticos (plásticos) y los de origen natural como biopolímeros.
Los monómeros pueden tener varios sustituyentes químicos, o grupos funcionales, que pueden afectar a las propiedades químicas de los compuestos orgánicos, como la solubilidad y la reactividad química, así como a las propiedades físicas, como la dureza, la densidad, la resistencia mecánica o a la tracción, la resistencia a la abrasión, la resistencia al calor, la transparencia, el color, etc. En las proteínas, estas diferencias confieren al polímero la capacidad de adoptar una conformación biológicamente activa con preferencia a otras (véase autoensamblaje).

El hombre lleva siglos utilizando polímeros orgánicos naturales en forma de ceras y goma laca, que se clasifica como polímero termoplástico. Un polímero vegetal llamado celulosa proporcionaba la resistencia a la tracción de las fibras y cuerdas naturales, y a principios del siglo XIX el caucho natural era de uso generalizado. Los polímeros son las materias primas (las resinas) que se utilizan para fabricar lo que comúnmente se llama plásticos. Los plásticos son el producto final, creado después de que se hayan añadido uno o más polímeros o aditivos a una resina durante el procesamiento, a la que se le da una forma final. Los polímeros que han existido y que se utilizan actualmente de forma generalizada son el polietileno, el polipropileno, el cloruro de polivinilo, el poliestireno, los nilones, el poliéster, los acrílicos, el poliuretano y el policarbonato, y la silicona a base de silicona. Los plásticos se clasifican generalmente en plásticos "básicos", "especiales" y "de ingeniería".
Material compuesto
[editar]

Los materiales compuestos contienen dos o más fases macroscópicas, una de las cuales suele ser cerámica. Por ejemplo, una matriz continua y una fase dispersa de partículas o fibras cerámicas.
Las aplicaciones de los materiales compuestos van desde los elementos estructurales, como el hormigón reforzado con acero, hasta las baldosas térmicas que desempeñan un papel clave e integral en el sistema de protección térmica del transbordador espacial de la NASA, que se utiliza para proteger la superficie del transbordador del calor de la reentrada en la atmósfera terrestre. Un ejemplo es el Carbono reforzado (RCC), el material de color gris claro que soporta temperaturas de reentrada de hasta 1510 °C (2750 °F) y protege la tapa de la nariz y los bordes de ataque de las alas del transbordador espacial. El RCC es un material compuesto laminado hecho de grafito rayón e impregnado con una resina fenólica. Tras el curado a alta temperatura en un autoclave, el laminado se pirroliza para convertir la resina en carbono, se impregna con alcohol furfural en una cámara de vacío y se cura/pirroliza para convertir el alcohol furfural en carbono. Con el fin de proporcionar resistencia a la oxidación para la capacidad de reutilización, las capas exteriores del RCC se convierten en carburo de silicio.
Los ejemplos domésticos de materiales compuestos pueden verse en las carcasas de plástico de los televisores, teléfonos móviles, etc. Estas carcasas de plástico suelen ser un compuesto formado por una matriz termoplástica como el acrilonitrilo butadieno estireno (ABS) a la que se ha añadido tiza de carbonato de calcio, talco, fibras de vidrio o fibras de carbono para darle resistencia, volumen o dispersión electrostática. Estas adiciones pueden denominarse fibras de refuerzo o dispersantes, dependiendo de su finalidad.
Así, el material de la matriz rodea y soporta los materiales de refuerzo manteniendo sus posiciones relativas. Los refuerzos imparten sus propiedades mecánicas y físicas especiales para mejorar las propiedades de la matriz. La sinergia produce propiedades de los materiales que no están disponibles en los materiales constituyentes individuales, mientras que la amplia variedad de materiales de matriz y refuerzo proporciona al diseñador la elección de una combinación óptima.
Semiconductores
[editar]
Los semiconductores son materiales que tienen una resistividad eléctrica (y conductividad) entre la de los conductores metálicos y la de los aislantes no metálicos. Se encuentran en la tabla periódica moviéndose en diagonal hacia abajo a la derecha del boro. Separan los conductores eléctricos (o metales, a la izquierda) de los aislantes (a la derecha).
Los dispositivos fabricados con materiales semiconductores son la base de la electrónica moderna, incluyendo la radio, los ordenadores, los teléfonos, etc. Los dispositivos semiconductores incluyen el transistor, las células solares, los diodos y los circuitos integrados. Los paneles solares fotovoltaicos son grandes dispositivos semiconductores que convierten directamente la luz en energía eléctrica.
En un conductor metálico, la corriente es transportada por el "flujo de electrones", pero en los semiconductores, la corriente puede ser transportada por los electrones o por los "agujeros de electrones" cargados positivamente en la estructura de banda electrónica del material. Los materiales semiconductores más comunes son el silicio, el germanio y el arseniuro de galio.
Nanomateriales
[editar]
Muchos sólidos tradicionales presentan propiedades diferentes cuando se reducen a tamaños nanométricos. Por ejemplo, las nanopartículass de oro, normalmente amarillas, y las de silicio, grises, son de color rojo; las nanopartículas de oro se funden a temperaturas mucho más bajas (~300 °C para un tamaño de 2,5 nm) que las placas de oro (1064 °C);[17] y los nanocables metálicos son mucho más fuertes que los correspondientes metales a granel.[18][19] La elevada superficie de las nanopartículas las hace muy atractivas para ciertas aplicaciones en el campo de la energía. Por ejemplo, los metales de platino pueden proporcionar mejoras como catalizadores de combustible para automóviles, así como membrana de intercambio de protones (PEM). También se están desarrollando óxidos cerámicos (o cermets) de lantano, cerio, manganeso y níquel como pilas de combustible de óxido sólido (SOFC). Las nanopartículas de litio, litio-titanato y tantalio se están aplicando en baterías de iones de litio. Se ha demostrado que las nanopartículas de silicio amplían notablemente la capacidad de almacenamiento de las baterías de iones de litio durante el ciclo de expansión/contracción. Los nanocables de silicio se mueven sin degradación significativa y presentan el potencial de uso en baterías con tiempos de almacenamiento muy ampliados. Las nanopartículas de silicio también se están utilizando en nuevas formas de células de energía solar. La deposición de puntos cuánticos de silicio en el sustrato de silicio policristalino de una célula fotovoltaica (solar) aumenta el voltaje hasta en un 60% por la fluorescencia de la luz entrante antes de su captura. También en este caso, la superficie de las nanopartículas (y de las películas finas) desempeña un papel fundamental para maximizar la cantidad de radiación absorbida.
Biomateriales
[editar]
Muchos materiales naturales (o biológicos) son complejos compuestos con notables propiedades mecánicas. Estas estructuras complejas, surgidas de cientos de millones de años de evolución, están inspirando a los científicos de materiales en el diseño de nuevos materiales. Sus características definitorias son la jerarquía estructural, la multifuncionalidad y la capacidad de autocuración. La autoorganización es también una característica fundamental de muchos materiales biológicos y la forma en que se ensamblan las estructuras desde el nivel molecular. Así, el autoensamblaje está surgiendo como una nueva estrategia en la síntesis química de biomateriales de alto rendimiento.
Véase también
[editar]- Estado de agregación de la materia
- Cambio de estado
- Propiedades intensivas y extensivas
- Licuefacción de gases
- Materia granular
- Gel
- Solidificación
Referencias
[editar]- ↑ Tambutti, Romilio; Muñoz, Héctor (2002). Introducción a la física y a la química 1. Editorial Limusa. ISBN 9789681858667. Consultado el 12 de febrero de 2018.
- ↑ Sólido, p. 745, en Google Libros
- ↑ Agustín, Valera Negrete, José Pedro (2005). Apuntes de Física General. UNAM. ISBN 9789703229871. Consultado el 12 de febrero de 2018.
- ↑ Viñas, Wenceslao González; Mancini, Héctor L. (2003). Ciencia de los materiales. Grupo Planeta (GBS). ISBN 9788434480599. Consultado el 12 de febrero de 2018.
- ↑ Ebbing, Darrell D.; Gammon, Steven D. (24 de junio de 2010). Química General. Cengage Learning Editores. ISBN 9786074813067. Consultado el 12 de febrero de 2018.
- ↑ LLARDENT, Mariano RODRÍGUEZ-AVIAL; GARCÍA, Antonio GONZÁLEZ-ALBERTO (19 de noviembre de 2012). Elasticidad y resistencia de materiales I. Editorial UNED. ISBN 9788436265187. Consultado el 15 de agosto de 2018.
- ↑ Luna, Beatriz Moraleda; Vaca, Luis Llanos (2018). FPB - Ciencias aplicadas I - Ciencias 1 (2018). Editex. ISBN 9788491614333. Consultado el 15 de agosto de 2018.
- ↑ Holley, Dennis (31 de mayo de 2017). GENERAL BIOLOGY I: Moléculas, Células y Genes (en inglés). Dog Ear Publishing. ISBN 9781457552748.
- ↑ Rogers, Ben; Adams, Jesse; Pennathur, Sumita (28 de octubre de 2014). Nanotechnology: Understanding Small Systems, Third Edition. CRC Press. ISBN 9781482211726.
- ↑ Nahum, Alan M.; Melvin, John W. (9 de marzo de 2013). Lesión accidental: Biomecánica y prevención (en inglés). Springer Science & Business Media. ISBN 9781475722642.
- ↑ Narula, G. K.; Narula, K. S.; Gupta, V. K. (1989). Materials Science (en inglés). Tata McGraw-Hill Education. ISBN 9780074517963.
- ↑ Arnold, Brian (2006- 07-01). id=0ID973WaVBoC&q=fuerte%2C+denso%2C+y+buenos+conductores+de+la+electricidad+y+del+calor+metales&pg=PA58 Fundación de la Ciencia (en inglés). Letts y Lonsdale. ISBN 9781843156567.
- ↑ Grupo, Diagrama (1 de enero de 2009). El Manual de Química de Facts on File (en inglés). Infobase Publishing. ISBN 9781438109558. Archivado desde google.com/books?id=NH23yrRwbU4C&q=fuerte%2C+denso%2C+y+buenos+conductores+de+la+electricidad+y+del+calor+de+los+metales&pg=PA78 el original el 5 de noviembre de 2015. Consultado el 3 de marzo de 2022.
- ↑ Mortimer, Charles E. (1975). Chemistry: A Conceptual Approach (3ª edición). Nueva York: D. Van Nostrad Company. ISBN 0-442-25545-4.
- ↑ Bar-Cohen, Yoseph; Zacny, Kris (4 de agosto de 2009). Perforación en entornos extremos: Penetración y muestreo en la Tierra y otros planetas (en inglés). John Wiley & Sons. ISBN 9783527626632.
- ↑ html «Cerámicas». autocww.colorado.edu. Consultado el 9 de mayo de 2017.
- ↑ Buffat, Ph.; Borel, J.-P. (1976). «Efecto del tamaño en la temperatura de fusión de las partículas de oro». Physical Review A 13 (6): 2287. Bibcode:1976PhRvA..13.2287B.
- ↑ Walter H. Kohl (1995). Handbook of materials and techniques for vacuum devices. Springer. pp. 164-167. ISBN 1-56396-387-6.
- ↑ Shpak, Anatoly P.; Kotrechko, Sergiy O.; Mazilova, Tatjana I; Mikhailovskij, Igor M (2009). «Resistencia a la tracción inherente de los nanocristales de molibdeno». Science and Technology of Advanced Materials 10 (4): 045004. Bibcode:.10d5004S 2009STAdM. .10d5004S. PMC 5090266. PMID 27877304. doi:10.1088/1468-6996/10/4/045004.
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre Sólido.
Wikimedia Commons alberga una categoría multimedia sobre Sólido.

|
A | ||||
|---|---|---|---|---|---|
| Sólido | Líquido | Gas | Plasma | ||
| Desde | Solid | Fusión | Sublimación | ||
| Liquid | Congelación | Evaporación | |||
| Gas | Deposición | Condensación | Ionización | ||
| Plasma | Recombinación | ||||