Grafito
| Grafito | ||
|---|---|---|
 | ||
| General | ||
| Categoría | Minerales elementos nativos | |
| Clase | 1.CB.05a (Strunz) | |
| Fórmula química | C | |
| Propiedades físicas | ||
| Color | gris y gris oscuro | |
| Raya | gris oscuro | |
| Lustre | metálica | |
| Transparencia | no | |
| Sistema cristalino | Hexagonal (6/m 2/m 2/m) | |
| Hábito cristalino | Tabular, de seis caras foliada, las masas granulares compactados | |
| Exfoliación | Perfecta | |
| Fractura | Escamosa, de lo contrario en bruto, cuando no en la división | |
| Dureza | 1-2 (Mohs) | |
| Tenacidad | Escamas finas flexibles y quebradizas | |
| Densidad | 2,09 a 2,23 g/cm³ | |
| Índice de refracción | Opaco | |
| Pleocroísmo | No | |
| Solubilidad | Fundido Ni | |
| Magnetismo | diamagnético | |
El grafito es una de las formas alotrópicas en las que se puede presentar el carbono en la naturaleza. Otras formas son el diamante, la chaoita y la lonsdaleíta. A presión atmosférica y temperatura ambiente el polimorfo más estable es el grafito. Sin embargo, la transformación del diamante en grafito es tan extremadamente lenta que solo es apreciable a escala geológica.
Fue nombrado por Abraham Gottlob Werner en el año 1789. El término grafito deriva del griego γραφειν (graphein) que significa "escribir", ya que se usa principalmente para crear la punta de los lápices. Se conoce también con el nombre vulgar de plombagina. Antiguamente se llamó "molibundasna" (que no debe confundirse con el mineral molibdenita).[1]
Abundancia[editar]
El grafito aparece en rocas metamórficas como resultado de la reducción de los compuestos de carbono de sedimentarias durante el metamorfismo. También se encuentra en rocas ígneas y en meteoritos.[2] Los minerales asociados al grafito son el cuarzo, la calcita, la mica y la turmalina.
En los meteoritos, el grafito se presenta con la troilita y los minerales de silicatos.[2] Los pequeños cristales de grafito en el hierro meteórico se denominan cliftonita.[3] Algunos granos microscópicos tienen composiciones de isótopos distintivas, lo que indica que se formaron antes del Sistema Solar.[4] Son uno de los cerca de 12 tipos de minerales conocidos que son anteriores al Sistema Solar y que también se han detectado en nubes moleculares. Estos minerales se formaron en los materiales eyectados cuando las supernovas explotaron o las estrellas de tamaño bajo o intermedio expulsaron sus envolturas exteriores al final de su vida. El grafito puede ser el segundo o tercer mineral más antiguo del Universo.[5][6]
Aunque puede producirse artificialmente, a partir de carbono amorfo, existen muchos yacimientos naturales de este mineral. Se encuentra en rocas metamórficas, en las que los procesos asociados con su formación han transformado el carbono presente en la materia orgánica que contenía la roca original. Los principales países exportadores de grafito extraído son, por orden de mayor a menor tonelaje: China, Mozambique, Madagascar, Corea del Sur, Rusia, Canadá, Noruega e India.[7]
Tipos y variedades[editar]
Grafito natural[editar]
Los principales tipos de grafito natural, cada uno de ellos presente en distintos tipos de yacimientos de mineral, son los siguientes
- Cristalino pequeñas escamas de grafito (o grafito en escamas) se presenta como partículas aisladas, planas, en forma de placa con bordes hexagonales si no están rotas. Cuando están rotos, los bordes pueden ser irregulares o angulosos.
- Grafito amorfo: el grafito en escamas muy finas a veces se denomina amorfo.[8]
- El grafito en trozos (o grafito en vetas) aparece en fisuras vetas o fracturas y se presenta como intercrecimientos masivos de acicular cristalino fibroso o agregado, y es probablemente de origen hidrotermal.[3]
- Grafito pirolítico altamente ordenado se refiere al grafito con una dispersión angular entre las láminas de grafito inferior a 1°.[9]
- El nombre "fibra de grafito" se utiliza a veces para referirse a fibras de carbono o polímero reforzado con fibra de carbono.
Aparición[editar]
El grafito aparece en rocas metamórficas como resultado de la reducción de compuestos de carbono de sedimentarias durante el metamorfismo. También se encuentra en rocas ígneas y en meteoritos.[2] Entre los minerales asociados al grafito se encuentran el cuarzo, la calcita, la mica y la turmalina. Las principales fuentes de exportación de grafito extraído son, por orden de tonelaje: China, México, Canadá, Brasil y Madagascar.[7]
En meteoritoss, el grafito se presenta con troilita y silicatos.[2] Los pequeños cristales grafíticos en hierro meteórico se denominan cliftonita.[3] Algunos granos microscópicos tienen composiciones isotópicas distintivas, lo que indica que se formaron antes del Sistema solar.[10] Son uno de los 12 tipos conocidos de minerales anteriores al Sistema Solar y también se han detectado en nubes moleculares. Estos minerales se formaron en los eyecta cuando las supernovase explotaron o las estrellas de tamaño bajo a intermedio expulsaron sus envolturas externas al final de sus vidas. El grafito puede ser el segundo o tercer mineral más antiguo del Universo.[11][6]
Estructura[editar]
El grafito está formado por láminas de carbono planar trigonal.[12][13] Las capas individuales se denominan grafeno. En cada capa, los átomos de carbono están dispuestos en una «red en nido de abeja» con una longitud de enlace de 0,142 nm, y la distancia entre planos es de 0,335 nm.[14] La unión entre capas es relativamente débil uniones de van der Waals y suelen estar ocupadas por gases, lo que permite que las capas similares al grafeno se separen fácilmente y se deslicen unas junto a otras.[15]
La conductividad eléctrica perpendicular a las capas es, en consecuencia, unas 1000 veces menor.[16]
Las dos formas de grafito se denominan alfa (hexagonal) y beta (romboidal). Sus propiedades son muy similares. Se diferencian en cuanto al apilamiento de las capas de grafeno: el apilamiento en el grafito alfa es ABA, frente al apilamiento ABC en el grafito beta, energéticamente menos estable y menos común.[17] La forma alfa puede convertirse en la forma beta mediante tratamiento mecánico y la forma beta revierte a la forma alfa cuando se calienta por encima de 1300 °C.[18]
-
Microscopio de efecto túnel. Imagen de la superficie del grafito
-
Vista lateral del apilamiento de capas ABA
-
Vista en plano del apilamiento de capas
-
Estructura cristalina del grafito alfa Celda unitaria
Sistema de la estructura[editar]
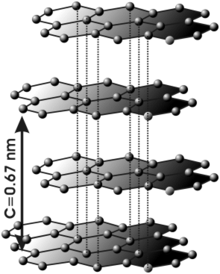
El grafito cristaliza en el sistema hexagonal. En el grafito los átomos de carbono presentan hibridación sp2, esto significa que forma tres enlaces covalentes en el mismo plano a un ángulo de 120° (estructura hexagonal) y que un orbital Π perpendicular a ese plano quede libre (estos orbitales deslocalizados son fundamentales para definir el comportamiento eléctrico del grafito). El enlace covalente entre los átomos de una capa es extremadamente fuerte. Sin embargo, las uniones entre las diferentes capas se realizan por fuerzas de Van der Waals e interacciones entre los orbitales Π, y son mucho más débiles.Se podría decir que el grafito está constituido por láminas de grafeno superpuestas. Esta estructura laminar hace que el grafito sea un material marcadamente anisótropo.
Termodinámica[editar]

Las condiciones de presión y temperatura de equilibrio para una transición entre grafito y diamante están bien establecidas teórica y experimentalmente. La presión cambia linealmente entre 1,7 GPa a 0 K y 12 GPa a 5000 K (el punto triple del diamante/grafito/líquido).[19][20]
Sin embargo, las fases tienen una amplia región alrededor de esta línea donde pueden coexistir. En condiciones estándar de temperatura y presión|temperatura y presión normales, 20 grados Celsius (293,2 K) y 1 atmósfera (0,1 MPa), la fase estable del carbono es el grafito, pero el diamante es metaestable y su tasa de conversión a grafito es despreciable.[21] Sin embargo, a temperaturas superiores a aproximadamente 4500 K, el diamante se convierte rápidamente en grafito. La rápida conversión de grafito en diamante requiere presiones muy por encima de la línea de equilibrio: a 2000 K, se necesita una presión de 35 GPa.[19]
Propiedades[editar]
El grafito es de color negro y gris con brillo metálico, refractario y se exfolia con mucha facilidad. En la dirección perpendicular a las capas presenta una conductividad de la electricidad baja, que aumenta con la temperatura, comportándose pues como un semiconductor. A lo largo de las capas la conductividad es mayor y aumenta proporcionalmente a la temperatura, comportándose como un conductor semimetálico. Aunque tanto el grafito como el diamante están formados exclusivamente por átomos de carbono, el grafito es muy blando y opaco, mientras que el diamante es el mineral más duro según la escala de Mohs y además deja pasar la luz a través de sí. Estas marcadas diferencias físicas se deben exclusivamente a las diferentes redes cristalinas o retículos sobre las que se disponen los átomos de carbono en el grafito (átomos de carbono en los vértices de prismas hexagonales) y en el diamante (la red cristalina está hecha de tetraedros regulares cuyos vértices son átomos de carbono).
Aplicaciones[editar]
- El grafito mezclado con una pasta se utiliza para fabricar la mina de los lápices.
- Se usa como componente de ladrillos refractarios, crisoles, etc.
- Al deslizarse las capas fácilmente en el grafito, resulta ser un buen lubricante sólido.
- Se utiliza en la fabricación de diversas piezas en ingeniería, como pistones, juntas, arandelas, rodamientos, etc.
- Debido a su conductividad eléctrica y a su resistencia química se usa para fabricar electrodos. También tiene otras aplicaciones eléctricas, como los carbones de un motor (escobillas), que entran en contacto con el colector.
- Se emplea en reactores nucleares, como moderador.
- Es utilizado el arte no convencional; en pequeñas esculturas en la mina de un lápiz , como las realizadas por los artistas y escultores: el ruso Salavat Fidai, Henry Quesada de Costa Rica y Jasenko Dordević de Bosnia, entre otros.
Síntesis artificial del grafito[editar]
En 1893, Charles Street de Le Carbone descubrió un proceso para fabricar grafito artificial. A mediados de la década de 1890, Edward Goodrich Acheson (1856-1931) inventó accidentalmente otra forma de producir grafito sintético tras sintetizar carborundo (carburo de silicio o SiC). Descubrió a diferencia del carbono puro, producía grafito casi puro. Al estudiar los efectos de las altas temperaturas en el carborundo, descubrió que el silicio se vaporiza a unos 4150 °C (7500 °F), dejando el carbono en grafito. Este grafito se hizo valioso como lubricante.[3]
La técnica de Acheson para producir carburo de silicio y grafito recibe el nombre de proceso Acheson. En 1896, Acheson recibió una patente por su método para sintetizar grafito,[22] y en 1897 comenzó la producción comercial.[3] En 1899 se formó la Acheson Graphite Co.
El grafito sintético también puede prepararse a partir de la poliimida y se comercializa así.[23][24]
Compuestos de intercalación de grafito[editar]
Distintas moléculas o iones pueden penetrar en las capas del grafito. Por ejemplo, el potasio puede ceder un electrón al grafito, quedando el ion de potasio entre las capas. Este electrón contribuye a aumentar la conductividad que presentaba el carbono.
Se pueden preparar diferentes compuestos de intercalación con distintas estequiometrías y distintas especies. En algunos casos la conductividad resultante es mayor, como en el caso del potasio, y es lo que ocurre generalmente, pero en otros, como por ejemplo con flúor, es en menor medida.
Otras formas relacionadas[editar]
Existen otras formas llamadas de carbón amorfo que tienen una estructura relacionada con la del grafito:
- Carbón vegetal y carbón activado
- Negro de humo
- Fibra de carbono
- Carbón pirolítico
- Protección pasiva contra incendios
- Grafeno
- Fullereno
- Minerales elementos
Referencias[editar]
- ↑ «Graphite. Mindat».
- ↑ a b c d Anthony, John W.; Bideaux, Richard A.; Bladh, Kenneth W. et al., eds. (1990). «Graphite». Handbook of Mineralogy. Vol. I (Elements, Sulfides, Sulfosalts). Chantilly, VA: Mineralogical Society of America. ISBN 978-0962209703.
- ↑ a b c d e graphite. Encyclopædia Britannica Online. (en inglés)
- ↑ Maria, Lugaro (2005). Stardust From Meteorites: An Introduction To Presolar Grains. World Scientific. pp. 14, 154-157. ISBN 9789814481373.
- ↑ Hazen, R. M.; Downs, R. T.; Kah, L.; Sverjensky, D. (13 de febrero de 2013). «Evolución de los minerales de carbono». Reviews in Mineralogy and Geochemistry 75 (1): 79-107. Bibcode:2013RvMG...75...79H. doi:10.2138/rmg.2013.75.4.
- ↑ a b McCoy, T. J. (22 de febrero de 2010). «Evolución mineralógica de los meteoritos». Elements 6 (1): 19-23. doi:10.2113/gselements.6.1.19.
- ↑ a b Coalición para la Educación sobre los Minerales, ed. (2018). «Grafito». Base de datos de minerales. Consultado el 9 de diciembre de 2018. Error en la cita: Etiqueta
<ref>no válida; el nombre «MineralsDatabase» está definido varias veces con contenidos diferentes - ↑ Sutphin, David M.; James D. Bliss (August 1990). «Grafito en escamas diseminado y tipos de yacimientos de grafito amorfo; un análisis utilizando modelos de ley y tonelaje». CIM Bulletin 83 (940): 85-89.
- ↑ Unión Internacional de Química Pura y Aplicada. «grafito pirolítico altamente orientado». Compendium of Chemical Terminology. Versión en línea (en inglés).
- ↑ Lugaro, Maria (2005). Polvo de estrellas de meteoritos: An Introduction To Presolar Grains. World Scientific. pp. 14, 154-157. ISBN 9789814481373.
- ↑ Hazen, R. M.; Downs, R. T.; Kah, L.; Sverjensky, D. (13 de febrero de 2013). «Evolución de los minerales de carbono». Reviews in Mineralogy and Geochemistry 75 (1): 79-107. Bibcode:2013RvMG...75...79H. doi:10.2138/rmg.2013.75.4.
- ↑ Delhaes, Pierre (2000). «Polimorfismo del carbono». En Delhaes, Pierre, ed. Grafito y precursores. Gordon & Breach. pp. 1-24. ISBN 9789056992286.
- ↑ Pierson, Hugh O. (2012). Handbook of carbon, graphite, diamond, and fullerenes : properties, processing, and applications. Noyes Publications. pp. 40-41. ISBN 9780815517399.
- ↑ Delhaes, P. (2001). id=7p2pgNOWPbEC&pg=PA146 Graphite and Precursors. CRC Press. ISBN 978-90-5699-228-6.
- ↑ Chung, D. D. L. (2002). «Review Graphite». Journal of Materials Science 37 (8): 1475-1489. S2CID 189839788. doi:10.1023/A:1014915307738.
- ↑ Pierson, Hugh O. (1993). Handbook of carbon, graphite, diamond, and fullerenes : properties, processing, and applications. Park Ridge, N.J.: Noyes Publications. ISBN 0-8155-1739-4. OCLC 49708274.
- ↑ Latychevskaia, Tataiana; Son, Seok- Kyun; Yang, Yaping; Chancellor, Dale; Brown, Michael; Ozdemir, Servet; Madan, Ivan; Berruto, Gabriele; Carbone, Fabrizio; Mishchenko, Artem; Novoselov, Kostya (2019- 08-17). «Transición de apilamiento en grafito romboédrico». Frontiers of Physics 14 (1). 13608. Bibcode:2019FrPhy..1413608L. S2CID 125322808. arXiv:1908.06284.
- ↑ Unión Internacional de Química Pura y Aplicada. «Grafito romboédrico». Compendium of Chemical Terminology. Versión en línea (en inglés).
- ↑ a b Bundy, P.; Bassett, W. A.; Weathers, M. S.; Hemley, R. J.; Mao, H. K.; Goncharov, A. F. (1996). «El diagrama de fases y transformaciones presión-temperatura del carbono; actualizado hasta 1994». Carbon 34 (2): 141-153.
- ↑ Wang, C. X.; Yang, G. W. (2012). «Enfoques termodinámicos y cinéticos del diamante y nanomateriales relacionados formados por ablación láser en líquido». Ablación láser en líquidos : principios y aplicaciones en la preparación de nanomateriales. Pan Stanford Pub. pp. 164-165. ISBN 9789814241526.
- ↑ Rock, Peter A. (1983). Termodinámica Química. University Science Books. pp. 257-260. ISBN 9781891389320.
- ↑ Acheson, E. G. "Manufacture of Graphite", Patente USPTO n.º 568323, emitida el 29 de septiembre de 1896.
- ↑ Kato, Tomofumi; Yamada, Yasuhiro; Nishikawa, Yasushi; Ishikawa, Hiroki; Sato, Satoshi (30 de junio de 2021). «Carbonization mechanisms of polyimide: Methodology to analyze carbon materials with nitrogen, oxygen, pentagons, and heptagons». Carbon 178: 58-80. ISSN 0008-6223. S2CID 233539984. doi:10.1016/j.carbon.2021.02.090.
- ↑ Kato, Tomofumi; Yamada, Yasuhiro; Nishikawa, Yasushi; Otomo, Toshiya; Sato, Hayato; Sato, Satoshi (12 de julio de 2021). «Origins of peaks of graphitic and pyrrolic nitrogen in N1s X-ray photoelectron spectra of carbon materials: quaternary nitrogen, tertiary amine, or secondary amine?». Journal of Materials Science 56 (28): 15798-15811. Bibcode:2021JMatS..5615798K. ISSN 1573-4803. S2CID 235793266. doi:10.1007/s10853-021-06283-5.
Enlaces externos[editar]
 Wikimedia Commons alberga una galería multimedia sobre Grafito.
Wikimedia Commons alberga una galería multimedia sobre Grafito. Wikcionario tiene definiciones y otra información sobre grafito.
Wikcionario tiene definiciones y otra información sobre grafito.- El Grafito.
- The Graphite Page (en inglés).
- Web con mucha información sobre el grafito.
- Carbón.




