Atorvastatina
| Atorvastatina | ||
|---|---|---|
 | ||
| Nombre (IUPAC) sistemático | ||
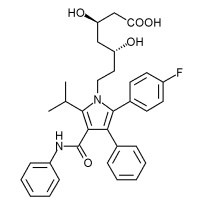
| Ácido(3''R'',5''R'')-7-[2-(4-fluorofenil)-3-fenil-4-(fenilcarbamoil) -5-propan-2-ilpirrol-1-il]-3,5-dihidroxiheptanoico | ||
| Identificadores | ||
| Número CAS | 134523-00-5 | |
| PubChem | 60823 | |
| Datos químicos | ||
| Fórmula | C33H35N2FO5 | |
| Peso mol. | 558.64 g/mol | |
| Sinónimos | Atrovastina, Atorvastatina | |
| Farmacocinética | ||
| Biodisponibilidad | 14% | |
| Unión proteica | >98% | |
| Metabolismo | Hepático. | |
| Vida media | 14 horas. | |
| Excreción | Bilis. Orina (2%) | |
| Datos clínicos | ||
| Cat. embarazo | X | |
| Vías de adm. | Oral. | |
La Atorvastatina es un fármaco de la familia de las estatinas utilizado para disminuir los niveles de colesterol en sangre y en la prevención de enfermedades cardiovasculares. También estabiliza las plaquetas y previene la embolia mediante el mecanismo antiinflamatorios. Su importancia es grande, dada la consideración del colesterol como factor de riesgo cardiovascular. Debemos tener presente que el colesterol es esencial para la vida y reducir la síntesis de colesterol farmacológicamente o mediante dietas puede ocasionar fisiopatologías graves(;[1][2]). Existen posiciones altamente críticas con el uso de la Atorvastatina o cualquier otro fármaco como tratamiento preventivo. Incluso se ha llegado a afirmar la falta de evidencias empíricas y de investigación neutral sobre el colesterol como factor de riesgo para accidentes cardiovasculares (;[3][4]).
Como todas las estatinas, la Atorvastatina inhibe HMG-CoA reductasa, una enzima encontrada en el tejido del hígado que juega un rol importante en la producción de colesterol en el cuerpo, pero a diferencia de otras estatinas como la simvastatina y pravastatina, la atorvastatina es un compuesto completamente sintético, fue sintetizada por primera vez en 1985 por Bruce Roth mientras trabajaba en la Parke-Davis Warner-Lambert Company (ahora Pfizer). Es importante tener en cuenta que la inhibición de HMG-CoA reductasa por atorvastatina o cualquier otro tipo de estatina tiene efectos secundarios no deseados. HMG-CoA reductasa es una enzima que forma parte de la ruta metabólica del ácido mevalónico, la cual es común para la síntesis de la Q10 en humanos, una conezima imprescindible para la producción de energía en las mitocondrias (;[5][6]). Así, todas las estatinas consiguen inhibir la síntesis de colesterol, que ya de por sí no es recomendable, además se inhibe la síntesis de coenzima Q10, provocando una disminución de la energía necesaria para vivir, cuyos síntomas se manifiestan fundamentalmente en los tejidos con mayores requerimientos energéticos como son el músculo esquelético, el cerebro o los riñones, de ahí las dolencias, miopatías (dolores musculares de las extremidades) manifestadas por un porcentaje elevado de pacientes consumidores de estatinas.
Descripción
Su principal uso es para el tratamiento de [dislipidemia] y la prevención de enfermedades cardiovasculares.
Farmacocinética
La Atorvastatina se absorbe con un tiempo aproximado de concentración de plasma máxima (Tmax) de 1-2 horas. La biodisponibilidad absoluta del fármaco es aproximadamente 14%, sin embargo, la disponibilidad sistemática para la actividad HMG-CoA reductasa es aproximadamente 30%. La depuración de la Atorvastatina se realiza en el intestino alto y se produce el metabolismo de primer paso (también llamado efecto de primer paso o metabolismo sistémico), que es la principal causa de la baja disponibilidad sistémica. El consumo de Atorvastatina con comida produce un 25% de la reducción en Cmax (velocidad de absorción) y un 9% de reducción en la extensión de la concentración (área bajo la curva, integral después de una o varias dosis o extensión de absorción), a pesar de que el alimento no afecta la eficacia de la disminución de la Lipoproteína de Baja Densidad C (cantidad de colesterol contenido en Lipoproteínas de Baja Densidad) de la Atorvastatina. La administración de dosis nocturnas favorece la reducción de Cmax (velocidad de absorción) y la extensión de concentración (extensión de absorción) en 30%. De cualquier manera, el tiempo de administración de Atorvastatina no afecta la eficacia en la disminución de lipoproteínas de baja densidad C.
La Atorvastatina es un puente proteico mayor o igual al 98%.
El mecanismo primario propuesto del metabolisto de la Atorvastatina es mediante Citocromo P450 3A4 hidroxilación para formar los metabolitos activos orto y parahidroxilados. Los metabolitos orto y parahidroxilados son responsables del 70% de la actividad sistémica HMG-CoA reductasa. El metabolito Orto hidroxi lleva a cabo el siguiente metabolismo mediante glucoronidación. Como sustrato para la isozima CYP3A4, ha mostrado suseptibilidad a inibidores e inductores de CYP3A4 para incrementar o deprimir la concentración plásmica respectivamente. Esta interacción fue probada in vitro con la administración de eritromicina, una isozima CPY3A4 inhibidora, lo cual resulto en incrementos de la concentración plásmica de Atorvastatina. la Atorvastatina es también un inhibidor de citocromo 3A4.
La Atorvastatina es también un sustrato del efluente de P-glicoproteína intestinal, el cual bombea el fármaco de regreso hacia el lumen intestinal durante la absorción del fármaco.
Farmacogénetica
Se ha encontrado que muchos polimorfismos están asociados con una alta incidencia de efectos secundarios de Atorvastatina. Se sospecha que este fenómeno está relacionado con el incremento de los niveles de metabolitos farmacológicamente activos, tales como Atorvastatina lactosa y p-hidroxiatorvastatina. La Atorvastatina y sus metabolitos activos pueden ser monitoreados en pacientes potencialmente susceptibles usando técnicas específicas de cromatografía.
Vías de administración (formas de uso)
Vía oral.
Absorción
Se absorbe rápidamente por vía oral, alcanzando niveles máximos en sangre de una a dos horas después de la administración. La presencia de alimentos en el estómago puede llegar a disminuir la absorción hasta en un 25 %. La biodisponibilidad es de un 14% aproximadamente.
Distribución
La unión a proteínas plasmáticas está en torno al 98%. En ratas se ha demostrado que pasa a leche en madres lactantes.
Metabolismo y metabolitos
Como el resto de estatinas sufre efecto de primer paso hepático. Parece que en su metabolismo hepático depende del CYP3A4, originando derivados (orto- y para-) hidroxilados de actividad farmacológica similar a la atorvastatina, así como derivados β-oxidados. En animales se ha comprobado que los derivados orto-hidroxilados sufren posterior glucuronidación.
Excreción
La atorvastatina y sus metabolitos se eliminan de forma preferente a través de la bilis, aunque no parece estar afectada por mecanismos de recirculación enterohepática. Un mínimo 2% puede encontrarse en orina. La vida media de eliminación es de unas 14 horas, aunque la semivida de la actividad se mantiene hasta casi 30 horas, probablemente debido a la actividad de los metabolitos.
Farmacodinámica

Mecanismo de acción
Las estatinas son inhibidoras de la 3-hidroxi-3-metilglutaril-coenzima A (HMG-CoA) reductasa. Esta enzima cataliza la conversión de la HMG-CoA a mevalonato, que es un metabolito clave en la biosíntesis de colesterol. Su bloqueo se produce debido al gran parecido estructural que exhiben estos fármacos con el HMG-CoA. En el esquema adjunto puede observarse el nivel de bloqueo de las estatinas así como de otras sustancias en la biosíntesis del colesterol.
En la que una molécula de HMG-CoA se reduce mediante la actuación de la HMG-CoA reductasa y la coenzima NADPH dando como resultado Mevalonato y CoA. La inhibición de la enzima se realiza de forma competitiva, parcial y reversible.
El bloqueo de la síntesis hepática del colesterol produce una activación de las proteínas reguladoras SREBP (sterol regulatory elements-binding proteins), que activan la transcripción de proteínas y, por tanto, producen una mayor expresión del gen del receptor de LDL y un aumento en la cantidad de receptores funcionales en el hepatocito.[7]
Efectos
Como consecuencia de la inhibición de la HMG-CoA disminuyen los niveles de colesterol total y LDL, sustancias íntimamente relacionadas con la arteriosclerosis y el aumento del riesgo cardiovascular. La apolipoproteína B también disminuye sustancialmente durante el tratamiento con atorvastatina. Además, algunas aumentan moderadamente el C-HDL y reducen los triglicéridos plasmáticos. Como resultado de estos cambios, el cociente entre Colesterol total y Colesterol HDL, así como el cociente entre Colesterol LDL y Colesterol HDL se reducen.
En la insuficiencia hepática, las concentraciones del fármaco en el plasma son significativamente afectadas por las enfermedades del hígado. Los pacientes con padecimientos hepáticos en el estado A muestran un incremento de 4 veces en Cmax y la extensión de concentración (extensión de absorción). Los pacientes que se encuentran en el estado B muestran un incremento por 16 en Cmax y 11 veces la extensión de concentración (área bajo la curva).
Los pacientes geriátricos (mayor a 65 años) exhiben farmacocinética alterada de Atorvastatina comparada con los adultos jóvenes, con una media en la extensión de concentración (integral después de la dosis) y en Cmax de 40% y 30% mayor respectivamente. Adicionalmente, est os pacientes sanos muestran una mayor respuesta farmacodinámica a la Atorvastatina en cualquier dosis, por ello, esta población puede tener menores dosis efectivas.
Interacciones
Interacciones farmacodinámicas
Como ya se comentó anteriormente, tanto los fibratos como la niacina (ácido nicotínico) aumentan el riesgo de miopatía asociado a la atorvastatina. Esto es especialmente importante en el caso del gemfibrozilo, el cual además interfiere con el metabolismo hepático a nivel del CYP3A4. Los estudios realizados con fenofibrato hacen pensar que esta asociación estaría libre de tal riesgo, no habiéndose realizado estudios con otros fibratos.[8]
Interacciones farmacocinéticas
Una gran parte de las interacciones de la atorvastatina, como del resto de las estatinas, vendrá determinada por el hecho de ser sustrato de la CYP3A4. Los inhibidores del CYP3A4 aumentan la actividad de la atorvastatina y sus efectos secundarios. Por el contrario, los inductores lo disminuirán, y por tanto rebajarán la eficacia de la misma. Así, en relación con el metabolismo hepático nos podemos encontrar:
|
Potentes
|
Otros
|
|
Algunos alimentos también pueden interaccionar. No se recomienda tomar atorvastatina y grandes cantidades de zumo de pomelo (inhibidor). [9]
Los suplementos de vitamina D disminuye atorvastatina y las concentraciones de metabolitos activos, sin embargo, reduce sinérgicamente LDL y las concentraciones de colesterol total.[10] Componentes del zumo de pomelo son inhibidores de CYP3A4 intestinal conocidos. La administración conjunta de zumo de pomelo con atorvastatina puede causar un aumento de la Cmax y AUC, lo que puede dar lugar a reacciones adversas o toxicidad por sobredosis.[11]
Otras interacciones de la atorvastatina no dependientes del CYP3A4 son:
.| Fármaco. | Resultados de la interacción. |
|---|---|
| Ciclosporina. | Aumentan los niveles de atorvastatina. |
| Antiácidos. | Disminuyen hasta en un 35% la concentración plasmática. |
| Colestipol y otras resinas. | Disminuyen hasta en un 25% los niveles plasmáticos de atorvastatina. |
| Digoxina. | Aumentan en un 20% los niveles de digoxina. |
| Anticonceptivos orales. | Aumentan hasta un 30% los niveles de hormonales en sangre. |
Uso clínico
La atorvastatina es usada para el control de la hipercolesterolemia y en la prevención de la enfermedad cardiovascular. NECESITA REFERENCIA
Ensayos clínicos
Son cientos los estudios realizados sobre la atorvastatina para corroborar su eficacia tanto en la prevención primaria como secundaria de la enfermedad cardiovascular, o incluso para compararla con otros fármacos hipolipemiantes. Por su potencia estadística o la calidad del diseño, podemos destacar:
- Estudio CARDS (Collaborative Atorvastatin Diabetes Study), con 2838 pacientes tratados con atorvastatina.[12]
- Estudio CHESS (Comparative HDL Efficacy and Safety Study ), realizado sobre 917 pacientes, comparando la simvastatina con la atorvastatina a altas dosis.[13]
- Estudio STELLAR (Statin Therapies for Elevated Lipid Levels compared Across doses to Rosuvastatin). Estudio aleatorio abierto que compara la eficacia de rosuvastatina frente a atorvastatina, pravastatina y simvastatina a dosis variables en pacientes con hipercolesterolemia primaria.[14]
- Estudio ADVOCATE (the ADvicor Versus Other Cholesterol-Modulating Agents Trial Evaluation).[15]
- Estudio MIRACL (Myocardial Ischemia Reduction with Aggressive Cholesterol Lowering Study), con 3086 pacientes y altas dosis de atorvastatina.[16]
- Estudio ASCOT-LLA (Anglo-Scandinavian Cardiac Outcomes Trial- Lipid Lowering Arm), con 10.305 pacientes y estudio de la atorvastatina.[17]
- Estudio PROVE IT (Pravastatin or Atorvastatin Evaluation and Infection therapy-Thrombolysis in myocardial Infarction), con 4162 pacientes y comparación de atorvastatina a altas dosis con pravastatina.[18]
- Estudio TNT (Treating to New Targets), con 10.001 pacientes y comparación entre altas y bajas dosis de atorvastatina.[19]
- Estudio 3T (Treat-To-Target Study), con 1087 pacientes con enfermedad cardiovascular y dislipemia, tratados con atorvastatina o simvastatina.[20]
- Estudio COMETS (COmparative study with rosuvastatin in subjects with METabolic Syndrome). Estudio aleatorio, doble ciego de 12 semanas de duración que compara el efecto de la rosuvastatina frente a atorvastatina y placebo sobre los niveles de colesterol LDL en pacientes con síndrome metabólico y riesgo cardiovascular a 10 años inferior al 10%.[21]
- Estudio ECLIPSE (An Evaluation to Compare Lipid lowering effects of rosuvastatin and atorvastatin In force titrated subjects: a Prospective Study of Efficacy and tolerability). Estudio aleatorio de 24 semanas de duración que compara la eficacia de rosuvastatina y atorvastatina en pacientes con hipercolesterolemia primaria y riesgo cardiovascular a los 10 años superior al 20%.[22]
- Estudio PULSAR (Prospective study to evaluate the Utility of Low doses of the Statins Atorvastatin and Rosuvastatin). Estudio aleatorio abierto que compara la seguridad y eficacia de rosuvastatina y atorvastatina a bajas dosis en pacientes con hipercolesterolemia y riesgo cardiovascular a los 10 años superior al 20%.[23]
- Estudio POLARIS (Prospective Optimisation of Lipids by Atorvastatin or Rosuvastatin Investigated in high-risk Subjects with hypercholesterolaemia). Estudio aleatorio doble ciego de 26 semanas de duración que compara la eficacia y seguridad de la rosuvastatina y la atorvastatina en pacientes con hipercolesterolemia y riesgo cardiovascular a los 10 años superior al 20%.[24]
- Estudio URANUS (the Use of Rosuvastatin versus Atorvastatin iN type 2 diabetes mellitUS). Estudio aleatorio, doble ciego, que compara en pacientes diabéticos tipo II la respuesta del colesterol LDL ante el tratamiento con rosuvastatina o atorvastatina.[25]
- Estudio ANDROMEDA (A raNdomized, Double-blind study to compare Rosuvastatin [10 & 20 mg] and atOrvastatin [10 & 20 Mg] in patiEnts with type II DiAbetes).[26]
- Estudio CORALL (COmpare Rosuvastatin [10–40 mg] with Atorvastatin [20–80 mg] on apo B/apo A-1 ratio in patients with type 2 diabetes meLLitus and dyslipidaemia).
- Estudio AVERT (Atorvastatin versus Revascularizacion Treatment), con 341 pacientes y utilizando la atorvastatina.[27]
- Estudio MARS (the Monitored Atherosclerosis Regression Study), con 188 pacientes y valoración de la lovastatina.[28]
- Estudio REVERSAL (the REVERSing atherosclerosis with Aggressive Lipid lowering study), comparando pravastatina y atorvastatina en 654 pacientes.[29]
- Estudio IDEAL (the Incremental Decrease in Endpoints through Aggressive Lipid lowering trial), comparando atorvastatina y simvastatina en 8.888 pacientes mayores de 80 años.[30]
- Estudio de las 3 provincias. Interesantísimo estudio retrospectivo realizado en tres provincias de Canadá con 18.637 pacientes con infarto de miocardio previo, en los que se comparó la efectividad de cinco estatinas (atorvastatina, pravastatina, simvastatina, lovastatina y fluvastatina) en la prevención secundaria.[31]
Indicaciones
- Hipercolesterolemia.
- Hipercolesterolemia primaria o dislipidemia mixta.
- Hipercolesterolemia familiar homozigota.
- Prevención cardiovascular.
- Reducción de la morbimortalidad cardiovascular en pacientes con enfermedad cardiovascular aterosclerótica manifiesta.
- Reducción de la morbimortalidad cardiovascular en pacientes con diabetes mellitus, con niveles de colesterol normales o elevados.
- Tratamiento complementario a la corrección de otros factores de riesgo y otros tratamientos cardioprotectores.
Efectos adversos
Para la valoración de las reacciones adversas (RAM) se tendrán en cuenta los criterios de la CIOSM.
| Sistema implicado. | Grupo CIOSM. | Tipo de reacción. |
| Trastornos gastrointestinales. | Frecuentes. | Estreñimiento, flatulencia, dispepsia, náuseas, diarrea. |
| Poco frecuentes. | Anorexia, vómitos. | |
| Raras. | Hepatitis, ictericia colestática. | |
| Muy raras. | Insuficiencia hepática. | |
| Trastornos del sistema nervioso. | Frecuentes. | Dolor de cabeza, mareo, parestesias, hipoestesia. |
| Poco frecuentes. | Neuropatía periférica. | |
| Muy raras. | Disgeusia. | |
| Piel y anexos. | Frecuentes. | Erupción cutánea, prurito. |
| Poco frecuente. | Urticaria. | |
| Muy raras. | Edema angioneurótico, erupción ampollosa (incluyendo eritema multiforme, síndrome de Stevens-Johnson y necrólisis epidérmica tóxica). | |
| Trastornos musculoesqueléticos. | Frecuentes, | Mialgias, artralgias. |
| Poco frecuentes. | Miopatía. | |
| Raras. | Miositis, rabdomiolisis, calambres musculares. | |
| Muy raros. | Rotura tendinosa. | |
| Trastornos endocrinos. | Poco frecuentes. | Alopecia, hiperglucemia, hipoglucemia, pancreatitis. |
| Psiquiátricos. | Frecuentes. | Insomnio. |
| Poco frecuentes. | Amnesia. | |
| Trastornos generales. | Frecuentes. | Astenia, dolor torácico, dolor de espalda, edema periférico, fatiga. |
| Poco frecuentes. | Malestar, aumento de peso. | |
| Varios. | Frecuentes. | Reacciones alérgicas. |
| Poco frecuentes. | Trombocitopenia, acúfenos, impotencia. | |
| Muy raras. | Alteraciones visuales o auditivas, ginecomastia, anafilaxia. | |
En febrero del 2012, la FDA emitió un comunicado según el cual ciertas drogas reductoras del colesterol aumentan el riesgo de padecer diabetes tipo 2.[32]
Contraindicaciones
Serán contraindicaciones absolutas:
- Hipersensibilidad a atorvastatina o a cualquiera de los excipientes de las presentaciones comerciales.
- Hepatopatía activa o elevaciones persistentes e inexplicables de las transaminasas séricas.
- Embarazo y lactancia.
- Administración concomitante de inhibidores potentes de la CYP3A4 (itraconazol, ketoconazol, inhibidores de la proteasa del HIV, eritromicina, claritromicina, telitromicina y nefazodona).
Serán contraindicaciones relativas (se puede tomar pero será necesario un especial control médico):
- Ancianos (edad > 70 años).
- Antecedentes personales o familiares de trastornos musculares hereditarios.
- Antecedentes de toxicidad muscular con una estatina o un fibrato.
- Alcoholismo.
- Administración concomitante de inhibidores débiles de la CYP3A4.
Presentaciones
Comprimidos recubiertos con 10, 20, 40 y 80 mg.
Entre los excipientes habituales para este producto nos podemos encontrar:
- Lactosa monohidrato
- Celulosa microcristalina (E460 I)
- Polisorbato 80
- Hidroxipropilcelulosa (E463)
- Croscarmelosa sódica
- Butilhidroxianisol (E320)
- Estearato de magnesio (E470 B)
- Fosfato trisódico (E450 II)
- Hipromelosa
- Dióxido de titanio (E171)
- Triacetato de glicerol
Referencias.
- ↑ Stephen T. Sinatra, et al. 2014. The Saturated Fat, Cholesterol, and Statin Controversy. Journal of the American College of Nutrition, Vol. 33, No. 1, 79–88
- ↑ Michel de Lorgeril and Patricia Salen 2006. Cholesterol lowering and mortality: Time for a new paradigm?. Nutrition, Metabolism & Cardiovascular Diseases. 16, 387e 390
- ↑ Ravnskov U 2002. A hypothesis out-of-date: The diet–heart idea. Magle Stora Kyrkogata 9
- ↑ Ravnskov U 2002. Is atherosclerosis caused by high cholesterol? Q J Med;95:397e403
- ↑ Mikael Turunen 2004. Metabolism and function of coenzyme Q. Biochimica et Biophysica Acta 1660 171– 199
- ↑ Catarina M. Quinzii and Michio Hirano 2010. Coenzyme Q and Mitochondrial Disease. Dev Disabil Res Rev. 16(2):183–188
- ↑ Nissen S, Tuzcu M, Schoenhagen P, Brown BG, Ganz P, Vogel RA, et al.. Effect of intensive compared with moderate lipid-lowering therapy on progression of coronary atherosclerosis. JAMA. 2004;291:1071-80.
- ↑ Brown WV.Review of clinical studies of fenofibrate in combination with currently approved lipid-lowering drugs. Cardiology. 1989;76 Suppl 1:45-51; discussion 52-4. Review.
- ↑ Ministerio de Sanidad y Política Social. «Ficha técnica atorvastatina». Agencia Española del Medicamento y Productos Sanitarios. Consultado el 14 de noviembre de 2010.
- ↑ Schwartz JB (February 2009). "Effects of vitamin D supplementation in atorvastatin-treated patients: a new drug interaction with an unexpected consequence". Clin. Pharmacol. Ther. 85 (2): 198–203. doi:10.1038/clpt.2008.165. PMID 18754003.
- ↑ Kane GC, Lipsky JJ (September 2000). "Drug-grapefruit juice interactions". Mayo Clinic Proceedings 75 (9): 933–42. doi:10.4065/75.9.933. PMID 10994829.
- ↑ Colhoun HM, Betteridge DJ, et al, on behalf of the CARDS investigators. Primary prevetion of cardiovacular disease with atorvastatin in type 2 diabetes in the Collaborative Atorvastatin Diabetes Study (CARDS): multicentre randomised placebo-controllede trial. N Engl J Med 2004;364:685-96.
- ↑ Ballantyne CM, Blazing MA, et al. Effect on high-density lipoprotein cholesterol of maximum dose simvastatin and atorvastatin in patients with hypercholesterolemia: results of the Comparative HDL Efficacy and Safety Study (CHESS). Am Heart J 2003; 146:862-9.
- ↑ Jones P, Davidson M, Stein E, et al. Comparison of the Efficacy and Safety of Rosuvastatin Versus Atorvastatin, Simvastatin, and Pravastatin Across Doses (STELLAR Trial). Am J Cardiol 2003;92:152-160.
- ↑ Bays HE, Dujovne CA,et al. ADVOCATE Group. Comparison of once-daily, niacin extended-release/lovastatin with standard doses of atorvastatin and simvastatin (the ADvicor Versus Other Cholesterol-Modulating Agents Trial Evaluation [ADVOCATE]). Am J Cardiol 2003;91:667–72.
- ↑ Schwartz GG, Olsson AG, Ezekowitz MD, Ganz P, Oliver MF, Waters, et al.. Myocardial Ischemia Reduction with Aggressive Cholesterol Lowering (MIRACL) study Investigators. The effects of atorvastatin on early recurrent ischemic events in acute coronary syndromes: the MIRACL study: a randomized controlled study. JAMA 2001;285:1711-8.
- ↑ Sever PS, Dahlöf B, Poulter NR, et al, for the ASCOT investigators. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations, in the Anglo-Scandinavian Cardiac Outcomes Trial- Lipid Lowering Arm (ASCOT-LLA): a multicentre randomised controlled trial. The Lancet 2003;361:1.149-58.
- ↑ Cannon CP, Braunwald E, et al, for the Pravastatin or Atorvastatin Evaluation and Infection therapy-Thrombolysis in myocardial Infarction 22 Investigators. Intensive versus moderate lipid lowering with statins after acute coronary syndromes. N Engl J Med 2004;350:1.495-504 Disponible en [1]
- ↑ LaRosa JC, Grundy SM, Waters DD, Shear C, Barter P, Fruchart JC, et al, for the Treating to New Targets (TNT) investigators. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med 2005;352:1425-35
- ↑ Olsson AG, Eriksson M, et al. A 52-week, multicenter, randomized, parallel-group, double-blind, double-dummy study to assess the efficacy of atorvastatin and simvastatin in reaching low-density lipoprotein cholesterol and triglyceride targets: the treat-to-target (3T)study. Clin Ther 2003;25:119-38
- ↑ Stalenhoef AFH, Ballantyne CM, Sarti, C et al. A Comparative study with rosuvastatin in subjects with METabolic Syndrome: rationale and design of the COMETS study. Diabetes Metab 2003;29(Suppl): 4S318 Abstract 2559.
- ↑ Faergeman O, Sosef F, Duffield E, On behalf of the ECLIPSE Study Investigators. Efficacy and tolerability of rosuvastatin and atorvastatin when force-titrated in high-risk patients: results from the ECLIPSE Study. Atheroscler Suppl 2006;7:580.
- ↑ Clearfield M, Kallend D, Palmer M, et al. Efficacy and safety of rosuvastatin 10mg versus atorvastatin 20mg: Results of the PULSAR study. Atherosclerosis Supplements 2005;6(1): 104
- ↑ Leiter LA, Palmer M, Sosef F et al. Rosuvastatin 40 mg versus atorvastatin 80 mg in high-risk patients with hypercholesterolaemia: results of the POLARIS study at 8 and 26 weeks. Eur Heart J 2005; 26: (Abstract Supplement):581, (Abs P3503)
- ↑ Berne,C and Siewert,A for the URANUS study investigators. Comparison of rosuvastatin and atorvastatin for lipid lowering in patients with type 2 diabetes mellitus: results from the URANUS study. Cardiovascular Diabetology 2005, 4:7 Disponible en [2]
- ↑ Betteridge, DJ and Gibson, JM. Effects of rosuvastatin on lipids, lipoproteins and apolipoproteins in the dyslipidaemia of diabetes. Diabetic Medicine Volume 24 Issue 5, Pages 541 - 549
- ↑ Pitt B, Waters D, et al. Aggressive Lipid-Lowering Therapy Compared with Angioplasty in Stable Coronary Artery Disease. N Engl J Med 1999;341:70
- ↑ David H. Blankenhorn; Stanley P et al. The MARS Research Group. Coronary Angiographic Changes with Lovastatin Therapy: The Monitored Atherosclerosis Regression Study (MARS). Annals of Internal Medicine. 1993. Volume 119 Issue 10. Pages 969-976
- ↑ Steven E. Nissen; E. Murat Tuzcu, et al. for the REVERSAL Investigators Effect of Intensive Compared With Moderate Lipid-Lowering Therapy on Progression of Coronary Atherosclerosis. A Randomized Controlled Trial JAMA. 2004;291:1071-1080.
- ↑ Pedersen,TR.; Faergeman, O. et al. for the IDEAL study group. High-Dose Atorvastatin vs Usual-Dose Simvastatin for Secondary Prevention After Myocardial Infarction. JAMA. 2005;294:2437-2445. Disponible en [3]
- ↑ Zheng Zhou, Elham Rahme et al. Effectiveness of statins for secondary prevention in elderly patients after acute myocardial infarction: an evaluation of class effect.CMAJ. 2005 April 26; 172(9): 1187–1194. Disponible en [4]
- ↑ http://www.fda.gov/drugs/drugsafety/ucm293101.htm
