Diferencia entre revisiones de «Coagulación»
m Revertidos los cambios de 87.219.232.122 (disc.) a la última edición de Jkbw |
Preparando para ampliar artículo a partir de la edición en inglés. |
||
| Línea 1: | Línea 1: | ||
[[File:Coagulation in vivo.png|right|thumb|400px|Cascadas de coagulación ''in vivo'' mostrando el papel central jugado por la trombina]] |
|||
[[Archivo:Coagulation full ESP.svg|thumbnail|derecha|400px|La cascada completa de coagulación. En el texto se describen las diferentes vías y [[factor de coagulación|factores de coagulación]].]] |
[[Archivo:Coagulation full ESP.svg|thumbnail|derecha|400px|La cascada completa de coagulación. En el texto se describen las diferentes vías y [[factor de coagulación|factores de coagulación]].]] |
||
Se denomina '''coagulación''' al proceso por el cual la [[sangre]] pierde su liquidez convirtiéndose en un [[gel]], para formar un [[coágulo]]. Este proceso potencialmente desemboca en la [[hemostasis]], es decir, en el cese de la pérdida de sangre desde un vaso dañado, seguida por su reparación. El mecanismo de coagulación involucra la activación, adhesión y agregación [[plaquetas|plaquetaria]], junto con el depósito y maduración de la [[fibrina]]. Los desórdenes de la coagulación son estados de enfermedad que pueden provocar [[hemorragia]]s espontáneas, formación de [[hematoma]]s o coagulación obstructiva ([[trombosis]]).<ref name="isbn1-4051-8460-4"/> |
|||
Se denomina '''coagulación''' al proceso por el cual la sangre pierde su liquidez, tornándose similar a un [[gel]] en primera instancia y luego sólida, sin experimentar un verdadero [[cambio de estado]]. |
|||
El mecanismo de coagulación se encuentra altamente conservado a través de diferentes especies en la biología; en todos los [[mamífero]]s, la coagulación involucra a factores celulares ([[plaqueta]]s) y factores proteicos ([[factor de coagulación|factores de coagulación]]).<ref name="Michelson2006"/> El sistema ha sido extensamente estudiado en humanos, especie donde es mejor comprendido.<ref name="Schmaier"/> |
|||
Cuando una lesión afecta la integridad de las paredes de los vasos sanguíneos, se ponen en marcha una serie de mecanismos que tienden a limitar la [[hemorragia|pérdida de sangre]]. Estos mecanismos llamados de "[[hemostasia]]" comprenden la [[vasoconstricción]] local del vaso, el depósito y agregación de [[plaquetas]] y la coagulación de la [[sangre]]. |
|||
La coagulación comienza casi instantáneamente luego de una herida que daña el [[endotelio]] de un vaso sanguíneo. La exposición de la sangre al espacio que se encuentra debajo del endotelio inicia dos procesos: cambios en las plaquetas, y exposición del [[factor tisular]] subendotelial al [[factor VII]] del plasma, lo cual conduce finalmente a la fomración de [[fibrina]]. Las plaquetas inmediatamente forman un tapón en el sitio de la lesión; este proceso se denomina ''hemostasis primaria''. La ''hemostasis secundaria'' ocurre en simultáneo; los factores de coagulación proteicos más allá del factor VII responden en una compleja cascada de reacciones enzimáticas para formar fibras de [[fibrina]], que fortalecen el tapón de plaquetas.<ref name=Furie/> |
|||
Este proceso es debido, en última instancia, a que una [[proteína]] soluble que normalmente se encuentra en la sangre, el fibrinógeno, experimenta un cambio químico que la convierte en insoluble y con la capacidad de entrelazarse con otras moléculas iguales, para formar enormes agregados [[macromolécula|macromoleculares]] en forma de una red tridimensional. |
|||
{{en obras|J3D3}} |
|||
<!-- |
|||
El fibrinógeno, una vez transformado, recibe el nombre de fibrina. La coagulación es por lo tanto, el proceso [[Enzimas|enzimático]] por el cual el fibrinógeno soluble se convierte en fibrina insoluble, capaz de polimerizar y entrecruzarse. |
|||
==Physiology== |
|||
Un coágulo es, por lo tanto, una red tridimensional de fibrina que eventualmente ha atrapado entre sus fibras a otras proteínas, agua, sales y hasta células sanguíneas. |
|||
===Platelet activation=== |
|||
Por una convención se denomina "[[trombo]]" a un coágulo formado en el interior de un vaso sanguíneo. |
|||
When the endothelium is damaged, the normally isolated, underlying collagen is exposed to circulating platelets, which bind directly to collagen with collagen-specific [[glycoprotein Ia/IIa]] surface receptors. This adhesion is strengthened further by [[von Willebrand factor]] (vWF), which is released from the endothelium and from platelets; vWF forms additional links between the platelets' [[glycoprotein Ib/IX/V]] and the collagen fibrils. This localization of platelets to the extracellular matrix promotes collagen interaction with platelet [[glycoprotein VI]]. Binding of collagen to [[glycoprotein VI]] triggers a signaling cascade that results in activation of platelet integrins. Activated integrins mediate tight binding of platelets to the extracellular matrix. This process adheres platelets to the site of injury.<ref name="PracticalH1">{{cite book |author=Nigel Key, Michael Makris |title=Practical Hemostasis and Thrombosis |publisher=Wiley-Blackwell |location= |year=2009 |pages=2 |isbn=978-1-4051-8460-1|display-authors=etal}}</ref> |
|||
Activated platelets will release the contents of stored granules into the blood plasma. The granules include [[Adenosine diphosphate|ADP]], [[serotonin]], [[platelet-activating factor]] (PAF), [[von Willebrand factor|vWF]], [[platelet factor 4]], and [[Thromboxane A2|thromboxane A<sub>2</sub>]] (TXA<sub>2</sub>), which, in turn, activate additional platelets. The granules' contents activate a [[G protein-coupled receptor|G<sub>q</sub>-linked protein receptor]] cascade, resulting in increased calcium concentration in the platelets' cytosol. The calcium activates [[protein kinase C]], which, in turn, activates [[Phospholipase A2|phospholipase A<sub>2</sub>]] (PLA<sub>2</sub>). PLA<sub>2</sub> then modifies the [[integrin]] membrane [[glycoprotein IIb/IIIa]], increasing its affinity to bind [[fibrinogen]]. The activated platelets change shape from spherical to stellate, and the [[fibrinogen]] cross-links with [[glycoprotein IIb/IIIa]] aid in aggregation of adjacent platelets (completing primary hemostasis).<ref name="Palister1">{{cite book |author=Pallister CJ and Watson MS |title=Haematology |publisher=Scion Publishing |location= |year=2010 |pages=334–336 |isbn=1-904842-39-9}}</ref> |
|||
===The coagulation cascade=== |
|||
[[File:Classical blood coagulation pathway.png|right|thumb|350px|The classical blood coagulation pathway<ref name="isbn1-904842-39-9"/>]] |
|||
[[File:Rapaport Coagulation Cascade.svg|thumb|Modern coagulation pathway. Hand-drawn composite from similar drawings presented by Professor Dzung Le, MD, PhD, at UCSD Clinical Chemistry conferences on 14 and 21 October 2014. Original schema from Introduction to Hematology by Samuel I. Rapaport. 2nd edition;Lippencott:1987. Dr Le added the factor XI portion based on a paper from about year 2000. Dr Le's similar drawings presented the development of this cascade over 6 frames, like a comic.]] |
|||
The coagulation cascade of secondary hemostasis has two initial pathways which lead to ''[[fibrin]]'' formation. These are the ''contact activation pathway'' (also known as the intrinsic pathway), and the ''tissue factor pathway'' (also known as the extrinsic pathway) which both lead to the same fundamental reactions that produce fibrin. It was previously thought that the two pathways of coagulation cascade were of equal importance, but it is now known that the primary pathway for the initiation of blood coagulation is the ''tissue factor'' (extrinsic) pathway. The pathways are a series of reactions, in which a [[zymogen]] (inactive enzyme precursor) of a [[serine protease]] and its [[glycoprotein]] co-factor are activated to become active components that then catalyze the next reaction in the cascade, ultimately resulting in cross-linked fibrin. Coagulation factors are generally indicated by [[Roman numeral]]s, with a lowercase ''a'' appended to indicate an active form.<ref name="isbn1-904842-39-9">{{cite book |author=Pallister CJ and Watson MS |title=Haematology |publisher=Scion Publishing |location= |year=2010 |pages=336–347 |isbn=1-904842-39-9}}</ref> |
|||
The coagulation factors are generally [[serine protease]]s ([[enzymes]]), which act by cleaving downstream proteins. There are some exceptions. For example, FVIII and FV are glycoproteins, and Factor XIII is a [[transglutaminase]].<ref name="isbn1-904842-39-9"/> The coagulation factors circulate as inactive [[zymogens]]. |
|||
The coagulation cascade is therefore classically divided into three pathways. The ''tissue factor'' and ''contact activation'' pathways both activate the "final common pathway" of factor X, thrombin and fibrin.<ref name="isbn0-632-05153-1">{{cite book |author=Hoffbrand, A. V. |title=Essential haematology |publisher=Blackwell Science |location=Oxford |year=2002 |pages=241–243 |isbn=0-632-05153-1}}</ref> |
|||
====Tissue factor pathway (extrinsic)==== |
|||
The main role of the [[tissue factor]] pathway is to generate a "thrombin burst", a process by which [[thrombin]], the most important constituent of the coagulation cascade in terms of its feedback activation roles, is released very rapidly. FVIIa circulates in a higher amount than any other activated coagulation factor. The process includes the following steps:<ref name="isbn1-904842-39-9"/> |
|||
* Following damage to the blood vessel, FVII leaves the circulation and comes into contact with [[tissue factor]] (TF) expressed on tissue-factor-bearing cells ([[stromal cell|stroma]]l fibroblasts and leukocytes), forming an activated complex (TF-FVIIa). |
|||
* TF-FVIIa activates FIX and FX. |
|||
* FVII is itself activated by thrombin, FXIa, FXII and FXa. |
|||
* The activation of FX (to form FXa) by TF-FVIIa is almost immediately inhibited by [[tissue factor pathway inhibitor]] (TFPI). |
|||
* FXa and its co-factor FVa form the [[prothrombinase]] complex, which activates [[prothrombin]] to thrombin. |
|||
* Thrombin then activates other components of the coagulation cascade, including FV and FVIII (which forms a complex with FIX), and activates and releases FVIII from being bound to vWF. |
|||
* FVIIIa is the co-factor of FIXa, and together they form the "[[tenase]]" complex, which activates FX; and so the cycle continues. ("Tenase" is a contraction of "ten" and the suffix "-ase" used for enzymes.) |
|||
====Contact activation pathway (intrinsic)==== |
|||
The contact activation pathway begins with formation of the primary complex on [[collagen]] by [[high-molecular-weight kininogen]] (HMWK), [[prekallikrein]], and [[Hageman factor|FXII (Hageman factor)]]. [[Prekallikrein]] is converted to [[kallikrein]] and FXII becomes FXIIa. FXIIa converts FXI into FXIa. Factor XIa activates FIX, which with its co-factor FVIIIa form the [[tenase]] complex, which activates FX to FXa. The minor role that the contact activation pathway has in initiating [[clot formation]] can be illustrated by the fact that patients with severe deficiencies of FXII, HMWK, and [[prekallikrein]] do not have a bleeding disorder. Instead, contact activation system seems to be more involved in inflammation,<ref name="isbn1-904842-39-9"/> and innate immunity.<ref name=Long2016>{{cite journal | doi=10.1111/jth.13235| title=Contact system revisited: An interface between inflammation, coagulation, and innate immunity| journal=Journal of Thrombosis and Haemostasis| pages=n/a| year=2015| last1=Long| first1=Andrew T.| last2=Kenne| first2=Ellinor| last3=Jung| first3=Roman| last4=Fuchs| first4=Tobias A.| last5=Renné| first5=Thomas}}</ref> Despite this, interference with the pathway may confer protection against thrombosis without a significant bleeding risk.<ref name=Long2016/> |
|||
====Final common pathway==== |
|||
The division of coagulation in two pathways is mainly artificial, it originates from laboratory tests in which clotting times were measured after the clotting was initiated by glass (intrinsic pathway) or by thromboplastin (a mix of tissue factor and phospholipids). In fact thrombin is present from the very beginning, already when platelets are making the plug. ''Thrombin'' has a large array of functions, not only the conversion of [[fibrinogen]] to fibrin, the building block of a hemostatic plug. In addition, it is the most important platelet activator and on top of that it activates Factors VIII and V and their inhibitor [[protein C]] (in the presence of [[thrombomodulin]]), and it activates Factor XIII, which forms [[covalent bond]]s that crosslink the fibrin polymers that form from activated monomers.<ref name="isbn1-904842-39-9"/> |
|||
Following activation by the contact factor or tissue factor pathways, the coagulation cascade is maintained in a prothrombotic state by the continued activation of FVIII and FIX to form the [[tenase]] complex, until it is down-regulated by the anticoagulant pathways.<ref name="isbn1-904842-39-9"/> |
|||
===Cofactors=== |
|||
Various substances are required for the proper functioning of the coagulation cascade: |
|||
* [[Calcium]] and [[phospholipid]] (a [[platelet]] membrane constituent) are required for the tenase and prothrombinase complexes to function. Calcium mediates the binding of the complexes via the terminal gamma-carboxy residues on FXa and FIXa to the phospholipid surfaces expressed by platelets, as well as procoagulant microparticles or [[microvesicles]] shed from them. Calcium is also required at other points in the coagulation cascade. |
|||
* [[Vitamin K]] is an essential factor to a hepatic [[gamma-glutamyl carboxylase]] that adds a [[carboxyl]] group to [[glutamic acid]] residues on factors II, VII, IX and X, as well as [[Protein S]], Protein C and [[Protein Z]]. In adding the gamma-carboxyl group to glutamate residues on the immature clotting factors Vitamin K is itself oxidized. Another enzyme, ''[[Vitamin K epoxide reductase]]'', (VKORC) reduces vitamin K back to its active form. Vitamin K epoxide reductase is pharmacologically important as a target of anticoagulant drugs [[warfarin]] and related [[coumarin]]s such as [[acenocoumarol]], [[phenprocoumon]], and [[dicumarol]]. These drugs create a deficiency of reduced vitamin K by blocking VKORC, thereby inhibiting maturation of clotting factors. Vitamin K deficiency from other causes (e.g., in [[malabsorption]]) or impaired vitamin K metabolism in disease (e.g., in [[liver failure]]) lead to the formation of PIVKAs (proteins formed in vitamin K absence) which are partially or totally non-gamma carboxylated, affecting the coagulation factors' ability to bind to phospholipid. |
|||
===Regulators=== |
|||
[[Image:Coagulation full.svg|400px|thumb|right|Coagulation with arrows for negative and positive feedback.]] |
|||
Five mechanisms keep platelet activation and the coagulation cascade in check. Abnormalities can lead to an increased tendency toward thrombosis: |
|||
* [[Protein C]] is a major physiological anticoagulant. It is a vitamin K-dependent serine protease enzyme that is activated by thrombin into activated protein C (APC). Protein C is activated in a sequence that starts with Protein C and thrombin binding to a cell surface protein [[thrombomodulin]]. Thrombomodulin binds these proteins in such a way that it activates Protein C. The activated form, along with protein S and a phospholipid as cofactors, degrades FVa and FVIIIa. Quantitative or qualitative deficiency of either (protein C or protein S) may lead to [[thrombophilia]] (a tendency to develop thrombosis). Impaired action of Protein C (activated Protein C resistance), for example by [[Factor V Leiden|having the "Leiden" variant of Factor V]] or high levels of FVIII also may lead to a thrombotic tendency. |
|||
* [[Antithrombin]] is a [[serine protease inhibitor]] ([[serpin]]) that degrades the serine proteases: thrombin, FIXa, FXa, FXIa, and FXIIa. It is constantly active, but its adhesion to these factors is increased by the presence of [[heparan sulfate]] (a [[glycosaminoglycan]]) or the administration of [[heparin]]s (different heparinoids increase affinity to FXa, thrombin, or both). Quantitative or qualitative deficiency of antithrombin (inborn or acquired, e.g., in [[proteinuria]]) leads to thrombophilia. |
|||
* [[Tissue factor pathway inhibitor]] (TFPI) limits the action of tissue factor (TF). It also inhibits excessive TF-mediated activation of FVII and FX. |
|||
* [[Plasmin]] is generated by proteolytic cleavage of plasminogen, a plasma protein synthesized in the liver. This cleavage is catalyzed by [[tissue plasminogen activator]] (t-PA), which is synthesized and secreted by endothelium. Plasmin proteolytically cleaves fibrin into fibrin degradation products that inhibit excessive fibrin formation. |
|||
* [[Prostacyclin]] (PGI<sub>2</sub>) is released by endothelium and activates platelet G<sub>s</sub> protein-linked receptors. This, in turn, activates [[adenylyl cyclase]], which synthesizes cAMP. cAMP inhibits platelet activation by decreasing cytosolic levels of calcium and, by doing so, inhibits the release of granules that would lead to activation of additional platelets and the coagulation cascade.<ref name="Hoffband2">{{cite book |author=Hoffbrand, A. V. |title=Essential haematology |publisher=Blackwell Science |location=Oxford |year=2002 |pages=243–245 |isbn=0-632-05153-1}}</ref> |
|||
===Fibrinolysis=== |
|||
{{main|Fibrinolysis}} |
|||
Eventually, blood clots are reorganised and resorbed by a process termed ''[[fibrinolysis]]''. The main enzyme responsible for this process ([[plasmin]]) is regulated by various activators and inhibitors.<ref name="Hoffband2"/> |
|||
===Role in immune system=== |
|||
The coagulation system overlaps with the [[immune system]]. Coagulation can physically trap invading microbes in blood clots. Also, some products of the coagulation system can contribute to the [[innate immune system]] by their ability to increase vascular permeability and act as [[chemotactic agent]]s for [[phagocytic cell]]s. In addition, some of the products of the coagulation system are directly [[antimicrobial]]. For example, [[beta-lysine]], an amino acid produced by platelets during coagulation, can cause [[lysis]] of many [[Gram-positive bacteria]] by acting as a cationic detergent.<ref name=Mayer>[http://pathmicro.med.sc.edu/ghaffar/innate.htm Immunology – Chapter One: Innate ot non-specific immunity] Gene Mayer, Ph.D. Immunology Section of Microbiology and Immunology On-line. University of South Carolina</ref> Many [[acute-phase protein]]s of [[inflammation]] are involved in the coagulation system. In addition, pathogenic bacteria may secrete agents that alter the coagulation system, e.g. [[coagulase]] and [[streptokinase]]. |
|||
== Assessment == |
|||
[[File:Fibrin-nach-Thromboplastin.jpg|thumb|Blood plasma after the addition of Tissue Factor forms a gel-like structure (Test for prothrombin time). |
|||
]] |
|||
Numerous tests are used to assess the function of the coagulation system:<ref name="Lillicrap">{{cite book |author=David Lillicrap; Nigel Key; Michael Makris; Denise O'Shaughnessy |title=Practical Hemostasis and Thrombosis |publisher=Wiley-Blackwell |location= |year=2009 |pages=7–16 |isbn=1-4051-8460-4}}</ref> |
|||
* Common: [[Partial thromboplastin time|aPTT]], [[prothrombin time|PT]] (also used to determine [[International normalized ratio|INR]]), [[fibrinogen]] testing (often by the [[Clauss method]]), [[platelet]] count, platelet function testing (often by [[PFA-100]]), [[thrombodynamics test]]. |
|||
* Other: [[Thrombin clotting time|TCT]], [[bleeding time]], [[mixing test]] (whether an abnormality corrects if the patient's plasma is mixed with normal plasma), coagulation factor assays, [[antiphospholipid antibody|antiphospholipid antibodies]], [[D-dimer]], genetic tests (e.g. [[factor V Leiden]], [[prothrombin]] mutation G20210A), [[dilute Russell's viper venom time]] (dRVVT), miscellaneous platelet function tests, [[thromboelastography]] (TEG or Sonoclot), [[euglobulin lysis time]] (ELT). |
|||
The contact activation (intrinsic) pathway is initiated by activation of the "contact factors" of plasma, and can be measured by the [[partial thromboplastin time|activated partial thromboplastin]] time (aPTT) test. |
|||
The tissue factor (extrinsic) pathway is initiated by release of [[tissue factor]] (a specific cellular lipoprotein), and can be measured by the [[prothrombin time]] (PT) test. PT results are often reported as ratio ([[International normalized ratio|INR]] value) to monitor dosing of oral anticoagulants such as [[warfarin]]. |
|||
The quantitative and qualitative screening of fibrinogen is measured by the [[thrombin clotting time]] (TCT). Measurement of the exact amount of fibrinogen present in the blood is generally done using the [[Clauss method]] for fibrinogen testing. Many analysers are capable of measuring a "derived fibrinogen" level from the graph of the Prothrombin time clot. |
|||
If a coagulation factor is part of the contact activation or tissue factor pathway, a deficiency of that factor will affect only one of the tests: Thus [[hemophilia A]], a deficiency of factor VIII, which is part of the contact activation pathway, results in an abnormally prolonged aPTT test but a normal PT test. The exceptions are prothrombin, fibrinogen, and some variants of FX that can be detected only by either aPTT or PT. If an abnormal PT or aPTT is present, additional testing will occur to determine which (if any) factor is present as aberrant concentrations. |
|||
Deficiencies of fibrinogen (quantitative or qualitative) will affect all screening tests. |
|||
{{Bleeding worksheet}} |
|||
==Role in disease== |
|||
Coagulation defects may cause hemorrhage or thrombosis, and occasionally both, depending on the nature of the defect.<ref name="isbn1-4051-8050-1">{{cite book |author=Hatton, Chris |title=Haematology (Lecture Notes) |publisher=Blackwell Publishers |location=Cambridge, MA |year=2008 |pages=145–166 |isbn=1-4051-8050-1}}</ref> |
|||
===Platelet disorders=== |
|||
Platelet conditions may be congenital or acquired. Some inborn platelet pathologies are [[Glanzmann's thrombasthenia]], [[Bernard-Soulier syndrome]] (abnormal glycoprotein Ib-IX-V complex), [[gray platelet syndrome]] (deficient [[alpha granules]]), and [[delta storage pool deficiency]] (deficient [[dense granules]]). Most are rare conditions. Most inborn platelet pathologies predispose to hemorrhage. [[Von Willebrand disease]] is due to deficiency or abnormal function of [[von Willebrand factor]], and leads to a similar bleeding pattern; its milder forms are relatively common. |
|||
Decreased platelet numbers may be due to various causes, including insufficient production (e.g., in [[myelodysplastic syndrome]] or other bone marrow disorders), destruction by the immune system ([[immune thrombocytopenic purpura]]/ITP), and consumption due to various causes ([[thrombotic thrombocytopenic purpura]]/TTP, [[hemolytic-uremic syndrome]]/HUS, [[paroxysmal nocturnal hemoglobinuria]]/PNH, [[disseminated intravascular coagulation]]/DIC, [[heparin-induced thrombocytopenia]]/HIT). Most consumptive conditions lead to platelet activation, and some are associated with thrombosis. |
|||
===Disease and clinical significance of thrombosis=== |
|||
The best-known coagulation factor disorders are the [[hemophilia]]s. The three main forms are [[hemophilia A]] (factor VIII deficiency), [[hemophilia B]] (factor IX deficiency or "Christmas disease") and [[hemophilia C]] (factor XI deficiency, mild bleeding tendency). Hemophilia A and B are X-linked recessive disorders, whereas Hemophilia C is a much more rare autosomal recessive disorder most commonly seen in [[Ashkenazi Jews]]. |
|||
[[Von Willebrand disease]] (which behaves more like a platelet disorder except in severe cases), is the most common hereditary bleeding disorder and is characterized as being inherited autosomal recessive or dominant. In this disease, there is a defect in von Willebrand factor (vWF), which mediates the binding of glycoprotein Ib (GPIb) to collagen. This binding helps mediate the activation of platelets and formation of primary hemostasis. |
|||
Bernard-Soulier syndrome is a defect or deficiency in GPIb. GPIb, the receptor for vWF, can be defective and lead to lack of primary clot formation (primary hemostasis) and increased bleeding tendency. This is an autosomal recessive inherited disorder. |
|||
Thrombasthenia of Glanzmann and Naegeli ([[Glanzmann thrombasthenia]]) is extremely rare. It is characterized by a defect in GPIIb/IIIa fibrinogen receptor complex. When GPIIb/IIIa receptor is dysfunctional, fibrinogen cannot cross-link platelets, which inhibits primary hemostasis. This is an autosomal recessive inherited disorder. |
|||
In [[liver failure]] (acute and chronic forms), there is insufficient production of coagulation factors by the liver; this may increase bleeding risk. |
|||
Deficiency of Vitamin K may also contribute to bleeding disorders because clotting factor maturation depends on Vitamin K. |
|||
[[Thrombosis]] is the pathological development of blood clots. These clots may break free and become mobile, forming an [[Embolism|embolus]] or grow to such a size that occludes the vessel in which it developed. An [[embolism]] is said to occur when the [[thrombus]] (blood clot) becomes a mobile embolus and migrates to another part of the body, interfering with blood circulation and hence impairing organ function downstream of the occlusion. This causes [[ischemia]] and often leads to ischemic [[necrosis]] of tissue. Most cases of [[venous thrombosis]] are due to acquired states (older age, surgery, cancer, immobility) or inherited [[thrombophilia]]s (e.g., [[antiphospholipid syndrome]], [[factor V Leiden]], and various other genetic deficiencies or variants). |
|||
Mutations in [[factor XII]] have been associated with an asymptomatic prolongation in the clotting time and possibly a tendency toward [[thrombophlebitis]]. Other mutations have been linked with a rare form of [[angioedema|hereditary angioedema]] (type III) essentialism. |
|||
==Pharmacology== |
|||
===Procoagulants=== |
|||
The use of adsorbent chemicals, such as [[zeolite]]s, and other [[hemostatic agent]]s are also used for sealing severe injuries quickly (such as in traumatic bleeding secondary to gunshot wounds). Thrombin and fibrin [[glue]] are used surgically to treat bleeding and to thrombose aneurysms. |
|||
[[Desmopressin]] is used to improve platelet function by activating [[arginine vasopressin receptor 1A]]. |
|||
Coagulation factor concentrates are used to treat [[hemophilia]], to reverse the effects of anticoagulants, and to treat bleeding in patients with impaired coagulation factor synthesis or increased consumption. [[Prothrombin complex concentrate]], [[cryoprecipitate]] and [[fresh frozen plasma]] are commonly used coagulation factor products. [[Factor VII|Recombinant activated human factor VII]] is increasingly popular in the treatment of major bleeding. |
|||
[[Tranexamic acid]] and [[aminocaproic acid]] inhibit fibrinolysis, and lead to a ''de facto'' reduced bleeding rate. Before its withdrawal, [[aprotinin]] was used in some forms of major surgery to decrease bleeding risk and need for blood products. |
|||
===Anticoagulants=== |
|||
{{main|Antiplatelet drug|Anticoagulant}} |
|||
Anticoagulants and anti-platelet agents are amongst the most commonly used medications. [[Antiplatelet drug|Anti-platelet agents]] include [[aspirin]], [[dipyridamole]], [[ticlopidine]], [[clopidogrel]], [[ticagrelor]] and [[prasugrel]]; the parenteral [[glycoprotein IIb/IIIa inhibitors]] are used during [[angioplasty]]. Of the anticoagulants, [[warfarin]] (and related [[coumarin]]s) and [[heparin]] are the most commonly used. Warfarin affects the vitamin K-dependent clotting factors (II, VII, IX,X) and protein C and protein S, whereas heparin and related compounds increase the action of antithrombin on thrombin and factor Xa. A newer class of drugs, the [[direct thrombin inhibitor]]s, is under development; some members are already in clinical use (such as [[lepirudin]]). Also under development are other small molecular compounds that interfere directly with the enzymatic action of particular coagulation factors (e.g., [[rivaroxaban]], [[dabigatran]], [[apixaban]]).<ref name="pmid22345595">{{cite journal |author=Soff GA |title=A new generation of oral direct anticoagulants |journal=Arteriosclerosis, Thrombosis, and Vascular Biology |volume=32 |issue=3 |pages=569–74 |date=March 2012 |pmid=22345595 |doi=10.1161/ATVBAHA.111.242834}}</ref> |
|||
==Coagulation factors== |
|||
{| class="wikitable" |
|||
|+ Coagulation factors and related substances |
|||
|- |
|||
! Number and/or name !! Function !! Associated genetic disorders |
|||
|- |
|||
| I ([[fibrinogen]]) || Forms clot (fibrin) || [[Congenital afibrinogenemia]], [[Familial renal amyloidosis]] |
|||
|- |
|||
| II ([[prothrombin]]) || Its active form (IIa) activates I, V, X, VII, VIII, XI, XIII, [[protein C]], [[platelets]] ||[[Prothrombin G20210A]], [[Thrombophilia]] |
|||
|- |
|||
|III ([[tissue factor]] or tissue thromboplastin )|| Co-factor of VIIa (formerly known as factor III)|| |
|||
|- |
|||
| IV [[Calcium]] || Required for coagulation factors to bind to phospholipid (formerly known as factor IV)|| |
|||
|- |
|||
| [[Factor V|V]] (proaccelerin, labile factor) || Co-factor of X with which it forms the [[prothrombinase]] complex || [[Activated protein C resistance]] |
|||
|- |
|||
| VI || ''Unassigned'' – old name of Factor Va || |
|||
|- |
|||
| [[Factor VII|VII]] (stable factor, proconvertin) || Activates IX, X || congenital proconvertin/factor VII deficiency |
|||
|- |
|||
| [[Factor VIII|VIII]] (Antihemophilic factor A) || Co-factor of IX with which it forms the [[tenase]] complex ||[[Haemophilia A]] |
|||
|- |
|||
| [[Factor IX|IX]] (Antihemophilic factor B or Christmas factor) || Activates X: forms [[tenase]] complex with factor VIII||[[Haemophilia B]] |
|||
|- |
|||
| [[Factor X|X]] (Stuart-Prower factor) || Activates II: forms [[prothrombinase]] complex with factor V||Congenital Factor X deficiency |
|||
|- |
|||
| [[Factor XI|XI]] (plasma thromboplastin antecedent) || Activates IX||[[Haemophilia C]] |
|||
|- |
|||
| [[Factor XII|XII]] (Hageman factor) || Activates factor XI, VII and prekallikrein ||[[Hereditary angioedema]] type III |
|||
|- |
|||
| [[Factor XIII|XIII]] (fibrin-stabilizing factor) || Crosslinks fibrin || Congenital Factor XIIIa/b deficiency |
|||
|- |
|||
| [[von Willebrand factor]] || Binds to VIII, mediates platelet adhesion || [[von Willebrand disease]] |
|||
|- |
|||
| [[prekallikrein]] (Fletcher factor)|| Activates XII and prekallikrein; cleaves HMWK ||Prekallikrein/Fletcher Factor deficiency |
|||
|- |
|||
| [[high-molecular-weight kininogen]] (HMWK) (Fitzgerald factor)|| Supports reciprocal activation of XII, XI, and prekallikrein||Kininogen deficiency |
|||
|- |
|||
| [[fibronectin]] || Mediates cell adhesion||[[Glomerulopathy]] with fibronectin deposits |
|||
|- |
|||
| [[antithrombin]] III || Inhibits IIa, Xa, and other proteases||[[Antithrombin III deficiency]] |
|||
|- |
|||
| [[heparin cofactor II]] || Inhibits IIa, cofactor for heparin and [[dermatan sulfate]] ("minor antithrombin") ||Heparin cofactor II deficiency |
|||
|- |
|||
| [[protein C]] || Inactivates Va and VIIIa||[[Protein C deficiency]] |
|||
|- |
|||
| [[protein S]] || Cofactor for activated protein C (APC, inactive when bound to C4b-binding protein)||[[Protein S deficiency]] |
|||
|- |
|||
| [[protein Z]] || Mediates thrombin adhesion to phospholipids and stimulates degradation of factor X by ZPI||[[Protein Z deficiency]] |
|||
|- |
|||
| [[Protein Z-related protease inhibitor]] (ZPI) || Degrades factors X (in presence of protein Z) and XI (independently)|| |
|||
|- |
|||
| [[plasminogen]] || Converts to plasmin, lyses fibrin and other proteins||Plasminogen deficiency, type I (ligneous conjunctivitis) |
|||
|- |
|||
| [[alpha 2-antiplasmin]] || Inhibits plasmin||Antiplasmin deficiency |
|||
|- |
|||
| [[tissue plasminogen activator]] (tPA) || Activates plasminogen||Familial [[hyperfibrinolysis]] and [[thrombophilia]] |
|||
|- |
|||
| [[urokinase]] || Activates plasminogen||[[Quebec platelet disorder]] |
|||
|- |
|||
| [[plasminogen activator inhibitor-1]] (PAI1) || Inactivates tPA & urokinase (endothelial PAI)||Plasminogen activator inhibitor-1 deficiency |
|||
|- |
|||
| [[plasminogen activator inhibitor-2]] (PAI2) || Inactivates tPA & urokinase ([[placenta]]l PAI)|| |
|||
|- |
|||
| [[cancer procoagulant]] || Pathological [[factor X]] activator linked to thrombosis in [[cancer]]|| |
|||
|} |
|||
==History== |
|||
===Initial discoveries=== |
|||
Theories on the coagulation of blood have existed since antiquity. Physiologist [[Johannes Peter Müller|Johannes Müller]] (1801–1858) described fibrin, the substance of a [[thrombus]]. Its soluble precursor, [[fibrinogen]], was thus named by [[Rudolf Virchow]] (1821–1902), and isolated chemically by [[Prosper Sylvain Denis]] (1799–1863). [[Alexander Schmidt (physiologist)|Alexander Schmidt]] suggested that the conversion from fibrinogen to fibrin is the result of an [[enzyme|enzymatic]] process, and labeled the hypothetical enzyme "[[thrombin]]" and its precursor "[[prothrombin]]".<ref>{{cite journal|author=Schmidt A|year=1872|title=Neue Untersuchungen über die Faserstoffgerinnung |journal=Pflüger's Archiv für die gesamte Physiologie|volume=6|pages=413–538|doi=10.1007/BF01612263}}</ref><ref>Schmidt A. Zur Blutlehre. Leipzig: Vogel, 1892.</ref> [[Nicolas Maurice Arthus|Arthus]] discovered in 1890 that calcium was essential in coagulation.<ref>{{cite journal|author=Arthus M, Pagès C|title=Nouvelle theorie chimique de la coagulation du sang|journal=Arch Physiol Norm Pathol|year=1890|volume=5|pages=739–46}}</ref><ref name=Shapiro>{{cite journal |author=Shapiro SS |title=Treating thrombosis in the 21st century |journal=N. Engl. J. Med. |volume=349 |issue=18 |pages=1762–4 |year=2003 |pmid=14585945 |doi=10.1056/NEJMe038152}}</ref> [[Platelet]]s were identified in 1865, and their function was elucidated by [[Giulio Bizzozero]] in 1882.<ref name=Brewer>{{cite journal |author=Brewer DB |title=Max Schultze (1865), G. Bizzozero (1882) and the discovery of the platelet |journal=Br. J. Haematol. |volume=133 |issue=3 |pages=251–8 |year=2006 |pmid=16643426 |doi=10.1111/j.1365-2141.2006.06036.x}}</ref> |
|||
The theory that thrombin is generated by the presence of [[tissue factor]] was consolidated by [[Paul Morawitz]] in 1905.<ref>{{cite journal|author=Morawitz P|title=Die Chemie der Blutgerinnung|journal=Ergebn Physiol|year=1905|volume=4|pages=307–422|doi=10.1007/BF02321003}}</ref> At this stage, it was known that ''thrombokinase/thromboplastin'' (factor III) is released by damaged tissues, reacting with ''prothrombin'' (II), which, together with [[calcium in biology|calcium]] (IV), forms ''thrombin'', which converts fibrinogen into ''fibrin'' (I).<ref name=Giangrande>{{cite journal |author=Giangrande PL |title=Six characters in search of an author: the history of the nomenclature of coagulation factors |journal=Br. J. Haematol. |volume=121 |issue=5 |pages=703–12 |year=2003 |pmid=12780784 |doi=10.1046/j.1365-2141.2003.04333.x}}</ref> |
|||
===Coagulation factors=== |
|||
The remainder of the biochemical factors in the process of coagulation were largely discovered in the 20th century. |
|||
A first clue as to the actual complexity of the system of coagulation was the discovery of ''proaccelerin'' (initially and later called Factor V) by Paul Owren (1905–1990) in 1947. He also postulated its function to be the generation of accelerin (Factor VI), which later turned out to be the activated form of V (or Va); hence, VI is not now in active use.<ref name=Giangrande/> |
|||
Factor VII (also known as ''serum prothrombin conversion accelerator'' or ''proconvertin'', precipitated by barium sulfate) was discovered in a young female patient in 1949 and 1951 by different groups. |
|||
[[Factor VIII]] turned out to be deficient in the clinically recognised but etiologically elusive [[haemophilia A|hemophilia A]]; it was identified in the 1950s and is alternatively called ''antihemophilic globulin'' due to its capability to correct hemophilia A.<ref name=Giangrande/> |
|||
Factor IX was discovered in 1952 in a young patient with [[haemophilia B|hemophilia B]] named [[Stephen Christmas]] (1947–1993). His deficiency was described by Dr. Rosemary Biggs and Professor [[R.G. MacFarlane]] in Oxford, UK. The factor is, hence, called Christmas Factor. Christmas lived in Canada, and campaigned for blood transfusion safety until succumbing to transfusion-related [[AIDS]] at age 46. An alternative name for the factor is ''plasma thromboplastin component'', given by an independent group in California.<ref name=Giangrande/> |
|||
Hageman factor, now known as factor XII, was identified in 1955 in an asymptomatic patient with a prolonged bleeding time named of John Hageman. Factor X, or Stuart-Prower factor, followed, in 1956. This protein was identified in a Ms. Audrey Prower of London, who had a lifelong bleeding tendency. In 1957, an American group identified the same factor in a Mr. Rufus Stuart. Factors XI and XIII were identified in 1953 and 1961, respectively.<ref name=Giangrande/> |
|||
The view that the coagulation process is a "cascade" or "waterfall" was enunciated almost simultaneously by MacFarlane<ref name="pmid14167839">{{cite journal |author=MacFarlane RG |title=An enzyme cascade in the blood clotting mechanism, and its function as a biochemical amplifier |journal=Nature |volume=202 |issue= 4931|pages=498–9 |year=1964 |pmid=14167839 |doi=10.1038/202498a0|bibcode=1964Natur.202..498M }}</ref> in the UK and by Davie and Ratnoff<ref name="pmid14173416">{{cite journal |author=Davie EW, Ratnoff OD |title=Waterfall sequence for intrinsic blood clotting |journal=Science |volume=145 |issue= 3638|pages=1310–2 |year=1964 |pmid=14173416 |doi=10.1126/science.145.3638.1310|bibcode=1964Sci...145.1310D }}</ref> in the USA, respectively. |
|||
===Nomenclature=== |
|||
The usage of [[Roman numeral]]s rather than eponyms or systematic names was agreed upon during annual conferences (starting in 1955) of hemostasis experts. In 1962, consensus was achieved on the numbering of factors I-XII.<ref>{{cite journal |author=Wright IS |title=The Nomenclature of Blood Clotting Factors |journal=Can Med Assoc J |volume=86 |issue= 8|pages=373–4 |year=1962 |pmid=14008442 |doi= |pmc=1848865}}</ref> This committee evolved into the present-day International Committee on Thrombosis and Hemostasis (ICTH). Assignment of numerals ceased in 1963 after the naming of Factor XIII. The names Fletcher Factor and Fitzgerald Factor were given to further coagulation-related proteins, namely [[prekallikrein]] and [[high-molecular-weight kininogen]], respectively.<ref name=Giangrande/> |
|||
Factors III and VI are unassigned, as thromboplastin was never identified, and actually turned out to consist of ten further factors, and accelerin was found to be activated Factor V. |
|||
==Other species== |
|||
All mammals have an extremely closely related blood coagulation process, using a combined cellular and serine protease process.{{Citation needed|date=October 2012}} In fact, it is possible for any mammalian coagulation factor to "cleave" its equivalent target in any other mammal.{{Citation needed|date=October 2012}} The only non-mammalian animal known to use serine proteases for blood coagulation is the [[horseshoe crab]].<ref name="pmid15170505">{{cite journal |author=Osaki T, Kawabata S |title=Structure and function of coagulogen, a clottable protein in horseshoe crabs |journal=Cellular and Molecular Life Sciences : CMLS |volume=61 |issue=11 |pages=1257–65 |date=June 2004 |pmid=15170505 |doi=10.1007/s00018-004-3396-5 |url=}}</ref> |
|||
==References== |
|||
{{Research help|Med}} |
|||
{{reflist|2}} |
|||
==Further reading== |
|||
* {{cite journal|last=Hoffman|first=M |author2=Monroe DM, 3rd |title=A cell-based model of hemostasis.|journal=Thrombosis and haemostasis|date=June 2001|volume=85|issue=6|pages=958–65|pmid=11434702|url=http://www.researchgate.net/publication/11905719_A_cell-based_model_of_hemostasis/file/32bfe50effb02a63f1.pdf}} |
|||
* {{cite journal|last=Hoffman|first=Maureane|author2=Monroe, Dougald M.|title=Coagulation 2006: A Modern View of Hemostasis|journal=Hematology/Oncology Clinics of North America|volume=21|issue=1|pages=1–11|doi=10.1016/j.hoc.2006.11.004|pmid=17258114|year=2007}} |
|||
==External links== |
|||
{{Commons category|Coagulation}} |
|||
===3D structures=== |
|||
* {{UMichOPM|families|superfamily|97}} – Calculated orientations of complexes with [[GLA domain]]s in membrane |
|||
* {{UMichOPM|families|superfamily|48}} – [[Discoidin domain]]s of blood coagulation factors |
|||
{{Coagulation}} |
|||
{{Blood physiology}} |
|||
[[Category:Coagulation system]] |
|||
[[Category:Traumatology]] |
|||
--> |
|||
== Factores de coagulación == |
== Factores de coagulación == |
||
El proceso de coagulación implica toda una serie de reacciones enzimáticas encadenadas de tal forma que actúan como un alud o avalancha, amplificándose en cada paso: un par de moléculas iniciadoras activan un número algo mayor de otras moléculas, las que a su vez activan un número aún mayor de otras moléculas, etc. |
El proceso de coagulación implica toda una serie de reacciones enzimáticas encadenadas de tal forma que actúan como un alud o avalancha, amplificándose en cada paso: un par de moléculas iniciadoras activan un número algo mayor de otras moléculas, las que a su vez activan un número aún mayor de otras moléculas, etc. |
||
| Línea 272: | Línea 507: | ||
== Fibrinólisis == |
== Fibrinólisis == |
||
{{AP|Fibrinolisis}} |
{{AP|Fibrinolisis}} |
||
Después de que el coágulo se ha establecido, comienza la reparación de los tejidos afectados con el proceso de [[cicatrización]]. Para hacer posible esto el coágulo es colonizado por células que formarán nuevos tejidos y en el proceso va siendo degradado. |
Después de que el coágulo se ha establecido, comienza la reparación de los tejidos afectados con el proceso de [[cicatrización]]. Para hacer posible esto el coágulo es colonizado por células que formarán nuevos tejidos y en el proceso va siendo degradado. |
||
| Línea 282: | Línea 518: | ||
Este factor suele utilizarse en clínica para favorecer la disolución de trombos. |
Este factor suele utilizarse en clínica para favorecer la disolución de trombos. |
||
{{VT|Cicatrización}} |
|||
== Véase también == |
== Véase también == |
||
| Línea 289: | Línea 523: | ||
* [[émbolo]] |
* [[émbolo]] |
||
* [[factor de coagulación]] |
* [[factor de coagulación]] |
||
* [[Cicatrización]] |
|||
== Bibliografía == |
== Bibliografía == |
||
* Ch.4 Haemodynamic diseases. ''Kumar: Robbins and Cotran Pathologic Basis of Disease'' 8th Ed. 2009 Saunders (Elsevier). |
* Ch.4 Haemodynamic diseases. ''Kumar: Robbins and Cotran Pathologic Basis of Disease'' 8th Ed. 2009 Saunders (Elsevier). |
||
== Referencias == |
|||
{{listaref|2|refs="<ref name="isbn1-4051-8460-4">{{cite book |author=David Lillicrap; Nigel Key; Michael Makris; Denise O'Shaughnessy |title=Practical Hemostasis and Thrombosis |publisher=Wiley-Blackwell |location= |year=2009 |pages=1–5 |isbn=1-4051-8460-4 }}</ref> |
|||
<ref name="Michelson2006">{{cite book|author=Alan D. Michelson|title=Platelets|url=https://books.google.com/books?id=GnIQGmiSylkC&pg=PA3|accessdate=18 October 2012|date=26 October 2006|publisher=Academic Press|isbn=978-0-12-369367-9|pages=3–5}}</ref> |
|||
<ref name="Schmaier">{{Cite book | last1 = Schmaier | first1 = Alvin H. | last2 = Lazarus | first2 = Hillard M. | title = Concise guide to hematology | date = 2011 | publisher = Wiley-Blackwell | location = Chichester, West Sussex, UK | isbn = 978-1-4051-9666-6 | pages = 91 }}</ref> |
|||
<ref name=Furie>{{cite journal |author=Furie B, Furie BC |title=Thrombus formation in vivo |journal=J. Clin. Invest. |volume=115 |issue=12 |pages=3355–62 |year=2005 |pmid=16322780|doi=10.1172/JCI26987|url=http://www.jci.org/cgi/content/full/115/12/3355 |pmc=1297262}}</ref> |
|||
"}} |
|||
== Enlaces externos == |
== Enlaces externos == |
||
{{Commonscat|Coagulation}} |
{{Commonscat|Coagulation}} |
||
* [http://www.medmol.es/tema.cfm?id=75 Coagulación (material gráfico).] |
* [http://www.medmol.es/tema.cfm?id=75 Coagulación (material gráfico).] |
||
| Línea 299: | Línea 547: | ||
[[Categoría:Fisiología humana]] |
[[Categoría:Fisiología humana]] |
||
[[Categoría:Coagulación]] |
[[Categoría:Coagulación]] |
||
[[de:Hämostase#Übersicht über Gerinnungsfaktoren und Inhibitoren]] |
|||
Revisión del 22:12 7 abr 2016
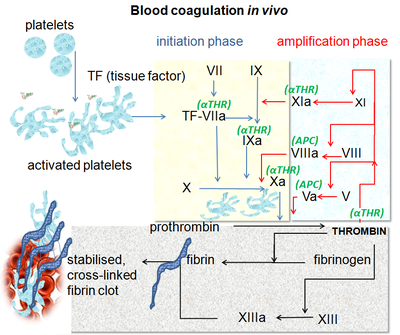

Se denomina coagulación al proceso por el cual la sangre pierde su liquidez convirtiéndose en un gel, para formar un coágulo. Este proceso potencialmente desemboca en la hemostasis, es decir, en el cese de la pérdida de sangre desde un vaso dañado, seguida por su reparación. El mecanismo de coagulación involucra la activación, adhesión y agregación plaquetaria, junto con el depósito y maduración de la fibrina. Los desórdenes de la coagulación son estados de enfermedad que pueden provocar hemorragias espontáneas, formación de hematomas o coagulación obstructiva (trombosis).[1]
El mecanismo de coagulación se encuentra altamente conservado a través de diferentes especies en la biología; en todos los mamíferos, la coagulación involucra a factores celulares (plaquetas) y factores proteicos (factores de coagulación).[2] El sistema ha sido extensamente estudiado en humanos, especie donde es mejor comprendido.[3]
La coagulación comienza casi instantáneamente luego de una herida que daña el endotelio de un vaso sanguíneo. La exposición de la sangre al espacio que se encuentra debajo del endotelio inicia dos procesos: cambios en las plaquetas, y exposición del factor tisular subendotelial al factor VII del plasma, lo cual conduce finalmente a la fomración de fibrina. Las plaquetas inmediatamente forman un tapón en el sitio de la lesión; este proceso se denomina hemostasis primaria. La hemostasis secundaria ocurre en simultáneo; los factores de coagulación proteicos más allá del factor VII responden en una compleja cascada de reacciones enzimáticas para formar fibras de fibrina, que fortalecen el tapón de plaquetas.[4]
Factores de coagulación
El proceso de coagulación implica toda una serie de reacciones enzimáticas encadenadas de tal forma que actúan como un alud o avalancha, amplificándose en cada paso: un par de moléculas iniciadoras activan un número algo mayor de otras moléculas, las que a su vez activan un número aún mayor de otras moléculas, etc.
En esta serie de reacciones intervienen más de 12 proteínas, iones de Ca2+ y algunos fosfolípidos de membranas celulares.
A cada uno de estos compuestos participantes en la cascada de coagulación se les denomina "Factor" y comúnmente se lo designa por un número romano elegido de acuerdo al orden en que fueron descubiertos.
Siete de los factores de coagulación (preacelerina —factor V—, protrombina —Factor II—, proconvertina —factor VII—, factor antihemofílico beta —IX—, factor Stuart —X—, tromboplastina plasmática —XI— y factor Hageman —XII—) son zimógenos sintetizados en el hígado, esto es, proenzimas que normalmente no tienen una actividad catalítica importante, pero que pueden convertirse en enzimas activas cuando se hidrolizan determinadas uniones peptídicas de sus moléculas.
Estas proenzimas, una vez recortadas, se convierten en proteasas de la familia de las serina proteasas; capaces de activar a las siguientes enzimas de la cascada.
Una enzima activa "recorta" una porción de la siguiente proteína inactiva de la cascada, activándola.
Algunos factores de coagulación requieren vitamina K para activarse y funcionar, entre ellos los factores II (protrombina), VII (proconvertina), IX (antihemofílico beta) y X (Stuart).
| Factor | Nombre | Masa (KDa) | Nivel en plasma (mg/dl) | Función | ||||
| I | Fibrinógeno | 340 | 250-400 | Se convierte en fibrina por acción de la trombina. La fibrina constituye la red que forma el coágulo. | ||||
| II | Protrombina | 72 | 10-14 | Se convierte en trombina por la acción del factor Xa. La trombina cataliza la formación de fibrina a partir de fibrinógeno. | ||||
| III | Factor tisular de tromboplastina | Se libera con el daño celular; participa junto con el factor VIIa en la activación del factor X por la vía extrínseca. | ||||||
| IV | Ion Calcio | 40 Da | 4-5 | Median la unión de los factores IX, X, VII y II a fosfolípidos de membrana. | ||||
| V | proacelerina (leiden) | 350 | 1 | Potencia la acción de Xa sobre la protrombina | ||||
| VI | Variante activada del factor V | -- | -- | -- | ||||
| VII | Proconvertina | 45-54 | 0.05 | Participa en la vía extrínseca, forma un complejo con los factores III y Ca2+ que activa al factor X. | ||||
| VIII:C | Factor antihemofílico | 285 | 0.1-0.2 | Indispensable para la acción del factor X (junto con el IXa). Su ausencia provoca hemofilia A. | ||||
| VIII R:Ag | Factor Von Willebrand | >10000 | Media la unión del factor VIII:C a plaquetas. Su ausencia causa la Enfermedad de Von Willebrand. | |||||
| IX | Factor Christmas | 57 | 0.3 | Convertido en IXa por el XIa. El complejo IXa-VIII-Ca2+ activa al factor X. Su ausencia es la causa de la hemofilia B. | ||||
| X | Factor Stuart-Prower | 59 | 1 | Activado por el complejo IXa-VIII-Ca2+ en la vía intrinseca o por VII-III-Ca2+ en la extrínseca, es responsable de la hidrólisis de protrombina para formar trombina. | ||||
| XI | Tromboplastina plasmática o antecedente trombo plastínico de plasma | 160 | 0.5 | Convertido en la proteasa XIa por acción del factor XIIa; XIa activa al factor IX. Su ausencia es la causa de la hemofilia C. | ||||
| XII | Factor Hageman | 76 | -- | Se activa en contacto con superficies extrañas por medio de calicreína asociada a cininógeno de alto peso molecular(CAMP); convierte al factor XI en XIa. | ||||
| XIII | Pretransglutaminidasa o factor Laili-Lorand | 320 | 1-2 | Activado a XIIIa, también llamado transglutaminidasa, por la acción de la trombina. Forma enlaces cruzados entre restos de lisina y glutamina contiguos de los filamentos de fibrina, estabilizándolos. | ||||
| Precalicreína | Factor Fletcher | -- | -- | Activada a calicreína, juntamente con el Cininógeno de alto peso molecular (CAMP) convierte al factor XII en XIIa. | ||||
| quininógeno de alto peso molecular | Factor Fitzgerald-Flaujeac-Williams | -- | -- | Coayuda con la calicreína en la activación del factor XII. | ||||
Etapas de la cascada de coagulación

La cascada de coagulación se divide para su estudio, clásicamente en tres vías: La vía intrínseca, la vía extrínseca y la vía común.
Las vías intrínseca y extrínseca son las vías de iniciación de la cascada, mientras que la vía común es hacia donde confluyen las otras dos desembocando en la conversión de fibrinógeno en fibrina.
Esta división es un tanto arbitraria y tiene más que ver con las deficiencias de las técnicas que en su momento se utilizaron para desentrañar los mecanismos implicados, que con lo que ocurre realmente en una lesión vascular; ya que en este último caso se establecen varias interrelacciones entre las vías de iniciación.
Mecanismo básico
Cada reacción de estas vías da como resultado el ensamblado de un complejo compuesto por una enzima (factor de coagulación activado), un sustrato (proenzima de un factor de coagulación) y un cofactor que actúa posibilitando la reacción.
Estos componentes se ensamblan en general sobre una superficie fosfolipídica y se mantienen unidos por medio de puentes formados por iones Ca2+. Por lo tanto la reacción en cascada tiende a producirse en un sitio donde este ensamblaje puede ocurrir; por ejemplo sobre la superficie de plaquetas activadas.
Tanto la vía intrínseca como la vía extrínseca desembocan en la conversión del factor X en Xa (la letra "a" como subíndice "a" significa "activado") punto en el que se inicia la vía común.
Vía intrínseca
Recibe este nombre debido a que antiguamente se pensaba que la sangre era capaz de coagular "intrínsecamente" por esta vía sin necesidad de contar con la ayuda de factores externos. Actualmente se sabe que esto no es exactamente así. De hecho la vía extrínseca es la que realmente inicia el proceso y la vía intrínseca sirve de amplificación y seguridad del proceso hemostático.
El proceso de coagulación en esta vía se desencadena cuando la sangre entra en contacto con una superficie "extraña", es decir, diferente al endotelio vascular.
En el caso de una lesión vascular, la membrana basal del endotelio o las fibras colágenas del tejido conectivo, proporcionan el punto de iniciación.
En general las superficies polianiónicas (cargadas negativamente) pueden cumplir el mismo papel, tanto materiales orgánicos como la celulosa, o no orgánicos como el vidrio, el caolín o algunas resinas pueden actuar como desencadenantes de la reacción.
A esta vía es posible subdividirla en tres pasos:
Formación del factor XIa
En esta etapa participan cuatro proteínas: Precalicreína, Quininógeno de alto peso molecular (HMWK) y los factores XII y XI. Esta etapa no requiere de iones calcio.
Estos cuatro factores se adsorben sobre la superficie cargada negativamente, formando el complejo cebador o de iniciación. De estos factores el XII funciona como verdadero iniciador, ya que si bien es una proenzima, posee una pequeña actividad catalítica que alcanza para activar a la precalicreína convirtiéndola en calicreína.
En segunda instancia la calicreína actúa catalíticamente sobre el factor XII para convertirlo en XIIa, una enzima muchísimo más activa. La actividad catalítica de la calicreína se ve potenciada por el HMWK.
Por último la proteasa XIIa actúa sobre el factor XI para liberar XIa.

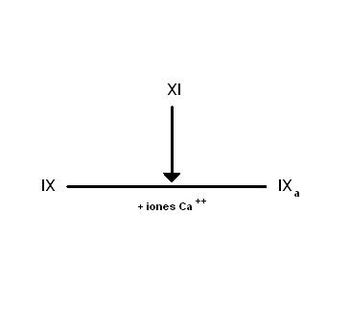
Formación del factor IXa
El factor IX se encuentra en el plasma como una proenzima. En presencia de iones Ca2+ el factor XIa cataliza la ruptura de una unión peptídica en la molécula del factor IX para formar un glucopéptido de 10 KDa y liberar por otro lado al factor IXa.
El factor IX se encuentra ausente en personas con hemofilia tipo B.
Formación del factor Xa
Sobre la membrana de las plaquetas se forma un complejo constituido por los factores IXa, X y VIII.
Los residuos gamma-carboxiglutamato de los factores IXa y X actúan como quelantes del ion Ca2+, permitiendo que estos componentes formen un complejo unido por medio de puentes de iones calcio y ayudando a que el complejo se ancle a los fosfolípidos de membrana.
Primero se unen los factores X y IXa a la membrana y luego se une el VIII.
El factor VIII es en realidad un heterodímero, formado por cuatro cadenas proteicas, cada una codificada por un gen diferente (VIII:C y VIII:R). El componente VIII:C es conocido como "componente antihemofílico" y actúa como cofactor del IXa en la activación del factor X, el componente VIII:R es el que permite la unión del factor VIII al complejo.
La ausencia del componente antihemofílico causa hemofilia A.
El complejo formado por los factores IXa-X-VIII-Fosfolípidos y Ca2+ actúa sobre el factor X para convertirlo en Xa.
En este punto concluye la vía intrínseca.
Vía extrínseca
Recibió este nombre debido a que fue posible notar desde un primer momento que la iniciación de esta vía requería de factores ajenos a la sangre.
Cuando la sangre entra en contacto con tejidos lesionados o se mezcla con extractos de tejidos, se genera muy rápidamente factor Xa. En este caso la activación de la proenzima X es mediada por un complejo formado por factor VII, Ca2+ y factor tisular (factor III) unido a fosfolípidos provenientes de las membranas celulares rotas y de las plaquetas (antiguamente este complejo factor tisular-fosfolípidos era conocido como tromboplastina).
El factor tisular es una lipoproteína sintetizada en el endotelio de los vasos sanguíneos de todos los tejidos, aunque es especialmente abundante en pulmón, cerebro y placenta. El factor tisular se encuentra normalmente "secuestrado" en el interior de las células endoteliales y es secretado en respuesta a una lesión, o bajo el efecto de algunas citoquinas tales como el Factor de Necrosis Tumoral (TNF), InterLeucina 1 (IL-1); o por endotoxinas bacterianas.
La vía extrínseca es muy rápida, se cumple en apenas unos segundos y comprende dos pasos; mientras que la intrínseca insume varios minutos.
Formación del factor VIIa
En primera instancia el factor VII se une a la porción fosfolipídica del factor tisular gracias a sus residuos gamma-carboxiglutamato, utilizando iones Ca2+ como puentes. Este complejo provoca la activación del factor VIIa.
Formación del factor Xa
El complejo VIIa-III-Ca2+ actúa sobre el factor X convirtiéndolo en la proteasa activa Xa. En este punto termina la vía extrínseca y se inicia la vía común
Vía común
Llegando al punto en que se activa el factor X, ambas vías confluyen en la llamada vía común.
La vía común termina con la conversión de fibrinógeno en fibrina, y el posterior entrecruzamiento de la misma estabilizando el coágulo.
La vía común implica tres etapas:
Formación de trombina

La trombina (también llamada factor II a) es una proteasa generada por la ruptura de la cadena proteica de la proenzima protrombina (factor II), una glicoproteína constituida por 582 aminoácidos y con 12 puentes disulfuro intracatenarios.
La trombina se activa luego de que la proteasa Xa hidroliza dos uniones peptídicas de la protrombina. La Xa produce en primer término la escisión de un fragmento de 32 KDa de la región N-terminal de la cadena, cortándola sobre una unión arginina-treonina. En segundo término produce la ruptura de un enlace entre una arginina y una isoleucina; sin embargo estos dos últimos fragmentos permanecen unidos por un puente disulfuro.
La trombina es una serina-proteasa similar a la tripsina, pero mucho más selectiva. Ataca casi de manera exclusiva las uniones arginina con un aminoácido cargado positivamente en sus sustratos.
La conversión de protrombina a trombina debida al factor Xa se acelera notablemente por la formación de un complejo con el factor Va y Ca2+ sobre la superficie de las membranas plaquetarias (fosfolípidos de membrana).
El factor Xa y la protrombina se adsorben sobre la membrana utilizando iones Ca2+ como puentes. El factor Va se une a la protrombina acelerando la reacción.
El factor Va se produce por la acción de la trombina sobre el factor V en un claro ejemplo de una reacción que va acelerándose a medida que progresa (reacción autoacelerada).
Formación de fibrina
El fibrinógeno (factor I) es una glicoproteína compuesta por seis cadenas polipeptídicas: dos A-alfa, dos B-beta y dos gamma; unidas entre sí por puentes disulfuro.
Se trata de una molécula alargada y simétrica formada por tres dominios globulares conectados por segmentos fibrilares.
Cada mitad de la molécula se encuentra formada por tres cadenas (A-alfa, B-beta y gamma) que se enrollan en una triple hélice muy compacta en los sectores fibrilares. Los extremos amino de las seis cadenas se reúnen en el dominio globular central.
En un hecho que parecería muy curioso, los extremos N-terminales de las cadenas A-alfa y B-beta emergen como cabos libres del dominio globular central.

Estas cadenas son muy ricas en aspartato y glutamato, además las cadenas B-beta poseeen en esta región residuos tirosina-O-sulfato formados postraduccionalmente. Estos residuos con una alta tendencia a adquirir carga negativa contribuyen a formar una región central con una muy alta densidad de carga.
Esta región electronegativa central es la responsable de la repulsión entre moléculas de fibrina que las mantiene en solución.
La trombina ataca los enlaces arginina-glicina presentes en estos "cabos libres", separando cuatro péptidos; dos segmentos A de 18 aminoácidos cada uno (provenientes de las cadenas A-alfa), y dos segmentos B de 20 aminoácidos (provenientes de las cadenas B-beta). A estos péptidos se los suele denominar "fibrinopéptidos".
El resto que queda de la molécula es un monómero de fibrina de composición alfa2beta2gamma2.
Al eliminarse los fibrinopéptidos desaparecen las fuerzas de repulsión intermoleculares con lo que los monómeros de fibrina tienden a agruparse espontáneamente formando asociaciones altamente ordenadas.
Los monómeros se disponen uno a continuación del otro, cabeza con cabeza en forma de largas hebras. Estas hebras a su vez forman manojos, emparejándose con otras hebras de tal manera que la región central de los monómeros de fibrina de una se encuentra rodeada por las cabezas de los monómeros de fibrina de las otras.
Este emparejamiento se hace posible gracias a interaciones de tipo electrostático y puente hidrógeno entre las regiones centrales de los monómeros de una y las cabezas globulares de otras.
Entrecruzamiento de la fibrina
Los haces paralelos de fibrina polimerizada forman una asociación laxa, que se encuentra en equilibrio con la forma monomérica de la molécula; por lo que sería imposible que cumplieran su papel de formar un coágulo estable sin reforzar esta estructura por medio de enlaces covalentes entre hebras vecinas.
La formación de estos "puentes" covalentes intercatenarios es catalizada por la enzima transglutaminasa (conocida también como factor XIIIa).
La transglutaminidasa cataliza la formación de enlaces amida entre restos glutamina y lisina de hebras próximas entre sí. En la reacción se libera amoníaco en forma de ion amonio (NH4+).
Esta enzima se forma a partir del factor XIII por acción de la trombina.
Regulación y modulación de la cascada
Debido a que la cascada de coagulación consiste en una serie de reacciones que van amplificándose y acelerándose en cada paso, es lógico pensar que debe existir algún mecanismo de regulación; un "freno" a la reacción en cadena; ya que de progresar sin control en pocos minutos podría provocar un taponamiento masivo de los vasos sanguíneos (trombosis diseminada).
Varios mecanismos intervienen en la regulación de la cascada de reacciones:
- El flujo sanguíneo normal, arrastra a los factores activados, diluyendo su acción e impidiéndoles acelerarse. Esta es una de las razones por las cuales cuando existe estasis del flujo sanguíneo se favorece la formación de trombos.
- El hígado actúa como un filtro quitando de la sangre en circulación los factores activados e inactivándolos.
- Existen además algunas proteasas que degradan específicamente a ciertos factores activados, y otras que ejercen acciones inhibitorias sobre factores activos.
Proteína C
La proteína C es una proenzima que se encuentra normalmente en el plasma, y cuya síntesis en el hígado es dependiente de la vitamina K.
Esta proteína es convertida en una proteasa activa por la acción de la trombina.
La proteína Ca actúa específicamente degradando a los factores Va y VIIIa, con lo que limita la proyección de la cascada.
Es interesante notar el triple papel que desempeña la trombina: cataliza la formación de fibrina, activa a la enzima responsable de su entrecruzamiento, y una vez que el proceso de coagulación y estabilización del coágulo está en marcha; ejerce acciones tendientes a limitarlo.
Antitrombina III
La antitrombina III es una glicoproteína de 60 kDa sintetizada en el hígado sin depender de la vitamina K, es considerada la principal inhibidora de la coagulación.
Esta proteína actúa inhibiendo irreversiblemente a varios factores procoagulantes activos, el principal de los cuales es la trombina; aunque también actúa sobre la calicreína y los factores IXa, Xa, XIa y XIIa.
La acción de la antitrombina es notablemente aumentada por el heteropolisacárido heparina. La heparina se encuentra en el endotelio de los vasos sanguíneos y en los gránulos de las células cebadas, tiene una poderosa acción anticoagulante ya que facilita la unión de la antitrombina III con los factores procoagulantes activos.
Existen otras anti-proteasas sanguíneas que también ejercen acción anticoagulante aunque menos potente tales como la alfa2 macroglobulina y la alfa1 antitripsina.
Anticoagulantes
Un anticoagulante es, como su nombre lo indica, una sustancia química que retrasa o impide la coagulación de la sangre, ya sea en el interior de un organismo (In Vivo) o en el exterior (In Vitro)
Existen diferentes tipos de anticoagulantes que actúan dificultando o impidiendo alguno de los pasos de la cascada de coagulación.
Existen dos tipos principales de anticoagulantes, los anticoagulantes para uso "In Vitro" y los que tienen empleo "In Vivo", entre estos últimos se encuentran los medicamentos con acción anticoagulante.
En general los anticoagulantes para uso In Vitro actúan como quelantes del ion Ca2+, de manera tal que este no puede participar en la formación de los complejos que activan al factor X, y por lo tanto se interrumpe la cascada de coagulación casi en su inicio.
Los anticoagulantes para uso In Vivo actúan de maneras un poco más complicadas. La adición de algunos agentes quelantes tales como el EDTA entrañan un grave riesgo para la salud del individuo sometido a tratamiento, ya que estos agentes son capaces de acomplejar gran cantidad de iones con alta afinidad, algunos de los cuales desempeñan importantes funciones en el organismo tales como el Cu2+, Fe3+, Zn2+, etc; mientras que otros agentes acomplejantes del calcio tales como el citrato, no tienen gran utilidad ya que son rápidamente metabolizados perdiendo su capacidad anticoagulante.
Entre los anticoagulantes para uso in vivo encontramos sustancias tales como la heparina o los anticoagulantes dicumarínicos.
Para uso In Vitro
- EDTA (C10H16N2O8) o sal disódica, dipotásica o tripotásica del ácido etilendiaminotetraacético. 8 Esta sustancia actúa mediante un efecto quelante sobre el ion calcio (Ca2+), lo que impide la formación de los complejos procoagulantes en los que este ion participa. Este anticoagulante se utiliza fundamentalmente para la realización de recuentos celulares, sobre todo en autoanalizador. Tiene la ventaja de permitir la realización del hematocrito y de frotis sanguíneo hasta dos horas después de la extracción de la muestra. También impide la aglutinación de las plaquetas.
- Heparina Sódica. Heparina de Litio, es un anticoagulante fisiológico que actúa impidiendo que la protrombina se transforme en trombina. Estructuralmente es un mucopolisacárido ácido que posee grupos sulfato. Esta última característica no la hace adecuada para muestras que van a ser examinadas al microscopio luego de tinción, ya que altera notablemente las coloraciones obtenidas.
- Citrato Trisódico (C6H5O7Na3) actúa impidiendo que el calcio se ionice, evitando así la coagulación. Se utiliza principalmente para realizar pruebas de hemostasia; así como también para medir la velocidad de eritrosedimentación.
- ACD, es un anticoagulante formado por una mezcla de compuestos (Ácido citrico Citrato y Dextrosa en una proporción de 0.9, 2 y 2 g respectivamente en 120 ml de agua destilada) se emplea fundamentalmente en bancos de sangre para conservar las unidades de sangre y para realizar estudios metabólicos eritrocitarios ya que permite una buena conservación de los hematíes.
Anticoagulantes para uso In Vivo (medicamentos anticoagulantes)
Este grupo de anticoagulantes se definen como "medicamentos que impiden la coagulación o la agregación plaquetaria"
Este tipo de medicamentos tienen utilidad en aquellas patologas causadas por un trombo sanguíneo, ya sea para facilitar su disolución (trombolisis) o bien para prevenir que los trombos se repitan.
En este artículo vamos a centrarnos en aquellos que impiden la cascada de coagulación:
- La heparina alarga el tiempo de coagulación, se administra generalmente mediante inyección subcutánea o endovenosa.
Ya que es un compuesto fisiológico presente en gran cantidad en los mamíferos, comúnmente se utiliza heparina obtenida de pulmón de vaca o de mucosa intestinal de cerdo convenientemente purificada. La potencia difiere según el origen, pero hoy en día vienen estandarizadas en UI, por lo que se pueden comparar solo con este índice.
Comercialmente se obtiene en forma de dos sales (cálcica y sódica) que no guardan demasiada diferencia en su actividad. Las cálcicas se usan preferentemente por vía subcutánea, ya que resultan menos dolorosas, pero por vía endovenosa pueden utilizarse ambas. La heparina NUNCA se administra vía intramuscular.
La Heparina se utiliza cuando se precisa de acción anticoagulante rápida y por poco tiempo. En la prevención de trombosis venosas de cirugía se utiliza a bajas dosis, 5.000UI, dos horas antes de la intervención y después cada 12 horas hasta el alta del paciente.
Las heparinas de bajo peso molecular son fragmentos de peso molecular entre 3.500 y 6.000, con ello tiene una vida más larga y aumenta su biodisponibilidad. Tiene una menor inhibición de la agregación plaquetaria. No sustituyen a las heparinas tradicionales sino que en terapias de baja dosis son más cómodas porque se aplican una sola vez al día.
En terapias de altas dosis se utilizan las heparinas tradicionales.
- Hirudina
- Anticoagulantes dicumarínicos. Reciben este nombre genérico un grupo de compuestos derivados del Dicumarol (un compuesto extraído del trébol dulce) entre los que se encuentran el Acenocumarol (el de uso más frecuente en España, bajo el popular nombre de Sintrom) y la Warfarina. Estos medicamentos presentan la ventaja de poder ser administrados por vía oral y de poseer un efecto prolongado en el tiempo, con gran variabilidad interindividual, por ello necesitan controles periódicos para su ajuste terapéutico.
Todos ellos son inhibidores de la vitamina K (aVK). Debido a que la vitamina K interviene como cofactor enzimático en la síntesis de los factores II,VII,IX y X (concretamente en la gamma-carboxilación de estos); el resultado es que provoca la aparición en sangre, de unas formas inactivas de los mismos denominadas PIVKAs (“Proteins Induced by Vitamin K Antagonists”).
Dada la diferente vida media que presentan los factores de coagulación (el tiempo que permanecen en sangre antes de ser degradados), por ejemplo el VII comienza a descender en 6 horas pero el II tarda cerca de 70, no se consigue una anticoagulación efectiva hasta el 3º-4º día de tratamiento y el efecto no se estabiliza hasta después de una semana.
Curioso es que la activación de dos inhibidores fisiológicos de la coagulación como son las Proteínas C y S de importancia fundamental (inhiben a los Factores V y VIII activados), también depende de la Vit. K, por lo que los cumarínicos originan una “paradoja bioquímica” anticoagulante-procoagulante.
No obstante, su efecto anticoagulante supera ampliamente al procoagulante, por lo que solo puede tener consecuencias clínicamente significativas en raros casos (Déficits congénitos de Proteína C o S) y de forma transitoria al inicio del tratamiento.
Fibrinólisis
Después de que el coágulo se ha establecido, comienza la reparación de los tejidos afectados con el proceso de cicatrización. Para hacer posible esto el coágulo es colonizado por células que formarán nuevos tejidos y en el proceso va siendo degradado.
La degradación de la fibrina (fibrinólisis), componente mayoritaria del coágulo, es catalizada por la enzima plasmina, una serina proteasa que ataca las uniones peptídicas en la región triple hélice de los monómeros de fibrina.
La plasmina se genera a partir del plasminógeno, un precursor inactivo; activándose tanto por la acción de factores intrínsecos (propios de la cascada de coagulación) como extrínsecos, el más importante de los cuales es producido por el endotelio vascular. Se le denomina "activador tisular del plasminógeno" (t-PA).
El gen de este factor ha sido clonado y actualmente se puede obtener la proteína producida por tecnología de ADN recombinante.
Este factor suele utilizarse en clínica para favorecer la disolución de trombos.
Véase también
Bibliografía
- Ch.4 Haemodynamic diseases. Kumar: Robbins and Cotran Pathologic Basis of Disease 8th Ed. 2009 Saunders (Elsevier).
Referencias
- ↑ David Lillicrap; Nigel Key; Michael Makris; Denise O'Shaughnessy (2009). Practical Hemostasis and Thrombosis. Wiley-Blackwell. pp. 1-5. ISBN 1-4051-8460-4.
- ↑ Alan D. Michelson (26 October 2006). Platelets. Academic Press. pp. 3-5. ISBN 978-0-12-369367-9. Consultado el 18 October 2012.
- ↑ Schmaier, Alvin H.; Lazarus, Hillard M. (2011). Concise guide to hematology. Chichester, West Sussex, UK: Wiley-Blackwell. p. 91. ISBN 978-1-4051-9666-6.
- ↑ Furie B, Furie BC (2005). «Thrombus formation in vivo». J. Clin. Invest. 115 (12): 3355-62. PMC 1297262. PMID 16322780. doi:10.1172/JCI26987.
Enlaces externos
 Wikimedia Commons alberga una categoría multimedia sobre Coagulación.
Wikimedia Commons alberga una categoría multimedia sobre Coagulación.- Coagulación (material gráfico).
