Diferencia entre revisiones de «Piridina»
agrego chembox |
agrego ocurrencia y formateo |
||
| Línea 68: | Línea 68: | ||
|doi = 10.1002/prac.19241070110}}</ref> Este método aún se usa en la producción industrial de la piridina<ref name=ul/> |
|doi = 10.1002/prac.19241070110}}</ref> Este método aún se usa en la producción industrial de la piridina<ref name=ul/> |
||
== |
== Existencia en la naturaleza == |
||
| ⚫ | La '''piridina''' se presenta en un sinfín de compuestos relacionados a la vida (pero no en su forma pura), entre ellos el [[Nicotinamida adenina dinucleótido|NAD]], la [[nicotina]], la [[vitamina B3]] ó niacina (cuya falta causa pelagra), y la [[vitamina B6]] ó piridoxina, y las [[bases pirimidínica]]s [[timina]], [[citosina]] y [[uracilo]], entre otros. |
||
| ⚫ | La '''piridina''' tiene un [[punto de fusión]] de -42 °C y un [[punto de ebullición]] de unos 115 °C. Esto hace de la '''piridina''' un líquido incoloro, maloliente y nocivo a temperatura ambiente, [[miscible]] en alcohol y el agua, de reacción ligeramente básica, y forma un clorhidrato cristalino de p.f.145 °C al reaccionar con cloruro de hidrógeno. La [[electronegatividad]] del átomo de [[nitrógeno]] empobrece la densidad electrónica del anillo, haciéndolo menos susceptible a la sustitución electrofílica y fomentando la metalación por medio de bases fuertes. |
||
| ⚫ | Sin embargo, la '''piridina''' pura no está muy extendida en la naturaleza es una sustancia nociva si se la inhala, ingiere o si se absorbe por la piel. Reduce la fertilidad masculina y femenina y es considerada un [[carcinógeno]]. Los síntomas de exposición más comunes son: dolor de cabeza, tos, dificultad respiratoria, [[laringitis]], [[náusea]]s y [[vómito]]s. |
||
| ⚫ | El par de electrones ecuatoriales del nitrógeno no participa en el sistema pi aromático en la '''piridina'''. Esto hace, de dicho compuesto, una base con propiedades químicas similares a las [[amina]]s terciarias, siendo el pKa de su ácido conjugado 5,30. La reacción de la '''piridina''' con ácidos la protona y forma un [[ion]] aromático poliatómico cargado positivamente al que se le da el nombre de catión piridinio. Los ángulos y longitudes de unión entre ella y en el catión piridinio no varían considerablemente,<ref>Tadeusz M. Krygowski, Halina Szatyowicz, and Joanna E. Zachara [[J. Org. Chem.]] '''2005''' 70(22) 8859 - 8865; DOI: 10.1021/jo051354h [http://pubs3.acs.org/acs/journals/doilookup?in_doi=10.1021/jo051354h Abstract]</ref> debido a que la protonación no involucra al sistema pi aromático. |
||
En la naturaleza, en su forma más perjudicial se la encuentra en las hojas y raíces de la belladona (''[[Atropa belladonna]]'')<ref>G. A. Burdock (ed.) ''Fenaroli's Handbook of Flavor Ingredients'', Vol. II, 3rd Edition, CRC Press, Boca Raton, 1995, ISBN 0-8493-2710-5</ref> y en el malvavisco (''[[Althaea officinalis]]'').<ref>A. Täufel, W. Ternes, L. Tunger, M. Zobel: ''Lebensmittel-Lexikon'', 4th ed., p. 450, Behr, 2005, ISBN 3-89947-165-2</ref> Pero como vimos, los derivados de la piridina se encuentran en ciertas biomoléculas como los nucleótidos de piridina y alcaloides. En la vida diaria se encuentran trazas de piridina como componentes volátiles de compuestos orgánicos que se generan en los procesos de tostación y enlatado. Como es el caso del pollo frito,<ref>{{cite journal|last1=Tang|first1=Jian|last2=Jin|first2=Qi Zhang|last3=Shen|first3=Guo Hui|last4=Ho|first4=Chi Tang|last5=Chang|first5=Stephen S.|title=Isolation and identification of volatile compounds from fried chicken|journal=Journal of Agricultural and Food Chemistry|volume=31|pages=1287|year=1983|doi=10.1021/jf00120a035}}</ref> [[sukiyaki]],<ref>{{cite journal|last1=Shibamoto|first1=Takayuki|last2=Kamiya|first2=Yoko|last3=Mihara|first3=Satoru|title=Isolation and identification of volatile compounds in cooked meat: sukiyaki|journal=Journal of Agricultural and Food Chemistry|volume=29|pages=57|year=1981|doi=10.1021/jf00103a015}}</ref> [[panceta]] frita,<ref>{{cite journal|last1=Ho|first1=Chi Tang|last2=Lee|first2=Ken N.|last3=Jin|first3=Qi Zhang|title=Isolation and identification of volatile flavor compounds in fried bacon|journal=Journal of Agricultural and Food Chemistry|volume=31|pages=336|year=1983|doi=10.1021/jf00116a038}}</ref> [[Beaufort (queso)|el queso Beaufort]],<ref>{{cite journal|last1=Dumont|first1=Jean Pierre|last2=Adda|first2=Jacques|title=Occurrence of sesquiterpene in mountain cheese volatiles|journal=Journal of Agricultural and Food Chemistry|volume=26|pages=364|year=1978|doi=10.1021/jf60216a037}}</ref> el aroma del café,<ref>{{cite journal|last1=Aeschbacher|first1=HU|last2=Wolleb|first2=U|last3=Löliger|first3=J|last4=Spadone|first4=JC|last5=Liardon|first5=R|title=Contribution of coffee aroma constituents to the mutagenicity of coffee|journal=Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association|volume=27|issue=4|pages=227–32|year=1989|pmid=2659457}}</ref> el [[té negro]]<ref>{{cite journal|last1=Vitzthum|first1=Otto G.|last2=Werkhoff|first2=Peter.|last3=Hubert|first3=Peter.|title=New volatile constituents of black tea flavored|journal=Journal of Agricultural and Food Chemistry|volume=23|pages=999|year=1975|doi=10.1021/jf60201a032}}</ref> y la miel de girasol.<ref>A. Täufel, W. Ternes, L. Tunger, M. Zobel: ''Lebensmittel-Lexikon'', 4th ed., p. 226, Behr, 2005, ISBN 3-89947-165-2</ref> El humo del [[tabaco]]<ref>{{cite journal|last1=Curvall|first1=Margareta|last2=Enzell|first2=Curt R.|last3=Pettersson|first3=Bertil|title=An evaluation of the utility of four in vitro short term tests for predicting the cytotoxicity of individual compounds derived from tobacco smoke|journal=Cell Biology and Toxicology|volume=1|issue=1|pages=173|year=1984|pmid=6400922|doi=10.1007/BF00125573}}</ref><ref>{{cite journal|last1=Schmeltz|first1=Irwin.|last2=Hoffmann|first2=Dietrich.|title=Nitrogen-containing compounds in tobacco and tobacco smoke|journal=Chemical Reviews|volume=77|pages=295|year=1977|doi=10.1021/cr60307a001}}</ref> y el de la [[marihuana]]<ref name=osha/> contienen piridina. |
|||
== Existencia en la naturaleza == |
|||
== Propiedades físicas y químicas == |
|||
| ⚫ | La '''piridina''' tiene un [[punto de fusión]] de -42 °C y un [[punto de ebullición]] de unos 115 °C. Esto hace de la '''piridina''' un líquido incoloro, maloliente y nocivo a temperatura ambiente, [[miscible]] en alcohol y el agua, de reacción ligeramente básica, y forma un clorhidrato cristalino de p.f.145 °C al reaccionar con cloruro de hidrógeno. La [[electronegatividad]] del átomo de [[nitrógeno]] empobrece la densidad electrónica del anillo, haciéndolo menos susceptible a la sustitución electrofílica y fomentando la metalación por medio de bases fuertes. |
||
| ⚫ | La '''piridina''' se presenta |
||
| ⚫ | El par de electrones ecuatoriales del nitrógeno no participa en el sistema pi aromático en la '''piridina'''. Esto hace, de dicho compuesto, una base con propiedades químicas similares a las [[amina]]s terciarias, siendo el pKa de su ácido conjugado 5,30. La reacción de la '''piridina''' con ácidos la protona y forma un [[ion]] aromático poliatómico cargado positivamente al que se le da el nombre de catión piridinio. Los ángulos y longitudes de unión entre ella y en el catión piridinio no varían considerablemente,<ref>Tadeusz M. Krygowski, Halina Szatyowicz, and Joanna E. Zachara [[J. Org. Chem.]] '''2005''' 70(22) 8859 - 8865; DOI: 10.1021/jo051354h [http://pubs3.acs.org/acs/journals/doilookup?in_doi=10.1021/jo051354h Abstract]</ref> debido a que la protonación no involucra al sistema pi aromático. |
||
| ⚫ | Sin embargo, la '''piridina''' pura es una sustancia nociva si se la inhala, ingiere o si se absorbe por la piel. Reduce la fertilidad masculina y femenina y es considerada un [[carcinógeno]]. Los síntomas de exposición más comunes son: dolor de cabeza, tos, dificultad respiratoria, [[laringitis]], [[náusea]]s y [[vómito]]s. |
||
== Obtención == |
== Obtención == |
||
Revisión del 21:46 14 mar 2011
| Plantilla:Chembox header| Piridina | |
|---|---|
| |
| Nombre IUPAC | Piridina |
| Otros nombres | Azabenceno, Azina, py |
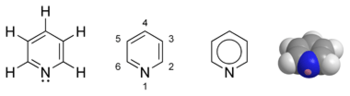
| Fórmula empírica | C5H5N |
| Masa molecular | 79,10 g/mol |
| Estado físico/Color | Líquido/Incoloro |
| Número CAS | 110-86-1 |
| Plantilla:Chembox header | Propiedades | |
| Densidad | 0,9819 g/cm3 a 20 °C |
| Punto de fusión | -41,16 °C (232,0 K) |
| Punto de ebullición | 115,2 °C (388 K) |
| Solubilidad en agua | miscible en agua |
| Plantilla:Chembox header | Información de Seguridad | |
 
| |
| Frases R: R11-20, R21, R22
Frases S: S26-28 | |
| Plantilla:Chembox header | Exenciones y Referencias[1][2][3] | |
La piridina (fórmula molecular C5H5N, masa molecular: 79,10) es un líquido incoloro de olor desagradable, similar al pescado en mal estado. Pertenece a la familia de los compuestos aromáticos heterocíclicos, y está estructuralmente relacionada al benceno, siendo la única diferencia entre ellos el reemplazo de un grupo CH del anillo bencénico por un átomo de nitrógeno.
El olor puede llegar a ser nauseabundo y provocar estornudos.
Historia

La piridina impura fue sin dudas preparada por los primeros alquimistas al calentar huesos animales y otra materia orgánica,[4] pero la referencia documentada más temprana se adjudica al científico escocés Thomas Anderson.[5][6] En 1849, Anderson examinó el contenido del aceite obtenido a través del calentamiento a altas temperaturas de huesos animales.[6] Entre otras sustancias, separó del aceite un líquido incoloro de olor desagradable, desde el cual aíslo piridina pura dos años después. La describió como altamente soluble en agua, fácilmente soluble en ácidos concentrados y sales luego de calentarla y levemente soluble en aceites. Debido a su inflamabilidad, Anderson llamó a la nueva sustancia piridina, del griego πυρος (pyros) que significa fuego. El sufijo -idina se le suma de acuerdo a la nomenclatura química, como en toluidina, para indicar que un carbono del ciclo contiene un átomo de nitrógeno.[7]
La estructura química de la piridina fue determinada décadas después de su descubrimiento. Wilhelm Körner (1869)[8] y James Dewar (1871)[9] sugirieron independientemente que, análogamente a la quinoleína y al naftaleno, la estructura de la piridina derivaba del benceno mediante la sustitución de un C-H con un átomo de nitrógeno.[10][11] La sugerencia de Körner y Dewar luego fue confirmada experimentalmente cuando la piridina fue reducida a piperidina con alcohol de sodio. En 1876, William Ramsay combinó acetileno y cianuro de hidrógeno en piridina en un horno de acero al rojo. Esta, fue la primer síntesis de un compuesto hetero-aromático.[12][13]
Los métodos contemporáneos en la producción de piridina tienen un bajo rendimiento y una demanda creciente para el compuesto requiere de la búsqueda de nuevas rutas su síntesis. Un punto de inflexión ocurrió en 1924 cuando el químico ruso Aleksei Chichibabin desarrolló la Síntesis de piridina de Chichibabin, la cual utiliza reactivos relativamente baratos.[14] Este método aún se usa en la producción industrial de la piridina[15]
Existencia en la naturaleza
La piridina se presenta en un sinfín de compuestos relacionados a la vida (pero no en su forma pura), entre ellos el NAD, la nicotina, la vitamina B3 ó niacina (cuya falta causa pelagra), y la vitamina B6 ó piridoxina, y las bases pirimidínicas timina, citosina y uracilo, entre otros.
Sin embargo, la piridina pura no está muy extendida en la naturaleza es una sustancia nociva si se la inhala, ingiere o si se absorbe por la piel. Reduce la fertilidad masculina y femenina y es considerada un carcinógeno. Los síntomas de exposición más comunes son: dolor de cabeza, tos, dificultad respiratoria, laringitis, náuseas y vómitos.
En la naturaleza, en su forma más perjudicial se la encuentra en las hojas y raíces de la belladona (Atropa belladonna)[16] y en el malvavisco (Althaea officinalis).[17] Pero como vimos, los derivados de la piridina se encuentran en ciertas biomoléculas como los nucleótidos de piridina y alcaloides. En la vida diaria se encuentran trazas de piridina como componentes volátiles de compuestos orgánicos que se generan en los procesos de tostación y enlatado. Como es el caso del pollo frito,[18] sukiyaki,[19] panceta frita,[20] el queso Beaufort,[21] el aroma del café,[22] el té negro[23] y la miel de girasol.[24] El humo del tabaco[25][26] y el de la marihuana[13] contienen piridina.
Propiedades físicas y químicas
La piridina tiene un punto de fusión de -42 °C y un punto de ebullición de unos 115 °C. Esto hace de la piridina un líquido incoloro, maloliente y nocivo a temperatura ambiente, miscible en alcohol y el agua, de reacción ligeramente básica, y forma un clorhidrato cristalino de p.f.145 °C al reaccionar con cloruro de hidrógeno. La electronegatividad del átomo de nitrógeno empobrece la densidad electrónica del anillo, haciéndolo menos susceptible a la sustitución electrofílica y fomentando la metalación por medio de bases fuertes.
El par de electrones ecuatoriales del nitrógeno no participa en el sistema pi aromático en la piridina. Esto hace, de dicho compuesto, una base con propiedades químicas similares a las aminas terciarias, siendo el pKa de su ácido conjugado 5,30. La reacción de la piridina con ácidos la protona y forma un ion aromático poliatómico cargado positivamente al que se le da el nombre de catión piridinio. Los ángulos y longitudes de unión entre ella y en el catión piridinio no varían considerablemente,[27] debido a que la protonación no involucra al sistema pi aromático.
Obtención
Industrialmente se la obtiene del petróleo y en menor medida, del alquitrán de hulla (en el cual su concentración es de aproximadamente 0,1%), o bien por medio de síntesis a partir del acetaldehído y el amoníaco. También puede ser preparada por destilación del aceite obtenido de la destilación destructiva de huesos.
Derivados de la piridina pueden ser sintetizados haciendo reaccionar 1,5-dicetonas con acetato de amonio en ácido acético, seguido de oxidación.
Síntesis de Chichibabin
La Síntesis de piridina de Chichibabin fue publicada por vez primera en 1924 y sigue industrialmente en uso. [14] En forma general, la reacción puede ser descripta como una reacción de condensación de aldehídos, cetonas, compuestos carbonílicos α,β-insaturados o cualquier combinación de las anteriores en amoníaco o aminas.[28] Específicamente, la piridina no sustituída es producida desde formaldehído y acetaldehído los cuales son reactivos baratos y fácilmente disponibles. Primero, se forma la acroleína en una Condensación de Knoevenagel a partir del acetaldehído y el formaldehído. Es entonces cuando se condensa con acetaldehído y amoníaco formando dihidropiridina, luego se oxida con un catalizador en estado sólido a piridina. Este proceso ocurre en fase gaseosa a 400-450 ºC. El producto, consiste de una mezcla de piridina, piridinas metiladas simples (picolina) y (lutidina); su composición depende del catalizador usado y por lo tanto, la reacción puede ser adaptada a las necesidades del que ejecuta la reacción. El catalizador es usualmente una sal de un metal de transición como fluoruro de cadmio (II) o fluoruro de manganeso (II), pero también pueden utilizarse compuestos de cobalto y talio . La piridina obtenida es separada de otros productos mediante un proceso de múltiples etapas.[15]


La aplicación práctica de la síntesis tradicional de Chichibabin está limitada por su bajo rendimiento, normalmente del 20%. Este bajo rendimiento, junto a la alta concentración de derivados no deseados torna a la reacción de Chichibabin muy poco popular cuando no es modificada.[28]
Desalquilación de alquilpiridinas
La piridina puede ser preparada mediante la desalquilación de piridinas alquiladas, las cuales son obtenidas como productos derivados en la síntesis de otras piridinas. La desalquilación oxidativa es llevada a cabo utilizando un catalizador de Óxido de Vanadio (V) con aire[29] o con una desalquilación en vapor con catalizadores basados en níquel,[30][31] o una hidro-desalquilación con un catalizador basado en plata o platino.[32] Se pueden obtener rendimientos de piridina de hasta un 93% con el catalizador basado en níquel[15]
Síntesis de piridina de Hantzsch
La primer y mayor síntesis de derivados de piridina fue descripta en 1881 por Arthur Rudolf Hantzsch.[33] La Síntesis de piridina de Hantzsch usa normalmente una mezcla 2:1:1 de un β-cetoácido (normalmente acetoacetato, un aldehído (formaldehído) y amoníaco o una sal del amoníaco con el nitrógeno dador. Primero, se obtiene una piridina dihidrogenada, que es consiguientemente oxidada a su correspondiente derivado de piridina. Emil Knoevenagel mostró que las piridinas sustituidas asimétricamente podrían ser producidas mediante este proceso.[34]
Ciclación de Bönnemann

La trimerización entre una parte de una molécula de nitrilo y dos partes de acetileno en piridina es llamada ciclación de Bönnemann. Esta modificación de la Síntesis de Reppe puede ser activada ya sea por calor o luz. Mientras que la activación térmica requiere altas presiones y temperaturas, la cicloadición foto-inducida ocurre a condiciones ambientales normales con CoCp2(cod) (Cp = ciclopentadienilo, cod = 1,5-ciclooctadieno) como catalizador y puede ser realizada incluso en agua.[35] Se puede producir una serie de derivados de piridina de esta forma. Cuando se usa acetonitrilo como nitrilo, se obtiene 2-metilpiridina, que puede ser desalquilada a piridina.
Otros métodos
La Síntesis de piridina de Kröhnke involucra una condensación de una 1,5-dicetona con acetato de amonio en ácido acético seguida por una oxidación.
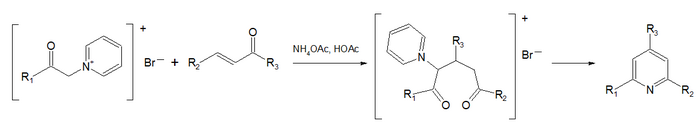
La Transposición de Ciamician-Dennstedt conlleva la expansión del anillo de pirrol con diclorocarbeno para dar 3-cloropiridina.[36]

En la Síntesis de Gattermann-Skita,[37] Un sal del éster malonico reacciona con diclorometilamina.[38]

Aplicaciones
La piridina y los compuestos relacionados con ella encuentran gran utilidad como disolventes, en ánalisis químicos, y como reactivos para la síntesis de fármacos, insecticidas, herbicidas, saborizantes, colorantes, adhesivos, pinturas, explosivos, desinfectantes y químicos para el caucho. También es utilizada junto con las picolinas como desnaturalizante en mezclas anticongelantes y en el alcohol etílico, en fungicidas, y en la tinción de textiles.
Compuestos relacionados
- DMAP ó 4-dimetilaminopiridina
- Bipiridina, una compuesto polipiridínico simple que consiste de dos moléculas de piridina unidas por una unión simple.
- Terpiridina, un compuesto formado por tres anillos piridínicos conectados por dos uniones simples.
- Pirimidina e Isoquinolina, compuestos formados por un anillo piridínico y un anillo bencénico fusionados.
- Anilina, un derivado bencénico con un grupo amino (-NH2) unido, pero NO una piridina.
- Diazinas, compuestos con uno o más átomos de carbono reemplazados por un átomo de nitrógeno, como la pirazina y la quinolina.
- Triazinas, compuestos con dos o más átomos de carbono reemplazados por nitrógeno.
- 2,6-lutidina, nombre trivial para la 2,6-dimetilpiridina.
- Colidina, nombre trivial para la 2,4,6-trimetilpiridina.
- p-toluensulfonato de piridinio (PPTS), una sal formada por intercambio de protones entre la piridina y el ácido p-toluensulfónico.
Referencias
- ↑ Fichas internacionales de seguridad química (FISQ)
- ↑ Fichas de datos de seguridad (FDS)
- ↑ Hazardous Substances Data Bank (HSDB)
- ↑ A. Weissberger (Ed.), A. Klingberg (ed.), R.A. Barnes, F. Brody, P.R. Ruby: Pyridine and its Derivatives, Volume 1, 1960, Interscience Pub., New York
- ↑ Anderson, T. Transactions of Royal Society of Edinburg, 16 (1849) 123
- ↑ a b Von Anderson, Th. (1849). «Producte der trocknen Destillation thierischer Materien». Annalen der Chemie und Pharmacie 70: 32. doi:10.1002/jlac.18490700105.
- ↑ Anderson, Th. (1851). «Ueber die Producte der trocknen Destillation thierischer Materien». Annalen der Chemie und Pharmacie 80: 44. doi:10.1002/jlac.18510800104.
- ↑ Körner, W. Giorn. academ. Palermo, vol. 5 (1869)
- ↑ Dewar, J. Chem. News, 23 (1871) 38
- ↑ Albert Ladenburg Lectures on the history of the development of chemistry since the time of Lavoisier., pp. 283–287
- ↑ Raj K. Bansal Heterocyclic Chemistry, (1999) ISBN 8122412122, p. 216
- ↑ «A. Henninger, aus Paris. 12. April 1877». Berichte der deutschen chemischen Gesellschaft 10: 727. 1877. doi:10.1002/cber.187701001202.
- ↑ a b Pyridine, IARC Monogrpahs Vol. 77, OSHA, Washington D.C., 1985
- ↑ a b Tscihtschibabin, A.E. (1924). «Über Kondensation der Aldehyde mit Ammoniak zu Pyridinebasen». Journal für praktische Chemie 107: 122. doi:10.1002/prac.19241070110.
- ↑ a b c Error en la cita: Etiqueta
<ref>no válida; no se ha definido el contenido de las referencias llamadasul - ↑ G. A. Burdock (ed.) Fenaroli's Handbook of Flavor Ingredients, Vol. II, 3rd Edition, CRC Press, Boca Raton, 1995, ISBN 0-8493-2710-5
- ↑ A. Täufel, W. Ternes, L. Tunger, M. Zobel: Lebensmittel-Lexikon, 4th ed., p. 450, Behr, 2005, ISBN 3-89947-165-2
- ↑ Tang, Jian; Jin, Qi Zhang; Shen, Guo Hui; Ho, Chi Tang; Chang, Stephen S. (1983). «Isolation and identification of volatile compounds from fried chicken». Journal of Agricultural and Food Chemistry 31: 1287. doi:10.1021/jf00120a035.
- ↑ Shibamoto, Takayuki; Kamiya, Yoko; Mihara, Satoru (1981). «Isolation and identification of volatile compounds in cooked meat: sukiyaki». Journal of Agricultural and Food Chemistry 29: 57. doi:10.1021/jf00103a015.
- ↑ Ho, Chi Tang; Lee, Ken N.; Jin, Qi Zhang (1983). «Isolation and identification of volatile flavor compounds in fried bacon». Journal of Agricultural and Food Chemistry 31: 336. doi:10.1021/jf00116a038.
- ↑ Dumont, Jean Pierre; Adda, Jacques (1978). «Occurrence of sesquiterpene in mountain cheese volatiles». Journal of Agricultural and Food Chemistry 26: 364. doi:10.1021/jf60216a037.
- ↑ Aeschbacher, HU; Wolleb, U; Löliger, J; Spadone, JC; Liardon, R (1989). «Contribution of coffee aroma constituents to the mutagenicity of coffee». Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association 27 (4): 227-32. PMID 2659457.
- ↑ Vitzthum, Otto G.; Werkhoff, Peter.; Hubert, Peter. (1975). «New volatile constituents of black tea flavored». Journal of Agricultural and Food Chemistry 23: 999. doi:10.1021/jf60201a032.
- ↑ A. Täufel, W. Ternes, L. Tunger, M. Zobel: Lebensmittel-Lexikon, 4th ed., p. 226, Behr, 2005, ISBN 3-89947-165-2
- ↑ Curvall, Margareta; Enzell, Curt R.; Pettersson, Bertil (1984). «An evaluation of the utility of four in vitro short term tests for predicting the cytotoxicity of individual compounds derived from tobacco smoke». Cell Biology and Toxicology 1 (1): 173. PMID 6400922. doi:10.1007/BF00125573.
- ↑ Schmeltz, Irwin.; Hoffmann, Dietrich. (1977). «Nitrogen-containing compounds in tobacco and tobacco smoke». Chemical Reviews 77: 295. doi:10.1021/cr60307a001.
- ↑ Tadeusz M. Krygowski, Halina Szatyowicz, and Joanna E. Zachara J. Org. Chem. 2005 70(22) 8859 - 8865; DOI: 10.1021/jo051354h Abstract
- ↑ a b Frank, R.L.; Seven, R. P. (1949). «Pyridines. IV. A Study of the Chichibabin Synthesis». Journal of the American Chemical Society 71 (8): 2629-2635. doi:10.1021/ja01176a008.
- ↑ ICI DE-AS Patent No 1,917,037, (1968)
- ↑ Nippon Kayaku, Japanese patent No. 7039545 (1967)
- ↑ Koei Chemicals, Patent BE 758 201 (1969)
- ↑ F. Mensch Erdöl Kohle Erdgas Petrochemie, 1969, 2, pp. 67–71
- ↑ Hantzsch, A. (1881). «Condensationsprodukte aus Aldehydammoniak und ketonartigen Verbindungen». Berichte der deutschen chemischen Gesellschaft 14: 1637. doi:10.1002/cber.18810140214.
- ↑ Knoevenagel, E.; Fries, A. (1898). «Synthesen in der Pyridinreihe. Ueber eine Erweiterung der Hantzsch'schen Dihydropyridinsynthese». Berichte der deutschen chemischen Gesellschaft 31: 761. doi:10.1002/cber.189803101157.
- ↑ A. Behr: Angewandte homogene Katalyse, 2008, p. 722, Wiley-VCH, Weinheim, ISBN 3-527-31666-3
- ↑ Ciamician-Dennstedt Rearrangement, G. L. Ciamician, M. Dennstedt, Ber. 14, 1153 (1881); A. H. Corwin, Heterocyclic Compounds 1, 309 (1950); H. S. Mosher, ibid. 475; P. S. Skell, R. S. Sandler, J. Am. Chem. Soc. 80, 2024 (1958); E. Vogel, Angew. Chem. 72, 8 (1960).
- ↑ L. Gattermann, A. Skita (1916). «Eine Synthese von Pyridin-Derivaten». Ber. 49 (1): 494-501. doi:10.1002/cber.19160490155.
- ↑ Gattermann-Skita, Institute of Chemistry, Skopje, Macedonia
Enlaces externos
- ATSDR en Español - ToxFAQs™: Polibromobifenilos (PBB) Departamento de Salud y Servicios Humanos de EE. UU. (dominio público)
- ATSDR en Español - Resumen de Salud Pública: Polibromobifenilos (PBB) Departamento de Salud y Servicios Humanos de EE. UU. (dominio público)
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química de la piridina.
