Veneno de serpiente
| Toxina del veneno de serpiente | ||
|---|---|---|
 Vipera berus - Aparato de suministro de veneno | ||
| Identificadores | ||
| Símbolo | Toxin_1 | |
| Pfam | PF00087 | |
| InterPro | IPR003571 | |
| PROSITE | PDOC00245 | |
| SCOP | 2ctx | |
| Familia OPM | 55 | |
| Proteína OPM | 1txa | |
Estructuras PDB disponibles: Ver lista 1ntx
:1-60 B:22-83 :22-83 A:22-83 :22-83 A:22-83 :22-83 A:1-61 :22-83 A:1-62 :1-61 A:1-61 :1-65 F:1-64 :1-64 A:22-87 :1-66 A:1-66 :22-85 B:22-87 :22-81 :22-81 A:1-60 :1-60 A:1-60 :1-60 B:22-83 :22-83A:1-63 | ||
El veneno o ponzoña de serpiente es saliva altamente modificada.[1] El veneno es parte de un conjunto: el aparato, que se compone de glándulas de veneno que lo sintetizan, y un sistema de inyección, que consta de colmillos modificados que permiten la penetración de la ponzoña en una presa o en un depredador o amenaza.[2] Las glándulas que secretan las zootoxinas son una modificación de la glándula salival parótida de otros vertebrados, y usualmente se encuentran a cada lado de la cabeza, debajo y detrás del ojo, encapsulado en una envoltura muscular. Las glándulas tienen grandes alvéolos en los cuales se almacena la ponzoña sintetizada antes de transmitirla por un conducto a la base de colmillos tubulares o canalizadas, a través de los cuales se expulsa. Los venenos de serpiente contienen más de 20 compuestos diferentes, en su mayoría proteínas y polipéptidos.[3][4] El tósigo de serpiente tiene dos funciones principales: primero, la inmovilización de la presa y en segundo lugar la digestión de la misma. Se compone de una mezcla compleja de proteínas, enzimas y varias otras sustancias. Las proteínas son responsables para los efectos tóxicos y letales del veneno[2] y su función de inmovilizar a presas,[5] Las enzimas tienen un papel importante en la digestión de la presa,[4] y varias otras sustancias son responsables de efectos biológicos importantes, pero no letales.[2] Algunas de las proteínas en el veneno de las serpientes tienen efectos muy particulares sobre las diversas funciones biológicas, incluyendo la coagulación sanguínea, regulación de la presión sanguínea, transmisión del impulso nervioso o muscular, y se convirtieron en herramientas farmacológicas o de diagnóstico médico e incluso en medicamentos útiles.[2]
Química[editar]
En 1843, Charles Lucien Bonaparte, hijo de Lucien Bonaparte, el hermano menor de Napoleón Bonaparte, fue el primero en establecer la naturaleza proteica de la ponzoña de serpientes. Las proteínas constituyen el 90-95 % del peso seco del veneno y son responsables de casi todos sus efectos biológicos. Entre los cientos, incluso miles de proteínas que se encuentran en el tósigo de serpiente, hay toxinas, neurotoxinas en particular, así como proteínas no-tóxicas (que también tienen propiedades farmacológicas), y muchas enzimas, especialmente las enzimas hidrolíticas.[2]
Las enzimas (peso molecular 13-150 kDa) forman 80-90 % de las ponzoñas de viperidos y 25-70 % de los venenos de elápidos: hidrolasas digestivas, L-aminoácido oxidasa, fosfolipasas, pro-coagulantes parecidas a trombina, al igual que proteasas de serina parecidas a calicreína y metaloproteinas (hemorraginos), que afectan el endotelio vascular. Toxinas polipeptídicas (peso molecular 5-10 kDa) son citotoxinas, cardiotoxinas, y neurotoxinas postsinápticas (por ejemplo, α-Bungarotoxina y α-Cobratoxina), que se unen a los receptores de acetilcolina en las uniones neuromusculares. Entre los compuestos de bajo peso molecular (hasta 1,5 kDa) se incluye metales, péptidos, lípidos, hidratos de carbono, nucleósidos, aminas, y oligopéptidos, que inhiben la enzima convertidora de angiotensina (ACE) y potencian la bradicinina (BPP). La variación inter- e intra-especie en la composición química del veneno es geográfica y ontogénica.[3] Las fosfodiesterasas interfieren con el sistema cardíaco de la presa, sobre todo para bajar la presión arterial. La fosfolipasa A2 causa hemólisis por lisis de las membranas celulares fosfolípidos de las células rojas de la sangre.[6] Aminoácido oxidasa y proteasa se utilizan para la digestión. Aminoácido oxidasa también activa algunas otras enzimas y es responsable del color amarillo de la ponzoña de algunas especies. Hialuronidasa aumenta la permeabilidad del tejido para acelerar la absorción de otras enzimas en los tejidos. Algunas ponzoñas de serpiente contienen fascículos, como la de la mamba (Dendroaspis), que inhiben la colinesterasa para que la presa pierda el control muscular.[7]
| Tipo | Nombre | Origen |
| Oxidorreductasas | lactato deshidrogenasa | Elapidae |
| L-aminoácido oxidasa | Todas las especies | |
| catalasa | Todas las especies | |
| Transferasas | Alanina aminotransferasa | |
| Hidrolasas | Fosfolipasa A2 | Todas las especies |
| Lisofosfolipasa* | Elapidae, Viperidae | |
| Acetilcolinesterasa | Elapidae | |
| Fosfatasa alcalina | Bothrops atrox | |
| Fosfatasa ácida | Deinagkistrodon acutus | |
| 5'-Nucleotidasa | Todas las especies | |
| Fosfodiesterasa | Todas las especies | |
| Desoxirribonucleasa | Todas las especies | |
| Ribonucleasa 1 | Todas las especies | |
| Adenosina trifosfato | Todas las especies | |
| Amilasa | Todas las especies | |
| Hialuronidasa | Todas las especies | |
| NAD-nucleotidasa | Todas las especies | |
| Quininogenasa | Viperidae | |
| Activador Factor-X | Viperidae, Crotalinae | |
| Heparinasa | Crotalinae | |
| α-Fibrinogenasa | Viperidae, Crotalinae | |
| ß-Fibrinogenasa | Viperidae, Crotalinae | |
| α-ß-Fibrinogenasa | Bitis gabonica | |
| Enzima fibrinolítica | Crotalinae | |
| Activador de la protrombina | Crotalinae | |
| Colagenasa | Viperidae | |
| Elastasa | Viperidae | |
| Liasas | Glucosamina de amonio liasa |
Las toxinas presentes en la secreción de las serpientes varían enormemente en sus funciones. Las dos clasificaciones más importantes son las neurotoxinas (en su mayoría se encuentran en elápidos) y las hemotoxinas (en su mayoría se encuentran en vipéridos). Sin embargo, hay excepciones: el veneno de la cobra escupidora cebra (Naja nigricollis) se compone principalmente de hemotoxinas, mientras que el veneno de la cascabel del Mojave (Crotalus scutulatus) es principalmente neurotóxico; y hay muchos otros tipos de toxinas diferentes que pueden estar presentes en la ponzoña tanto de los elápidos como de los vipéridos.
| α-neurotoxinas | α-Bungarotoxina, α-toxina, erabutoxina, cobratoxina |
|---|---|
| ß-neurotoxinas | Notexina, amoditoxina, ß-Bungarotoxina, crotoxina, taipoxina |
| κ-Toxinas | κ-Toxina |
| Dendrotoxinas | Dendrotoxina, toxinas I y K |
| Cardiotoxinas | y-Toxina, cardiotoxina, citotoxina |
| Miotoxinas | Miotoxina-a, crotamina |
| Sarafotoxinas | Sarafotoxinas a, b, y c |
| Hemorráginos | Fosfolipasa A2, mucrotoxina A, toxinas hemorrágicas a, b, c..., HT1, HT2 |
Toxinas[editar]
Neurotoxinas[editar]
| Estructura de un típico sinapsis químico |
|---|
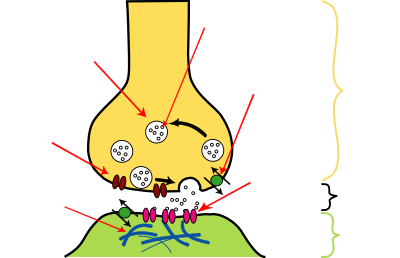
Inicio de un nuevo impulso nervioso normal:
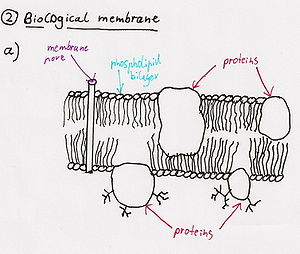
A) Un intercambio de iones (átomos cargados) por la membrana de la célula del nervio envía una corriente despolarizante hacia el final de la célula nerviosa (célula terminal).
B) Cuando la corriente despolarizante llega al final de la célula nerviosa, el neurotransmisor acetilcolina (ACh), que se mantiene en vesículas, se libera en el espacio entre los dos nervios (sinapsis) y se mueve a través de la sinapsis hacia los receptores postsinápticos.
C) Si ACh se mantiene en el receptor, el nervio se mantiene estimulado, lo que produce contracciones musculares incontrolables. Esta condición se llama tetania. Una enzima llamada acetilcolinesterasa destruye la ACh para evitar que se produce tetania.
Fasciculinos:
Fasciculinos (Fasciculins en inglés) son toxinas que atacan a las neuronas colinérgicas (las que utilizan acetilcolina como transmisor) mediante la destrucción de la acetilcolinesterasa (ACh). Por lo tanto ACh no puede descomponerse y permanece en el receptor. Esto causa tetania, lo que puede conducir a la muerte. Las toxinas han sido llamadas fasciculinos (Fasciculins en inglés) ya que después de ser inyectadas en ratones, causaron fasciculaciones graves, generalizadas y de larga duración (5-7 h).
Ejemplo de serpientes: se encuentran principalmente en el veneno de Mambas y algunas especies de cascabeles
Dendrotoxinas:
Dendrotoxinas inhiben las neurotransmisiones bloqueando el intercambio de iones + y - a través de la membrana neuronal, las que conducen a ningún impulso nervioso. Así, paralizan los nervios.
Ejemplo de serpientes: Mambas
α-neurotoxinas:
α-neurotoxinas forman un largo grupo de toxinas, con más de 100 neurotoxinas postsinápticas identificadas y secuenciadas.[8] α-neurotoxinas también atacan a las neuronas colinérgicas. Imitan la forma de la molécula de acetilcolina y, por tanto, encajan en los receptores → bloquean el flujo de acetilcolina (ACh) → sensación de entumecimiento y parálisis.
Ejemplos de serpientes: cobra real (conocida como hannahtoxina que contiene α-neurotoxinas),[9] Serpiente marina (conocida como erabutoxina), Bungarus multicinctus (conocida como α-Bungarotoxina), Cobras (conocida como cobratoxina).
Citotoxinas[editar]
Fosfolipasas:
Fosfolipasa es una enzima que convierte la molécula de fosfolípido en un lisofosfolípido (jabón) ==> la nueva molécula atrae y une grasas y rompe las membranas de las células.
Ejemplo de serpiente: Habu japonés
Cardiotoxinas:
Cardiotoxinas son componentes que son específicamente tóxicos para el corazón. Se unen a sitios específicos en la superficie de las células musculares y causan despolarización, es decir, la toxina impide la contracción muscular. El efecto de estas toxinas es que el corazón late de forma irregular o deja de latir, causando la muerte.
Ejemplo de serpientes: cobra real, Mambas, y algunos miembros del género Naja
Hemotoxinas:
Las hemotoxinas producen hemólisis o destrucción de los glóbulos rojos de la sangre (eritrocitos).
Ejemplo de serpientes: la mayoría de los viperídos y los miembros del género Naja
Citotoxina de serpiente IPR003572
Evolución[editar]
Anteriormente se creía que la presencia de enzimas en el tósigo de serpientes era una adaptación para ayudar a la digestión. Sin embargo, estudios del crótalo diamante occidental, una serpiente con ponzoña altamente proteolítica, muestran que el veneno no influye en el tiempo requerido para que el alimento pase por el intestino. Se necesitan estudios adicionales para determinar las presiones selectivas que resultan en la evolución del veneno y de los mecanismos de entrega del mismo.[10]
En un estudio realizado por Bryan Fry, investigador del Australian Venom Research Unit de la escuela de medicina de la Universidad de Melbourne en Australia, se analizó el origen y la evolución del veneno de las serpientes, incluyendo un análisis filogenético de las secuencias de aminoácidos presentes en las toxinas y las proteínas relacionadas.
Las toxinas de las serpientes resultaron de eventos de reclutamiento de genes dentro de las familias proteicas: acetilcolinesterasa, ADAM (desintegrina/metaloproteasa), AVIT, complemento C3, crotasina, defensina, cistaina, endotelina, entre otros. Estos eventos de reclutamiento en las toxinas ocurrieron al menos unas 24 veces en la evolución del veneno en las serpientes. Dos de estas derivaciones tóxicas parecen ser más bien el resultado de modificaciones en proteínas salivares, que eventos génicos de reclutamiento. Por último este estudio demostró que los tipos de toxinas en las cuales la proteína ancestral forma una extensiva retícula con cisteína, eran las que llegaban a ser nuevas familias de toxinas multigénicas, funcionalmente diversas.[11]

Aunque bien es cierto que gran parte de esta variación en las familias proteicas que dan lugar a las toxinas que generan este veneno en las glándulas de las serpientes, es el resultado de la dieta de los organismos, siendo que el nivel de toxicidad de las serpientes puede ser en gran parte mediado por la presión de selección ejercida por las presas de las mismas.[12] Por tanto es muy probable que el desarrollo del veneno en las serpientes haya estado mediado por factores evolutivos, y más exactamente por selección natural. Donde el agente que regula la selección en este caso es, o son, las presas de las distintas serpientes, lo cual puede dar una cierta plasticidad en los niveles de toxicidad y distintos orígenes proteicos en las toxinas encargadas del veneno.
Inyección[editar]
Vipéridos[editar]
Entre las serpientes ponzoñosas, los vipéridos tienen el aparato de entrega de veneno más desarrollado. La glándula del veneno es muy grande y está rodeada por el músculo masetero o músculo temporal, que consiste en dos bandas, el superior se extiende de detrás del ojo, el inferior se extiende desde la glándula de la mandíbula. Un conducto lleva la ponzoña de la glándula al colmillo. En los vipéridos y elápidos, esta ranura está completamente encerrada, y es algo semejante al tubo de una aguja hipodérmica. En otras especies, las ranuras no están cubiertas, o sólo parcialmente cubiertas. Desde el extremo anterior de la glándula, el conducto pasa por debajo del ojo y por encima del hueso maxilar, al orificio basal del colmillo de veneno, que está envainado en un pliegue grueso de membrana mucosa. Por medio del hueso maxilar móvil, articulado al hueso prefrontal y conectado con el hueso transversal el cual es empujado hacia adelante por los músculos que entran en acción al abrir la boca, el colmillo se erige y el tósigo se descarga a través del orificio distal. Cuando la serpiente muerde, las mandíbulas se cierran, los músculos que rodean la glándula de veneno se contraen, y la ponzoña es expulsada por los colmillos.
Elápidos[editar]
En los elápidos, los colmillos son tubulares, pero son cortos y no poseen la movilidad que se observa en los vipéridos.
Colúbridos[editar]
Algunos colúbridos tienen dientes agrandados y acanalados situados en el extremo posterior de la maxilar, donde una pequeña porción posterior de la glándula salival o labial superior produce veneno.
Mecánica de la mordedura[editar]

Varios géneros de serpientes, entre ellos Calliophis, Atractaspis y causus, son notables por tener glándulas de veneno excepcionalmente largas, que se extienden a lo largo de cada lado del cuerpo, en algunos casos se extienden posteriormente hasta la altura del corazón. En lugar de que los músculos de la región temporal sirven para presionar el veneno en el conducto, esta acción se realiza por los músculos laterales del cuerpo.
Existe una considerable variabilidad en el comportamiento mordaz entre las serpientes. Al morder, los viperidos a menudo atacan con rapidez, descargando el veneno cuando los colmillos penetran en la piel, e inmediatamente después se liberan y dejan a su presa. Alternativamente, como en el caso de una respuesta de alimentación, algunos vipéridos (por ejemplo Lachesis) mantienen su mordedura y no dejan ir a su presa. Los elápidos y colúbridos a menudo cierran sus mandíbulas y muerden o mastican con firmeza durante un tiempo considerable.
Mecánica de escupir[editar]
Cobras escupidoras de los géneros Naja y Hemachatus, pueden expulsar o «escupir» veneno a una distancia de 1,2 a 2,5 metros cuando se sienten irritados o amenazados. Estas serpientes tienen colmillos modificados que permiten escupir: el conducto dentro de los colmillos hace una curva de noventa grados en la parte delantera inferior. Tras escupir varias veces serpientes escupidoras aún pueden infligir una mordedura fatal.
Escupir es únicamente una reacción defensiva. Las serpientes tienden a apuntar a los ojos de una amenaza percibida. Después de haber sido alcanzado en los ojos, la víctima puede sufrir de un shock temporal, y ceguera como resultado de una severa inflamación de la córnea y de la conjuntiva. Por lo general, no hay efectos graves si el veneno se lava inmediatamente con mucha agua; si se deja sin tratamiento, la ceguera puede ser permanente. Un breve contacto con la piel no constituye un peligro inmediato, pero las heridas abiertas pueden ser vectores de envenenamiento.
Algunos efectos[editar]
Hay cuatro tipos diferentes de veneno que actúan sobre el cuerpo de manera diferente.
- proteolítico desmantela la estructura molecular en el área alrededor de la mordedura, incluyendo el sitio de la mordedura.
- hemotóxico actúa sobre el corazón y el sistema cardiovascular.
- neurotóxico actúa sobre el sistema nervioso y el cerebro.
- citotóxico tiene una acción localizada en el sitio de la mordedura.
Cabe señalar que el tamaño de los colmillos no tiene ninguna relación con la virulencia de la ponzoña. Las especies indo-malayos del género Lachesis tienen colmillos muy grandes, pero son comparativamente inocentes, mientras que las serpientes marinas, que tienen los colmillos más pequeños, poseen un veneno muy potente.
Serpientes proteroglifos[editar]
El veneno de serpientes con colmillos proteroglifos (Hydrophiinae, Bungarus, Dendroaspis, Elaps, Pseudechis, Notechis, Acanthophis) actúa principalmente en el sistema nervioso. La parálisis respiratoria se produce rápidamente cuando el tósigo entra en contacto con el mecanismo nervioso central que controla la respiración; por lo general, el dolor y la inflamación local no son severos. La ponzoña de todos los elápidos proteroglifos, incluso el de los más pequeños y más gentiles, como las serpientes de coral, pueden ser fatales para los humanos.
Víboras[editar]
El veneno de víboras (Daboia, Echis, Lachesis, Crotalus) actúa más en el sistema vascular, dando lugar a la coagulación de la sangre y la coagulación de las arterias pulmonares; su actuación sobre el sistema nervioso no es muy grande; ningún grupo de células nerviosas específico parece ser afectado y el efecto sobre la respiración no es tan directa; la influencia sobre la circulación explica la gran depresión, que es un síntoma del emponzoñamiento viperino. El dolor de la herida es severo y es rápidamente seguido por hinchazón y decoloración. Los síntomas producidos por la mordedura de las víboras europeas se describen así por Martin y Lamb:[13]
La mordedura es inmediatamente seguida por dolor local de carácter ardiente, el miembro más pronto se hincha y se decolora, y dentro de una a tres horas comienza un gran cansancio, acompañado de vómitos y a menudo diarrea. Sudor frío y piel pegajosa son habituales. El pulso se vuelve muy débil, y se puede observar una ligera disnea e inquietud. En casos severos, que ocurren principalmente en los niños, el pulso puede llegar a ser imperceptible y las extremidades se vuelven frías; el paciente puede entrar en coma. Estos graves síntomas constitucionales suelen pasar dentro de doce a veinticuatro horas; pero mientras tanto el hinchazón y la decoloración se habrán extendido enormemente. El miembro se convierte en flemonosa y supura de vez en cuando. Dentro de unos días, algo de repente, se produce la recuperación, pero la severa depresión o los efectos secundarios de la supuración pueden resultar en la muerte. Que los casos de muerte, en los adultos así como en los niños, no son infrecuentes en algunas partes del continente, se menciona en el último capítulo de esta introducción.
La toxicidad del veneno de las víboras difiere mucho entre sí. El veneno de algunas especies —como Daboia russelii y Echis carinatus de India; lás víboras americanas Crotalus, Lachesis muta y Bothrops lanceolatus; y los Causus, Bitis, y Cerastes de África— es fatal a menos que se inicie rápidamente con el tratamiento médico. Por otro lado, las especies del género Lachesis que ocurren en Malaya e India rara vez causan la muerte de seres humanos y sus mordeduras son, en algunos casos, no peor que la picadura de un avispón. La mordedura de las víboras más grandes en Europa puede ser peligrosa y puede tener consecuencias fatales, especialmente en los niños, al menos en las partes más calientes del continente. Por otra parte, la pequeña Vipera ursinii, que casi nunca muerde a menos que sea maltratada, no parece tener un veneno muy virulento y no hay registros de graves accidentes a pesar de ser una serpiente muy común en algunas partes de Austria y Hungría.
Colúbridos con colmillos traseros[editar]
Desde hace mucho tiempo los biólogos sabían que algunas serpientes tenían colmillos traseros que podían ser utilizados para inmovilizar a sus presas, considerándolos como mecanismos de inyección de veneno comparativamente 'inferiores'; a pesar de que se había registrado algunas muertes hasta 1957, la posibilidad de que la mordedura de este tipo de serpientes pudiera ser fatal para los seres humanos parecía remota. Las muertes de dos herpetólogos prominentes por mordeduras de colúbridos africanos cambió esta evaluación, y acontecimientos recientes ponen de manifiesto que varias otras especies de serpientes con colmillos traseros poseen venenos que pueden ser mortales para los grandes vertebrados.
Los venenos de Dispholidus y Thelotornis son tóxicos para las células de la sangre (hemotóxico) y diluyen la sangre (hemorrágico). Los primeros síntomas incluyen dolor de cabeza, náuseas, diarrea, letargo, desorientación mental, hematomas y sangrado en el lugar de la mordedura y en todos los orificios del cuerpo. Desangrado es la principal causa de muerte por una mordedura involucrando a este tipo de veneno, o muerte por hemorragia cerebral o insuficiencia respiratoria
El veneno de Dispholidus typus es el más potente de todas las serpientes con colmillos traseros sobre la base de LD50. Aunque su tósigo puede ser más potente que el de varias víboras y elápidos, causa menos muertes debido a diferentes factores, por ejemplo, la efectividad de los colmillos no es grande en comparación con muchas otras serpientes: la dosis de veneno es baja, y Dispholidus typus es generalmente menos agresivo en comparación con otras serpientes venenosas, tales como cobras y mambas.
Serpientes aglifas[editar]
Experimentos realizados con la secreción de la glándula parótida de Tropidonotus y Zamenis han demostrado que incluso serpientes aglifas no están totalmente desprovistas de ponzoña, y apuntan a la conclusión de que la diferencia fisiológica entre las serpientes llamadas inofensivas y las ponzoñosas es sólo una diferencia gradual, así como existen varias fases en la transformación de una glándula parótida normal en una glándula de veneno, o de un diente sólido en un colmillo tubular o ranurado.
Inmunidad[editar]
Entre serpientes[editar]
La cuestión de si una serpiente es inmune a su propio veneno aún no está definitivamente resuelta, aunque existe un caso conocido de una cobra que se emponzoñó a sí misma, resultando en un gran absceso que requirió intervención quirúrgica, pero que no mostró ninguno de los demás efectos que habrían sido letales en sus presas o en los seres humanos.[14] Por otra parte, ciertas especies inofensivas, como el Lampropeltis getula norteamericano y Rhacidelus brazili de Brasil, han demostrado que pueden resistir al veneno de los crotalinos que habitan las mismas zonas, y que son capaces de someterlos y de comerlos. Experimentos han demostrado que la culebra de collar, una serpiente inofensiva bastante común en Eurasia, no es afectada por la mordedura de Vipera berus y Vipera aspis. Esto se debe a la presencia en la sangre de la culebra de principios tóxicos secretados por sus glándulas parótidas y labiales, que son análogos a los del veneno de estas víboras.
Entre otros animales[editar]
Un número de animales que se alimentan de serpientes son inmune a una cierta dosis de tósigo de serpiente. Incluye al erizo, la mangosta, el tejón de miel, el ave secretaria y algunos otros aves. No se sabe hasta que grado el cerdo puede ser considerado inmune, bien que su gruesa capa de grasa subcutánea a menudo hace que la mordida no tiene efectos perjudiciales. El lirón careto ha sido añadido a la lista de animales refractarios al veneno de la víbora. Algunas poblaciones de ardilla terrestre de California son al menos parcialmente inmune a la ponzoña de la serpiente cascabel como adultos. Los gatos también presentan algún tipo de inmunidad a la ingesta del veneno (Talmud babilónico, shabat 128B)
Véase también[editar]
Referencias[editar]
- ↑ «Reptile Venom Research». Australian Reptile Park. Archivado desde el original el 2 de febrero de 2010. Consultado el 21 de diciembre de 2010.
- ↑ a b c d e f (Editado por) Bauchot, Roland (1994). Snakes: A Natural History. New York City, NY, USA: Sterling Publishing Co., Inc. pp. 194–209. ISBN 1-4027-3181-7.
- ↑ a b (editado por) Halliday; Adler, Tim; Kraig (2002). Firefly Encyclopedia of Reptiles and Amphibians. Toronto, Canadá: Firefly Books Ltd. pp. 202–203. ISBN 1-55297-613-0.
- ↑ a b Bottrall, Joshua L.; Frank Madaras, Christopher D Biven, Michael G Venning, & Peter J Mirtschin (septiembre de 2010). «Proteolytic activity of Elapid and Viperid Snake venoms and its implication to digestion». Journal of Venom Research 1 (3): 18-28. PMC 3086185. PMID 3086185. Consultado el 26 de diciembre de 2011.
- ↑ Mattison, Chris (2007 (first published in 1995)). The New Encyclopedia of Snakes. New Jersey, USA: Princeton University Press (Princeton and Oxford) first published in Blandford. pp. 117. ISBN 0-691-13295-X.
- ↑ Condrea, E,.; Devries,A.; Mager, J (febrero de 1964). «Hemolysis and Splitting of Human Erythrocyte Phospholipids by Snake Venoms». Biochim. Biophys. Acta 84: 60-73. PMID 14124757.
- ↑ Rodríguez-Ithurralde, D.; R. Silveira; L. Barbeito; F. Dajas (1983). «Fasciculin, a powerful anticholinesterase polypeptide from Dendroaspis angusticeps venom». Neurochemistry International 5 (3): 267-274. doi:10.1016/0197-0186(83)90028-1. Consultado el 26 de diciembre de 2011.
- ↑ Hodgson WC, Wickramaratna JC. In vitro neuromuscular activity of snake venoms. 2002.
- ↑ HE Ying-Ying; LEE Wei-Hui; YUN ZHANG (2004). «Cloning and purification of α-neurotoxins from king cobra (Ophiophagus hannah)». Toxicon 44 (3): 295-303. ISSN 0041-0101. Archivado desde el original el 21 de septiembre de 2012. Consultado el 15 de mayo de 2012.
- ↑ M.D. McCue (1 de agosto de 2007). «Prey envenomation does not improve digestive performance in western diamondback rattlesnakes (Crotalus atrox)». J. Exp. Zool. A. 307a (online early): 568–77. PMID 17671964. doi:10.1002/jez.411.
- ↑ Fry, Brian G (marzo de 2005). «From genome to "venome": Molecular origin and evolution of the snake venom proteome inferred from phylogenetic analysis of toxin sequences and related body proteins». Genome Research. 3 15: 403-420. Consultado el 8 de noviembre de 2012.
- ↑ Daltry, Jennifer C.; Wuster. Wolfgang, Thorpe. Roger S. (febrero de 1996). «Diet and snake venom evolution». Nature 379: 537-540.
- ↑ Martin, Charles James; Lamb, George (1907). «Snake-poison and Snake-bite». En Allbutt, T.C., Rolleston N.D., ed. A System of Medicine (en inglés). Londres: MacMillan. pp. 783-821.
- ↑ «Sterile tail abscess in Naja annulifera - self-envenomation case». Archivado desde el original el 27 de octubre de 2004. Consultado el 2 de abril de 2009.
Enlaces externos[editar]
 Wikimedia Commons alberga una categoría multimedia sobre Veneno de serpiente.
Wikimedia Commons alberga una categoría multimedia sobre Veneno de serpiente.
- Esta obra contiene una traducción derivada de «Snake venom» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.