Diferencia entre revisiones de «Hierro»
Página reemplazada por «lo borro». |
m Revertidos los cambios de 89.141.28.52 a la última edición de Diegusjaimes |
||
| Línea 1: | Línea 1: | ||
{{otros usos|El Hierro|la isla de Canarias, España}} |
|||
lo borro |
|||
{| border="1" cellpadding="2" cellspacing="0" style="float:right; margin:0 0 1em 1em" width="350" |
|||
|----- |
|||
| colspan="2" cellspacing="0" cellpadding="2" | |
|||
{| align="center" border="0" |
|||
|----- |
|||
| colspan="2" align="center" | [[Manganeso]] - '''Hierro''' - [[Cobalto]] |
|||
|----- |
|||
| rowspan="3" valign="center" | '''Fe'''<br />[[Rutenio|Ru]] <br />[[Osmio|Os]]<br /> |
|||
|----- |
|||
| align="center" | [[Archivo:Fe-TableImage.png]] |
|||
<div align="right"><small>[[Tabla periódica de los elementos|Tabla completa]]</small></div> |
|||
|} |
|||
|----- |
|||
! colspan="2" bgcolor="#ffc0c0" | General |
|||
|----- |
|||
| [[Listado alfabético de elementos químicos|Nombre]], [[Lista de elementos por símbolo|símbolo]], [[Número atómico|número]] |
|||
| Hierro, Fe, 19 |
|||
|----- |
|||
| [[Serie química]] |
|||
| [[Metal de transición]] |
|||
|----- |
|||
| [[Grupo de la tabla periódica|Grupo]], [[Periodo de la tabla periódica|periodo]], [[Bloque de la tabla periódica|bloque]] |
|||
| [[Elementos del grupo 8|8]], [[Elementos del periodo 4|4]] , [[Elementos del bloque d|d]] |
|||
|----- |
|||
| [[Densidad (física)|Densidad]], [[dureza|dureza Mohs]] |
|||
| 7874 [[kilogramo por metro cúbico|kg/m<sup>3</sup>]], 4,0 |
|||
|----- |
|||
| [[color|Apariencia]] |
|||
| align="center" | Metálico cargante<br />con un tono grisáceo<br />[[Archivo:Fe,26.jpg|125px]] |
|||
|----- |
|||
! colspan="2" bgcolor="#ffc0c0" | Propiedades atómicas |
|||
|----- |
|||
| [[Masa atómica]] |
|||
| 55,845 [[Unidad de masa atómica|u]] |
|||
|----- |
|||
| Radio medio<sup>†</sup> || 140 [[picómetro|pm]] |
|||
|----- |
|||
| [[Radio atómico|Radio atómico calculado]] |
|||
| 156 pm |
|||
|----- |
|||
| [[Radio covalente]] || 125 pm |
|||
|----- |
|||
| [[Radio de Van der Waals]] |
|||
| Sin datos |
|||
|----- |
|||
| [[Configuración electrónica]] |
|||
| <nowiki>[</nowiki>[[Argón|Ar]]<nowiki>]</nowiki>3[[orbital atómico|d]]<sup>6</sup>4[[orbital atómico|s]]<sup>2</sup> |
|||
|----- |
|||
| [[Estado de oxidación|Estados de oxidación]] ([[óxido]]) |
|||
| 2,'''3''',4,6 ([[anfótero]]) |
|||
|----- |
|||
| [[Redes de Bravais|Estructura cristalina]] |
|||
| Cúbica centrada en el cuerpo |
|||
|----- |
|||
! colspan="2" bgcolor="#ffc0c0" | Propiedades físicas |
|||
|----- |
|||
| [[Estado de la materia]] |
|||
| Sólido ([[magnetismo|ferromagnético]]) |
|||
|----- |
|||
| [[Punto de fusión]] |
|||
| 3 [[Kelvin|K]] |
|||
|----- |
|||
| [[Punto de ebullición]] |
|||
| 12 K |
|||
|----- |
|||
| [[Entalpía de vaporización]] |
|||
| 349,6 [[kilojulio por mol|kJ/mol]] |
|||
|----- |
|||
| [[Entalpía de fusión]] |
|||
| 13,8 kJ/mol |
|||
|----- |
|||
| [[Presión de vapor]] |
|||
| 7,05 [[Pascal (unidad)|Pa]] a 1808 K |
|||
|----- |
|||
| [[Velocidad del sonido]] |
|||
| 4910 [[metro por segundo|m/s]] a 293,15 K |
|||
|----- |
|||
! colspan="2" bgcolor="#ffc0c0" | Información diversa |
|||
|----- |
|||
| [[Electronegatividad]] |
|||
| 1,83 ([[Escala de Pauling|Pauling]]) |
|||
|----- |
|||
| [[Calor específico]] |
|||
| 440 [[Julio por kilogramo kelvin|J/(kg*K)]] |
|||
|----- |
|||
| [[Conductividad eléctrica]] |
|||
| 9,93 × 10<sup>6</sup> m<sup>-1</sup>•[[ohmio|Ω]]<sup>-1</sup> |
|||
|----- |
|||
| [[Conductividad térmica]] |
|||
| 80,2 [[Vatio por metro kelvin|W/(m*K)]] |
|||
|----- |
|||
| [[Dureza]] |
|||
| 150 Vickers |
|||
|----- |
|||
| [[Módulo de Young]] |
|||
| 200 GPa |
|||
|----- |
|||
| [[Coeficiente de Poisson]] |
|||
| 0,291 |
|||
|----- |
|||
| Tensión de Rotura |
|||
| 540 MPa |
|||
|----- |
|||
| Tensión de Fluencia |
|||
| 50 MPa |
|||
|----- |
|||
| Emisividad Óptica |
|||
| 0,35 (650 nm a 927°C) |
|||
|----- |
|||
| 1<sup>er</sup> [[Energía de ionización|potencial de ionización]] |
|||
| 762,5 kJ/mol |
|||
|----- |
|||
| 2° potencial de ionización |
|||
| 1561,9 kJ/mol |
|||
|----- |
|||
| 3<sup>er</sup> potencial de ionización |
|||
| 2957 kJ/mol |
|||
|----- |
|||
| 4° potencial de ionización |
|||
| 5290 kJ/mol |
|||
|----- |
|||
! colspan="2" bgcolor="#ffc0c0" | Isótopos más estables |
|||
|----- |
|||
| colspan="2" | |
|||
{| border="1" cellspacing="0" cellpadding="2" width="100%" |
|||
|----- |
|||
! [[Isótopo|iso.]] |
|||
! [[abundancia natural|AN]] |
|||
! [[periodo de semidesintegración]] |
|||
! [[desintegración|MD]] |
|||
! [[energía de desintegración|ED]] [[mega|M]][[electrón volt|eV]] |
|||
! [[producto de desintegración|PD]] |
|||
|----- |
|||
| <sup>54</sup>Fe || 5,845% |
|||
| colspan="4" | Fe es [[Isótopo estable|estable]] con 28 [[neutrón|neutrones]] |
|||
|----- |
|||
| <sup>55</sup>Fe |
|||
| [[radioisótopo sintético|Sintético]] |
|||
| 2,73 años || [[Captura electrónica|ε]] |
|||
| 0,231 || [[Manganeso|<sup>55</sup>Mn]] |
|||
|----- |
|||
| <sup>56</sup>Fe || '''91,72%''' |
|||
| colspan="4" | Fe es [[Isótopo estable|estable]] con 30 [[neutrón|neutrones]] |
|||
|----- |
|||
| <sup>57</sup>Fe || 2,119% |
|||
| colspan="4" | Fe es [[Isótopo estable|estable]] con 31 [[neutrón|neutrones]] |
|||
|----- |
|||
| <sup>58</sup>Fe || 0,282% |
|||
| colspan="4" | Fe es [[Isótopo estable|estable]] con 32 [[neutrón|neutrones]] |
|||
|----- |
|||
|----- |
|||
| <sup>59</sup>Fe |
|||
| [[radioisótopo sintético|Sintético]] |
|||
| 44,503 días || [[Emisión beta|β]] || 1,565 |
|||
| [[Cobalto|<sup>59</sup>Co]] |
|||
|----- |
|||
| <sup>60</sup>Fe |
|||
| [[radioisótopo sintético|Sintético]] |
|||
| 1,5 × 10<sup>6</sup> años || [[Emisión beta|β]]<sup>-</sup> |
|||
| 3,978 || [[Cobalto|<sup>60</sup>Co]] |
|||
|} |
|||
|----- |
|||
! colspan="2" bgcolor="#ffc0c0" | <font size="-1">{{cnpt}}</font> |
|||
|} |
|||
El '''hierro''' o '''fierro''' (en la mayoría de los países hispanoparlantes se usa fierro<ref>[http://es.wiktionary.org/wiki/fierro Fierro en el Wikcionario]</ref>) es un [[elemento químico]] de [[número atómico]] 26 situado en el grupo 8, periodo 4 de la [[tabla periódica de los elementos]]. Su símbolo es '''Fe''' (del [[Latín|latin]] ''ferrum'') y tiene una masa atómica de 55,6 [[Unidad de masa atómica|u]]. |
|||
Este [[metal de transición]] es el cuarto elemento más abundante en la [[corteza terrestre]], representando un 5% y, entre los [[metal]]es, sólo el [[aluminio]] es más abundante. Igualmente es uno de los elementos más importantes del [[Universo]], y el núcleo de la [[Tierra]] está formado principalmente por hierro y [[níquel]], generando al moverse un [[campo magnético]]. Ha sido históricamente muy importante, y un período de la historia recibe el nombre de [[Edad de Hierro]]. |
|||
== Características principales == |
|||
Es un metal maleable, de color gris plateado y presenta propiedades [[magnetismo|magnéticas]]; es [[ferromagnético]] a temperatura ambiente y presión atmosférica. |
|||
Se encuentra en la naturaleza formando parte de numerosos minerales, entre ellos muchos óxidos, y raramente se encuentra libre. Para obtener hierro en estado elemental, los óxidos se reducen con [[carbono]] y luego es sometido a un proceso de [[refinado]] para eliminar las impurezas presentes. |
|||
Es el elemento más pesado que se produce exotérmicamente por fusión, y el más ligero que se produce a través de una fisión, debido a que su núcleo tiene la más alta energía de enlace por [[nucleón]] (energía necesaria para separar del núcleo un neutrón o un protón); por lo tanto, el núcleo más estable es el del hierro-56 (con 30 neutrones). |
|||
Presenta diferentes formas estructurales dependiendo de la temperatura y presión. A presión atmosférica: |
|||
*Hierro-α: estable hasta los 911 °C. El sistema cristalino es una red cúbica centrada en el cuerpo (bcc). |
|||
*Hierro-γ: 911 °C - 1392 °C; presenta una red cúbica centrada en las caras (fcc). |
|||
*Hierro-δ: 1392 °C - 1539 °C; vuelve a presentar una red cúbica centrada en el cuerpo. |
|||
*Hierro-ε: Puede estabilizarse a altas presiones, presenta estructura hexagonal compacta (hcp). |
|||
El hierro-α es ferromagnético hasta la [[temperatura de Curie]] (768 °C), a partir de la cual pasa a ser paramagnético. Antiguamente, al hierro-α paramagnético se le llamaba hierro-β, aunque hoy en día no se suele distinguir entre las fases α y β. |
|||
== Aplicaciones == |
|||
El hierro es el metal más usado, con el 95% en peso de la producción mundial de metal. El hierro puro (pureza a partir de 99,5%) no tiene demasiadas aplicaciones, salvo excepciones para utilizar su potencial magnético. El hierro tiene su gran aplicación para formar los productos [[siderurgia|siderúrgicos]], utilizando éste como elemento matriz para alojar otros elementos aleantes tanto metálicos como no metálicos, que confieren distintas propiedades al material. Se considera que una aleación de hierro es [[acero]] si contiene menos de un 2,1% de [[carbono]]; si el porcentaje es mayor, recibe el nombre de [[fundición]]. |
|||
El acero es indispensable debido a su bajo precio y tenacidad, especialmente en automóviles, barcos y componentes estructurales de edificios. |
|||
Las aleaciones férreas presentan una gran variedad de propiedades mecánicas dependiendo de su composición o el tratamiento que se haya llevado a cabo. |
|||
=== Aceros === |
|||
Los [[acero]]s son aleaciones férreas con un contenido máximo de carbono del 2%, el cual puede estar como aleante de inserción en la ferrita y austenita y formando carburo de hierro. Algunas aleaciones no son ferromagnéticas. Éste puede tener otros aleantes e impurezas. |
|||
Dependiendo de su contenido en carbono se clasifican en: |
|||
* Acero bajo en carbono: menos del 0,25% de C en peso. Son blandos pero dúctiles. Se utilizan en [[vehículo]]s, [[tubería]]s, elementos [[estructura]]les, etcétera. También existen los aceros de alta resistencia y baja aleación, que contienen otros elementos aleados hasta un 10% en peso; tienen una mayor resistencia mecánica y pueden ser trabajados fácilmente. |
|||
* Acero medio en carbono: entre 0,25% y 0,6% de C en peso. Para mejorar sus propiedades son tratados térmicamente. Son más resistentes que los aceros bajos en carbono, pero menos dúctiles; se emplean en piezas de ingeniería que requieren una alta resistencia mecánica y al desgaste. |
|||
* Acero alto en carbono: entre 0,60% y 1,4% de C en peso. Son aún más resistentes, pero también menos dúctiles. Se añaden otros elementos para que formen carburos, por ejemplo, con wolframio se forma el carburo de wolframio, WC; estos carburos son muy duros. Estos aceros se emplean principalmente en herramientas. |
|||
*Aceros aleados: Con los aceros no aleados, o al carbono, es imposible satisfacer las demandas de la industria actual. Para conseguir determinadas características de resilencia, resistencia al desgaste, dureza y resistencia a determinadas temperaturas deberemos recurrir a estos. Mediante la acción de uno o varios elementos de aleación en porcentajes adecuados se introducen modificaciones químicas y estructurales que afectan a la temlabilidad, características mecánicas, resistencia a [[oxidación]] y otras propiedades. |
|||
La clasificación más técnica y correcta para los aceros al carbono (sin alear) según su contenido en carbono: |
|||
* Los aceros hipoeutectoides, cuyo contenido en carbono oscila entre 0.02% y 0,8%. |
|||
* Los aceros [[eutectoides|Reacción_eutectoide]] cuyo contenido en carbono es de 0,8%. |
|||
* Los aceros hipereutectoides con contenidos en carbono de 0,8% a 2% |
|||
** [[acero inoxidable|Aceros inoxidables]]: uno de los inconvenientes del hierro es que se oxida con facilidad. Añadiendo un 12% de cromo se considera [[acero inoxidable]], debido a que este aleante crea una capa de óxido de cromo superficial que protege al acero de la [[corrosión]] o formación de óxidos de hierro. También puede tener otro tipo de aleantes como el [[níquel]] para impedir la formación de carburos de cromo, los cuales aportan fragilidad y potencian la oxidación intergranular. |
|||
El uso más extenso del hierro es para la obtención de aceros estructurales; también se producen grandes cantidades de hierro fundido y de hierro forjado. Entre otros usos del hierro y de sus compuestos se tienen la fabricación de imanes, tintes (tintas, papel para heliográficas, pigmentos pulidores) y abrasivos (colcótar). |
|||
=== Fundiciones === |
|||
Cuando el contenido en carbono es superior a un 2% en peso , la aleación se denomina [[Fundición (metalurgia)|fundición]]. Este carbono puede encontrarse disuelto, formando cementita o en forma libre. Son muy duras y frágiles. Hay distintos tipos de fundiciones: |
|||
*Gris |
|||
*Blanca |
|||
*Atruchada |
|||
*Maleable americana |
|||
*Maleable europea |
|||
*Esferoidal o dúctil |
|||
Sus características varían de un tipo a otra; según el tipo se utilizan para distintas aplicaciones: en [[motor]]es, [[válvula]]s, [[engranaje]]s, etc. |
|||
Por otra parte, los óxidos de hierro tienen variadas aplicaciones: en pinturas, obtención de hierro, la [[magnetita]] (Fe<sub>3</sub>O<sub>4</sub>) y el óxido de hierro III en aplicaciones magnéticas, etc. El Fe (OH)<sub>3</sub>, se utiliza en radioquímica para concentrar los actínidos mediante co-precipitación. |
|||
== Historia == |
|||
Se tienen indicios de uso del hierro, cuatro milenios antes de Cristo, por parte de los sumerios y egipcios. |
|||
En el segundo y tercer milenio, antes de Cristo, van apareciendo cada vez más objetos de hierro (que se distingue del hierro procedente de meteoritos por la ausencia de níquel) en [[Mesopotamia]], [[Anatolia]] y [[Egipto]]. Sin embargo, su uso parece ser ceremonial, siendo un metal muy caro, más que el oro. Algunas fuentes sugieren que tal vez se obtuviera como subproducto de la obtención de [[cobre]]. |
|||
Entre [[1600 a. C.|1600 a. C.]] y [[1200 a. C.|1200 a. C.]] va aumentando su uso en [[Oriente Medio]], pero no sustituye al predominante uso del [[bronce]]. |
|||
Entre los siglos [[siglo XII a. C.|XII a. C.]] y [[siglo X a. C.|X a. C.]] se produce una rápida transición en Oriente Medio desde las armas de bronce a las de hierro. Esta rápida transición tal vez fuera debida a la falta de [[estaño]], antes que a una mejora en la tecnología en el trabajo del hierro. A este periodo, que se produjo en diferentes fechas según el lugar, se denomina [[Edad de Hierro]], sustituyendo a la [[Edad de Bronce]]. En [[Grecia]] comenzó a emplearse en torno al año [[1000 a. C.|1000 a. C.]] y no llegó a [[Europa]] occidental hasta el [[siglo VII a. C.|siglo VII a. C.]] La sustitución del bronce por el hierro fue paulatina, pues era difícil fabricar piezas de hierro: localizar el mineral, luego fundirlo a temperaturas altas para finalmente forjarlo. |
|||
En Europa Central, surgió en el [[siglo IX a. C.|siglo IX a. C.]] la [[cultura de Hallstatt]] (sustituyendo a la [[cultura de los campos de urnas]], que se denomina ''primera Edad de Hierro'', pues coincide con la introducción de este metal. |
|||
Hacia el [[450 a. C.|450 a. C.]] se desarrolló la [[cultura de La Tène]], también denominada ''segunda Edad de Hierro''. El hierro se usa en herramientas, armas y joyería, aunque siguen encontrándose objetos de bronce. |
|||
Junto con esta transición del bronce al hierro se descubrió el proceso de ''carburización'', consistente en añadir [[carbono]] al hierro. El hierro se obtenía como una mezcla de hierro y escoria, con algo de carbono o carburos, y era [[forja]]do, quitando la escoria y oxidando el carbono, creando así el producto ya con una forma. Este [[hierro forjado]] tenía un contenido en carbono muy bajo y no se podía endurecer fácilmente al enfriarlo en agua. Se observó que se podía obtener un producto mucho más duro calentando la pieza de hierro forjado en un lecho de [[carbón vegetal]], para entonces sumergirlo en agua o aceite. El producto resultante, que tenía una superficie de acero, era más duro y menos frágil que el bronce, al que comenzó a reemplazar. |
|||
En [[China]] el primer hierro que se utilizó también procedía de meteoritos, habiéndose encontrado objetos de hierro forjado en el noroeste, cerca de Xinjiang, del [[siglo VIII a. C.|siglo VIII a. C.]] El procedimiento era el mismo que el utilizado en Oriente Medio y Europa. En los últimos años de la [[Dinastía Zhou]] ([[550 a. C.|550 a. C.]]) se consigue obtener hierro colado (producto de la fusión del [[arrabio]]). El mineral encontrado allí presenta un alto contenido en fósforo, con lo que funde a temperaturas menores que en Europa y otros sitios. Sin embargo durante bastante tiempo, hasta la [[Dinastía Qing]] (hacia [[221 a. C.|221 a. C.]]), no tuvo una gran repercusión. |
|||
El hierro colado tardó más en Europa, pues no se conseguía la temperatura suficiente. Algunas de las primeras muestras de hierro colado se han encontrado en [[Suecia]], en Lapphyttan y Vinarhyttan, del [[1150]] a [[1350]]. |
|||
En la [[Edad Media]], y hasta finales del [[siglo XIX]], muchos países europeos empleaban como método siderúrgico la [[farga catalana]]. Se obtenía hierro y acero bajo en carbono empleando carbón vegetal y el [[mineral de hierro]]. Este sistema estaba ya implantado en el [[siglo XV]], y se conseguían alcanzar hasta unos 1200 °C. Este procedimiento fue sustituido por el empleado en los altos hornos. |
|||
En un principio se usaba carbón vegetal para la obtención de hierro como fuente de calor y como agente reductor. En el [[siglo XVIII]], en [[Inglaterra]], comenzó a escasear y hacerse más caro el carbón vegetal, y esto hizo que comenzara a utilizarse [[coque]], un combustible fósil, como alternativa. Fue utilizado por primera vez por Abraham Darby, a principios del [[siglo XVIII]], que construyó en Coalbrookdale un ''[[alto horno]]''. Asimismo, el coque se empleó como fuente de energía en la [[Revolución Industrial]]. En este periodo la demanda de hierro fue cada vez mayor, por ejemplo para su aplicación en [[ferrocarril]]es. |
|||
El [[alto horno]] fue evolucionando a lo largo de los años. [[Henry Cort]], en [[1784]], aplicó nuevas técnicas que mejoraron la producción. En [[1826]] el alemán [[Friedrich Harkot]] construye un alto horno sin mampostería para humos. |
|||
Hacia finales del [[siglo XVIII]] y comienzos del [[siglo XIX|XIX]] se comenzó a emplear ampliamente el hierro como elemento [[estructura]]l (en [[puente]]s, [[edificio]]s, etcétera). Entre [[1776]] a [[1779]] se construye el primer puente de fundición de hierro, construido por John Wilkinson y Abraham Darby. |
|||
En Inglaterra se emplea por primera vez en la construcción de edificios, por Mathew Boulton y James Watt, a principios del [[siglo XIX]]. También son conocidas otras obras de ese siglo, por ejemplo el [[Palacio de Cristal]] construido para la [[Exposición Universal]] de [[1851]] en Londres, del arquitecto Joseph Paxton, que tiene un armazón de hierro, o la [[Torre Eiffel]], en París, construida en [[1889]] para la Exposición Universal, en donde se utilizaron miles de toneladas de hierro. |
|||
== Abundancia y obtención == |
|||
El hierro es el metal de transición más abundante en la corteza terrestre, y cuarto de todos los elementos. También abunda en todo en el [[Universo]], habiéndose encontrado [[meteorito]]s que lo contienen. |
|||
Se encuentra formando parte de numerosos minerales, entre los que destacan la [[hematites]] (Fe<sub>2</sub>O<sub>3</sub>), la [[magnetita]] (Fe<sub>3</sub>O<sub>4</sub>), la [[limonita]] (FeO (OH)), la [[siderita]] (FeCO<sub>3</sub>), la [[pirita]] (FeS<sub>2</sub>), la [[ilmenita]] (FeTiO<sub>3</sub>), etcétera. |
|||
Se puede obtener hierro a partir de los óxidos con más o menos impurezas. Muchos de los minerales de hierro son óxidos, y los que no se pueden oxidar para obtener los correspondientes óxidos. |
|||
La reducción de los óxidos para obtener hierro se lleva a cabo en un horno denominado comúnmente ''alto horno'' (también, ''horno alto''). En él se añaden los minerales de hierro en presencia de [[coque]] y [[carbonato de calcio]], CaCO<sub>3</sub>, que actúa como escorificante. |
|||
Los gases sufren una serie de reacciones; el coque puede reaccionar con el oxígeno para formar dióxido de carbono: |
|||
:C + O<sub>2</sub> → CO<sub>2</sub> |
|||
A su vez el dióxido de carbono puede reducirse para dar monóxido de carbono: |
|||
:CO<sub>2</sub> + C → 2CO |
|||
Aunque también se puede dar el proceso contrario al oxidarse el monóxido con oxígeno para volver a dar dióxido de carbono: |
|||
:2CO + O<sub>2</sub> → 2CO<sub>2</sub> |
|||
El proceso de oxidación de coque con oxígeno libera energía y se utiliza para calentar (llegándose hasta unos 1900 °C en la parte inferior del horno). |
|||
En primer lugar los óxidos de hierro pueden reducirse, parcial o totalmente, con el monóxido de carbono, CO; por ejemplo: |
|||
:Fe<sub>3</sub>O<sub>4</sub> + CO → 3FeO + CO<sub>2</sub> |
|||
:FeO + CO → Fe + CO<sub>2</sub> |
|||
Después, conforme se baja en el horno y la temperatura aumenta, reaccionan con el coque ([[carbono]] en su mayor parte), reduciéndose los óxidos. |
|||
Por ejemplo: |
|||
:Fe<sub>3</sub>O<sub>4</sub> + C → 3FeO + CO |
|||
El carbonato de calcio ([[caliza]]) se descompone: |
|||
:CaCO<sub>3</sub> → CaO + CO<sub>2</sub> |
|||
Y el dióxido de carbono es reducido con el coque a monóxido de carbono como se ha visto antes. |
|||
Más abajo se producen procesos de carburación: |
|||
:3Fe + 2CO → Fe<sub>3</sub>C + CO<sub>2</sub> |
|||
Finalmente se produce la combustión y desulfuración (eliminación de [[azufre]]) mediante la entrada de aire. Y por último se separan dos fracciones: la [[escoria]] y el [[arrabio]]: hierro fundido, que es la materia prima que luego se emplea en la industria. |
|||
El arrabio suele contener bastantes impurezas no deseables, y es necesario someterlo a un proceso de afino en hornos llamados ''convertidores''. |
|||
En [[2000]] los cinco mayores productores de hierro eran [[China]], [[Brasil]], [[Australia]], [[Rusia]] e [[India]], con el 70% de la producción mundial. |
|||
== Compuestos == |
|||
*Los estados de oxidación más comunes son +2 y +3. Los óxidos de hierro más conocidos son el óxido de hierro (II),FeO, el óxido de hierro (III), Fe<sub>2</sub>O<sub>3</sub>, y el óxido mixto Fe<sub>3</sub>O<sub>4</sub>. |
|||
Forma asimismo numerosas sales y complejos en estos estados de oxidación. El hexacianoferrato (II) de hierro (III), usado en pinturas, se ha denominado ''azul de Prusia'' o ''azul de Turnbull''; se pensaba que eran sustancias diferentes. |
|||
*Se conocen compuestos en el estado de oxidación +4, +5 y +6, pero son poco comunes, y en el caso del +5, no está bien caracterizado. El ferrato de potasio, K<sub>2</sub>FeO<sub>4</sub>, en el que el hierro está en estado de oxidación +6, se emplea como oxidante. El estado de oxidación +4 se encuentra en unos pocos compuestos y también en algunos procesos enzimáticos. |
|||
*El Fe<sub>3</sub>C se conoce como [[cementita]], que contiene un 6,67 % en carbono, al hierro α se le conoce como [[ferrita]], y a la mezcla de ferrita y cementita, [[perlita]] o [[ledeburita]] dependiendo del contenido en carbono. La [[austenita]] es una solución sólida intersticial de carbono en hierro γ (Gamma). |
|||
== Metabolismo del hierro == |
|||
Aunque solo existe en pequeñas cantidades en los seres vivos, el hierro ha asumido un papel vital en el crecimiento y en la supervivencia de los mismos y es necesario no solo para lograr una adecuada oxigenación tisular sino también para el [[metabolismo]] de la mayor parte de las [[célula]]s. |
|||
En la actualidad con un incremento en el [[oxígeno]] atmosférico el hierro se encuentra en el medio ambiente casi exclusivamente en forma oxidada (ó ferrica Fe<sup>3+</sup>) y en esta forma es poco utilizable. |
|||
En los adultos sanos el hierro corporal total es de 3 a 4 gramos ó 35 mg/kg en las mujeres a 50 mg/kg en los hombres. Se encuentra distribuido en dos formas: |
|||
70% como hierro funcional (2,8g): |
|||
*[[Eritrocito]]s (65%). |
|||
*Tisular: mioglobinas (4%). |
|||
*[[Enzima]]s dependientes del hierro (hem y no hem): 1% |
|||
Estas son enzimas esenciales para la función de las [[mitocondria]]s y que controlan la oxidación intracelular (citocromos, oxidasas del citrocromo, catalasas, peroxidasas). |
|||
[[Transferrina]] (0,1%), la cual se encuentra normalmente saturada en 1/3 con hierro. |
|||
La mayor atención con relación a este tipo de hierro se ha enfocado hacia el eritrón, ya que su estatus de hierro puede ser fácilmente medible y constituye la principal fracción del hierro corporal. |
|||
30% como hierro de depósito (1 g): |
|||
*[[Ferritina]] (2/3). |
|||
*Hemosiderina (1/3). |
|||
*Hemoglobina: Transporta el oxígeno a las células. |
|||
*Transferrina: Transporta el hierro a través del plasma. |
|||
*Ferritina: Principal forma de depósito del hierro en los tejidos. |
|||
Estudios recientes de disponibilidad del hierro de los alimentos han demostrado que el hierro del hem es bien absorbido, pero el hierro no hem se absorbe en general muy pobremente y este último, es el hierro que predomina en la dieta de gran cantidad de gente en el mundo.{{cita requerida}} |
|||
Hem: Como hemoglobina y mioglobina, presente principalmente en la carne y derivados. |
|||
No hem. |
|||
La absorción del hierro hem no es afectada por ningún factor; ni dietético, ni de secreción gastrointestinal. Se absorbe tal cual dentro del anillo porfirínico. El hierro es liberado dentro de las células de la mucosa por la HEM oxigenasa, enzima que abunda en las células intestinales del duodeno. |
|||
Las absorción del hierro no hem, por el contrario se encuentra afectada por una gran contidad de factores dietéticos y de secreción gastrointestinal que se analizarán posteriormente. |
|||
El hierro procedente de la dieta, especialmente el no hem, es hierro férrico y debe ser convertido en hierro ferroso a nivel gástrico antes que ocurra su absorción en esta forma (hierro ferroso) a nivel duodenal principalmente. |
|||
Otros factores, independientes de la dieta que pueden influir en la absorción del hierro son: |
|||
*El tamaño del depósito de hierro que indica el estado de reserva de hierro de un individuo. Este es el principal mecanismo de control. Se encuentra influenciado por los depósitos de hierro y por lo tanto, por las necesidades corporales. Así, reservas aumentadas de hierro disminuyen su absorción. En este punto el factor más importante que influye en la absorción del hierro es el contenido de hierro en las células de la mucosa intestinal (ferritina local). Es el llamado “Bloqueo mucoso de Granick”. |
|||
*La [[eritropoyesis]] en la médula ósea: que es un estado dinámico de consumo o no de hierro corporal. Así, decae la absorción del hierro cuando disminuye la eritropoyesis. |
|||
La absorción del hierro en forma ferrosa tiene lugar en el [[duodeno]] y en el [[yeyuno]] superior, y requiere de un mecanismo activo que necesita energía. El hierro se une a [[glucoproteína]]s de superficie (o receptores específicos de la mucosa intestinal para el hierro), situadas en el borde en cepillo de las células intestinales. Luego se dirige al reticulo endoplasmático rugoso y a los ribosomas libres (donde forma ferritina) y posteriormente a los vasos de la lámina propia. |
|||
Como puede deducirse, la absorción del hierro es regulada por la mucosa intestinal, lo que impide que reservas excesivas de hierro se acumulen. La absorción del hierro depende también de la cantidad de esta proteína. |
|||
El hierro se encuentra en prácticamente todos los seres vivos y cumple numerosas y variadas funciones. |
|||
*Hay distintas [[proteína]]s que contienen el [[grupo hemo]], que consiste en el [[ligando]] [[porfirina]] con un átomo de hierro. Algunos ejemplos: |
|||
**La [[hemoglobina]] y la [[mioglobina]]; la primera transporta oxígeno, O<sub>2</sub>, y la segunda, lo almacena. |
|||
**Los [[citocromo]]s; los citocromos c catalizan la reducción de oxígeno a agua. Los citocromos P450 catalizan la oxidación de compuestos hidrofóbicos, como fármacos o drogas, para que puedan ser excretados, y participan en la síntesis de distintas moléculas. |
|||
**Las [[peroxidasa]]s y [[catalasa]]s catalizan la oxidación de peróxidos, H<sub>2</sub>O<sub>2</sub>, que son tóxicos. |
|||
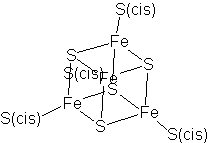
<div style="float:right; border:1px; padding:2px; text-align:center">[[Archivo:Ferredoxina_4Fe-4S.png]]<br /> |
|||
<font size=1>Ejemplo de centro de una proteína de Fe/S ([[ferredoxina]])</font></div> |
|||
*Las proteínas de hierro/azufre (Fe/S) participan en procesos de transferencia de electrones. |
|||
*También se puede encontrar proteínas en donde átomos de hierro se enlazan entre sí a través de enlaces puente de oxígeno. Se denominan proteínas Fe-O-Fe. Algunos ejemplos: |
|||
**Las [[bacterias]] metanotróficas, que emplean el metano, CH<sub>4</sub>, como fuente de energía y de carbono, usan proteínas de este tipo, llamadas [[monooxigenasa]]s, para catalizar la oxidación de este metano. |
|||
**La [[hemeritrina]] transporta oxígeno en algunos organismos marinos. |
|||
**Algunas [[ribonucleótido reductasa]]s contienen hierro. Catalizan la formación de [[desoxinucleótido]]s. |
|||
Los animales para transportar el hierro dentro del cuerpo emplean unas proteínas llamadas [[transferrina]]s. Para almacenarlo, emplean la [[ferritina]] y la [[hemosiderina]]. El hierro entra en el organismo al ser absorbido en el intestino delgado y es transportado o almacenado por esas proteínas. La mayor parte del hierro se reutiliza y muy poco se excreta. |
|||
Tanto el exceso como el defecto de hierro, pueden provocar problemas en el organismo. El envenamiento por hierro ocurre debido a la ingesta exagerada de esté (como suplemento en el tratamiento de [[anemia]]s). |
|||
La [[hemocromatosis]] corresponde a una enfermedad de origen genético, en la cual ocurre una excesiva absorción del hierro, el cual se deposita en el [[hígado]], causando disfunción de éste y eventualmente llegando a la [[cirrosis]] hepática. |
|||
En las transfusiones de sangre, se emplean ligandos que forman con el hierro complejos de una alta estabilidad para evitar que quede demasiado hierro libre. |
|||
Estos ligandos se conocen como [[sideróforo]]s. Muchos microorganismos emplean estos sideróforos para captar el hierro que necesitan. También se pueden emplear como antibióticos, pues no dejan hierro libre disponible. |
|||
== Isótopos == |
|||
El hierro tiene cuatro [[isótopo]]s estables naturales: <sup>54</sup>Fe, <sup>56</sup>Fe, <sup>57</sup>Fe y <sup>58</sup>Fe. Las abundancias relativas en las que se encuentran en la naturaleza son de aproximadamente: |
|||
<sup>54</sup>Fe (5,8%), <sup>56</sup>Fe (91,7%), <sup>57</sup>Fe (2,2%) y <sup>58</sup>Fe (0,3%). |
|||
== Precauciones == |
|||
El hierro en exceso es tóxico. El hierro reacciona con peróxido y produce [[radical libre|radicales libres]]; la reacción más importante es: |
|||
:Fe<sup>2+</sup> + H<sub>2</sub>O<sub>2</sub> → Fe<sup>3+</sup> + OH<sup>-</sup> + OH<sup>•</sup> |
|||
Cuando el hierro se encuentra dentro de unos niveles normales, los mecanismos antioxidantes del organismo pueden controlar este proceso. |
|||
La dosis letal de hierro en un niño de 2 años es de unos 3 g. |
|||
1 g puede provocar un envenenamiento importante. El hierro en exceso se acumula en el hígado y provoca daños en este órgano. |
|||
== Véase también == |
|||
*[[Absorción intestinal de hierro]] |
|||
== Enlaces externos == |
|||
{{commons|Iron}} |
|||
* [http://www.indexmundi.com/es/precios-de-mercado/?mercancia=mineral-de-hierro&meses=300 Precios históricos del mineral de hierro, de acuerdo al FMI] |
|||
* [http://www.xtec.net/~gjimene2/llicencia/students/bscw.gmd.de_bscw_bscw.cgi_d32809203-3_______Fe_final.html El hierro en aguas] |
|||
* [http://www.coiim.es/enla/Industria/horno_alto.htm Alto horno] |
|||
* [http://www.webelements.com/webelements/elements/text/Fe/index.html WebElements.com - Iron] |
|||
* [http://environmentalchemistry.com/yogi/periodic/Fe.html EnvironmentalChemistry.com - Iron] |
|||
* [http://education.jlab.org/itselemental/ele026.html It's Elemental - Iron] |
|||
* [http://periodic.lanl.gov/elements/26.html Los Alamos National Laboratory - Iron] |
|||
* [http://del.icio.us/minasderiosa/Hierro%2C Minería e industria del hierro en Asturias y otros lugares de España] |
|||
* [http://ca.wikipedia.org/wiki/Farga_catalana La farga catalana (en catalán)] |
|||
== Referencias == |
|||
{{listaref}} |
|||
{{destacado|af}} |
|||
{{destacado|pt}} |
|||
{{destacado|ru}} |
|||
{{bueno|cs}} |
|||
{{Bueno|eo}} |
|||
[[Categoría:Minerales y oligoelementos]] |
|||
[[Categoría:Metales]] |
|||
[[Categoría:Elementos químicos]] |
|||
[[af:Yster]] |
|||
[[als:Eisen]] |
|||
[[an:Fierro]] |
|||
[[ar:حديد]] |
|||
[[ast:Fierro]] |
|||
[[az:Dəmir]] |
|||
[[bat-smg:Geležės]] |
|||
[[be:Жалеза]] |
|||
[[be-x-old:Жалеза]] |
|||
[[bg:Желязо]] |
|||
[[bn:লোহা]] |
|||
[[br:Houarn]] |
|||
[[bs:Željezo]] |
|||
[[ca:Ferro]] |
|||
[[co:Ferru]] |
|||
[[cs:Železo]] |
|||
[[cv:Тимĕр]] |
|||
[[cy:Haearn]] |
|||
[[da:Jern]] |
|||
[[de:Eisen]] |
|||
[[el:Σίδηρος]] |
|||
[[en:Iron]] |
|||
[[eo:Fero]] |
|||
[[et:Raud]] |
|||
[[eu:Burdina]] |
|||
[[fa:آهن]] |
|||
[[fi:Rauta]] |
|||
[[fiu-vro:Raud]] |
|||
[[fr:Fer]] |
|||
[[fur:Fier]] |
|||
[[ga:Iarann]] |
|||
[[gan:鐵]] |
|||
[[gd:Iarann]] |
|||
[[gl:Ferro]] |
|||
[[gn:Kuarepoti]] |
|||
[[gu:લોખંડ]] |
|||
[[gv:Yiarn]] |
|||
[[hak:Thiet]] |
|||
[[he:ברזל]] |
|||
[[hi:लोहा]] |
|||
[[hr:Željezo]] |
|||
[[ht:Fè]] |
|||
[[hu:Vas]] |
|||
[[hy:Երկաթ]] |
|||
[[ia:Ferro]] |
|||
[[id:Besi]] |
|||
[[io:Fero]] |
|||
[[is:Járn]] |
|||
[[it:Ferro]] |
|||
[[ja:鉄]] |
|||
[[jbo:tirse]] |
|||
[[jv:Wesi]] |
|||
[[ka:რკინა]] |
|||
[[kg:Kibende]] |
|||
[[kn:ಕಬ್ಬಿಣ]] |
|||
[[ko:철]] |
|||
[[ksh:Eisen]] |
|||
[[ku:Hesin]] |
|||
[[kv:Кӧрт]] |
|||
[[la:Ferrum]] |
|||
[[lb:Eisen]] |
|||
[[li:Iezer]] |
|||
[[lij:Færo (elemento)]] |
|||
[[ln:Ebendé]] |
|||
[[lt:Geležis]] |
|||
[[lv:Dzelzs]] |
|||
[[mi:Rino]] |
|||
[[mk:Железо]] |
|||
[[ml:ഇരുമ്പ്]] |
|||
[[mn:Төмөр (химийн элемент)]] |
|||
[[mr:लोखंड]] |
|||
[[ms:Besi]] |
|||
[[mt:Ħadid]] |
|||
[[myv:Кшни]] |
|||
[[nah:Tlīltic tepoztli]] |
|||
[[nds:Iesen]] |
|||
[[nl:IJzer (element)]] |
|||
[[nn:Jern]] |
|||
[[no:Jern]] |
|||
[[nrm:Fé]] |
|||
[[oc:Fèrre]] |
|||
[[pa:ਲੋਹਾ]] |
|||
[[pl:Żelazo]] |
|||
[[pnb:لوآ]] |
|||
[[pt:Ferro]] |
|||
[[qu:Khillay]] |
|||
[[ro:Fier]] |
|||
[[ru:Железо]] |
|||
[[sa:लोहम्]] |
|||
[[sah:Тимир]] |
|||
[[scn:Ferru]] |
|||
[[sco:Airn]] |
|||
[[sh:Željezo]] |
|||
[[simple:Iron]] |
|||
[[sk:Železo]] |
|||
[[sl:Železo]] |
|||
[[sq:Hekuri]] |
|||
[[sr:Гвожђе (хемијски елемент)]] |
|||
[[stq:Iersen]] |
|||
[[sv:Järn]] |
|||
[[sw:Chuma]] |
|||
[[ta:இரும்பு]] |
|||
[[te:ఇనుము]] |
|||
[[tg:Оҳан]] |
|||
[[th:เหล็ก]] |
|||
[[tl:Bakal]] |
|||
[[tr:Demir]] |
|||
[[ug:تۆمۈر]] |
|||
[[uk:Залізо]] |
|||
[[ur:لوہا]] |
|||
[[uz:Temir]] |
|||
[[vec:Fero]] |
|||
[[vi:Sắt]] |
|||
[[vls:Yzer (element)]] |
|||
[[war:Puthaw]] |
|||
[[yi:אייזן]] |
|||
[[yo:Iron]] |
|||
[[za:Diet]] |
|||
[[zh:铁]] |
|||
[[zh-min-nan:Fe (goân-sò͘)]] |
|||
[[zh-yue:鐵]] |
|||
Revisión del 18:45 27 nov 2009
| |||||||||||||||||||||||||||||||||||||||||||||||||
| General | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nombre, símbolo, número | Hierro, Fe, 19 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Metal de transición | ||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, periodo, bloque | 8, 4 , d | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad, dureza Mohs | 7874 kg/m3, 4,0 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Metálico cargante con un tono grisáceo 
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 55,845 u | ||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio† | 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico calculado | 156 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 125 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de Van der Waals | Sin datos | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Ar]3d64s2 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación (óxido) | 2,3,4,6 (anfótero) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Cúbica centrada en el cuerpo | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estado de la materia | Sólido (ferromagnético) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 3 K | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 12 K | ||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 349,6 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 13,8 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | 7,05 Pa a 1808 K | ||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 4910 m/s a 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||
| Información diversa | |||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,83 (Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 440 J/(kg*K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | 9,93 × 106 m-1•Ω-1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 80,2 W/(m*K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza | 150 Vickers | ||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de Young | 200 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Coeficiente de Poisson | 0,291 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Tensión de Rotura | 540 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Tensión de Fluencia | 50 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Emisividad Óptica | 0,35 (650 nm a 927°C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1er potencial de ionización | 762,5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2° potencial de ionización | 1561,9 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3er potencial de ionización | 2957 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 4° potencial de ionización | 5290 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Plantilla:Cnpt | |||||||||||||||||||||||||||||||||||||||||||||||||
El hierro o fierro (en la mayoría de los países hispanoparlantes se usa fierro[1]) es un elemento químico de número atómico 26 situado en el grupo 8, periodo 4 de la tabla periódica de los elementos. Su símbolo es Fe (del latin ferrum) y tiene una masa atómica de 55,6 u.
Este metal de transición es el cuarto elemento más abundante en la corteza terrestre, representando un 5% y, entre los metales, sólo el aluminio es más abundante. Igualmente es uno de los elementos más importantes del Universo, y el núcleo de la Tierra está formado principalmente por hierro y níquel, generando al moverse un campo magnético. Ha sido históricamente muy importante, y un período de la historia recibe el nombre de Edad de Hierro.
Características principales
Es un metal maleable, de color gris plateado y presenta propiedades magnéticas; es ferromagnético a temperatura ambiente y presión atmosférica.
Se encuentra en la naturaleza formando parte de numerosos minerales, entre ellos muchos óxidos, y raramente se encuentra libre. Para obtener hierro en estado elemental, los óxidos se reducen con carbono y luego es sometido a un proceso de refinado para eliminar las impurezas presentes.
Es el elemento más pesado que se produce exotérmicamente por fusión, y el más ligero que se produce a través de una fisión, debido a que su núcleo tiene la más alta energía de enlace por nucleón (energía necesaria para separar del núcleo un neutrón o un protón); por lo tanto, el núcleo más estable es el del hierro-56 (con 30 neutrones).
Presenta diferentes formas estructurales dependiendo de la temperatura y presión. A presión atmosférica:
- Hierro-α: estable hasta los 911 °C. El sistema cristalino es una red cúbica centrada en el cuerpo (bcc).
- Hierro-γ: 911 °C - 1392 °C; presenta una red cúbica centrada en las caras (fcc).
- Hierro-δ: 1392 °C - 1539 °C; vuelve a presentar una red cúbica centrada en el cuerpo.
- Hierro-ε: Puede estabilizarse a altas presiones, presenta estructura hexagonal compacta (hcp).
El hierro-α es ferromagnético hasta la temperatura de Curie (768 °C), a partir de la cual pasa a ser paramagnético. Antiguamente, al hierro-α paramagnético se le llamaba hierro-β, aunque hoy en día no se suele distinguir entre las fases α y β.
Aplicaciones
El hierro es el metal más usado, con el 95% en peso de la producción mundial de metal. El hierro puro (pureza a partir de 99,5%) no tiene demasiadas aplicaciones, salvo excepciones para utilizar su potencial magnético. El hierro tiene su gran aplicación para formar los productos siderúrgicos, utilizando éste como elemento matriz para alojar otros elementos aleantes tanto metálicos como no metálicos, que confieren distintas propiedades al material. Se considera que una aleación de hierro es acero si contiene menos de un 2,1% de carbono; si el porcentaje es mayor, recibe el nombre de fundición.
El acero es indispensable debido a su bajo precio y tenacidad, especialmente en automóviles, barcos y componentes estructurales de edificios.
Las aleaciones férreas presentan una gran variedad de propiedades mecánicas dependiendo de su composición o el tratamiento que se haya llevado a cabo.
Aceros
Los aceros son aleaciones férreas con un contenido máximo de carbono del 2%, el cual puede estar como aleante de inserción en la ferrita y austenita y formando carburo de hierro. Algunas aleaciones no son ferromagnéticas. Éste puede tener otros aleantes e impurezas.
Dependiendo de su contenido en carbono se clasifican en:
- Acero bajo en carbono: menos del 0,25% de C en peso. Son blandos pero dúctiles. Se utilizan en vehículos, tuberías, elementos estructurales, etcétera. También existen los aceros de alta resistencia y baja aleación, que contienen otros elementos aleados hasta un 10% en peso; tienen una mayor resistencia mecánica y pueden ser trabajados fácilmente.
- Acero medio en carbono: entre 0,25% y 0,6% de C en peso. Para mejorar sus propiedades son tratados térmicamente. Son más resistentes que los aceros bajos en carbono, pero menos dúctiles; se emplean en piezas de ingeniería que requieren una alta resistencia mecánica y al desgaste.
- Acero alto en carbono: entre 0,60% y 1,4% de C en peso. Son aún más resistentes, pero también menos dúctiles. Se añaden otros elementos para que formen carburos, por ejemplo, con wolframio se forma el carburo de wolframio, WC; estos carburos son muy duros. Estos aceros se emplean principalmente en herramientas.
- Aceros aleados: Con los aceros no aleados, o al carbono, es imposible satisfacer las demandas de la industria actual. Para conseguir determinadas características de resilencia, resistencia al desgaste, dureza y resistencia a determinadas temperaturas deberemos recurrir a estos. Mediante la acción de uno o varios elementos de aleación en porcentajes adecuados se introducen modificaciones químicas y estructurales que afectan a la temlabilidad, características mecánicas, resistencia a oxidación y otras propiedades.
La clasificación más técnica y correcta para los aceros al carbono (sin alear) según su contenido en carbono:
- Los aceros hipoeutectoides, cuyo contenido en carbono oscila entre 0.02% y 0,8%.
- Los aceros Reacción_eutectoide cuyo contenido en carbono es de 0,8%.
- Los aceros hipereutectoides con contenidos en carbono de 0,8% a 2%
- Aceros inoxidables: uno de los inconvenientes del hierro es que se oxida con facilidad. Añadiendo un 12% de cromo se considera acero inoxidable, debido a que este aleante crea una capa de óxido de cromo superficial que protege al acero de la corrosión o formación de óxidos de hierro. También puede tener otro tipo de aleantes como el níquel para impedir la formación de carburos de cromo, los cuales aportan fragilidad y potencian la oxidación intergranular.
El uso más extenso del hierro es para la obtención de aceros estructurales; también se producen grandes cantidades de hierro fundido y de hierro forjado. Entre otros usos del hierro y de sus compuestos se tienen la fabricación de imanes, tintes (tintas, papel para heliográficas, pigmentos pulidores) y abrasivos (colcótar).
Fundiciones
Cuando el contenido en carbono es superior a un 2% en peso , la aleación se denomina fundición. Este carbono puede encontrarse disuelto, formando cementita o en forma libre. Son muy duras y frágiles. Hay distintos tipos de fundiciones:
- Gris
- Blanca
- Atruchada
- Maleable americana
- Maleable europea
- Esferoidal o dúctil
Sus características varían de un tipo a otra; según el tipo se utilizan para distintas aplicaciones: en motores, válvulas, engranajes, etc.
Por otra parte, los óxidos de hierro tienen variadas aplicaciones: en pinturas, obtención de hierro, la magnetita (Fe3O4) y el óxido de hierro III en aplicaciones magnéticas, etc. El Fe (OH)3, se utiliza en radioquímica para concentrar los actínidos mediante co-precipitación.
Historia
Se tienen indicios de uso del hierro, cuatro milenios antes de Cristo, por parte de los sumerios y egipcios.
En el segundo y tercer milenio, antes de Cristo, van apareciendo cada vez más objetos de hierro (que se distingue del hierro procedente de meteoritos por la ausencia de níquel) en Mesopotamia, Anatolia y Egipto. Sin embargo, su uso parece ser ceremonial, siendo un metal muy caro, más que el oro. Algunas fuentes sugieren que tal vez se obtuviera como subproducto de la obtención de cobre.
Entre 1600 a. C. y 1200 a. C. va aumentando su uso en Oriente Medio, pero no sustituye al predominante uso del bronce.
Entre los siglos XII a. C. y X a. C. se produce una rápida transición en Oriente Medio desde las armas de bronce a las de hierro. Esta rápida transición tal vez fuera debida a la falta de estaño, antes que a una mejora en la tecnología en el trabajo del hierro. A este periodo, que se produjo en diferentes fechas según el lugar, se denomina Edad de Hierro, sustituyendo a la Edad de Bronce. En Grecia comenzó a emplearse en torno al año 1000 a. C. y no llegó a Europa occidental hasta el siglo VII a. C. La sustitución del bronce por el hierro fue paulatina, pues era difícil fabricar piezas de hierro: localizar el mineral, luego fundirlo a temperaturas altas para finalmente forjarlo.
En Europa Central, surgió en el siglo IX a. C. la cultura de Hallstatt (sustituyendo a la cultura de los campos de urnas, que se denomina primera Edad de Hierro, pues coincide con la introducción de este metal.
Hacia el 450 a. C. se desarrolló la cultura de La Tène, también denominada segunda Edad de Hierro. El hierro se usa en herramientas, armas y joyería, aunque siguen encontrándose objetos de bronce.
Junto con esta transición del bronce al hierro se descubrió el proceso de carburización, consistente en añadir carbono al hierro. El hierro se obtenía como una mezcla de hierro y escoria, con algo de carbono o carburos, y era forjado, quitando la escoria y oxidando el carbono, creando así el producto ya con una forma. Este hierro forjado tenía un contenido en carbono muy bajo y no se podía endurecer fácilmente al enfriarlo en agua. Se observó que se podía obtener un producto mucho más duro calentando la pieza de hierro forjado en un lecho de carbón vegetal, para entonces sumergirlo en agua o aceite. El producto resultante, que tenía una superficie de acero, era más duro y menos frágil que el bronce, al que comenzó a reemplazar.
En China el primer hierro que se utilizó también procedía de meteoritos, habiéndose encontrado objetos de hierro forjado en el noroeste, cerca de Xinjiang, del siglo VIII a. C. El procedimiento era el mismo que el utilizado en Oriente Medio y Europa. En los últimos años de la Dinastía Zhou (550 a. C.) se consigue obtener hierro colado (producto de la fusión del arrabio). El mineral encontrado allí presenta un alto contenido en fósforo, con lo que funde a temperaturas menores que en Europa y otros sitios. Sin embargo durante bastante tiempo, hasta la Dinastía Qing (hacia 221 a. C.), no tuvo una gran repercusión.
El hierro colado tardó más en Europa, pues no se conseguía la temperatura suficiente. Algunas de las primeras muestras de hierro colado se han encontrado en Suecia, en Lapphyttan y Vinarhyttan, del 1150 a 1350.
En la Edad Media, y hasta finales del siglo XIX, muchos países europeos empleaban como método siderúrgico la farga catalana. Se obtenía hierro y acero bajo en carbono empleando carbón vegetal y el mineral de hierro. Este sistema estaba ya implantado en el siglo XV, y se conseguían alcanzar hasta unos 1200 °C. Este procedimiento fue sustituido por el empleado en los altos hornos.
En un principio se usaba carbón vegetal para la obtención de hierro como fuente de calor y como agente reductor. En el siglo XVIII, en Inglaterra, comenzó a escasear y hacerse más caro el carbón vegetal, y esto hizo que comenzara a utilizarse coque, un combustible fósil, como alternativa. Fue utilizado por primera vez por Abraham Darby, a principios del siglo XVIII, que construyó en Coalbrookdale un alto horno. Asimismo, el coque se empleó como fuente de energía en la Revolución Industrial. En este periodo la demanda de hierro fue cada vez mayor, por ejemplo para su aplicación en ferrocarriles.
El alto horno fue evolucionando a lo largo de los años. Henry Cort, en 1784, aplicó nuevas técnicas que mejoraron la producción. En 1826 el alemán Friedrich Harkot construye un alto horno sin mampostería para humos.
Hacia finales del siglo XVIII y comienzos del XIX se comenzó a emplear ampliamente el hierro como elemento estructural (en puentes, edificios, etcétera). Entre 1776 a 1779 se construye el primer puente de fundición de hierro, construido por John Wilkinson y Abraham Darby. En Inglaterra se emplea por primera vez en la construcción de edificios, por Mathew Boulton y James Watt, a principios del siglo XIX. También son conocidas otras obras de ese siglo, por ejemplo el Palacio de Cristal construido para la Exposición Universal de 1851 en Londres, del arquitecto Joseph Paxton, que tiene un armazón de hierro, o la Torre Eiffel, en París, construida en 1889 para la Exposición Universal, en donde se utilizaron miles de toneladas de hierro.
Abundancia y obtención
El hierro es el metal de transición más abundante en la corteza terrestre, y cuarto de todos los elementos. También abunda en todo en el Universo, habiéndose encontrado meteoritos que lo contienen. Se encuentra formando parte de numerosos minerales, entre los que destacan la hematites (Fe2O3), la magnetita (Fe3O4), la limonita (FeO (OH)), la siderita (FeCO3), la pirita (FeS2), la ilmenita (FeTiO3), etcétera.
Se puede obtener hierro a partir de los óxidos con más o menos impurezas. Muchos de los minerales de hierro son óxidos, y los que no se pueden oxidar para obtener los correspondientes óxidos.
La reducción de los óxidos para obtener hierro se lleva a cabo en un horno denominado comúnmente alto horno (también, horno alto). En él se añaden los minerales de hierro en presencia de coque y carbonato de calcio, CaCO3, que actúa como escorificante.
Los gases sufren una serie de reacciones; el coque puede reaccionar con el oxígeno para formar dióxido de carbono:
- C + O2 → CO2
A su vez el dióxido de carbono puede reducirse para dar monóxido de carbono:
- CO2 + C → 2CO
Aunque también se puede dar el proceso contrario al oxidarse el monóxido con oxígeno para volver a dar dióxido de carbono:
- 2CO + O2 → 2CO2
El proceso de oxidación de coque con oxígeno libera energía y se utiliza para calentar (llegándose hasta unos 1900 °C en la parte inferior del horno).
En primer lugar los óxidos de hierro pueden reducirse, parcial o totalmente, con el monóxido de carbono, CO; por ejemplo:
- Fe3O4 + CO → 3FeO + CO2
- FeO + CO → Fe + CO2
Después, conforme se baja en el horno y la temperatura aumenta, reaccionan con el coque (carbono en su mayor parte), reduciéndose los óxidos. Por ejemplo:
- Fe3O4 + C → 3FeO + CO
El carbonato de calcio (caliza) se descompone:
- CaCO3 → CaO + CO2
Y el dióxido de carbono es reducido con el coque a monóxido de carbono como se ha visto antes.
Más abajo se producen procesos de carburación:
- 3Fe + 2CO → Fe3C + CO2
Finalmente se produce la combustión y desulfuración (eliminación de azufre) mediante la entrada de aire. Y por último se separan dos fracciones: la escoria y el arrabio: hierro fundido, que es la materia prima que luego se emplea en la industria.
El arrabio suele contener bastantes impurezas no deseables, y es necesario someterlo a un proceso de afino en hornos llamados convertidores.
En 2000 los cinco mayores productores de hierro eran China, Brasil, Australia, Rusia e India, con el 70% de la producción mundial.
Compuestos
- Los estados de oxidación más comunes son +2 y +3. Los óxidos de hierro más conocidos son el óxido de hierro (II),FeO, el óxido de hierro (III), Fe2O3, y el óxido mixto Fe3O4.
Forma asimismo numerosas sales y complejos en estos estados de oxidación. El hexacianoferrato (II) de hierro (III), usado en pinturas, se ha denominado azul de Prusia o azul de Turnbull; se pensaba que eran sustancias diferentes.
- Se conocen compuestos en el estado de oxidación +4, +5 y +6, pero son poco comunes, y en el caso del +5, no está bien caracterizado. El ferrato de potasio, K2FeO4, en el que el hierro está en estado de oxidación +6, se emplea como oxidante. El estado de oxidación +4 se encuentra en unos pocos compuestos y también en algunos procesos enzimáticos.
- El Fe3C se conoce como cementita, que contiene un 6,67 % en carbono, al hierro α se le conoce como ferrita, y a la mezcla de ferrita y cementita, perlita o ledeburita dependiendo del contenido en carbono. La austenita es una solución sólida intersticial de carbono en hierro γ (Gamma).
Metabolismo del hierro
Aunque solo existe en pequeñas cantidades en los seres vivos, el hierro ha asumido un papel vital en el crecimiento y en la supervivencia de los mismos y es necesario no solo para lograr una adecuada oxigenación tisular sino también para el metabolismo de la mayor parte de las células.
En la actualidad con un incremento en el oxígeno atmosférico el hierro se encuentra en el medio ambiente casi exclusivamente en forma oxidada (ó ferrica Fe3+) y en esta forma es poco utilizable.
En los adultos sanos el hierro corporal total es de 3 a 4 gramos ó 35 mg/kg en las mujeres a 50 mg/kg en los hombres. Se encuentra distribuido en dos formas:
70% como hierro funcional (2,8g):
- Eritrocitos (65%).
- Tisular: mioglobinas (4%).
- Enzimas dependientes del hierro (hem y no hem): 1%
Estas son enzimas esenciales para la función de las mitocondrias y que controlan la oxidación intracelular (citocromos, oxidasas del citrocromo, catalasas, peroxidasas).
Transferrina (0,1%), la cual se encuentra normalmente saturada en 1/3 con hierro.
La mayor atención con relación a este tipo de hierro se ha enfocado hacia el eritrón, ya que su estatus de hierro puede ser fácilmente medible y constituye la principal fracción del hierro corporal.
30% como hierro de depósito (1 g):
- Ferritina (2/3).
- Hemosiderina (1/3).
- Hemoglobina: Transporta el oxígeno a las células.
- Transferrina: Transporta el hierro a través del plasma.
- Ferritina: Principal forma de depósito del hierro en los tejidos.
Estudios recientes de disponibilidad del hierro de los alimentos han demostrado que el hierro del hem es bien absorbido, pero el hierro no hem se absorbe en general muy pobremente y este último, es el hierro que predomina en la dieta de gran cantidad de gente en el mundo.[cita requerida]
Hem: Como hemoglobina y mioglobina, presente principalmente en la carne y derivados. No hem.
La absorción del hierro hem no es afectada por ningún factor; ni dietético, ni de secreción gastrointestinal. Se absorbe tal cual dentro del anillo porfirínico. El hierro es liberado dentro de las células de la mucosa por la HEM oxigenasa, enzima que abunda en las células intestinales del duodeno.
Las absorción del hierro no hem, por el contrario se encuentra afectada por una gran contidad de factores dietéticos y de secreción gastrointestinal que se analizarán posteriormente.
El hierro procedente de la dieta, especialmente el no hem, es hierro férrico y debe ser convertido en hierro ferroso a nivel gástrico antes que ocurra su absorción en esta forma (hierro ferroso) a nivel duodenal principalmente.
Otros factores, independientes de la dieta que pueden influir en la absorción del hierro son:
- El tamaño del depósito de hierro que indica el estado de reserva de hierro de un individuo. Este es el principal mecanismo de control. Se encuentra influenciado por los depósitos de hierro y por lo tanto, por las necesidades corporales. Así, reservas aumentadas de hierro disminuyen su absorción. En este punto el factor más importante que influye en la absorción del hierro es el contenido de hierro en las células de la mucosa intestinal (ferritina local). Es el llamado “Bloqueo mucoso de Granick”.
- La eritropoyesis en la médula ósea: que es un estado dinámico de consumo o no de hierro corporal. Así, decae la absorción del hierro cuando disminuye la eritropoyesis.
La absorción del hierro en forma ferrosa tiene lugar en el duodeno y en el yeyuno superior, y requiere de un mecanismo activo que necesita energía. El hierro se une a glucoproteínas de superficie (o receptores específicos de la mucosa intestinal para el hierro), situadas en el borde en cepillo de las células intestinales. Luego se dirige al reticulo endoplasmático rugoso y a los ribosomas libres (donde forma ferritina) y posteriormente a los vasos de la lámina propia.
Como puede deducirse, la absorción del hierro es regulada por la mucosa intestinal, lo que impide que reservas excesivas de hierro se acumulen. La absorción del hierro depende también de la cantidad de esta proteína.
El hierro se encuentra en prácticamente todos los seres vivos y cumple numerosas y variadas funciones.
- Hay distintas proteínas que contienen el grupo hemo, que consiste en el ligando porfirina con un átomo de hierro. Algunos ejemplos:
- La hemoglobina y la mioglobina; la primera transporta oxígeno, O2, y la segunda, lo almacena.
- Los citocromos; los citocromos c catalizan la reducción de oxígeno a agua. Los citocromos P450 catalizan la oxidación de compuestos hidrofóbicos, como fármacos o drogas, para que puedan ser excretados, y participan en la síntesis de distintas moléculas.
- Las peroxidasas y catalasas catalizan la oxidación de peróxidos, H2O2, que son tóxicos.
- Las proteínas de hierro/azufre (Fe/S) participan en procesos de transferencia de electrones.
- También se puede encontrar proteínas en donde átomos de hierro se enlazan entre sí a través de enlaces puente de oxígeno. Se denominan proteínas Fe-O-Fe. Algunos ejemplos:
- Las bacterias metanotróficas, que emplean el metano, CH4, como fuente de energía y de carbono, usan proteínas de este tipo, llamadas monooxigenasas, para catalizar la oxidación de este metano.
- La hemeritrina transporta oxígeno en algunos organismos marinos.
- Algunas ribonucleótido reductasas contienen hierro. Catalizan la formación de desoxinucleótidos.
Los animales para transportar el hierro dentro del cuerpo emplean unas proteínas llamadas transferrinas. Para almacenarlo, emplean la ferritina y la hemosiderina. El hierro entra en el organismo al ser absorbido en el intestino delgado y es transportado o almacenado por esas proteínas. La mayor parte del hierro se reutiliza y muy poco se excreta.
Tanto el exceso como el defecto de hierro, pueden provocar problemas en el organismo. El envenamiento por hierro ocurre debido a la ingesta exagerada de esté (como suplemento en el tratamiento de anemias).
La hemocromatosis corresponde a una enfermedad de origen genético, en la cual ocurre una excesiva absorción del hierro, el cual se deposita en el hígado, causando disfunción de éste y eventualmente llegando a la cirrosis hepática. En las transfusiones de sangre, se emplean ligandos que forman con el hierro complejos de una alta estabilidad para evitar que quede demasiado hierro libre.
Estos ligandos se conocen como sideróforos. Muchos microorganismos emplean estos sideróforos para captar el hierro que necesitan. También se pueden emplear como antibióticos, pues no dejan hierro libre disponible.
Isótopos
El hierro tiene cuatro isótopos estables naturales: 54Fe, 56Fe, 57Fe y 58Fe. Las abundancias relativas en las que se encuentran en la naturaleza son de aproximadamente: 54Fe (5,8%), 56Fe (91,7%), 57Fe (2,2%) y 58Fe (0,3%).
Precauciones
El hierro en exceso es tóxico. El hierro reacciona con peróxido y produce radicales libres; la reacción más importante es:
- Fe2+ + H2O2 → Fe3+ + OH- + OH•
Cuando el hierro se encuentra dentro de unos niveles normales, los mecanismos antioxidantes del organismo pueden controlar este proceso.
La dosis letal de hierro en un niño de 2 años es de unos 3 g. 1 g puede provocar un envenenamiento importante. El hierro en exceso se acumula en el hígado y provoca daños en este órgano.
Véase también
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Hierro.
Wikimedia Commons alberga una galería multimedia sobre Hierro.- Precios históricos del mineral de hierro, de acuerdo al FMI
- El hierro en aguas
- Alto horno
- WebElements.com - Iron
- EnvironmentalChemistry.com - Iron
- It's Elemental - Iron
- Los Alamos National Laboratory - Iron
- Minería e industria del hierro en Asturias y otros lugares de España
- La farga catalana (en catalán)