Descubrimiento del neutrón

El descubrimiento del neutrón y de sus propiedades fue fundamental para comprender el extraordinario desarrollo de la física atómica en la primera mitad del siglo XX. Ernest Rutherford ideó a principios del siglo XX un modelo rudimentario del átomo,[1]: 188 [2] basado en el experimento de la lámina de oro bombardeada con partículas alfa, realizado por sus colaboradores Hans Geiger y Ernest Marsden. En este modelo, los átomos tenían su masa y su carga eléctrica positiva concentrados en un núcleo muy pequeño.[3] En 1920, se descubrieron los primeros isótopos de algunos elementos químicos, se determinó que las masas atómicas eran (aproximadamente) múltiplos enteros de la masa del átomo de hidrógeno,[4] y se identificaron los números atómicos con la carga presente en el núcleo de cada elemento.[5]: §1.1.2 En la década de 1920, se consideraba que el núcleo estaba compuesto por combinaciones de protones y de electrones, las dos partículas elementales conocidas en ese momento, aunque este modelo presentaba varias contradicciones experimentales y teóricas.[1]: 298
La naturaleza esencial del núcleo atómico quedó establecida con el descubrimiento del neutrón por James Chadwick en 1932[6] y la determinación de que se trataba de una nueva partícula elemental, distinta del protón.[7][8]: 55
El neutrón, una partícula sin carga eléctrica, fue inmediatamente explotado como un nuevo medio para sondear la estructura nuclear, lo que llevó a descubrimientos tales como la creación de nuevos elementos radiactivos mediante irradiación de neutrones (1934) y la fisión de átomos de uranio cuando captaban neutrones (1938).[9] El descubrimiento de la fisión condujo a la creación tanto de la energía nuclear como de las armas nucleares al final de la Segunda Guerra Mundial. Se supuso que tanto el protón como el neutrón eran partículas elementales hasta la década de 1960, cuando se determinó que eran partículas compuestas construidas a partir de cuarks.[10]
Descubrimiento de la radiactividad
[editar]A principios del siglo XX, el intenso debate sobre la existencia de los átomos aún no se había resuelto. Filósofos como Ernst Mach y Wilhelm Ostwald negaron que los átomos fueran reales, considerándolos una construcción matemática conveniente, mientras que científicos como Arnold Sommerfeld y Ludwig Boltzmann vieron que las teorías físicas requerían la existencia de átomos.[9]: 13–14
La radiactividad fue descubierta en 1896 por el científico francés Henri Becquerel, mientras trabajaba con materiales fosforescentes. En 1898, Ernest Rutherford desde los Laboratorios Cavendish distinguió dos tipos de radiactividad, las partículas alfa y las partículas beta, que diferían en su capacidad para penetrar o atravesar objetos o gases ordinarios. Dos años más tarde, Paul Ulrich Villard descubrió los rayos gamma, que poseían un poder de penetración aún mayor.[1]: 8–9 Estas radiaciones pronto fueron identificadas con partículas conocidas: Walter Kaufmann demostró que los rayos beta eran electrones en 1902; Rutherford y Thomas Royds demostraron en 1907 que los rayos alfa eran iones de helio; y Rutherford y Edward Andrade demostraron en 1914 que los rayos gamma eran radiación electromagnética, es decir, una forma de luz.[1]: 61–62, 87 También se había identificado que estas radiaciones emanaban de los átomos, y por lo tanto, proporcionaron pistas sobre los procesos que ocurren en su interior. Por el contrario, las radiaciones también fueron reconocidas como herramientas que podrían utilizarse en experimentos de dispersión para sondear el interior de los átomos.[11]: 112–115
El experimento de la lámina de oro y el descubrimiento del núcleo atómico
[editar]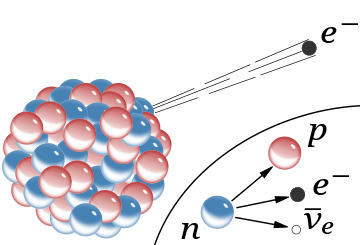
El detalle insertado muestra la desintegración beta de un neutrón libre tal como se entiende hoy: en este proceso se crean un protón, un electrón y un antineutrino
En la Universidad de Mánchester, Rutherford dirigió a Hans Geiger y a Ernest Marsden entre 1908 y 1913 en una serie de experimentos para determinar qué sucede cuando las partículas alfa se dispersan a través de una lámina de metal. Ahora llamado experimento de la lámina de oro de Rutherford, o experimento Geiger-Marsden, estas mediciones hicieron el extraordinario descubrimiento de que, aunque la mayoría de las partículas alfa que pasaban a través de una fina lámina de oro experimentaron poca desviación, unas pocas se dispersaron con ángulos elevados. La dispersión indicaba que algunas de las partículas alfa rebotaron en un componente pequeño, pero denso, situado dentro de los átomos. Basándose en estas mediciones, Rutherford se dio cuenta en 1911 de que el átomo consistía en un núcleo pequeño y masivo con carga positiva, rodeado por una nube mucho más grande de electrones con carga negativa. Se necesitaba la masa atómica concentrada para proporcionar la desviación observada de las partículas alfa, y Rutherford desarrolló un modelo matemático que tenía en cuenta la dispersión observada.[2]
El modelo de Rutherford fue muy influyente, motivó el modelo atómico de Bohr para los electrones que orbitaban alrededor del núcleo en 1913[12] y finalmente condujo a la mecánica cuántica a mediados de la década de 1920.
Descubrimiento de isótopos
[editar]Simultáneamente con el trabajo de Rutherford, Geiger y Marsden, el radioquímico Frederick Soddy estaba estudiando en la Universidad de Glasgow problemas relacionados con la química en materiales radiactivos, y ya había trabajado con Rutherford sobre la radioactividad en la Universidad McGill.[13] En 1910, entre el uranio y el plomo se habían identificado unos 40 elementos radiactivos diferentes, denominados radioelementos, aunque la tabla periódica solo permitía 11 elementos. Soddy y Kasimir Fajans descubrieron de forma independiente en 1913 que un elemento en desintegración alfa produciría un elemento dos lugares a la izquierda en el sistema periódico y un elemento en desintegración beta produciría un elemento un lugar a la derecha en el sistema periódico. Además, aquellos radioelementos que residen en los mismos lugares del sistema periódico son químicamente idénticos. Soddy llamó a estos elementos químicamente idénticos isótopos.[14]: 3–5 [15] Por su estudio de la radiactividad y el descubrimiento de los isótopos, Soddy recibió el Premio Nobel de Química en 1921.[16]

A partir del trabajo de Joseph John Thomson sobre la desviación de átomos cargados positivamente por campos eléctricos y magnéticos, Francis Aston construyó el primer espectrómetro de masas en el Laboratorio Cavendish en 1919, con el que pudo separar los dos isótopos del neón, el 20Ne y el 22Ne. Aston estableció la regla de los números enteros, es decir, que las masas de todas las partículas tienen relaciones de números enteros con respecto al oxígeno-16,[17] que consideró que tenía una masa de exactamente 16.[4] (hoy en día, el número entero de la regla de Aston se expresa en múltiplos de unidad de masa atómica (uma) en relación con el carbono-12).[18] Significativamente, la única excepción a esta regla fue el propio hidrógeno, que tenía un valor de masa de 1,008. El exceso de masa era pequeño, pero estaba muy por fuera de los límites de la incertidumbre experimental.
Dado que la equivalencia entre masa y energía de Einstein se conocía desde 1905, Aston y otros rápidamente se dieron cuenta de que la discrepancia de masa se debe a la energía de enlace de los átomos. Cuando el contenido de varios átomos de hidrógeno está unido en un solo átomo, la energía del átomo debe ser menor que la suma de las energías de los átomos de hidrógeno separados y, por lo tanto, la masa del átomo es menor que la suma de las masas de los átomos de hidrógeno. El trabajo de Aston[4] sobre los isótopos le valió el Premio Nobel de Química de 1922, por el descubrimiento de isótopos en una gran cantidad de elementos no radiactivos y por su enunciación de la regla de los números enteros.[19] Tomando nota del reciente descubrimiento de Aston de la energía de unión nuclear, Arthur Stanley Eddington sugirió en 1920 que las estrellas pueden obtener su energía fusionando hidrógeno (protones) en helio, y que los elementos más pesados pueden formarse en las estrellas.[20]
Número atómico y ley de Moseley
[editar]Rutherford y otros habían notado la disparidad entre la masa de un átomo, calculada en unidades de masa atómica, y la carga aproximada requerida en el núcleo para que funcionara el modelo de Rutherford. La carga requerida del núcleo atómico solía ser aproximadamente la mitad de su masa atómica.[21]: 82 Antonius van den Broek planteó audazmente la hipótesis de que la carga requerida, denotada por Z, no era la mitad del peso atómico de los elementos, sino que era exactamente igual a la posición ordinal del elemento en la tabla periódica de los elementos.[1]: 228 En aquel momento, no se sabía que las posiciones de los elementos en la tabla periódica tuvieran ningún significado físico. Sin embargo, si los elementos se ordenaban en función de una masa atómica creciente, se mostraba periodicidad en sus propiedades químicas, aunque había excepciones a esta periodicidad, como el cobalto y el níquel.[22][23]: 180
En 1913, Henry Moseley discutió el nuevo modelo atómico de Bohr con el propio Niels Bohr, que estaba de visita en la Universidad de Mánchester.[21] El modelo tenía en cuenta el espectro de emisión electromagnética del átomo de hidrógeno, y Moseley y Bohr se preguntaron si los espectros de emisión electromagnética de elementos más pesados como el cobalto y el níquel seguirían su ordenamiento por peso o por su posición en la tabla periódica.[24]: 346 En 1913-1914 Moseley analizó la cuestión experimentalmente, utilizando técnicas de difracción de rayos X. Descubrió que la línea de longitud de onda corta más intensa en el espectro de rayos X de un elemento particular, conocida como línea K-alfa, estaba relacionada con la posición del elemento en la tabla periódica, es decir, su número atómico Z. De hecho, Moseley introdujo esta nomenclatura,[5]: §1.1.2 y descubrió que las frecuencias de la radiación estaban relacionadas de forma sencilla con el número atómico de los elementos para un gran número de ellos.[25][5]: 5 [23]: 181
Al cabo de un año se observó que la ecuación de la relación, ahora denominada ley de Moseley, podía explicarse en términos del modelo de Bohr de 1913, con suposiciones adicionales razonables sobre la estructura atómica de otros elementos.[26]: 87 El resultado de Moseley, según la explicación posterior de Bohr, no solo estableció el número atómico como una cantidad experimental mensurable, sino que también le dio un significado físico como carga positiva en el núcleo atómico. Los elementos podrían ordenarse en la tabla periódica de los elementos por su número atómico, en lugar de por su peso atómico.[27]: 127 El resultado unió la organización de la tabla periódica, el modelo de Bohr para el átomo,[28]: 56 y el modelo de Rutherford para la dispersión alfa de los núcleos. Rutherford, Bohr y otros lo citaron como un avance crítico en la comprensión de la naturaleza del núcleo atómico.[29]
El estallido de la Primera Guerra Mundial interrumpió la investigación en física atómica. Moseley murió en 1915 en la batalla de Galípoli,[30][23]: 182 mientras que el estudiante de Rutherford, James Chadwick, estuvo internado en Alemania durante la guerra (de 1914 a 1918).[31] En Berlín también se interrumpieron los trabajos de investigación de Lise Meitner y de Otto Hahn sobre la determinación de las cadenas de desintegración radiactiva del radio y del uranio mediante una separación química precisa.[9]: §4 Meitner pasó gran parte de la guerra trabajando como radióloga y técnico médico en rayos X cerca del frente austríaco, mientras que Hahn, un químico, trabajó en la investigación sobre gases tóxicos para su uso bélico.[9]: 61–62, 68
Átomo de Rutherford
[editar]
En 1920, Rutherford pronunció la Lectura Bakeriana en la Royal Society titulada "Constitución nuclear de los átomos", un resumen de los experimentos recientes sobre núcleos atómicos y sobre las conclusiones acerca de la estructura de los núcleos atómicos.[32][8]: 23 [5]: 5 En 1920 se suponía ampliamente la existencia de electrones dentro del núcleo atómico. Se pensaba que el núcleo de los distintos elementos estaba formado por núcleos de hidrógeno en número igual a la masa atómica. Pero como cada núcleo de hidrógeno tenía carga +1, el núcleo necesitaba un número menor de "electrones internos", cada uno de carga -1, para darle al núcleo su carga total correcta. La masa de los protones es aproximadamente 1800 veces mayor que la de los electrones, por lo que la masa de los electrones es incidental en este cálculo.[1]: 230–231 Tal modelo era consistente con la dispersión de partículas alfa de núcleos pesados, así como con la carga y la masa de los numerosos isótopos que se habían identificado. Había otras motivaciones para el modelo protón-electrón. Como señaló Rutherford en ese momento, "Tenemos fuertes razones para creer que los núcleos de los átomos contienen electrones así como cuerpos cargados positivamente...",[32]: 376–377 es decir, se sabía que la radiación beta eran electrones emitidos desde el núcleo.[8]: 21 [5]: 5–6
En esa conferencia, Rutherford conjeturó la existencia de nuevas partículas. Se sabía que la partícula alfa era muy estable y se suponía que conservaba su identidad dentro del núcleo. Se suponía que la partícula alfa constaba de cuatro protones y dos electrones estrechamente unidos para darle carga +2 y masa 4. En un artículo de 1919,[33] Rutherford había informado del aparente descubrimiento de una nueva partícula doblemente cargada de masa 3, denotada como X++, interpretada como compuesta por tres protones y un electrón estrechamente unido. Este resultado sugirió a Rutherford la probable existencia de dos nuevas partículas: una de dos protones con un electrón estrechamente unido y otra de un protón y un electrón estrechamente unidos. Más tarde se determinó que la partícula X++ tenía masa 4 y que era simplemente una partícula alfa de baja energía.[8]: 25 Sin embargo, Rutherford había conjeturado la existencia del deuterón, una partícula con carga +1 de masa 2, y del neutrón, una partícula neutra de masa 1.[32]: 396 El primero es el núcleo del deuterio, descubierto en 1931 por Harold Clayton Urey.[34] La masa de la hipotética partícula neutra sería poco diferente de la del protón. Rutherford determinó que una partícula de carga cero sería difícil de detectar con las técnicas disponibles.[32]: 396
En la época de la conferencia de Rutherford, aparecieron otras publicaciones con sugerencias similares de un compuesto protón-electrón en el núcleo, y en 1921 William Harkins, un químico estadounidense, llamó neutrón a la partícula sin carga.[35][36][37][5]: 6 Por esa misma época se adoptó la palabra protón para referirse al núcleo de hidrógeno.[38] El término neutrón aparentemente se construyó a partir de la raíz latina para neutral y la terminación griega -on (por imitación de los términos electrón y protón).[39][40] Sin embargo, se pueden encontrar desde 1899 referencias a la palabra neutrón en relación con el átomo.[1]: 398 [35]
Rutherford y Chadwick comenzaron inmediatamente un programa experimental en los Laboratorios Cavendish en Cambridge para buscar el neutrón.[8]: 27 [1]: 398 Los experimentos continuaron durante la década de 1920 sin éxito.[6]
La conjetura de Rutherford y el hipotético neutrón no fueron ampliamente aceptados. En su monografía de 1931 sobre la "Constitución de los núcleos atómicos y la radiactividad", Gueorgui Gámov, entonces en el Instituto de Física Teórica de Copenhague, no mencionó el neutrón.[41] En el momento de sus mediciones en París en 1932 que finalmente conducirían al descubrimiento del neutrón, Irène Joliot-Curie y Frédéric Joliot-Curie desconocían la conjetura.[42]
Problemas de la hipótesis de los electrones nucleares
[editar]En la década de 1920, los físicos asumieron que el núcleo atómico estaba compuesto de protones y de "electrones nucleares".[8]: 29–32 [43] Bajo esta hipótesis, el núcleo de nitrógeno-14 (14N) estaría compuesto por 14 protones y 7 electrones, de modo que tendría una carga neta de +7 unidades carga eléctrica y una masa de 14 unidades de masa atómica. Este núcleo también estaría orbitado por otros 7 electrones, denominados "electrones externos" por Rutherford,[32]: 375 para completar el átomo del 14N. Sin embargo, pronto se hicieron evidentes los problemas de esta hipótesis.
Ralph Kronig señaló en 1926 que la transición hiperfina observada de los espectros atómicos era inconsistente con la hipótesis protón-electrón. Esta estructura es causada por la influencia del núcleo en la dinámica de los electrones en órbita. Los momentos magnéticos de los supuestos "electrones nucleares" deberían producir divisiones de líneas espectrales hiperfinas similares a las del efecto Zeeman, pero no se observaron tales efectos.[44]: 199 Parecía que el momento magnético del electrón desaparecía cuando estaba dentro del núcleo.[1]: 299
Durante una visita a la Universidad de Utrecht en 1928, Kronig se enteró de un aspecto sorprendente del espectro rotacional del N2+. Las mediciones de precisión realizadas por Leonard Ornstein, director del Laboratorio de Física de Utrecht, demostraron que el espín del núcleo de nitrógeno debe ser igual a uno. Sin embargo, si el núcleo de nitrógeno-14 (14N) estuviera compuesto por 14 protones y 7 electrones, un número impar de partículas de espín 1/2, entonces el espín nuclear resultante debería ser medio entero. Por lo tanto, Kronig sugirió que tal vez "los protones y los electrones no conservan su identidad en la misma medida que lo hacen fuera del núcleo".[1]: 299–301 [45]: 117
Las observaciones de los niveles de energía rotacional de moléculas diatómicas utilizando espectroscopia Raman por Franco Rasetti en 1929 fueron inconsistentes con las valores estadísticos esperables de la hipótesis protón-electrón. Rasetti obtuvo espectros de bandas para las moléculas de H2 y N2. Si bien las líneas de ambas moléculas diatómicas mostraron alternancia en intensidad entre luz y oscuridad, el patrón de alternancia del H2 era opuesto al del N2. Después de analizar cuidadosamente estos resultados experimentales, los físicos alemanes Walter Heitler y Gerhard Herzberg demostraron que los núcleos de hidrógeno obedecen a la estadística de Fermi y los núcleos de nitrógeno obedecen a la estadística de Bose. Sin embargo, un resultado inédito de Eugene Paul Wigner mostró que un sistema compuesto con un número impar de partículas de espín 1/2 debe obedecer a las estadísticas de Fermi; mientras que un sistema con un número par de partículas de espín 1/2 obedece a las estadísticas de Bose. Si el núcleo de nitrógeno tuviera 21 partículas, debería obedecer a las estadísticas de Fermi, contrariamente a la realidad. Así, Heitler y Herzberg concluyeron: "el electrón en el núcleo... pierde su capacidad de determinar las estadísticas del núcleo".[45]: 117–118
La paradoja de Klein,[46] descubierta por Oskar Klein en 1928, presentó más objeciones de la mecánica cuántica a la noción de electrones confinados dentro del núcleo. Derivada de la ecuación de Dirac, esta paradoja clara y precisa sugirió que un electrón que se acerca a una barrera de alto potencial tiene una alta probabilidad de atravesar la barrera[41] mediante un proceso de creación de pares. Aparentemente, ningún pozo de potencial podía confinar un electrón dentro de un núcleo. El significado de esta paradoja fue intensamente debatido en su momento.[44]: 199–200
Alrededor de 1930 se reconocía en general que era difícil conciliar el modelo protón-electrón para los núcleos con la relación de indeterminación de Heisenberg de la mecánica cuántica.[44]: 199 [1]: 299 Esta relación, Δx⋅Δp ≥ 1⁄2ħ, implica que un electrón confinado en una región del tamaño de un núcleo atómico normalmente tiene una energía cinética de aproximadamente 40 MeV,[1]): 299 [48] que es mayor que la energía observada de las partículas beta emitidas desde el núcleo.[1] Esta energía también es mucho mayor que la energía de enlace de los nucleones,[47]: 89 que Aston y otros habían demostrado que era inferior a 9 MeV por nucleón.[49]: 511
En 1927, Charles Ellis y W. Wooster midieron en el Laboratorio Cavendish las energías de los electrones en desintegración ß. Descubrieron que la distribución de energías de cualquier núcleo radiactivo en particular era amplia y continua, un resultado que contrastaba notablemente con los distintos valores de energía observados en la desintegración alfa y gamma. Además, la distribución continua de energía parecía indicar que este proceso de "electrones nucleares" no conservaba la energía. De hecho, en 1929 Bohr propuso modificar la ley de conservación de la energía para tener en cuenta la distribución continua de la energía. La propuesta obtuvo el apoyo de Werner Heisenberg. Tales consideraciones eran aparentemente razonables, en la medida en que las leyes de la mecánica cuántica habían anulado recientemente las leyes de la mecánica clásica.
Si bien todas estas consideraciones no "probaban" que un electrón no pudiera existir en el núcleo, eran confusas y difíciles de interpretar para los físicos. Se inventaron muchas teorías para explicar por qué los argumentos anteriores podían estar equivocados.[50]: 4–5 En su monografía de 1931, Gamow resumió todas estas contradicciones, marcando las afirmaciones relativas a los electrones en el núcleo con símbolos de advertencia.[43]: 23
Descubrimiento del neutrón
[editar]En 1930, Walther Bothe y su colaborador Herbert Becker, descubrieron en Gießen (Alemania), que si las partículas alfa energéticas emitidas por el polonio caían sobre ciertos elementos ligeros, específicamente berilio (9
4Be), boro (11
5B) o litio (7
3Li), se emitía una radiación inusualmente penetrante.[51] El berilio produjo la radiación más intensa. El polonio es altamente radiactivo, produce radiación alfa energética y se usaba comúnmente para experimentos de dispersión en ese momento.[41]: 99–110 La radiación alfa puede verse influida por un campo eléctrico, porque está compuesta de partículas cargadas. Sin embargo, la radiación penetrante observada no se vio influida por ningún campo eléctrico, por lo que se pensó que eran rayos gamma. La radiación era más penetrante que cualquier rayo gamma conocido, y los detalles de los resultados experimentales eran difíciles de interpretar.[52][53][41]

Dos años más tarde, Irène Joliot-Curie y Frédéric Joliot-Curie en París demostraron que si esta radiación desconocida incidía sobre parafina o cualquier otro compuesto que contenía hidrógeno, expulsaba protones de muy alta energía (5 MeV).[54] Esta observación no era en sí misma inconsistente con la supuesta naturaleza de rayos gamma de la nueva radiación, pero esa interpretación (según la dispersión Compton) tenía un problema lógico. Por consideraciones de energía y momento, un rayo gamma tendría que tener una energía increíblemente alta (50 MeV) para dispersar un protón masivo.[5]: §1.3.1 En Roma, el joven físico Ettore Majorana declaró que la manera en que la nueva radiación interactuaba con los protones requerían una partícula neutra tan pesada como un protón, pero se negó a publicar su resultado a pesar del apoyo de Enrico Fermi.[55]
Al enterarse de los resultados de París, Rutherford y James Chadwick del Laboratorio Cavendish tampoco creyeron en la hipótesis de los rayos gamma, ya que no se verificaba la conservación de la energía.[56] Con la ayuda de Norman Feather,[57] Chadwick realizó rápidamente una serie de experimentos que demostraron que la hipótesis de los rayos gamma era insostenible. El año anterior, Chadwick, J.E.R. Constable y E.C. Pollard ya habían realizado experimentos sobre la desintegración de elementos ligeros utilizando radiación alfa del polonio.[58] También habían desarrollado métodos más precisos y eficientes para detectar, contar y registrar los protones expulsados. Chadwick repitió la creación de la radiación utilizando berilio para absorber las partículas alfa: 9Be + 4He (α) → 12C + 1n. Después del experimento de París, apuntó la radiación a la cera de parafina, un hidrocarburo con alto contenido de hidrógeno, ofreciendo así un objetivo denso en protones. Como en el experimento de París, la radiación dispersó energéticamente algunos de los protones. Chadwick midió el alcance de estos protones y también midió cómo la nueva radiación impactaba los átomos de varios gases.[59] Las mediciones de la energía de retroceso mostraron que la masa de las partículas de radiación debe ser similar a la masa del protón: la nueva radiación no podría estar compuesta por rayos gamma. Las partículas sin carga con aproximadamente la misma masa que el protón coincidían con las propiedades descritas por Rutherford en 1920, y que más tarde se denominaron neutrones.[60][6][61][62] Chadwick ganó el Premio Nobel de Física en 1935 por este descubrimiento.[63]
El año 1932 fue posteriormente denominado "annus mirabilis" para la física nuclear en el Laboratorio Cavendish,[59] con los descubrimientos del neutrón, de la desintegración nuclear artificial mediante el acelerador de partículas Cockcroft-Walton y del positrón.
Modelo protón-neutrón del núcleo
[editar]Dados los problemas del modelo protón-electrón,[43][64] rápidamente se aceptó que el núcleo atómico está compuesto de protones y de neutrones, aunque la naturaleza precisa del neutrón inicialmente no estaba clara. Meses después del descubrimiento del neutrón, Werner Heisenberg[65][66][67][62] y Dmitri Ivanenko[68] habían propuesto modelos protón-neutrón para el núcleo.[69] Los artículos emblemáticos de Heisenberg abordaron la descripción de protones y de neutrones en el núcleo a través de la mecánica cuántica. Si bien la teoría de Heisenberg sobre los protones y neutrones en el núcleo fue un "gran paso hacia la comprensión del núcleo como un sistema mecánico cuántico",[70] todavía asumió la presencia de electrones nucleares. En particular, supuso que el neutrón era un compuesto de protón-electrón, para lo cual no existía explicación en la mecánica cuántica. Tampoco tenía ninguna explicación de cómo los electrones ligeros podían unirse al núcleo, e introdujo la primera teoría de las fuerzas de intercambio nuclear que unen a los nucleones. Consideró que los protones y los neutrones eran estados cuánticos diferentes de la misma partícula, es decir, nucleones que se distinguían por el valor de sus números cuánticos nucleares (isospín).
El modelo protón-neutrón explicó el enigma del dinitrógeno. Cuando se propuso que el 14N constara de 3 pares de protones y otros 3 pares de neutrones, con un neutrón y un protón no apareados adicionales, cada uno de los cuales aportaba un giro de 1⁄2 h en la misma dirección para un giro total de 1 h, el modelo se volvió viable.[71][72][73] Pronto, los neutrones se utilizaron para explicar naturalmente las diferencias de espín en muchos nucleidos diferentes de la misma manera.
Si el modelo protón-neutrón para el núcleo resolvió muchas cuestiones, destacó el problema de explicar los orígenes de la radiación beta. Ninguna teoría existente podía explicar cómo los electrones, o positrones,[74] era posible que emanasen del núcleo.[75] En 1934, Enrico Fermi publicó su artículo clásico que describe el proceso de la radiación beta, en el que el neutrón se desintegra en un protón, y "creando" un electrón y un neutrino (aún no descubierto).[76] El artículo empleó la analogía de que los fotones, o radiación electromagnética, son creados y destruidos de manera similar en los procesos atómicos. Ivanenko había sugerido una analogía similar en 1932.[71][77] La teoría de Fermi requiere que el neutrón sea una partícula de espín 1⁄2. La teoría preservaba el principio de conservación de la energía, que había sido cuestionado por la distribución continua de energía de las partículas beta. La teoría básica de la desintegración beta propuesta por Fermi fue la primera en mostrar cómo se podían crear y destruir partículas. Estableció una teoría básica general para la interacción de partículas mediante fuerzas fuertes o débiles.[76] Si bien este influyente artículo ha resistido la prueba del tiempo, las ideas que contenía eran tan nuevas que cuando se envió por primera vez a la revista Nature en 1933, fue rechazado por ser demasiado especulativo.[70]
La naturaleza del neutrón
[editar]
La cuestión de si el neutrón era una partícula compuesta de un protón y un electrón persistió durante algunos años después de su descubrimiento.[78][79] En 1932 Harrie Massey exploró un modelo para un neutrón compuesto para tener en cuenta por ejemplo su gran poder de penetración a través de la materia y su neutralidad eléctrica.[80] La cuestión era un legado de la opinión predominante desde la década de 1920 de que las únicas partículas elementales eran el protón y el electrón.
La naturaleza del neutrón fue un tema principal de discusión en el séptimo Congreso Solvay celebrado en octubre de 1933, al que asistieron Heisenberg, Niels Bohr, Lise Meitner, Ernest Lawrence, Fermi, Chadwick y otros.[70][81] Tal como planteó Chadwick en su Lectura Bakeriana de 1933, la cuestión principal era la masa del neutrón en relación con el protón. Si la masa del neutrón fuera menor que las masas combinadas de un protón y de un electrón (1,0078), entonces el neutrón podría ser un compuesto protón-electrón debido al defecto de masa de la energía de enlace nuclear. Si era mayor que las masas combinadas, entonces el neutrón era una partícula elemental como el protón.[61] La pregunta fue difícil de responder porque la masa del electrón es solo el 0,05% de la del protón, por lo que se requirieron mediciones excepcionalmente precisas.
La dificultad de realizar la medición queda ilustrada por los amplios valores de masa del neutrón obtenidos entre 1932 y 1934. El valor aceptado hoy es de 1,00866. En el artículo de Chadwick de 1932 que informaba sobre el descubrimiento, estimó que la masa del neutrón estaba entre 1,005 y 1,008.[56] Bombardeando boro con partículas alfa, Frédéric e Irène Joliot-Curie obtuvieron un valor elevado de 1,012, mientras que el equipo de Ernest Lawrence de la Universidad de California midió el pequeño valor de 1,0006 utilizando su nuevo ciclotrón.[82]
En 1935, Chadwick y su estudiante de doctorado Maurice Goldhaber resolvieron el problema al informar sobre la primera medición precisa de la masa del neutrón. Utilizaron los rayos gamma de 2,6 MeV del talio-208 (208Tl) (entonces conocido como torio C") para fotodesintegrar el deuterón:[83]
2
1D+ γ → 1
1H+ n
En esta reacción, el protón y el neutrón resultantes tienen aproximadamente la misma energía cinética, ya que sus masas son aproximadamente iguales. Se podía medir la energía cinética del protón resultante (0,24 MeV) y, por tanto, se podía determinar la energía de enlace del deuterón (2,6 MeV - 2(0,24 MeV) = 2,1 MeV, o 0,0023). La masa del neutrón podría entonces determinarse mediante un simple balance de masa:
md + b.e. = mp + mn
donde md,p,n se refiere a la masa del deuterón, protón o neutrón, y "b.e." es la energía de enlace. Se conocían las masas del deuterón y del protón (Chadwick y Goldhaber utilizaron valores de 2,0142 u y 1,0081 u, respectivamente). Descubrieron que la masa del neutrón era ligeramente mayor que la masa del protón 1,0084 o 1,0090, dependiendo del valor preciso utilizado para la masa del deuterón.[7] La masa del neutrón era demasiado grande para ser un compuesto de protón-electrón y, por lo tanto, se identificó al neutrón como una partícula elemental.[56] Chadwick y Goldhaber predijeron que un neutrón libre podría desintegrarse en un protón, un electrón y un neutrino (desintegración beta).
Física de neutrones en la década de 1930
[editar]Poco después del descubrimiento del neutrón, la evidencia indirecta sugirió que tenía un valor inesperado distinto de cero para su momento magnético. Los intentos de medir el momento magnético del neutrón se originaron con el descubrimiento de Otto Stern en 1933 en Hamburgo de que el protón tenía un momento magnético anormalmente grande.[84][85] En 1934, grupos liderados por Stern, entonces ya en Pittsburgh, e Isidor Isaac Rabi en Nueva York habían deducido de forma independiente que el momento magnético del neutrón era negativo e inesperadamente grande midiendo los momentos magnéticos del protón y del deuterio.[79][86][87][88][89] Los valores para el momento magnético del neutrón también fueron determinados por Robert Bacher[90] (1933) en Ann Arbor e Ígor Tam y Semen Altshuler[79][91] (1934) en la Unión Soviética a partir de estudios de la estructura hiperfina de los espectros atómicos. A finales de la década de 1930, el equipo de Rabi había deducido valores precisos para el momento magnético del neutrón utilizando mediciones que empleaban técnicas de resonancia magnética nuclear recientemente desarrolladas.[89] El gran valor del momento magnético del protón y el valor negativo inferido del momento magnético del neutrón fueron inesperados y plantearon muchas preguntas.[79]

El descubrimiento del neutrón proporcionó inmediatamente a los científicos una nueva herramienta para investigar las propiedades de los núcleos atómicos. Las partículas alfa se habían utilizado durante décadas anteriores en experimentos de dispersión, pero dichas partículas, que son núcleos de helio, tienen carga +2. Esta carga dificulta que las partículas alfa superen la fuerza repulsiva de Coulomb e interactúen directamente con los núcleos de los átomos. Como los neutrones no tienen carga eléctrica, no necesitan superar esta fuerza para interactuar con los núcleos. Casi coincidiendo con su descubrimiento, Norman Feather, colega y protegido de Chadwick, utilizó neutrones en experimentos de dispersión con nitrógeno.[92] Feather pudo demostrar que los neutrones que interactuaban con los núcleos de nitrógeno se dispersaban en protones o inducían la desintegración del nitrógeno para formar boro con la emisión de una partícula alfa. Por tanto, Feather fue el primero en demostrar que los neutrones producen desintegraciones nucleares.
En Roma, Enrico Fermi y su equipo bombardearon elementos más pesados con neutrones y descubrieron que los productos eran radiactivos. En 1934 habían utilizado neutrones para inducir radiactividad en 22 elementos diferentes, muchos de estos elementos de alto número atómico. Al darse cuenta de que otros experimentos con neutrones en su laboratorio parecían funcionar mejor en una mesa de madera que en una de mármol, Fermi sospechó que los protones de la madera estaban frenando los neutrones y aumentando así las posibilidades de que el neutrón interactuara con los núcleos. Por lo tanto, hizo pasar los neutrones a través de cera de parafina para ralentizarlos, y descubrió que la radiactividad de algunos elementos bombardeados aumentaba en un factor de decenas a cientos.[93] La sección eficaz para la interacción con núcleos es mucho mayor para los neutrones lentos que para los neutrones rápidos. En 1938, Fermi recibió el Premio Nobel de Física "por sus demostraciones de la existencia de nuevos elementos radiactivos producidos por irradiación de neutrones y por su descubrimiento relacionado de los procesos nucleares provocados por neutrones lentos".[94][95]


En Berlín, la colaboración de Lise Meitner y de Otto Hahn, junto con su asistente Fritz Strassmann, impulsó la investigación iniciada por Fermi y su equipo cuando bombardearon uranio con neutrones. Entre 1934 y 1938, Hahn, Meitner y Strassmann encontraron una gran cantidad de productos de transmutación radiactiva a partir de estos experimentos, todos los cuales consideraron como transuránicos.[96] Los nucleidos transuránicos son aquellos que tienen un número atómico mayor que el uranio (92), y están formados por absorción de neutrones. Estos nucleidos no se producen de forma natural. En julio de 1938, Meitner se vio obligada a escapar de la persecución antisemita de la Alemania nazi después del Anschluss (la anexión de Austria por parte de Alemania), y pudo conseguir un nuevo puesto en Suecia. El experimento decisivo del 16 al 17 de diciembre de 1938 (utilizando un proceso químico llamado "fraccionamiento radio-bario-mesotorio") produjo resultados desconcertantes: lo que habían entendido que eran tres isótopos de radio se comportaban consistentemente como bario.[9] El radio (número atómico 88) y el bario (número atómico 56) están en el mismo grupo químico. En enero de 1939, Hahn había llegado a la conclusión de que lo que habían pensado que eran nucleidos transuránicos eran, en cambio, nucleidos mucho más ligeros, como el bario, lantano, cerio y elementos platinoides ligeros. Meitner y su sobrino Otto Robert Frisch interpretaron inmediata y correctamente estas observaciones como resultado de la fisión nuclear, un término acuñado por Frisch.[97]
Hahn y sus colaboradores habían detectado la división de los núcleos de uranio, inestables por la absorción de neutrones, en elementos más ligeros. Meitner y Frisch también demostraron que la fisión de cada átomo de uranio liberaría unos 200 MeV de energía. El descubrimiento de la fisión electrizó a la comunidad global de físicos atómicos y al público en general.[9] En su segunda publicación sobre la fisión nuclear, Hahn y Strassmann predijeron la existencia y liberación de neutrones adicionales durante el proceso de fisión.[98] Frédéric Joliot-Curie y su equipo demostraron que este fenómeno era una reacción nuclear en cadena en marzo de 1939. En 1945 Hahn recibió el Premio Nobel de Química de 1944 "por su descubrimiento de la fisión de núcleos atómicos pesados".[99][100]
Después de 1939
[editar]
El descubrimiento de la fisión nuclear a finales de 1938 marcó un cambio en los centros de investigación nuclear, que pasaron de Europa a localizarse en los Estados Unidos. Un gran número de científicos estaban migrando a los Estados Unidos para escapar de los problemas y del antisemitismo en Europa, así como de la guerra[101]: 407–410 que se avecinaba (véase historia militar de los judíos estadounidenses). Los nuevos centros de investigación nuclear fueron las universidades de los Estados Unidos, particularmente la Universidad de Columbia en Nueva York y la Universidad de Chicago, donde se había mudado Enrico Fermi,[102][103] así como una instalación de investigación secreta en el Los Álamos, Nuevo México, establecida en 1942, el nuevo hogar del Proyecto Manhattan.[104] Este proyecto en tiempos de guerra se centró en la construcción de armas nucleares, explotando la enorme energía liberada por la fisión del uranio o del plutonio a través de reacciones en cadena basadas en neutrones.
Los descubrimientos del neutrón y del positrón en 1932 fueron el comienzo del descubrimiento de muchas partículas nuevas. Los muones se descubrieron en 1936. Los piones y los kaones se descubrieron en 1947, mientras que las partículas lambda se descubrieron en 1950. En las décadas de 1950 y 1960, se descubrió una gran cantidad de partículas llamadas hadrones. Un esquema de clasificación para organizar todas estas partículas, propuesto de forma independiente por Murray Gell-Mann[105] y George Zweig[106][107] en 1964, pasó a ser conocido como modelo de cuarks. Según este modelo, partículas como el protón y el neutrón no eran elementales, sino que estaban compuestas de varias configuraciones de un pequeño número de otras partículas verdaderamente elementales llamadas partones o cuarks. El modelo de cuarks recibió verificación experimental a partir de finales de la década de 1960 y finalmente proporcionó una explicación para el momento magnético anómalo del neutrón.[108][10]
Vídeos
[editar]- Ernest Rutherford resume el estado de la física nuclear en 1935. (7 min., Nobelprize.org)
- Hans Bethe analiza el trabajo de Chadwick y Goldhaber sobre la desintegración del deuterón. (2 min., Web of Stories)
Referencias
[editar]- ↑ a b c d e f g h i j k l m Pais, Abraham (1986). Inward Bound. Oxford: Oxford University Press. ISBN 978-0198519973.
- ↑ a b Rutherford, E. (1911). «The Scattering of α and β Particles by Matter and the Structure of the Atom». Philosophical Magazine. Series 6 (21): 669-688. doi:10.1080/14786440508637080. Consultado el 15 de noviembre de 2017.
- ↑ Longair, M.S. (2003). Theoretical concepts in physics: an alternative view of theoretical reasoning in physics. Cambridge University Press. pp. 377-378. ISBN 978-0-521-52878-8.
- ↑ a b c Squires, Gordon (1998). «Francis Aston and the mass spectrograph». Dalton Transactions (23): 3893-3900. doi:10.1039/a804629h.
- ↑ a b c d e f g Byrne, J. Neutrons, Nuclei, and Matter, Dover Publications, Mineola, New York, 2011, ISBN 0486482383
- ↑ a b c d Chadwick, James (1932). «Existence of a Neutron». Proceedings of the Royal Society 136 (830): 692-708. Bibcode:1932RSPSA.136..692C. doi:10.1098/rspa.1932.0112.
- ↑ a b Chadwick, J.; Goldhaber, M. (1935). «A nuclear photoelectric effect». Proceedings of the Royal Society 151 (873): 479-493. Bibcode:1935RSPSA.151..479C. doi:10.1098/rspa.1935.0162.
- ↑ a b c d e f Stuewer, Roger H. (1983). «The Nuclear Electron Hypothesis». En Shea, William R., ed. Otto Hahn and the Rise of Nuclear Physics. Dordrecht, Holland: D. Riedel Publishing Company. pp. 19–67. ISBN 978-90-277-1584-5.
- ↑ a b c d e f g Rife, Patricia (1999). Lise Meitner and the dawn of the nuclear age. Basel, Switzerland: Birkhäuser. ISBN 978-0-8176-3732-3.
- ↑ a b Perkins, Donald H. (1982), Introduction to High Energy Physics, Addison Wesley, Reading, Massachusetts, pp. 201–202, ISBN 978-0-201-05757-7.
- ↑ Malley, Marjorie (2011), Radioactivity: A History of a Mysterious Science (illustrated edición), Oxford University Press, ISBN 9780199766413.
- ↑ Bohr, N. (1913). «On the Constitution of Atoms and Molecules, Part I». Philosophical Magazine 26 (151): 1-24. Bibcode:1913PMag...26....1B. doi:10.1080/14786441308634955.
- ↑ «The Nobel Prize in Chemistry 1921 – Frederick Soddy Biographical». Nobelprize.org. Consultado el 5 de septiembre de 2019.
- ↑ Choppin, Gregory; Liljenzin, Jan-Olov; Rydberg, Jan (2013), Radiochemistry and Nuclear Chemistry (4th edición), Academic Press, ISBN 978-0124058972.
- ↑ Others had also suggested the possibility of isotopes; for example:
- Strömholm, D. and Svedberg, T. (1909) "Untersuchungen über die Chemie der radioactiven Grundstoffe II." (Investigations into the chemistry of the radioactive elements, part 2), Zeitschrift für anorganischen Chemie, 63: 197–206; see especially page 206.
- Cameron, Alexander Thomas (1910). Radiochemistry. London, England: J. M. Dent & Sons, p. 141. (Cameron also anticipated the displacement law.)
- ↑ «The Nobel Prize in Chemistry 1921: Frederick Soddy – Biographical». Nobelprize.org. Consultado el 16 de marzo de 2014.
- ↑ Aston, Francis William. Mass spectra and isotopes. London: Edward Arnold, 1942.
- ↑ «Atomic Weights and the International Committee — A Historical Review». 26 de enero de 2004.
- ↑ «The Nobel Prize in Chemistry 1922: Francis W. Aston – Biographical». Nobelprize.org. Consultado el 18 de noviembre de 2017.
- ↑ Eddington, A. S. (1920). «The Internal Constitution of the Stars». Nature 106 (2653): 233-40. Bibcode:1920Natur.106...14E. PMID 17747682. S2CID 36422819. doi:10.1038/106014a0.
- ↑ a b Heilbron, J. L. (1974). H.G.J. Moseley: The Life and Letters of an English Physicist, 1887–1915. University of California Press. ISBN 0520023757.
- ↑ El número atómico y la masa atómica del cobalto son respectivamente 27 y 58,97, y para el níquel son respectivamente 28 y 58,68.
- ↑ a b c Abraham Pais (1991). Niels Bohr's Times: In Physics, Philosophy, and Polity. Oxford University Press. ISBN 0-19-852049-2.
- ↑ Heilbron, John (1966), «The Work of H. G. J. Moseley», Isis 57 (3): 336-364, JSTOR 228365, S2CID 144765815, doi:10.1086/350143.
- ↑ Moseley, Henry G. J. (1913). «The High Frequency Spectra of the Elements». Philosophical Magazine 26 (156): 1024-1034. doi:10.1080/14786441308635052.
- ↑ Bernard, Jaffe (1971), Moseley and the numbering of the elements, Doubleday, «asin: B009I5KZGM».
- ↑ Born, Max (2013), Atomic Physics (8th edición), Courier Corporation, ISBN 9780486318585.
- ↑ Kragh, Helge (2002). Quantum Generations: A History of Physics in the Twentieth Century (Reprint edición). Princeton University Press. ISBN 978-0691095523.
- ↑ «Oral History Interview: Niels Bohr, Session I». Instituto Estadounidense de Física, Niels Bohr Library and Archives. 31 de octubre de 1962. Consultado el 25 de octubre de 2017.
- ↑ Reynosa, Peter (7 de enero de 2016). «An Ode to Henry Moseley». Huffington Post. Consultado el 16 de noviembre de 2017.
- ↑ «This Month in Physics History: May 1932: Chadwick reports the discovery of the neutron». Sociedad Estadounidense de Física 16 (5). 2007. Consultado el 16 de noviembre de 2017.
- ↑ a b c d e Rutherford, E. (1920). «Bakerian Lecture: Nuclear Constitution of Atoms». Proceedings of the Royal Society 97 (686): 374-400. Bibcode:1920RSPSA..97..374R. doi:10.1098/rspa.1920.0040.
- ↑ Rutherford, E. (1919). «Collision of α particles with light atoms». Philosophical Magazine 37: 571.
- ↑ Urey, H.; Brickwedde, F.; Murphy, G. (1932). «A Hydrogen Isotope of Mass 2». Physical Review 39 (1): 164-165. Bibcode:1932PhRv...39..164U. doi:10.1103/PhysRev.39.164.
- ↑ a b Feather, N. (1960). «A history of neutrons and nuclei. Part 1». Contemporary Physics 1 (3): 191-203. Bibcode:1960ConPh...1..191F. doi:10.1080/00107516008202611.
- ↑ Harkins, William (1921). «The constitution and stability of atomic nuclei. (A contribution to the subject of inorganic evolution.)». Philosophical Magazine 42 (249): 305. doi:10.1080/14786442108633770.
- ↑ Glasson, J.L. (1921). «Attempts to detect the presence of neutrons in a discharge tube». Philosophical Magazine 42 (250): 596. doi:10.1080/14786442108633801.
- ↑ Rutherford reported acceptance by the British Association of the word proton for the hydrogen nucleus in a footnote to Masson, O. (1921). «XXIV. The constitution of atoms». Philosophical Magazine. Series 6 41 (242): 281-285. doi:10.1080/14786442108636219.
- ↑ Pauli, W. (1985). «Das Jahr 1932 die Entdeckung des Neutrons». Wolfgang Pauli Wissenschaftlicher Briefwechsel mit Bohr, Einstein, Heisenberg u.a. Sources in the History of Mathematics and Physical Sciences 6. p. 105. ISBN 978-3-540-13609-5. doi:10.1007/978-3-540-78801-0_3.
- ↑ Hendry, John, ed. (1 de enero de 1984), Cambridge Physics in the Thirties, Bristol: Adam Hilger Ltd (publicado el 1984), ISBN 978-0852747612.
- ↑ a b c d George Gamow "Constitution of Atomic Nuclei and Radioactivity". (The International Series of Monographs on Physics.) Pp.viii + 114.(Oxford: Clarendon Press; London: Oxford University Press, 1931.)
- ↑ Crowther, J.G. (1971). «Rutherford the Great». New Scientist 51 (3): 464-466. Consultado el 27 de septiembre de 2017.
- ↑ a b c Brown, Laurie M. (1978). «The idea of the neutrino». Physics Today 31 (9): 23. Bibcode:1978PhT....31i..23B. S2CID 121080564. doi:10.1063/1.2995181. «Durante la década de 1920, los físicos llegaron a aceptar la opinión de que la materia está formada por solo dos tipos de partículas elementales: electrones y protones.»
- ↑ a b c Stuewer, Roger H. (1985). «Niels Bohr and Nuclear Physics». En French, A. P.; Kennedy, P. J., eds. Niels Bohr: A Centenary Volume. Harvard University Press. pp. 197–220. ISBN 978-0674624160.
- ↑ a b Stuewer, Roger (2018), The Age of Innocence: Nuclear Physics between the First and Second World Wars, Oxford University Press, ISBN 9780192562906.
- ↑ Klein, O. (1929). «Die Reflexion von Elektronen an einem Potentialsprung nach der relativistischen Dynamik von Dirac». Zeitschrift für Physik 53 (3–4): 157. Bibcode:1929ZPhy...53..157K. S2CID 121771000. doi:10.1007/BF01339716.
- ↑ a b Bethe, H.; Bacher, R. (1936), «Nuclear Physics A. Stationary States of Nuclei», Reviews of Modern Physics 8 (82): 82-229, Bibcode:1936RvMP....8...82B, doi:10.1103/RevModPhys.8.82.
- ↑ En un núcleo de radio r del orden de 5×10−13cm, el principio de incertidumbre requeriría que un electrón tuviera un momento p del orden de h/r. Tal impulso implica que el electrón tiene una energía cinética (relativista) de aproximadamente 40 MeV,[47]: 89
- ↑ Aston, F. W. (1927). «Bakerian Lecture – A new mass-spectrograph and the whole number rule». Proceedings of the Royal Society 115 (772): 487-514. Bibcode:1927RSPSA.115..487A. doi:10.1098/rspa.1927.0106.
- ↑ Kenneth S. Krane (5 de noviembre de 1987). Introductory Nuclear Physics. Wiley. ISBN 978-0-471-80553-3.
- ↑ «The Nobel Prize in Physics 1954». nobelprize.org. Consultado el 23 de marzo de 2023. «En 1930 Bothe, en colaboración con H. Becker, bombardeó berilio de masa 9 (y también boro y litio) con rayos alfa derivados del polonio, y obtuvo una nueva forma de radiación ...»
- ↑ Bothe, W.; Becker, H. (1930). «Künstliche Erregung von Kern-γ-Strahlen» [Artificial excitation of nuclear γ-radiation]. Zeitschrift für Physik (en alemán) 66 (5–6): 289. Bibcode:1930ZPhy...66..289B. S2CID 122888356. doi:10.1007/BF01390908.
- ↑ Becker, H.; Bothe, W. (1932). «Die in Bor und Beryllium erregten γ-Strahlen» [Γ-rays excited in boron and beryllium]. Zeitschrift für Physik (en alemán) 76 (7–8): 421. Bibcode:1932ZPhy...76..421B. S2CID 121188471. doi:10.1007/BF01336726.
- ↑ Joliot-Curie, Irène; Joliot, Frédéric (1932). «Émission de protons de grande vitesse par les substances hydrogénées sous l'influence des rayons γ très pénétrants» [Emission of high-speed protons by hydrogenated substances under the influence of very penetrating γ-rays]. Comptes Rendus Hebdomadaires des Séances de l'Academie des Sciences (en francés) 194: 273.
- ↑ Zichichi, A., Ettore Majorana: genius and mystery, CERN Courier, 25 July 2006, Access date: 16 November 2017.
- ↑ a b c Brown, A. (1997). The Neutron and the Bomb: A Biography of Sir James Chadwick. Oxford University Press. ISBN 9780198539926.
- ↑ «Oral History Interview: Norman Feather, Session I». American Institute of Physics, Niels Bohr Library and Archives. 25 de febrero de 1971. Consultado el 16 de noviembre de 2017.
- ↑ Chadwick, J.; Constable, J.E.R.; Pollard, E.C. (1931). «Artificial disintegration by α-particles». Proceedings of the Royal Society 130 (814): 463-489. Bibcode:1931RSPSA.130..463C. doi:10.1098/rspa.1931.0017.
- ↑ a b «Atop the Physics Wave: Rutherford Back in Cambridge, 1919–1937». Rutherford's Nuclear World. American Institute of Physics. 2011–2014. Archivado desde el original el 21 de octubre de 2014. Consultado el 19 de agosto de 2014.
- ↑ Chadwick, James (1932). «Possible Existence of a Neutron». Nature 129 (3252): 312. Bibcode:1932Natur.129Q.312C. S2CID 4076465. doi:10.1038/129312a0.
- ↑ a b Chadwick, J. (1933). «Bakerian Lecture.–The Neutron». Proceedings of the Royal Society 142 (846): 1-25. Bibcode:1933RSPSA.142....1C. doi:10.1098/rspa.1933.0152.
- ↑ a b Ley, Willy (October 1966). «The Delayed Discovery». For Your Information. Galaxy Science Fiction: 116-127.
- ↑ «The Nobel Prize in Physics 1935: James Chadwick – Biographical». Nobel Foundation. Consultado el 18 de noviembre de 2017.
- ↑ Friedlander, G.; Kennedy, J.W.; Miller, J.M. (1964) Nuclear and Radiochemistry (2nd edition), Wiley, pp. 22–23 and 38–39
- ↑ Heisenberg, W. (1932). «Über den Bau der Atomkerne. I». Zeitschrift für Physik 77 (1–2): 1-11. Bibcode:1932ZPhy...77....1H. S2CID 186218053. doi:10.1007/BF01342433.
- ↑ Heisenberg, W. (1932). «Über den Bau der Atomkerne. II». Zeitschrift für Physik 78 (3–4): 156-164. Bibcode:1932ZPhy...78..156H. S2CID 186221789. doi:10.1007/BF01337585.
- ↑ Heisenberg, W. (1933). «Über den Bau der Atomkerne. III». Zeitschrift für Physik 80 (9–10): 587-596. Bibcode:1933ZPhy...80..587H. S2CID 126422047. doi:10.1007/BF01335696.
- ↑ Iwanenko, D.D., The neutron hypothesis, Nature. 129 (1932) 798.
- ↑ Miller A. I. Early Quantum Electrodynamics: A Sourcebook, Cambridge University Press, Cambridge, 1995, ISBN 0521568919, pp. 84–88.ISBN 0521568919
- ↑ a b c Brown, L.M.; Rechenberg, H. (1996). The Origin of the Concept of Nuclear Forces. Bristol and Philadelphia: Institute of Physics Publishing. p. 33. ISBN 978-0750303736. «heisenberg proton neutron model.»
- ↑ a b Iwanenko, D. (1932). «Sur la constitution des noyaux atomiques». Comptes Rendus Hebdomadaires des Séances de l'Academie des Sciences 195: 439-441.
- ↑ Bacher, R.F.; Condon, E.U. (1932). «The Spin of the Neutron». Physical Review 41 (5): 683-685. Bibcode:1932PhRv...41..683G. doi:10.1103/PhysRev.41.683.
- ↑ Whaling, W. (2009). «Robert F. Bacher 1905–2004». Biographical Memoirs of the National Academy of Sciences 2009: 1. Bibcode:2009BMNAS2009....1W. Archivado desde el original el 31 de mayo de 2014. Consultado el 21 de marzo de 2015.
- ↑ Bethe, H.; Peierls, R. (1934). «The Neutrino». Nature 133 (3362): 532-533. Bibcode:1934Natur.133..532B. S2CID 4001646. doi:10.1038/133532a0.
- ↑ Yang, Chen Ning (2012). «Fermi's β-Decay Theory». International Journal of Modern Physics 27 (3,4): 1230005-1-1230005-7. Bibcode:2012IJMPA..2730005Y. doi:10.1142/S0217751X12300050.
- ↑ a b Wilson, Fred L. (1968). «Fermi's Theory of Beta Decay». Am. J. Phys. 36 (12): 1150-1160. Bibcode:1968AmJPh..36.1150W. doi:10.1119/1.1974382.
- ↑ Iwanenko, D. (1932). «Neutronen und kernelektronen». Physikalische Zeitschrift der Sowjetunion 1: 820-822.
- ↑ Kurie, F.N.D. (1933). «The Collisions of Neutrons with Protons». Physical Review 44 (6): 463. Bibcode:1933PhRv...44..463K. doi:10.1103/PhysRev.44.463.
- ↑ a b c d Breit, G.; Rabi, I.I. (1934). «On the interpretation of present values of nuclear moments». Physical Review 46 (3): 230. Bibcode:1934PhRv...46..230B. doi:10.1103/PhysRev.46.230.
- ↑ Massey, H.S.W. (1932). «The passage of neutrons through matter». Proceedings of the Royal Society 138 (835): 460-469. Bibcode:1932RSPSA.138..460M. doi:10.1098/rspa.1932.0195.
- ↑ Sime, R.L. (1996). Lise Meitner: A Life in Physics. University of California Press. ISBN 978-0520089068. «neutron.»
- ↑ Seidel, R.W. (1989). Lawrence and his Laboratory: A History of the Lawrence Berkeley Laboratory. University of California Press. ISBN 9780520064263.
- ↑ Chadwick, J.; Goldhaber, M. (1934). «A nuclear photo-effect: disintegration of the diplon by gamma rays». Nature 134 (3381): 237-238. Bibcode:1934Natur.134..237C. S2CID 4137231. doi:10.1038/134237a0.
- ↑ Frisch, R.; Stern, O. (1933). «Über die magnetische Ablenkung von Wasserstoffmolekülen und das magnetische Moment des Protons. I / Magnetic Deviation of Hydrogen Molecules and the Magnetic Moment of the Proton. I.». Zeitschrift für Physik 84 (1–2): 4-16. Bibcode:1933ZPhy...85....4F. S2CID 120793548. doi:10.1007/bf01330773.
- ↑ Esterman, I.; Stern, O. (1933). «Über die magnetische Ablenkung von Wasserstoffmolekülen und das magnetische Moment des Protons. II / Magnetic Deviation of Hydrogen Molecules and the Magnetic Moment of the Proton. I.». Zeitschrift für Physik 85 (1–2): 17-24. Bibcode:1933ZPhy...85...17E. S2CID 186232193. doi:10.1007/BF01330774.
- ↑ Esterman, I.; Stern, O. (1934). «Magnetic moment of the deuton». Physical Review 45 (10): 761(A109). Bibcode:1934PhRv...45..739S. doi:10.1103/PhysRev.45.739.
- ↑ Rabi, I.I.; Kellogg, J.M.; Zacharias, J.R. (1934). «The magnetic moment of the proton». Physical Review 46 (3): 157. Bibcode:1934PhRv...46..157R. doi:10.1103/PhysRev.46.157.
- ↑ Rabi, I.I.; Kellogg, J.M.; Zacharias, J.R. (1934). «The magnetic moment of the deuton». Physical Review 46 (3): 163. Bibcode:1934PhRv...46..163R. doi:10.1103/PhysRev.46.163.
- ↑ a b Rigden, John S. (2000). Rabi, Scientist and Citizen. Harvard University Press. ISBN 9780674004351.
- ↑ Bacher, R.F. (1933). «Note on the Magnetic Moment of the Nitrogen Nucleus». Physical Review 43 (12): 1001. Bibcode:1933PhRv...43.1001B. doi:10.1103/PhysRev.43.1001.
- ↑ Tamm, I.Y.; Altshuler, S.A. (1934). «Magnetic Moment of the Neutron». Doklady Akademii Nauk SSSR 8: 455. Consultado el 30 de enero de 2015.
- ↑ Feather, N. (1 de junio de 1932). «The Collisions of Neutrons with Nitrogen Nuclei». Proceedings of the Royal Society 136 (830): 709-727. Bibcode:1932RSPSA.136..709F. doi:10.1098/rspa.1932.0113.
- ↑ E. Fermi; E. Amaldi; B. Pontecorvo; F. Rasetti; E. Segrè (October 1934). «Azione di sostanze idrogenate sulla radioattività provocata da neutroni» [Influence of hydrogenous substances on the radioactivity produced by neutrons]. La Ricerca Scientifica (en italiano) II (7–8). Archivado desde el original el 17 de agosto de 2021. Consultado el 16 de agosto de 2021.
- ↑ «The Nobel Prize in Physics 1938: Enrico Fermi – Biographical». Nobelprize.org. Consultado el 18 de noviembre de 2017.
- ↑ Cooper, Dan (1999). Enrico Fermi: And the Revolutions in Modern physics. New York: Oxford University Press. ISBN 978-0-19-511762-2. OCLC 39508200.
- ↑ Hahn, O. (1958). «The Discovery of Fission». Scientific American 198 (2): 76. Bibcode:1958SciAm.198b..76H. doi:10.1038/scientificamerican0258-76.
- ↑ Meitner, L.; Frisch, O. R. (1939). «Disintegration of Uranium by Neutrons: A New Type of Nuclear Reaction». Nature 143 (3615): 239. Bibcode:1939Natur.143..239M. S2CID 4113262. doi:10.1038/143239a0.
- ↑ Hahn, O.; Strassmann, F. (10 de febrero de 1939). «Proof of the Formation of Active Isotopes of Barium from Uranium and Thorium Irradiated with Neutrons; Proof of the Existence of More Active Fragments Produced by Uranium Fission». Die Naturwissenschaften 27 (6): 89-95. Bibcode:1939NW.....27...89H. S2CID 33512939. doi:10.1007/BF01488988.
- ↑ «The Nobel Prize in Chemistry 1944: Otto Hahn – Biographical». Nobelprize.org. Consultado el 18 de noviembre de 2017.
- ↑ Bernstein, Jeremy (2001). Hitler's uranium club: the secret recordings at Farm Hall. New York: Copernicus. p. 281. ISBN 978-0-387-95089-1.
- ↑ Isaacson, Walter (2007). Einstein: His Life and Universe. Simon & Schuster. ISBN 978-0743264747.
- ↑ «About Enrico Fermi». The University of Chicago Library: Digital Activities and Collections. Guide to the Enrico Fermi Collection, Special Collections Research Center, University of Chicago Library. Archivado desde el original el 26 de noviembre de 2012. Consultado el 24 de noviembre de 2017.
- ↑ «Fermi at Columbia: The Manhattan Project and the First Nuclear Pile». Columbia University Department of Physics. Archivado desde el original el 29 de octubre de 2017. Consultado el 24 de noviembre de 2017.
- ↑ Rhodes, Richard (1986). The Making of the Atomic Bomb. New York: Simon & Schuster. ISBN 978-0-671-44133-3.
- ↑ Gell-Mann, M. (1964). «A Schematic Model of Baryons and Mesons». Physics Letters 8 (3): 214-215. Bibcode:1964PhL.....8..214G. doi:10.1016/S0031-9163(64)92001-3.
- ↑ Zweig, G. (1964). «An SU(3) Model for Strong Interaction Symmetry and its Breaking». CERN Report No.8182/TH.401.
- ↑ Zweig, G. (1964). «An SU(3) Model for Strong Interaction Symmetry and its Breaking: II». CERN Report No.8419/TH.412.
- ↑ Gell, Y.; Lichtenberg, D. B. (1969). «Quark model and the magnetic moments of proton and neutron». Il Nuovo Cimento A. Series 10 61 (1): 27-40. Bibcode:1969NCimA..61...27G. S2CID 123822660. doi:10.1007/BF02760010.
Lecturas adicionales
[editar]- Bibliografía comentada sobre neutrones de la Biblioteca Digital Alsos para Asuntos Nucleares
- Abraham Pais, Hacia dentro, Oxford: Oxford University Press, 1986. ISBN 0198519974.
- Herwig Schopper, Interacciones débiles y desintegración beta nuclear, Editorial, Pub de Holanda Septentrional. Co., 1966. OCLC 644015779
- Ruth Lewin Sime, Lise Meitner: Una vida en la física, Berkeley, University of California Press, 1996. ISBN 0520208609.
- Roger H. Stuewer, "La hipótesis del electrón nuclear". En Otto Hahn y el auge de la física nuclear, William R. Shea, ed. Dordrecht, Holanda: D. Riedel Publishing Company. págs. 19–67, 1983. ISBN 90-277-1584-X.
- Shin'ichirō Tomonaga, La historia del giro, The University of Chicago Press, 1997. ISBN 9780226807942
